1.本发明涉及一种光电响应型氧化锰-碳复合涂层及其制备方法和在神经和骨组织修复中的应用,属于生物医用技术领域。
背景技术:
2.在人体的骨骼系统中,神经组织主要分布在骨代谢活跃的区域,其正常功能对于维持骨骼微环境稳定和促进骨折愈合至关重要。例如,当人体发生骨折后,神经细胞分泌的降钙素基因相关肽(calcitonin gene related peptide,cgrp)可促进骨组织再生,利于术后骨植入材料实现骨整合。然而,当神经系统发生病变或功能损伤时,骨折周围神经支配不足,这使得骨折部位常表现为骨痂强度低、骨折愈合延迟和骨不连,严重制约了骨修复过程。因此,开发具有促进良好神经再生功能的新型骨修复材料对于促进神系统经病变或损伤患者的骨修复具有重要意义。
3.金属钛及其合金具有良好的生物相容性、化学稳定性和耐腐蚀性,是临床上常用的骨植入材料。但钛表面的生物惰性使其促进成骨和神经再生的能力不足。电信号是人体神经、骨骼等组织中普遍存在的一种生物信号,并在调控细胞增殖、迁移、基因表达等方面发挥着重要作用。近年来,作为一种成本低、安全性高和可控性好的电刺激模式,非侵入式的光电刺激被广泛用于研究神经、骨骼、肌肉等的修复。因此,在钛及其合金表面制备具有光电响应特性的生物涂层,有望刺激对电信号敏感的成骨细胞和神经细胞,到达促进骨和神经组织快速修复的目的。
4.现有研究表明,光刺激下的tio2基涂层可调控细胞的黏附、生长和分化行为。然而,tio2半导体材料的带隙较宽(~3.1ev),只能响应波长较短的紫外光,这种高能量的紫外光辐照极易造成细胞损伤。相比而言,氧化锰是一类常见的窄带隙(1.4-2.7ev)半导体材料,在可见-部分红外光波段具有较强的光吸收能力,可避免使用紫外光产生的细胞毒性。此外,适量的mn
2
还能活化细胞整联蛋白,激活胞内信号通道,利于神经或成骨细胞的分化。然而,氧化锰半导体的导电性不足,不利于光生电子和空穴的有效分离。
技术实现要素:
5.为了解决现有技术中存在的上述缺陷,本发明提供一种光电响应型氧化锰-碳复合涂层及其制备方法和在神经和骨组织修复中的应用。所述复合涂层具有良好的生物活性和光电响应特性,能在外加光照下产生光电流刺激神经细胞增殖,并且能促进神经细胞释放神经肽,潜在性地调控骨组织修复。同时,氧化锰-碳表面的成骨细胞在光照下呈现出较好的成骨分化能力。
6.第一方面,本发明提供一种光电响应型氧化锰-碳复合涂层。所述氧化锰-碳涂层是在具有连通孔结构的氧化锰纳米片层表面原位负载碳材料的生物涂层。碳材料层的引入保留了氧化锰的纳米片层和连通孔结构,具有比表面积大的特点,可促进细胞的黏附,以及
增强光电信号对细胞的刺激效果。所述复合涂层中碳材料包裹于氧化锰片层表面且与氧化锰接触紧密以将氧化锰在光照条件下产生的光电子迅速转移。一些技术方案中,所述复合涂层将氧化锰与导电性良好的碳材料(例如石墨或者碳纳米管)复合,促进氧化锰中光生载流子快速转移,并提高材料的光吸收范围,通过光电刺激促进神经和骨组织再生,为研究开发新型的光电响应型骨-神经组织修复用涂层材料提供可能。
7.所述生物涂层中碳的质量比为1-30%。此时碳材料能显著增强复合涂层的导电性,提高光电响应特性,并保留氧化锰层的纳米结构。碳的质量比可进一步优选为5-25%。
8.较佳地,所述氧化锰纳米片由粒径0.01-2μm的氧化锰颗粒形成,纳米片的厚度为1-30nm。
9.较佳地,所述连通孔结构的孔径为0.02-2μm。
10.较佳地,所述复合涂层的厚度为1-20μm,优选为1-5μm。
11.第二方面,本发明提供上述任一项所述的光电响应型氧化锰-碳复合涂层的制备方法。所述制备方法包括以下步骤:
12.(1)水热反应制备氧化锰涂层:以高锰酸钾为锰源,盐酸为还原剂,氯化钾为结构稳定剂,并上述原料溶于去离子水得到混合溶液,随后使用该混合溶液在基材表面采用水热反应法原位生长氧化锰片层;
13.(2)将步骤(1)制备的氧化锰片层在葡萄糖溶液中浸泡一段时间后,在氩气氛围下于200-600℃退火1-4h,得到光电响应型氧化锰-碳复合涂层。
14.本发明采用水热反应联合高温碳化法,在基材表面原位生长具有纳米结构的氧化锰-碳(mno-c)复合涂层。
15.较佳地,所述基材包括医用金属或合金材料,优选为纯钛、钛合金、不锈钢或钴铬钼合金中至少一种。
16.较佳地,步骤(1)中,高锰酸钾的浓度为0.001-0.01mol/l,盐酸的浓度为高锰酸钾的1-5倍,氯化钾的浓度为高锰酸钾的1-5倍。
17.较佳地,步骤(1)中,水热反应温度为80-180℃,水热反应时间为0.5-24h。将水热反应温度和反应时间控制在上述范围内,能够在基材表面形成纳米片层结构以及避免纳米片层结构被破坏。
18.较佳地,步骤(2)中,所述葡萄糖溶液浓度为0.1-2wt.%,浸泡时间为2-48h。
19.较佳地,步骤(2)中,退火温度为200-600℃,时间为1-4h。退火温度过低,时间过短,这不利于将氧化锰表面吸附的葡萄糖转化为导电性良好的碳材料例如石墨。退火温度过高,时间过长,纳米片层结构易被破坏。
20.第三方面,本发明提供了上述任一项所述的光电响应型氧化锰-碳复合涂层在神经和骨组织修复中的应用。
附图说明
21.图1为mno和mno-c涂层的sem照片;图2中的a为mno和mno-c涂层的xrd图谱,b为mno和mno-c涂层的拉曼图谱;图3中的a为mno和mno-c涂层的电化学阻抗谱(eis),b为mno和mno-c涂层的uv-vis-nir漫反射光谱;
图4中的a为红光辐照时不同样品的光电流密度曲线,b为mno-c复合涂层在加入vc时的光电流密度曲线;图5中的a为不同样品表面pc12细胞的增殖,b为cgrp释放量;图6中的a为不同样品表面mc3t3-e1细胞的alp活性,b为钙沉积量。
具体实施方式
22.通过下述实施方式进一步说明本发明,应理解,下述实施方式仅用于说明本发明,而非限制本发明。在没有特殊说明的情况下,各百分含量指质量百分含量。
23.本公开提供一种促进神经和骨组织修复的光电响应型氧化锰-碳复合涂层及其制备方法和应用。所述氧化锰-碳复合涂层(也可以称为“mno-c”复合涂层)是在具有连通孔结构的氧化锰纳米片层表面原位负载碳材料层的生物涂层。光照条件下氧化锰半导体材料中产生光电子,光电子经碳材料转移到细胞表面。因此,本发明的复合涂层将碳材料设计在氧化锰片层表面,即便于碳材料与细胞或者组织接触,从而保证电信号从氧化锰转移至细胞或组织。在此说明的是,在碳材料表面沉积氧化锰的方式不适用于本发明,因为氧化锰半导体导电性不足、不利于光生电子和空穴的有效分离的特性使其无法将光照条件顺利转移至细胞或者组织。故本发明的复合涂层中碳材料应包裹于氧化锰片层结构表面且与氧化锰接触紧密,以便将氧化锰中产生的光电子迅速转移至组织或细胞。
24.本发明复合涂层中碳材料的负载使得生物涂层仍然保留了纳米片层结构和连通孔结构(如图1所示)。纳米片层结构可促进神经和成骨细胞黏附,而且使得涂层具有较大的比表面积;连通孔结构可暴露较多的活性位点,利于光生电信号在材料-溶液界面处转移,增强电信号对细胞的刺激效果。所述氧化锰-碳复合涂层利用氧化锰的半导体特性和导电材料导电性两者之间的协同,尤其是氧化锰的半导体特性使其在一定波长的光照下产生光生电子,导电性良好的碳材料将所述光生电子转移至组织或细胞,进而刺激对电信号敏感的骨组织再生。
25.相比于mno涂层,本发明所得mno-c复合涂层具有更优的光电响应特性和生物活性,能在外加光照下,刺激神经细胞增殖和成骨细胞分化,是一种潜在的生物医用材料,可用于神经系统病变或损伤患者的骨修复材料的研究与开发。
26.本发明所述mno-c复合涂层的制备方法是通过在基材表面原位水热生长氧化锰纳米片层并在纳米片层表面通过高温碳化法负载碳材料而获得的具有纳米片状结构和连通孔结构的mno-c复合涂层。以下示例性说明所述具有促进神经和骨组织再生功能的mno-c复合涂层的制备方法。
27.水热反应:以高锰酸钾为锰源,盐酸为还原剂,氯化钾为结构稳定剂。将上述原料溶于去离子水中,得到混合溶液。可将上述原料一起加入去离子水中,也可以将上述原料依次或者分次加入。该混合溶液中,所述高锰酸钾的浓度为0.001-0.01mol/l,所述盐酸的浓度为高锰酸钾浓度的1-5倍,所述氯化钾的浓度为高锰酸钾浓度的1-5倍。将基材置于混合溶液中,采用水热反应法在基材表面原位生长氧化锰涂层,获得表面被纳米片包覆的基材。所述基材包括但不限于纯钛、钛合金、不锈钢或钴铬钼合金等。所述水热反应法的反应温度为80-180℃,优选为100-150℃。水热反应保温时间为0.5-24h,优选为8-15h。优选为钛基材,此时钛基材表面能够吸附金属锰离子,从而在基材表面反应形成氧化锰晶粒。随着反应
时间延长,氧化锰晶粒逐渐长大成为纳米片,在基材表面交织而成连通孔结构。
28.高温碳化法。将水热反应制备的氧化锰涂层在葡萄糖溶液中浸泡一段时间后,在氩气中退火,得到mno-c复合涂层。所述葡萄糖溶液浓度为0.1-2wt.%,优选为0.3-1wt.%。所述浸泡时间为2-48h,优选为8-24h。所述退火温度为200-600℃,优选为300-500℃。所述退火时间为1-4h,优选为1.5-3h。具有连通孔结构的氧化锰纳米片层便于吸收葡萄糖溶液,该葡萄糖溶液作为碳前驱体,经过高温碳化可以形成具有较高导电性的碳材料。该方法原料简单易得且产物结构均匀,且经过碳化后仍然能够保持连通孔结构。
29.所得复合涂层具有良好的生物活性和光电响应特性,能在外加光照下刺激神经细胞增殖,利于神经组织修复和释放神经肽,适于潜在性地调控骨组织修复。此外,mno-c表面的成骨细胞在光照下呈现出较好的成骨分化能力。
30.下面进一步例举实施例以详细说明本发明。以下通过下述具体实施例进一步说明本发明,应理解,下述实施例仅用于进一步说明本发明,不能理解为对本发明保护范围的限制。本领域的技术人员根据本发明的内容作出的一些非本质的改进和调整均属于本发明的保护范围。下述实施例具体的工艺参数等也仅是合适范围中的一个示例,即本领域技术人员可以通过本文的说明做合适范围内的选择,而并非要限定于下文示例的具体数值。
31.实施例1
32.mno-c复合涂层的制备
33.将砂纸打磨光滑的钛片置于高锰酸钾、氯化钾和盐酸的混合溶液中,采用水热反应法,在钛片表面原位生长氧化锰涂层。将水热反应制备的氧化锰涂层在葡萄糖溶液中浸泡一段时间后,采用高温碳化法(氩气氛围退火)制备mno-c复合涂层。水热反应法所用离子混合液体积为60ml,高锰酸钾浓度为0.001mol/l,氯化钾浓度为0.003mol/l,盐酸浓度为0.004mol/l。水热反应时间为12h,水热反应温度为120℃。高温碳化法所用葡萄糖溶液浓度为0.5wt.%,浸泡时间为24h。退火温度为450℃,退火时间为2h。
34.将水热反应所得涂层直接在氩气氛围450℃下退火2h得到的mno涂层作为对照。
35.涂层制备结束后,对mno和mno-c涂层的表面形貌进行分析。通过图1所示的sem照片可以看出,两种涂层皆为纳米片层结构。
36.由如图2中的a所示的xrd图谱可知,mno和mno-c涂层样品的主相皆为mno(jcpds card no:89-4835)。
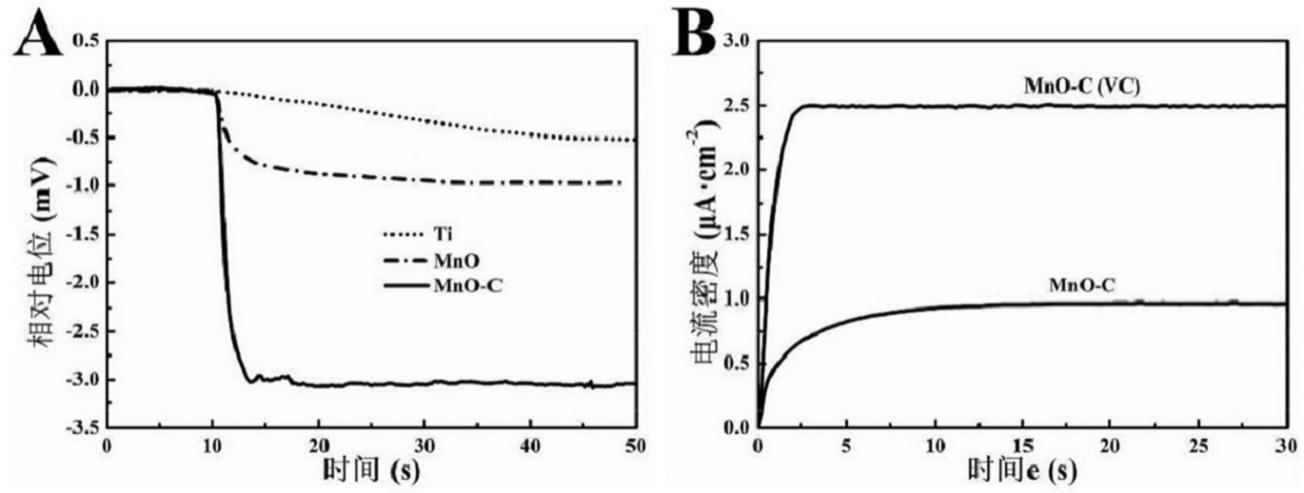
37.由如图2中的b所示的拉曼图谱可知,mno涂层只含有氧化锰的振动峰,mno-c涂层含有氧化锰和c的振动峰。c的振动峰可见明显的g峰(1602cm-1
,石墨晶格中sp2杂化的c原子)和d峰(1357cm-1
,石墨缺陷,对应于非晶态碳)。g峰和d峰的强度比约为1.72,表明高温碳化法制得的碳材料具有较高的石墨化程度,这能显著增强涂层的导电性。
38.由表1所示的eds测试结果可知,mno-c复合涂层中的c含量为11.78at.%。
39.表1mno-c复合涂层的eds元素分析样品mn(at.%)o(at.%)c(at.%)ti(at.%)mno-c12.4543.7211.7832.05
40.mno-c复合涂层的光电化学活性检测
41.采用三电极体系(饱和甘汞电极为参比电极,铂片为对电极,覆盖有涂层的钛片为工作电极),在0.5mol/l的na2so4溶液中,利用电化学工作站(corrtest,china)测试样品的
eis曲线。eis的测试频率范围为100,000
–
0.1hz。通过紫外可见分光光度计(metash,china)测试样品的uv-vis-nir漫反射光谱。
42.通过电化学工作站测试样品的光电流响应曲线,测试用溶液为0.5mol/l的na2so4,光源为650nm(功率为0.1w)的激光器。在恒电位(1v,相对于sce)模式下,测试样品在有/无光照时的光电流曲线。其中,光照和黑暗的时间均设置为30s。部分样品的光电压和光电流响应曲线在含有浓度为1mm抗坏血酸(维生素c,vitamin c,vc)的na2so4溶液中进行。
43.由图3中的a可知,相比于mno,mno-c复合涂层的eis谱图在高频区的圆弧直径更小,意味着碳材料的引入降低了纳米复合涂层的电化学阻抗,这利于材料中的光生电荷转移至溶液。
44.由如图3中的b所示样品的uv-vis-nir漫反射光谱可知,mno-c复合涂层具有更强的光吸收能力。通过uv-vis-nir漫反射光谱计算mno和mno-c的直接带隙分别为1.85ev和1.65ev,可分别被波长小于670nm和751nm的单色光激发。
45.如图4中的a所示的样品的光电流响应曲线,结果显示不同样品在红光辐照时产生的光电流密度呈现如下趋势:1μa/cm2(mno-c)>0.4μa/cm2(mno)>0.1μa/cm2(ti)。当加入空穴清除剂vc(维生素c)时,mno-c复合涂层的光电流密度迅速提升至2.5μa/cm2,如图4中的b所示。因此,碳材料的负载可增强mno-c复合涂层的光电活性,空穴清除剂能通过抑制复合涂层中光生电子和空穴的复合而增强其光电响应能力。
46.神经细胞在mno-c复合涂层表面的增殖行为和神经肽分泌量检测
47.采用大鼠肾上腺嗜铬细胞瘤pc12细胞进行神经细胞相关实验。
48.(1)细胞增殖
49.将密度为2
×
104/孔的pc12细胞接种于灭菌的样品表面,部分孔加入终浓度为5mm的vc,部分样品使用功率为3w的led灯(峰值波长为650nm,闪烁模式)辐照20-30min。培养24h后,采用cck-8法检测细胞增殖。
50.(2)cgrp神经肽分泌量
51.将密度为5
×
104/孔的pc12细胞接种于灭菌的样品表面,部分孔加入终浓度为5mm的vc。孵育24h后,部分样品使用功率为3w的led灯(峰值波长为650nm,闪烁模式)辐照20-30min,采用elisa法检测培养液中cgrp的含量。
52.图5中的a为pc12细胞在不同样品表面培养24h后的增殖结果,发现mno-c复合涂层能明显促进其表面pc12细胞在正常培养条件下的增殖。在红光的辐照下,相比于ti基材和mno涂层,mno-c复合涂层能显著促进pc12细胞增殖,其中mno-c(vc)组的细胞增值率最高。相比于正常培养条件,红光辐照提高了mno-c和mno-c(vc)组的细胞活性。因此,碳材料的负载利于提高mno-c复合涂层的光电活性和生物相容性,该复合涂层可通过光电信号促进神经细胞在其表面的增殖。
53.图5中的b为不同样品表面pc12细胞的cgrp分泌量,发现相较于mno涂层和ti基材,mno-c复合涂层表面能促进pc12细胞分泌cgrp。光照能显著促进mno-c(vc)组的神经细胞分泌cgrp,分泌量分别为ti和mno实验组的1.23倍和1.49倍,表明光电流促进了pc12细胞释放神经肽。由于神经肽能促进成骨细胞有丝分裂,上调成骨分化相关基因的表达,从而促进骨形成,因此,材料表面cgrp分泌量较高的pc12细胞具有促进成骨细胞分化的潜能。
54.成骨细胞在mno-c复合涂层表面的分化行为
55.采用小鼠前成骨细胞mc3t3-e1进行成骨细胞分化实验。
56.(1)碱性磷酸酶(alp)活性
57.将mc3t3-e1细胞接种于灭菌的样品表面,部分孔加入终浓度为5mm的vc,部分样品使用功率为3w的led灯辐照(峰值波长为650nm,闪烁模式)20-30min/d。孵育14d后,分别向每孔加入200μl含0.2%triton x-100的pbs溶液,置于冰上裂解15min。随后将裂解的悬浮液离心处理5min,收集上清液,转移至96孔板。将50μl的上清液与150μl的对硝基苯磷酸酯(p-nitrophenylphosphate,pnpp)混合,在避光下培养10min。采用酶标仪测定上清液的od值。此外,使用bca法检测细胞内的总蛋白含量,alp活性以μm/min
·
g表示。
58.(2)钙沉积量
59.将mc3t3-e1细胞接种于灭菌的样品表面,部分孔加入终浓度为5mm的vc,部分样品使用功率为3w的led灯辐照(峰值波长为650nm,闪烁模式)20-30min/d。孵育14d后,使用pbs洗涤样品2次,加入多聚甲醛溶液固定15min。随后加入茜素红染液(alizarin red,ars,sigma-aldrich),在37℃下孵育30min,pbs洗涤3次后,每孔加入500μl的氯化十六烷基吡啶(cetylpyridinium chloride,cpc,sigma-aldrich)溶液用于评价细胞的钙沉积量,室温下孵育15min。采用酶标仪测定上清液在590nm处的od值。
60.图6中的a和b分别为前成骨细胞在材料表面培养14d后的alp活性和钙沉积量。与正常培养条件相比,光照提高了ti表面mc3t3-e1细胞的alp活性和钙沉积量。在红光辐照下,不同样品表面细胞的alp活性呈现如下趋势:mno-c(vc)>mno-c>mno>ti。因此,mno-c复合涂层表面mc3t3-e1细胞在红光辐照下呈现出较好的成骨分化能力。
再多了解一些
本文用于创业者技术爱好者查询,仅供学习研究,如用于商业用途,请联系技术所有人。