tigit结合剂和其用途
本技术是申请号为201680032723.7,申请日为2016年5月27日,申请人为梅里奥生物制药第五有限公司,发明创造名称为“tigit结合剂和其用途”的发明专利申请的分案申请。相关申请的交叉参考
1.本技术主张在2015年5月28日提出申请的美国临时申请号62/167,582、2015年8月14日提出申请的美国临时申请号62/205,279及2016年3月25日提出申请的美国临时申请号62/313,487的优先权,将各案以其完整内容特此并入本文以供参考。
技术领域
2.本发明概括关于结合tigit的剂,特别为特异性结合tigit的细胞外结构域的抗体,以及使用该剂调节免疫反应及/或治疗疾病(诸如癌症)的方法。
背景技术:
3.免疫疗法的基础在于操控及/或调节免疫系统,包括先天免疫反应及后天免疫反应二者。免疫疗法的概括目标为藉由控制对〝外来剂〞(例如病原体或肿瘤细胞)的免疫反应来治疗疾病。然而,在一些事例中,免疫疗法是用于治疗可自对抗正常存在于体内的蛋白质、分子及/或组织的异常免疫反应引起的自体免疫疾病。免疫疗法可包括诱发或增强特异性免疫反应或抑制或降低特异性免疫反应的剂及方法。
4.免疫系统是由众多细胞类型所组成的高度复杂系统,这些细胞包括但不限于t细胞、b细胞、自然杀手细胞、抗原呈现细胞、树突细胞、单核球和巨噬细胞。这些细胞具有控制那些交互作用及反应的复杂且细微的系统。细胞是利用活化和抑制机制及回馈环路二者来维持查核反应且不容许不受控制的免疫反应的负面结果(例如自体免疫疾病)。
5.癌免疫监测的概念是基于免疫系统可辨识肿瘤细胞、启动免疫反应及抑制肿瘤发展及/或进展的理论。然而,明确的是许多癌细胞已发展出逃避免疫系统的机制,其可容许不受抑制的肿瘤生长。癌/肿瘤免疫疗法着重于发展可活化及/或激励免疫系统的新型且新颖的剂,以达成更有效的抗肿瘤细胞攻击,导致增加杀死肿瘤细胞及/或抑制肿瘤生长。
技术实现要素:
本发明概述
6.本发明提供结合具有ig及itim结构域的t 细胞免疫受体(tigit)的各种剂,包括但不限于特异性结合tigit的细胞外结构域的抗体。在特定的实施方案中,该剂为tigit拮抗剂。本发明提供使用该剂的方法。在一些实施方案中,本发明提供该剂于免疫疗法的方法。在一些实施方案中,本发明提供使用该剂于癌症免疫疗法的方法。在一些实施方案中,该剂是用于诱发、活化、促进、增强、提高或延长免疫反应的方法中。在一些实施方案中,该剂是用于诱发、活化、促进、增强、提高或延长对癌及/或肿瘤的免疫反应的方法中。在一些实施方案中,该剂是用于抑制肿瘤或肿瘤细胞生长的方法中。在一些实施方案中,该剂是用
于治疗癌症的方法中。在一些实施方案中,该方法包含抑制癌细胞生长。在一些实施方案中,该剂是与至少一种额外治疗剂组合使用。
7.本发明亦提供包含本文所述的剂的组合物,诸如医药组合物。亦提供编码该剂的多核苷酸及/或载体及制造该剂的方法。提供包含或生产本文所述的剂的细胞,以及包含本文所述的多核苷酸及/或载体的细胞。
8.在一个方面中,本发明提供结合tigit的剂。在一些实施方案中,该剂结合小鼠tigit。在一些实施方案中,该剂结合人类tigit。在一些实施方案中,该剂结合小鼠tigit及人类tigit。在一些实施方案中,该剂为抗体。在一些实施方案中,该剂为结合小鼠tigit的抗体。在一些实施方案中,该剂为结合人类tigit的抗体。在一些实施方案中,该剂为结合小鼠tigit及人类tigit的抗体。在一些实施方案中,该剂为结合人类 tigit及不结合小鼠tigit的抗体。
9.在一些实施方案中,该剂为特异性结合tigit 的细胞外结构域的抗体,该抗体包含:包含 gsslsssyms(seq id no:7)或gfslsssyms(seq idno:13)的重链cdr1、包含iigsngntyyanwakg (seq id no:8)的重链cdr2及包含ggyrtsgmdp(seqid no:9)的重链cdr3;及/或包含qasqsissylnw (seq id no:10)、qasqsniysdlaw(seq id no:14) 或qasqniysdlaw(seq id no:81)的轻链cdr1、包含 dalklas(seq id no:11)或rastlas(seq id no: 15)的轻链cdr2及包含qqehsvgnvdn(seq id no: 12)或qqehlvawiyn(seq id no:16)的轻链cdr3。在一些实施方案中,该剂为包含下列者的抗体:包含 gsslsssyms(seq id no:7)的重链cdr1、包含 iigsngntyyanwakg(seq id no:8)的重链cdr2及包含ggyrtsgmdp(seq id no:9)的重链cdr3;及/或包含qasqsissylnw(seq id no:10)的轻链cdr1、包含dalklas(seq id no:11)的轻链cdr2及包含 qqehsvgnvdn(seq id no:12)的轻链cdr3。在其他的实施方案中,该剂为包含下列者的抗体:包含 gfslsssyms(seq id no:13)的重链cdr1、包含 iigsngntyyanwakg(sq id no:8)的重链cdr2及包含 ggyrtsgmdp(seq id no:9)的重链cdr3;及/或包含qasqsniysdlaw(seq id no:14)的轻链cdr1、包含 rastlas(seq id no:15)的轻链cdr2及包含 qqehlvawiyn(seq id no:16)的轻链cdr3。在其他的实施方案中,该剂为包含下列者的抗体:包含 gfslsssyms(seq id no:13)的重链cdr1、包含 iigsngntyyanwakg(sq id no:8)的重链cdr2及包含 ggyrtsgmdp(seq id no:9)的重链cdr3;及/或包含 qasqniysdlaw(seq id no:81)的轻链cdr1、包含 rastlas(seq id no:15)的轻链cdr2及包含 qqehlvawiyn(seq id no:16)的轻链cdr3。
10.在一些实施方案中,该剂为特异性结合tigit 的细胞外结构域的抗体,其中抗体包含与seq id no: 17、seq id no:19或seq id no:32具有至少90%的序列一致性的重链可变区;及/或与seq id no:18或 seq id no:20具有至少90%的序列一致性的轻链可变区。在一些实施方案中,抗体包含与seq id no:17、 seq id no:19或seq id no:32具有至少95%的序列一致性的重链可变区;及/或与seq id no:18或seq idno:20具有至少95%的序列一致性的轻链可变区。在一些实施方案中,抗体包含:包含seq id no:17的重链可变区及包含seq id no:18的轻链可变区;包含seqid no:19的重链可变区及包含seq id no:20的轻链可变区;或包含seq id no:32的重链可变区及包含 seq id no:20的轻链可变区。
11.在一些实施方案中,该剂为特异性结人类 tigit的细胞外结构域的抗体,该抗体包含:包含 tsdyawn(seq id no:57)的重链cdr1、包含 yisysgstsynpslrs(seq id no:58)
的重链cdr2及包含arrqvglgfay(seq id no:59)的重链cdr3;及/ 或包含kasqdvstava(seq id no:60)的轻链cdr1、包含sasyryt(seq id no:61)的轻链cdr2及包含 qqhystp(seq id no:62)的轻链cdr3。
12.在一些实施方案中,该剂为特异性结合tigit 的细胞外结构域的抗体,该抗体包含与seq id no:63 或seq id no:67具有至少90%的序列一致性的重链可变区;及/或与seq id no:64或seq id no:68具有至少90%的序列一致性的轻链可变区。在一些实施方案中,抗体包含与seq id no:63或seq id no:67具有至少 95%的序列一致性的重链可变区;及/或与seq id no:64 或seq id no:68具有至少95%的序列一致性的轻链可变区。在一些实施方案中,抗体包含:包含seq id no: 63的重链可变区及包含seq id no:64的轻链可变区,或包含seq id no:67的重链可变区及包含seq idno:68的轻链可变区。
13.在一些实施方案中,该剂为抗体,其为单克隆抗体、人源化抗体、人类抗体、重组抗体、嵌合抗体、双特异性抗体、包含抗原结合部位的抗体片段、igg抗体、igg1抗体、igg2抗体或igg4抗体。在一些实施方案中,抗体为单价。在一些实施方案中,抗体为双价。在一些实施方案中,抗体为单特异性。在一些实施方案中,抗体为双特异性。
14.在一些实施方案中,该剂为特异性结合tigit 的抗体,其中抗体包含选自由下列所组成的群组的重链氨基酸序列:seq id no:26、seq id no:27、seq idno:29、seq id no:34和seq id no:56;及选自由下列所组成的群组的轻链氨基酸序列:seq id no:28和 seq id no:30。在一些实施方案中,抗体包含seq idno:265的重链氨基酸序列和seq id no:28的轻链氨基酸序列;seq id no:27的重链氨基酸序列和seq idno:28的轻链氨基酸序列;seq id no:29的重链氨基酸序列和seq id no:30的轻链氨基酸序列;seq idno:34的重链氨基酸序列和seq id no:30的轻链氨基酸序列;或seq id no:56的重链氨基酸序列和seq idno:30的轻链氨基酸序列。
15.在一些实施方案中,特异性结合人类tigit 的抗体包含seq id no:70的重链氨基酸序列和seq idno:72的轻链氨基酸序列。在一些实施方案中,特异性结合人类tigit的抗体包含seq id no:82的重链氨基酸序列和seq id no:72的轻链氨基酸序列。
16.在一些实施方案中,特异性结合人类tigit 的抗体不结合小鼠tigit。在一些实施方案中,特异性结合人类tigit的抗体不结合大鼠tigit。在一些实施方案中,特异性结合人类tigit的抗体不结合兔子tigit。在一些实施方案中,特异性结合人类tigit的抗体不结合狨猴tigit。在一些实施方案中,特异性结合人类tigit的抗体不结合狗tigit。在一些实施方案中,特异性结合人类tigit的抗体不结合猪tigit。在一些实施方案中,特异性结合人类tigit的抗体不结合食蟹猕猴tigit。在一些实施方案中,特异性结合人类tigit的抗体不结合恒河猴tigit。
17.在一些实施方案中,该剂为特异性结合tigit 的抗体,其中抗体包含来自选自由下列所组成的群组的抗体的重链可变区和轻链可变区:313r11、313r12、 313r14、313r19和313r20。在一些实施方案中,抗体是选自由下列所组成的群组:313r11、313r12、313r14、 313r19和313r20。在一些实施方案中,抗体为313r19。在一些实施方案中,抗体包含由寄存于atcc编号为 pta-122180的质粒编码的重链可变区。在一些实施方案中,抗体包含由寄存于atcc编号为pta-122181的质粒编码的轻链可变区。在一些实施方案中,抗体包含重链,其包含由寄存于atcc编号为pta-122180的质粒编码的重链可变区。在一些实施方案中,抗体
包含轻链,其包含由寄存于atcc编号为pta-122181的质粒编码的轻链可变区。在一些实施方案中,抗体包含由寄存于atcc编号为pta-122180的质粒编码的重链可变区及由寄存于 atcc编号为pta-122181的质粒编码的轻链可变区。在一些实施方案中,抗体包含由寄存于atcc编号为pta
‑ꢀ
122180的质粒编码的多肽及由寄存于atcc编号为pta
‑ꢀ
122181的质粒编码的多肽。
18.在另一方面中,本发明提供寄存于atcc且分配的指定编号为pta-122180的质粒及寄存于atcc且分配的指定编号为pta-122181的质粒。
19.在一些实施方案中,特异性结合人类tigit 的抗体包含来自抗体313m32的重链可变区和轻链可变区。在一些实施方案中,抗体包含由寄存于atcc编号为 pta-122346的质粒编码的重链可变区。在一些实施方案中,抗体包含多肽,其包含由寄存于atcc编号为pta
‑ꢀ
122346的质粒编码的重链可变区。在一些实施方案中,抗体包含由寄存于atcc编号为pta-122347的质粒编码的轻链可变区。在一些实施方案中,抗体包含由寄存于 atcc编号为pta-122347的质粒编码的轻链。在一些实施方案中,抗体包含由寄存于atcc编号为pta-122346 的质粒编码的重链可变区及由寄存于atcc编号为pta
‑ꢀ
122347的质粒编码的轻链可变区。在一些实施方案中,抗体包含由寄存于atcc编号为pta-122346的质粒编码的多肽及由寄存于atcc编号为pta-122347的质粒编码的多肽。
20.在另一方面中,本发明提供寄存于atcc且分配的指定编号为pta-122346的质粒及寄存于atcc且分配的指定编号为pta-122347的质粒。
21.在前述方面及实施方案,以及本文所述的其他方面及实施方案中的每一个的一些实施方案中,该剂为单价。在一些实施方案中,该剂为双价。在一些实施方案中,该剂为单特异性。在一些实施方案中,该剂为双特异性。在一些实施方案中,双特异性剂为异质二聚体剂或异质二聚体分子。在一些实施方案中,异质二聚体剂包含特异性结合tigit的本文所述的抗体。
22.在另一方面中,本发明提供分离的抗体,其与本文所述的剂(例如抗体)竞争与人类tigit特异性结合。在一些实施方案中,分离的抗体与本文所述的剂(例如抗体)结合人类tigit的相同的抗原决定区。在一些实施方案中,分离的抗体结合人类tigit的抗原决定区,该抗原决定区与以本文所述的剂(例如抗体)结合的tigit的抗原决定区重叠。在一些实施方案中,特异性结合人类 tigit的抗体结合抗原决定区,其包含在seq id no:79 内的氨基酸。在一些实施方案中,特异性结合人类tigit 的抗体结合抗原决定区,其包含在seq id no:80内的氨基酸。在一些实施方案中,特异性结合人类tigit的抗体结合抗原决定区,其包含在seq id no:79和seq idno:80内的氨基酸。在一些实施方案中,特异性结合人类tigit的抗体结合抗原决定区,其包含seq id no:4 的氨基酸q62和i109。在一些实施方案中,特异性结合人类tigit的抗体结合抗原决定区,其包含seq id no: 4的氨基酸q62和t119。在一些实施方案中,特异性结合人类tigit的抗体结合抗原决定区,其包含seq idno:4的氨基酸q64和i109。在一些实施方案中,特异性结合人类tigit的抗体结合抗原决定区,其包含seqid no:4的氨基酸q64和t119。在一些实施方案中,特异性结合人类tigit的抗体结合抗原决定区,其包含seqid no:4的氨基酸q62、q64和i109。在一些实施方案中,特异性结合人类tigit的抗体结合抗原决定区,其包含seq id no:4的氨基酸q62、q64和t119。在一些实施方案中,特异性结合人类tigit的抗体结合抗原决定区,其包含seq id no:4的氨基酸q62、
i109和t119。在一些实施方案中,特异性结合人类tigit的抗体结合抗原决定区,其包含seq id no:4的氨基酸q64、i109和 t119。在一些实施方案中,特异性结合人类tigit的抗体结合抗原决定区,其包含seq id no:4的氨基酸q62、 q64、i109和t119。在一些实施方案中,特异性结合人类 tigit的抗体结合抗原决定区,其包含至少一种选自由下列所组成的群组:seq id no:4的氨基酸n58、e60、 q62、q64、l65、f107、i109、h111、t117、t119、 g120和r121。在一些实施方案中,抗原决定区为构象抗原决定区。在一些实施方案中,特异性结合人类tigit的抗体结合抗原决定区,其不包含seq id no:4的氨基酸 v100。
23.在前述方面及实施方案,以及本文所述的其他方面及实施方案中的每一个的一些实施方案中,特异性结合tigit的剂为抗体,其中抗体为双特异性剂的一部分。在一些实施方案中,双特异性剂包含结合tigit的第一臂及结合第二标靶的第二臂(second arm)。在一些实施方案中,双特异性剂包含特异性结合tigit的第一臂及第二臂,其中第一臂包含本文所述的抗tigit抗体。在一些实施方案中,双特异性剂包含结合tigit的第一臂及包含来自抗体的抗原结合部位的第二臂。在一些实施方案中,双特异性剂包含结合tigit的第一臂及特异性结合pd
‑ꢀ
1、pd-l1、ctla4、tim-3、lag-3、ox-40或gitr的第二臂。在一些实施方案中,双特异性剂包含结合tigit 的第一臂及特异性结合肿瘤抗原的第二臂。在一些实施方案中,双特异性剂包含结合tigit的第一臂及包含免疫反应刺激剂的第二臂。在一些实施方案中,免疫反应刺激剂是选自由下列所组成的群组:颗粒细胞-巨噬细胞集落刺激因子(gm-csf)、巨噬细胞集落刺激因子(m-csf)、颗粒细胞集落刺激因子(g-csf)、白介素2(il-2)、白介素3 (il-3)、白介素12(il-12)、白介素15(il-15)、b7-1 (cd80)、b7-2(cd86)、4-1bb配体、gitrl、ox-40l、抗cd3抗体、抗ctla4抗体、抗pd-1抗体、抗pd-l1 抗体、抗gitr抗体、抗ox-40抗体、抗lag-3抗体和抗tim-3抗体。
24.在一些实施方案中,双特异性剂为异质二聚体剂或异质二聚体分子。在一些实施方案中,双特异性剂为同质二聚体剂或同质二聚体分子。在一些实施方案中,异质二聚体分子包含结合人类tigit的第一臂及结合第二标靶的第二臂。在一些实施方案中,异质二聚体分子包含特异性结合人类tigit的第一臂及第二臂,其中第一臂包含本文所述的抗tigit抗体。在一些实施方案中,异质二聚体分子包含结合人类tigit的第一臂及特异性结合第二标靶的第二臂,该第二臂包含来自抗体的抗原结合部位。在一些实施方案中,异质二聚体分子为双特异性抗体。在一些实施方案中,异质二聚体分子包含结合人类tigit的第一臂及特异性结合肿瘤抗原的第二臂。在一些实施方案中,异质二聚体分子包含结合人类tigit的第一臂及特异性结合pd-1、pd-l1、ctla-4、tim-3、lag-3、ox
‑ꢀ
40、4-1bb或gitr的第二臂。在一些实施方案中,异质二聚体分子包含结合tigit的第一臂及第二臂,该第二臂包含免疫治疗剂。在一些实施方案中,免疫治疗剂是选自由下列所组成的群组:颗粒细胞-巨噬细胞集落刺激因子 (gm-csf)、巨噬细胞集落刺激因子(m-csf)、颗粒细胞集落刺激因子(g-csf)、白介素2(il-2)、白介素3(il-3)、白介素12(il-12)、白介素15(il-15)、b7-1(cd80)、b7
‑ꢀ
2(cd86)、4-1bb配体、gitrl、ox-40l、抗cd3抗体、抗ctla-4抗体、抗pd-1抗体、抗pd-l1抗体、抗4
‑ꢀ
1bb抗体、抗gitr抗体、抗ox-40抗体、抗lag-3抗体和抗tim-3抗体。
25.在一些实施方案中,本文所述的异质二聚体分子包含第一臂及第二臂,该第一臂包含第一ch3结构域且该第二臂包含第二ch3结构域,其中各ch3结构域经修饰以促进异质二聚体的形成。在一些实施方案中, ch3结构域是基于静电效应而修饰。在一些实施方案
中, ch3结构域是利用突起进入孔中(knobs-into-holes)技术而修饰。
26.在一些实施方案中,本文所述的双特异性剂包含第一臂及第二臂,该第一臂包含第一ch3结构域,该第二臂包含第二ch3结构域,其中各ch3结构域经修饰以促进异质二聚体的形成。在一些实施方案中,ch3结构域是基于静电效应而修饰。在一些实施方案中,ch3结构域是利用突起进入孔中技术而修饰。
27.在前述方面及实施方案,以及本文所述的其他方面及实施方案中的每一个的一些实施方案中,本文所述的剂特异性结合tigit且抑制tigit与脊髓灰白质病毒受体(pvr)结合。在一些实施方案中,该剂特异性结合 tigit且抑制或阻断tigit与pvr之间的交互作用。在一些实施方案中,该剂特异性结合tigit且抑制tigit与 pvr-l2结合。在一些实施方案中,该剂特异性结合 tigit且抑制或阻断tigit与pvr-l2之间的交互作用。在一些实施方案中,该剂特异性结合tigit且抑制tigit 与pvr-l3结合。在一些实施方案中,该剂特异性结合 tigit且抑制或阻断tigit与pvr-l3之间的交互作用。在一些实施方案中,该剂为tigit拮抗剂。在一些实施方案中,该剂特异性结合tigit且抑制tigit传导信号。在一些实施方案中,该剂特异性结合tigit且为经tigit介导的传导信号的拮抗剂。在一些实施方案中,该剂特异性结合tigit且抑制tigit活化。在一些实施方案中,该剂特异性结合tigit且抑制tigit磷酸化。在一些实施方案中,该剂特异性结合tigit且降低tigit的细胞表面表达。
28.在前述方面及实施方案,以及本文所述的其他方面及实施方案中的每一个的一些实施方案中,本文所述的剂特异性结合tigit且诱发、活化、促进、增强、提高及/或延长免疫反应。在一些实施方案中,免疫反应是针对肿瘤或肿瘤细胞。在一些实施方案中,免疫反应是针对病毒或病毒感染细胞。在一些实施方案中,该剂增加细胞介导的免疫力。在一些实施方案中,该剂增加t细胞活性。在一些实施方案中,该剂增加溶胞性t细胞(ctl)活性。在一些实施方案中,该剂增加自然杀手(nk)细胞活性。在一些实施方案中,该剂增加il-2生产及/或il-2生产细胞的数目。在一些实施方案中,该剂增加ifn-γ生产及/或ifn-γ生产细胞的数目。在一些实施方案中,该剂增强th1型免疫反应。在一些实施方案中,该剂降低il-4 生产及/或il-4生产细胞的数目。在一些实施方案中,该剂降低il-10及/或il-10生产细胞的数目。在一些实施方案中,该剂降低il-6及/或il-6生产细胞的数目。在一些实施方案中,该剂降低il-5及/或il-5生产细胞的数目。在一些实施方案中,该剂降低th2型免疫反应。在一些实施方案中,该剂降低treg细胞的数目。在一些实施方案中,该剂降低treg活性。在一些实施方案中,该剂抑制及/或降低treg的抑制活性。在一些实施方案中,该剂降低mdsc的数目。在一些实施方案中,该剂抑制及/或降低骨髓衍生性抑制细胞(mdsc)的抑制活性。
29.在前述方面及实施方案,以及本文所述的其他方面及实施方案中的每一个的一些实施方案中,本文所述的剂特异性结合tigit且抑制肿瘤生长。在一些实施方案中,该剂降低肿瘤生长。在一些实施方案中,该剂降低肿瘤生长至不可检测的大小。在一些实施方案中,该剂诱发长期抗肿瘤免疫性。
30.在另一方面中,本发明提供包含本文所述的剂的组合物。亦提供使用包含本文所述的剂的组合物的方法。
31.在另一方面中,本发明提供本文所述的剂及医药上可接受的载剂的医药组合物。亦提供治疗受试者 (例如人类)的癌症及/或抑制肿瘤生长的方法,其包含对受试者施用有效量的包含本文所述的剂的组合物。亦提供治疗受试者(例如人类)的病毒感染的方法,其
包含对受试者施用有效量的包含本文所述的剂的组合物。
32.在前述方面,以及本文别处所述的其他方面/ 实施方案中的每一个的特定实施方案中,该剂被分离。在特定的实施方案中,该剂实质上是纯的。
33.在另一方面中,本发明提供多核苷酸,其包含编码本文所述的剂的多核苷酸。在一些实施方案中,多核苷酸经分离。在一些实施方案中,本发明提供包含多核苷酸的载体,以及包含载体及/或多核苷酸的细胞。在一些实施方案中,本发明亦提供包含或生产本文所述的剂的细胞。在一些实施方案中,细胞为单克隆细胞系。
34.在另一方面中,本发明提供调节受试者的免疫反应的方法。在一些实施方案中,调节免疫反应的方法包含诱发、活化、促进、增强、提高或延长受试者的免疫反应的方法。在一些实施方案中,诱发、活化、促进、增强、提高或延长受试者的免疫反应的方法包含施用治疗有效量的本文所述的抗体、双特异性剂或多肽。在一些实施方案中,诱发、活化、促进、增强、提高或延长受试者的免疫反应的方法包含施用治疗有效量的本文所述的异质二聚体双特异性剂或同质二聚体双特异性剂。在一些实施方案中,诱发、活化、促进、增强、提高或延长受试者的免疫反应的方法包含施用治疗有效量的本文所述的抗体,该抗体特异性结合tigit。在一些实施方案中,诱发受试者中的免疫反应的方法包含施用本文所述的剂。在一些实施方案中,活化受试者的免疫反应的方法包含施用本文所述的剂。在一些实施方案中,促进受试者的免疫反应的方法包含施用本文所述的剂。在一些实施方案中,增加受试者的免疫反应的方法包含施用本文所述的剂。在一些实施方案中,增强受试者的免疫反应的方法包含施用本文所述的剂。在一些实施方案中,延长受试者的免疫反应的方法包含施用本文所述的剂。在一些实施方案中,免疫反应是针对抗原刺激。在一些实施方案中,抗原刺激为肿瘤或肿瘤细胞。在一些实施方案中,抗原刺激为病原体。在一些实施方案中,抗原刺激为病毒。在一些实施方案中,抗原刺激为病毒感染细胞。在一些实施方案中,免疫反应是对抗肿瘤或癌。
35.在一些实施方案中,本发明提供增加免疫细胞活性的方法。在一些实施方案中,增加免疫细胞活性的方法包含将细胞与有效量的本文所述的剂接触。在一些实施方案中,免疫细胞为t细胞、nk细胞、单核球、巨噬细胞、骨髓衍生性细胞、抗原呈现细胞(apc)及/或b细胞。在一些实施方案中,增加受试者的nk细胞活性的方法包含对受试者施用治疗有效量的本文所述的剂。在一些实施方案中,增加受试者的t细胞活性的方法包含对受试者施用治疗有效量的本文所述的剂。在一些实施方案中,增加受试者的t细胞及/或nk细胞活化的方法包含对受试者施用治疗有效量的本文所述的剂。在一些实施方案中,增加受试者的t细胞反应的方法包含对受试者施用治疗有效量的本文所述的剂。在一些实施方案中,增加受试者的ctl细胞活性的方法包含对受试者施用治疗有效量的本文所述的剂。在一些实施方案中,抑制受试者的treg 活性的方法包含对受试者施用治疗有效量的本文所述的剂。在一些实施方案中,抑制受试者的treg的抑制活性的方法包含对受试者施用治疗有效量的本文所述的剂。在一些实施方案中,抑制受试者的mdsc活性的方法包含对受试者施用治疗有效量的本文所述的剂。在一些实施方案中,抑制受试者的mdsc的抑制活性的方法包含对受试者施用治疗有效量的本文所述的剂。
36.在一些实施方案中,本发明提供诱发、活化、促进、增强、提高或延长受试者的免疫反应的方法,其包含对受试者施用治疗有效量的结合人类tigit的剂。在一些实施方案中,
诱发、活化、促进、增强、提高或延长受试者的免疫反应的方法包含对受试者施用治疗有效量的抑制或降低tigit活性的剂。在一些实施方案中,诱发、活化、促进、增强、提高或延长受试者的免疫反应的方法包含对受试者施用治疗有效量的抑制或降低tigit传导信号的剂。在一些实施方案中,免疫反应是对抗肿瘤细胞、肿瘤或癌。在一些实施方案中,免疫反应是对抗病毒感染、病毒抗原或病毒感染细胞。
37.在另一方面中,本发明提供抑制肿瘤细胞或肿瘤生长的方法,其包含将肿瘤或肿瘤细胞与有效量的本文所述的剂接触。在一些实施方案中,抑制肿瘤生长的方法包含将肿瘤或肿瘤细胞与有效量的结合人类tigit的剂接触。
38.在另一方面中,本发明提供抑制受试者的肿瘤生长的方法,其包含对受试者施用治疗有效量的本文所述的剂。在一些实施方案中,抑制受试者的肿瘤生长的方法包含对受试者施用治疗有效量的结合人类tigit的剂。在一些实施方案中,抑制受试者的肿瘤生长的方法包含对受试者施用治疗有效量的结合人类tigit的抗体。在一些实施方案中,抑制受试者的肿瘤生长的方法包含对受试者施用治疗有效量的结合人类tigit的双特异性剂。在一些实施方案中,肿瘤是选自由下列所组成的群组:结肠直肠肿瘤、结肠肿瘤、卵巢肿瘤、胰肿瘤、肺肿瘤、肝肿瘤、乳房肿瘤、肾肿瘤、前列腺肿瘤、胃肠道肿瘤、黑色素瘤、子宫颈肿瘤、膀胱肿瘤、神经胶质母细胞瘤和头与颈肿瘤。
39.在另一方面中,本发明提供治疗受试者的癌症的方法,其包含对受试者施用治疗有效量的本文所述的剂。在一些实施方案中,治疗受试者的癌症的方法包含对受试者施用治疗有效量的结合人类tigit的剂。在一些实施方案中,治疗受试者的癌症的方法包含对受试者施用治疗有效量的结合人类tigit的抗体。在一些实施方案中,治疗受试者的癌症的方法包含对受试者施用治疗有效量的结合人类tigit的双特异性剂。在一些实施方案中,癌症是选自由下列所组成的群组:结肠直肠癌症、卵巢癌症、胰脏癌、肺癌、肝癌、乳癌、肾脏癌、前列腺癌、胃肠道癌症、黑色素瘤、子宫颈癌症、膀胱癌症、神经胶质母细胞瘤和头与颈癌症。
40.在另一方面中,本发明提供刺激及/或诱发受试者的长期抗肿瘤免疫性的方法,其包含将治疗有效量的本文所述的剂施用给受试者。
41.在另一方面中,本发明提供刺激受试者中的保护反应的方法,其包含对受试者施用治疗有效量的本文所述的剂与关注的抗原组合。在一些实施方案中,关注的抗原为肿瘤抗原。在一些实施方案中,关注的抗原为癌细胞生物标记。在一些实施方案中,关注的抗原为癌干细胞标记。
42.在前述方面及实施方案,以及本文所述的其他方面及实施方案中的每一个的一些实施方案中,该方法包含对受试者施用免疫反应刺激剂。在一些实施方案中,免疫反应刺激剂是选自由下列所组成的群组:gm-csf、 m-csf、g-csf、il-3、il-12、il-1、il-2、b7-1 (cd80)、b7-2(cd86)、抗cd3抗体、抗ctla-4抗体、抗cd28抗体、抗pd-l1抗体和抗pd1抗体。
43.在前述方面及实施方案,以及本文所述的其他方面及实施方案中的每一个的一些实施方案中,该方法进一步包含施用至少一种额外治疗剂。在一些实施方案中,额外治疗剂为化疗剂。在一些实施方案中,额外治疗剂为抗体。在一些实施方案中,额外治疗剂为抗pd-1抗体、抗pd-l1抗体、抗ctla4抗体、抗lag-3抗体或抗 tim-3抗体。在一些实施方案中,额外治疗剂为notch途径、wnt途径或rspo/lgr途径的抑制剂。
44.在一些实施方案中,额外治疗剂为免疫治疗剂。如本文所使用的词句〝免疫治疗剂〞是以最广义使用且是指直接或间接影响或调节免疫系统的物质。在一些实施方案中,免疫治疗剂为藉由诱发免疫系统组分中的任一者活化或增加免疫系统组分中的任一者的活性而直接或间接刺激免疫系统的剂。当考虑tigit结合剂为免疫治疗剂时,则可将此额外的免疫治疗剂视为〝第二〞免疫治疗剂。在一些实施方案中,第二免疫治疗剂是选自由下列所组成的群组:gm-csf、m-csf、g-csf、il-2、il-3、il
‑ꢀ
12、il-15、b7-1(cd80)、b7-2(cd86)、4-1bb配体、 gitrl、ox-40配体、抗cd3抗体、抗ctla-4抗体、抗 cd28抗体、抗pd-1抗体、抗pd-l1抗体、抗4-1bb抗体、抗gitr抗体、抗ox-40抗体、抗lag-3抗体和抗 tim-3抗体。在一些实施方案中,第二免疫治疗剂为包含下列的融合蛋白:gm-csf、m-csf、g-csf、il-2、il
‑ꢀ
3、il-12、il-15、b7-1(cd80)、b7-2(cd86)、4-1bb配体、gitrl、ox-40配体或其片段。在一些实施方案中,第二免疫治疗剂为包含gitrl、ox40配体或4-1bb配体的至少一种复制的细胞外结构域的融合蛋白。
45.在前述方面及实施方案,以及本文所述的其他方面及实施方案中的每一个的一些实施方案中,受试者为人类。在一些实施方案中,受试者曾患有至少已部分移除的肿瘤或癌。
46.在前述方面及实施方案,以及本文所述的其他方面及实施方案中的每一个的一些实施方案中,肿瘤或癌表达pd-l1。在一些实施方案中,该方法另外包含测定肿瘤或癌中的pd-l1表达量的步骤。在一些实施方案中,测定pd-l1表达量是在以本文所述的剂治疗或接触之前进行。在一些实施方案中,若肿瘤或癌具有上升的pd-l1表达量,则将本文所述的剂施用受试者。在一些实施方案中,若肿瘤或癌具有上升的pd-l1表达量,则将肿瘤或癌与本文所述的剂接触。
47.在此本发明的方面或实施方案是按照马库西 (markush)群组或其他替代群组说明,本发明不仅包含以全体列示的整个群组,并亦个别包含群组的每一成员及主要群组中所有可能的亚群组,且亦包含群组成员中的一或多者不存在的主要群组。本发明亦展望明确排除于所主张的本发明以外的任何群组成员中的一或多者。
附图说明
48.图1a和1b.对小鼠tigit所产生的兔子抗体的facs分析。(a)将hek-293t细胞以编码小鼠tigitecd-cd4tm-gfp(绿荧光蛋白)或人类tigit ecd
‑ꢀ
cd4tm-gfp的cdna表达载体过渡性转染。将转染的细胞以兔子抗体培育且以流动式细胞测量术分析。特异性结合是以各facs图内存在的对角线信号表示。(b)将hek
‑ꢀ
293t细胞以编码小鼠tigit-cd4tm-gfp的cdna表达载体过渡性转染。将转染的细胞与可溶性小鼠pvr-fc融合蛋白在对小鼠tigit所产生的兔子抗体或没有抗体的存在下培育且以流动式细胞测量术分析。特异性结合是以各 facs图内存在的对角线信号表示。结合阻断是由失去的特异性结合来证明且以facs图上的圆圈表示。
49.图2a和2b.在tigit-pvr交互作用之后的蛋白质磷酸化的西方墨点分析。将人类jurket t细胞以 flag-标签化的小鼠tigit-gfp稳定地转导及将e.g7
‑ꢀ
ova细胞以小鼠pvr-gfp稳定地转导。(a)tigit磷酸化。(b)shp1及erk1/2磷酸化。
50.图3.在抗tigit抗体不存在或存在下的 tigit-pvr交互作用之后的tigit磷酸化
的西方墨点分析。
51.图4.在抗tigit抗体不存在或存在下的 tigit-pvr交互作用之后的shp1及erk1/2磷酸化的西方墨点分析。
52.图5a和5b.细胞激素生产的tigit抑制作用。(a)在表达tigit的b3z t细胞及b3z t细胞中的 il-2分泌。(b)在以抗tigit抗体预处理之后,在表达 tigit的b3z t细胞及b3z t细胞中的il-2分泌。
53.图6a和6b.自然杀手细胞活性的tigit抑制作用。(a)表达tigit的亲代nk-92细胞及nk-92细胞的细胞毒性。(b)在以抗tigit抗体预处理之后,表达 tigit的亲代nk-92细胞及nk-92细胞的细胞毒性。
54.图7a和7b.以抗tigit抗体的肿瘤生长抑制。将结肠肿瘤系ct26.wt经皮下植入balb/c小鼠中(n =10只小鼠/组)。小鼠是在第10、15、18、22、25和29 天以0.25毫克/小鼠的抗tigit抗体313r11、抗tigit抗体313r12、小鼠igg1对照抗体和小鼠igg2对照抗体注射。监测肿瘤生长且以电子式卡尺在指示的时间点测量肿瘤体积。数据是以注射后几天内的肿瘤体积(立方毫米)显示。(a)图显示各组的平均值
±
sem。(b)以抗tigit抗体 313r12及对照抗体的额外研究。
55.图8.以抗tigit抗体的肿瘤生长抑制。将结肠肿瘤系ct26.wt经皮下植入balb/c小鼠中(n=10只小鼠/组)。小鼠是在第10、14、17和21天以0.25毫克/小鼠的抗tigit抗体313r12、抗tigit抗体313r13和小鼠 igg2对照抗体注射。监测肿瘤生长且以电子式卡尺在指示的时间点测量肿瘤体积。数据是以注射后几天内的肿瘤体积(立方毫米)显示。图显示各组的平均值
±
sem。
56.图9a至9d.用于ifn-γ、il-2、il-4和il
‑ꢀ
10的elispot检定法。细胞是自以抗tigit抗体313r12 或同型匹配的对照抗体治疗的携ct26.wt肿瘤的小鼠的脾收获。细胞是在ah-1肽的存在或不存在下培育且接着使用elispot试剂盒分析。(a)显示细胞生产的ifn-γ的总光学密度(tod)。(b)显示细胞生产的il-2的tod。(c) 显示细胞生产的il-4的tod。(b)显示细胞生产的il-10 的tod。
57.图10.在来自以抗tigit抗体治疗的小鼠的脾细胞群中的自然杀手细胞活性。
58.图11.在来自以抗tigit抗体治疗的小鼠的脾细胞群中的treg活性。
59.图12a至12e.来自以抗tigit抗体治疗的小鼠的脾细胞的facs分析。(a)总活细胞中的cd3 细胞百分比。(b)总活细胞中的cd4 细胞百分比。(c)总活细胞中的cd8 细胞百分比。(d)总cd4 群中的cd4 中心记忆t细胞百分比。(e)总cd8 群中的cd8 中心记忆t 细胞百分比。
60.图13a至13d.在来自以抗tigit抗体治疗的小鼠的脾细胞群中的tigit阳性或阴性treg的facs 分析。(a)总活细胞中的tigit-阳性细胞百分比。(b)总 cd4 细胞中的foxp3 细胞百分比(鉴别treg)。(c)总treg 细胞中的tigit-阳性细胞百分比。(d)总treg细胞中的 tigit-阴性细胞百分比。
61.图14a至14d.在来自以抗tigit抗体治疗的小鼠的脾细胞群中的mdsc的facs分析。(a)总活细胞中的cd11b 细胞百分比。(b)总cd11b 细胞中的 mdsc百分比。(c)总cd11b 细胞中的g-mdsc百分比。 (d)总cd11b 细胞中的m-mdsc百分比。
62.图15.以抗tigit抗体的肿瘤生长抑制。将肾癌细胞(鼠类肾腺癌)经皮下植入
balb/c小鼠中(n=10 只小鼠/组)。小鼠是在第7、10、14、17、21和24天以 0.25毫克/小鼠的抗tigit抗体313r12及小鼠igg2对照抗体注射。监测肿瘤生长且以电子式卡尺在指示的时间点测量肿瘤体积。数据是以注射后几天内的肿瘤体积(立方毫米)显示。图显示各组的平均值
±
sem。
63.图16.以抗tigit抗体313r12的肿瘤生长抑制
–
剂量研究。将鼠类结肠肿瘤系ct26.wt经皮下植入balb/c小鼠中(n=10只小鼠/组)。将小鼠是以0.5、 1、3、5、10、15或30毫克/公斤的抗tigit抗体313r12 治疗或以对照抗体治疗。小鼠是以每周两次经腹膜内注射给药,总共6次剂量。监测肿瘤生长且以电子式卡尺测量肿瘤体积。
64.图17a至17f.以抗tigit抗体313r12和抗 pd-l1抗体的活体内肿瘤生长抑制。鼠类结肠肿瘤系 ct26.wt是经皮下植入(30,000个细胞/小鼠)balb/c小鼠中。将小鼠以0.25毫克/小鼠的抗tigit抗体313r12、抗 pd-l1抗体、313r12与抗pd-l1抗体的组合或对照抗体治疗(每组n=10)。将小鼠以每周两次施用抗体经3周。监测肿瘤生长且以电子式卡尺在指示的时间点测量肿瘤体积。(a)在以对照抗体治疗的组内的个别小鼠的肿瘤体积。(b)在以抗tigit抗体313r12治疗的组内的个别小鼠的肿瘤体积。(c)在以抗pd-l1抗体治疗的组内的个别小鼠的肿瘤体积。(d)在以抗tigit抗体313r12与抗pd-l1 抗体治疗的组内的个别小鼠的肿瘤体积。(e)四个治疗组的平均肿瘤生长。(f)存活率曲线。
65.图18a至18e.以抗tigit抗体313r12和抗 pd-1抗体的活体内肿瘤生长抑制。将鼠类结肠肿瘤系 ct26.wt经皮下植入(30,000个细胞/小鼠)balb/c小鼠中。将小鼠以0.25毫克/小鼠的抗tigit抗体313r12、抗pd-1抗体、313r12与抗pd-1抗体的组合或对照抗体(每组n=15)治疗。将小鼠以每周两次施用抗体经3周。监测肿瘤生长且以电子式卡尺在指示的时间点测量肿瘤体积。(a)在以对照抗体治疗的组内的个别小鼠的肿瘤体积。(b)在以抗tigit抗体313r12治疗的组内的个别小鼠的肿瘤体积。(c)在以抗pd-1抗体治疗的组内的个别小鼠的肿瘤体积。(d)在以抗tigit抗体313r12与抗pd-1抗体治疗的组内的个别小鼠的肿瘤体积。(e)四个治疗组的平均肿瘤生长。
66.图19a和19b.阻断人类tigit与pvr结合的抗tigit抗体的facs分析。(a)将hek-293t细胞以编码人类tigit ecd-cd4tm-gfp(绿荧光蛋白)或人类 tigit ecd-cd4tm-gfp的cdna表达载体过渡性转染。将转染的细胞与可溶性人类pvr-fc融合蛋白在对tigit 所产生的10、2或0.4微克/毫升浓度的抗体(313r19、 313m26或313m32)或没有抗体的存在下培育且以流动式细胞测量术分析。特异性结合是以facs图内存在的对角线信号表示。结合阻断是由facs图上以深黑色框内的失去的特异性结合来证明。(b)将hek-293t细胞以编码人类tigit ecd-cd4tm-gfp(绿荧光蛋白)或人类tigitecd-cd4tm-gfp的cdna表达载体过渡性转染。将转染的细胞与可溶性人类pvr-兔子fc融合蛋白在对tigit所产生的10、5、2.5或1.25微克/毫升浓度的抗体(313r19 或313m32)或在没有抗体的存在下培育且以流动式细胞测量术分析。特异性结合是以facs图内存在的对角线信号表示。结合阻断是由facs图上以深黑色框内的失去的特异性结合来证明。
67.图20.在抗tigit抗体313r19、313m26和 313m32不存在或存在下的tigit-pvr交互作用之后, tigit磷酸化的西方墨点分析。
68.图21.人类tigit(seq id no:4)、食蟹猕猴tigit(seq id no:77)及恒河猴tigit(seq id no: 78)的序列比对。
69.图22.藉由抗tigit抗体与含有特异性氨基酸取代的变体人类tigit蛋白质结合的facs分析的抗原决定区定位。htigit变体为(1)e36k和i41v;(2) t51m;(3)q62h和q64h;(4)d72e;(5)s78y和 s80a;(6)v100m;(7)i109t和t119r;及(8)g135s。
70.图23.代表与tigit结合的pvr的图形。人类tigit的结构是以球图像显示及pvr的结构是以带状图像提供。包含313m32抗原决定区的至少一部分的氨基酸以黑球显示。包含313m34/10a7抗原决定区的至少一部分的氨基酸以灰球显示。
71.图24a和24b.在抗tigit抗体之间的竞争结合研究。(a)以313r19与313m26的竞争研究。(b)与 313m34/10a7及313r19或313m34/10a7与313m32的竞争研究。
72.图25.以抗tigit抗体反转经pvr-介导的细胞激素分泌抑制。
73.图26.抗体依赖性细胞毒性检定法。
74.图27.在人源化小鼠模式中以抗tigit抗体 313r19和313m32的肿瘤生长抑制。将人源化小鼠以源自患者的黑色素瘤肿瘤细胞经皮下注射(omp-m9,75,000个细胞/小鼠)。容许肿瘤生长19天,直到其达到约50立方毫米的平均体积。将携肿瘤的小鼠随机分组(每组n=8)。将携肿瘤的小鼠以对照抗体、抗tigit抗体313r19或抗 tigit抗体313m32治疗。将小鼠每5天以1或5毫克/公斤给药。监测肿瘤生长且以电子式卡尺在指示的时间点测量肿瘤体积。
具体实施方式
75.本发明提供调节免疫反应的新颖剂,其包括但不限于多肽、抗体和异质二聚体分子。该剂包括特异性结合tigit的多肽、抗体和异质二聚体分子及调节tigit 活化及/或传导信号的剂。该剂包括抑制tigit活化及/或传导信号的多肽、抗体和异质二聚体分子,由此增强免疫反应。亦提供相关的多肽和多核苷酸,包含该剂的组合物,及制造该剂的方法。提供筛选用于调节免疫反应的剂的方法。提供使用新颖剂的方法,诸如抑制肿瘤生长的方法及/或治疗癌症的方法。亦提供治疗病毒感染的方法。进一步提供使用新颖剂的方法,诸如活化免疫反应的方法、刺激免疫反应的方法、促进免疫反应的方法、增强免疫反应的方法、活化自然杀手(nk)细胞及/或t细胞的方法、增加nk细胞及/或t细胞活性的方法、促进nk细胞及/或t细胞活性的方法、降低及/或抑制t细胞抑制因子的方法、及/或降低及/或抑制骨髓衍生性抑制细胞的方法。另外,可将本文所述的新颖剂用于抑制免疫反应的方法、抑制免疫反应的方法、降低t细胞活性的方法及/或治疗自体免疫疾病的方法中。i.定义
76.为了有助于对本发明的了解,将许多术语及词句定义于下。
77.如本文所使用的术语〝促效剂〞和〝促效性〞是指或说明能够直接或间接地、实质地诱发、活化、促进、增加或增强标靶及/或途径的生物活性的剂。本文所使用的术语〝促效剂〞包括部分或完全诱发、活化、促进、增加或增强蛋白质活性的任何剂。
78.如本文所使用的术语〝拮抗剂〞和〝拮抗性〞是指或说明能够直接或间接地、部分或完全地阻断、抑制、降低或中和标靶及/或途径的生物活性的剂。本文所使用的术语〝拮抗剂〞包括部分或完全地阻断、抑制、降低或中和蛋白质活性的任何剂。
79.如本文所使用的术语〝调节(modulation)〞和〝调节(modulate)〞是指生物活性的改变或变化。调节包括但不限于刺激活性或抑制活性。调节可为增加或降低活性、改变结合
特征或与蛋白质、途径、系统或其他关注的生物标靶的活性相关联的生物、功能或免疫性质的任何其他改变。
80.如本文所使用的术语〝抗体〞是指辨识及透过至少一个抗原结合部位特异性结合标靶的免疫球蛋白分子。标靶可为蛋白质、多肽、肽、碳水化合物、多核苷酸、脂质或前述中任一者的组合。如本文所使用的术语包含完整多克隆抗体、完整单克隆抗体、抗体片段(诸如 fab、fab'、f(ab')2和fv片段)、单链fv(scfv)抗体、多特异性抗体、双特异性抗体、单特异性抗体、单价抗体、嵌合抗体、人源化抗体、人类抗体、包含抗体的抗原结合部位的融合蛋白及任何其他包含抗原结合部位的经修饰的免疫球蛋白分子,只要抗体展现所期望的生物活性。抗体可为五种基于那些分别称为α、δ、ε、γ及μ的重链恒定结构域的一致性的主要类别的免疫球蛋白中的任一者: iga、igd、ige、igg和igm,或其子类别(同型)(例如 igg1、igg2、igg3、igg4、iga1和iga2)。不同类别的免疫球蛋白具有不同且熟知的子单位结构及三维构型。抗体可为未经修饰(naked)或与其他分子共轭,这些其他分子包括但不限于毒素及放射性同位素。
81.术语〝抗体片段〞是指完整抗体的一部分且通常是指完整抗体的抗原性决定可变区。抗体片段的实例包括但不限于fab、fab'、f(ab')2和fv片段、线性抗体、单链抗体及自抗体片段所形成的多特异性抗体。如本文所使用的〝抗体片段〞包含抗原结合部位或抗原决定区结合部位。
82.术语抗体的〝可变区〞是指单独或组合的抗体轻链可变区或抗体重链可变区。重链可变区或轻链可变区通常是由以三个互补决定区(cdr)连接的四个架构区 (fr)所组成,亦称为〝超级可变区〞。在各链中的cdr 是由架构区以紧密邻接的方式固定在一起且与来自其他链的cdr一起促成抗体的抗原结合部位的形成。有至少两种用于测定cdr的技术:(1)基于跨物种序列变异性的方法(亦即kabat等人的1991,sequences of proteins ofimmunological interest,5th edition,national institutes ofhealth,bethesda md.),及(2)基于抗原-抗体复合物的结晶学研究的方法(al lazikani等人的1997,j.mol.biol., 273:927-948)。另外,在本技术领域中有时使用该两种方法的组合来测定cdr。
83.如本文所使用的术语〝单克隆抗体〞是指涉及其高度特异性辨识及结合单一抗原决定子或抗原决定区的同源性抗体群。这与多克隆抗体相反,多克隆抗体通常包括辨识不同的抗原决定子的不同的抗体的混合物。术语〝单克隆抗体〞包含完整及全长单克隆抗体二者,以及抗体片段(例如fab、fab'、f(ab')2、fv)、单链(scfv)抗体、包含抗体片段的融合蛋白及任何其他包含抗原结合部位的经修饰的免疫球蛋白分子。此外,〝单克隆抗体〞是指由任何多种技术所制成的此等抗体,包括但不限于融合瘤生产、噬菌体选择、重组表达和基因转殖动物。
84.如本文所使用的术语〝人源化抗体〞是指含有最少的非人类序列的特异性免疫球蛋白链、嵌合性免疫球蛋白或其片段的抗体。人源化抗体通常为其中cdr的氨基酸残基以来自具有所期望的特异性、亲和性及/或结合能力的非人类物种(例如小鼠、大鼠、兔子或仓鼠)的 cdr的氨基酸残基取代的人类免疫球蛋白。在一些情况中,人类免疫球蛋白的架构可变区氨基酸残基可以来自非人类物种的抗体中的对应氨基酸残基取代。人源化抗体可藉由取代在架构可变区及/或经取代的非人类氨基酸残基内的额外氨基酸残基而进一步修饰,
以进一步改进及最优化抗体特异性、亲和性及/或结合能力。人源化抗体可包含可变结构域,其含有所有或实质上所有对应于非人类免疫球蛋白的cdr,而所有或实质上所有的架构可变区为那些人类免疫球蛋白序列的架构区可变区。在一些实施方案中,可变结构域包含人类免疫球蛋白序列的架构区。在一些实施方案中,可变结构域包含人类免疫球蛋白共有序列的架构区。人源化抗体亦可包含至少一部分的免疫球蛋白恒定区或结构域(fc),通常为至少一部分的人类免疫球蛋白。
85.如本文所使用的术语〝人类抗体〞是指由人类所生产的抗体或使用本技术中已知的技术中的任一者所制得的具有对应于由人类所生产的抗体的氨基酸序列的抗体。
86.如本文所使用的术语〝嵌合抗体〞是指其中免疫球蛋白分子的氨基酸序列是衍生自二或更多物种的抗体。轻链可变区和重链可变区通常对应于自一种哺乳动物物种(例如小鼠、大鼠、兔子等等)所衍生的具有所期望的特异性、亲和性及/或结合能力的抗体的可变区,而恒定区是与自另一物种所衍生的抗体的序列为同源性。恒定区通常为人类,以避免在抗体中诱出免疫反应。
87.术语〝抗原决定区〞与〝抗原决定子〞在本文可交换使用,且是指能够以特别的抗体辨识且特异性结合的抗原或标靶部分。当抗原或标靶为多肽时,则抗原决定区可自连续氨基酸及自以蛋白质三级折叠并列的非连续氨基酸二者形成。自连续氨基酸所形成的抗原决定区(亦称线性抗原决定区)通常在蛋白质变性时仍被保留,而三级折叠所形成的抗原决定区(亦称为构象抗原决定区)通常在蛋白质变性时失去。抗原决定区通常包括至少3个氨基酸,且更常为至少5、6、7或8-10个氨基酸于独特的空间构象中。
88.术语〝选择性结合〞或〝特异性结合〞意指剂对抗原决定区、蛋白质或标靶分子比与替代物质(包括相关和不相关蛋白质)更频繁、更快速、具有更长持续期间、具有更高亲和性或与以上文的某些组合交互作用。在特定的实施方案中,〝特异性结合〞意指例如该剂以约 0.1mm或更小,但是更经常以小于约1μm的kd与蛋白质或标靶结合。在特定的实施方案中,〝特异性结合〞意指该剂以至少约0.1μm或更小,至少约0.01μm或更小,或至少约1nm或更小的kd与标靶结合。因为在不同物种中的同源性蛋白质之间的序列一致性,所以特异性结合可包括辨识在超过一种以上的物种中的蛋白质或标靶的剂(例如小鼠tigit和人类tigit)。同样地,因为在不同的蛋白质的多肽序列的特定区域内的同源性,所以特异性结合可包括辨识超过一种以上的蛋白质或标靶的剂。应了解在特定的实施方案中,特异性结合第一标靶的剂可以或不可以特异性结合第二标靶。确切而言,〝特异性结合〞不一定需要(虽然可包括)排他性结合,亦即与单一标靶结合。因此,在特定的实施方案中,该剂特异性结合超过一种以上的标靶。在特定的实施方案中,多重标靶可以相同的抗原结合部位与剂结合。例如,抗体可在特定的情况下包含两个相同的抗原结合部位,每一个特异性结合二或更多个蛋白质的相同的抗原决定区。在特定的可替代实施方案中,抗体可为双特异性且包含至少两个具有不同的特异性的抗原结合部位。述及的结合通常(但不必然)意指特异性结合。
89.术语〝多肽〞和〝肽〞和〝蛋白质〞可于本文交换使用且是指任何长度的氨基酸的聚合物。聚合物可为线性或分支,其可包含经修饰的氨基酸,且其可经非氨基酸中断。这些术语亦包含经天然或干预修饰的氨基酸聚合物;例如双硫键形成、糖化、脂化、乙酰化、磷酸化或任何其他操控或修饰,诸如与标记的成分共轭。该定义亦包括例如含有一或多个氨基酸类似物(包括例如非天然氨基酸)以及本技术中已知的其他修饰物的多肽。应了解因为本发
明的多肽可基于抗体或免疫球蛋白超级家族的其他成员,所以在特定的实施方案中,〝多肽〞可以单链或二或更多个缔合链出现。
90.术语〝多核苷酸〞和〝核酸〞和〝核酸分子〞可于本文交换使用且是指任何长度的核苷酸的聚合物,且包括dna和rna。核苷酸可为脱氧核糖核苷酸、核糖核苷酸、经修饰的核苷酸或碱及/或其类似物,或任何可藉由dna或rna聚合酶并入聚合物中的任何底物。
91.在述及的二或更多个核酸或多肽中,术语〝一致〞或〝一致性〞百分比是指当比较及比对(若必要时导入间隔)二或更多个序列或子序列以达最高对应性,不考虑任何保守性氨基酸取代为序列一致性的一部分时,该二或更多个序列或子序列为相同的或具有相同的特定百分比的核苷酸或氨基酸残基。一致性百分比可使用序列比较软件或算法测量,或以目视检查测量。可用于获得氨基酸或核苷酸序列比对的各算法及软件为本技术中所熟知。这些包括但不限于blast、align、megalign、bestfit、 gcg wisconsin软件包及其变化产品。在一些实施方案中,本发明的两个核酸或多肽实质上一致,当比较及比对以达最高对应性时,如使用序列比较算法或目视检查所测量,那些具有至少70%,至少75%,至少80%,至少 85%,至少90%,且在一些实施方案中至少95%,96%,97%,98%,99%的核苷酸或氨基酸残基一致性。在一些实施方案中,一致性存在于至少约10,至少约20,至少约40-60个核苷酸或氨基酸残基,至少约60-80个核苷酸或氨基酸残基长度或介于之间的任何整数值的序列区域内。在一些实施方案中,一致性存在于比60-80个核苷酸或氨基酸残基更长的区域内,诸如至少约80-100个核苷酸或氨基酸残基,且在一些实施方案中,序列实质上与比较的全长序列一致,诸如核苷酸序列的编码区域。
92.〝保守性氨基酸取代〞为其中一个氨基酸残基经具有类似侧链的另一氨基酸残基取代的取代。具有类似侧链的氨基酸残基家族已于本技术中概括定义,包括碱性侧链(例如离氨酸、精氨酸、组氨酸)、酸性侧链(例如天冬氨酸、麸氨酸)、不带电的极性侧链(例如甘氨酸、天冬酰氨酸、麸酰氨酸、丝氨酸、苏氨酸、酪氨酸、半胱氨酸)、非极性侧链(例如丙氨酸、缬氨酸、白氨酸、异白氨酸、脯氨酸、苯基丙氨酸、甲硫氨酸、色氨酸)、β-分支侧链(例如苏氨酸、缬氨酸、异白氨酸)及芳族侧链(例如酪氨酸、苯基丙氨酸、色氨酸、组氨酸)。例如,以苯基丙氨酸取代酪氨酸被视为保守性取代。在本发明的多肽及/ 或抗体的序列中的保守性取代通常不废除含有氨基酸序列的多肽或抗体结合至标靶结合部位。鉴别不消除结合的核苷酸及氨基酸保守性取代的方法为本技艺中所熟知。
93.如本文所使用的术语〝载体〞意指建构体,其能够在宿主细胞中递送及经常表达一或多个关注的基因或序列。载体的实例包括但不限于病毒载体、裸dna或 rna表达载体、质粒载体、黏粒载体、噬菌体载体、与阳离子缩合剂缔合的dna或rna表达载体,及包封在脂质体中的dna或rna表达载体。
94.经〝分离〞的多肽、可溶性蛋白质、抗体、多核苷酸、载体、细胞或组合物为呈未于自然中发现的形式的多肽、可溶性蛋白质、抗体、多核苷酸、载体、细胞或组合物。经分离的多肽、可溶性蛋白质、抗体、多核苷酸、载体、细胞或组合物包括那些经纯化至使那些不再呈于自然中发现的形式的程度者。在一些实施方案中,经纯化的多肽、可溶性蛋白质、抗体、多核苷酸、载体、细胞或组合物为实质上纯的。
95.如本文所使用的术语〝实质上纯的〞是指为至少50%纯的(亦即不含污染物),至少90%纯的,至少 95%纯的,至少98%纯的或至少99%纯的材料。
96.如本文所使用的术语〝免疫反应〞包括来自先天免疫系统及后天免疫系统二者的反应。其包括细胞介导及/或体液的免疫反应二者。其包括但不限于t细胞及 b细胞反应,以及来自免疫系统的其他细胞的反应,诸如自然杀手(nk)细胞、单核球、巨噬细胞等等。
97.如本文所使用的术语〝癌〞和〝癌性〞是指或说明哺乳动物的生理病况,其中细胞群是以不受调节的细胞生长为特征。癌的实例包括但不限于癌(carcinoma)、胚细胞瘤、肉瘤和血液性癌症,诸如淋巴瘤和白血病。
98.如本文所使用的术语〝肿瘤〞和〝赘瘤〞是指任何由过度细胞生长或增生所导致的任何组织团块,其为包括癌前病灶的良性(非癌性)或恶性(癌性)。
99.如本文所使用的术语〝转移〞是指癌症藉此自起源位置扩散或转变至身体的其他区域,在新部位发展类似的癌性病灶的过程。〝转移的(metastatic)或转移 (metastasizing)〞细胞为与邻接的细胞丧失黏着接触且自疾病的原发部位经由血流或淋巴移动至全身的继发部位的细胞。
100.术语〝癌干细胞〞和〝csc〞和〝肿瘤干细胞〞和〝肿瘤初始细胞〞在本文可交换使用且是指来自癌或肿瘤的细胞,其:(1)具有扩大的增生能力;(2)能够进行不对称的细胞分裂以产生一或多种类型的经分化的细胞后代,其中经分化的细胞具有降低的增生或发育潜力,及 (3)能够进行对称的细胞分裂以自我更新或自我维持。与无法形成肿瘤的大部分肿瘤细胞相比,这些性质赋予癌干细胞在连续移植至适当的宿主(例如小鼠)时能够形成或建立肿瘤或癌的能力。癌干细胞是以混乱方式进行相对于分化的自我更新,以形成具有异常的细胞类型的肿瘤,该细胞类型可在突变发生时而随时间改变。
101.术语〝癌细胞〞和〝肿瘤细胞〞是指源自癌或肿瘤或癌前病灶的整体细胞族群,包括非致瘤细胞(其包含大部分的癌细胞群)及致瘤干细胞(癌干细胞)二者。如本文所使用的术语〝癌细胞〞或〝肿瘤细胞〞在仅用于指称这些缺乏更新及分化能力的细胞时以术语〝非致瘤〞修饰,以区别这些肿瘤细胞与癌干细胞。
102.如本文所使用的术语〝致瘤(tumorigenic)〞是指癌干细胞的功能特性,包括自我更新(引起额外的致瘤干细胞)及增生的特性,以产生所有其他的肿瘤细胞(引起经分化及因此非致瘤肿瘤细胞)。
103.如本文所使用的术语〝致瘤性(tumorigenicity )〞是指来自肿瘤的随机细胞样品在连续移植至适当的宿主(例如小鼠)中时形成明显的肿瘤的能力。
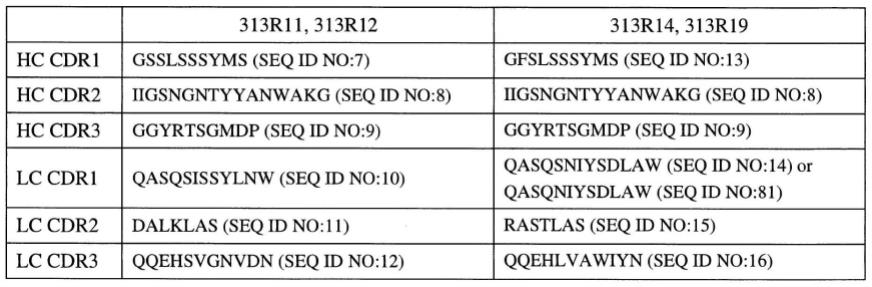
104.术语〝受试者〞是指成为特定治疗的接受者的任何动物(例如哺乳动物),包括但不限于人类、非人灵长类动物、犬、猫、兔子、啮齿动物及类似者。关于人类受试者的术语〝受试者〞及〝患者〞通常在本文可交换使用。
105.术语〝医药上可接受的〞是指经联邦或州政府的管理局核准或可核准或经美国药典或其他普遍公认的药典中用于动物(包括人类)而列示的材料。
106.术语〝医药上可接受的赋形剂、载剂或佐剂〞或〝可接受的医药载剂〞是指可与本发明的至少一种剂一起施用受试者的赋形剂、载剂或佐剂,且其不破坏本发明的剂的药理活性及在以足以递送治疗效应的剂量施用时没有毒性。那些熟习本技术领域者及美国fda通常认为医药上可接受的赋形剂、载剂或佐剂为任何调配物的无活性成分。
107.术语〝有效量〞或〝治疗有效量〞或〝治疗效应〞是指本文所述的剂、抗体、多肽、多核苷酸、小有机分子或有效〝治疗〞受试者(诸如哺乳动物)中的疾病或病症的其他药物的量。
在癌或肿瘤的例子中,剂(例如多肽或抗体)的治疗有效量具有治疗效应且因此可增强或激励免疫反应、增强或激励抗肿瘤反应、增强免疫细胞的溶胞活性、增强杀死肿瘤细胞、增加以免疫细胞杀死肿瘤细胞、减少肿瘤细胞数目、降低致瘤性、降低致瘤频率或降低肿瘤发生能力、减少癌干细胞数目或频率、减少肿瘤大小、减少癌细胞群、抑制或停止癌细胞浸润至外围器官中,包括例如癌扩散至软组织和骨中、抑制且停止肿瘤或癌细胞转移、抑制且停止肿瘤或癌细胞生长、缓解一或多种与癌相关的症状至某种程度、降低发病率和死亡率、改进生活质量、或此等效应的组合。
108.术语〝治疗(treating或treatment或totreat)〞或〝缓和(alleviating或to alleviate)〞是指下列二者:(1)治疗性措施,其治愈、减缓、减轻经诊断的病理状况或病症症状,及/或终止经诊断的病理状况或病症的进展,及(2)预防性(prophylactic或preventative)措施,其预防或减缓靶定的病理状况或病症的发展。因此,那些需要治疗者包括那些已患有病症者、那些易患有病症者及那些期望预防其病症者。在癌或肿瘤的例子中,若患者显示下列中的一或多者,则根据本发明的方法成功地〝治疗〞受试者:增加免疫反应、增加抗肿瘤反应、增加免疫细胞的溶胞活性、增加杀死肿瘤细胞、增加以免疫细胞杀死肿瘤细胞、减少或完全没有癌细胞数目、减少肿瘤大小、抑制或没有癌细胞浸润至外围器官中,包括癌扩散至软组织和骨中、抑制或没有肿瘤或癌细胞转移、抑制或没有癌生长、缓解一或多种与特定的癌相关的症状、降低发病率和死亡率、改进生活质量、降低致瘤性、减少癌干细胞数目或频率、或此等效应的组合。
109.如本发明及申请专利范围中所使用的单数形式一(〝a〞、〝an〞)和该(〝the〞)包括复数形式,除非上下文另外清楚地说明。
110.应了解无论何时以文字〝包含〞说明实施方案时,亦提供以〝由...组成〞及/或〝实质上由...组成〞的术语所说明的其他方面类似的实施方案。亦应了解无论何时以文字〝实质上由...组成〞说明实施方案时,亦提供以〝由...组成〞的术语所说明的其他方面类似的实施方案。
111.如本文所使用述及的〝约(about或 approximately)〞某数值或参数包括(且说明)针对该数值或参数的实施方案。例如,述及〝约x〞的说明包括〝x〞的说明。
112.如本文于词句中所使用的术语〝及/或〞(诸如〝a及/或b〞)意欲包括a和b二者;a或b;a(单独);及b(单独)。同样地,如词句中所使用的术语〝及/ 或〞(诸如〝a、b及/或c〞)意欲包含下列实施方案中的每一个:a、b和c;a、b或c;a或c;a或b;b或c;a和c;a和b;b和c;a(单独);b(单独);及c (单独)。ii.tigit结合剂
113.具有ig及itim结构域(tigit)的t细胞免疫受体为含有免疫球蛋白可变(igv)结构域的第i型跨膜糖蛋白。tigit属于脊髓灰白质病毒受体(pvr)家族且与脊髓灰白质病毒受体(pvr;cd155)以高亲和性结合及与 pvrl-2(cd112)和pvrl-3(cd113)以低亲和性结合。 tigit表达在t细胞上,包括调节性t细胞和记忆性t细胞,以及表达在nk细胞上且在原生cd4 t细胞活化之后向上调节。小鼠tigit(uniprotkb no.p86176)及人类 tigit(uniprotkb no.q495a1)的全长氨基酸(aa)序列为本技术中已知且在本文分别以seq id no:1及seq idno:4提供。如本文所使用的述及的氨基酸位置是指全长氨基酸序列(包括信号序列)的编号。
114.本发明提供特异性结合tigit的剂。该剂在本文称为〝tigit结合剂〞。在一些实施方案中,tigit 结合剂为抗体。在一些实施方案中,tigit结合剂为多肽。在特定的实施方案中,tigit结合剂结合小鼠 tigit。在特定的实施方案中,tigit结合剂结合人类 tigit。在特定的实施方案中,tigit结合剂结合小鼠 tigit及人类tigit。在一些实施方案中,tigit结合剂结合人类tigit及不结合小鼠tigit。
115.在一些实施方案中,该剂结合tigit且干扰 tigit与第二蛋白质的交互作用。在一些实施方案中,该剂结合tigit且干扰tigit与pvr的交互作用。在一些实施方案中,该剂结合tigit且干扰tigit与pvrl-2的交互作用。在一些实施方案中,该剂结合tigit且干扰 tigit与pvrl-3的交互作用。在一些实施方案中,该剂特异性结合tigit且该剂阻扰tigit与pvr结合及/或阻扰tigit传导信号的pvr活化。
116.在特定的实施方案中,tigit结合剂为特异性结合tigit的细胞外结构域的抗体或其片段。在特定的实施方案中,tigit结合剂为特异性结合小鼠tigit的细胞外结构域的抗体或其片段。在特定的实施方案中,tigit 结合剂为特异性结合人类tigit的细胞外结构域的抗体或其片段。在特定的实施方案中,tigit结合剂为特异性结合小鼠tigit及人类tigit的细胞外结构域的抗体或其片段。在一些实施方案中,tigit结合剂为特异性结合 tigit的似ig结构域的抗体。在一些实施方案中,tigit 结合剂为特异性结合tigit的igv结构域的抗体。在一些实施方案中,tigit结合剂为在人类tigit的氨基酸22
‑ꢀ
141及/或小鼠tigit氨基酸29-148内结合的抗体。在一些实施方案中,tigit剂为在seq id no:4的氨基酸 22-141及/或seq id no:1的氨基酸29-148内结合的抗体。在一些实施方案中,该剂为在人类tigit的氨基酸 22-124及/或小鼠tigit氨基酸29-127内结合的抗体。在一些实施方案中,该剂是在seq id no:4的氨基酸22
‑ꢀ
124及/或seq id no:1的氨基酸29-127内结合。在特定的实施方案中,tigit剂是在seq id no:3或其片段内结合。在特定的实施方案中,tigit剂是在seq idno:6或其片段内结合。在一些实施方案中,tigit剂为在人类tigit的氨基酸22-141内结合的抗体。在一些实施方案中,tigit剂为在seq id no:4的氨基酸22-141 内结合的抗体。在一些实施方案中,tigit剂为在人类 tigit的氨基酸50-124内结合的抗体。在一些实施方案中,tigit剂为在seq id no:4的氨基酸50-124内结合的抗体。在特定的实施方案中,tigit结合剂是在seqid no:6或其片段内结合。
117.在一些实施方案中,tigit结合剂为结合抗原决定区的抗体,该抗原决定区包含在seq id no:79内的氨基酸。在一些实施方案中,tigit结合剂为结合抗原决定区的抗体,该抗原决定区包含在seq id no:80内的氨基酸。在一些实施方案中,tigit结合剂为结合抗原决定区的抗体,该抗原决定区包含在seq id no:79及 seq id no:80内的氨基酸。在一些实施方案中,tigit 结合剂为结合抗原决定区的抗体,该抗原决定区包含seqid no:4的氨基酸q62和i109。在一些实施方案中, tigit结合剂为结合抗原决定区的抗体,该抗原决定区包含seq id no:4的氨基酸q62和t119。在一些实施方案中,tigit结合剂为结合抗原决定区的抗体,该抗原决定区包含seq id no:4的氨基酸q64和i109。在一些实施方案中,tigit结合剂为结合抗原决定区的抗体,该抗原决定区包含seq id no:4的氨基酸q64和t119。在一些实施方案中,tigit结合剂为结合抗原决定区的抗体,该抗原决定区包含seq id no:4的氨基酸q62、 q64和i109。在一些实施方案中,tigit结合剂为结合抗原决定区的抗体,该抗原决定区包含seq id no:4的氨基酸q62、q64和t119。在一些实施方案中,tigit结合剂为结
合抗原决定区的抗体,该抗原决定区包含seq idno:4的氨基酸q62、i109和t119。在一些实施方案中,tigit结合剂为结合抗原决定区的抗体,该抗原决定区包含seq id no:4的氨基酸q64、i109和t119。在一些实施方案中,tigit结合剂为结合抗原决定区的抗体,该抗原决定区包含seq id no:4的氨基酸q62、q64、 i109和t119。在一些实施方案中,tigit结合剂为结合抗原决定区的抗体,该抗原决定区包含至少一种选自由下列所组成的群组:seq id no:4的氨基酸n58、e60、 q62、q64、l65、f107、i109、h111、t117、t119、 g120和r121。在一些实施方案中,抗原决定区为构象抗原决定区。在一些实施方案中,tigit结合剂为结合抗原决定区的抗体,该抗原决定区不包含seq id no:4的氨基酸v100。
118.在特定的实施方案中,tigit结合剂(例如抗体)是以约1μm或更小,约100nm或更小,约40nm或更小,约20nm或更小,约10nm或更小,约1nm或更小,约0.1nm或更小,50pm或更小,10pm或更小或1pm或更小的离解常数(kd)结合tigit。在一些实施方案中, tigit结合剂是以约20nm或更小的kd结合tigit。在一些实施方案中,tigit结合剂是以约10nm或更小的kd结合tigit。在一些实施方案中,tigit结合剂是以约 1nm或更小的kd结合tigit。在一些实施方案中,tigit 结合剂是以约0.5nm或更小的kd结合tigit。在一些实施方案中,tigit结合剂是以约0.1nm或更小的kd结合 tigit。在一些实施方案中,tigit结合剂是以约50pm 或更小的kd结合tigit。在一些实施方案中,tigit结合剂是以约25pm或更小的kd结合tigit。在一些实施方案中,tigit结合剂是以约10pm或更小的kd结合 tigit。在一些实施方案中,tigit结合剂是以约1pm或更小的kd结合tigit。在一些实施方案中,tigit结合剂是以约10nm或更小的kd结合人类tigit及小鼠 tigit二者。在一些实施方案中,tigit结合剂是以约 1nm或更小的kd结合人类tigit及小鼠tigit二者。在一些实施方案中,tigit结合剂是以约0.1nm或更小的 kd结合人类tigit及小鼠tigit二者。在一些实施方案中,结合剂(例如抗体)对tigit的离解常数是使用固定在 biacore芯片上的包含tigit蛋白质的至少一部分的细胞外结构域的tigit融合蛋白测定的离解常数。在一些实施方案中,结合剂(例如抗体)对tigit的离解常数是使用在biacore芯片上以抗人类igg抗体及可溶性tigit蛋白质所捕获的结合剂测定的离解常数。
119.在一些实施方案中,tigit结合剂包含特异性结合tigit的第一抗原结合部位及特异性结合第二标靶的第二抗原结合部位。在一些实施方案中,tigit结合剂为包含特异性结合tigit的第一抗原结合部位及特异性结合第二标靶的第二抗原结合部位的双特异性剂。在一些实施方案中,tigit结合剂是以约100nm或更小的kd结合 tigit及第二标靶二者。在一些实施方案中,tigit结合剂是以约50nm或更小的kd结合tigit及第二标靶二者。在一些实施方案中,tigit结合剂是以约20nm或更小的kd结合tigit及第二标靶二者。在一些实施方案中,tigit结合剂是以约10nm或更小的kd结合tigit 及第二标靶二者。在一些实施方案中,tigit结合剂是以约1nm或更小的kd结合tigit及第二标靶二者。在一些实施方案中,抗原结合部位中的一者的亲和性比其他的抗原结合部位的亲和性更弱。例如,一个抗原结合部位的 kd可为约1nm及第二抗原结合部位的kd可为约10nm。在一些实施方案中,在两个抗原结合部位之间的亲和性差别可为约2倍或更大,约3倍或更大,约5倍或更大,约 8倍或更大,约10倍或更大,约15倍或更大,约20倍或更大,约30倍或更大,约50倍或更大或约100倍或更大。两个抗原结合部位的亲和性调节可影响双特异性抗体的生物活性。例如,降低对tigit或第二标靶的抗原结合部位的亲和性可具有所期望的效应,例如降低结合剂毒性及/或增
加治疗指数。
120.在特定的实施方案中,tigit结合剂(例如抗体)是以约1μm或更低,约100nm或更低,约40nm或更低,约20nm或更低,约10nm或更低,约1nm或更低或约0.1nm或更低的一半最大有效浓度(ec
50
)结合tigit。在特定的实施方案中,tigit结合剂是以约1μm或更低,约100nm或更低,约40nm或更低,约20nm或更低,约 10nm或更低,约1nm或更低或约0.1nm或更低的一半最大有效浓度(ec
50
)结合人类tigit。在特定的实施方案中,tigit结合剂是以约40nm或更低,约20nm或更低,约10nm或更低,约1nm或更低或约0.1nm或更低的ec
50
结合小鼠tigit及/或人类tigit。
121.在特定的实施方案中,tigit结合剂为抗体。在一些实施方案中,抗体为重组抗体。在一些实施方案中,抗体为单克隆抗体。在一些实施方案中,抗体为嵌合抗体。在一些实施方案中,抗体为人源化抗体。在一些实施方案中,抗体为人类抗体。在一些实施方案中,抗体为 iga、igd、ige、igg或igm抗体。在特定的实施方案中,抗体为igg1抗体。在特定的实施方案中,抗体为 igg2抗体。在一些实施方案中,抗体为igg4抗体。在特定的实施方案中,抗体为包含抗原结合部位的抗体片段。在一些实施方案中,抗体为双特异性抗体或多特异性抗体。在一些实施方案中,抗体为单价抗体。在一些实施方案中,抗体为单特异性抗体。在一些实施方案中,抗体为双价抗体。在一些实施方案中,抗体是与细胞毒性部分共轭。在一些实施方案中,将抗体分离。在一些实施方案中,抗体为实质上纯的。
122.在一些实施方案中,tigit结合剂为多克隆抗体。多克隆抗体可以任何已知的方法制备。在一些实施方案中,多克隆抗体是藉由以关注的抗原(例如纯化的肽片段、全长重组蛋白或融合蛋白)使用多次皮下或腹膜内注射使动物免疫(例如兔、大鼠、小鼠、山羊、驴)而制得。抗原可随意地与载剂共轭,诸如钥孔状帽贝血蓝素(klh) 或血清白蛋白。抗原(具有或不具有载剂蛋白质)是在无菌盐水中稀释且通常与佐剂(例如完全或不完全弗氏 (freund’s)佐剂)组合以形成稳定的乳液。在充足的时期之后,自经免疫的动物(通常自血液或腹水)回收多克隆抗体。多克隆抗体可根据本技术中的标准方法自血清或腹水纯化,这些方法包括但不限于亲和性层析术、离子交换层析术、胶体电泳和透析。
123.在一些实施方案中,tigit结合剂为单克隆抗体。单克隆抗体可使用本技术中已知的融合瘤方法制备。在一些实施方案中,将小鼠、大鼠、兔子、仓鼠或其他适当的宿主动物使用融合瘤方法如上述免疫,以引诱生产特异性结合免疫抗原的抗体。在一些实施方案中,可将淋巴细胞于试管内免疫。在一些实施方案中,免疫抗原可为人类蛋白质或其片段。在一些实施方案中,免疫抗原可为小鼠蛋白质或其片段。
124.在免疫之后,将淋巴细胞分离且使用例如聚乙二醇与适合的骨髓瘤细胞系融合。融合瘤细胞系使用本技术中已知的专用培养基挑选且未融合的淋巴细胞及骨髓瘤细胞在挑选过程不会存活。生产尤其针对挑选的抗原的单克隆抗体的融合瘤可以多种方法鉴别,包括但不限于免疫沉淀、免疫转渍和试管内结合检定法(例如流动式细胞测量术、facs、elisa和放射性免疫检定法)。融合瘤可使用标准方法于试管内培养而繁殖或于动物活体内繁殖成腹水肿瘤。单克隆抗体可根据本技术中的标准方法自培养基或腹水液体纯化,这些方法包括但不限于亲和性层析术、离子交换层析术、胶体电泳和透析。
125.在特定的实施方案中,单克隆抗体可使用熟习本技术领域者已知的重组dna技术制得。编码单克隆抗体的多核苷酸是自成熟b细胞或融合瘤细胞分离,诸如藉由使用特异性
扩增编码抗体重链及轻链的基因的寡核苷酸引子的rt-pcr,且多核苷酸序列是使用标准技术测定。接着将经分离的编码重链及轻链的多核苷酸克隆至适合的表达载体中,其在转染至不以另外方式生产免疫球蛋白的宿主细胞时(诸如大肠杆菌、类人猿cos细胞、中国仓鼠卵巢(cho)细胞或骨髓瘤细胞)生产单克隆抗体。
126.在特定的其他实施方案中,重组单克隆抗体或其片段可自表达所期望的物种的可变结构域或cdr的噬菌体展示库分离。
127.编码单克隆抗体的多核苷酸可藉由例如使用重组dna技术来修饰,以产生替代抗体。在一些实施方案中,例如小鼠单克隆抗体的轻链及重链恒定结构域可经例如人类抗体的恒定区取代以产生嵌合抗体,或经非免疫球蛋白多肽取代以产生融合抗体。在一些实施方案中,将恒定区截短或移除以产生所期望的单克隆抗体的抗体片段。可变区的部位引导的突变形成或高密度突变形成可用于使单克隆抗体的特异性、亲和性等等最优化。
128.在一些实施方案中,tigit结合剂为人源化抗体。人源化抗体通常为人类免疫球蛋白,其中cdr的氨基酸残基是使用熟习本技术领域者已知的方法以来自非人类物种(例如小鼠、大鼠、兔子、仓鼠等等)的具有所期望的特异性、亲和性及/或结合能力的cdr的氨基酸残基取代。在一些实施方案中,人类免疫球蛋白的一些架构可变区氨基酸残基是以非人类物种的抗体中的对应氨基酸残基取代。在一些实施方案中,人源化抗体可藉由取代架构可变区及/或经取代的非人类残基内的额外残基而进一步修饰,以进一步改进及最优化抗体特异性、亲和性及/或能力。人源化抗体通常包含可变结构域,其含有所有或实质上所有对应于非人类免疫球蛋白的cdr,而所有或实质上所有的架构可变区为那些人类免疫球蛋白序列的架构区。在一些实施方案中,架构区为人类免疫球蛋白共有序列的架构区。在一些实施方案中,人源化抗体亦可包含至少一部分的免疫球蛋白恒定区或结构域(fc),通常为至少一部分的人类免疫球蛋白。在特定的实施方案中,此等人源化抗体是用于治疗,因为那些在施用人类受试者时可降低抗原性及hama(人类抗小鼠抗体)反应。
129.在特定的实施方案中,tigit结合剂为人类抗体。人类抗体可使用本技术中已知的各种技术直接制备。在一些实施方案中,人类抗体可自试管内免疫的不朽人类 b淋巴细胞或自免疫受试者分离的淋巴细胞产生。在任一例子中,可产生且分离用于生产针对标靶抗原的抗体的细胞。在一些实施方案中,人类抗体可选自噬菌体库,其中噬菌体库表达人类抗体。另一选择地,噬菌体展示技术可用于自未免疫的给予体的免疫球蛋白可变结构域基因谱系 (gene repertoire)于试管内生产人类抗体及抗体片段。用于产生及使用抗体噬菌体库的技术为本技术中所熟知。一经鉴别出抗体,则可使用本技术中已知的亲和性成熟策略来产生较高的亲和性人类抗体,包括但不限于链替换(chainshuffling)及部位引导的突变形成。
130.在一些实施方案中,人类抗体可于含有人类免疫球蛋白基因座的基因转殖小鼠中制得。一经免疫时,这些小鼠能够生产人类抗体的全谱系,而不生产内源性免疫球蛋白。
131.在一些实施方案中,tigit结合剂为双特异性抗体。因此,本发明包含特异性辨识tigit及至少一种额外标靶的双特异性抗体。双特异性抗体能够特异性辨识及结合至少两种不同的抗原或抗原决定区。不同的抗原决定区可在相同的分子内(例如两个抗原决定区在tigit上)或在不同的分子上(例如一个抗原决定区在tigit上及一个抗原决定区在不同的蛋白质上)。在一些实施方案中,与个别抗体或一种以上的抗体的组合相比,双特异性抗
体具有增强的效力。在一些实施方案中,与个别抗体或一种以上的抗体的组合相比,双特异性抗体具有降低的毒性。那些熟习本技术领域者已知任何治疗剂可具有独特的药物动力学(pk)(例如循环半衰期)。在一些实施方案中,双特异性抗体具有使两种活性结合剂的pk同步的能力,其中两种个别的结合剂具有不同的pk分布。在一些实施方案中,双特异性抗体具有使两种剂的作用集中在相同区域中 (例如肿瘤及/或肿瘤微环境)的能力。在一些实施方案中,双特异性抗体具有使两种剂的作用集中在相同标靶(例如肿瘤或肿瘤细胞)的能力。在一些实施方案中,双特异性抗体具有使两种剂的作用靶定至一种以上的生物途径或功能的能力。在一些实施方案中,双特异性抗体具有靶定两种不同的细胞且使那些更紧密在一起(例如免疫细胞及肿瘤细胞)的能力。
132.在一些实施方案中,双特异性抗体为单克隆抗体。在一些实施方案中,双特异性抗体为人源化抗体。在一些实施方案中,双特异性抗体为人类抗体。在一些实施方案中,双特异性抗体为igg1抗体。在一些实施方案中,双特异性抗体为igg2抗体。在一些实施方案中,双特异性抗体为igg4抗体。在一些实施方案中,双特异性抗体具有降低的毒性及/或副作用。在一些实施方案中,与两种个别抗体的混合物或成为单一剂的抗体相比,双特异性抗体具有降低的毒性及/或副作用。在一些实施方案中,双特异性抗体具有增加的治疗指数。在一些实施方案中,与两种个别抗体的混合物或成为单一剂的抗体相比,双特异性抗体具有增加的治疗指数。
133.在一些实施方案中,抗体可特异性辨识及结合第一抗原标靶(例如tigit)以及第二抗原标靶,诸如在免疫细胞上的效应子分子(例如cd2、cd3、cd28、 ctla4、pd-1、pd-l1、cd80或cd86)或fc受体(例如 cd64、cd32或cd16),以便使细胞防御机制聚集在表达及/或生产第一抗原标靶的细胞。在一些实施方案中,抗体可用于引导胞毒剂至表达特别的标靶抗原的细胞。这些抗体具有抗原结合臂及结合胞毒剂或放射性核素螯合剂 (诸如eotube、dpta、dota或teta)的臂。
134.用于制备双特异性抗体的技术为那些熟习本技术领域者已知。在一些实施方案中,双特异性抗体包含具有氨基酸修饰的重链恒定区,该氨基酸为两个重链之间的接口的一部分。在一些实施方案中,双特异性抗体可使用〝突起进入孔中〞策略产生。在一些例子中,将术语〝突起〞和〝孔〞以术语〝隆凸〞和〝腔室〞取代。在一些实施方案中,双特异性抗体可包含不能够在重链之间形成双硫键联的可变绞链区。在一些实施方案中,修饰可包含导致静电交互作用改变的氨基酸变化。在一些实施方案中,修饰可包含导致疏水性/亲水性交互作用改变的氨基酸变化。
135.双特异性抗体可为包含抗原结合部位的完整抗体或抗体片段。亦预期具有超过两价的抗体。例如,可制备三特异性抗体。因此,在特定的实施方案中,对 tigit的抗体具有多特异性。
136.在特定的实施方案中,本文所述的抗体(或其他的多肽)可为单特异性。在特定的实施方案中,抗体含有的一或多个抗原结合部位中的每一个能够结合 (binding)(或结合(bind))tigit的同源性抗原决定区。
137.在特定的实施方案中,tigit结合剂为抗体片段。抗体片段可具有与完整抗体不同的功能或能力;例如抗体片段可具有增加的肿瘤穿透。已知用于生产抗体片段的各种技术,包括但不限于完整抗体的蛋白水解消化。在一些实施方案中,抗体片段包括由胃蛋白酶消
化抗体分子所生产的f(ab')2片段。在一些实施方案中,抗体片段包括藉由还原f(ab')2片段的双硫桥所产生的fab片段。在其他的实施方案中,抗体片段包括藉由以木瓜酶及还原剂处理抗体分子所产生的fab片段。在特定的实施方案中,抗体片段是以重组方法生产。在一些实施方案中,抗体片段包括fv或单链fv(scfv)片段。fab、fv及scfv抗体片段可表达在大肠杆菌或其他的宿主细胞中且自大肠杆菌或其他的宿主细胞分泌,容许大量生产这些片段。在一些实施方案中,抗体片段是自抗体噬菌体库分离,如本文所讨论。例如,可使用方法建构fab表达库,容许快速且有效的鉴别对tigit或其衍生物、片段、类似物或同源物具有所期望的特异性的单克隆fab片段。在一些实施方案中,抗体片段为线性抗体片段。在特定的实施方案中,抗体片段为单特异性或双特异性。在特定的实施方案中,tigit 结合剂为scfv。可使用各种技术来生产对tigit具有特异性的单链抗体。
138.在一些实施方案中,尤其在抗体片段的例子中,抗体经修饰以改变(例如增加或降低)其血清半衰期。这可藉由例如使抗体片段中的适当区域突变而使救援受体结合抗原决定区并入抗体片段中来达成,或藉由将抗原决定区并入肽标签中,接着与抗体片段在末端或中间融合 (例如藉由dna或肽合成)来达成。
139.异质共轭抗体亦属于本发明的范围内。异质共轭抗体是由二个共价连接的抗体所组成。经提出的此等抗体用于例如使免疫细胞靶定不希望的细胞(例如肿瘤细胞)。亦可预期以合成蛋白质化学中已知的方法于试管内制备异质共轭抗体,包括那些涉及交联剂的方法。例如,免疫毒素可使用双硫交换反应或藉由形成硫醚键来建构。适合于此目的的试剂的实例包括亚氨基硫醇盐及甲基-4
‑ꢀ
巯基丁亚酰胺酸酯。
140.就本发明的目的而言,应理解经修饰的抗体可包含提供抗体与标靶(亦即tigit)缔合的任何类型的可变区。关于此点,可变区可包含或源自可经诱发以启动体液反应及产生对抗所期望的抗原的免疫球蛋白的任何类型的哺乳动物。确切而言,经修饰的抗体的可变区可源自例如人类、鼠类、兔子、非人类灵长类动物(例如食蟹猕猴、猕猴等等)或兔子。在一些实施方案中,经修饰的免疫球蛋白的可变区及恒定区二者为人类。在其他的实施方案中,可兼容抗体的可变区(通常源自非人类来源)可经工程化或经特定设计以改进分子的结合特性或降低免疫原性。关于此点,可将本发明中有用的可变区人源化或透过输入的氨基酸序列的加入而以另外的方式改变。
141.在特定的实施方案中,在重链及轻链二者中的可变结构域是藉由至少部分取代一或多个cdr及若必要时藉由部分的架构区取代及序列修饰及/或变异而改变。虽然cdr可能源自与架构区起源的抗体相同类型或甚至相同亚型的抗体,但是设想cdr可能源自不同类型的抗体且常常源自不同物种的抗体。可能没必要将所有的 cdr以供体可变区的所有cdr取代以转移一个可变结构域的抗原结合能力至另一可变结构域。反而可能只需要转移那些维持抗原结合部位活性所需的残基。
142.尽管改变可变区,那些熟习本技术领域者应理解本发明的经修饰的抗体还是包含其中恒定结构域中的一或多者的至少一部分已删除或以其他方式改变的抗体 (例如全长抗体或其免疫反应性片段),以提供所期望的生化特征,诸如与包含原生或未改变的恒定区约相同的免疫原性的抗体相比时具有增加的肿瘤定位或增加的血清半衰期。在一些实施方案中,经修饰的抗体的恒定区包含人类恒定区。与本发明可相容的恒定区修饰包含添加、删除或取代在一或多个结构域中的一或多个氨基酸。本文所揭示的经修饰的抗体可包含对三
个重链恒定结构域中的一或多者(ch1、ch2或ch3)及/或对轻链恒定结构域(cl)的改变或修饰。在一些实施方案中,一或多个结构域是自经修饰的抗体的恒定区部分或全部删除。在一些实施方案中,经修饰的抗体包含其中整个ch2结构域经移除的结构域删除的建构体或变体(
△
ch2建构体)。在一些实施方案中,将删去的恒定区结构域以短氨基酸间隔子(例如10个氨基酸残基)取代,以提供通常由缺少的恒定区所赋予的某些分子柔韧性。
143.在一些实施方案中,经修饰的抗体经工程化以直接融合ch3结构域与抗体的绞链区。在其他的实施方案中,将肽间隔子插入绞链区与经修饰的ch2及/或 ch3结构域之间。例如,可表达其中ch2结构域经删除且剩余的ch3结构域(经修饰或未经修饰)以5至20个氨基酸间隔子与绞链区连结的建构体。可添加此间隔子以确保恒定区的调节组件维持自由且易利用,或绞链区维持柔韧。然而,应注意氨基酸间隔子可在一些情况中证实具有免疫原性且引诱对抗建构体的不希望的免疫反应。因此,在特定的实施方案中,添加至建构体的任何间隔子为相对非免疫原性,以维持经修饰的抗体的所期望的生物质量。
144.在一些实施方案中,经修饰的抗体可能仅具有部分删除的恒定结构域或少数或甚至单一氨基酸的取代。例如,在ch2结构域的选择区域中的单一氨基酸突变可能足以实质地降低fc结合。在一些实施方案中,在 ch2结构域的选择区域中的单一氨基酸突变可能足以实质地降低fc结合且增加癌细胞定位及/或肿瘤穿透。同样地,可能希望单纯地删除一或多个控制欲调节的特异性效应子功能(例如补体c1q结合)的恒定区结构域的部分。恒定区的此等部分删除可改进经选择的抗体特征(血清半衰期),同时保留与目标恒定区结构域完整性相关联的其他所期望的功能。而且,如上所提及,所揭示的抗体的恒定区可透过一或多个氨基酸的突变或取代而修饰,以增强所得建构物的分布。关于此点,有可能阻扰由保守的结合部位所提供的活性(例如fc结合),且实质地维持经修饰的抗体的构型及免疫原性分布。在特定的实施方案中,经修饰的抗体包含添加一或多个氨基酸至恒定区以增强所期望的特征,诸如降低或增加效应子功能或提供更多的细胞毒素或碳水化合物连接部位。
145.在本技术中已知恒定区介导数种效应子功能。例如,以补体的c1组分与igg或igm抗体(与抗原结合)的fc区结合使补体系统活化。补体活化在细胞病原体的调理及溶解中具有重要性。补体活化亦刺激发炎反应,且亦可涉入自体免疫超敏反应。另外,抗体的fc区可结合表达fc受体(fcr)的细胞。有一些fc受体对不同类别的抗体具有特异性,包括igg(γ受体)、ige(ε受体)、iga(α受体)及igm(μ受体)。抗体与细胞表面上的 fc受体结合触发许多重要且多变的生物反应,包括吞噬且破坏抗体包覆粒子、清除免疫复合物、以杀手细胞溶解经抗体包覆的标靶细胞(称为抗体依赖性细胞毒性或 adcc)、释放发炎媒介物、胚胎转移及控制免疫球蛋白生产。
146.在特定的实施方案中,经修饰的抗体提供经改变的效应子功能,该功能依次影响所施用的抗体的生物分布。例如,在一些实施方案中,恒定区结构域的删除或不活化(透过点突变或其他手段)可降低循环修饰的抗体的 fc受体结合。在一些实施方案中,恒定区结构域的删除或不活化(透过点突变或其他手段)可降低循环修饰的抗体的fc受体结合,由此增加癌细胞定位及/或肿瘤穿透。在其他的实施方案中,恒定区修饰增加抗体的血清半衰期。在其他的实施方案中,恒定区修饰降低抗体的血清半衰期。在一些实施方案中,恒定区经修饰以消除双硫键联或寡糖部分。依照本发明的恒定区修饰可使用熟知的生化或分子工程技术轻易进行。
147.在特定的实施方案中,tigit结合剂(其为抗体)不具有一或多个效应子功能。例如,在一些实施方案中,抗体不具有adcc活性及/或补体依赖性细胞毒性 (cdc)活性。在特定的实施方案中,抗体不结合fc受体及 /或补体因子。在特定的实施方案中,抗体不具有效应子功能。
148.本发明另外包含实质上与本文所述的重组、单克隆、嵌合、人源化和人类抗体或其抗体片段同源的变体及相等物。这些变体可含有例如保守性取代突变,亦即以类似的氨基酸取代一或多个氨基酸。
149.本发明提供用于生产结合tigit的抗体的方法,该抗体包括特异性结合tigit及第二标靶二者的双特异性抗体。在一些实施方案中,用于生产结合tigit的抗体的方法包含使用融合瘤技术。在一些实施方案中,提供用于生产结合人类tigit的抗体的方法。在一些实施方案中,该方法包含使用包含小鼠tigit或其片段的细胞外结构域的多肽作为抗原。在一些实施方案中,该方法包含使用包含人类tigit或其片段的细胞外结构域的多肽作为抗原。在一些实施方案中,该方法包含使用包含小鼠tigit 的氨基酸29-148的多肽作为抗原。在一些实施方案中,该方法包含使用包含人类tigit的氨基酸22-141的多肽作为抗原抗原。在一些实施方案中,该方法包含使用包含 seq id no:1的氨基酸29-148的多肽作为抗原。在一些实施方案中,该方法包含使用包含seq id no:4的氨基酸22-141作为抗原。在一些实施方案中,该方法包含使用包含seq id no:3或其片段的多肽作为抗原。在一些实施方案中,该方法包含使用包含seq id no:6或其片段的多肽作为抗原。在一些实施方案中,用于产生结合 tigit的抗体的方法包含筛选噬菌体库。在一些实施方案中,用于产生结合tigit的抗体的方法包含筛选人类噬菌体库。本发明另外提供用于鉴别结合tigit的抗体的方法。在一些实施方案中,抗体是藉由facs筛选对tigit 或其片段的结合来鉴别。在一些实施方案中,抗体是藉由使用elisa筛选对tigit或其片段的结合来鉴别。在一些实施方案中,抗体是藉由以facs筛选用于阻断tigit 与pvr的结合来鉴别。
150.在一些实施方案中,用于产生对tigit的抗体的方法包含以包含小鼠tigit的氨基酸29-148的多肽使哺乳动物免疫。在一些实施方案中,用于产生对tigit 的抗体的方法包含以包含人类tigit的氨基酸22-141的多肽使哺乳动物免疫。在一些实施方案中,用于产生对 tigit的抗体的方法包含以包含小鼠tigit的氨基酸29
‑ꢀ
148的片段(例如部分)的多肽使哺乳动物免疫。在一些实施方案中,用于产生对tigit的抗体的方法包含以包含人类tigit的氨基酸22-141的片段的多肽使哺乳动物免疫。在一些实施方案中,该方法另外包含自哺乳动物分离抗体或抗体生产细胞。在一些实施方案中,用于产生结合 tigit的单克隆抗体的方法包含:(a)以包含小鼠tigit的氨基酸29-148的片段的多肽使哺乳动物免疫;(b)自经免疫的哺乳动物分离抗体生产细胞;及(c)将抗体生产细胞与骨髓瘤细胞系的细胞融合,以形成融合瘤细胞。在一些实施方案中,用于产生结合tigit的单克隆抗体的方法包含:(a)以包含人类tigit的氨基酸22-141的片段的多肽使哺乳动物免疫;(b)自经免疫的哺乳动物分离抗体生产细胞;及(c)将抗体生产细胞与骨髓瘤细胞系的细胞融合,以形成融合瘤细胞。在一些实施方案中,该方法另外包含 (d)选择表达结合tigit的抗体的融合瘤细胞。在特定的实施方案中,哺乳动物为小鼠。在一些实施方案中,哺乳动物为大鼠。在一些实施方案中,哺乳动物为兔子。在一些实施方案中,抗体是使用包含小鼠tigit的氨基酸29
‑ꢀ
148或其片段的多肽选择。在一些实施方案中,抗体是使用包含人类tigit的氨基酸22-141或其
片段的多肽选择。在一些实施方案中,抗体结合人类tigit及小鼠 tigit二者。在一些实施方案中,抗体不结合小鼠 tigit。在一些实施方案中,抗体不结合食蟹猕猴 tigit。在一些实施方案中,抗体不结合恒河猴tigit。在一些实施方案中,抗体不结合大鼠tigit。在一些实施方案中,抗体结合人类tigit及不结合小鼠tigit。在一些实施方案中,抗体结合人类tigit及不结合食蟹猕猴 tigit。在一些实施方案中,抗体结合人类tigit及不结合恒河猴tigit。在一些实施方案中,抗体结合人类 tigit及不结合大鼠tigit。
151.在一些实施方案中,用于生产结合tigit的抗体的方法包含使用包含单一抗原结合部位的膜结合的异质二聚体分子鉴别抗体。在一些非限制性实施方案中,抗体是使用国际专利公开案wo 2011/100566中所述的方法及多肽来鉴别。
152.在一些实施方案中,用于生产结合tigit的抗体的方法包含筛选抗体表达库。在一些实施方案中,抗体表达库为噬菌体库。在一些实施方案中,筛选包含拣选 (panning)。在一些实施方案中,抗体表达库为哺乳动物细胞库。在一些实施方案中,抗体表达库是使用小鼠tigit 或其片段的氨基酸29-148来筛选。在一些实施方案中,抗体表达库是使用人类tigit或其片段的氨基酸22-141 来筛选。在一些实施方案中,以筛选鉴别的抗体结合人类 tigit及小鼠tigit二者。在一些实施方案中,以筛选鉴别的抗体为tigit拮抗剂。
153.在一些实施方案中,以本文所述的方法产生的抗体为tigit拮抗剂。在一些实施方案中,以本文所述的方法产生的抗体抑制tigit传导信号。在一些实施方案中,以本文所述的方法产生的抗体抑制tigit磷酸化。
154.在特定的实施方案中,将本文所述的抗体分离。在特定的实施方案中,本文所述的抗体为实质上纯的。
155.本发明的tigit结合剂(例如抗体)可以本技术中已知的任何方法检定特异性结合。可使用的免疫检定法包括但不限于使用下列技术的竞争性及非竞争性检定系统:诸如biacore分析、facs分析、免疫荧光、免疫细胞化学、西方墨点分析、放射性免疫检定、elisa、〝三明治〞式免疫检定、免疫沉淀检定、沉淀反应、凝胶扩散沉淀反应、免疫扩散检定、凝集检定、补体固定检定、免疫放射检定、荧光免疫检定和蛋白质a免疫检定。此等检定为惯例程序且为本技术中所熟知(参见例如ausubel等人的editors,1994-present,current protocols in molecularbiology,john wiley&sons,inc.,new york,ny)。
156.在非限制性实例中,用于抗体与人类tigit 的特异性结合的筛选可使用elisa测定。elisa包含制备抗原(例如tigit或其片段),以抗原包覆96槽孔微量滴定盘的槽孔,添加与可检测的化合物(诸如酵素底物,例如辣根过氧化酶或碱性磷酸酶)共轭的试验抗体至槽孔中,培育一段时期且检测与抗原结合的抗体的存在。在一些实施方案中,试验抗体不与可检测的化合物共轭,反而将辨识抗体(例如抗fc抗体)且与可检测的化合物共轭的二级抗体添加至槽孔中。在一些实施方案中,不以抗原包覆槽孔,反而以试验抗体包覆槽孔,添加抗原(例如 tigit)至槽孔,接着添加与可检测的化合物共轭的二级抗体。熟习本技术领域者能具有关于可修改以增加检测信号的参数以及本技术中已知的elisa的其他变量的知识。
157.在另一非限制性实例中,用于抗体与人类 tigit的特异性结合可使用facs测定。facs筛选检定法可包含产生表达成为全长蛋白质(tigit)或融合蛋白(例如tigit-cd4tm)的抗原的建构体,将建构体转染至细胞中,使抗原表达在细胞表面上,将试验抗体与经转染的细胞混合且培育一段时期。以试验抗体结合的细胞可使用与可检测的化合物共轭的二级
抗体(例如经pe共轭的抗fc 抗体)及流动式细胞测量计鉴别。熟习本技术领域者能具有关于可修改而使检测信号最优化的参数以及可增强筛选 (例如阻断抗体的筛选)的facs的其他变量的知识。
158.抗体或其他结合剂对抗原(例如tigit)的结合亲和性及抗体-抗原交互作用的解离速率(off-rate)可藉由竞争性结合检定法测定。竞争性结合检定法的一个实例为放射性免疫检定法,其包含将经标记的抗原(例如3h或
125
i-tigit)或其片段或变体与关注的抗体在增量的未标记的抗原存在下培育,接着检测与经标记的抗原结合的抗体。抗体对抗原的亲和性及结合解离速率可自斯卡查德 (scatchard)图分析的数据测定。在一些实施方案中, biacore动力学分析是用于测定结合抗原(例如tigit)的抗体或剂的结合及解离速率。在一些实施方案中,biacore 动力学分析包含分析抗体与芯片表面上固定的抗原(例如 tigit)的结合及自芯片的解离。在一些实施方案中, biacore动力学分析包含分析抗原(例如tigit)与芯片表面上固定的抗体(例如抗tigit抗体)的结合及自芯片的解离。
159.在特定的实施方案中,本发明提供特异性结合tigit的tigit结合剂(例如抗体),其中tigit结合剂包含抗体313r11、313r12、313r14或313r19的cdr中的一、二、三、四、五及/或六者(参见表1)。在一些实施方案中,tigit结合剂包含13r11、313r12、313r14或 313r19或其人源化变体的cdr中的一或多者;313r11、 313r12、313r14或313r19或其人源化变体的cdr中的二或更多者;313r11、313r12、313r14或313r19或其人源化变体的cdr中的三或更多者;313r11、313r12、 313r14或313r19或其人源化变体的cdr中的四或更多者;313r11、313r12、313r14或313r19或其人源化变体的cdr中的五或更多者;或313r11、313r12、313r14 或313r19或其人源化变体的cdr中的全部六者。表1
160.在特定的实施方案中,本发明提供特异性结合tigit的tigit结合剂(例如抗体),其中tigit结合剂包含:包含gsslsssyms(seq id no:7)或 gfslsssyms(seq id no:13)的重链cdr1、包含 iigsngntyyanwakg(seq id no:8)的重链cdr2及包含ggyrtsgmdp(seq id no:9)的重链cdr3。在一些实施方案中,tigit结合剂另外包含:包含 qasqsissylnw(seq id no:10)、qasqsniysdlaw (seq id no:14)或qasqniysdlaw(seq id no:81) 的轻链cdr1、包含dalklas(seq id no:11)或 rastlas(seq id no:15)的轻链cdr2及包含 qqehsvgnvdn(seq id no:12)或qqehlvawiyn (seq id no:16)的轻链cdr3。在一些实施方案中, tigit结合剂包含:包含qasqsissylnw(seq id no: 10)、qasqsniysdlaw(seq id no:14)或 qasqniysdlaw(seq id no:81)的轻链cdr1、包含 dalklas(seq id no:11)或rastlas(seq id no:15)的轻链cdr2及包含qqehsvgnvdn(seq id no: 12)或qqehlvawiyn(seq id no:
16)的轻链cdr3。在一些实施方案中,tigit结合剂包含:(a)包含 gsslsssyms(seq id no:7)或gfslsssyms(seq idno:13)的重链cdr1、包含iigsngntyyanwakg (seq id no:8)的重链cdr2及包含ggyrtsgmdp(seqid no:9)的重链cdr3;及(b)包含qasqsissylnw (seq id no:10)、qasqsniysdlaw(seq id no:14) 或qasqniysdlaw(seq id no:81)的轻链cdr1、包含dalklas(seq id no:11)或rastlas(seq idno:15)的轻链cdr2及包含qqehsvgnvdn(seq idno:12)或qqehlvawiyn(seq id no:16)的轻链 cdr3。在一些实施方案中,tigit结合剂包含:(a)包含 gsslsssyms(seq id no:7)的重链cdr1、包含 iigsngntyyanwakg(seq id no:8)的重链cdr2及包含ggyrtsgmdp(seq id no:9)的重链cdr3;及(b) 包含qasqsissylnw(seq id no:10)的轻链cdr1、包含dalklas(seq id no:11)的轻链cdr2及包含 qqehsvgnvdn(seq id no:12)的轻链cdr3。在一些实施方案中,tigit结合剂包含:(a)包含gfslsssyms (seq id no:13)的重链cdr1、包含 iigsngntyyanwakg(seq id no:8)的重链cdr2及包含ggyrtsgmdp(seq id no:9)的重链cdr3;及(b) 包含qasqsniysdlaw(seq id no:14)的轻链cdr1、包含rastlas(seq id no:15)的轻链cdr2及包含 qqehlvawiyn(seq id no:16)的轻链cdr3。在一些实施方案中,tigit结合剂包含:(a)包含gfslsssyms (seq id no:13)的重链cdr1、包含 iigsngntyyanwakg(seq id no:8)的重链cdr2及包含ggyrtsgmdp(seq id no:9)的重链cdr3;及(b) 包含qasqniysdlaw(seq id no:81)的轻链cdr1、包含rastlas(seq id no:15)的轻链cdr2及包含 qqehlvawiyn(seq id no:16)的轻链cdr3。
161.在特定的实施方案中,本发明提供特异性结合人类tigit的tigit结合剂(例如抗体),其中tigit结合剂包含:(a)包含gsslsssyms(seq id no:7)、 gfslsssyms(seq id no:13)或包含1、2、3或4个氨基酸取代的其变体的重链cdr1;(b)包含 iigsngntyyanwakg(seq id no:8)或包含1、2、3 或4个氨基酸取代的其变体的重链cdr2;(c)包含 ggyrtsgmdp(seq id no:9)或包含1、2、3或4个氨基酸取代的其变体的重链cdr3;(d)包含 qasqsissylnw(seq id no:10)、qasqsniysdlaw (seq id no:14)、qasqniysdlaw(seq id no:81)或包含1、2、3或4个氨基酸取代的其变体的轻链cdr1; (e)包含dalklas(seq id no:11)、rastlas(seq idno:15)或包含1、2、3或4个氨基酸取代的其变体的轻链cdr2;及(f)包含qqehsvgnvdn(seq id no:12)、qqehlvawiyn(seq id no:16)或包含1、2、3或4个氨基酸取代的其变体的轻链cdr3。在特定的实施方案中,氨基酸取代为保守性取代。在一些实施方案中,取代构成人源化过程的一部分。在一些实施方案中,取代构成种系人源化过程的一部分。
162.在特定的实施方案中,本发明提供特异性结合tigit的tigit结合剂(例如抗体),本发明提供tigit 结合剂(例如抗体),其中tigit结合剂包含与seq idno:17、seq id no:19或seq id no:32具有至少约 80%的序列一致性的重链可变区及/或与seq id no:18 或seq id no:20具有至少约80%的序列一致性的轻链可变区。在特定的实施方案中,tigit结合剂包含与seqid no:17具有至少约85%,至少约90%,至少约95%,至少约97%或至少约99%的序列一致性的重链可变区。在特定的实施方案中,tigit结合剂包含与seq id no:19 具有至少约85%,至少约90%,至少约95%,至少约97%或至少约99%的序列一致性的重链可变区。在特定的实施方案中,tigit结合剂包含与seq id no:32具有至少约 85%,至少约90%,至少约95%,至少约97%或至少约 99%的序列一致性的重链可变区。在特定的实施方案中, tigit结合剂包含与seq id no:18具有至少约85%,至少约90%,至少约95%,至少约97%或至少约99%的序列一致性的轻链可变区。在特定的实施方案中,tigit结合剂包
含与seq id no:20具有至少约85%,至少约90%,至少约95%,至少约97%或至少约99%的序列一致性的轻链可变区。在特定的实施方案中,tigit结合剂包含与seq id no:17、seq id no:19或seq id no:32 具有至少约95%的序列一致性的重链可变区及/或与seqid no:18或seq id no:20具有至少约95%的序列一致性的轻链可变区。在特定的实施方案中,tigit结合剂包含重链可变区和轻链可变区,该重链可变区包含seqid no:17、seq id no:19或seq id no:32及/或该轻链可变区包含seq id no:18或seq id no:20。在特定的实施方案中,tigit结合剂包含重链可变区和轻链可变区,该重链可变区包含seq id no:17、seq idno:19或seq id no:32且该轻链可变区包含seq idno:18或seq id no:20。在特定的实施方案中, tigit结合剂包含重链可变区和轻链可变区,该重链可变区基本上由seq id no:17、seq id no:19或seq idno:32所组成且该轻链可变区基本上由seq id no:18 或seq id no:20所组成。在特定的实施方案中,tigit 结合剂包含重链可变区和轻链可变区,该重链可变区是由 seq id no:17、seq id no:19或seq id no:32所组成且该轻链可变区是由seq id no:18或seq id no: 20所组成。
163.在特定的实施方案中,tigit结合剂包含重链可变区和轻链可变区,该重链可变区包含seq id no:17 且该轻链可变区包含seq id no:18。在特定的实施方案中,tigit结合剂包含重链可变区和轻链可变区,该重链可变区基本上由seq id no:17所组成且该轻链可变区基本上由seq id no:18所组成。在特定的实施方案中,tigit结合剂包含重链可变区和轻链可变区,该重链可变区是由seq id no:17所组成且该轻链可变区是由 seq id no:18所组成。
164.在特定的实施方案中,tigit结合剂包含重链可变区和轻链可变区,该重链可变区包含seq id no:19 且该轻链可变区包含seq id no:20。在特定的实施方案中,tigit结合剂包含重链可变区和轻链可变区,该重链可变区基本上由seq id no:19所组成且该轻链可变区基本上由seq id no:20所组成。在特定的实施方案中,tigit结合剂包含重链可变区和轻链可变区,该重链可变区是由seq id no:19所组成且该轻链可变区是由 seq id no:20所组成。
165.在特定的实施方案中,tigit结合剂包含重链可变区和轻链可变区,该重链可变区包含seq id no:32 且该轻链可变区包含seq id no:20。在特定的实施方案中,tigit结合剂包含重链可变区和轻链可变区,该重链可变区基本上由seq id no:32所组成且该轻链可变区基本上由seq id no:20所组成。在特定的实施方案中,tigit结合剂包含重链可变区和轻链可变区,该重链可变区是由seq id no:32所组成且该轻链可变区是由 seq id no:20所组成。
166.在特定的实施方案中,本发明提供特异性结合tigit的tigit结合剂(例如抗体),其中tigit结合剂包含:(a)与seq id no:26、seq id no:27、seq idno:29、seq id no:34或seq id no:56具有至少 90%的序列一致性的重链;及/或(b)与seq id no:28或 seq id no:30具有至少90%的序列一致性的轻链。在一些实施方案中,tigit结合剂包含:(a)与seq id no: 26、seq id no:27、seq id no:29、seq id no:34 或seq id no:56具有至少95%的序列一致性的重链;及/或(b)与seq id no:28或seq id no:30具有至少 95%的序列一致性的轻链。在一些实施方案中,tigit结合剂包含重链和轻链,该重链包含seq id no:26及/或该轻链包含seq id no:28。在一些实施方案中,tigit 结合剂包含重链和轻链,该重链包
含seq id no:27及/ 或该轻链包含seq id no:28。在一些实施方案中, tigit结合剂包含重链和轻链,该重链包含seq id no: 29及/或该轻链包含seq id no:30。在一些实施方案中,tigit结合剂包含重链和轻链,该重链包含seq idno:34及/或该轻链包含seq id no:30。在一些实施方案中,tigit结合剂包含重链和轻链,该重链包含seqid no:56及/或该轻链包含seq id no:30。在一些实施方案中,tigit结合剂包含重链和轻链,该重链基本上由seq id no:26或seq id no:27所组成且该轻链基本上由seq id no:28所组成。在一些实施方案中,tigit结合剂包含重链和轻链,该重链基本上由seq idno:29、seq id no:34或seq id no:56所组成且该轻链基本上由seq id no:30所组成。在一些实施方案中,tigit结合剂包含重链和轻链,该重链基本上由seqid no:26所组成且该轻链基本上由seq id no:28所组成。在一些实施方案中,tigit结合剂包含重链和轻链,该重链是由seq id no:27所组成且该轻链是由 seq id no:28所组成。在一些实施方案中,tigit结合剂包含重链和轻链,该重链是由seq id no:29所组成且该轻链是由seq id no:30所组成。在一些实施方案中,tigit结合剂包含重链和轻链,该重链是由seq idno:34所组成且该轻链是由seq id no:30所组成。在一些实施方案中,tigit结合剂包含重链和轻链,该重链是由seq id no:56所组成且该轻链是由seq id no: 30所组成。
167.在特定的实施方案中,tigit结合剂包含 313r11抗体的重链可变区和轻链可变区。在一些实施方案中,tigit结合剂包含313r11抗体的可变区,其中来自313r11抗体的重链可变区及/或轻链可变区经亲和性成熟。在特定的实施方案中,tigit结合剂包含313r11抗体(具有或不具有前导序列)的重链和轻链。在特定的实施方案中,tigit结合剂为313r11抗体。在特定的实施方案中,tigit结合剂包含313r11抗体的重链可变区及/或轻链可变区,其中重链可变区及/或轻链可变区经人源化。在特定的实施方案中,tigit结合剂包含313r11抗体的人源化形式的重链可变区及/或轻链可变区。在特定的实施方案中,tigit结合剂包含成为igg1、igg2或 igg4重链的一部分的313r11抗体的重链可变区。
168.在特定的实施方案中,tigit结合剂包含、基本上由或由抗体313r11所组成。在特定的实施方案中, tigit结合剂包含、基本上由或由抗体313r11的变体所组成。
169.在特定的实施方案中,tigit结合剂包含 313r12抗体的重链可变区和轻链可变区。在一些实施方案中,tigit结合剂包含313r12抗体的可变区,其中来自313r12抗体的重链可变区及/或轻链可变区经亲和性成熟。在特定的实施方案中,tigit结合剂包含313r12抗体(具有或不具有前导序列)的重链和轻链。在特定的实施方案中,tigit结合剂为313r12抗体。在特定的实施方案中,tigit结合剂包含313r12抗体的重链可变区及/或轻链可变区,其中重链可变区及/或轻链可变区经人源化。在特定的实施方案中,tigit结合剂包含313r12抗体的人源化形式的重链可变区及/或轻链可变区。在特定的实施方案中,tigit结合剂包含成为igg1、igg2或 igg4重链的一部分的313r12抗体的重链可变区。
170.在特定的实施方案中,tigit结合剂包含抗体 313r12、基本上由或由抗体313r12所组成。在特定的实施方案中,tigit结合剂包含抗体313r12的变体、基本上由或由抗体313r12的变体所组成。
171.在特定的实施方案中,tigit结合剂包含 313r14抗体的重链可变区和轻链可变区。在一些实施方案中,tigit结合剂包含313r14抗体的可变区,其中来自313r14抗体的重链可变区及/或轻链可变区经亲和性成熟。在特定的实施方案中,tigit结合剂包含313r14
抗体(具有或不具有前导序列)的重链和轻链。在特定的实施方案中,tigit结合剂为313r14抗体。在特定的实施方案中,tigit结合剂包含313r14抗体的重链可变区及/或轻链可变区,其中重链可变区及/或轻链可变区经人源化。在特定的实施方案中,tigit结合剂包含313r14抗体的人源化形式的重链可变区及/或轻链可变区。在特定的实施方案中,tigit结合剂包含成为igg1、igg2或 igg4重链的一部分的313r14抗体的重链可变区。
172.在特定的实施方案中,tigit结合剂包含抗体 313r14、基本上由或由抗体313r14所组成。在特定的实施方案中,tigit结合剂包含抗体313r14的变体、基本上由或由抗体313r14的变体所组成。
173.在特定的实施方案中,tigit结合剂包含 313r19抗体的重链可变区和轻链可变区。在一些实施方案中,tigit结合剂包含313r19抗体的可变区,其中来自313r19抗体的重链可变区及/或轻链可变区经亲和性成熟。在特定的实施方案中,tigit结合剂包含313r19抗体(具有或不具有前导序列)的重链和轻链。在特定的实施方案中,tigit结合剂为313r19抗体。在特定的实施方案中,tigit结合剂包含313r19抗体的重链可变区及/或轻链可变区,其中重链可变区及/或轻链可变区经人源化。在特定的实施方案中,tigit结合剂包含313r19抗体的人源化形式的重链可变区及/或轻链可变区。在特定的实施方案中,tigit结合剂包含成为igg1、igg2或 igg4重链的一部分的313r19抗体的重链可变区。
174.在特定的实施方案中,tigit结合剂包含抗体 313r19、基本上由或由抗体313r19所组成。在特定的实施方案中,tigit结合剂包含抗体313r19的变体、基本上由或由抗体313r19的变体所组成。
175.在一些实施方案中,tigit结合剂包含在 2015年5月27日依照布达佩斯特条约(budapest treaty) 的条款保藏于美国菌种保藏中心(atcc),10801university boulevard,manassas,va,usa且以pta
‑ꢀ
122180编号的质粒所编码的重链可变区。在一些实施方案中,tigit结合剂包含在2015年5月27日依照布达佩斯特条约的条款保藏于atcc,10801 universityboulevard,manassas,va,usa且以pta-122181编号的质粒所编码的轻链可变区。在一些实施方案中,tigit结合剂包含由保藏于atcc且以pta-122180编号的质粒所编码的重链可变区和由保藏于atcc且以pta-122181编号的质粒所编码的轻链可变区。在一些实施方案中,tigit 结合剂包含重链,该重链包含由保藏于atcc且以pta
‑ꢀ
122180编号的质粒所编码的重链可变区。在一些实施方案中,tigit结合剂包含轻链,该轻链包含由保藏于 atcc且以pta-122181编号的质粒所编码的轻链可变区。在一些实施方案中,tigit结合剂包含重链和轻链,该重链包含由保藏于atcc且以pta-122180编号的质粒所编码的重链可变区且该轻链包含由保藏于atcc且以 pta-122181编号的质粒所编码的轻链可变区。
176.在特定的实施方案中,本发明提供特异性结合tigit的tigit结合剂(例如抗体),其中tigit结合剂包含抗体313m26或313m32的cdr中的一、二、三、四、五及/或六者(参见表2)。在一些实施方案中,tigit 结合剂包含313m26或313m32的cdr中的一或多者; 313m26或313m32的cdr中的二或更多者;313m26或 313m32的cdr中的三或更多者;313m26或313m32的 cdr中的四或更多者;313m26或313m32的cdr中的五或更多者;或313m26或313m32的cdr中的全部六者。表2
ꢀꢀ
313m26和313m32
hc cdr1tsdyawn(seq id no:57)hc cdr2yisysgstsynpslrs(seq id no:58)hc cdr3arrqvglgfay(seq id no:59)lc cdr1kasqdvstava(seq id no:60)lc cdr2sasyryt(seq id no:61)lc cdr3qqhystp(seq id no:62)
177.在特定的实施方案中,本发明提供特异性结合tigit的tigit结合剂(例如抗体),其中tigit结合剂包含:包含tsdyawn(seq id no:57)的重链cdr1、包含yisysgstsynpslrs(seq id no:58)的重链cdr2 及包含arrqvglgfay(seq id no:59)的重链cdr3。在一些实施方案中,tigit结合剂另外包含:包含 kasqdvstava(seq id no:60)的轻链cdr1、包含 sasyryt(seq id no:61)的轻链cdr2及包含 qqhystp(seq id no:62)的轻链cdr3。在一些实施方案中,tigit结合剂包含:包含kasqdvstava(seq idno:60)的轻链cdr1、包含sasyryt(seq id no:61) 的轻链cdr2及包含qqhystp(seq id no:62)的轻链 cdr3。在一些实施方案中,tigit结合剂包含:(a)包含 tsdyawn(seq id no:57)的重链cdr1、包含 yisysgstsynpslrs(seq id no:58)的重链cdr2及包含arrqvglgfay(seq id no:59)的重链cdr3;及(b) 包含kasqdvstava(seq id no:60)的轻链cdr1、包含sasyryt(seq id no:61)的轻链cdr2及包含 qqhystp(seq id no:62)的轻链cdr3。
178.在特定的实施方案中,本发明提供特异性结合人类tigit的tigit结合剂(例如抗体),其中tigit结合剂包含:(a)包含tsdyawn(seq id no:57)或包含 1、2、3或4个氨基酸取代的其变体的重链cdr1;(b)包含yisysgstsynpslrs(seq id no:58)或包含1、2、3 或4个氨基酸取代的其变体的重链cdr2;(c)包含 arrqvglgfay(seq id no:59)或包含1、2、3或4个氨基酸取代的其变体的重链cdr3;(d)包含 kasqdvstava(seq id no:60)或包含1、2、3或4个氨基酸取代的其变体的轻链cdr1;(e)包含sasyryt (seq id no:61)或包含1、2、3或4个氨基酸取代的其变体的轻链cdr2;或(f)包含qqhystp(seq id no: 62)或包含1、2、3或4个氨基酸取代的其变体的轻链 cdr3。在特定的实施方案中,氨基酸取代为保守性取代。在一些实施方案中,在一些实施方案中,取代构成人源化过程的一部分。在一些实施方案中,取代构成种系人源化过程的一部分。在一些实施方案中,取代构成结合最优化过程的一部分。
179.在特定的实施方案中,本发明提供特异性结合tigit的tigit结合剂(例如抗体),其中tigit结合剂包含与seq id no:63或seq id no:67具有至少约 80%的序列一致性的重链可变区及/或与seq id no:64 或seq id no:68具有至少80%的序列一致性的轻链可变区。在特定的实施方案中,tigit结合剂包含与seqid no:63具有至少约85%,至少约90%,至少约95%,至少约97%或至少约99%的序列一致性的重链可变区。在特定的实施方案中,tigit结合剂包含与seq id no:67 具有至少约85%,至少约90%,至少约95%,至少约97%或至少约99%的序列一致性的重链可变区。在特定的实施方案中,tigit结合剂包含与seq id no:64具有至少约 85%,至少约90%,至少约95%,至少约97%或至少约 99%的序列一致性的轻链可变区。在特定的实施方案中, tigit结合剂包含与seq id no:68具有至少约85%,至少约90%,至少约95%,至少约97%或至少约99%的序列一致性的轻链可变区。在特定的实施方案中,tigit结合剂包含与seq id no:63或seq id no:67具有至少约 95%的序列一致性的重链可变区及/或与seq id no:64 或seq id no:68具有至少约95%
的序列一致性的轻链可变区。在特定的实施方案中,tigit结合剂包含重链可变区和轻链可变区,该重链可变区包含seq id no:63 或seq id no:67及/或该轻链可变区包含seq id no: 64或seq id no:68。在特定的实施方案中,tigit结合剂包含重链可变区和轻链可变区,该重链可变区包含seqid no:63或seq id no:67且该轻链可变区包含seqid no:64或seq id no:68。在特定的实施方案中, tigit结合剂包含重链可变区和轻链可变区,该重链可变区基本上由seq id no:63或seq id no:67所组成且该轻链可变区基本上由seq id no:64或seq id no: 68所组成。在特定的实施方案中,tigit结合剂包含重链可变区和轻链可变区,该重链可变区是由seq id no:63 或seq id no:67所组成且该轻链可变区是由seq idno:64或seq id no:68所组成。
180.在特定的实施方案中,tigit结合剂包含重链可变区和轻链可变区,该重链可变区包含seq id no:63 且该轻链可变区包含seq id no:64。在特定的实施方案中,tigit结合剂包含重链可变区和轻链可变区,该重链可变区基本上由seq id no:63所组成且该轻链可变区基本上由seq id no:64所组成。在特定的实施方案中,tigit结合剂包含重链可变区和轻链可变区,该重链可变区是由seq id no:63所组成且该轻链可变区是由 seq id no:64所组成。
181.在特定的实施方案中,tigit结合剂包含重链可变区和轻链可变区,该重链可变区包含seq id no:67 且该轻链可变区包含seq id no:68。在特定的实施方案中,tigit结合剂包含重链可变区和轻链可变区,该重链可变区基本上由seq id no:67所组成且该轻链可变区基本上由seq id no:68所组成。在特定的实施方案中,tigit结合剂包含重链可变区和轻链可变区,该重链可变区是由seq id no:67所组成且该轻链可变区是由 seq id no:68所组成。
182.在特定的实施方案中,本发明提供特异性结合tigit的tigit结合剂(例如抗体),其中tigit结合剂包含:与seq id no:70具有至少90%的序列一致性的重链及/或与seq id no:72具有至少90%的序列一致性的轻链。在一些实施方案中,tigit结合剂包含:与seqid no:70具有至少95%的序列一致性的重链及/或与 seq id no:72具有至少95%的序列一致性的轻链。在一些实施方案中,tigit结合剂包含:包含seq id no:70 的重链及/或seq id no:72的轻链。在一些实施方案中,tigit结合剂包含重链和轻链,该重链基本上由seqid no:70所组成且该轻链基本上由seq id no:72所组成。在一些实施方案中,tigit结合剂包含重链和轻链,该重链是由seq id no:70所组成且该轻链是由 seq id no:72所组成。
183.在特定的实施方案中,本发明提供特异性结合tigit的tigit结合剂(例如抗体),其中tigit结合剂包含:与seq id no:82具有至少90%的序列一致性的重链及/或与seq id no:72具有至少90%的序列一致性的轻链。在一些实施方案中,tigit结合剂包含:与seqid no:82具有至少95%的序列一致性的重链及/或与 seq id no:72具有至少95%的序列一致性的轻链。在一些实施方案中,tigit结合剂包含重链和轻链,该重链包含seq id no:82及/或该轻链包含seq id no:72。在一些实施方案中,tigit结合剂包含重链和轻链,该重链基本上由seq id no:82所组成且该轻链基本上由seqid no:72所组成。在一些实施方案中,tigit结合剂包含重链和轻链,该重链是由seq id no:82所组成且该轻链是由seq id no:72所组成。
184.在特定的实施方案中,tigit结合剂包含 313m26抗体的重链可变区和轻链可变
区。在一些实施方案中,tigit结合剂包含313m26抗体的可变区,其中来自313m26抗体的重链可变区及/或轻链可变区经亲和性成熟。在特定的实施方案中,tigit结合剂包含313m26抗体(具有或不具有前导序列)的重链和轻链。在特定的实施方案中,tigit结合剂为313m26抗体。在特定的实施方案中,tigit结合剂包含313m26抗体的重链可变区及/或轻链可变区,其中重链可变区及/或轻链可变区经人源化。在特定的实施方案中,tigit结合剂包含313m26抗体的人源化形式的重链可变区及/或轻链可变区。在特定的实施方案中,tigit结合剂包含成为igg1、igg2或 igg4重链的一部分的313m26抗体的重链可变区。
185.在特定的实施方案中,tigit结合剂包含抗体 313m26、基本上由或由抗体313m26所组成。在特定的实施方案中,tigit结合剂包含抗体313m26的变体、基本上由或由抗体313m26的变体所组成。
186.在特定的实施方案中,tigit结合剂包含 313m32抗体的重链可变区和轻链可变区。在一些实施方案中,tigit结合剂包含313m32抗体的可变区,其中来自313m32抗体的重链可变区及/或轻链可变区经亲和性成熟。在特定的实施方案中,tigit结合剂包含313m32抗体(具有或不具有前导序列)的重链和轻链。在特定的实施方案中,tigit结合剂为313m32抗体。在特定的实施方案中,tigit结合剂包含成为igg1、igg2或igg4重链的一部分的313m32抗体的重链可变区。在特定的实施方案中,tigit结合剂包含成为igg1重链的一部分的313m32 抗体的重链可变区。在特定的实施方案中,tigit结合剂包含成为igg2重链的一部分的313m32抗体的重链可变区。在特定的实施方案中,tigit结合剂包含成为igg4 重链的一部分的313m32抗体的重链可变区。
187.在特定的实施方案中,tigit结合剂包含抗体 313m32、基本上由或由抗体313m32所组成。在特定的实施方案中,tigit结合剂包含抗体313m32的变体、基本上由或由抗体313m32的变体所组成。
188.在一些实施方案中,tigit结合剂包含由2015年8月11日依照布达佩斯特条约的条款保藏于美国菌种保藏中心(atcc),10801university boulevard, manassas,va,usa且以pta-122346编号的质粒所编码的重链可变区。在一些实施方案中,tigit结合剂包含由 2015年8月11日依照布达佩斯特条约的条款保藏于 atcc,10801 university boulevard,manassas,va,usa 且以pta-122347编号的质粒所编码的轻链可变区。在一些实施方案中,tigit结合剂包含由保藏于atcc且以 pta-122346编号的质粒所编码的重链可变区及由保藏于 atcc且以pta-122347编号的质粒所编码的轻链可变区。在一些实施方案中,tigit结合剂包含重链,该重链包含由保藏于atcc且以pta-122346编号的质粒所编码的可变区。在一些实施方案中,tigit结合剂包含轻链,该轻链包含由保藏于atcc且以pta-122347编号的质粒所编码的可变区。在一些实施方案中,tigit结合剂包含重链和轻链,该重链包含由保藏于atcc且以pta
‑ꢀ
122346编号的质粒所编码的可变区且该轻链包含由保藏于atcc且以pta-122347编号的质粒所编码的可变区。
189.本发明亦包含同质二聚体剂/分子及异质二聚体剂/分子。在一些实施方案中,同质二聚体剂为多肽。在一些实施方案中,异质二聚体分子为多肽。同质二聚体分子通常包含两个相同的多肽。异质二聚体分子通常包含至少两个不同的多肽。在一些实施方案中,异质二聚体分子能够结合至少两个标靶,例如双特异性剂。标靶可为例如在单一细胞上的两个不同的蛋白质或在两个单独的细胞上的两个不同的蛋白质。术语〝臂〞可于本文用于说明同
质二聚体剂、异质二聚体剂及/或双特异性剂的结构。在一些实施方案中,各臂包含至少一个多肽。异质二聚体分子的各臂通常具有不同的功能,例如结合两个不同的标靶。在一些实施方案中,一个臂可包含来自抗体的抗原结合部位。在一些实施方案中,一个臂可包含受体的结合部分。在一些实施方案中,一个臂可包含配体。在一些实施方案中,一个臂可包含配体的结合部分。在一些实施方案中,同质二聚体剂包含两个相同的臂。在一些实施方案中,异质二聚体剂包含两个不同的臂。在一些实施方案中,双特异性剂包含两个不同的臂。
190.在一些实施方案中,本发明提供tigit结合剂,其为同质二聚体分子。在一些实施方案中,同质二聚体分子包含两个相同的多肽。在一些实施方案中,本发明提供tigit结合剂,其为异质二聚体分子。在一些实施方案中,异质二聚体分子包含至少两个不同的多肽。在一些实施方案中,本发明提供tigit结合剂,其为异质二聚体剂。在一些实施方案中,本发明提供tigit结合剂,其为双特异性剂。在特定的实施方案中,tigit结合剂为双特异性抗体。
191.在一些实施方案中,异质二聚体剂(例如双特异性剂)包含本文所述的tigit结合剂。在特定的实施方案中,异质二聚体剂包含免疫反应刺激剂或其功能性片段。在一些实施方案中,异质二聚体分子包含至少两个功能:(i)与tigit结合,及(ii)与第二标靶结合。在一些实施方案中,异质二聚体剂包含至少两个功能:(i)与tigit 结合,及(ii)〝不结合〞的功能。在特定的实施方案中,异质二聚体分子包含第二免疫治疗剂或其功能性片段。在一些实施方案中,异质二聚体分子的一个臂包含本文所述的tigit结合剂及异质二聚体分子的一个臂包含第二免疫治疗剂。在一些实施方案中,异质二聚体剂的一个臂包含本文所述的tigit结合剂及异质二聚体剂的一个臂包含免疫反应刺激剂。如本文所使用的词句〝免疫反应刺激剂〞是以最广义使用且是指藉由诱发免疫系统组分中的任一者活化或增加免疫系统组分中的任一者的活性而直接或间接刺激免疫系统的物质。例如,免疫反应刺激剂可包括细胞激素,以及各种抗原,包括肿瘤抗原及源自病原体的抗原。在一些实施方案中,第二免疫治疗剂(例如免疫反应刺激剂)包括但不限于集落刺激因子(例如颗粒细胞-巨噬细胞集落刺激因子(gm-csf)、巨噬细胞集落刺激因子(m
‑ꢀ
csf)、颗粒细胞集落刺激因子(g-csf)、干细胞因子 (scf))、白介素(例如il-1、il2、il-3、il-7、il-12、il
‑ꢀ
15、il-18)、细胞激素(例如γ-干扰素)、阻断免疫抑制功能的抗体(例如抗ctla4抗体、抗cd28抗体、抗pd-1 抗体、抗pd-l1抗体)、toll样受体(例如tlr4、tlr7、 tlr9)或b7家族成员(例如cd80、cd86)。在一些实施方案中,免疫治疗剂包括但不限于促效剂抗体(例如抗gitr 抗体、抗ox40抗体)或促效剂配体(例如gitrl或 ox40l)。
192.在一些实施方案中,tigit结合剂为异质二聚体分子(例如双特异性剂),其包含第一ch3结构域及第二 ch3结构域,各结构域经修饰以促进异质多聚体的形成。在一些实施方案中,第一及第二ch3结构域是使用突起进入孔中技术修饰。在一些实施方案中,第一及第二ch3 结构域包含导致静电交互作用改变的氨基酸变化。在一些实施方案中,第一及第二ch3结构域包含导致疏水性/亲水性交互作用改变的氨基酸变化。
193.在一些实施方案中,tigit结合剂为双特异性剂,其包含选自由下列所组成的群组的重链恒定区:(a)第一人类igg1恒定区,其中对应于igg1(seq id no:41) 的位置253和292的氨基酸经谷氨酸或天冬氨酸取代,及第二人类igg1恒定区,其中对应于igg1(seq id no:41)的位置240和282的氨基酸经赖氨酸取代;(b)第一人类igg2恒定区,其中对应于igg2
278上的氨基酸取代的第二人类igg2恒定区,其中氨基酸经赖氨酸取代。
197.在一些实施方案中,tigit结合剂为双特异性剂,其包含seq id no:45的重链恒定区。在一些实施方案中,tigit结合剂为双特异性抗体,其包含seq idno:46的重链恒定区。在一些实施方案中,tigit结合剂为双特异性抗体,其包含seq id no:47的重链恒定区。在一些实施方案中,tigit结合剂为双特异性抗体,其包含seq id no:48的重链恒定区。在一些实施方案中,tigit结合剂为双特异性抗体,其包含seq id no: 45的第一重链恒定区及seq id no:46的第二重链恒定区。在一些实施方案中,tigit结合剂为双特异性抗体,其包含seq id no:47的第一重链恒定区及seq idno:48的第二重链恒定区。
198.在一些实施方案中,tigit结合剂为双特异性剂,其包含seq id no:49的重链恒定区。在一些实施方案中,tigit结合剂为双特异性抗体,其包含seq idno:50的重链恒定区。在一些实施方案中,tigit结合剂为双特异性抗体,其包含seq id no:51的重链恒定区。在一些实施方案中,tigit结合剂为双特异性抗体,其包含seq id no:52的重链恒定区。在一些实施方案中,tigit结合剂为双特异性抗体,其包含seq id no: 49的第一重链恒定区及seq id no:50的第二重链恒定区。在一些实施方案中,tigit结合剂为双特异性抗体,其包含seq id no:51的第一重链恒定区及seq idno:52的第二重链恒定区。
199.在一些实施方案中,tigit结合剂为双特异性抗体,其包含特异性结合人类tigit的第一抗原结合部位。在一些实施方案中,tigit结合剂为双特异性抗体,其包含特异性结合人类tigit的第一抗原结合部位及结合第二标靶的第二抗原结合部位。在一些实施方案中, tigit结合剂为双特异性抗体,其包含:特异性结合人类 tigit的第一抗原结合部位,其中第一抗原结合部位包含:包含gsslsssyms(seq id no:7)或gfslsssyms (seq id no:13)的重链cdr1、包含 iigsngntyyanwakg(seq id no:8)的重链cdr2及包含ggyrtsgmdp(seq id no:9)的重链cdr3。在一些实施方案中,tigit结合剂为双特异性抗体,其包含:特异性结合人类tigit的第一抗原结合部位,其中第一抗原结合部位包含:包含gsslsssyms(seq id no:7)的重链cdr1、包含iigsngntyyanwakg(seq id no: 8)的重链cdr2及包含ggyrtsgmdp(seq id no:9)的重链cdr3。在一些实施方案中,tigit结合剂为双特异性抗体,其包含:特异性结合人类tigit的第一抗原结合部位,其中第一抗原结合部位包含:包含gfslsssyms (seq id no:13)的重链cdr1、包含 iigsngntyyanwakg(seq id no:8)的重链cdr2及包含ggyrtsgmdp(seq id no:9)的重链cdr3。在一些实施方案中,tigit结合剂为双特异性抗体,其包含:特异性结合人类tigit的第一抗原结合部位,其中第一抗原结合部位包含(a)包含gsslsssyms(seq id no:7)或 gfslsssyms(seq id no:13)的重链cdr1、包含 iigsngntyyanwakg(seq id no:8)的重链cdr2及包含ggyrtsgmdp(seq id no:9)的重链cdr3;及(b) 第二抗原结合部位,其中第一抗原结合部位及第二抗原结合部位包含共同的(亦即相同的)轻链。在一些实施方案中,tigit结合剂为双特异性抗体,其包含:特异性结合人类tigit的第一抗原结合部位,其中第一抗原结合部位包含(a)包含gsslsssyms(seq id no:7)或 gfslsssyms(seq id no:13)的重链cdr1、包含 iigsngntyyanwakg(seq id no:8)的重链cdr2及包含ggyrtsgmdp(seq id no:9)的重链cdr3;包含 qasqsissylnw(seq id no:10)、qasqsniysdlaw (seq id no:14)或qasqniysdlaw(seq id no:81) 的轻链cdr1、包含dalklas(seq id no:11)或 rastlas(seq id no:15)的轻链cdr2及包含 qqehsvgnvdn(seq id no:12)或qqehlvawiyn (seq id no:16)的轻链cdr3;及(b)第二抗原结合部位。在
一些实施方案中,双特异性抗体包含第一抗原结合部位,该第一抗原结合部位包含:包含qasqsissylnw (seq id no:10)、qasqsniysdlaw(seq id no:14) 或qasqniysdlaw(seq id no:81)的轻链cdr1、包含dalklas(seq id no:11)或rastlas(seq idno:15)的轻链cdr2及包含qqehsvgnvdn(seq idno:12)或qqehlvawiyn(seq id no:16)的轻链 cdr3。
200.在一些实施方案中,tigit结合剂为双特异性抗体,其包含与seq id no:17、seq id no:19或seqid no:32具有至少约80%的序列一致性的第一重链可变区。在特定的实施方案中,tigit结合剂为双特异性抗体,其包含与seq id no:17、seq id no:19或seqid no:32具有至少约85%,至少约90%,至少约95%,至少约97%或至少约99%的序列一致性的第一重链可变区。在一些实施方案中,双特异性抗体包含与seq idno:18或seq id no:20具有至少约80%的序列一致性的轻链可变区。在一些实施方案中,双特异性抗体包含与 seq id no:18或seq id no:20具有至少约85%,至少约90%,至少约95%,至少约97%或至少约99%的序列一致性的轻链可变区。在一些实施方案中,tigit结合剂为包含第一重链可变区的双特异性抗体,该第一重链可变区包含seq id no:17。在一些实施方案中,tigit结合剂为包含第一重链可变区的双特异性抗体,该第一重链可变区包含seq id no:19。在一些实施方案中,tigit结合剂为包含第一重链可变区的双特异性抗体,该第一重链可变区包含seq id no:32。在一些实施方案中,tigit 结合剂为包含第一轻链可变区的双特异性抗体,该第一轻链可变区包含seq id no:18。在一些实施方案中, tigit结合剂为包含第一轻链可变区的双特异性抗体,该第一轻链可变区包含seq id no:20。
201.在一些实施方案中,tigit结合剂为双特异性抗体,其包含第一重链可变区和第一重链恒定区,该第一重链可变区包含seq id no:17且该第一重链恒定区包含seq id no:45、seq id no:46、seq id no:47、 seq id no:48、seq id no:49、seq id no:50、 seq id no:51或seq id no:52。在一些实施方案中, tigit结合剂为双特异性抗体,其包含第一重链可变区和第一重链恒定区,该第一重链可变区包含seq id no:19 且该第一重链恒定区包含seq id no:45、seq id no: 46、seq id no:47、seq id no:48、seq id no: 49、seq id no:50、seq id no:51或seq id no: 52。在一些实施方案中,tigit结合剂为双特异性抗体,其包含第一重链可变区和第一重链恒定区,该第一重链可变区包含seq id no:32且该第一重链恒定区包含seqid no:45、seq id no:46、seq id no:47、seq idno:48、seq id no:49、seq id no:50、seq idno:51或seq id no:52。
202.在一些实施方案中,tigit结合剂为双特异性抗体,其包含特异性结合人类tigit的第一抗原结合部位。在一些实施方案中,tigit结合剂为双特异性抗体,其包含特异性结合人类tigit的第一抗原结合部位及结合第二标靶的第二抗原结合部位。在一些实施方案中, tigit结合剂为双特异性抗体,其包含:特异性结合人类 tigit的第一抗原结合部位,其中第一抗原结合部位包含:包含tsdyawn(seq id no:57)的重链cdr1、包含yisysgstsynpslrs(seq id no:58)的重链cdr2 及包含arrqvglgfay(seq id no:59)的重链cdr3。在一些实施方案中,tigit结合剂为双特异性抗体,其包含:特异性结合人类tigit的第一抗原结合部位,其中第一抗原结合部位包含(a)包含tsdyawn(seq id no:57) 的重链cdr1、包含yisysgstsynpslrs(seq id no: 58)的重链cdr2及包含arrqvglgfay(seq id no: 59)的重链cdr3;及(b)第二抗原结合部位,其中第一抗原结合部位及第二抗原结合部位包含共同的(亦即相同的) 轻链。在一些实施方案中,tigit结合剂为双特异性抗体,其包
含:特异性结合人类tigit的第一抗原结合部位,其中第一抗原结合部位包含(a)包含tsdyawn(seqid no:57的重链cdr1、包含yisysgstsynpslrs (seq id no:58)的重链cdr2及包含arrqvglgfay (seq id no:59)的重链cdr3;包含kasqdvstava (seq id no:60)的轻链cdr1、包含sasyryt(seq idno:61)的轻链cdr2及包含qqhystp(seq id no:62) 的轻链cdr3;及(b)第二抗原结合部位。在一些实施方案中,双特异性抗体包含第一抗原结合部位,其包含:包含 kasqdvstava(seq id no:60)的轻链cdr1、包含 sasyryt(seq id no:61)的轻链cdr2及包含 qqhystp(seq id no:62)的轻链cdr3。
203.在一些实施方案中,tigit结合剂为双特异性抗体,其包含与seq id no:63或seq id no:67具有至少约80%的序列一致性的第一重链可变区。在特定的实施方案中,tigit结合剂为双特异性抗体,其包含与seqid no:63或seq id no:67具有至少约85%,至少约 90%,至少约95%,至少约97%或至少约99%的序列一致性的第一重链可变区。在一些实施方案中,双特异性抗体包含与seq id no:64或seq id no:68具有至少约 80%的序列一致性的轻链可变区。在一些实施方案中,双特异性抗体包含与seq id no:64或seq id no:68具有至少约85%,至少约90%,至少约95%,至少约97%或至少约99%的序列一致性的轻链可变区。在一些实施方案中,tigit结合剂为包含第一重链可变区的双特异性抗体,该第一重链可变区包含seq id no:63。在一些实施方案中,tigit结合剂为包含第一重链可变区的双特异性抗体,该第一重链可变区包含seq id no:67。在一些实施方案中,tigit结合剂为包含第一轻链可变区的双特异性抗体,该第一轻链可变区包含seq id no:64。在一些实施方案中,tigit结合剂为包含第一轻链可变区的双特异性抗体,该第一轻链可变区包含seq id no:68。
204.在一些实施方案中,tigit结合剂为双特异性抗体,其包含第一重链可变区和第一重链恒定区,该第一重链可变区包含seq id no:63且该第一重链恒定区包含seq id no:45、seq id no:46、seq id no:47、 seq id no:48、seq id no:49、seq id no:50、 seq id no:51或seq id no:52。在一些实施方案中, tigit结合剂为双特异性抗体,其包含第一重链可变区和第一重链恒定区,该第一重链可变区包含seq id no:67 的第一重链可变区且该第一重链恒定区包含seq id no: 45、seq id no:46、seq id no:47、seq id no: 48、seq id no:49、seq id no:50、seq id no:51 或seq id no:52。
205.在特定的实施方案中,tigit结合剂为特异性结合人类tigit及第二标靶的双特异性抗体。在一些实施方案中,第二标靶为肿瘤抗原。在一些实施方案中,双特异性抗体包含本文所述的tigit结合剂及包含特异性结合肿瘤抗原的抗体的第二多肽。对肿瘤抗原具有结合特异性的双特异性抗体可用于引导tigit结合剂至肿瘤。这可有用于诱发及/或增强肿瘤微环境附近或内的肿瘤反应。在一些实施方案中,双特异性抗体可用于诱发或增强肿瘤浸润免疫细胞的活性。在一些实施方案中,双特异性抗体可用于诱发或增强肿瘤浸润淋巴细胞(til)的活性。在一些实施方案中,双特异性抗体可用于抑制或降低treg细胞活性。在一些实施方案中,双特异性抗体可用于抑制或降低msdc活性。
206.在一些实施方案中,tigit结合剂为双特异性抗体,其中第一标靶为tigit及第二标靶在免疫反应细胞上。在一些实施方案中,第二标靶在t细胞、nk细胞、 b细胞、巨噬细胞、树状细胞或骨髓细胞上。在一些实施方案中,第二标靶为pd-1、pd-l1、ctla4、tim-3、 lag-3、gitr、ox-40、gitrl或ox-40l。在一些实施方案中,第二标靶为cd28或4-1bb。
207.在一些实施方案中,双特异性抗体包含第一臂和第二臂,该第一臂包含本文所述的tigit结合剂且该第二臂包含特异性结合pd-1的抗体。在一些实施方案中,双特异性抗体包含第一臂和第二臂,该第一臂包含本文所述的tigit结合剂且该第二臂包含特异性结合pd-l1 的抗体。在一些实施方案中,双特异性抗体包含第一臂和第二臂,该第一臂包含本文所述的tigit结合剂且该第二臂包含特异性结合gitr的抗体。在一些实施方案中,双特异性抗体包含第一臂和第二臂,该第一臂包含本文所述的tigit结合剂且该第二臂包含特异性结合ox-40的抗体。在一些实施方案中,双特异性抗体包含第一臂和第二臂,该第一臂包含本文所述的tigit结合抗体且该第二臂包含特异性结合cd40的抗体。在一些实施方案中,双特异性抗体包含第一臂和第二臂,该第一臂包含本文所述的 tigit结合剂且该第二臂包含特异性结合ctla4的抗体。在一些实施方案中,双特异性抗体包含第一臂和第二臂,该第一臂包含本文所述的tigit结合抗体且该第二臂包含特异性结合cd28的抗体。在一些实施方案中,双特异性抗体包含第一臂和第二臂,该第一臂包含本文所述的 tigit结合剂且该第二臂包含特异性结合gitrl的抗体。在一些实施方案中,双特异性抗体包含第一臂和第二臂,该第一臂包含本文所述的tigit结合剂且该第二臂包含特异性结合ox-40l的抗体。
208.在一些实施方案中,tigit结合剂为双特异性抗体,其包含来自抗tigit抗体313r11的重链可变区。在一些实施方案中,tigit结合剂为双特异性抗体,其包含来自抗tigit抗体313r12的重链可变区。在一些实施方案中,tigit结合剂为双特异性抗体,其包含来自抗 tigit抗体313r14的重链可变区。在一些实施方案中, tigit结合剂为双特异性抗体,其包含来自抗tigit抗体 313r19或313r20的重链可变区。在一些实施方案中, tigit结合剂为双特异性抗体,其包含来自抗tigit抗体 313r11或313r12的轻链可变区。在一些实施方案中, tigit结合剂为双特异性抗体,其包含来自抗tigit抗体 313r14、313r19或313r20的轻链可变区。
209.在一些实施方案中,tigit结合剂为双特异性抗体,其包含来自抗tigit抗体313m26的重链可变区。在一些实施方案中,tigit结合剂为双特异性抗体,其包含来自抗tigit抗体313m26的轻链可变区。
210.在一些实施方案中,tigit结合剂为双特异性抗体,其包含来自抗tigit抗体313m32的重链可变区。在一些实施方案中,tigit结合剂为双特异性抗体,其包含来自抗tigit抗体313m32的轻链可变区。
211.在一些实施方案中,双特异性剂包含第一臂和第二臂,该第一臂包含本文所述的tigit结合剂且该第二臂包含多肽,该多肽包含特异性结合gitr的gitrl。在一些实施方案中,第二臂包含多肽,该多肽包含gitrl 的至少一个复制的细胞外结构域。在一些实施方案中,双特异性剂包含第一臂和第二臂,该第一臂包含本文所述的 tigit结合剂且该第二臂包含多肽,该多肽包含特异性结合ox-40的ox-40l。在一些实施方案中,第二臂包含多肽,该多肽包含ox-40l的至少一个复制的细胞外结构域。在一些实施方案中,双特异性剂包含第一臂和第二臂,该第一臂包含本文所述的tigit结合剂且该第二臂包含多肽,该多肽包含特异性结合cd40的cd40l。在一些实施方案中,第二臂包含多肽,该多肽包含cd40l的至少一个复制的细胞外结构域。在一些实施方案中,双特异性剂包含第一臂和第二臂,该第一臂包含本文所述的 tigit结合剂且该第二臂包含多肽,该多肽包含特异性结合4-1bb的4-1bb配体。在一些实施方案中,第二臂包含多肽,该多肽包含4-1bb配体的至少一个复制的细胞外
结构域。
212.在一些实施方案中,tigit结合剂为双特异性剂,其以约50nm或更小,约25nm或更小,约10nm或更小,约1nm或更小或约0.1nm或更小的kd结合 tigit。在一些实施方案中,tigit结合剂为双特异性剂,其以约50nm或更小,约25nm或更小,约10nm或更小,约1nm或更小或约0.1nm或更小的kd结合第二标靶。在一些实施方案中,tigit结合剂为双特异性剂,其以约50nm或更小的kd结合tigit及以约50nm或更小的kd结合第二标靶。在一些实施方案中,tigit结合剂为双特异性剂,其以约25nm或更小的kd结合tigit及以约25nm或更小的kd结合第二标靶。在一些实施方案中,tigit结合剂为双特异性剂,其以约10nm或更小的 kd结合tigit及以约10nm或更小的kd结合第二标靶。在一些实施方案中,tigit结合剂为双特异性剂,其以约 1nm或更小的kd结合tigit及以约1nm或更小的kd结合第二标靶。
213.在一些实施方案中,tigit结合剂为双特异性剂,其包含一个具有结合亲和性比第二抗原结合部位的结合亲和性更弱的抗原结合部位。例如,在一些实施方案中,双特异性剂可以从约0.1nm至1nm的范围内的kd结合tigit及可以从约1nm至10nm的范围内的kd结合第二标靶。或者,双特异性剂可以从约1nm至10nm的范围内的kd结合tigit及可以从约0.1nm至1nm的范围内的 kd结合第二标靶。在一些实施方案中,双特异性剂可以从约0.1nm至1nm的范围内的kd结合tigit及可以从约 1nm至10nm的范围内的kd结合第二标靶。或者,双特异性剂可以从约1nm至10nm的范围内的kd结合tigit 及可以从约0.1nm至1nm的范围内的kd结合第二标靶。在一些实施方案中,在两个抗原结合部位之间的亲和性差异可为约2倍或更高,约3倍或更高,约5倍或更高,约 8倍或更高,约10倍或更高,约15倍或更高,约30倍或更高,约50倍或更高或约100倍或更高。在一些实施方案中,将用于tigit的抗原结合部位的至少一个cdr 中的至少一个氨基酸残基以不同的氨基酸取代,使得tigit结合部位的亲和性改变。在一些实施方案中,使 tigit结合部位的亲和性增加。在一些实施方案中,使 tigit结合部位的亲和性降低。在一些实施方案中,将用于第二标靶抗原结合部位的至少一个cdr中的至少一个氨基酸残基以不同的氨基酸取代,使得第二抗原结合部位的亲和性改变。在一些实施方案中,使第二抗原结合部位的亲和性增加。在一些实施方案中,使第二抗原结合部位的亲和性降低。在一些实施方案中,使tigit及第二抗原结合部位二者的亲和性改变。
214.本发明提供特异性结合tigit的多肽,其包括但不限于抗体。在一些实施方案中,多肽结合人类 tigit。在一些实施方案中,多肽结合小鼠tigit。在一些实施方案中,多肽结合小鼠tigit及人类tigit。在一些实施方案中,多肽结合人类tigit及不结合小鼠 tigit。在一些实施方案中,多肽结合人类tigit及不结合大鼠tigit。在一些实施方案中,多肽结合人类tigit 及不结合兔子tigit。在一些实施方案中,多肽结合人类 tigit及不结合狨猴tigit。在一些实施方案中,多肽结合人类tigit及不结合狗tigit。在一些实施方案中,多肽结合人类tigit及不结合猪tigit。在一些实施方案中,多肽结合人类tigit及不结合食蟹猕猴tigit。在一些实施方案中,多肽结合人类tigit及不结合恒河猴 tigit。
215.在特定的实施方案中,多肽包含抗体313r11、313r12、313r14或313r19的cdr中的一、二、三、四、五及/或六者(参见本文表1)。抗体313r20 包含与抗体313r19相同的cdr及重链和轻链可变结构域,但是313r20包含igg4形式。在一些实施方案中,多肽包含每一cdr具有至多4个(亦即0、1、2、3或4)氨基酸取代的cdr。在特定的实施方案中,重链cdr容纳在重链可变区内。在特定的实施方案中,轻链cdr容纳在轻链可变区内。
216.在一些实施方案中,本发明提供特异性结合 tigit的多肽,其中多肽包含与seq id no:17、seq idno:19或seq id no:32具有至少约80%的序列一致性的氨基酸序列及/或与seq id no:18或seq id no:20 具有至少约80%的序列一致性的氨基酸序列。在特定的实施方案中,多肽包含与seq id no:17、seq id no:19 或seq id no:32具有至少约85%,至少约90%,至少约95%,至少约97%或至少约99%的序列一致性的氨基酸序列。在特定的实施方案中,多肽包含与seq id no:18 或seq id no:20具有至少约85%,至少约90%,至少约95%,至少约97%或至少约99%的序列一致性的氨基酸序列。在特定的实施方案中,多肽包含与seq id no: 17、seq id no:19或seq id no:32具有至少约95%的序列一致性的氨基酸序列及/或与seq id no:18或 seq id no:20具有至少约95%的序列一致性的氨基酸序列。在特定的实施方案中,多肽包含:包含seq id no:17的氨基酸序列及/或包含seq id no:18的氨基酸序列。在特定的实施方案中,多肽包含:包含seq id no: 19的氨基酸序列及/或包含seq id no的氨基酸序列: 20。在特定的实施方案中,多肽包含:包含seq id no: 32的氨基酸序列及/或包含seq id no:20的氨基酸序列。
217.在一些实施方案中,多肽包含:包含seq idno:17、seq id no:18、seq id no:19、seq idno:20及/或seq id no:32的氨基酸序列。如本文所定义,多肽可以单链或二或更多个缔合链出现。在特定的实施方案中,多肽包含:包含seq id no:17的氨基酸序列及包含seq id no:18的氨基酸序列。在特定的实施方案中,多肽包含:包含seq id no:19的氨基酸序列及包含seq id no:20的氨基酸序列。在特定的实施方案中,多肽包含:包含seq id no:32的氨基酸序列及包含seq id no:20的氨基酸序列。在特定的实施方案中,多肽包含基本上由seq id no:17所组成的氨基酸序列及基本上由seq id no:18所组成的氨基酸序列。在特定的实施方案中,多肽包含基本上由seq idno:19所组成的氨基酸序列及及基本上由seq id no: 20所组成的氨基酸序列。在特定的实施方案中,多肽包含基本上由seq id no:32所组成的氨基酸序列及基本上由seq id no:20所组成的氨基酸序列。在特定的实施方案中,多肽包含基本上由seq id no:17所组成的氨基酸序列及基本上由seq id no:18所组成的氨基酸序列。在特定的实施方案中,多肽包含基本上由seq idno:19所组成的氨基酸序列及基本上由seq id no:20 所组成的氨基酸序列。在特定的实施方案中,多肽包含基本上由seq id no:32所组成的氨基酸序列及基本上由 seq id no:20所组成的氨基酸序列。
218.在一些实施方案中,多肽包含:包含seq idno:21、seq id no:22、seq id no:23、seq idno:24、seq id no:25、seq id no:26、seq idno:27、seq id no:28、seq id no:29、seq idno:30、seq id no:33、seq id no:34、seq idno:55及/或seq id no:56的氨基酸序列。在特定的实施方案中,多肽包含:包含seq id no:21的氨基酸序列及包含seq id no:23的氨基酸序列。在特定的实施方案中,多肽包含:包含seq id no:22的氨基酸序列及包含seq id no:23的氨基酸序列。在特定的实施方案中,多肽包含:包含seq id no:24的氨基酸序列及包含seq id no:25的氨基酸序列。在特定的实施方案中,多肽包含:包含seq id no:33的氨基酸序列及包含seq id no:25的氨基酸序列。在特定的实施方案中,多肽包含:包含seq id no:55的氨基酸序列及包含seq id no:25的氨基酸序列。在特定的实施方案中,多肽包含:包含seq id no:26的氨基酸序列及包含seq id no:28的氨基酸序列。在特定的实施方案中,多肽包含:包含seq id no:27的氨基酸序列及包含seq id no:28的氨基酸序列。在特定的实施方案中,多肽包含:包含seq id no:29的氨基酸序列及包含seq id no:
30的氨基酸序列。在特定的实施方案中,多肽包含:包含seq id no:34的氨基酸序列及包含seq id no:30的氨基酸序列。在特定的实施方案中,多肽包含:包含seq id no:56的氨基酸序列及包含seq id no:30的氨基酸序列。
219.在一些实施方案中,tigit结合剂包含多肽,其包含选自由下列所组成的群组的序列:seq id no: 17、seq id no:18、seq id no:19、seq id no: 20、seq id no:26、seq id no:27、seq id no: 28、seq id no:29、seq id no:30、seq id no: 32、seq id no:34和seq id no:56。
220.在特定的实施方案中,多肽包含:包含由 seq id no:21所组成的氨基酸序列及包含由seq idno:23所组成的氨基酸序列。在特定的实施方案中,多肽包含:包含由seq id no:22所组成的氨基酸序列及包含由seq id no:23所组成的氨基酸序列。在特定的实施方案中,多肽包含:包含由seq id no:24所组成的氨基酸序列及包含由seq id no:25所组成的氨基酸序列。在特定的实施方案中,多肽包含:包含由seq idno:33所组成的氨基酸序列及包含由seq id no:25所组成的氨基酸序列。在特定的实施方案中,多肽包含:包含由seq id no:55所组成的氨基酸序列及包含由seqid no:25所组成的氨基酸序列。在特定的实施方案中,多肽包含:包含由seq id no:26所组成的氨基酸序列及包含由seq id no:28所组成的氨基酸序列。在特定的实施方案中,多肽包含:包含由seq id no:27所组成的氨基酸序列及包含由seq id no:28所组成的氨基酸序列。在特定的实施方案中,多肽包含:包含由seqid no:29所组成的氨基酸序列及包含由seq id no:30 所组成的氨基酸序列。在特定的实施方案中,多肽包含:包含由seq id no:34所组成的氨基酸序列及包含由 seq id no:30所组成的氨基酸序列。在特定的实施方案中,多肽包含:包含由seq id no:56所组成的氨基酸序列及包含由seq id no:30所组成的氨基酸序列。
221.在特定的实施方案中,多肽包含抗体313m26 或313m32的cdr中的一、二、三、四、五及/或六者(参见本文表2)。在一些实施方案中,多肽包含每一cdr具有至多4个(亦即0、1、2、3或4)氨基酸取代的cdr。在特定的实施方案中,重链cdr容纳在重链可变区内。在特定的实施方案中,轻链cdr容纳在轻链可变区内。
222.在一些实施方案中,本发明提供特异性结合 tigit的多肽,其中多肽包含与seq id no:63或seqid no:67具有至少约80%的序列一致性的氨基酸序列及 /或与seq id no:64或seq id no:68具有至少约80%的序列一致性的氨基酸序列。在特定的实施方案中,多肽包含与seq id no:63或seq id no:67具有至少约 85%,至少约90%,至少约95%,至少约97%或至少约 99%的序列一致性的氨基酸序列。在特定的实施方案中,多肽包含与seq id no:64或seq id no:68具有至少约85%,至少约90%,至少约95%,至少约97%或至少约 99%的序列一致性的氨基酸序列。在特定的实施方案中,多肽包含与seq id no:63或seq id no:167具有至少约95%的序列一致性的氨基酸序列及/或与seq id no: 64或seq id no:68具有至少约95%的序列一致性的氨基酸序列。在特定的实施方案中,多肽包含:包含seqid no:63的氨基酸序列及/或包含seq id no:64的氨基酸序列。在特定的实施方案中,多肽包含:包含seqid no:67的氨基酸序列及/或包含seq id no:68的氨基酸序列。
223.在一些实施方案中,多肽包含选自由下列所组成的群组的氨基酸序列:seq id no:63、seq idno:64、seq id no:67、seq id no:68、seq idno:69、seq id no:70、seq id no:71、seq idno:72及/或seq id no:82。如本文所定义,多肽可以单链或二或更多个缔合
链出现。在特定的实施方案中,多肽包含:包含seq id no:63的氨基酸序列及包含seqid no:64的氨基酸序列。在特定的实施方案中,多肽包含:包含seq id no:67的氨基酸序列及包含seq idno:68的氨基酸序列。在特定的实施方案中,多肽包含:包含seq id no:69的氨基酸序列及包含seq idno:71的氨基酸序列。在特定的实施方案中,多肽包含:包含seq id no:70的氨基酸序列及包含seq idno:72的氨基酸序列。在特定的实施方案中,多肽包含:包含seq id no:82的氨基酸序列及包含seq idno:72的氨基酸序列。
224.在特定的实施方案中,多肽包含由seq idno:63所组成的氨基酸序列及由seq id no:64所组成的氨基酸序列。在特定的实施方案中,多肽包含由seqid no:67所组成的氨基酸序列及由seq id no:68所组成的氨基酸序列。在特定的实施方案中,多肽包含由 seq id no:69所组成的氨基酸序列及由seq id no:71 所组成的氨基酸序列。在特定的实施方案中,多肽包含由 seq id no:70所组成的氨基酸序列及由seq id no:72 所组成的氨基酸序列。在特定的实施方案中,多肽包含由 seq id no:82所组成的氨基酸序列及由seq id no:72 所组成的氨基酸序列。
225.许多蛋白质(包括抗体)含有引导蛋白质运送至不同地区的信号序列。信号序列(又称信号肽或前导序列) 通常位于新生多肽的n端。这些信号序列靶定多肽至内质网且将蛋白质分类至它们的目的地,例如至胞器的内部空间、至细胞内膜、至细胞外膜或经由分泌至细胞外部。在蛋白质运送至内质网之后,大部分的信号序列是藉由信号肽酶与蛋白质切割。自多肽切割信号序列通常发生在氨基酸序列的特定部位,且取决于信号序列内的氨基酸残基而定。虽然通常有一个特定的切割部位,但是可藉由信号肽酶辨识及/或使用一个以上的切割部位,导致多肽的不均匀n端。例如,使用在信号序列内不同的切割部位可导致以不同的n端氨基酸表达的多肽。因此,在一些实施方案中,如本文所述的多肽可包含具有不同的n端的多肽的混合物。在一些实施方案中,n端的长度相差1、2、3、4 或5个氨基酸。在一些实施方案中,多肽为实质上均匀的,亦即多肽具有相同的n端。在一些实施方案中,与〝原生〞或〝亲代〞信号序列,多肽的信号序列包含一或多个(例如一、二、三、四、五、六、七、八、九、十等等)氨基酸取代及/或删除。在一些实施方案中,多肽的信号序列包含容许一个切割部位占优势的氨基酸取代及/或删除,由此导致具有一个n端的实质上均匀的多肽。在一些实施方案中,多肽的信号序列影响多肽的表达程度,例如增加表达或降低表达。
226.在特定的实施方案中,抗体与本文所述的 tigit结合剂竞争与tigit特异性结合。在一些实施方案中,抗体与tigit结合剂竞争与tigit特异性结合,该 tigit结合剂包含:(a)包含gsslsssyms(seq id no: 7)或gfslsssyms(seq id no:13)的重链cdr1、包含 iigsngntyyanwakg(seq id no:8)的重链cdr2及包含ggyrtsgmdp(seq id no:9)的重链cdr3;及(b) 包含qasqsissylnw(seq id no:10)、qasqsniysdlaw(seq id no:14)或qasqniysdlaw (seq id no:81)的轻链cdr1、包含dalklas(seq idno:11)或rastlas(seq id no:15)的轻链cdr2及包含qqehsvgnvdn(seq id no:12)或qqehlvawiyn (seq id no:16)的轻链cdr3。
227.在特定的实施方案中,抗体与tigit结合剂竞争与tigit特异性结合,该tigit结合剂包含:(a)包含seq id no:17、seq id no:19或seq id no:32 的重链可变区;及(b)包含seq id no:18或seq idno:20的轻链可变区。在特定的实施方案中,抗体与 tigit结合剂竞争与tigit特异性结合,该tigit结合剂包含重链可变区和轻链可变区,该重链可变区包
含seqid no:17且该轻链可变区包含seq id no:18。在特定的实施方案中,抗体与tigit结合剂竞争与tigit特异性结合,该tigit结合剂包含重链可变区和轻链可变区,该重链可变区包含seq id no:19且该轻链可变区包含 seq id no:20。在特定的实施方案中,抗体与tigit结合剂竞争与tigit特异性结合,该tigit结合剂包含重链可变区和轻链可变区,该重链可变区包含seq id no:32 且该轻链可变区包含seq id no:20。
228.在特定的实施方案中,抗体与tigit结合剂竞争与tigit特异性结合,该tigit结合剂包含:包含 seq id no:26、seq id no:27、seq id no:29、 seq id no:34或seq id no:56的重链及包含seq idno:28或seq id no:30的轻链。在特定的实施方案中,抗体与tigit结合剂竞争与tigit特异性结合,该 tigit结合剂包含重链和轻链,该重链包含seq id no: 26且该轻链包含seq id no:28。在特定的实施方案中,抗体与tigit结合剂竞争与tigit特异性结合,该 tigit结合剂包含重链和轻链,该重链包含seq id no: 27且该轻链包含seq id no:28。在特定的实施方案中,抗体与tigit结合剂竞争与tigit特异性结合,该 tigit结合剂包含重链和轻链,该重链包含seq id no: 29且该轻链包含seq id no:30。在特定的实施方案中,抗体与tigit结合剂竞争与tigit特异性结合,该 tigit结合剂包含重链和轻链,该重链包含seq id no: 34且该轻链包含seq id no:30。在一些实施方案中,抗体与tigit结合剂竞争与tigit特异性结合,该tigit 结合剂包含重链和轻链,该重链包含seq id no:56且该轻链包含seq id no:30。
229.在特定的实施方案中,抗体与抗体313r11竞争与tigit特异性结合。在特定的实施方案中,抗体与抗体313r12竞争与tigit特异性结合。在特定的实施方案中,抗体与抗体313r14竞争与人类tigit的特异性结合。在特定的实施方案中,抗体与抗体313r19竞争与人类tigit的特异性结合。在特定的实施方案中,抗体与抗体313r20竞争与人类tigit的特异性结合。
230.在一些实施方案中,抗体与参考抗体竞争与tigit特异性结合,其中参考抗体为抗体313r11。在一些实施方案中,抗体与参考抗体竞争与tigit特异性结合,其中参考抗体为抗体313r12。在一些实施方案中,抗体与参考抗体竞争与tigit特异性结合,其中参考抗体为抗体313r14。在一些实施方案中,抗体与参考抗体竞争与tigit特异性结合,其中参考抗体为抗体313r19。在一些实施方案中,抗体与参考抗体竞争与tigit特异性结合,其中参考抗体为抗体313r20。
231.在特定的实施方案中,抗体与本发明的tigit 结合剂结合tigit的相同的抗原决定区或基本上相同的抗原决定区。在特定的实施方案中,抗体与抗体313r11结合tigit的相同的抗原决定区或基本上相同的抗原决定区。在特定的实施方案中,抗体与抗体313r12结合 tigit的相同的抗原决定区或基本上相同的抗原决定区。在特定的实施方案中,抗体与抗体313r14结合tigit的相同的抗原决定区或基本上相同的抗原决定区。在特定的实施方案中,抗体与抗体313r19结合tigit的相同的抗原决定区或基本上相同的抗原决定区。在特定的实施方案中,抗体与抗体313r20结合tigit的相同的抗原决定区或基本上相同的抗原决定区。
232.在另一实施方案中,抗体结合tigit的抗原决定区,其与本发明的tigit结合剂结合的tigit的抗原决定区重叠。在一些实施方案中,抗体结合tigit的抗原决定区,其与抗体313r11结合的tigit的抗原决定区重叠。在另一实施方案中,抗体结合tigit的抗原决定区,
其与抗体313r12结合的tigit的抗原决定区重叠。在一些实施方案中,抗体结合tigit的抗原决定区,其与抗体 313r14结合的tigit的抗原决定区重叠。在特定的实施方案中,抗体结合tigit的抗原决定区,其与抗体 313r19结合的tigit的抗原决定区重叠。在特定的实施方案中,抗体结合tigit的抗原决定区,其与抗体 313r20结合的tigit的抗原决定区重叠。
233.在特定的实施方案中,抗体与本文所述的 tigit结合剂竞争与tigit特异性结合。在一些实施方案中,抗体与tigit结合剂竞争与tigit特异性结合,该 tigit结合剂包含:(a)包含tsdyawn(seq id no:57) 的重链cdr1、包含yisysgstsynpslrs(seq id no: 58)的重链cdr2及包含arrqvglgfay(seq id no: 59)的重链cdr3;及(b)包含kasqdvstava(seq idno:60)的轻链cdr1、包含sasyryt(seq id no:61) 的轻链cdr2及包含qqhystp(seq id no:62)的轻链 cdr3。
234.在特定的实施方案中,抗体与tigit结合剂竞争与tigit特异性结合,该tigit结合剂包含(a)包含seq id no:63或seq id no:67的重链可变区,及(b) 包含seq id no:64或seq id no:68的轻链可变区。在特定的实施方案中,抗体与tigit结合剂竞争与tigit 特异性结合,该tigit结合剂包含重链可变区和轻链可变区,该重链可变区包含seq id no:63且该轻链可变区包含seq id no:64。在特定的实施方案中,抗体与 tigit结合剂竞争与tigit特异性结合,该tigit结合剂包含重链可变区和轻链可变区,该重链可变区包含seqid no:167且该轻链可变区包含seq id no:68。在特定的实施方案中,抗体与tigit结合剂竞争与tigit特异性结合,该tigit结合剂包含重链和轻链,该重链包含 seq id no:70且该轻链包含seq id no:72。在特定的实施方案中,抗体与tigit结合剂竞争与tigit特异性结合,该tigit结合剂包含重链和轻链,该重链包含seqid no:82且该轻链包含seq id no:72。
235.在特定的实施方案中,抗体与抗体313m26竞争与tigit特异性结合。在特定的实施方案中,抗体与抗体313m32竞争与tigit特异性结合。在特定的实施方案中,抗体与抗体313m32竞争与人类tigit的特异性结合。在一些实施方案中,抗体与参考抗体竞争与tigit特异性结合,其中参考抗体为抗体313m26。在一些实施方案中,抗体与参考抗体竞争与tigit特异性结合,其中参考抗体为抗体313m32。在一些实施方案中,抗体与参考抗体竞争与人类tigit的特异性结合,其中参考抗体为抗体313m32。
236.在特定的实施方案中,抗体与本文所述的 tigit结合剂结合tigit的相同的抗原决定区或基本上相同的抗原决定区。在特定的实施方案中,抗体与抗体313m26结合tigit的相同的抗原决定区或基本上相同的抗原决定区。在特定的实施方案中,抗体与抗体313m32 结合tigit的相同的抗原决定区或基本上相同的抗原决定区。在特定的实施方案中,抗体与抗体313m32结合人类 tigit的相同的抗原决定区或基本上相同的抗原决定区。
237.在另一实施方案中,抗体结合tigit的抗原决定区,其与本文所述的tigit结合剂结合的tigit的抗原决定区重叠。在一些实施方案中,抗体结合tigit的抗原决定区,其与抗体313m26结合的tigit的抗原决定区重叠。在另一实施方案中,抗体结合tigit的抗原决定区,其与抗体313m32结合的tigit的抗原决定区重叠。在另一实施方案中,抗体结合tigit的抗原决定区,其与抗体313m32结合的人类tigit的抗原决定区重叠。
238.在一些实施方案中,抗体与本文所述的tigit 结合剂竞争与抗原决定区的结合,该抗原决定区包含在 seq id no:79内的氨基酸。在一些实施方案中,抗体与本文所述的tigit结合剂竞争与抗原决定区的结合,该抗原决定区包含在seq id no:80内的氨基酸。在
一些实施方案中,抗体与本文所述的tigit结合剂竞争与抗原决定区的结合,该抗原决定区包含在seq id no:79及 seq id no:80内的氨基酸。在一些实施方案中,抗体与本文所述的tigit结合剂竞争与抗原决定区的结合,该抗原决定区包含seq id no:4的氨基酸q62和i109。在一些实施方案中,抗体与本文所述的tigit结合剂竞争与抗原决定区的结合,该抗原决定区包含seq id no:4的氨基酸q62和t119。在一些实施方案中,抗体与本文所述的tigit结合剂竞争与抗原决定区的结合,该抗原决定区包含seq id no:4的氨基酸q64和i109。在一些实施方案中,抗体与本文所述的tigit结合剂竞争与抗原决定区的结合,该抗原决定区包含seq id no:4的氨基酸q64 和t119。在一些实施方案中,抗体与本文所述的tigit 结合剂竞争与抗原决定区的结合,该抗原决定区包含seqid no:4的氨基酸q62、q64和i109。在一些实施方案中,抗体与本文所述的tigit结合剂竞争与抗原决定区的结合,该抗原决定区包含seq id no:4的氨基酸q62、 q64和t119。在一些实施方案中,抗体与本文所述的 tigit结合剂竞争与抗原决定区的结合,该抗原决定区包含seq id no:4的氨基酸q62、i109和t119。在一些实施方案中,抗体与本文所述的tigit结合剂竞争与抗原决定区的结合,该抗原决定区包含seq id no:4的氨基酸 q64、i109和t119。在一些实施方案中,抗体与本文所述的tigit结合剂竞争与抗原决定区的结合,该抗原决定区包含seq id no:4的氨基酸q62、q64、i109和t119。在一些实施方案中,抗体与本文所述的tigit结合剂竞争与抗原决定区的结合,该抗原决定区包含至少一种选自由下列所组成的群组:seq id no:4的氨基酸n58、e60、 q62、q64、l65、f107、i109、h111、t117、t119、 g120和r121。
239.在特定的实施方案中,本文所述的tigit结合剂(例如抗体)结合tigit及调节tigit活性。在一些实施方案中,tigit结合剂为tigit拮抗剂且降低tigit活性。在特定的实施方案中,tigit结合剂抑制至少约 10%,至少约20%,至少约30%,至少约50%,至少约 75%,至少约90%或约100%的tigit活性。在特定的实施方案中,抑制tigit活性的tigit结合剂为抗体 313r11、抗体313r12、抗体313r14、抗体313r19、或抗体313r20。在特定的实施方案中,抑制人类tigit活性的tigit结合剂为抗体313r11、抗体313r12、抗体 313r14、抗体313r19、或抗体313r20的人源化版本 (version)。在特定的实施方案中,抑制tigit活性的 tigit结合剂为抗体313m26或抗体313m32。在特定的实施方案中,抑制人类tigit活性的tigit结合剂为抗体 313m26(例如抗体313m32)的人源化版本。在特定的实施方案中,抑制tigit活性的tigit结合剂为抗体 313m32。
240.在一些实施方案中,本文所述的tigit结合剂结合tigit及抑制或降低tigit传导信号。在特定的实施方案中,tigit结合剂(例如抗体)抑制至少约10%,至少约20%,至少约30%,至少约50%,至少约75%,至少约90%或约100%的tigit传导信号。在一些实施方案中,tigit结合剂抑制小鼠tigit传导信号。在一些实施方案中,tigit结合剂抑制人类tigit传导信号。在一些实施方案中,tigit结合剂抑制小鼠及人类tigit传导信号。在特定的实施方案中,抑制tigit传导信号的tigit 结合剂为抗体313r11、抗体313r12、抗体313r14、抗体 313r19或抗体313r20。在特定的实施方案中,抑制 tigit传导信号的tigit结合剂为抗体313m26或抗体 313m32。在特定的实施方案中,抑制tigit传导信号的 tigit结合剂为抗体313m32。
241.tigit是在与其相反受体(counter-receptor) pvr交互作用之后在其胞质尾区磷酸化。tigit的磷酸化为级联的开始,该级联包括影响其他已知的传导信号途径的下游事
件。因此,评估tigit磷酸化可给出关于tigit 活性及tigit传导信号的信息。
242.磷酸化检定法为那些熟习本技术领域者已知且常被用于监测蛋白质活化及/或途径活化。检定法可用于监测各种治疗对标靶蛋白质及/或标靶途径的活化的效应。例如,试管内磷酸化检定法可用于评估tigit拮抗剂对pvr诱发的tigit活化的效应。
243.在特定的实施方案中,tigit结合剂(例如抗体)抑制tigit与受体结合。在特定的实施方案中,tigit 结合剂抑制tigit与pvr结合。在一些实施方案中, tigit结合剂抑制tigit与pvr-l2、pvr-l3及/或pvr
‑ꢀ
l4结合。在特定的实施方案中,抑制tigit结合剂与 pvr的结合为至少约10%,至少约25%,至少约50%,至少约75%,至少约90%或至少约95%。在特定的实施方案中,抑制tigit结合剂与pvr-l2、pvr-l3及/或pvr-l4 的结合为至少约10%,至少约25%,至少约50%,至少约 75%,至少约90%或至少约95%。在特定的实施方案中,抑制tigit与pvr结合的tigit结合剂为抗体313r11、抗体313r12、抗体313r14、抗体313r19或抗体 313r20。在特定的实施方案中,抑制tigit与pvr-l2、 pvr-l3及/或pvr-l4结合的tigit结合剂为抗体 313r11、抗体313r12、抗体313r14、抗体313r19或抗体313r20。在特定的实施方案中,抑制tigit与pvr结合的tigit结合剂为抗体313m26或抗体313m32。在特定的实施方案中,抑制tigit与pvr结合的tigit结合剂为抗体313m32。在特定的实施方案中,抑制tigit与 pvr-l2、pvr-l3及/或pvr-l4结合的tigit结合剂为抗体313m26或抗体313m32。在特定的实施方案中,抑制 tigit与pvr-l2、pvr-l3及/或pvr-l4结合的tigit结合剂为抗体313m32。
244.在特定的实施方案中,tigit结合剂(例如抗体)阻断tigit与受体结合。在特定的实施方案中,tigit 结合剂阻断tigit与pvr结合。在特定的实施方案中,阻断tigit结合剂与pvr的结合为至少约10%,至少约 25%,至少约50%,至少约75%,至少约90%或至少约 95%。在一些实施方案中,tigit结合剂阻断tigit与 pvr-l2、pvr-l3及/或pvr-l4结合。在特定的实施方案中,阻断tigit结合剂与pvr-l2、pvr-l3及/或pvr-l4 的结合为至少约10%,至少约25%,至少约50%,至少约 75%,至少约90%或至少约95%。在特定的实施方案中,阻断tigi与pvr结合的tigit结合剂为抗体313r11、抗体313r12、抗体313r14、抗体313r19或抗体 313r20。在特定的实施方案中,阻断tigit与pvr-l2、 pvr-l3及/或pvr-l4结合的tigit结合剂为抗体 313r11、抗体313r12、抗体313r14、抗体313r19或抗体313r20。在特定的实施方案中,阻断tigit与pvr结合的tigit结合剂为抗体313m26或抗体313m32。在特定的实施方案中,阻断tigit与pvr结合的tigit结合剂为抗体313m32。在特定的实施方案中,阻断tigit与 pvr-l2、pvr-l3及/或pvr-l4结合的tigit结合剂为抗体313m26或抗体313m32。在特定的实施方案中,阻断 tigit与pvr-l2、pvr-l3及/或pvr-l4结合的tigit结合剂为抗体313m32。
245.结合检定法为那些熟习本技术领域者已知且于本文说明。结合检定法监测试验剂对标靶蛋白质与蛋白质结合伙伴(例如受体或配体)之间的交互作用的效应。例如,试管内结合检定法可用评估tigit拮抗剂是否阻断 tigit对pvr的交互作用。
246.在特定的实施方案中,本文所述的tigit结合剂具有下列效应中的一或多者:抑制肿瘤细胞增生、抑制肿瘤生长、降低肿瘤的致瘤性、藉由减少肿瘤中的癌干细胞频率而降低肿瘤的致瘤性、触发肿瘤细胞的细胞死亡、增强或激励免疫反应、增强或激励抗肿瘤反应、增加免疫细胞的溶胞活性、增加杀死肿瘤细胞、藉由免疫细胞增加杀死肿瘤细胞、诱发肿瘤
的细胞分化、分化致瘤细胞至非致瘤状态、诱发肿瘤细胞中的分化标记表达、预防肿瘤细胞转移、降低肿瘤细胞存活、增加细胞接触依赖性生长抑制、增加肿瘤细胞凋亡、降低上皮间质转变(emt)或降低肿瘤细胞存活。在一些实施方案中,该剂具有下列效应中的一或多者:抑制病毒感染、抑制慢性病毒感染、减少病毒载量、触发经病毒感染的细胞的细胞死亡或减少经病毒感染的细胞的数目或百分比。
247.在特定的实施方案中,本文所述的tigit结合剂抑制肿瘤生长。在特定的实施方案中,tigit结合剂抑制活体内肿瘤生长(例如在小鼠模式中及/或在患有癌症的人类中)。在特定的实施方案中,与未经处理的肿瘤相比,使肿瘤生长抑制至少约2倍,约3倍,约5倍,约 10倍,约50倍,约100倍或约1000倍。
248.在特定的实施方案中,本文所述的tigit结合剂降低致瘤性。在特定的实施方案中,tigit结合剂在动物模式中(诸如小鼠模式)降低致瘤性。在一些实施方案中,小鼠模式为小鼠异种移植模式。在一些实施方案中, tigit结合剂不结合小鼠tigit且在小鼠模式中无效。在一些实施方案中,在小鼠模式中使用替代的tigit结合剂结合小鼠tigit。在特定的实施方案中,tigit结合剂降低在动物模式中(诸如小鼠模式)的肿瘤(包含癌干细胞)发生性。在特定的实施方案中,使肿瘤中的癌干细胞数目或频率减少至少约2倍,约3倍,约5倍,约10倍,约50 倍,约100倍或约1000倍。在特定的实施方案中,减少的癌干细胞数目或频率是藉由使用动物模型的限制稀释试验检定法测定。关于使用限制稀释检定法测定肿瘤中减少的癌干细胞数目或频率的额外实例及指南可见于例如国际公开案号wo 2008/042236、美国专利公开案号 2008/0064049及美国专利公开案号2008/0178305。
249.在特定的实施方案中,本文所述的剂(例如多肽及/或抗体)结合tigit及调节免疫反应。在一些实施方案中,本文所述的tigit结合剂活化及/或增加免疫反应。在一些实施方案中,tigit结合剂增加、促进或增强细胞介导的免疫力。在一些实施方案中,tigit结合剂增加、促进或增强先天细胞介导的免疫力。在一些实施方案中,tigit结合剂增加、促进或增强后天细胞介导的免疫力。在一些实施方案中,tigit结合剂增加、促进或增强 t细胞活性。在一些实施方案中,tigit结合剂增加、促进或增强溶胞性t细胞(ctl)活性。在一些实施方案中, tigit结合剂增加、促进或增强nk细胞活性。在一些实施方案中,tigit结合剂增加、促进或增强淋巴激素活化的杀手细胞(lak)活性。在一些实施方案中,tigit结合剂增加、促进或增强肿瘤浸润的淋巴细胞(tif)活性。在一些实施方案中,tigit结合剂抑制或降低treg细胞活性。在一些实施方案中,tigit结合剂抑制或降低mdsc 活性。在一些实施方案中,tigit结合剂增加、促进或增强杀死肿瘤细胞。在一些实施方案中,tigit结合剂增加、促进或增强肿瘤生长抑制。
250.在特定的实施方案中,本文所述的剂为人类 tigit拮抗剂。在一些实施方案中,该剂为tigit拮抗剂且活化及/或增加免疫反应。在一些实施方案中,该剂为 tigit拮抗剂且活化及/或增加nk细胞活性。在特定的实施方案中,该剂增加至少约10%,至少约20%,至少约 30%,至少约50%,至少约75%,至少约90%或约100%的活性。在一些实施方案中,该剂为tigit拮抗剂且活化及/或增加t细胞活性(例如t细胞溶胞活性)。在特定的实施方案中,该剂增加至少约10%,至少约20%,至少约 30%,至少约50%,至少约75%,至少约90%或约100%的活性。在一些实施方案中,该剂为tigit拮抗剂且诱发及/或增强th1型免疫反应。th1型免疫反应通常包括生产干扰素-γ(ifn-γ)、il-2和肿瘤坏死因子-β(tnf-β)。比较的
th2型免疫反应通常包括生产il-4、il-5、il-6、il
‑ꢀ
9、il-10和il-13。在一些实施方案中,该剂为tigit拮抗剂且诱发及/或增加细胞激素或淋巴激素生产。在一些实施方案中,诱发及/或增加细胞激素或淋巴激素生产可为间接效应。
251.在特定的实施方案中,本文所述的tigit结合剂增加nk细胞活化。在特定的实施方案中,tigit结合剂增加t细胞活化。在特定的实施方案中,以tigit结合剂活化nk细胞及/或t细胞导致增加至少约10%,至少约25%,至少约50%,至少约75%,至少约90%或至少约95%的nk细胞及/或t细胞活化程度。在特定的实施方案中,增加nk细胞活化的tigit结合剂为抗体 313r11、抗体313r12、抗体313r14、抗体313r19或抗体313r20。在特定的实施方案中,增加nk细胞活化的 tigit结合剂为抗体313m26或抗体313m32。在特定的实施方案中,增加nk细胞活化的tigit结合剂为抗体 313m32。
252.在特定的实施方案中,tigit结合剂(例如抗体)为调节性t细胞(treg)活性的拮抗剂。在特定的实施方案中,本文所述的tigit结合剂抑制或降低treg活性。在特定的实施方案中,以tigit结合剂抑制treg活性导致抑制至少约10%,至少约25%,至少约50%,至少约 75%,至少约90%,至少约95%或约100%的treg细胞抑制活性。在特定的实施方案中,抑制treg活性的tigit 结合剂为抗体313r11、抗体313r12、抗体313r14、抗体 313r19或抗体313r20。在特定的实施方案中,抑制treg 活性的tigit结合剂为抗体313m26或抗体313m32。在特定的实施方案中,抑制treg活性的tigit结合剂为抗体313m32。
253.在特定的实施方案中,tigit结合剂(例如抗体)为骨髓衍生性抑制细胞(mdsc)的拮抗剂。在特定的实施方案中,tigit结合剂抑制mdsc活性。在特定的实施方案中,tigit结合剂抑制至少约10%,至少约20%,至少约30%,至少约50%,至少约75%,至少约90%或约 100%的mdsc活性。在特定的实施方案中,抑制mdsc 活性的tigit结合剂为抗体313r11、抗体313r12、抗体 313r14、抗体313r19或抗体313r20。在特定的实施方案中,抑制mdsc活性的tigit结合剂为抗体313m26或抗体313m32。在特定的实施方案中,抑制mdsc活性的 tigit结合剂为抗体313m32。
254.在特定的实施方案中,tigit结合剂(例如抗体)增加自然杀手(nk)细胞活性。在特定的实施方案中, tigit结合剂增加至少约10%,至少约20%,至少约 30%,至少约50%,至少约75%,至少约90%或约100%的nk细胞活性。在特定的实施方案中,增加nk细胞活性的tigit结合剂为抗体313r11、抗体313r12、抗体 313r14、抗体313r19或抗体313r20。在特定的实施方案中,增加nk细胞活性的tigit结合剂为抗体313m26或抗体313m32。在特定的实施方案中,增加nk细胞活性的tigit结合剂为抗体313m32。
255.在特定的实施方案中,tigit结合剂(例如抗体)增加肿瘤浸润的淋巴细胞(til)活性。在特定的实施方案中,tigit结合剂增加至少约10%,至少约20%,至少约30%,至少约50%,至少约75%,至少约90%或约 100%的til活性。在特定的实施方案中,增加til细胞活性的tigit结合剂为抗体313r11、抗体313r12、抗体313r14、抗体313r19或抗体313r20。在特定的实施方案中,增加til细胞活性的tigit结合剂为抗体313m26或抗体313m32。在特定的实施方案中,增加til细胞活性的tigit结合剂为抗体313m32。
256.在特定的实施方案中,tigit结合剂(例如抗体)增加或增强淋巴激素活化的杀手细胞(lak)活性。在特定的实施方案中,tigit结合剂增加至少约10%,至少约 20%,至少约30%,至少约50%,至少约75%,至少约 90%或约100%的lak活性。在特定的实施方案中,
增加 lak细胞活性的tigit结合剂为抗体313r11、抗体 313r12、抗体313r14、抗体313r19或抗体313r20。在特定的实施方案中,增加lak细胞活性的tigit结合剂为抗体313m26或抗体313m32。在特定的实施方案中,增加lak细胞活性的tigit结合剂为抗体313m32。
257.用于测定tigit结合剂(或候选结合剂)是否调节免疫反应的活体内及试管内检定法为本技术中已知或正在发展中。在一些实施方案中,可使用功能检定法检测t 细胞活化。在一些实施方案中,可使用功能检定法检测t 细胞增生。在一些实施方案中,可使用功能检定法检测 nk活性。在一些实施方案中,可使用功能检定法检测 ctl活性。在一些实施方案中,可使用功能检定法检测 treg活性。在一些实施方案中,可使用功能检定法检测 mdsc活性。在一些实施方案中,可使用功能检定法检测细胞激素或淋巴激素的生产或细胞生产的细胞激素或淋巴激素。在一些实施方案中,elispot检定法是用于测量抗原特异性t细胞频率。在一些实施方案中,elispot检定法是用于测量细胞激素释放/生产及/或用于测量细胞激素生产的细胞数目。在一些实施方案中,细胞激素检定法是用于鉴别th1型反应。在一些实施方案中,细胞激素检定法是用于鉴别th2型反应。在一些实施方案中,细胞激素检定法是用于鉴别th17-型反应。在一些实施方案中, facs分析是用于测量在免疫细胞上的活化标记,该免疫细胞包括但不限于t细胞、b-细胞、nk细胞、巨噬细胞及/或骨髓细胞。
258.在特定的实施方案中,本文所述的tigit结合剂在小鼠、大鼠、食蟹猕猴或人类中具有至少约2小时、至少约5小时、至少约10小时、至少约24小时、至少约3天、至少约1周或至少约2周的循环半衰期。在特定的实施方案中,tigit结合剂为igg(例如igg1、igg2 或igg4)抗体,其在小鼠、食蟹猕猴或人类中具有至少约 2小时、至少约5小时、至少约10小时、至少约24小时、至少约3天、至少约1周或至少约2周的循环半衰期。增加(或降低)该剂(诸如多肽和抗体)的半衰期的方法为本技术中已知。例如,增加igg抗体的循环半衰期的方法包括引入突变至fc区中,其在ph 6.0增加抗体与新生 fc受体(fcrn)的ph依赖性结合。增加缺乏fc区的抗体片段的循环半衰期的已知方法包括诸如聚乙二醇化 (pegylation)的技术。
259.在本文所述的一些实施方案中,tigit结合剂为多肽。在一些实施方案中,多肽为包含抗体或其片段的重组多肽、天然多肽或合成多肽,其结合tigit。在本技术中承认可改变本发明的一些氨基酸序列而不实质地影响蛋白质的结构或功能。因此,本发明另外包括结合tigit 的多肽的变异,其显示实质的活性或包括抗体或其片段区域。在一些实施方案中,tigit结合多肽的氨基酸序列变异包括删除、插入、反转、重复及/或其他的取代类型。
260.多肽、类似物及其变体可经另外修饰而含有不是多肽的正常部分的额外的化学部分。经衍生的部分可改进或在其他方面调节多肽的溶解性、生物半衰期及/或吸收。该部分亦可降低或消除多肽及变体的非所期望的副作用。化学部分的评论可见于remington:the science andpractice of pharmacy,22
st edition,2012,pharmaceuticalpress,london中。
261.在特定的实施方案中,本文所述的多肽经分离。在特定的实施方案中,本文所述的多肽为实质上纯的。
262.本文所述的多肽可以本技术中已知任何适合的方法生产。此等方法可在从直接的蛋白质合成方法至建构编码多肽序列的dna序列及在适合的宿主内表达这些序列的范围内。在一些实施方案中,dna序列是使用藉由分离或合成编码关注的野生型蛋白质的dna序列的重组技术而建构。序列可藉由部位特异性突变形成而随意地突变,以提供其功能性类
似物。
263.在一些实施方案中,编码关注的多肽的dna 序列可藉由使用寡核苷酸合成器的化学合成而建构。寡核苷酸可基于所期望的多肽的氨基酸序列及选择在其中生产关注的重组多肽的宿主细胞中得利的那些密码子来设计。标准方法可应用于合成编码经分离的所关注的多肽的多核苷酸序列。例如,完全氨基酸序列可用于建构反转译基因。另外,可合成含有编码特别的经分离的多肽的核苷酸序列的dna寡聚体。例如,可合成且接着接合编码所期望的多肽部分的许多小型寡核苷酸。个别的寡核苷酸通常含有用于互补组装的5'或3'悬突。
264.一经组装(藉由合成、部位引导的突变形成或其他方法),可将编码特别的所关注的多肽的多核苷酸序列插入表达载体中且经操作地连结至适合于所期望的宿主内的蛋白质表达的表达控制序列。适当的组装可藉由在适合的宿主内的核苷酸定序、限制酵素定位及/或生物活性多肽的表达来确认。如本技术所熟知,为了在宿主内获得高表达程度的转染基因,基因必须经操作地连结至所选定的表达宿主内具有功能的转录及转译表达控制序列。
265.在特定的实施方案中,重组表达载体是用于扩增及表达编码对抗人类tigit的抗体或其片段的 dna。例如,重组表达载体可为可复制的dna建构体,其具有合成或经cdna-衍生的编码tigit结合剂的多肽链 (诸如抗tigit抗体或其片段)的dna片段,其经操作地连结至源自哺乳动物、微生物、病毒或昆虫基因的适合的转录及/或转译调节组件。转录单位通常包含下列的组装:(1)在基因表达中具有调节角色的基因组件,例如转录启动子或增强子,(2)转录成mrna及转译成蛋白质的结构或编码序列,及(3)适当的转录及转译初始及终止序列。调节组件可包括操作子序列以控制转录。可另外并入通常由复制起点赋予的宿主内复制的能力及有助于转形物辨识的选择基因。dna区彼此在功能性相关时,将这些〝经操作地连结〞。例如,若信号肽的dna(分泌前导序列)经表达为参与多肽分泌的前驱体,则将其经操作地连结至多肽的dna;若启动子控制序列转录,则将其经操作地链接至编码序列;或若核糖体结合部位是位于允许转译的位置,则该结合部位经操作地链接至编码序列。在一些实施方案中,意欲用于酵母菌表达系统的结构组件包括使宿主细胞能细胞外分泌转译的蛋白质的前导序列。在其他的实施方案中,在表达重组蛋白而没有前导或运送序列的情况中,重组蛋白可包括n端甲硫氨酸残基。此残基接着可随意地自经表达的重组蛋白切割以提供最终产物。
266.表达控制序列及表达载体的选择取决于宿主的选择。可使用各种广泛的表达宿主/载体组合。有用于真核宿主的表达载体包括例如包含来自sv40、牛乳头状瘤病毒、腺病毒及巨细胞病毒的表达控制序列的载体。有用于细菌宿主的表达载体包括已知的细菌质粒,诸如来自大肠杆菌的质粒(包括pcr1、pbr322、pmb9和其衍生物),及广泛的宿主范围质粒,诸如m13及其他的丝状单股dna噬菌体。
267.本发明的tigit结合剂(例如多肽或抗体)可由一或多个载体表达。例如,在一些实施方案中,一个重链多肽是由一个载体表达,第二重链多肽是由第二载体表达,及轻链多肽是由第三载体表达。在一些实施方案中,第一重链多肽及轻链多肽是由一个载体表达及第二重链多肽是由第二载体表达。在一些实施方案中,两个重链多肽是由一个载体表达及轻链多肽是由第二载体表达。在一些实施方案中,三个多肽是由一个载体表达。因此,在一些实施方案中,第一重链多肽、第二重链多肽及轻链多肽是由单一载体表达。
268.适合于tigit结合多肽或抗体(用作为抗原的 tigit蛋白质)表达的宿主细胞包括原核生物、酵母菌细胞、昆虫细胞或在适当的启动子控制下的高级真核细胞。原核生物包括革兰(gram)阴性或革兰阳性有机体,例如大肠杆菌或杆菌(bacillus)。高级真核细胞包括如下文所述的哺乳动物来源的确立细胞系。亦可使用无细胞的转译系统。用于细菌、真菌、酵母菌及哺乳动物细胞宿主的适当的克隆及表达载体,以及蛋白质生产(包括抗体生产)方法为本技术中所熟知。
269.各种哺乳动物培养系统可用于表达重组多肽。可能希望哺乳动物细胞中的重组蛋白表达,因为这些蛋白质通常经恰当地折叠、适当地修饰且具有生物功能。适合的哺乳动物宿主细胞系的实例包括但不限于cos
‑ꢀ
7(源自猴肾)、l-929(源自小鼠纤维母细胞)、c127(源自小鼠乳房肿瘤)、3t3(源自小鼠纤维母细胞)、cho(源自中国仓鼠卵巢)、hela(源自人类子宫颈癌)、bhk(源自仓鼠肾纤维母细胞)、hek-293(源自人类胚胎肾)细胞系及其变体。哺乳动物表达载体可包含非转录组件(诸如复制起点、连结至欲表达基因的适合的启动子和增强子、及其他的5'或3'侧翼非转录序列)及5'或3'非转译序列(诸如必要的核糖体结合部位、聚腺苷酸化部位、剪接供体和受体部位,及转录终止序列)。
270.在昆虫细胞培养系统(例如杆状病毒)中的重组蛋白表达亦供给用于生产恰当地折叠及具有生物功能蛋白质的有效方法。用于昆虫细胞中生产异源性蛋白质的杆状病毒系统为那些熟习本技领域者所熟知。
271.因此,本发明提供包含本文所述的tigit结合剂的细胞。在一些实施方案中,细胞生产本文所述的 tigit结合剂。在特定的实施方案中,细胞生产抗体。在一些实施方案中,细胞生产结合小鼠tigit的抗体。在一些实施方案中,细胞生产结合人类tigit的抗体。在一些实施方案中,细胞生产结合小鼠tigit及人类tigit的抗体。在特定的实施方案中,细胞生产抗体313r11。在特定的实施方案中,细胞生产抗体313r12。在特定的实施方案中,细胞生产抗体313r14。在特定的实施方案中,细胞生产抗体313r19。在特定的实施方案中,细胞生产抗体313r20。在特定的实施方案中,细胞生产抗体 313m26。在特定的实施方案中,细胞生产抗体313m32。在一些实施方案中,细胞生产结合tigit的双特异性抗体。在一些实施方案中,细胞生产结合tigit及第二标靶的双特异性抗体。在一些实施方案中,细胞为融合瘤细胞。在一些实施方案中,细胞为哺乳动物细胞。在一些实施方案中,细胞为原核细胞。在一些实施方案中,细胞为真核细胞。
272.由转型宿主所生产的蛋白质可根据任何适合的方法纯化。标准的方法包括层析术(例如离子交换、亲和性及筛分管柱层析术)、离心、差别性溶解度或用于蛋白质纯化的任何其他的标准技术。可将亲和性标签(诸如六组氨酸、麦芽糖结合结构域、流感外套序列和谷胱甘肽
ꢀ‑
s-转移酶)连接至蛋白质,容许通过适当的亲和性管柱而轻易地纯化。用于纯化免疫球蛋白的亲和性层析术可包括蛋白质a、蛋白质g和蛋白质l层析术。经分离的蛋白质亦可使用下列技术经物理特征化,诸如蛋白水解、尺寸排阻层析术(sec)、质谱术(ms)、核磁共振(nmr)、等电集聚(ief)、高性能液相层析术(hplc)和x射线结晶术。经分离的蛋白质纯度可使用那些熟习本技领域者已知的技术测定,包括但不限于sds-page、sec,毛细管胶体电泳、ief和毛细管等电集聚(cief)。
273.在一些实施方案中,来自分泌重组蛋白至培养基的表达系统的上清液可使用市场上可取得的蛋白质浓缩过滤器先浓缩,例如amicon或millipore pellicon超过滤单位。在
浓缩步骤之后,可将浓缩液施加至适合的纯化基质中。在一些实施方案中,可使用阴离子交换树脂,例如具有二乙基氨基乙基(deae)侧链的的基质或底物。基质可为丙烯酰胺、洋菜糖、葡聚糖、纤维素或常用于蛋白质纯化的其他类型。在一些实施方案中,可使用阳离子交换步骤。适合的阳离子交换剂包括各种包含磺丙基或羧甲基的不可溶基质。在一些实施方案中,可采用羟磷灰石基质,包括但不限于陶瓷羟磷灰石(cht)。在特定的实施方案中,一或多种使用疏水性rh-hplc基质(例如具有侧链甲基或其他脂族基团的硅胶)的逆相hplc步骤可用于进一步纯化重组蛋白(例如tigit结合剂)。可使用一些或所有的前述纯化步骤的各种组合来提供均匀的重组蛋白。
274.在一些实施方案中,异质二聚体蛋白质(诸如双特异性抗体)是根据本文所述的方法中的任一者纯化。在一些实施方案中,抗tigit双特异性抗体是使用至少一种层析步骤分离及/或纯化。在一些实施方案中,至少一种层析步骤包含亲和性层析术。在一些实施方案中,至少一种层析步骤另外包含阴离子交换层析术。在一些实施方案中,经分离及/或纯化的抗体产物包含至少90%的异质二聚体抗体。在一些实施方案中,经分离及/或纯化的抗体产物包含至少95%,96%,97%,98%或99%的异质二聚体抗体。在一些实施方案中,经分离及/或纯化的抗体产物包含约100%的异质二聚体抗体。
275.在一些实施方案中,可将细菌培养物中所生产的多肽分离,例如藉由自沉淀细胞的初步萃取,接着以一或多次浓缩、盐析、水性离子交换或尺寸排阻层析步骤。hplc可用于最终纯化步骤。用于表达重组蛋白的微生物细胞可以任何习知的方法破碎,包括冷冻解冻循环、超音波震荡、机械破碎或使用细胞溶解剂。
276.在特定的实施方案中,tigit结合剂为多肽,其不为抗体或不包含免疫球蛋白fc区。用于鉴别及生产以高亲和性结合至蛋白质标靶的非抗体多肽的各种方法为本技术中已知。在特定的实施方案中,噬菌体或哺乳动物展示技术可用于生产及/或鉴别tigit结合多肽。在特定的实施方案中,多肽包含选自由下列所组成的群组类型的蛋白质支架:蛋白质a、蛋白质g、脂质运载蛋白 (lipocalin)、纤维黏连蛋白(fibronectin)结构域、锚蛋白 (ankyrin)共有重复结构域和硫氧还原蛋白(thioredoxin)。用于鉴别及生产以高亲和性与蛋白质标靶结合的非抗体多肽的各种方法为本技术中已知。在特定的实施方案中,噬菌体展示技术可用于生产及/或鉴别结合多肽。在特定的实施方案中,哺乳动物细胞展示技术可用于生产及/或鉴别结合多肽。
277.可另外希望修饰多肽,以便增加(或降低)其血清半衰期。这可藉由例如以多肽中的适当区域的突变而使救援受体结合抗原决定区以并入多肽来达成,或藉由将抗原决定区并入肽标签中,接着与多肽在末端或中间融合(例如藉由dna或肽合成)来达成。
278.异质共轭分子亦在本发明的范围内。异质共轭分子是由两个共价连接的多肽所组成。经提出的此等分子例如用于使免疫细胞靶定不希望的细胞(例如肿瘤细胞)。亦可预期以使用合成蛋白质化学中已知的方法于试管内制备异质共轭分子,包括那些涉及交联剂的方法。例如,免疫毒素可使用双硫交换反应或藉由形成硫醚键来建构。适合于此目的的试剂的实例包括亚氨基硫醇盐及甲基
ꢀ‑
4-巯基丁亚酰胺酸酯。
279.在特定的实施方案中,tigit结合剂可以数种共轭(即免疫共轭物或放射共轭物)或非共轭形式中的任一者使用。在特定的实施方案中,该剂可以非共轭形式使用以驾驭受试者的天然防御机制,包括补体依赖性细胞毒性 (cdc)及抗体依赖性细胞毒性(adcc),以
id no:55和seq idno:56的多核苷酸至少约80%的一致性,至少约85%的一致性,至少约90%的一致性,至少约95%的一致性,且在一些实施方案中,至少约96%,97%,98%或99%的一致性的核苷酸序列的多核苷酸。亦提供多核苷酸,其包含与编码选自由下列所组成的群组的氨基酸序列:seq idno:17、seq id no:18、seq id no:19、seq idno:20、seq id no:21、seq id no:22、seq idno:23、seq id no:24、seq id no:25、seq idno:26、seq id no:27、seq id no:28、seq idno:29、seq id no:30、seq id no:32、seq idno:33、seq id no:34、seq id no:55和seq idno:56的多核苷酸杂交的多核苷酸。在特定的实施方案中,杂交是在高严格条件下。高严格条件为那些熟习本技术领域者已知且可包括但不限于:(1)使用低离子强度及高温清洗,例如在50℃下以具有0.1%十二烷基硫酸钠的 15mm氯化钠/1.5mm柠檬酸钠(1x ssc);(2)在杂交期间使用变性剂,诸如甲酰胺,例如在42℃下使用于5x ssc(0.75m nacl,75mm柠檬酸钠)中具有0.1%牛血清白蛋白/0.1% ficoll/0.1%聚乙烯基吡咯烷酮/50mm磷酸钠缓冲液,ph 6.5的50%(体积/体积)甲酰胺;或(3)在42℃下使用50%甲酰胺、5x ssc、50mm磷酸钠(ph 6.8)、0.1%焦磷酸钠、5x丹哈德(denhardt’s)溶液、经音波化的鲑鱼精子dna(50微克/毫升)、0.1% sds及10%硫酸葡聚糖,在55℃下以含有50%甲酰胺的0.2x ssc清洗,接着在 55℃下以含有edta的0.1x ssc高严格清洗。
284.在特定的实施方案中,多核苷酸包含编码多肽的多核苷酸,该多肽包含选自由下列所组成的群组的氨基酸序列:seq id no:63、seq id no:64、seq idno:67、seq id no:68、seq id no:69、seq idno:70、seq id no:71、seq id no:72和seq idno:82。
285.在特定的实施方案中,多核苷酸包含具有与编码选自由:seq id no:63、seq id no:64、seq idno:67、seq id no:68、seq id no:69、seq idno:70、seq id no:71、seq id no:72和seq i d no:82所组成的群组的氨基酸序列的多核苷酸至少约 80%的一致性,至少约85%的一致性,至少约90%的一致性,至少约95%的一致性,且在一些实施方案中,至少约 96%,97%,98%或99%的一致性的核苷酸序列的多核苷酸。亦提供多核苷酸,其包含与编码选自由下列所组成的群组的氨基酸序列的多核苷酸杂交的多核苷酸:seq idno:63、seq id no:64、seq id no:67、seq idno:68、seq id no:69、seq id no:70、seq idno:71、seq id no:72和seq id no:82。
286.在一些实施方案中,多核苷酸包含选自由下列所组成的群组的多核苷酸序列:seq id no:65、seqid no:66、seq id no:73、seq id no:74、seq idno:75和seq id no:76。在特定的实施方案中,多核苷酸包含具有与选自由:seq id no:65、seq id no: 66、seq id no:73、seq id no:74、seq id no:75 和seq id no:76所组成的群组的核苷酸序列至少约 80%的一致性,至少约85%的一致性,至少约90%的一致性,至少约95%的一致性,且在一些实施方案中,至少约 96%,97%,98%或99%的一致性的核苷酸序列的多核苷酸。亦提供多核苷酸,其包含与选自由下列所组成的群组的多核苷酸序列杂交的多核苷酸:seq id no:65、seqid no:66、seq id no:73、seq id no:74、seq idno:75和seq id no:76。在特定的实施方案中,杂交技术是在如上述的高严格条件下进行。
287.在特定的实施方案中,多核苷酸包含在相同的阅读框架中与多核苷酸融合的成熟多肽的编码序列,该多核苷酸协助例如来自宿主细胞的多肽的表达及分泌(例如作为控制来自细胞的多肽运送的分泌序列功能的前导序列)。具有前导序列的多肽为前蛋白质且可具有以宿主细胞切割的前导序列,以形成多肽的成熟形式。多核苷酸亦可编码原蛋白质,其
为成熟蛋白加上额外的5'氨基酸残基。具有原序列(pro-sequence)的成熟蛋白为原蛋白质且为蛋白质的不活化形式。原序列一经切割,则剩下活性成熟蛋白。
288.在特定的实施方案中,多核苷酸包含在相同的阅读框架中与标记序列融合的成熟多肽的编码序列,该标记序列容许例如纯化编码的多肽。例如,标记序列可为由pqe-9载体供给的六组氨酸标签,以提供在细菌宿主的例子中用于纯化与标记融合的成熟多肽,或当使用哺乳动物宿主(例如cos-7细胞)时,标记序列可为源自流感血球凝集素蛋白质的血球凝集素(ha)标签。在一些实施方案中,标记序列为flag-卷标,序列dykddddk的肽(seqid no:40),其可与其他的亲和性标签联合使用。
289.本发明另外关于本文所述的多核苷酸的变体,其中变体编码例如片段、类似物及/或衍生物。
290.在特定的实施方案中,本发明提供多核苷酸,其包含具有与编码包含本文所述的tigit结合剂的多肽的多核苷酸至少约80%的一致性,至少约85%的一致性,至少约90%的一致性,至少约95%的一致性,且在一些实施方案中,至少约96%,97%,98%或99%的一致性的核苷酸序列的多核苷酸。
291.如本文所使用的词句具有与参考核苷酸序列例如95%的〝一致性〞的核苷酸序列的多核苷酸意欲指多核苷酸的核苷酸序列与参考序列相同,除了多核苷酸序列可包括以参考核苷酸序列的每100个核苷酸计最多5点突变。换言之,为了获得具有核苷酸序列与参考核苷酸序列至少95%的一致性的多核苷酸,可将参考序列中最多5%的核苷酸删除或以另一核苷酸取代,或可将参考序列中的总核苷酸的最多5%的核苷酸数目插入参考序列。参考序列的这些突变可发生在参考核苷酸序列的5'或3'末端位置上或那些末端位置之间的任何位置,这些任何位置个别地散置在参考序列中的核苷酸之间或参考序列内的一或多相邻群组中。
292.多核苷酸变体可含有在编码区、非编码区或两者中的变化。在一些实施方案中,多核苷酸变体含有产生静默取代、添加或删除的变化,但不改变经编码的多肽的性质或活性。在一些实施方案中,多核苷酸变体包含不导致多肽的氨基酸序列改变的静默取代(由于基因密码的简并性)。多核苷酸变体可就各种原因而生产,例如使特定的宿主的密码子表达最优化(例如将人类mrna中的密码子改变成细菌宿主(诸如大肠杆菌)偏好的密码子)。在一些实施方案中,多核苷酸变体包含至少一个在序列的非编码或编码区中的静默突变。
293.在一些实施方案中,生产多核苷酸变体以调节或改变经编码的多肽的表达(或表达量)。在一些实施方案中,生产多核苷酸变体以增加经编码的多肽的表达。在一些实施方案中,生产多核苷酸变体以降低经编码的多肽的表达。在一些实施方案中,与亲代多核苷酸序列相比,多核苷酸变体增加经编码的多肽的表达。在一些实施方案中,与亲代多核苷酸序列相比,多核苷酸变体降低经编码的多肽的表达。
294.在一些实施方案中,生产至少一种多核苷酸变体(不改变经编码的多肽的氨基酸序列)以增加异质二聚体分子的生产。在一些实施方案中,生产至少一种多核苷酸变体(不改变经编码的多肽的氨基酸序列)以增加双特异性抗体的生产。
295.在特定的实施方案中,多核苷酸经分离。在特定的实施方案中,多核苷酸为实质上纯的。
296.亦提供包含本文所述的多核苷酸的载体及细胞。在一些实施方案中,表达载体包
含多核苷酸分子。在一些实施方案中,宿主细胞包含表达载体,其包含多核苷酸分子。在一些实施方案中,宿主细胞包含多核苷酸分子。iv.使用方法及医药组合物
297.本发明的tigit结合剂有用于各种应用,包括但不限于治疗性治疗方法,诸如癌症治疗。在一些实施方案中,治疗性治疗方法包含癌症的免疫治疗。在特定的实施方案中,tigit结合剂有用于活化、促进、增强及/或提高免疫反应、抑制肿瘤生长、减少肿瘤体积、增加肿瘤细胞凋亡及/或降低致瘤性。在一些实施方案中,本发明的tigit结合剂亦有用于对抗病原体(诸如病毒)的免疫治疗。在特定的实施方案中,tigit结合剂有用于活化、促进、增强及/或提高免疫反应、抑制病毒感染、降低病毒感染、增加病毒感染细胞凋亡及/或增加杀死病毒感染细胞。使用方法可为试管内、活体外或活体内方法。
298.本发明提供使用本文所述的tigit结合剂活化受试者的免疫反应的方法。在一些实施方案中,本发明提供使用本文所述的tigit结合剂促进受试者的免疫反应的方法。在一些实施方案中,本发明提供使用本文所述的 tigit结合剂增加受试者的免疫反应的方法。在一些实施方案中,本发明提供使用本文所述的tigit结合剂增强受试者的免疫反应的方法。在一些实施方案中,活化、促进、增强及/或提高免疫反应包含增加细胞介导的免疫力。在一些实施方案中,活化、促进、增强及/或提高免疫反应包含增加t细胞活性。在一些实施方案中,活化、促进、增强及/或提高免疫反应包含增加ctl活性。在一些实施方案中,活化、促进、增强及/或提高免疫反应包含增加nk细胞活性。在一些实施方案中,活化、促进、增强及/或提高免疫反应包含增加t细胞活性及增加nk 细胞活性。在一些实施方案中,活化、促进、增强及/或提高免疫反应包含增加ctl活性及增加nk细胞活性。在一些实施方案中,活化、促进、增强及/或提高免疫反应包含抑制或降低treg的抑制活性。在一些实施方案中,活化、促进、增强及/或提高免疫反应包含抑制或降低 mdsc的抑制活性。在一些实施方案中,免疫反应为抗原刺激的结果。在一些实施方案中,抗原刺激为肿瘤细胞。在一些实施方案中,抗原刺激为癌。在一些实施方案中,抗原刺激为病原体。在一些实施方案中,抗原刺激为病毒。在一些实施方案中,抗原刺激为病毒感染细胞。在一些实施方案中,在本文所述的方法中的任一者中,tigit 结合剂为抗tigit抗体。在一些实施方案中,在本文所述的方法中的任一者中,tigit结合剂为抗体313m32。
299.在一些实施方案中,增加受试者的免疫反应的方法包含对受试者施用治疗有效量的本文所述的tigit 结合剂,其中该剂为特异性结合tigit的细胞外结构域的抗体。在一些实施方案中,增加受试者的免疫反应的方法包含对受试者施用治疗有效量的本文所述的tigit结合剂,其中该剂为特异性结合人类tigit的细胞外结构域的抗体。在一些实施方案中,增加受试者的免疫反应的方法包含对受试者施用治疗有效量的抗体313m32。
300.在一些实施方案中,本发明提供本文所述的 tigit结合剂的用途,其制造或制备用于活化、促进、增强及/或提高免疫反应的药剂。在一些实施方案中,本发明提供本文所述的tigit结合剂的用途,其制造或制备用于增加细胞介导的免疫力的药剂。在一些实施方案中,本发明提供本文所述的tigit结合剂的用途,其制造或制备用于增加t细胞活性的药剂。在一些实施方案中,本发明提供本文所述的tigit结合剂的用途,其制造或制备用于增加ctl活性的药剂。在一些实施方案中,本发明提供本文所述的tigit结合剂的用途,其制造或制备用于增加 nk活性的药剂。在一些实施方案中,本发明提供本文所述的tigit结合剂的
用途,其制造或制备用于抑制或降低 treg的抑制活性的药剂。在一些实施方案中,本发明提供本文所述的tigit结合剂的用途,其制造或制备用于抑制或降低mdsc的抑制活性的药剂。
301.本发明亦提供抑制及/或降低细胞的tigit传导信号的方法,其包含将细胞与有效量的本文所述的 tigit结合剂接触。在一些实施方案中,抑制及/或降低细胞的tigit传导信号的方法包含将细胞与有效量的抗体 313m32接触。在一些实施方案中,本发明提供本文所述的tigit结合剂的用途,其制造或制备用于抑制及/或降低细胞的tigit传导信号的药剂。在特定的实施方案中,细胞为t细胞。在一些实施方案中,细胞为活化的t细胞。在一些实施方案中,细胞为nk细胞。在一些实施方案中,细胞为treg。在一些实施方案中,细胞为mdsc。在特定的实施方案中,该方法为活体内方法,其中细胞与该剂接触的步骤包含对受试者施用治疗有效量的tigit结合剂。在一些实施方案中,该方法为试管内或活体外方法。
302.本发明亦提供使用本文所述的tigit结合剂抑制肿瘤生长的方法。在一些实施方案中,抑制肿瘤生长的方法包含使用抗体313m32。在特定的实施方案中,抑制肿瘤生长的方法包含将细胞混合物与tigit结合剂于试管内接触。例如,将与免疫细胞(例如t细胞或nk细胞) 混合的不朽细胞系或癌细胞系在添加结合tigit的试验剂的培养基中培育。在一些实施方案中,将肿瘤细胞自患者样品(诸如组织生检、胸膜渗液或血液样品)分离,与免疫细胞(例如t细胞及/或nk细胞)混合且在添加结合tigit 的试验剂的培养基中培育。在一些实施方案中,本发明提供本文所述的tigit结合剂的用途,其制造或制备用于抑制肿瘤或肿瘤细胞生长的药剂。在一些实施方案中, tigit结合剂增加、促进及/或增强免疫细胞活性。在一些实施方案中,tigit结合剂抑制肿瘤细胞生长。
303.在一些实施方案中,抑制肿瘤生长的方法包含将肿瘤或肿瘤细胞与本文所述的tigit结合剂在活体内接触。在特定的实施方案中,肿瘤或肿瘤细胞与tigit结合剂接触是在动物模式中进行。例如,试验剂可施用给患有肿瘤的小鼠。在一些实施方案中,tigit结合剂增加、促进及/或增强小鼠的免疫细胞活性。在一些实施方案中,tigit结合剂抑制肿瘤生长。在一些实施方案中, tigit结合剂引起肿瘤消退。在一些实施方案中,tigit 结合剂是在肿瘤细胞引入动物的同时或之后立即施用,以预防肿瘤生长(〝预防性模式〞)。在一些实施方案中, tigit结合剂是在肿瘤已生长至特定大小或已〝确立〞之后作为治疗剂施用(〝治疗性模式〞)。
304.在特定的实施方案中,抑制肿瘤生长的方法包含对受试者施用治疗有效量的本文所述的tigit结合剂。在特定的实施方案中,受试者为人类。在特定的实施方案中,受试者具有肿瘤或受试者已有至少部分移除的肿瘤。在一些实施方案中,抑制肿瘤生长的方法包含对受试者施用治疗有效量的抗体313m32。
305.另外,本发明提供抑制受试者的肿瘤生长的方法,其包含对受试者施用治疗有效量的本文所述的 tigit结合剂。在一些实施方案中,本发明提供本文所述的tigit结合剂的用途,其制造或制备用于抑制肿瘤或肿瘤细胞生长的药剂。在特定的实施方案中,肿瘤包含癌干细胞。在特定的实施方案中,在肿瘤中的癌干细胞频率是藉由施用该剂而降低。在一些实施方案中,提供降低受试者肿瘤的癌干细胞频率的方法,其包含对受试者施用治疗有效量的tigit结合剂。
306.另外,本发明提供降低受试者的致瘤性的方法,其包含对受试者施用治疗有效量
的本文所述的tigit 结合剂。在特定的实施方案中,肿瘤包含癌干细胞。在一些实施方案中,致瘤性是藉由降低肿瘤的癌干细胞频率而降低。在一些实施方案中,该方法包含使用本文所述的 tigit结合剂。在特定的实施方案中,肿瘤的癌干细胞频率是藉由施用本文所述的tigit结合剂而降低。在一些实施方案中,降低受试者的致瘤性的方法包含对受试者施用治疗有效量抗体313m32。
307.在一些实施方案中,肿瘤为实体肿瘤。在特定的实施方案中,肿瘤为选自由下列所组成的群组的肿瘤:结肠直肠肿瘤、胰肿瘤、肺肿瘤、卵巢肿瘤、肝肿瘤、乳房肿瘤、肾肿瘤、前列腺肿瘤、神经内分泌肿瘤、胃肠道肿瘤、黑色素瘤、子宫颈肿瘤、膀胱肿瘤、神经胶质母细胞瘤和头与颈肿瘤。在特定的实施方案中,肿瘤为结肠直肠肿瘤。在特定的实施方案中,肿瘤为卵巢肿瘤。在一些实施方案中,肿瘤为肺肿瘤。在特定的实施方案中,肿瘤为胰肿瘤。在特定的实施方案中,肿瘤为黑色素肿瘤。
308.本发明提供治疗癌症的方法,其包含对受试者(例如需要治疗的受试者)施用治疗有效量的本文所述的 tigit结合剂。在一些实施方案中,本发明提供本文所述的tigit结合剂的用途,其制造或制备用于治疗癌症的药剂。在一些实施方案中,tigit结合剂结合人类tigit且抑制或降低癌生长。在特定的实施方案中,受试者为人类。在特定的实施方案中,受试者具有癌性肿瘤。在特定的实施方案中,受试者已有至少部分移除的肿瘤。在一些实施方案中,用于治疗受试者的癌症的方法包含对受试者施用治疗有效量的抗体313m32。
309.在特定的实施方案中,癌症为选自由下列所组成的群组的癌症:结肠直肠癌、胰脏癌、肺癌、卵巢癌、肝癌、乳癌、肾脏癌、前列腺癌、胃肠道癌、黑色素瘤、子宫颈癌、神经内分泌癌、膀胱癌、神经胶质母细胞瘤和头与颈癌。在特定的实施方案中,癌症为胰脏癌。在特定的实施方案中,癌症为卵巢癌。在特定的实施方案中,癌症为结肠直肠癌。在特定的实施方案中,癌症为乳癌。在特定的实施方案中,癌症为前列腺癌。在特定的实施方案中,癌症为肺癌。在特定的实施方案中,癌症为黑色素瘤。
310.在一些实施方案中,癌症为血液性癌。在一些实施方案中,癌症是选自由下列所组成的群组:急性骨髓性白血病(aml)、霍奇金氏(hodgkin)淋巴瘤、多发性骨髓瘤、t细胞急性淋巴胚细胞白血病(t-all)、慢性淋巴细胞性(cll)、毛细胞白血病、慢性骨髓性白血病 (cml)、非霍奇金氏淋巴瘤、弥漫性大型b细胞淋巴瘤 (dlbcl)、套细胞淋巴瘤(mcl)和皮肤t细胞淋巴瘤 (ctcl)。
311.在本文所述的方法的一些实施方案中,该方法另外包含测定肿瘤或癌中的pd-l1表达量的步骤。在一些实施方案中,测定pd-l1表达量是在以本文所述的tigit结合剂治疗之前进行。在一些实施方案中,若肿瘤或癌具有上升的pd-l1表达量,则将tigit结合剂施用受试者。在一些实施方案中,该方法包含(i)获得受试者的癌或肿瘤样品;(ii)测量样品中的pd-l1表达量;及(iii) 若肿瘤或癌具有上升的pd-l1表达量,则对受试者施用有效量的tigit结合剂。在一些实施方案中,样品为生检样品。在一些实施方案中,样品包含肿瘤细胞、肿瘤浸润的免疫细胞、基质细胞及其任何组合。在一些实施方案中,样品为经福尔马林固定的石蜡包埋(ffpe)样品。在一些实施方案中,样品为归档、新鲜或冷冻组织。在一些实施方案中,将样品中的pd-l1表达量与预测定的pd-l1表达量比较。在一些实施方案中,预测定的pd-l1表达的表达量为参考肿瘤样品、参考正常组织样品、一系列的参考肿瘤样品或一系列的参考正常组织样品中的pd-l1表达量。在一些实施方案中,pd-l1表达量是使用免疫
组织化学 (ihc)检定法测定。在一些实施方案中,pd-l1表达量是使用包含h-分数评估的检定法测定。在一些实施方案中,pd-l1表达量是使用特异性结合pd-l1的抗体测定。在一些实施方案中,pd-l1是在肿瘤细胞上检测。在一些实施方案中,pd-l1是在肿瘤浸润的免疫细胞上检测。
312.以二或更多种治疗剂的组合疗法常使用以不同作用机制运作的剂,虽然并非必要。使用具有不同的作用机制的剂的组合疗法可能导致加成或协同效应。组合疗法可容许单一剂的剂量比单一疗法使用的剂量更低,由此降低该剂的毒性副作用及/或增加治疗指数。组合疗法可降低抗药性癌细胞发生的可能性。在一些实施方案中,组合疗法包含影响免疫反应(例如增强或活化反应)的治疗剂及影响(例如抑制或杀死)肿瘤/癌细胞的治疗剂。
313.在一些实施方案中,本文所述的剂与至少一种额外治疗剂的组合导致加成或协同效应。在一些实施方案中,组合疗法导致本文所述的剂的治疗指数增加。在一些实施方案中,组合疗法导致额外治疗剂的治疗指数增加。在一些实施方案中,组合疗法导致本文所述的剂的毒性及/或副作用降低。在一些实施方案中,组合疗法导致额外治疗剂的毒性及/或副作用降低。
314.在特定的实施方案中,除了施用本文所述的 tigit结合剂以外,该方法或治疗另外包含施用至少一种额外治疗剂。额外治疗剂可在施用tigit结合剂之前、同步及/或之后施用。在一些实施方案中,至少一种额外治疗剂包含1、2、3或更多个额外治疗剂。
315.治疗剂可与本文所述的剂组合施用,包括化疗剂。因此,在一些实施方案中,该方法或治疗包含本发明的剂与化疗剂组合或与化疗剂混合液组合施用。以本发明的剂治疗可发生在施用化疗剂之前、同步或之后。组合施用可包括以单一医药调配物或使用分开的调配物共同施用,或以任何顺序连续施用,但是通常在一段期间内,使得所有的活性剂可同时发挥那些生物活性。这些化疗剂的准备及施用时程可根据制造商的指示使用或由熟习的医师凭经验决定。这些化疗剂的准备及给药方案亦说明于thechemotherapy source book,4
th edition,2008,m.c.perry, editor,lippincott,williams&wilkins,philadelphia,pa 中。
316.有用的治疗剂类别包括例如抗微管蛋白剂、奥立他汀(auristatin)、dna小沟结合剂(minor groovebinder)、dna复制抑制剂、烷化剂(例如铂复合物,诸如顺铂(cisplatin)、单(铂)、二(铂)和三核铂复合物,及卡铂 (carboplatin))、蒽环类(anthracycline)、抗生素、抗叶酸剂、抗代谢物、化疗致敏剂、倍癌霉素(duocarmycin)、依托泊苷(etoposide)、氟化嘧啶、离子载体、莱克西托素(lexitropsin)、亚硝基尿素、普拉汀诺(platinol)、嘌呤抗代谢物、嘌呤霉素(puromycin)、放射致敏剂、类固醇、紫杉烷、拓扑异构酶抑制剂、长春花生物碱或类似者。在特定的实施方案中,第二治疗剂为烷化剂、抗代谢物、抗有丝分裂剂、拓扑异构酶抑制剂或血管生成抑制剂。
317.在本发明中有用的化疗剂包括但不限于烷化剂,诸如噻替派(thiotepa)和环磷酰胺(cyclosphosphamide) (cytoxan);烷基磺酸盐,诸如白消安(busulfan)、英丙舒凡(improsulfan)和哌泊舒凡(piposulfan);氮丙啶,诸如苯多巴(benzodopa)、卡波醌(carboquone)、甲基优瑞多巴 (meturedopa)和优瑞多巴(uredopa);亚乙基亚胺 (ethylenimines)及甲基三聚氰胺(methylamelamines),包括阿草特胺(altretamine)、三亚乙基三聚氰胺( triethylenemelamine)、三乙烯磷酰胺( trietylenephosphoramide)、
三乙烯硫磷酰胺 (triethylenethiophosphaoramide)和三羟甲基三聚氰胺 (trimethylolomelamime);氮芥子气,诸如氯芥苯丁酸 (chlorambucil)、萘氮芥(chlornaphazine)、氯磷酰胺 (cholophosphamide)、雌二醇氮芥(estramustine)、异环磷酸胺(ifosfamide)、双氯乙基甲胺(mechlorethamine)、氧氮芥(mechlorethamine oxide)盐酸盐、霉法兰(melphalan)、新氮芥(novembichin)、胆甾醇苯乙酸氮芥(phenesterine)、松龙苯芥(prednimustine)、氯乙环磷酰胺(trofosfamide)、尿嘧啶芥(uracil mustard);亚硝基脲(nitrosureas),诸如卡氮芥(carmustine)、吡葡亚硝脲(chlorozotocin)、福莫司汀 (fotemustine)、罗氮芥(lomustine)、尼氮芥(nimustine)、雷诺氮芥(ranimustine);抗生素,诸如阿克拉霉素 (aclacinomysins)、放线菌素(actinomycin)、安曲霉素 (authramycin)、氮丝胺酸(azaserine)、博来霉素 (bleomycins)、放线菌素(cactinomycin)、卡利奇霉素 (calicheamicin)、卡拉比辛(carabicin)、洋红霉素 (caminomycin)、嗜癌素(carzinophilin)、色霉素 (chromomycins)、达克霉素(dactinomycin)、正定霉素 (daunorubicin)、地托比星(detorubicin)、6-重氮-5-侧氧基
‑ꢀ
l-正白胺酸、多柔比星(doxorubicin)、表阿霉素 (epirubicin)、依索比星(esorubicin)、伊达比星 (idarubicin)、麻西罗霉素(marcellomycin)、丝裂霉素 (mitomycins)、霉酚酸、诺加霉素(nogalamycin)、橄榄霉素(olivomycin)、培洛霉素(peplomycin)、波弗霉素 (potfiromycin)、嘌呤霉素(puromycin)、三铁阿霉素 (quelamycin)、罗多比星(rodorubicin)、链霉黑素 (streptonigrin)、链脲佐菌素(streptozocin)、杀结核菌素 (tubercidin)、鸟苯美司(ubenimex)、新制癌菌素 (zinostatin)、佐柔比星(zorubicin);抗代谢物,诸如甲胺喋呤(methotrexate)和5-氟尿嘧啶(5-fu);叶酸类似物,诸如二甲叶酸(denopterin)、甲胺喋呤、蝶罗呤 (pteropterin)、三甲蝶呤(trimetrexate);嘌呤类似物,诸如氟达拉滨(fludarabine)、6-巯基嘌呤(6
‑ꢀ
mercaptopurine)、硫咪嘌呤(thiamiprine)、硫鸟嘌呤;嘧啶类似物,诸如安西他滨(ancitabine)、阿扎胞苷 (azacitidine)、6-硫唑脲嘧啶(6-azauridine)、卡莫氟 (carmofur)、胞嘧啶阿拉伯糖苷、二脱氧尿苷、脱氧氟尿苷(doxifluridine)、依诺他滨(enocitabine)、氟尿苷 (floxuridine)、5-fu;雄性素,诸如卡鲁睪酮(calusterone )、屈他雄酮(dromostanolone)丙酸盐、硫雄甾醇 (epitiostanol)、美雄烷(mepitiostane)、睪内酮(testolactone );抗肾上腺剂,诸如氨鲁米特(aminoglutethimide)、米托坦(mitotane)、曲洛司坦(trilostane);叶酸补充剂,诸如亚叶酸;醋葡醛内酯(aceglatone);醛磷酰胺糖苷 (aldophosphamide glycoside);氨基酮戊酸(aminolevulinicacid);安吖啶(amsacrine);贝斯特氮芥(bestrabucil);比生群(bisantrene);依达曲沙(edatraxate);磷胺氮芥 (defofamine);秋水仙胺(demecolcine);地吖醌(diaziquone );艾氟米辛(elformithine);依利醋铵(elliptiniumacetate);依托格鲁(etoglucid);硝酸镓(gallium nitrate);羟基脲;香菇糖(lentinan);氯尼达明(lonidamine);米托胍腙(mitoguazone);米托蒽醌(mitoxantrone);莫哌达醇 (mopidamol);二胺硝吖啶(nitracrine);喷司他丁 (pentostatin);蛋胺氮芥(phenamet);吡柔比星 (pirarubicin);鬼臼酸(podophyllinic acid);2-乙基酰肼(2
‑ꢀ
ethylhydrazide);丙卡巴肼(procarbazine);psk;雷佐生 (razoxane);西佐喃(sizofuran);锗螺胺(spirogermanium) ;细交链孢菌酮酸(tenuazonic acid);三亚胺醌 (triaziquone);2,
2',2"-三氯三乙胺(2,2',2"
‑ꢀ
trichlorotriethylamine);乌拉坦(urethan);长春地辛 (vindesine);达卡巴嗪(dacarbazine);甘露莫司汀 (mannomustine);二溴甘露醇(mitobronitol);二溴卫矛醇 (mitolactol);哌泊溴烷(pipobroman);加西托星 (gacytosine);阿拉伯糖苷(ara-c);类紫杉醇(taxoids),例如太平洋紫杉醇(taxol)和多西紫杉醇(taxotere);苯丁酸氮芥(chlorambucil);吉西他滨(gemcitabine);6-硫鸟嘌呤;巯嘌呤(mercaptopurine);铂类似物,诸如顺铂 (cisplatin)和卡铂(carboplatin);长春碱(vinblastine);铂 (platinum);依托泊苷(etoposide)(vp-16);异环磷酰胺 (ifosfamide);丝裂霉素c;米托蒽醌(mitoxantrone);长春新碱(vincristine);长春瑞滨(vinorelbine);温诺平 (navelbine);米托蒽醌(novantrone);替尼泊苷 (teniposide);道诺霉素(daunomycin);氨喋呤 (aminopterin);伊班膦酸盐(ibandronate);cpt11;拓扑异构酶抑制剂rfs 2000;二氟甲基鸟胺酸(dmfo);视黄酸;埃斯培拉霉素(esperamicins);卡培他滨(capecitabine) (xeloda)及上述任一剂的医药上可接受的盐、酸或衍生物。化疗剂亦包括调节或抑制荷尔蒙对肿瘤作用的抗荷尔蒙剂,诸如抗雌激素剂,包括例如它莫西芬(tamoxifen)、雷洛昔芬(raloxifene)、芳香酶抑制4(5)-咪唑、4-羟基它莫西芬、曲沃昔芬(trioxifene)、雷洛昔芬(keoxifene)、ly117018、奥那司酮(onapristone)和托瑞米芬(toremifene) (fareston);及抗雄性素剂,诸如氟他胺(flutamide)、尼鲁米特(nilutamide)、比卡鲁胺(bicalutamide)、柳普林 (leuprolide)和戈舍瑞林(goserelin);及上述任一剂的医药上可接受的盐、酸或衍生物。在特定的实施方案中,额外治疗剂为顺铂。在特定的实施方案中,额外治疗剂为卡铂。
318.在特定的实施方案中,化疗剂为拓扑异构酶抑制剂。拓扑异构酶抑制剂为干扰拓扑异构酶(例如拓扑异构酶i或ii)活性的化疗剂。拓扑异构酶抑制剂包括但不限于多柔比星(doxorubicin)hcl、正定霉素柠檬酸盐 (daunorubicin citrate)、米托蒽醌(mitoxantrone)hcl、放线菌素d、依托泊苷(etoposide)、拓扑替康(topotecan) hcl、替尼泊苷(teniposide)(vm-26)及伊立替康 (irinotecan),以及这些中任一剂的医药上可接受的盐、酸或衍生物。在一些实施方案中,额外治疗剂为伊立替康。
319.在特定的实施方案中,化疗剂为抗代谢物。抗代谢物为化学物质,其结构类似正常生化反应所需的代谢物,但仍有足以干扰一或多种细胞正常功能的差别,诸如细胞分裂。抗代谢物包括但不限于吉西他滨 (gemcitabine)、氟尿嘧啶(fluorouracil)、卡培他滨 (capecitabine)、甲胺喋呤钠、雷替曲塞(ralitrexed)、培美曲塞(pemetrexed)、替加氟(tegafur)、胞嘧啶阿拉伯糖苷 (cytosine arabinoside)、硫鸟嘌呤、5-氮杂胞苷、6-巯基嘌呤、硫唑嘌呤、6-硫鸟嘌呤、喷司他丁(pentostatin)、氟达拉滨(fludarabine)盐酸盐和克拉屈滨(cladribine),以及这些中任一剂的医药上可接受的盐、酸或衍生物。在特定的实施方案中,额外治疗剂为吉西他滨。
320.在特定的实施方案中,化疗剂为抗有丝分裂剂,包括但不限于结合微管蛋白的剂。在一些实施方案中,该剂为紫杉烷。在特定的实施方案中,该剂为太平洋紫杉醇(paclitaxel)或多西紫杉醇(docetaxel),或太平洋紫杉醇或多西紫杉醇的医药上可接受的盐、酸或衍生物。在特定的实施方案中,该剂为太平洋紫杉醇(taxol)、多西紫杉醇(taxotere)、白蛋白结合的太平洋紫杉醇 (abraxane)、dha-太平洋紫杉醇或pg-太平洋紫杉醇。在特定的可替代实施方案中,抗有丝分裂剂包含长春花生物碱,诸如长春新碱
(vincristine)、长春碱(binblastine)、长春瑞滨(vinorelbine)或长春地辛(vindesine)或其医药上可接受的盐、酸或衍生物。在一些实施方案中,抗有丝分裂剂为驱动蛋白(kinesin)eg5的抑制剂或有丝分裂激酶(诸如auroraa或plk1)的抑制剂。在特定的实施方案中,额外治疗剂为太平洋紫杉醇。
321.在一些实施方案中,额外治疗剂包含诸如小分子的剂。例如,治疗可包含本发明的剂与作为抗肿瘤相关性抗原(包括但不限于egfr、her2(erbb2)及/或 vegf)的抑制剂作用的小分子的组合施用。在一些实施方案中,本发明的剂是与选自由下列所组成的群组的蛋白激酶抑制剂组合施用:吉非替尼(gefitinib)(iressa)、埃罗替尼(erlotinib)(tarceva)、舒尼替尼(sunitinib) (sutent)、拉帕替尼(lapatanib)、凡德他尼(vandetanib) (zactima)、aee788、ci-1033、西地尼布(cediranib) (recentin)、索拉非尼(sorafenib)(nexavar)和帕唑帕尼(pazopanib)(gw786034b)。在一些实施方案中,额外治疗剂包含mtor抑制剂。
322.在特定的实施方案中,额外治疗剂为抑制癌干细胞途径的剂。在一些实施方案中,额外治疗剂为 notch途径的抑制剂。在一些实施方案中,额外治疗剂为 wnt途径的抑制剂。在一些实施方案中,额外治疗剂为 bmp途径的抑制剂。在一些实施方案中,额外治疗剂为 hippo途径的抑制剂。在一些实施方案中,额外治疗剂为 rspo/lgr途径的抑制剂。在一些实施方案中,额外治疗剂为mtor/akr途径的抑制剂。
323.在一些实施方案中,额外治疗剂包含生物分子,诸如抗体。例如,治疗可包含本发明的剂与抗肿瘤相关性抗原的抗体(包括但不限于结合egfr、her2/erbb2 及/或vegf的抗体)的组合施用。在特定的实施方案中,额外治疗剂为对癌干细胞标记特异性的抗体。在一些实施方案中,额外治疗剂为结合notch途径的组分的抗体。在一些实施方案中,额外治疗剂为结合wnt途径的组分的抗体。在特定的实施方案中,额外治疗剂为抑制癌干细胞途径的抗体。在一些实施方案中,额外治疗剂为notch途径的抑制剂。在一些实施方案中,额外治疗剂为wnt途径的抑制剂。在一些实施方案中,额外治疗剂为bmp途径的抑制剂。在一些实施方案中,额外治疗剂为抑制β-连环蛋白传导信号的抗体。在特定的实施方案中,额外治疗剂为血管生成抑制剂的抗体(例如抗vegf或vegf受体抗体)。在特定的实施方案中,额外治疗剂为贝伐珠单抗 (bevacizumab)(avastin)、雷莫芦单抗(ramucirumab)、曲妥珠单抗(trastuzumab)(herceptin)、帕妥珠单抗 (pertuzumab)(omnitarg)、帕尼单抗(panitumumab) (vectibix)、尼妥珠单抗(nimotuzumab)、扎鲁木单抗 (zalutumumab)或西妥昔单抗(cetuximab)(erbitux)。
324.在特定的实施方案中,除了施用本文所述的 tigit结合剂以外,该方法或治疗另外包含施用至少一种额外的免疫治疗剂。在一些实施方案中,额外的免疫治疗剂为免疫反应刺激剂。在一些实施方案中,免疫治疗剂 (例如免疫反应刺激剂)包括但不限于集落刺激因子(例如颗粒细胞-巨噬细胞集落刺激因子(gm-csf)、巨噬细胞集落刺激因子(m-csf)、颗粒细胞集落刺激因子(g-csf)、干细胞因子(scf))、白介素(例如il-1、il2、il-3、il-7、il
‑ꢀ
12、il-15、il-18)、阻断免疫抑制功能的抗体(例如抗 ctla4抗体、抗cd28抗体、抗cd3抗体、抗pd-1抗体、抗pd-l1抗体)、增强免疫细胞功能的抗体(例如抗 gitr抗体或抗ox-40抗体)、toll样受体(例如tlr4、 tlr7、tlr9)、可溶性配体(例如gitrl或ox-40l)或b7 家族成员(例如cd80、cd86)。额外的免疫治疗剂(例如免疫反应刺激剂)可在施用tigit结合剂之前、同步
及/或之后施用。亦提供包含tigit结合剂及额外的免疫治疗剂 (例如免疫反应刺激剂)的医药组合物。在一些实施方案中,免疫治疗剂包含1、2、3或更多种免疫治疗剂。在一些实施方案中,免疫反应刺激剂包含1、2、3或更多种免疫反应刺激剂。
325.在一些实施方案中,额外治疗剂为免疫检查点抑制剂的抗体。在一些实施方案中,免疫检查点抑制剂为抗pd-1抗体、抗pd-l1抗体、抗ctla4抗体、抗 cd28抗体、抗lag3抗体、抗tim3抗体、抗gitr抗体或抗ox-40抗体。在一些实施方案中,免疫检查点抑制剂为抗4-1bb抗体。在一些实施方案中,额外治疗剂为选自由下列所组成的群组的抗pd-1抗体:尼沃单抗 (nivolumab)(opdivo)、派姆单抗(pembrolizumab) (keytruda)或皮狄单抗(pidilzumab)。在一些实施方案中,额外治疗剂为选自由下列所组成的群组的抗pd-1抗体:medi0680、regn2810、bgb-a317和pdr001。在一些实施方案中,额外治疗剂为选自由下列所组成的群组的抗pd-l1抗体:bms935559(mdx-1105),阿替索单抗 (atexolizumab)(mpdl3280a)、德瓦鲁单抗(durvalumab) (medi4736)或阿维单抗(avelumab)(msb0010718c)。在一些实施方案中,额外治疗剂为选自由下列所组成的群组的抗ctla-4抗体:伊匹单抗(ipilimumab)(yervoy)或曲美木单抗(tremelimumab)。在一些实施方案中,额外治疗剂为选自由下列所组成的群组的抗lag-3抗体:bms
‑ꢀ
986016和lag525。在一些实施方案中,额外治疗剂为选自由下列所组成的群组的抗ox-40抗体:medi6469、 medi0562和moxr0916。在一些实施方案中,额外治疗剂为选自由下列所组成的群组的抗4-1bb抗体:pf
‑ꢀ
05082566。
326.此外,以本文所述的tigit结合剂治疗可包括与其他的生物分子的组合治疗,诸如一或多种细胞激素 (例如淋巴激素、白介素、干扰素、肿瘤坏死因子及/或生长因子),或可伴随手术移除肿瘤、移除癌细胞或由治疗医师认为必要的任何其他疗法。
327.在一些实施方案中,tigit结合剂可与选自由下列所组成的群组的生物分子组合施用:肾上腺髓质素 (am)、血管生成素(ang)、bmps、bdnf、egf、红血球生成素(epo)、fgf、gdnf、g-csf、gm-csf、gdf9、 hgf、hdgf、igf、移动刺激因子、肌肉抑制素(gdf
‑ꢀ
8)、ngf、神经生长激素、pdgf、血小板生成素、tgf
‑ꢀ
α、tgf-β、tnf-α、vegf、plgf、γ-ifn、il-1、il-2、 il-3、il-4、il-5、il-6、il-7、il-12、il-15和il-18。在一些实施方案中,tigit结合剂可与选自由下列所组成的群组的生物分子组合施用:巨噬细胞集落刺激因子(m
‑ꢀ
csf)和干细胞因子(scf)。
328.在一些实施方案中,以本文所述的tigit结合剂治疗可伴随手术移除肿瘤、移除癌细胞或由治疗医师认为必要的任何其他手术疗法。
329.在特定的实施方案中,治疗包含施用本发明的tigit结合剂与放射疗法的组合。以tigit结合剂治疗可发生在施用放射疗法之前、同时或之后。此放射治疗的给量时程可由熟习的医师决定。
330.在特定的实施方案中,治疗包含施用本发明的tigit结合剂与抗病毒疗法组合。以tigit结合剂治疗可发生在施用抗病毒疗法之前、同时或之后。在组合疗法中所使用的抗病毒药物是取决于受试者感染的病毒而定。
331.组合施用可包括以单一医药调配物或使用分开的调配物共同施用,或以任何顺序连续施用,但是通常在一段期间内,使得所有的活性剂可同时发挥那些生物活性。
332.应理解本文所述的tigit结合剂与至少一种额外治疗剂的组合可以任何顺序施用或同步施用。在一些实施方案中,将tigit结合剂施用给先前已接受第二治疗剂治疗的患
者。在特定的其他实施方案中,tigit结合剂与第二治疗剂实质上同时或同步施用。例如,受试者可在接受第二治疗剂(例如化疗法)期间同时施用tigit结合剂。在特定的实施方案中,tigit结合剂是在以第二治疗剂治疗的1年内施用。在特定的可替代实施方案中, tigit结合剂是在以第二治疗剂的任何治疗的10、8、6、 4或2个月内施用。在特定的其他实施方案中,tigit结合剂是在以第二治疗剂的任何治疗的4、3、2或1周内施用。在一些实施方案中,结合剂是在以第二治疗剂的任何治疗的5、4、3、2或1天内施用。应进一步理解两种(或更多种)剂或治疗可在数小时或数分钟内(亦即实质上同时) 施用给受试者。
333.用于疾病治疗的本发明的tigit结合剂的适当剂量是取决于所期望的治疗的疾病类型、疾病的严重性和病程、疾病的反应性、结合剂是否以治疗或预防目的施用、先前治疗、患者的临床病史等等而定,所有皆由主治医师斟酌。tigit结合剂可施用一次或从数天持续至数月的治疗系列施用,或直到完成疗效或达到疾病状态的缩减 (例如减少肿瘤大小)。最优化给药方案可自药物累积于患者体内的测量值计算,且取决于个别剂的相对效力而改变。投药医师可决定最优化剂量、给药方法及重复频率。在特定的实施方案中,剂量为0.01微克至100毫克/公斤体重,从0.1微克至100毫克/公斤体重,从1微克至100 毫克/公斤体重,从1毫克至100毫克/公斤体重,1毫克至80毫克/公斤体重,从10毫克至100毫克/公斤体重,从10毫克至75毫克/公斤体重,或从10毫克至50毫克/ 公斤体重。在特定的实施方案中,tigit结合剂的剂量为从约0.1毫克至约20毫克/公斤体重。在一些实施方案中,tigit结合剂剂量为约0.5毫克/公斤体重。在一些实施方案中,tigit结合剂的剂量为约1毫克/公斤体重。在一些实施方案中,tigit结合剂的剂量为约1.5毫克/公斤体重。在一些实施方案中,tigit结合剂的剂量为约2毫克/公斤体重。在一些实施方案中,tigit结合剂的剂量为约2.5毫克/公斤体重。在一些实施方案中,tigit结合剂的剂量为约5毫克/公斤体重。在一些实施方案中,tigit 结合剂的剂量为约7.5毫克/公斤体重。在一些实施方案中,tigit结合剂的剂量为约10毫克/公斤体重。在一些实施方案中,tigit结合剂的剂量为约12.5毫克/公斤体重。在一些实施方案中,tigit结合剂的剂量为约15毫克/公斤体重。在特定的实施方案中,剂量可以每天、每周、每月或每年给予一或多次。在特定的实施方案中, tigit结合剂可以每周给予一次、每两周给予一次、每三周给予一次或每四周给予一次。
334.在一些实施方案中,tigit结合剂可以最初较高的〝加载(loading)〞剂量施用,随后以一或多个较低剂量施用。在一些实施方案中,亦可改变施用频率。在一些实施方案中,给药方案可包含以初始剂量施用,随后以每周一次、每二周一次、每三周一次或每月一次额外剂量 (或〝维持〞剂量)施用。例如,给药方案可包含以初始加载剂量施用,随后以例如一半初始剂量的每周维持剂量施用。或者,给药方案可包含以初始加载剂量施用,随后每隔一周以例如一半的初始剂量的维持剂量施用。或者,给药方案可包含经3周施用三次初始剂量,随后每隔一周以例如相同量的维持剂量施用。
335.如那些熟习本技领域者已知,施用任何治疗剂可引起副作用及/或毒性。在一些例子中,副作用及/或毒性非常严重以至于无法施用治疗有效剂量的特定剂。在一些例子中,药物疗法必须中断,且可尝试其他剂。然而,许多相同治疗类别的剂时常展现类似的副作用及/或毒性,意指患者必须停止治疗,或若可能,则忍受与治疗剂相关联的不适副作用。
336.在一些实施方案中,给药方案可限制成特定次数的施用或〝周期〞。在一些实施方案中,tigit结合剂是经3、4、5、6、7、8或更多个周期施用。例如, tigit结合剂是以每2周经6
个周期施用,tigit结合剂是以每3周经6个周期施用,tigit结合剂是以每2周经 4个周期施用,tigit结合剂是以每3周经4个周期施用等等。给药方案可考虑后决定且随后由那些熟习本技术领域者修改。
337.本发明提供对受试者施用本文所述的tigit 结合剂的方法,其包含使用间歇性给药策略施用一或多种剂,这可降低与施用结合剂、化疗剂等等相关联的副作用及/或毒性。在一些实施方案中,治疗人类受试者的癌症的方法包含对受试者施用治疗有效剂量的结合剂与治疗有效剂量的化疗剂的组合,其中剂中的一或二者是根据间歇性给药策略施用。在一些实施方案中,间歇性给药策略包含对受试者施用初始剂量的结合剂且约每2周施用一次结合剂的后续剂量。在一些实施方案中,间歇性给药策略包含对受试者施用初始剂量的结合剂且约每3周施用一次结合剂的后续剂量。在一些实施方案中,间歇性给药策略包含对受试者施用初始剂量的结合剂且约每4周施用一次结合剂的后续剂量。在一些实施方案中,结合剂是使用间歇性给药策略施用及化疗剂是每周施用。
338.本发明提供包含本文所述的tigit结合剂的组合物。本发明亦提供包含本文所述的tigit结合剂及医药上可接受的媒剂的医药组合物。在一些实施方案中,发现医药组合物在免疫治疗中的用途。在一些实施方案中,发现组合物在抑制肿瘤生长中的用途。在一些实施方案中,发现医药组合物在抑制受试者(例如人类患者)的肿瘤生长中的用途。在一些实施方案中,发现组合物在治疗癌症中的用途。在一些实施方案中,发现医药组合物在治疗受试者(例如人类患者)的癌症中的用途。
339.制备用于贮存及藉由组合纯化的抗体或本发明的tigit结合剂与医药上可接受的媒剂(例如载剂或赋形剂)而使用的调配物。那些熟习本技术领域者通常考虑成为调配物或医药组合物的无活性成分的医药上可接受的载剂、赋形剂及/或稳定剂。
340.适合的医药上可接受的媒剂包括但不限于无毒性缓冲剂,诸如磷酸盐、柠檬酸盐及其他的有机酸;盐,诸如氯化钠;抗氧化剂,包括抗坏血酸及甲硫胺酸;保存剂,诸如氯化十八烷基二甲基苯甲铵、氯化六烃季铵、氯化苯甲烃铵、氯化苯甲乙氧铵、酚、丁醇或苯甲醇、对羟苯甲酸烷酯(诸如对羟苯甲酸甲酯或对羟苯甲酸丙酯)、儿茶酚、间苯二酚、环己醇、3-戊醇和间甲酚;低分子量多肽(例如少于约10个氨基酸残基);蛋白质,诸如血清白蛋白、明胶或免疫球蛋白;亲水性聚合物,诸如聚乙烯基吡咯啶酮;氨基酸,诸如甘氨酸、谷氨酰胺、天冬酰胺、组氨酸、精氨酸或赖氨酸;碳水化合物,诸如单醣、双醣、葡萄糖、甘露糖或糊精;螯合剂,诸如 edta;糖,诸如蔗糖、甘露醇、海藻糖或山梨醇;盐形成的相对离子,诸如钠;金属复合物(例如zn-蛋白质复合物);及非离子性界面活性剂,诸如tween或聚乙二醇 (peg)。(remington:the science and practice ofpharmacy,22
st edition,2012,pharmaceutical press, london)。
341.本发明的医药组合物可以任何数种方式经局部或全身性施用。施用可为藉由表皮或透皮贴片、软膏、洗剂、乳膏、凝胶、滴剂、栓剂、喷剂、液体及粉剂的局部施用;藉由吸入或喷入粉剂或气雾剂的经肺施用,包括藉由喷雾器、气管内或鼻内施用;经口;或非经肠,包括静脉内、动脉内、肿瘤内、皮下、腹膜内、肌肉内(例如注射或输注)或颅内(例如脊椎鞘内或心室内)。
342.治疗调配物可呈单位剂量形式。此等调配物包括锭剂、丸剂、胶囊、粉剂、颗粒、在水或非水性介质中的溶液或悬浮液、或栓剂。在固态组合物中,诸如锭剂,主要活性成分是
与医药载剂混合。公知的制锭成分包括玉米淀粉、乳糖、蔗糖、山梨醇、滑石、硬脂酸、硬脂酸镁、磷酸二钙或胶和稀释剂(例如水)。这些可用于形成含有本发明化合物或其无毒性的医药上可接受的盐的均匀混合物的固体预调配组合物。固体预调配组合物接着细分成上述类型的单位剂量形式。可将调配物或组合物的锭剂、丸剂等等可包膜或以其他方式化合,以提供给予延长作用的优点的剂型。例如,锭剂或丸剂可包含以外部组分包覆的内部组合物。此外,两种组分可以肠溶层分开,肠溶层适合于抵抗崩解且允许内部组分完整通过胃或延迟释放。可以各种材料用于此等肠溶层或包膜,此等材料包括多种聚合酸及聚合酸与诸如虫胶、鲸腊醇和乙酸纤维素的材料的混合物。
343.本文所述的tigit结合剂亦可包封于微胶囊中。此等微胶囊是藉由例如凝聚技术或藉由界面聚合反应来制备,例如分别于胶体药物递送系统(例如脂质粒、白蛋白微球、微乳液、纳米粒子和纳米微囊)或于巨乳液中的羟甲基纤维素或明胶微胶囊和聚-(甲基丙烯酸甲酯)微胶囊,如remington:the science and practice of pharmacy, 22
st edition,2012,pharmaceutical press,london中所述。
344.在特定的实施方案中,医药调配物包括与脂质粒复合的本发明的tigit结合剂。生产脂质粒的方法为那些熟习本技领域者已知。例如,一些脂质粒可藉包含磷脂酰胆碱、胆固醇及peg-衍生性磷脂酰乙醇胺(peg-pe) 的脂质组合物的反相蒸发而产生。脂质粒可经挤压通过限定孔径的过滤器,得到具有所期望的直径的脂质粒。
345.在特定的实施方案中,可生产包含本文所述的tigit结合剂的持续释放型制剂。持续释放型制剂的适合的实例包括含有tigit结合剂的固相疏水性聚合物的半透性基质,其中基质是呈成形对象(例如膜或微胶囊)形式。持续释放型基质的实例包括聚酯、水凝胶(诸如聚(2
‑ꢀ
羟乙基-甲基丙烯酸酯)或聚乙烯醇)、聚交酯、l-谷氨酸与 7乙基-l-谷氨酸酯的共聚物、不可降解的乙烯-乙酸乙烯酯、可降解的乳酸-乙醇酸共聚物,诸如luprondepot
tm
(由乳酸-乙醇酸共聚物及柳菩林(leuprolideacetate)所组成的注射微球)、蔗糖乙酸异丁酸酯和聚-d-(
‑ꢀ
)-3-羟丁酸。v.实施方案
346.在实施方案1中,特异性结合tigit的细胞外结构域的分离的抗体,其包含:(a)包含gsslsssyms (seq id no:7)或gfslsssyms(seq id no:13)的重链 cdr1、包含iigsngntyyanwakg(seq id no:8)的重链cdr2及包含ggyrtsgmdp(seq id no:9)的重链 cdr3;及/或(b)包含qasqsissylnw(seq id no: 10)、qasqsniysdlaw(seq id no:14)或 qasqniysklaw(seq id no:81)的轻链cdr1、包含 dalklas(seq id no:11)或rastlas(seq id no: 15)的轻链cdr2及包含qqehsvgnvdn(seq id no: 12)或qqehlvawiyn(seq id no:16)的轻链cdr3。
347.在实施方案2中,实施方案1的抗体包含: (a)包含gsslsssyms(seq id no:7)的重链cdr1、包含iigsngntyyanwakg(seq id no:8)的重链cdr2 及包含ggyrtsgmdp(seq id no:9)的重链cdr3;及/ 或(b)包含qasqsissylnw(seq id no:10)的轻链 cdr1、包含dalklas(seq id no:11)的轻链cdr2及包含qqehsvgnvdn(seq id no:12)的轻链cdr3。
348.在实施方案3中,实施方案1的抗体包含: (a)包含gfslsssyms(seq id no:13)的重链cdr1、包含iigsngntyyanwakg(sq id no:8)的重链cdr2及包含ggyrtsgmdp(seq id no:9)的重链cdr3;及/或 (b)包含qasqniysklaw(seq id no:81)的轻链 cdr1、包含
rastlas(seq id no:15)的轻链cdr2及包含qqehlvawiyn(seq id no:16)的轻链cdr3。
349.在实施方案4中,特异性结合tigit的分离的抗体,其包含:(a)与seq id no:17、seq id no:19 或seq id no:32具有至少90%的序列一致性的重链可变区;及/或(b)与seq id no:18或seq id no:20具有至少90%的序列一致性的轻链可变区。
350.在实施方案5中,实施方案1至4中任一者的抗体包含:(a)与seq id no:17、seq id no:19或 seq id no:32具有至少95%的序列一致性的重链可变区;及/或(b)与seq id no:18或seq id no:20具有至少95%的序列一致性的轻链可变区。
351.在实施方案6中,实施方案5的抗体包含: (a)包含seq id no:17的重链可变区;及(b)包含seq idno:18的轻链可变区。
352.在实施方案7中,实施方案5的抗体包含: (a)包含seq id no:19的重链可变区;及(b)包含seq idno:20的轻链可变区。
353.在实施方案8中,实施方案5的抗体包含: (a)包含seq id no:32的重链可变区;及(b)包含seq idno:20的轻链可变区。
354.在实施方案9中,实施方案1至8中任一者的抗体为单克隆抗体。
355.在实施方案10中,实施方案1至9中任一者的抗体为人源化抗体。
356.在实施方案11中,实施方案1至10中任一者的抗体为人类抗体。
357.在实施方案12中,根据实施方案1至10中任一者的抗体为重组抗体或嵌合抗体。
358.在实施方案13中,实施方案1至12中任一者的抗体为双特异性抗体。
359.在实施方案14中,实施方案1至13中任一者的抗体为包含抗原结合部位的抗体片段。
360.在实施方案15中,实施方案1至13中任一者的抗体为igg抗体。
361.在实施方案16中,实施方案15的抗体为igg1抗体、igg2抗体或igg4抗体。
362.在实施方案17中,抗体包含(a)选自由下列所组成的群组的重链氨基酸序列:seq id no:26、seq idno:27、seq id no:29、seq id no:34和seq idno:56;及(b)选自由下列所组成的群组的轻链氨基酸序列:seq id no:28和seq id no:30。
363.在实施方案18中,实施方案17的抗体包含 seq id no:26的重链氨基酸序列和seq id no:28的轻链氨基酸序列。
364.在实施方案19中,实施方案17的抗体包含 seq id no:27的重链氨基酸序列和seq id no:28的轻链氨基酸序列。
365.在实施方案20中,实施方案17的抗体包含 seq id no:29的重链氨基酸序列和seq id no:30的轻链氨基酸序列。
366.在实施方案21中,实施方案17的抗体包含 seq id no:34的重链氨基酸序列和seq id no:30的轻链氨基酸序列。
367.在实施方案22中,实施方案17的抗体包含 seq id no:56的重链氨基酸序列和seq id no:30的轻链氨基酸序列。
368.在实施方案23中,抗体包含来自选自由下列所组成的群组的抗体的重链可变区和轻链可变区: 313r11、313r12、313r14、313r19和313r20。
369.在实施方案24中,抗体是选自由下列所组成的群组:313r11、313r12、313r14、313r19和313r20。
370.在实施方案25中,抗体包含由保藏于atcc 编号为pta-122180的质粒编码的重链可变区。
371.在实施方案26中,抗体包含由保藏于atcc 编号为pta-122181的质粒编码的轻链可变区。
372.在实施方案27中,抗体包含多肽,该多肽包含由保藏于atcc编号为pta-122180的质粒编码的重链可变区。
373.在实施方案28中,抗体包含多肽,该多肽包含由保藏于atcc编号为pta-122181的质粒编码的轻链可变区。
374.在实施方案29中,抗体包含由保藏于atcc 编号为pta-122180的质粒编码的重链可变区和由保藏于 atcc编号为pta-122181的质粒编码的轻链可变区。
375.在实施方案30中,抗体包含由保藏于atcc 编号为pta-122180的质粒和由保藏于atcc编号为pta
‑ꢀ
122181的质粒编码的多肽。
376.在实施方案31中,分离的抗体与实施方案1 至30中任一者的抗体竞争与tigit特异性结合。
377.在实施方案32中,分离的抗体与实施方案1 至30中任一者的抗体结合tigit的相同的抗原决定区。
378.在实施方案33中,分离的抗体结合tigit的抗原决定区,该抗原决定区与实施方案1至30中任一者的抗体结合的tigit的抗原决定区重叠。
379.在实施方案34中,实施方案1至33中任一者的抗体,其抑制tigit与脊髓灰白质病毒受体(pvr)结合。
380.在实施方案35中,实施方案1至33中任一者的抗体,其抑制或阻断tigit与pvr之间的交互作用。
381.在实施方案36中,实施方案1至33中任一者的抗体,其抑制tigit传导信号。
382.在实施方案37中,实施方案1至33中任一者的抗体,其为经tigit介导的传导信号的拮抗剂。
383.在实施方案38中,实施方案1至33中任一者的抗体,其抑制tigit活化。
384.在实施方案39中,实施方案1至33中任一者的抗体,其抑制tigit的磷酸化。
385.在实施方案40中,实施方案1至33中任一者的抗体,其降低tigit的细胞表面表达。
386.在实施方案41中,实施方案1至33中任一者的抗体,其诱发及/或增强免疫反应。
387.在实施方案42中,实施方案41的抗体,其中免疫反应是针对肿瘤或肿瘤细胞。
388.在实施方案43中,实施方案41的抗体,其中免疫反应是针对病毒或病毒感染细胞。
389.在实施方案44中,实施方案1至33中任一者的抗体,其增加细胞介导的免疫力。
390.在实施方案45中,实施方案1至33中任一者的抗体,其增加t细胞活性。
391.在实施方案46中,实施方案1至33中任一者的抗体,其增加溶胞性t细胞(ctl)活性。
392.在实施方案47中,实施方案1至33中任一者的抗体,其增加自然杀手(nk)细胞活性。
393.在实施方案48中,实施方案1至33中任一者的抗体,其增加il-2生产及/或il-2生产细胞的数目。
394.在实施方案49中,实施方案1至33中任一者的抗体,其增加ifn-γ生产及/或ifn-γ生产细胞的数目。
395.在实施方案50中,实施方案1至33中任一者的抗体,其增强th1型免疫反应。
396.在实施方案51中,实施方案1至33中任一者的抗体,其降低il-4生产及/或il-4生产细胞的数目。
397.在实施方案52中,实施方案1至33中任一者的抗体,其降低il-10及/或il-10生产细胞的数目。
398.在实施方案53中,实施方案1至33中任一者的抗体,其降低th2型免疫反应。
399.在实施方案54中,实施方案1至33中任一者的抗体,其抑制及/或降低调节性t细胞(treg)的抑制活性。
400.在实施方案55中,实施方案1至33中任一者的抗体,其抑制及/或降低骨髓衍生性抑制细胞(mdsc) 的抑制活性。
401.在实施方案56中,实施方案1至55中任一者的抗体,其抑制肿瘤生长。
402.在实施方案57中,异质二聚体剂包含实施方案1至33中任一者的抗体。
403.在实施方案58中,双特异性剂包含a)特异性结合tigit的第一臂,及b)第二臂,其中第一臂包含实施方案1至33中任一者的抗体。
404.在实施方案59中,实施方案58的双特异性剂,其中第二臂包含来自抗体的抗原结合部位。
405.在实施方案60中,实施方案58的双特异性剂,其中第二臂特异性结合pd-1、pd-l1、ctla4、tim
‑ꢀ
3、lag-3、ox-40或gitr。
406.在实施方案61中,实施方案58的双特异性剂,其中第二臂特异性结合肿瘤抗原。
407.在实施方案62中,实施方案58的双特异性剂,其中第二臂包含免疫反应刺激剂。
408.在实施方案63中,实施方案62的双特异性剂,其中免疫反应刺激剂是选自由下列所组成的群组:颗粒细胞-巨噬细胞集落刺激因子(gm-csf)、巨噬细胞集落刺激因子(m-csf)、颗粒细胞集落刺激因子(g-csf)、白介素2(il-2)、白介素3(il-3)、白介素12(il-12)、白介素 15(il-15)、b7-1(cd80)、b7-2(cd86)、4-1bb配体、gitrl、ox-40l、抗cd3抗体、抗ctla4抗体、抗pd
‑ꢀ
1抗体、抗pd-l1抗体、抗gitr抗体、抗ox-40抗体、抗lag-3抗体和抗tim-3抗体。
409.在实施方案64中,实施方案58至63中任一者的双特异性剂,其中第一臂包含第一ch3结构域及第二臂包含第二ch3结构域,各ch3结构域经修饰以促进异质二聚体的形成。
410.在实施方案65中,实施方案64的双特异性剂,其中第一及第二ch3结构域是基于静电效应而修饰。
411.在实施方案66中,实施方案58至63中任一者的双特异性剂,其中第一臂包含在对应于seq id no: 41的位置253和292上具有氨基酸取代的第一人类igg1 恒定区,其中氨基酸是经谷氨酸或天冬氨酸取代,及第二臂包含在对应于seq id no:41的位置240和282上具有氨基酸取代的第二人类igg1恒定区,其中氨基酸是经赖氨酸取代。
412.在实施方案67中,实施方案58至63中任一者的双特异性剂,其中第一臂包含在对应于seq id no: 41的位置240和282上具有氨基酸取代的第一人类igg1 恒定区,其中氨基酸是经赖氨酸取代,及第二臂包含在对应于seq id no:41的位置253和292上具有氨基酸取
代的第二人类igg1恒定区,其中氨基酸是经谷氨酸或天冬氨酸取代。
413.在实施方案68中,实施方案58至63中任一者的双特异性剂,其中第一臂包含在对应于seq id no: 42的位置249和288上具有氨基酸取代的第一人类igg2 恒定区,其中氨基酸是经谷氨酸或天冬氨酸取代,及第二臂包含在对应于seq id no:42的位置236和278上具有氨基酸取代的第二人类igg2恒定区,其中氨基酸是经赖氨酸取代。
414.在实施方案69中,实施方案58至63中任一者的双特异性剂,其中第一臂包含在对应于seq id no: 42的位置236和278上具有氨基酸取代的第一人类igg2 恒定区,其中氨基酸是经赖氨酸取代,及第二臂包含在对应于seq id no:42的位置249和288上具有氨基酸取代的第二人类igg2恒定区,其中氨基酸是经谷氨酸或天冬氨酸取代。
415.在实施方案70中,实施方案64的双特异性剂,其中第一及第二ch3结构域是使用突起进入孔中技术修饰。
416.在实施方案71中,实施方案58至70中任一者的双特异性剂,其抑制tigit与pvr结合。
417.在实施方案72中,实施方案58至70中任一者的双特异性剂,其抑制或阻断tigit与pvr之间的交互作用。
418.在实施方案73中,实施方案58至70中任一者的双特异性剂,其抑制tigit传导信号。
419.在实施方案74中,实施方案58至70中任一者的双特异性剂,其为经tigit介导的传导信号的拮抗剂。
420.在实施方案75中,实施方案58至70中任一者的双特异性剂,其抑制tigit活化。
421.在实施方案76中,实施方案58至70中任一者的双特异性剂,其抑制tigit的磷酸化。
422.在实施方案77中,实施方案58至70中任一者的双特异性剂,其降低tigit的细胞表面表达。
423.在实施方案78中,实施方案58至70中任一者的双特异性剂,其诱发及/或增强免疫反应。
424.在实施方案79中,实施方案78的双特异性剂,其中免疫反应是针对肿瘤或肿瘤细胞。
425.在实施方案80中,实施方案78的双特异性剂,其中免疫反应是针对病毒或病毒感染细胞。
426.在实施方案81中,实施方案58至70中任一者的双特异性剂,其增加细胞介导的免疫力。
427.在实施方案82中,实施方案58至70中任一者的双特异性剂,其增加t细胞活性。
428.在实施方案83中,实施方案58至70中任一者的双特异性剂,其增加ctl活性。
429.在实施方案84中,实施方案58至70中任一者的双特异性剂,其增加nk细胞活性。
430.在实施方案85中,实施方案58至70中任一者的双特异性剂,其增加il-2生产及/或il-2生产细胞的数目。
431.在实施方案86中,实施方案58至70中任一者的双特异性剂,其增加ifn-γ生产及/或ifn-γ生产细胞的数目。
432.在实施方案87中,实施方案58至70中任一者的双特异性剂,其增强th1型免疫反应。
433.在实施方案88中,实施方案58至70中任一者的双特异性剂,其降低il-4生产及/或il-4生产细胞的数目。
434.在实施方案89中,实施方案58至70中任一者的双特异性剂,其降低il-10及/或il-10生产细胞的数目。
435.在实施方案90中,实施方案58至70中任一者的双特异性剂,其降低th2型免疫反应。
436.在实施方案91中,实施方案58至70中任一者的双特异性剂,其抑制及/或降低treg的抑制活性。
437.在实施方案92中,实施方案58至70中任一者的双特异性剂,其抑制及/或降低mdsc的抑制活性。
438.在实施方案93中,实施方案58至92中任一者的双特异性剂,其抑制肿瘤生长。
439.在实施方案94中,多肽包含选自由下列所组成的群组的序列:seq id no:17、seq id no:18、 seq id no:19、seq id no:20、seq id no:21、seq id no:22、seq id no:23、seq id no:24、 seq id no:25、seq id no:26、seq id no:27、 seq id no:28、seq id no:29、seq id no:30、 seq id no:32、seq id no:33、seq id no:34、 seq id no:55和seq id no:56。
440.在实施方案95中,细胞包含或生产实施方案 1至94中任一者的抗体、双特异性剂或多肽。
441.在实施方案96中,组合物包含实施方案1至 94中任一者的抗体、双特异性剂或多肽。
442.在实施方案97中,医药组合物包含实施方案 1至94中任一者的抗体、双特异性剂或多肽及医药上可接受的载剂。
443.在实施方案98中,分离的多核苷酸分子包含编码实施方案1至94中任一者的抗体、双特异性剂或多肽的多核苷酸。
444.在实施方案99中,载体包含实施方案98的多核苷酸。
445.在实施方案100中,分离的细胞包含实施方案98的多核苷酸或实施方案99的载体。
446.在实施方案101中,诱发、活化、促进、增强、提高或延长受试者的免疫反应的方法,其包含施用治疗有效量的实施方案1至94中任一者的抗体、双特异性剂或多肽。
447.在实施方案102中,诱发、活化、促进、增强、提高或延长受试者的免疫反应的方法,其包含施用治疗有效量的实施方案1至33中任一者的抗体。
448.在实施方案103中,实施方案101或实施方案102的方法,其中免疫反应是对抗肿瘤或癌。
449.在实施方案104中,抑制肿瘤细胞生长的方法,其中该方法包含将肿瘤细胞与有效量的实施方案1至 94中任一者的抗体、双特异性剂或多肽接触。
450.在实施方案105中,抑制受试者的肿瘤生长的方法,其中该方法包含对受试者施用治疗有效量的实施方案1至94中任一者的抗体、双特异性剂或多肽。
451.在实施方案106中,抑制受试者的肿瘤生长的方法,其中该方法包含对受试者施用
治疗有效量的实施方案1至33中任一者的抗体。
452.在实施方案107中,实施方案103至106中任一者的方法,其中肿瘤或肿瘤细胞是选自由下列所组成的群组:结肠直肠肿瘤、卵巢肿瘤、胰肿瘤、肺肿瘤、肝肿瘤、乳房肿瘤、肾肿瘤、前列腺肿瘤、胃肠道肿瘤、黑色素瘤、子宫颈肿瘤、膀胱肿瘤、神经胶质母细胞瘤和头与颈肿瘤。
453.在实施方案108中,治疗受试者的癌症的方法,其中该方法包含对受试者施用治疗有效量的实施方案 1至94中任一者的抗体、双特异性剂或多肽。
454.在实施方案109中,治疗受试者的癌症的方法,其中该方法包含对受试者施用治疗有效量的实施方案1至33中任一者的抗体。
455.在实施方案110中,实施方案108或实施方案109的方法,其中癌症是选自由下列所组成的群组:结肠直肠癌、卵巢癌、胰脏癌、肺癌、肝癌、乳癌、肾脏癌、前列腺癌、胃肠道癌、黑色素瘤、子宫颈癌、膀胱癌、神经胶质母细胞瘤和头与颈癌。
456.在实施方案111中,实施方案101至100中任一者的方法,其另外包含施用至少一种额外治疗剂。
457.在实施方案112中,实施方案111的方法,其中额外治疗剂为化疗剂。
458.在实施方案113中,实施方案111的方法,其中额外治疗剂为抗体。
459.在实施方案114中,实施方案111的方法,其中额外治疗剂为抗pd-1抗体、抗pd-l1抗体、抗 ctla4抗体、抗lag-3抗体、或抗tim-3抗体。
460.在实施方案115中,实施方案111的方法,其中额外治疗剂为免疫反应刺激剂。
461.在实施方案116中,实施方案115的方法,其中免疫反应刺激剂是选自由下列所组成的群组:gm
‑ꢀ
csf、m-csf、g-csf、il-2、il-3、il-12、il-15、b7-1 (cd80)、b7-2(cd86)、4-1bb配体、gitrl、ox-40配体、抗cd3抗体、抗ctla4抗体、抗pd-1抗体、抗 pd-l1抗体、抗gitr抗体、抗ox-40抗体、抗lag-3 抗体和抗tim-3抗体。
462.在实施方案117中,实施方案111的方法,其中额外治疗剂为notch途径、wnt途径或rspo/lgr途径的抑制剂。
463.在实施方案118中,实施方案101至103或 105至117中任一者的方法,其中受试者为人类。
464.在实施方案119中,实施方案101至103或 105至118中任一者的方法,其中受试者具有肿瘤或移除的癌。
465.在实施方案120中,实施方案101至119中任一者的方法,其中肿瘤或癌表达pd-l1。
466.在实施方案121中,实施方案101至120中任一者的方法,其另外包含测定肿瘤或癌中的pd-l1表达量的步骤。
467.在实施方案122中,实施方案121的方法,其中测定pd-l1表达量是在治疗或与抗体接触之前进行。
468.在实施方案123中,实施方案121或实施方案122的方法,其中若肿瘤或癌具有上升的pd-l1表达量,则将抗体、双特异性剂或多肽:(a)施用受试者;或 (b)与肿瘤或肿瘤细胞接触。
469.在实施方案124中,保藏于atcc且分配的指定编号为pta-122180的质粒。
470.在实施方案125中,保藏于atcc且分配的指定编号为pta-122181的质粒。
471.在实施方案126中,特异性结合人类tigit 的细胞外结构域的分离的抗体,其包含:(a)包含tsdyawn(seq id no:57)的重链cdr1、包含 yisysgstsynpslrs(seq id no:58)的重链cdr2及包含arrqvglgfay(seq id no:59)的重链cdr3;及/ 或(b)包含kasqdvstava(seq id no:60)的轻链 cdr1、包含sasyryt(seq id no:61)的轻链cdr2及包含qqhystp(seq id no:62)的轻链cdr3。
472.在实施方案127中,特异性结合人类tigit 的分离的抗体,其包含:(a)与seq id no:63或seq idno:67具有至少90%的序列一致性的重链可变区;及/或 (b)与seq id no:64或seq id no:68具有至少90%的序列一致性的轻链可变区。
473.在实施方案128中,实施方案126或实施方案127的抗体,其包含:(a)与seq id no:63或seq idno:67具有至少95%的序列一致性的重链可变区;及/或 (b)与seq id no:64或seq id no:68具有至少95%的序列一致性的轻链可变区。
474.在实施方案129中,实施方案128的抗体,其包含重链可变区和轻链可变区,该重链可变区包含seqid no:63且该轻链可变区包含seq id no:64。
475.在实施方案130中,实施方案128的抗体,其包含重链可变区和轻链可变区,该重链可变区包含seqid no:67且该轻链可变区包含seq id no:68。
476.在实施方案131中,实施方案126至130中任一者的抗体,其为单克隆抗体。
477.在实施方案132中,实施方案126至128、 130或131中任一者的抗体,其为人源化抗体。
478.在实施方案133中,实施方案126的抗体,其为人类抗体。
479.在实施方案134中,实施方案126至133中任一者的抗体,其为重组抗体或嵌合抗体。
480.在实施方案135中,实施方案126至134中任一者的抗体,其为双特异性抗体。
481.在实施方案136中,实施方案126至135中任一者的抗体,其为包含抗原结合部位的抗体片段。
482.在实施方案137中,实施方案126至136中任一者的抗体,其为igg抗体。
483.在实施方案138中,实施方案137的抗体,其为igg1抗体、igg2抗体或igg4抗体。
484.在实施方案139中,抗体包含seq id no: 70的重链氨基酸序列和seq id no:72的轻链氨基酸序列。
485.在实施方案140中,抗体包含与抗体313m32 相同的重链可变区和轻链可变区氨基酸序列。
486.在实施方案141中,抗体包含由保藏于atcc 编号为pta-122346的质粒编码的重链可变区。
487.在实施方案143中,抗体包含由保藏于atcc 编号为pta-122347的质粒编码的轻链可变区。
488.在实施方案143中,抗体包含由保藏于atcc 编号为pta-122347的质粒编码的轻链。
489.在实施方案144中,抗体包含由保藏于atcc 编号为pta-122346的质粒编码的重链可变区和由保藏于 atcc编号为pta-122347的质粒编码的轻链可变区。
490.在实施方案145中,抗体包含由保藏于atcc 编号为pta-122346的质粒编码的重链
可变区和由保藏于atcc编号为pta-122347的质粒编码的轻链。
491.在实施方案146中,实施方案126至145中任一者的抗体,其不结合:(a)小鼠tigit;(b)大鼠 tigit;(c)食蟹猕猴tigit;及/或(d)恒河猴tigit。
492.在实施方案147中,分离的抗体与实施方案 126至146中任一者的抗体竞争与tigit特异性结合。
493.在实施方案148中,分离的抗体与实施方案 126至146中任一者的抗体结合tigit的相同的抗原决定区。
494.在实施方案149中,分离的抗体结合tigit 的抗原决定区,该抗原决定区与实施方案126至146中任一者的抗体结合的tigit的抗原决定区重叠。
495.在实施方案150中,特异性结合人类tigit 的分离的抗体,其中抗体结合抗原决定区,该抗原决定区包含:(a)在seq id no:79内的氨基酸;(b)在seq idno:80内的氨基酸;(c)在seq id no:79及seq idno:80内的氨基酸;(d)seq id no:4的氨基酸q62和i109;(e)seq id no:4的氨基酸q62和t119;(f)seqid no:4的氨基酸q64和i109;(g)seq id no:4的氨基酸q64和t119;(h)seq id no:4的氨基酸q62、 q64和i109;(i)seq id no:4的氨基酸q62、q64和 t119;(j)seq id no:4的氨基酸q62、i109和t119; (k)seq id no:4的氨基酸q64、i109和t119;或(l) seq id no:4的氨基酸q62、q64、i109和t119。
496.在实施方案151中,实施方案150的抗体,其中抗体结合包含在seq id no:79及seq id no:80 内的氨基酸的抗原决定区。
497.在实施方案152中,实施方案150的抗体,其中抗体结合抗原决定区,该抗原决定区包含下列中的至少一者:seq id no:4的氨基酸n58、e60、q62、 q64、l65、f107、i109、h111、t117、t119和g120。
498.在实施方案153中,实施方案150至152中任一者的抗体,其中抗原决定区为构象抗原决定区。
499.在实施方案154中,实施方案126至153中任一者的抗体,其抑制tigit与脊髓灰白质病毒受体 (pvr)结合。
500.在实施方案155中,实施方案126至153中任一者的抗体,其抑制或阻断tigit与pvr之间的交互作用。
501.在实施方案156中,实施方案126至153中任一者的抗体,其抑制tigit传导信号。
502.在实施方案157中,实施方案126至153中任一者的抗体,其为经tigit介导的传导信号的拮抗剂。
503.在实施方案158中,实施方案126至153中任一者的抗体,其抑制tigit活化。
504.在实施方案159中,实施方案126至153中任一者的抗体,其抑制tigit的磷酸化。
505.在实施方案160中,实施方案126至153中任一者的抗体,其降低tigit的细胞表面表达。
506.在实施方案161中,实施方案126至153中任一者的抗体,其诱发及/或增强免疫反应。
507.在实施方案162中,实施方案161的抗体,其中免疫反应是针对肿瘤或肿瘤细胞。
508.在实施方案163中,实施方案126至153中任一者的抗体,其增加细胞介导的免疫力。
509.在实施方案164中,实施方案126至153中任一者的抗体,其增加t细胞活性。
510.在实施方案165中,实施方案126至153中任一者的抗体,其增加溶胞性t细胞(ctl)活性。
511.在实施方案166中,实施方案126至153中任一者的抗体,其增加自然杀手(nk)细胞活性。
512.在实施方案167中,实施方案126至153中任一者的抗体,其增加il-2生产及/或il-2生产细胞的数目。
513.在实施方案168中,实施方案126至153中任一者的抗体,其增加ifn-γ生产及/或ifn-γ生产细胞的数目。
514.在实施方案169中,实施方案126至153中任一者的抗体,其增强th1型免疫反应。
515.在实施方案170中,实施方案126至153中任一者的抗体,其降低il-4生产及/或il-4生产细胞的数目。
516.在实施方案171中,实施方案126至153中任一者的抗体,其降低il-10生产及/或il-10-生产细胞的数目。
517.在实施方案172中,实施方案126至153中任一者的抗体,其降低th2型免疫反应。
518.在实施方案173中,实施方案126至153中任一者的抗体,其抑制及/或降低调节性t细胞(treg)的抑制活性。
519.在实施方案174中,实施方案126至153中任一者的抗体,其抑制及/或降低骨髓衍生性抑制细胞 (mdsc)的抑制活性。
520.在实施方案175中,实施方案126至153中任一者的抗体,其抑制肿瘤生长。
521.在实施方案176中,异质二聚体剂包含实施方案126至146中任一者的抗体。
522.在实施方案177中,双特异性剂包含:a)特异性结合tigit的第一臂,及b)第二臂,其中第一臂包含实施方案126至146中任一者的抗体。
523.在实施方案178中,实施方案177的双特异性剂,其中第二臂包含来自抗体的抗原结合部位。
524.在实施方案179中,实施方案177的双特异性剂,其中第二臂特异性结合pd-1、pd-l1、ctla-4、 tim-3、lag-3、ox-40或gitr。
525.在实施方案180中,实施方案177的双特异性剂,其中第二臂特异性结合肿瘤抗原。
526.在实施方案181中,实施方案177的双特异性剂,其中第二臂包含免疫治疗剂。
527.在实施方案182中,实施方案181的双特异性剂,其中免疫治疗剂是选自由下列所组成的群组:颗粒细胞-巨噬细胞集落刺激因子(gm-csf)、巨噬细胞集落刺激因子(m-csf)、颗粒细胞集落刺激因子(g-csf)、白介素 2(il-2)、白介素3(il-3)、白介素12(il-12)、白介素15 (il-15)、b7-1(cd80)、b7-2(cd86)、4-1bb配体、 gitrl、ox-40l、抗cd3抗体、抗ctla4抗体、抗pd
‑ꢀ
1抗体、抗pd-l1抗体、抗gitr抗体、抗ox-40抗体、抗4-1bb抗体、抗lag-3抗体和抗tim-3抗体。
528.在实施方案183中,实施方案177至182中任一者的双特异性剂,其中第一臂包含第一ch3结构域及第二臂包含第二ch3结构域,各ch3结构域经修饰以促进异质二聚体的形成。
529.在实施方案184中,实施方案183的双特异性剂,其中第一及第二ch3结构域是基于静电效应而修饰。
530.在实施方案185中,实施方案177至182中任一者的双特异性剂,其中第一臂包含在对应于seq idno:41的位置253和292上具有氨基酸取代的第一人类 igg1恒定区,其中氨基酸是经谷氨酸或天冬氨酸取代,及第二臂包含在对应于seq id no:41的位置240和282 上具有氨基酸取代的第二人类igg1恒定区,其中氨基酸是经赖氨酸取代。
531.在实施方案186中,实施方案177至182中任一者的双特异性剂,其中第一臂包含在对应于seq idno:41的位置240和282上具有氨基酸取代的第一人类 igg1恒定区,其中氨基酸是经赖氨酸取代,及第二臂包含在对应于seq id no:41的位置253和292上具有氨基酸取代的第二人类igg1恒定区,其中氨基酸是经谷氨酸或天冬氨酸取代。
532.在实施方案187中,实施方案183的双特异性剂,其中第一及第二ch3结构域是使用突起进入孔中技术修饰。
533.在实施方案188中,实施方案177至187中任一者的双特异性剂,其抑制tigit与pvr结合。
534.在实施方案189中,实施方案177至187中任一者的双特异性剂,其抑制或阻断tigit与pvr之间的交互作用。
535.在实施方案190中,实施方案177至187中任一者的双特异性剂,其抑制tigit传导信号。
536.在实施方案191中,实施方案177至187中任一者的双特异性剂,其为经tigit介导的传导信号的拮抗剂。
537.在实施方案192中,实施方案177至187中任一者的双特异性剂,其抑制tigit活化。
538.在实施方案193中,实施方案177至187中任一者的双特异性剂,其抑制tigit的磷酸化。
539.在实施方案194中,实施方案177至187中任一者的双特异性剂,其降低tigit的细胞表面表达。
540.在实施方案195中,实施方案177至187中任一者的双特异性剂,其诱发及/或增强免疫反应。
541.在实施方案196中,实施方案195的双特异性剂,其中免疫反应是针对肿瘤或肿瘤细胞。
542.在实施方案197中,实施方案177至187中任一者的双特异性剂,其增加细胞介导的免疫力。
543.在实施方案198中,实施方案177至187中任一者的双特异性剂,其增加t细胞活性。
544.在实施方案199中,实施方案177至187中任一者的双特异性剂,其增加ctl活性。
545.在实施方案200中,实施方案177至187中任一者的双特异性剂,其增加nk细胞活性。
546.在实施方案201中,实施方案177至187中任一者的双特异性剂,其增加il-2生产及/或il-2生产细胞的数目。
547.在实施方案202中,实施方案177至187中任一者的双特异性剂,其增加ifn-γ生产及/或ifn-γ生产细胞的数目。
548.在实施方案203中,实施方案177至187中任一者的双特异性剂,其增强th1型免疫反应。
549.在实施方案204中,实施方案177至187中任一者的双特异性剂,其降低il-4生产及/或il-4生产细胞的数目。
550.在实施方案205中,实施方案177至187中任一者的双特异性剂,其降低il-10生产及/或il-10-生产细胞的数目。
551.在实施方案206中,实施方案177至187中任一者的双特异性剂,其降低th2型免疫反应。
552.在实施方案207中,实施方案177至187中任一者的双特异性剂,其抑制及/或降低treg的抑制活性。
553.在实施方案208中,实施方案177至187中任一者的双特异性剂,其抑制及/或降低mdsc的抑制活性。
554.在实施方案209中,实施方案177至208中任一者的双特异性剂,其抑制肿瘤生长。
555.在实施方案210中,多肽包含选自由下列所组成的群组的序列:seq id no:63、seq id no:64、 seq id no:67、seq id no:68、seq id no:69、 seq id no:70、seq id no:71、seq id no:72和 seq id no:82。
556.在实施方案211中,细胞包含或生产实施方案126至210中任一者的抗体、双特异性剂或多肽。
557.在实施方案212中,组合物包含实施方案126 至210中任一者的抗体、双特异性剂或多肽。
558.在实施方案213中,医药组合物包含实施方案126至210中任一者的抗体、双特异性剂或多肽及医药上可接受的载剂。
559.在实施方案214中,分离的多核苷酸分子包含编码实施方案126至210中任一者的抗体、双特异性剂或多肽的多核苷酸。
560.在实施方案215中,分离的多核苷酸包含选自由下列所组成的群组的多核苷酸序列:seq id no: 65、seq id no:66、seq id no:73、seq id no: 74、seq id no:75和seq id no:76。
561.在实施方案216中,载体包含实施方案214 或实施方案215的多核苷酸。
562.在实施方案217中,分离的细胞包含实施方案214或实施方案215的多核苷酸。
563.在实施方案218中,分离的细胞包含实施方案216的载体。
564.在实施方案219中,诱发、活化、促进、增强、提高或延长受试者的免疫反应的方法,其包含施用治疗有效量的实施方案126至210中任一者的抗体、双特异性剂或多肽。
565.在实施方案220中,诱发、活化、促进、增强、提高或延长受试者的免疫反应的方法,其包含施用治疗有效量的实施方案126至153中任一者的抗体。
566.在实施方案221中,实施方案219或实施方案220的方法,其中免疫反应是对抗肿瘤或癌症。
567.在实施方案222中,抑制肿瘤细胞生长的方法,其中该方法包含将肿瘤细胞与有效量的实施方案126 至210中任一者的抗体、双特异性剂或多肽接触。
568.在实施方案223中,抑制受试者的肿瘤生长的方法,其中该方法包含对受试者施用治疗有效量的实施方案126至210中任一者的抗体、双特异性剂或多肽。
569.在实施方案224中,抑制受试者的肿瘤生长的方法,其中该方法包含对受试者施用
治疗有效量的实施方案126至153中任一者的抗体。
570.在实施方案225中,实施方案221至224中任一者的方法,其中肿瘤或肿瘤细胞是选自由下列所组成的群组:结肠直肠肿瘤、卵巢肿瘤、胰肿瘤、肺肿瘤、肝肿瘤、乳房肿瘤、肾肿瘤、前列腺肿瘤、胃肠道肿瘤、黑色素瘤、子宫颈肿瘤、膀胱肿瘤、神经胶质母细胞瘤和头与颈肿瘤。
571.在实施方案226中,治疗受试者的癌症的方法,其中该方法包含对受试者施用治疗有效量的实施方案 126至210中任一者的抗体、双特异性剂或多肽。
572.在实施方案227中,治疗受试者的癌症的方法,其中该方法包含对受试者施用治疗有效量的实施方案 126至153中任一者的抗体。
573.在实施方案228中,实施方案226或实施方案227的方法,其中癌症是选自由下列所组成的群组:结肠直肠癌、卵巢癌、胰脏癌、肺癌、肝癌、乳癌、肾脏癌、前列腺癌、胃肠道癌、黑色素瘤、子宫颈癌、膀胱癌、神经胶质母细胞瘤和头与颈癌。
574.在实施方案229中,实施方案219至228中任一者的方法,其另外包含施用至少一种额外治疗剂。
575.在实施方案230中,实施方案229的方法,其中额外治疗剂为化疗剂。
576.在实施方案231中,实施方案229的方法,其中额外治疗剂为抗体。
577.在实施方案232中,实施方案229的方法,其中额外治疗剂为免疫治疗剂。
578.在实施方案233中,实施方案232的方法,其中免疫治疗剂是选自由下列所组成的群组:gm-csf、 m-csf、g-csf、il-2、il-3、il-12、il-15、b7-1 (cd80)、b7-2(cd86)、4-1bb配体、gitrl、ox-40配体、抗cd3抗体、抗ctla-4抗体、抗pd-1抗体、抗pd-l1抗体、抗gitr抗体、抗ox-40抗体、抗4-1bb抗体、抗lag-3抗体和抗tim-3抗体。
579.在实施方案234中,实施方案229的方法,其中额外治疗剂为notch途径、wnt途径或rspo/lgr途径的抑制剂。
580.在实施方案235中,实施方案219至221或 223至234中任一者的方法,其中受试者已患有移除的肿瘤或癌。
581.在实施方案236中,实施方案221至235中任一者的方法,其中肿瘤或癌症表达pd-l1。
582.在实施方案237中,实施方案221至236中任一者的方法,其另外包含测定肿瘤或癌中的pd-l1表达量的步骤。
583.在实施方案238中,实施方案237的方法,其中测定pd-l1表达量是在以抗体治疗或接触之前进行。
584.在实施方案239中,实施方案236或实施方案237的方法,其中若肿瘤或癌具有上升的pd-l1表达量,将抗体、双特异性剂或多肽:(a)施用给受试者;或 (b)与肿瘤或肿瘤细胞接触。
585.在实施方案240中,质粒是保藏于atcc且编号为pta-122346。
586.在实施方案241中,质粒是保藏于atcc且编号为pta-122347。
587.在实施方案242中,抗体包含重链氨基酸序列seq id no:82和轻链氨基酸序列seq id no:72。vi.筛选
587.本发明提供鉴别调节免疫反应的tigit结合剂的筛选方法。在一些实施方案中,本发明提供筛选调节免疫反应的候选剂的方法,该剂包括但不限于多肽、抗体、肽、拟肽、小分子、化合物或其他药物。
588.在一些实施方案中,筛选用于调节免疫反应的候选tigit结合剂的方法包含测定该剂对免疫细胞是否有影响。在一些实施方案中,筛选用于调节免疫反应的候选tigit结合剂的方法包含测定该剂是否能够增加免疫细胞活性。在一些实施方案中,筛选用于调节免疫反应的候选tigit结合剂的方法包含测定该剂是否能够增加溶胞性细胞(诸如ctl及/或nk细胞)的活性。在一些实施方案中,筛选用于调节免疫反应的候选tigit结合剂的方法包含测定该剂是否能够降低免疫抑制因子细胞(诸如treg或 mdsc)的活性。vii.包含本文所述的剂的试剂盒
589.本发明提供包含本文所述的tigit结合剂的试剂盒,其可用于进行本文所述的方法。在特定的实施方案中,试剂盒包含至少一种经纯化的tigit结合剂于一或多个容器中。在一些实施方案中,试剂盒含有所有必要及 /或足以进行检测检定法的组分,包括所有的对照物、进行检定的用法说明及用于分析和呈现结果的任何必要的软件。熟习本技术领域者可轻易地辨识本发明所揭示的 tigit结合剂可轻易地并入本技术中熟知的经确立的试剂盒形式的一者中。
590.另外提供包含tigit结合剂以及至少一种额外治疗剂的试剂盒。在特定的实施方案中,第二(或更多) 治疗剂为化疗剂。在特定的实施方案中,第二(或更多)治疗剂为抗体。
591.本发明的实施方案可参考下列的非限制性实施例而进一步定义,其详细说明本发明的特定抗体的制备及使用本发明的抗体的方法。那些熟习本技术领域者将明白可对材料及方法二者实施许多修改而不脱离本发明的范围。实施例实施例1产生抗tigit抗体
592.抗tigit抗体是使用小鼠tigit的细胞外结构域而产生,使兔子免疫。以流动式细胞测量术筛选用于抗体与小鼠tigit及人类tigit结合的上清液,且选择用于进一步特征化的9种抗体克隆(图1)。筛选来自这些抗体的上清液特异性阻断小鼠tigit与其相反受体小鼠pvr 的交互作用的其能力。四种抗体显示出阻断tigit/pvr 交互作用。重要的是这些抗体中的二者能够结合人类tigit(313rb1和313rb2)。
593.将313rb1的重链和轻链可变区克隆至小鼠 igg1型式中以产生嵌合抗体313r11及至小鼠igg2a形式中以产生嵌合抗体313r12。313r11和313r12的cdr序列为(i)重链cdr1 gsslsssyms(seq id no:7),(ii)重链cdr2 iigsngntyyanwakg(seq id no:8),(iii)重链cdr3 ggyrtsgmdp(seq id no:9),(iv)轻链cdr1qasqsissylnw(seq id no:10),(v)轻链cdr2dalklas(seq id no:11),及(vi)轻链cdr3qqehsvgnvdn(seq id no:12)。313r11和313r12的重链可变区序列为seq id no:17及313r11和313r12 的轻链可变区序列为seq id no:18。313r11的重链序列为seq id no:21或seq id no:26(没有信号序列)。 313r12的重链序列为seq id no:22或seq id no: 27(没有信号序列)。313r11和313r12的轻链序列为seqid no:23或seq id no:28(没有信号序列)。
594.将313rb2的重链和轻链可变区克隆至人类 igg1形式中以产生抗体313r14。cdr经
修饰以增加对人类tigit的亲和性且使架构区最优化及/或人源化以产生数种变体,包括313r19。313r14和313r19的cdr序列为(i)重链cdr1 gfslsssyms(seq id no:13),(ii)重链cdr2 iigsngntyyanwakg(seq id no:8),(iii)重链cdr3 ggyrtsgmdp(seq id no:9),(iv)轻链cdr1qasqsniysdlaw(seq id no:14),(v)轻链cdr2rastlas(seq id no:15),及(vi)轻链cdr3qqehlvawiyn(seq id no:16)。313r14的重链可变区序列为seq id no:19及313r14的轻链可变区序列为 seq id no:20。313r19的重链可变区序列为seq idno:32及313r19的轻链可变区序列为seq id no: 20。313r14的重链序列为seq id no:24或seq idno:29(没有信号序列)。313r19的重链序列为seq idno:33或seq id no:34(没有信号序列)。313r14和 313r19的轻链序列为seq id no:25或seq id no: 30(没有信号序列)。
595.编码包含313r19抗体的重链可变区的多肽的质粒是在2015年5月27日依照布达佩斯条约的条款保藏于美国菌种保藏中心(atcc),10801universityboulevard,manassas,va,usa且以pta-122180编号。编码包含313r19抗体的轻链可变区的多肽的质粒是在2015 年5月27日依照布达佩斯条约的条款保藏于atcc, 10801university boulevard,manassas,va,usa且以 pta-122181编号。实施例2tigit传导信号及tigit磷酸化
596.如本文所述,tigit是在与其相反受体pvr 交互作用之后在其胞质尾区磷酸化。tigit的磷酸化为级联的开始,该级联包括影响其他已知的传导信号途径的下游事件。因此,评估tigit磷酸化以及下游蛋白质的磷酸化状态可给出关于tigit功能及tigit拮抗剂效应的信息。
597.jurkat cd4 人类t细胞是缺乏人类或鼠类 tigit表达,如以实时pcr及facs所测定(未显示数据)。为了产生tigit表达的细胞系,将jurkat细胞以表达以flag及绿荧光蛋白(gfp)标签化的鼠类tigit (mtigit)的慢病毒建构体感染。e.g7-ova鼠类淋巴瘤细胞系缺乏人类或鼠类pvr的表达,如以实时pcr及/或 facs所测定。e.g7-ova细胞组成性地合成且分泌卵白蛋白(ova)且以e.g7-ova细胞免疫的c57bl/6小鼠引起对ova 258-276肽具有特异性的经h-2kb限制的细胞毒性淋巴细胞。为了产生pvr表达的细胞系,将e.g7-ova 细胞以表达鼠类pvr(mpvr)及gfp的慢病毒建构体感染。将来自各感染的细胞系的gfp-阳性细胞使用 facsaria ii仪器(bd biosciences)分类至96槽孔盘中且将分离的单细胞扩展成克隆。在源自单细胞的克隆中的 gfp阳性及mtigit或mpvr表达是以facs分析及实时 pcr确认(未显示数据)。
598.为了评估反应pvr的tigit磷酸化,将细胞系在37℃下于无血清培养基中培育2小时。将jurkat
‑ꢀ
mtigit细胞与亲代e.g7-ova细胞或e.g7-ova-mpvr 细胞以5:1的细胞比混合且在37℃下于酪氨酸磷酸酶抑制剂(10mm钒酸钠,new england biolabs)的存在下培育5 分钟。制备细胞溶解物且以捕获经flag-标签化的 mtigit蛋白质的经抗flag-包覆的磁珠免疫沉淀。将免疫沉淀物以西方墨点分析评估。使用抗磷酸酪氨酸抗体 (cell signaling technology)评估存在的磷酸化tigit。使用抗flag抗体(cell signaling technology)评估存在的总 tigit。
599.与未表达pvr的细胞相比,观察出tigit在反应mpvr表达的肿瘤细胞的t细胞中高度磷酸化(图 2a)。
600.为了评估可能受tigit影响的其他传导信号途径,将细胞系在37℃下于无血清培养基中培育2小时。将jurkat-mtigit细胞与亲代e.g7-ova细胞或e.g7
‑ꢀ
ova-mpvr细胞以5:1的细胞比混合且在37℃下培育 0、5、15、45或60分钟。制备细胞溶解物且以西方墨点分析评估。磷酸化shp1(含sh2的酪氨酸磷酸酶1)及 erk1/2的含量分别使用抗磷酸shp1(tyr564)抗体及抗磷酸erk1/2(thr202/tyr204)抗体(二者皆来自cell signalingtechnology)测定。总erk1/2含量是使用抗erk1/2抗体 (cell signaling technology)测定。shp1为经细胞激素介导的信号转导途径(包括jak/stat途径)的重要的负调节剂,而erk1/2为参与ras-raf-mek-erk信号转导级联的蛋白激酶。
601.如图2b中所示,当tigit表达的t细胞与 mpvr表达的肿瘤细胞培育时,则shp1及erk1/2经特异性活化。如以磷酸化指示的活化是在早至5分钟时间点观察到且以45分钟出现开始降低的erk1/2及以60分钟出现开始降低的shp1。shp1及erk1/2在未表达mtigit的亲代jurkat t细胞中对mpvr没有活化反应(未显示数据)。
602.为了研究tigit拮抗剂是否会抑制tigit活性,在抗tigit抗体的存在下进行tigit磷酸化检定。如上文所述,将jurkat-mtigit细胞与亲代e.g7-ova细胞或e.g7-ova-mpvr细胞以5:1的细胞比混合且在37℃下于10mm钒酸钠及20微克/毫升的对照抗体(多克隆鼠类igg;sigma)、抗tigit抗体313r11、抗tigit抗体 313r12或抗tigit抗体313rb1的存在下培育5分钟。制备细胞溶解物且以捕获经flag-标签化的mtigit蛋白质的经抗flag-包覆的磁珠免疫沉淀。将免疫沉淀物以西方墨点分析评估。使用抗磷酸酪氨酸抗体(cell signalingtechnology)评估存在的磷酸化tigit。使用抗flag抗体 (cell signaling technology)评估存在的总tigit。
603.如先前所示,当mtigit表达的jurkat t细胞与mpvr表达的肿瘤细胞组合时,则mtigit高度磷酸化。当细胞在抗tigit抗体的存在下培育时,则反应与 mpvr交互作用的mtigit磷酸化降低及/或废除。tigit 磷酸化的降低是以抗tigit抗体313r12最显著(图3)。
604.进行研究tigit拮抗剂是否会抑制tigit传导信号的额外实验。类似于上文所述的研究,将jurkat
‑ꢀ
mtigit细胞与亲代e.g7-ova细胞或e.g7-ova-mpvr 细胞以5:1的细胞比混合且在37℃下于浓度增加的(0-40 微克/毫升)抗tigit抗体313r11、抗tigit抗体313r12 或抗tigit抗体313rb1的存在下培育15分钟。制备细胞溶解物且以西方墨点分析评估。磷酸化的shp1(含有 sh2的酪氨酸磷酸酶1)及磷酸化的erk1/2分别使用抗磷酸shp1(tyr562)抗体及抗磷酸erk1/2(thr202/tyr204)抗体测定。使用抗shp1抗体评估总shp1含量。使用抗 erk1/2抗体评估总erk1/2含量。
605.反应mtigit-mpvr交互作用的erk1/2磷酸化明确地由抗tigit抗体以剂量依赖方式抑制(图4)。反应mtigit-mpvr交互作用的shp1磷酸化是由抗tigit 抗体313rb1及313#11以剂量依赖方式抑制。在所显示的研究中,抗体313r12似乎对shp1磷酸化仅具有弱的反应。
607.这些结果强力示意抗tigit抗体抑制tigit 功能且影响下游传导信号途径。实施例3tigit抑制细胞激素生产
608.t细胞融合瘤b3z86/90.14(b3z)稳定地表达 ova-特异性h-2kbt细胞受体(tcr)。将b3z细胞以表达鼠类tigit(mtigit)的慢病毒建构体感染且产生源自单细胞的mtigit克隆(b3z-mtigit)。e.g7-ova鼠类淋巴瘤细胞系稳定地表达ova且可活化对b3z细胞的ova-特
异性tcr,导致il-2分泌。为了测定mtigit/mpvr交互作用对抗原特异性il-2分泌的效应,将亲代b3z细胞或 b3z-mtigit细胞与亲代e.g7-ova或e.g7-ova-mpvr 细胞(上文所述,参见实施例2)以2:1的比在12槽孔盘中培育。在24小时之后,以elisa(r&d systems)测量在无细胞培养物上清液中的il-2浓度。数据是以反应mpvr 表达的肿瘤细胞的亲代b3z或b3z-mtigit t细胞的il-2 分泌与比较反应mpvr阴性肿瘤细胞的il-2分泌的比来表示。
609.亲代b3z t细胞有类似的il-2分泌,无关于 mpvr对ova呈现的肿瘤细胞的表达(亦即约1.0的比)。相反地,来自b3z-mtigit t细胞的il-2分泌在mpvr表达的肿瘤细胞的存在下比在mpvr阴性肿瘤细胞的存在下更低(亦即《1.0的比)(图5a)。当b3z-mtigit t细胞在与 e.g7-ova细胞共培育之前以20微克/毫升的抗tigit抗体313r11或313r12预处理时,则不再抑制il-2生产(图 5b)。
610.这些结果示意以mpvr活化mtigit会抑制反应抗原的t细胞活化,如以降低的il-2生产所证实。此外,以tigit拮抗剂阻断tigit会抑制tigit活化且出现降低与tigit相关联的t细胞活性抑制,如所观察到大量生产的il-2。这些数据支持抑制tigit可〝释放对t 细胞抑制的约束〞及增强免疫反应的理论。实施例4tigit抑制nk细胞的细胞毒性
611.将nk-92人类自然杀手(nk)细胞系以表达经 flag及gfp标签化的mtigit的慢病毒建构体感染且衍生出克隆的细胞系(nk-92-mtigit),如上文所述。将 721.221人类b-细胞系以表达mpvr及gfp的慢病毒建构体感染且产生克隆的细胞系(721.221-mpvr)。以facs及实时pcr确认亲代721.221细胞缺乏人类或鼠类pvr表达(未显示数据)。亲代nk-92细胞或nk-92-mtigit细胞溶解亲代721.221或721.221-mpvr肿瘤细胞的能力是在标准的4小时钙黄绿素释放检定法中测试。将nk-92或 nk-92-mtigit细胞平铺于96槽孔v形底盘中。将标靶 721.221或721.221-mpvr细胞在37℃下以10μm钙黄绿素am(life technologies)经1小时标记且接着与nk-92 细胞以25:1或12:1的效应子:标靶的比组合。在37℃下培育4小时之后,收获无细胞上清液且在荧光计上以485纳米激发及535纳米放射下定量钙黄绿素释放。在随后的实验中,将nk-92细胞及nk-92-mtigit在20微克/毫升的抗tigit抗体313r11、抗体313r12或对照抗体的存在下培育x分钟。接着将细胞用于钙黄绿素释放检定法中,如上文所述。
612.特异性细胞溶解百分比是如下测定:溶解%= 100x(er-sr)/(mr-sr),其中er、sr及mr分别代表实验、自发性及最大钙黄绿素释放。自发性释放为在培养基中单独培育的标靶细胞发射的荧光(亦即在没有效应子细胞的存在下),而最大释放是藉由以等体积的10% sds溶解标靶细胞来测定。数据是以nk-92细胞(亲代或nk-92
‑ꢀ
mtigit)对抗721.221-mpvr标靶细胞的细胞毒性相对 nk-92细胞(亲代或nk-92-mtigit)对抗亲代(mpvr阴性)721.221标靶细胞的细胞毒性的比呈现。
613.如图6a中所示,亲代nk-92细胞具有类似的对抗mpvr阳性及mpvr阴性721.221标靶细胞的细胞毒性(亦即约1.0的比)。相反地,与对抗mpvr阴性亲代 721.221细胞系的细胞毒性相比,nk-92-mtigit细胞对抗 721.221-mpvr细胞的细胞毒性降低(亦即《1.0的比)。当效应子:标靶的比为25:1或12:1时,结果没有差别。当 nk-92或nk-92-mtigit细胞在用于细胞毒性检定法之前以抗tigit抗体313r11或抗体313r12处理时,则降低及/或废除经细胞介导
的细胞毒性的抑制作用(图6b)。
613.这些结果示意以mpvr活化mtigit会抑制经细胞介导的细胞毒性。重要的是结果证明tigit拮抗剂可干扰pvr-tigit交互作用且造成nk细胞修复或〝释放对nk细胞的细胞毒性能力的约束〞。实施例5以抗tigit抗体抑制活体内肿瘤生长
615.鼠类结肠肿瘤系ct26.wt是经皮下植入(30,000个细胞/小鼠)6-8周龄balb/c小鼠的后胁腹中。容许肿瘤生长10天,直到其达到约50立方毫米体积为止。将小鼠以0.25毫克/小鼠的抗tigit抗体313r11(migg1 抗体)、抗tigit抗体313r12(migg2a抗体)、migg1对照抗体或migg2a对照抗体治疗(每组对照抗体的n=10 及每组试验抗体的n=20)。将小鼠以每周两次经腹膜内注射给药三周。监测肿瘤生长且在第10、15、18、22、 25和29天以电子式卡尺测量肿瘤体积。
616.如图7a中所示,与同型匹配的对照抗体相比,抗tigit抗体313r12抑制几乎75%的肿瘤生长。9 只小鼠中的肿瘤以第29天消退至不可检测的程度。与同型匹配的对照抗体相比,抗tigit抗体313r11仅抑制约 15%的肿瘤生长。抗体313r11及313r12的差别仅为其 igg同型物,因为313r12为igg2a抗体及313r11为 igg1抗体。这些结果示意抗体同型物对抗tigit抗体的治疗效能可具有显著的效应。与小鼠igg1抗体(等同于人类igg2)相比,已知小鼠igg2抗体(等同于人类igg1抗体)具有增加的adcc活性,且这生物特征可在抗体 313r12的强力抗肿瘤效应中扮演一角色。
617.以抗tigit抗体313r12及对照migg2a抗体重复实验。如上文所述,将ct26.wt细胞同时植入 (30,000个细胞/小鼠)6-8周龄balb/c小鼠的后胁腹中。容许肿瘤生长7天,直到其达到约55立方毫米体积为止。将小鼠以0.25毫克/小鼠的抗tigit抗体313r12或migg2a对照抗体治疗(每组n=10)。将小鼠以每周两次经腹膜内注射给药三周。监测肿瘤生长且在第7、14、17、 21、25、28和31天以电子式卡尺测量肿瘤体积。
617.如先前研究中所观察,抗tigit抗体313r12 抑制ct26.wt肿瘤生长,在所有10只小鼠中皆察看到肿瘤生长抑制(图7b)。此外,在以抗体313r12治疗的10 只中有9只小鼠的肿瘤自原来的肿瘤大小消退,在治疗2 周之后以8只小鼠的肿瘤消退至不可检测的程度。在这研究中,在igg2抗体对照组中有3只小鼠的肿瘤消退,但是已知肿瘤消退可发生在未经治疗的免疫活性小鼠中,尤其若具有少的肿瘤细胞初始数目。然而,以抗体313r12 治疗组中的完全生长抑制及/或肿瘤消退证明以抗tigit 抗体治疗具有显著的治疗效应且这可归因于受试者免疫反应的调节及/或增强。
619.成功的抗癌免疫治疗包括产生长期抗肿瘤免疫性。为了研究是否已确立长期免疫性,将来自本文所述的研究的小鼠(其具有在以抗tigit抗体治疗后消退至不可检测程度的ct26.wt肿瘤)以新鲜ct26.wt肿瘤细胞挑战。将肿瘤完全消退的11只小鼠在第132天(在抗 tigit抗体313r12的最后剂量之后102天)以增加的 ct26.wt细胞数目(60,000个细胞/小鼠)注射。将10只原生小鼠以相同的ct26.wt细胞数目的ct26.wt细胞注射,作为对照组。不治疗小鼠,监测肿瘤生长且以电子式卡尺测量肿瘤体积。
620.在对照组中,全部10只小鼠皆于第23天发展出肿瘤且予以安乐死。相反地,先前已排除ct26.wt 肿瘤的小鼠中有10只没有长出肿瘤。剩余的小鼠在注射后14天发展出小的肿
瘤生长,但是肿瘤在第21天完全消退。这些小鼠接着再以150,000个ct26.wt细胞(5倍的初始量的细胞数目)挑战第二次。将10只原生小鼠以相同的ct26.wt细胞数目(150,000个细胞/小鼠)的ct26.wt 细胞注射,再作为对照组。如之前的实验,在对照组中的全部10只小鼠皆发展出肿瘤且在第22天予以安乐死。小鼠中有6只没有长出肿瘤及另外2只小鼠发展出小的肿瘤生长,其在第22天完全消退。其他3只小鼠有小的肿瘤,其似乎正在消退或稳定。这些结果总结于表3中且以各组中的无肿瘤小鼠的百分比呈现。表31小鼠仅在最初肿瘤挑战之后以313r12抗体治疗
621.这些结果指出以抗tigit抗体治疗可产生强力且有效的抗肿瘤反应。重要的是抗肿瘤反应似乎导致长期免疫性及免于肿瘤细胞。实施例6抗tigit igg2抗体的效应子活性
622.已显示出igg-fc区的糖化作用为透过补体(亦即adcc和cdc)的fcγri、fcγii、fcγriii和c1q组分介导的生物活性最优化表达所必要的。例如,小鼠igg2a抗体重链的糖化部位是在seq id no:22的天冬酰胺酸314 上。以丙氨酸残基取代天冬酰胺酸导致抗体去糖化且降低 adcc活性。产生抗tigit抗体313r12抗体的去糖化变体,其包含在位置314上的丙氨酸残基且称为313r13。
623.比较抗tigit抗体313r13与抗tigit抗体 313r12的活性以研究去糖化对抗肿瘤活性的效应。将 ct26.wt细胞植入(30,000个细胞/小鼠)6-8周龄balb/c小鼠的后胁腹中。容许肿瘤生长10天,直到其达到约50立方毫米体积为止。将小鼠以0.25毫克/小鼠的抗tigit抗体313r12、抗tigit抗体313r13或migg2a对照抗体治疗(每组对照抗体的n=10及每组试验抗体的n=20)。将小鼠以每周两次经腹膜内注射给药三周。监测肿瘤生长且在第7、10、14、17和21天以电子式卡尺测量肿瘤体积。
624.如图8中所示,与同型匹配的对照组相比,抗tigit抗体313r12显示显著的肿瘤生长抑制。相反地,去糖化的抗tigit抗体313r13未显示显著的抗肿瘤活性。
625.因为相信去糖化抗体可具有受限或没有 adcc活性,所以这些结果示意adcc可在抗tigit抗体 313r12的强力抗肿瘤效应中扮演显著的角色。实施例7ifn-γ、il-2、il-4和il-10的elispot检定法
625.elispot为检测细胞激素分泌细胞的高敏性免疫检定法。简言之,elispot检定法是使用预包覆在微盘槽孔上的对所期望的细胞激素具有特异性的捕获抗体。将经刺激的细胞分散在槽孔中且使紧邻任何细胞激素分泌细胞附近的固定抗体结合经分泌的细胞激素。接着进行标准的清洗步骤及以适当的检测试剂培育。例如,最常使用生物素化检测抗体,接
着使用与碱性磷酸酶共轭的链亲和素及有色的底物溶液的组合。有色的沉淀物是在细胞激素所在部位上形成且以点显现,每一个别的点代表个别的细胞激素分泌细胞。可以自动化读取系统或使用显微镜的手动方式计数点。在一些实施方案中,使用自动化读取系统捕获每一槽孔的影像,且使用总点数、点面积或总光学密度 (tod)定量。
627.ifn-γ分泌细胞是使用小鼠ifn-γelispot试剂盒(mabtech)检测。细胞是自以抗tigit抗体313r12(n =6)或同型匹配的对照抗体(n=6)治疗的携ct26.wt肿瘤的小鼠的脾分离而来(参见实施例5)。将来自各治疗组的各小鼠的脾细胞(5
×
105个/槽孔)分配至以对小鼠ifn-γ具有特异性的抗体包覆的96槽孔盘中。将细胞在肿瘤特异性cd8 t细胞肽ah-1的存在或不存在下培养且培育48 小时。ah-1肽(spsyvyhqf;seq id no:31)为内源于ct26.wt细胞系的鼠类白血病亲嗜性原病毒的gp70套膜蛋白质的经h2-l
d-限制的抗原决定区。细胞分泌的ifn-γ是依照制造商指示检测。使用bioreader 6000-f-z仪器 (biosys)捕获影像,且测定点数、点面积或总光学密度。结果是以总光学密度显示且数据是以平均
±
s.e.m表示。
627.如图9a中所示,与以对照抗体治疗的小鼠相比,以抗tigit抗体313r12治疗的小鼠中的ifn-γ分泌细胞显著地增加。重要的是ifn-γ分泌细胞仅在ah-1肽的存在下增加。这些结果指出抗tigit抗体313r12活化肿瘤特异性cd8 t细胞。活化可为直接或间接,亦即抑制因子细胞的抑制作用。
629.il-2分泌细胞是使用小鼠il-2elispot试剂盒 (mabtech)检测。细胞是自以抗tigit抗体313r12(n=6) 或同型匹配的对照抗体(n=6)治疗的携肿瘤的小鼠的脾分离而来。将来自各治疗组的各小鼠的脾细胞(5
×
105个/槽孔)分配至以对小鼠il-2具有特异性的抗体包覆的96槽孔盘中。将细胞培育48小时。细胞分泌的il-2是依照制造商指示检测。使用bioreader 6000-f-z仪器(biosys)捕获影像,且测定点数、点面积或总光学密度。结果是以总光学密度显示且数据是以平均
±
s.e.m表示。
630.如图9b中所示,与以对照抗体治疗的小鼠相比,在以抗tigit抗体313r12治疗的小鼠中的il-2分泌细胞略微降低。在ah-1肽存在或不存在下降低的il-2分泌细胞量相等。
631.il-4分泌细胞是使用小鼠il-4elispot试剂盒(mabtech)检测。细胞是自以抗tigit抗体313r12(n= 6)或同型匹配的对照抗体(n=6)治疗的携肿瘤的小鼠的脾分离而来。将来自各治疗组的各小鼠的脾细胞(5
×
105个/ 槽孔)分配至以对小鼠il-4具有特异性的抗体包覆的96槽孔盘中。将细胞培育48小时。细胞分泌的il-4是依照制造商指示检测。使用bioreader 6000-f-z仪器(biosys)捕获影像,且测定点数、点面积或总光学密度。结果是以总光学密度显示且数据是以平均
±
s.e.m表示。
632.如图9c中所示,与以对照抗体治疗的小鼠相比,在以抗tigit抗体313r12治疗的小鼠中的il-4分泌细胞显著地降低。
632.il-10分泌细胞是使用小鼠il-10elispot试剂盒(mabtech)检测。细胞是自以抗tigit抗体313r12(n =6)或同型匹配的对照抗体(n=6)治疗的携肿瘤的小鼠的脾分离而来。将来自各治疗组的各小鼠的脾细胞(5
×
105个 /槽孔)分配至以对小鼠il-10具有特异性的抗体包覆的96 槽孔盘中。将细胞培育48小时。细胞分泌的il-10是依照制造商指示检测。使用bioreader 6000-f-z仪器 (biosys)捕获影像,且测定点数、点面积或总光学密度。结果是以总光学密度显示且数据是以平均
±
s.e.m表示。
633.如图9d中所示,与以对照抗体治疗的小鼠相比,在以抗tigit抗体313r12治疗的小鼠中的il-10分泌细胞显著地降低。
634.ifn-γ通常是由nk细胞、th1 cd4 t细胞、 cd8 t细胞、抗原呈现细胞和b-细胞产生。研究示意 ifn-γ在肿瘤免疫性中的角色且其可为以其他的细胞激素 (特别为il-12和il-2)介导的抗肿瘤活性的调节剂。因此,以导致ifn-γ增加的抗tigit抗体治疗应该增强抗肿瘤免疫性。
635.il-4是由cd4 th2细胞生产且诱发原生 cd4 t细胞分化成th2细胞。另外,il-4抑制th1细胞产生、抑制th1细胞激素(诸如tnf-α和il-12)生产及抑制巨噬细胞活化。il-10通常是由treg和辅助t细胞生产。il-10原来经辨识为th2细胞激素,其调节先天免疫细胞生长及/或分化且抑制t细胞(特别为细胞毒性t细胞)的活化及效应子功能。最近,il-10已显示出具有一些免疫刺激效应及因此被视为具有多向性功能。在本发明的研究中,显著降低来自以抗tigit抗体治疗的小鼠的il-4 和il-10-生产细胞示意靶定tigit可导致th2反应抑制且可抑制treg及/或treg功能。实施例8细胞的细胞毒性检定法
637.用于t细胞的细胞毒性检定法的细胞是自上述携ct26.wt肿瘤的小鼠的脾收获(实施例5)。将细胞平铺于96槽孔v形底盘中的以10%(v/v)胎牛血清(fbs)、 2mm l-谷氨酰胺、100u/毫升的青霉素及100微克/毫升的链霉素(gibco)补充的rpmi 1640培养基(gibco/lifetechnologies,grand island,ny)中。将ct26.wt标靶细胞在37℃下以10μm钙黄绿素am(life technologies)经1 小时标记且接着与脾细胞以50:1的效应子:标靶(e:t)的比组合。在37℃下培育4小时之后,收获无细胞上清液且在荧光计上以485纳米激发及535纳米放射下定量钙黄绿素释放。特异性细胞溶解百分比是如下测定:溶解%=100 x(er-sr)/(mr-sr),其中er、sr及mr分别代表实验、自发性及最大钙黄绿素释放。自发性释放为在培养基中单独培育的标靶细胞发射的荧光(亦即在没有效应子细胞的存在下),而最大释放是藉由以等体积的10% sds溶解标靶细胞来测定。
637.如图10中所示,与来自以对照抗体治疗的小鼠的细胞相比,当小鼠以抗tigit抗体313r12治疗时,证明来自携ct26.wt肿瘤的小鼠的cd8 细胞毒性t细胞增加杀死ct26.wt标靶细胞的能力。
638.这些结果示意抗tigit抗体可增加抗原特异性细胞毒性t细胞活性及因此增强抗肿瘤免疫反应。这增加的细胞毒性t细胞活性可能由于抗tigit抗体的直接或间接效应,亦即抑制了抑制因子细胞效应。实施例9t调节性细胞(treg)检定法
639.t调节性细胞(treg)在维持衡定及防止自体免疫反应中扮演必要的角色。treg为t细胞的小子集,其大部分为cd4 细胞且表达cd25(il-2受体α链)及其他的treg细胞相关的分子标记。foxp3(转录因子)经辨识为 treg细胞发展及功能因子。foxp3被认为是界定且鉴别 treg细胞及分离treg与其他的t细胞亚群的特异性标记。然而,已在人类细胞中挑战foxp3对treg的特异性。除了cd4 treg细胞以外,cd8 treg细胞代表另一细胞亚群,且与cd4 treg细胞相比时,foxp3对它们的发展及功能可能不如此重要。
641.treg在以抗tigit抗体治疗的小鼠中的功能性是藉由测定treg对原生cd4 或cd8 t细胞增生的效应来评估。原生t细胞是来自未经治疗的小鼠的脾使用小鼠cd3 t细胞富集管柱(r&d systems)纯化而来。将这些纯化的t细胞以5μm紫色追踪染料(vtd;lifetechnologies)标记。将2
×
105个经vtd标记的t细胞与以抗cd3及抗cd28抗体包覆的珠培育,以刺激细胞增生。使用小鼠treg分离试剂盒(miltenyi biotec)自以抗 tigit抗体313r12(n=6)或同型匹配的对照抗体(n=5)治疗的携ct26.wt肿瘤的小鼠(参见实施例5)的脾分离出 treg。为了测定treg对t细胞增生的冲击,将经刺激的经vtd标记的t细胞(效应子)与来自以抗tigit抗体 313r12治疗的小鼠及以对照抗体治疗的小鼠的经分离的脾treg共同培养(1:0.5的效应子:treg的比)。在第4天,清洗细胞且将细胞与抗小鼠cd4或抗小鼠cd8抗体培育。细胞是使用facscanto ii仪器及facsdiva软件 v6.1.3(bd biosciences)的facs分析来评估。vtd信号是由于标记的细胞分裂而减半,因此将分析闸设定在以检定中没有treg细胞所获得的最大信号与以没有抗 cd3/cd28刺激所获得的最小信号之间。使用在此区内对 cd4 t细胞及cd8 t细胞的细胞百分比(降低的vtd表达)来计算cd4 及cd8 t细胞增生。抑制百分比是如下计算[最大信号-(样品信号/最大信号)]
×
100。
[0642]
如图11中所示,以抗tigit抗体313r12治疗对源自脾的treg对cd4 t细胞增生的抑制功能没有任何可观察的效应。相反地,以抗tigit抗体313r12治疗降低约30%的源自脾的treg对cd8 t细胞增生的抑制功能。
[0642]
这些结果示意以抗tigit抗体治疗可造成降低的treg功能及/或抑制,亦即〝取消约束〞免疫反应。降低treg功能或treg抑制可增强总体抗肿瘤免疫反应。实施例10使抗tigit抗体313r12治疗的携ct26.wt肿瘤的小鼠的免疫细胞特征化
[0644]
为了使抗tigit抗体313r12治疗的携 ct26.wt肿瘤的小鼠中的免疫细胞更佳地特征化,以 facs分析自个别小鼠分离的脾细胞。将ct26.wt细胞 (20,000个细胞/小鼠)注射至6-8周龄balb/c小鼠的后胁腹中。容许肿瘤生长10天,直到其达到约50立方毫米体积为止。将小鼠以0.25毫克/小鼠的抗tigit抗体313r12 或同型匹配的对照抗体治疗(每组n=10-20)。将小鼠以每周两次经腹膜内注射给药。监测肿瘤生长且以电子式卡尺测量肿瘤体积。使用各治疗组的6只小鼠进行分析。在细胞注射后第32天(在最后抗体剂量后1天)分离脾细胞。将脾细胞(1
×
106)与重组fc蛋白质培育10分钟,以阻断非特异性结合,且接着与荧光染料共轭的抗体在100微升 facs染色缓冲液(hbss加上2%的热失活的小牛血清)中于冰上培育20分钟。以清洗移除未结合的抗体且将死细胞以可固定的存活性染料标记。将细胞在室温下固定在 2%聚甲醛中20分钟且使用facscanto ii仪器及 facsdiva软件v6.1.3(bd biosciences)分析。
[0645]
总t细胞是使用抗小鼠cd3e抗体鉴别, cd4 t细胞是使用抗小鼠cd4抗体鉴别,及cd8 t细胞是使用抗小鼠cd8抗体鉴别。中心记忆细胞是使用抗小鼠/人类cd44抗体鉴别及效应子记忆细胞是使用抗人类 cd62l抗体鉴别。facs染色是如上述使用抗小鼠cd8b 抗体(克隆53-5.8,biolegend)、抗小鼠cd4抗体(克隆 gk1.5,biolegend)、抗小鼠cd62l抗体(克隆mel-14, biolegend)和抗小鼠cd44抗体(克隆1m7,biolegend)进行。细胞是以代表中心记忆细胞的cd44
高
cd62l
高
表达及代表效应子记忆细胞(闸控cd8 t细胞)的cd44
高
cd62l
低
表达来分析。
[0645]
与来自以对照抗体治疗的小鼠的t细胞群相比,facs分析指出以抗tigit抗体313r12治疗的携 ct26.wt肿瘤的小鼠具有增加的总活脾细胞的t细胞群 (图12a)。与以对照抗体治疗的小鼠相比,在以抗体 313r12治疗的小鼠中的(总活细胞的)cd4 t细胞百分比以及(总活细胞的)cd8 t细胞百分比增加(图12b和图 12c)。另外,在cd4 t细胞群内的中心记忆细胞百分比增加(图12d)。然而,在cd8 t细胞群内的中心记忆细胞百分比未增加(图12e)。
[0646]
这些数据指出以抗tigit抗体治疗增加cd4 和cd8 t细胞群二者的百分比。结果与增强的免疫反应一致。
[0647]
为了评定抗tigit抗体对标靶表达的效应,以流动式细胞测量术分析对treg的tigit表达。如本文所述,treg为抑制因子细胞及已知cd4 treg表达转录因子foxp3。如上文所述,自以抗tigit抗体313r12或对照抗体治疗的携ct26.wt肿瘤的小鼠分离出脾细胞。将脾细胞(1
×
106)与重组fc蛋白质培育10分钟,以阻断非特异性结合,且接着与抗tigit抗体313r12及抗小鼠 cd4抗体在100微升facs染色缓冲液(hbss加上2%的热失活的小牛血清)中于冰上培育20分钟。在以facs染色缓冲液清洗之后,将细胞以可固定的细胞存活性染料标记、固定且渗透隔夜。在渗透之后,将细胞以1x渗透缓冲液清洗两次。将细胞在冰上使用抗小鼠foxp3抗体经30分钟染色,清洗且在室温下以2%甲醛固定20分钟。使用facscanto ii仪器进行流动式细胞测量术且数据分析是使用facsdiva软件v6.1.3(bd biosciences)进行。
[0648]
如图13a中所示,与来自以对照抗体治疗的携肿瘤的小鼠的脾细胞相比,在以抗tigit抗体313r12 治疗的携ct26.wt肿瘤的小鼠中的表达tigit的总脾细胞百分比降低。两组小鼠的总cd4 细胞的foxp3 cd4 细胞百分比(代表treg)为约22-23%且似乎不受以抗tigit 抗体治疗的影响(图13b)。然而,与以对照抗体治疗的携肿瘤的小鼠相比,在来自以抗tigit抗体313r12治疗的携ct26.wt肿瘤的小鼠的脾细胞群中的(总treg 的)tigit-阳性treg百分比戏剧性地降低(图13c)。相反地,与以对照抗体治疗的携肿瘤的小鼠相比,在来自以抗 tigit抗体313r12治疗的携ct26.wt肿瘤的小鼠的脾细胞群中的tigit-阴性treg百分比略微增加(图13d)。
[0649]
这些结果示意抗tigit抗体313r12耗尽 tigit-阳性细胞,特别为treg。然而,如以facs评定的降低的tigit-阳性细胞可能由于tigit蛋白质的内化作用及/或tigit细胞表面表达的向下调节,而不是真正耗尽细胞。
[0651]
骨髓衍生性抑制细胞(mdsc)为骨髓细胞的异质化家族且已显示为有效力的后天及先天二者免疫性抑制因子。mdsc抑制cd4 t细胞和cd8 t细胞增生及活化且加速产生treg。相信mdsc是藉由抑制抗肿瘤免疫反应、促进血管生成及创造转移前环境而加速癌发展。 mdsc是以骨髓细胞系分化抗原gr1和cd11b的细胞表面表达特征化。gr1主要受限于颗粒细胞系的细胞上的表达及cd11b为在巨噬细胞、颗粒细胞、nk细胞和t细胞表面上发现的细胞表面整合素。在小鼠中,mdsc可部分基于这些标记而分裂成两个亚群:颗粒细胞mdsc(g
‑ꢀ
mdsc)及单细胞mdsc(m-mdsc)。g-mdsc通常具有多叶形细胞核及cd11b gr1
高
表达型,而m-mdsc具有单细胞形态及cd11b gr1
低
表达型。mdsc的两种群已显示出以多重机制抑制t细胞反应,包括增加精氨酸酶、可诱发的氧化氮合成酶(inos)、氧化氮和反应性氧种类的生产。因此,mdsc促成免疫抑制肿瘤微环境且可限制抗肿瘤免疫反应效应。
[0652]
来自以抗tigit抗体313r12或对照抗体治疗的携ct26.wt肿瘤的小鼠的骨髓细胞(特别为mdsc)是以 facs分析。将脾细胞(1
×
106)与重组fc蛋白质培育10分钟,以阻断非特异性结合,且接着与荧光染料共轭的抗体在100微升facs染色缓冲液(hbss加上2%的热失活的小牛血清)中于冰上培育20分钟。接着将细胞与抗小鼠 cd11b抗体及抗小鼠gr1抗体培育。以清洗移除未结合的抗体且将细胞以可固定的存活性染料标记。将细胞在室温下固定在2%聚甲醛中20分钟且使用facscanto ii仪器及facsdiva软件v6.1.3(bd biosciences)分析。
[0652]
如图14a中所示,与来自以对照抗体治疗的携肿瘤的小鼠的cd11b 骨髓细胞相比,来自以抗tigit 抗体313r12治疗的携ct26.wt肿瘤的小鼠的脾的(总活细胞)cd11b 骨髓细胞百分比降低约25%。与来自以对照抗体治疗的携肿瘤的小鼠的cd11b gr1 mdsc相比,来自以抗tigit抗体313r12治疗的携肿瘤的小鼠的脾的(总 cd11b 骨髓细胞)cd11b gr1 mdsc百分比降低约 45%(图14b)。在mdsc群内,来自以抗tigit抗体 313r12治疗的携ct26.wt肿瘤的小鼠的脾的g-mdsc(经鉴别为cd11b gr1
高
)百分比降低约66%,但是来自以抗 tigit抗体313r12治疗的携ct26.wt肿瘤的小鼠的脾的 m-mdsc(经鉴别为cd11b gr1
低
)增加约30%(分别为图 14c和14d)。
[0653]
这些结果示意以抗tigit抗体治疗可藉由降低特异性免疫细胞(亦即mdsc)的抑制活性而增强抗肿瘤反应。实施例11以抗tigit抗体的活体内肿瘤生长抑制
[0654]
肾癌细胞为自atcc获得的源自balb/c的肾腺癌细胞系。将肾癌细胞(5
×
105个细胞/小鼠)经皮下植入 6-8周龄balb/c小鼠的后胁腹中。容许肿瘤生长7天,直到其达到约43立方毫米体积为止。将小鼠以0.25毫克/小鼠的抗tigit抗体313r12(migg2a抗体)或migg2a对照抗体治疗(每组n=10)。将小鼠以每周两次经腹膜内注射给药三周。监测肿瘤生长且在第7、10、14、17、21和 24天以电子式卡尺测量肿瘤体积。
[0655]
如图15中所示,与同型匹配的对照抗体相比,抗tigit抗体313r12强力抑制肿瘤生长。所有对照小鼠由于肿瘤尺寸而于第28天予以安乐死。相反地,以抗体313r12治疗的10只小鼠中的8只的肿瘤在第28天消退及这些小鼠中的5只没有可检测的肿瘤。原来10只小鼠中的5只维持不变且直到注射后至少100天没有可检测的肿瘤。这些结果显示抗tigit抗体313r12的抗肿瘤活性在数种不同的肿瘤类型中皆有效。实施例12以抗tigit抗体的活体内肿瘤生长抑制-剂量研究
[0657]
因为抗tigit抗体已显示出有效抑制肿瘤生长,所以进行剂量范围研究。将鼠类结肠肿瘤系 ct26.wt经皮下植入(30,000个细胞/小鼠)balb/c小鼠中且容许肿瘤生长至约35立方毫米平均尺寸。将小鼠以 30、15、10、5、3、1或0.5毫克/公斤的抗tigit抗体 313r12或以对照抗体治疗(每组n=10)。将小鼠以每周一次经腹膜内注射给药,共三次剂量。监测肿瘤生长且以电子式卡尺在指示的时间点测量肿瘤体积。
[0657]
图16显示各治疗组的平均肿瘤体积。以各剂量(包括0.5毫克/公斤的最低量)的抗tigit抗体313r12 治疗皆强力抑制ct26.wt肿瘤生长。如表4中所示,以每个剂量值使至少40%的小鼠的肿瘤在第20天消退。在每个治疗组中,有个别的小鼠的肿瘤消退至不可检测
的程度。未于此实验看到剂量反应曲线,其可能由于在开始治疗时的肿瘤尺寸。表4
[0658]
这些结果证明抗tigit抗体313r12作为免疫治疗剂的效力。关于看到显著的抗肿瘤效应所需的少量抗 tigit抗体的这些结果通常令人惊讶。实施例13以抗tigit抗体及抗pd-l1抗体的活体内肿瘤生长抑制
[0659]
将鼠类结肠肿瘤系ct26.wt经皮下植入 (30,000个细胞/小鼠)balb/c小鼠中,且在治疗的第1天(植入后第10天),肿瘤具有约105立方毫米平均尺寸。将小鼠以0.25毫克/小鼠的抗tigit抗体313r12、抗pd
‑ꢀ
l1抗体、313r12与抗pd-l1抗体的组合或对照抗体治疗 (每组n=10-20)。将小鼠以每周两次施用抗体经3周。监测肿瘤生长且以电子式卡尺测量肿瘤体积。
[0660]
如图17b中所示,抗tigit抗体313r12是以高百分比强力抑制小鼠中的ct26.wt肿瘤生长。应注意的是以抗tigit抗体313r12治疗不仅能够抑制大部分小鼠中的肿瘤生长,并且能够诱发个别的肿瘤消退,时常至不可检测的程度。以抗pd-l1抗体作为单一剂治疗很少成功抑制肿瘤生长(图17c)。以抗tigit抗体313r12与抗 pd-l1抗体的组合治疗抑制肿瘤生长的程度比任一单独的剂更大(图17d)。平均肿瘤体积显示于图17e中及来自各组的小鼠的存活百分比显示于图17f中。
[0661]
一种评估抗肿瘤记忆细胞群的存在及/或功能性的方法为以新鲜肿瘤细胞再挑战先前治疗的小鼠。以先前经抗tigit抗体313r12、抗mpd-l1抗体或313r12与抗mpd-l1抗体的组合治疗的小鼠(来自上述研究)用于再挑战研究。将肿瘤在第一次肿瘤注射后至少128天完全消退且不可检测出肿瘤的小鼠再以ct26.wt肿瘤细胞 (30,000细胞)挑战。施予肿瘤再挑战的小鼠是在再挑战前 100天接受最后的治疗剂量。将原生balb/c小鼠(n=10) 以ct26.wt肿瘤细胞(30,000细胞)注射,作为对照组。监测肿瘤生长且以电子式卡尺在指示的时间点测量肿瘤体积。数据是以平均
±
s.e.m表示。
[0662]
在原生小鼠中的ct26.wt肿瘤的平均肿瘤体积稳定地生长至第28天,具有约1750立方毫米平均肿瘤体积。来自先前实验的小鼠中仅有2只先前已以抗pd-l1 抗体治疗的小鼠具有完全消退的肿瘤,但是该2只小鼠证明对肿瘤再挑战的完全免疫性。有4只先前已以抗tigit 抗体治疗的小鼠具有完全消退的肿瘤,且这些小鼠在再挑战之后没有长出肿瘤及证明对肿瘤再挑战的完全免疫性。另外,有7只先前已以313r12与抗pd-l1抗体的组合治疗
的小鼠具有完全消退的肿瘤,且这些小鼠证明对肿瘤挑战的完全免疫性。
[0663]
以作为单一剂或与抗pd-l1抗体组合的抗 tigit抗体治疗的小鼠似乎受到免于ct26.wt肿瘤细胞的再挑战的强力保护。这些结果示意在以作为单一剂或与检查点抑制剂组合的抗tigit抗体治疗之后存在的免疫原性记忆。实施例14以抗tigit抗体及抗pd-1抗体的活体内肿瘤生长抑制
[0664]
将鼠类结肠肿瘤系ct26.wt经皮下植入 (30,000个细胞/小鼠)balb/c小鼠中,且在治疗的第1天 (植入后第7天),肿瘤具有约62立方毫米平均尺寸。将小鼠(n=15)以12.5毫克抗tigit抗体313r12、抗pd-1 抗体、313r12与抗pd-1抗体的组合或对照抗体治疗(每组n=15)。将小鼠以每周两次经腹膜内注射施用抗体经3 周。监测肿瘤生长且以电子式卡尺测量肿瘤体积。
[0665]
如图18b中所示,以抗tigit抗体313r12治疗强力抑制肿瘤生长。如前面的实施例中所见,以 313r12治疗不仅能够抑制肿瘤生长,并且能够诱发一些肿瘤消退。以抗tigit抗体313r12与抗pd-1抗体的组合治疗抑制肿瘤生长的程度比任一单独的剂更大(图 18d)。在第24天的四组中的平均肿瘤体积显示于图18e 中。
[0666]
以先前经抗tigit抗体313r12、抗mpd-l1 抗体或313r12与抗mpd-l1抗体的组合治疗的小鼠(来自上述研究)用于再挑战研究。将肿瘤在第一次肿瘤注射后至少100天完全消退且不可检测出肿瘤的小鼠再以 ct26.wt肿瘤细胞(60,000细胞)挑战。将原生balb/c小鼠 (n=10)以ct26.wt肿瘤细胞(60,000细胞)注射,作为对照组。监测肿瘤生长且以电子式卡尺在指示的时间点测量肿瘤体积。数据是以平均
±
s.e.m表示。
[0667]
在原生小鼠中的ct26.wt肿瘤的平均肿瘤体积稳定地生长,在第21天具有约1250立方毫米平均肿瘤体积。来自先前实验的小鼠中有13只先前已以313r12与抗pd-1抗体的组合治疗的小鼠具有完全消退的肿瘤,且这些小鼠证明对肿瘤挑战的完全免疫性。
[0668]
这些结果进一步支持抗tigit抗体313r12为非常有效力的免疫治疗剂的构想,即使以单一剂施用时。另外,抗tigit抗体的效能可藉由其与其他的免疫治疗剂的组合而进一步增强。实施例15产生抗tigit单克隆抗体
[0669]
抗体是对抗重组人类tigit氨基酸22-141 (r&d systems)及/或重组人类tigit氨基酸22-138(sinobiological inc.)而产生。小鼠(n=3)是使用标准的技术以 tigit免疫。在最初免疫之后约70天使用facs分析来筛选对抗人类tigit的个别小鼠的血清。在分离出动物脾细胞用于融合瘤生产之后,选择具有最高的抗体效价的动物用于最终的抗原激励。使用sp2/0作为小鼠脾细胞的融合伙伴。融合瘤细胞以每一槽孔1个细胞平铺于96槽孔盘中且以facs分析筛选对抗人类tigit的上清液。
[0670]
建构用于抗tigit抗体的facs筛选的嵌合融合蛋白(flag-htigit-cd4tm-gfp),该嵌合融合蛋白赋予人类tigit的细胞外结构域的细胞表面表达且将嵌合融合蛋白转染至hek-293t细胞中。在48小时之后,将转染的细胞悬浮在含有2% fbs及肝素的冰冷的pbs中且在50微升融合瘤上清液的存在下于冰上培育30分钟。以 100微升pe共轭的抗人类fc二级抗体进行第二次培育,以检测以抗体结合的细胞。将细胞与作为正对照物的抗 flag抗体
(sigma-aldrich)及作为负对照物的抗pe抗体培育。以facscalibur仪器(bd biosciences)分析细胞且使用flowjo软件处理数据。
[0671]
鉴别出数种结合人类tigit的融合瘤且选择抗体313m26。313m26的重链可变区和轻链可变区的氨基酸序列分别为seq id no:63和seq id no:64。 313m26的重链可变区和轻链可变区的核苷酸序列分别为seq id no:65和seq id no:66。
[0672]
313m26抗体是使用那些熟习本技领域者已知的标准技术人源化。313m26的人源化版本在本文称为 313m32且为igg1抗体。313m32的重链可变区和轻链可变区的氨基酸序列分别为seq id no:67和seq idno:68。313m32的重链可变区和轻链可变区的核苷酸序列分别为seq id no:73和seq id no:74。将 313m26/313m32的重链和轻链cdr列示于本文的表2中 (seq id no:57-62)。具有预测信号序列的313m32的重链的氨基酸序列为seq id no:69及不具有预测信号序列的313m32的重链的氨基酸序列为seq id no:70;具有预测信号序列的313m32的轻链的氨基酸序列为seqid no:71及不具有预测信号序列的313m32的轻链的氨基酸序列为seq id no:72。313m32的重链和轻链的核苷酸序列分别为seq id no:75和seq id no:76。
[0673]
编码313m32抗体的重链可变区的质粒是在 2015年8月11日依照布达佩斯特条约的条款保藏于美国菌种保藏中心(atcc),10801 university boulevard, manassas,va,usa且以pta-122346编号。编码313m32 抗体的轻链可变区的质粒是在2015年8月11日依照布达佩斯特条约的条款保藏于美国菌种保藏中心(atcc), 10801 university boulevard,manassas,va,usa且以 pta-122347编号。
[0674]
筛选与来自许多不同物种的tigit蛋白质结合的人源化抗tigit抗体313m32。测定出313m32强力结合人类tigit及不结合来自任何其他测试的物种的 tigit,包括小鼠、大鼠、天竺鼠、兔子、狨猴、猪、狗、恒河猴和食蟹猕猴。这与在oncomedpharmaceuticals所产生的另一抗tigit抗体:313r19相反,其与除了天竺鼠以外的所有这些物种的tigit结合。抗体313r19为原来经鉴别为与小鼠及人类tigit二者结合的兔子抗tigit抗体(313r12)的人源化版本。表5总结抗tigit抗体及与小鼠、人类、食蟹猕猴和恒河猴tigit 的结合。表5实施例16阻断人类tigit与pvr结合的抗tigit抗体的facs分析
[0675]
细胞表面人类tigit蛋白质是藉由使用标准的重组dna技术接合人类tigit的氨基酸22-141与cd4 的跨膜结构域及c-端gfp蛋白质标签(htigit-cd4tm
‑ꢀ
gfp)而产生。pvr-fc建构体是使用标准的重组dna技术而产生。人类pvr的细胞外结构域尤其于框内与兔子fc 区接合且重组hpvr-rbfc蛋白质表达在cho细胞中。融合蛋白是来自细胞培养基使用蛋白质
a层析术纯化而来。
[0676]
将hek-293t细胞以tigit-cd4tm-gfp建构体过渡性转染。在16小时之后,将转染的细胞悬浮在含有2% fbs及肝素的冰冷的hbss中且与50微克/毫升的 hpvr-rbfc融合蛋白在抗tigit抗体313r19、313m26或 313m32的存在下于冰上培育60分钟。抗体313r19为兔子抗tigit抗体的人源化版本。313r19结合小鼠及人类 tigit。抗体是以10、2和0.4微克/毫升浓度测试。细胞不与抗体或不与hpvr-rbfc培育,作为对照物。以100微升pe共轭的抗兔子fc二级抗体进行第二次培育,以检测以hpvr-rbfc融合蛋白结合的细胞。以facscanto仪器 (bd biosciences)分析细胞且使用flowjo软件处理数据。
[0677]
如图19a中所示,hpvr-rbfc在没有任何抗 tigit抗体的存在下与表达在hek-293t细胞表面上的 htigit强力结合。所有三种抗tigit抗体在10微克/毫升的最高浓度下阻断hpvr-rbfc与htigit结合。然而, 313r19抗体在2微克/毫升和0.4微克/毫升抗体的较低浓度下不阻断hpvr-rbfc与htigit结合。相反地,抗 htigit抗体313m32在2微克/毫升下强力阻断hpvr
‑ꢀ
rbfc与htigit结合且阻断程度比亲代小鼠抗体313m26 更高。这些结果示意人源化313m32抗体对htigit的亲和性比亲代抗体313m26和抗体313r19更高。使用10、5、2.5和1.25微克/毫升浓度的抗体313r19和抗体 313m32进行额外的实验(图19b)。自该两个研究的结果示意抗体313m32对htigit的亲和性比抗体313r19高约5 倍。另外,初步biacore结果显示313r19的亲和性为 2nm及313m32的亲和性为0.4nm。实施例17tigit传导信号及tigit磷酸化
[0679]
tigit是在与其相反受体pvr交互作用之后于其胞质尾区磷酸化。tigit磷酸化为级联的开始,该级联包括影响其他已知的传导信号途径的下游事件。因此,评估tigit磷酸化可给出关于tigit功能及tigit拮抗剂效应的信息。
[0680]
jurkat cd4 人类t细胞系缺乏人类tigit表达,如以实时pcr及facs所测定(未显示数据)。为了产生tigit表达的细胞系,将jurkat细胞以表达以flag及绿荧光蛋白(gfp)标签化的人类tigit(htigit)的慢病毒建构体感染。将gfp-阳性细胞使用facsaria ii细胞分类器(bd biosciences)分类至96槽孔盘中,将单细胞扩展成克隆且选择克隆细胞系(jurkat-htigit)。
[0680]
721.221人类b细胞淋巴瘤系缺乏pvr表达,如以实时pcr及facs所测定(未显示数据)。为了产生 pvr表达的细胞系,将721.221细胞以表达人类pvr (hpvr)及gfp的慢病毒建构体感染。将gfp-阳性细胞使用facsaria ii细胞分类器(bd biosciences)分类至96槽孔盘中,将单细胞扩展成克隆且选择克隆细胞系(721.221
‑ꢀ
hpvr)。
[0681]
为了评估反应pvr的tigit磷酸化,将 jurkat-htigit细胞在37℃下于无血清培养基中培育2小时。接着将细胞在室温下以20微克/毫升的抗tigit抗体 313r19、313m26或313m32或对照抗体预处理20分钟。将jurkat-htigit细胞与亲代721.221细胞或721.221
‑ꢀ
mpvr细胞以5:1的细胞比混合且在37℃下于酪氨酸磷酸酶抑制剂(10mm钒酸钠,new england biolabs)的存在下培育5分钟。制备细胞溶解物且以捕获经flag-标签化的 htigit蛋白质的经抗flag-包覆的磁珠免疫沉淀。将免疫沉淀物在4-12% bis-tris凝胶(novex/life technologies) 上分离且使用iblot 2装置(life technologies)转移至硝化纤维薄膜。将薄膜与辣根过氧化酶共轭的抗酪氨酸抗体培育且使用标准的检测试剂观察
磷酸化的tigit(ptigit)。使用抗flag抗体(cell signaling technology)评估存在的总tigit。
[0682]
观察出htigit在反应hpvr表达的肿瘤细胞的jurkat细胞中高度磷酸化。此磷酸化是在抗tigit抗体 (尤其为313m32抗体)的存在下受到抑制(图20)。实施例18抗原决定区定位抗htigit抗体的抗原决定区定位
[0683]
为了鉴别抗体313m32的结合抗原决定区,以具有特异性氨基酸取代的一系列人类tigit变体进行分析。变体是基于人类tigit与食蟹猕猴tigit分别为 seq id no:4和seq id no:77的氨基酸序列之间的差别。恒河猴tigit的氨基酸序列(seq id no:78)与食蟹猕猴tigit相同(图21)。将氨基酸变体引入在食蟹猕猴 tigit中存在的氨基酸残基至人类tigit中的对应位置中。所产生的htigit变体具有在(1)e36k和i41v; (2)t51m;(3)q62h和q64h;(4)d72e;(5)s78y和 s80a;(6)v100m;(7)i109t和t119r;及(8)g135s上的取代。各变体htigit是使用实施例12中所述的htigit (aa 22-141)-cd4tm-gfp建构体而产生。
[0685]
tigit变体是藉由facs以抗htigit抗体评估。将hek-293t细胞以htigit-cd4tm-gfp、mtigit
‑ꢀ
cd4tm-gfp或变体htigit-cd4tm-gfp建构体中的一者过渡性转染。在16小时之后,将转染的细胞悬浮在含有 2%fbs的冰冷的hbss中且与1微克/毫升的抗htigit 抗体313r12、313m32或313m34/10a7于冰上培育30分钟。313m34为基于美国公开案2009/0258013中所述的 10a7抗体的氨基酸序列所产生的抗htigit抗体。10a7 抗体为结合小鼠tigit及人类tigit二者的抗小鼠tigit 抗体。以50微升pe共轭的抗fc二级抗体进行第二次培育,以检测以抗体结合的细胞。以facscalibur仪器(bdbiosciences)分析细胞且使用flowjo软件处理数据。
[0685]
如图22中所示,抗体313m32不与在氨基酸残基62和64上具有取代的tigit变体3及在氨基酸残基 109和119上具有取代的tigit变体7结合。抗体保留其与htigit及tigit变体1、2、4、5、6和8的强力结合。在与pvr结合的tigit的晶体结构的图像上以黑色强调氨基酸残基62、64、109和119(图23)。人类tigit 的结构是以球形图像显示及pvr的结构是以条状图像提供。氨基酸的位置揭露抗体313m32是在应该以pvr结合来阻断及/或干扰的区域内结合htigit。值得注意的是抗体313r12亦损失与在氨基酸残基109和119上具有取代的tigit变体7的结合,示意313r12结合与以313m32 结合的抗原决定区重叠的抗原决定区。有趣的是抗体 313m34/10a7与tigit的结合不受tigit变体3或变体7 的氨基酸取代的冲击,但是受到在tigit变体6的残基 100的氨基酸取代的冲击。这结果显示抗体313m34/10a7 不结合与抗体313m32相同的抗原决定区。抗体313m32 和313m34/10a7对tigit的关键结合残基的相对位置显示于图23的图像上。
[0686]
为了确认抗体313m26(313m32的亲代鼠类抗 htigit抗体)及313r19(自313m32所产生的人源化兔子抗htigit抗体)结合共同的抗原决定区,所以进行竞争研究。因为313m26及313r19抗体的fc部分不同,亦即分别为鼠类fc及人类fc,所以可测定一种抗体(313r19)在第二种抗体(313m26)的存在或不存在下的结合。简言之,将hek-293t细胞以编码人类tigit-cd4tm-gfp的表达载体过渡性转染。将细胞与0.5微克抗体313m19及过量抗体313m26(从50至0.78微克/毫升,2倍稀释)培育1小时。清洗细胞且与对人类fc具有特异性的经荧光
标记的二级抗体培育,且以流动式细胞测量术分析。
[0687]
如图24a中所示,抗体313m26与313r19竞争与htigit结合且过量313m26有效地阻断313r19与 htigit结合。这些数据表示313m26/313m32及 313r12/313r19结合至重叠的抗原决定区且与图23中所呈现的抗原决定区分析一致。在并行的实验中检查 313r19或313m32与313m34/10a7竞争与tigit结合的能力。如图24b中所示,观察到313r19或313m32抗体不与313m34/10a7竞争与htigit结合。这些结果表示 313r19及313m32结合至与以313m34/10a7结合的抗原决定区不同的抗原决定区。这些结果亦与图23中所呈现的抗原决定区分析一致。实施例19细胞激素生产
[0689]
tigit与表达在肿瘤细胞或抗原呈现细胞上的 pvr(cd155)的接合已显示出向下调节t细胞效应子功能且抑制抗肿瘤免疫反应(参见例如joller等人的2014, immunity,40:569-581)。研究抗tigit抗体313r19及313m32阻断经pvr介导的抑制t细胞激素分泌的能力。活化的人类t细胞芽是藉由初代人类t细胞与植物血球凝集素(pha,2微克/毫升)及il-2(4毫微克/毫升)培养10天而产生。将细胞芽静置于无pha/il-2培养基中24小时,以5
×
105个细胞/毫升再悬浮且在室温下以10或25微克/ 毫升的对照抗体(多克隆人类igg,25微克/毫升)、抗 tigit抗体313r19或313m32处理15分钟。接着将细胞平铺于已在4℃下以抗cd3抗体(ebioscience)、人类pvr
‑ꢀ
fc或抗cd3抗体及hpvr-fc(各以10微克/毫升)包覆隔夜的槽孔中。在48小时之后收获无细胞培养物上清液且以 elisa(r&d systems)测定ifn-γ及il-2细胞激素。结果是以相对于单独的抗cd3活化的细胞所产生的细胞激素来表示,其中抗cd3细胞激素量设定在1.0。
[0689]
如图25中所见,hpvr-fc不在活化的细胞中诱发ifn-γ或il-2生产。然而,hpvr-fc强力抑制藉由抗cd3接合而诱发的细胞激素生产。这抑制是以抗tigit 抗体313r19及313m32反转,且以25微克/毫升的较高剂量生产的ifn-γ或il-2实际上比以抗cd3所产生的量更大。活化的t细胞表达tigit及cd226二者,且二者可与pvr交互作用,但是tigit/pvr交互作用是受抑制的及cd226/pvr交互作用经活化。不想受到理论的束缚,示意当活化的t细胞与pvr接触时,以tigit/pvr 交互作用〝胜出〞,因为tigit比cd226更强力结合 pvr。另外,似乎在活化的t细胞上的tigit量比cd226 更高,所以整体交互作用是受抑制的。例如,在图25中比较单独的抗cd3与抗cd3加上pvr。当tigit以 313r19或313m32阻断时,则经tigit介导的抑制作用反转,但是理论上仍发生cd226/pvr交互作用,且该交互作用经活化。因此,如图25中所见,当阻断tigit且以抗cd3加上pvr刺激t细胞时,则ifn-γ量实际上比以单独的抗cd3刺激时更高。
[0690]
这些结果证明以抗tigit抗体阻断人类 tigit可阻扰tigit/pvr交互作用且修复有益于抗肿瘤反应的细胞激素生产。实施例20经抗体依赖性细胞介导的细胞毒性检定法
[0692]
经抗体依赖性细胞介导的细胞毒性(adcc)是指藉由细胞毒性效应子细胞通过非噬菌细胞过程杀死以抗体包覆的标靶细胞,通常以释放细胞毒性颗粒或表达细胞死亡诱发分子为特征。介导adcc的效应子细胞包括自然杀手(nk)细胞、单核球、巨噬细胞、嗜中性细
胞、嗜酸性细胞和树突细胞。研究抗tigit抗体313r19及313m32 介导nk细胞adcc的能力。adcc是在使用初代人类 nk细胞作为效应子及亲代jurkat细胞或jurkat-htigit细胞作为标靶的标准的4小时钙黄绿素释放检定法测试。在 ficoll-hypaque(sigma)密度梯度离心之前,藉由与 rosettesep混合液(stem cell technologies)培育30分钟而自新鲜周围血液肤色血球层(stanford blood center,paloalto,ca)直接分离出人类nk细胞。将标靶亲代jurkat或 jurkat-htigit细胞在37℃下以10μm钙黄绿素am(lifetechnologies)经1小时标记且接着在室温下以对照多克隆 igg抗体、抗tigit抗体313r19或抗tigit抗体 313m32(全部皆以10微克/毫升)处理15分钟。在培育之后,将jurkat或jurkat-htigit细胞与nk细胞以20:1的效应子:标靶比于96槽孔v形底盘中组合。在37℃下培育 4小时之后,收获无细胞上清液血液且在荧光计上以485 纳米激发及535纳米放射下定量钙黄绿素释放。特异性细胞溶解百分比是如下测定:溶解%=100
×
(er-sr)/(mr
‑ꢀ
sr),其中er、sr及mr分别代表实验释放、自发性释放及最大钙黄绿素释放。自发性释放为在培养基中单独培育的标靶细胞发射的荧光(亦即在没有效应子细胞的存在下),而最大释放是藉由以等体积的10% sds溶解标靶细胞来测定。jurkat及jurkat-htigit细胞系二者的adcc 百分比是以在实验抗体(313r19或313m32)存在下的特异性溶解百分比减去在对照抗体存在下的特异性溶解百分比来测定。如图26中所示,当标靶细胞表达tigit时,adcc 百分比在抗tigit抗体313r19及313m32的存在下显著地增加。以抗tigit抗体诱发adcc的能力能示意抗 tigit抗体可具有多重机制用于增强对肿瘤细胞的免疫反应。实施例21在人源化小鼠中以抗tigit抗体于活体内肿瘤生长抑制
[0692]
使用人源化小鼠模式研究抗tigit抗体对人类肿瘤的治疗效能。人源化小鼠是自jackson laboratories 获得。这些小鼠是藉由以人类造血干细胞(cd34 细胞)注射至经照射的nsg小鼠中而产生。在15周之后,以流动式细胞测量术确认存在的成熟人类淋巴细胞。将各小鼠经皮下注射源自患者的黑色素瘤肿瘤细胞(omp-m9,75,000 个细胞/小鼠)。容许肿瘤生长19天,直到其达到约50立方毫米平均体积。将携肿瘤的小鼠随机分组(每组n=8)。将携肿瘤的小鼠以对照抗体、抗tigit抗体313r19或抗 tigit抗体313m32治疗。小鼠是以每5天给药1毫克/公斤或5毫克/公斤。监测肿瘤生长且以电子式卡尺在指示的时间点测量肿瘤体积。
[0693]
如图27中所示,与对照组相比,在以抗体 313r19及抗体313m32治疗的小鼠中的肿瘤生长受到抑制。这些结果显示靶定的tigit有效于提高人类淋巴细胞的抗肿瘤免疫反应且促成于活体内抑制人类肿瘤生长。在此实验中,抗tigit抗体313r19或313m32与抗hpd-1 抗体的组合不抑制肿瘤生长至任何比作为单一剂的抗 tigit抗体更大的程度(未显示数据)。
[0695]
发现抗体313m32及313r19抑制人类淋巴细胞环境的肿瘤生长且具有类似的活体内效力。这些结果证明可以携源自患者的异种移植物的人源化小鼠模式用于研究抗tigit抗体313m32(其仅结合人类tigit),同时用于以抗tigit抗体313r12及313r19和鼠类肿瘤模式进行的临床前研究。实施例22
抗tigit抗体的药物动力学
[0696]
如本文所述,抗tigit抗体313r12优先与小鼠tigit结合且其为大部分的临床前效能研究所使用的小鼠替代分子。在c57bl-6j小鼠中以0.1、1和10毫克/公斤的剂量测定抗tigit抗体313r12的药物动力学(pk)。采集21天内的血液样品。313r12在所研究的剂量值下展现非线性2室pk特征。相信此浓度依赖性清除为单克隆抗体的典型特性,当标靶丰富且以药物可轻易接近时,经标靶介导的清除可能为整体消除机制的重要成分。10毫克/公斤的313r12的浓度时间分布于21天内接近于线性,示意可及的标靶分子饱和。终末半衰期的评估不适用于非线性pk数据。
[0697]
抗tigit抗体313r19的pk是在balb/c小鼠中测定。将10毫克/公斤的单一剂量经iv或ip给予各小鼠。采集21天内的血液样品。313r19展现具有典型的 igg清除的线性2室pk特征。在小鼠中的10毫克/公斤的终末半衰期经评估为7.6天。
[0698]
亦在食蟹猕猴中测定抗tigit抗体313r19的pk。将10、30和100毫克/公斤的剂量以每周两次给予各动物,经四次剂量。各剂量组为4只雄性动物且研究是在第四剂量之后终止,没有恢复期。在食蟹猕猴中的 313r19展现具有典型的igg清除的线性2室pk特征。在食蟹猕猴中的终末半衰期经评估为15.3天。
[0699]
抗tigit抗体313m32的药物动力学是在 balb/c小鼠中测定。将1或10毫克/公斤的单一剂量经iv 或将10毫克/公斤经ip给予各小鼠。采集21天内的血液样品。在小鼠中的313m32展现线性2室pk特征,这与 313m32与小鼠tigit具有不可检测的结合的事实一致。清除缓慢且初步证明典型的igg pk行为。在小鼠中的终末半衰期经评估为11.7天。
[0700]
应了解本文所述的实施例及实施方案仅以例证为目的,且根据这些的各种修改或变化建议给熟习本技术领域者,且各种修改或变化包括在本技术的精神及权限内。
[0701]
本文所引用的所有公开数据、专利、专利申请、网站及编号/数据库序列(包括多核苷酸和多肽序列)全部皆以相同程度的目的以其完整内容特此并入本文以供参考,如同每一个别的公开数据、专利、专利申请、网站及编号/数据库序列是经具体且个别地指示而因此并入以供参考。
[0705]
下列为本技术所揭示的序列:小鼠tigit氨基酸序列(seq id no:1)不具有预测信号序列的小鼠tigit氨基酸序列(seq id no:2)小鼠tigit细胞外结构域氨基酸序列(seq id no:3)人类tigit氨基酸序列(seq id no:4)
不具有预测信号序列的人类tigit氨基酸序列(seq id no:5)人类tigit细胞外结构域氨基酸序列(seq id no:6)313r11/313r12重链cdr1(seq id no:7)313r11/313r12/313r14/313r19重链cdr2(seq id no: 8)313r11/313r12/313r14/313r19重链cdr3(seq id no:9)313r11/313r12轻链cdr1(seq id no:10)313r11/313r12轻链cdr2(seq id no:11)313r11/313r12轻链cdr3(seq id no:12)313r14/313r19重链cdr1(seq id no:13)313r14/313r19轻链cdr1(seq id no:14)313r14/313r19轻链cdr2(seq id no:15)313r14/313r19轻链cdr3(seq id no:16)313r11/313r12重链可变区氨基酸序列(seq id no:17)313r11/313r12轻链可变区氨基酸序列(seq id no:18)313r14重链可变区氨基酸序列(seq id no:19)313r14/313r19/313r20轻链可变区氨基酸序列(seq id no:20)
具有画底线的信号序列的313r11重链(migg1)氨基酸序列 (seq id no:21)具有画底线的信号序列的313r12重链(migg2)氨基酸序列 (seq id no:22)具有画底线的信号序列的313r11/313r12轻链氨基酸序列 (seq id no:23)具有画底线的信号序列的313r14重链(higg1)氨基酸序列 (seq id no:24)具有画底线的信号序列的313r14/313r19/313r20轻链氨基酸序列(seq id no:25)不具有信号序列的313r11重链(migg1)氨基酸序列(seq id no:26)不具有信号序列的313r12重链(migg2)氨基酸序列(seq id no:27)
不具有信号序列的313r11/313r12轻链氨基酸序列(seqidno:28)不具有信号序列的313r14重链(higg1)氨基酸序列(seqidno:29)不具有预测信号序列的313r14/313r19/313r20轻链氨基酸序列(seqidno:30)ah-1肽(seqidno:31)313r19/313r20重链可变区氨基酸序列(seqidno:32)具有画底线的信号序列的313r19重链(igg1)氨基酸序列(seqidno:33)不具有信号序列的313r19重链(igg1)氨基酸序列(seqidno:34)
接头(seq id no:35)接头(seq id no:36)接头(seq id no:37)接头(seq id no:38)接头(seq id no:39)flag标签(seq id no:40)人类igg1重链恒定区(seq id no:41)人类igg2重链恒定区(seq id no:42)人类igg3重链恒定区(seq id no:43)人类igg4重链恒定区(seq id no:44)人类igg1 fc区(13a版本)(seq id no:45)人类igg1 fc区(13b版本)(seq id no:46)
人类igg1 fc区(13a版本)(seq id no:47)人类igg1 fc区(13b版本)(seq id no:48)人类igg2 fc区(13a版本)(seq id no:49)人类igg2 fc区(13b版本)(seq id no:50)人类igg2 fc区(13a版本)(seq id no:51)人类igg2 fc区(13a版本)(seq id no:52)人类igg2 fc区(13b版本)(seq id no:53)人类igg2 fc区(13b版本)(seq id no:54)具有画底线的信号序列的313r20重链(igg4)氨基酸序列 (seq id no:55)
不具有信号序列的313r20重链(igg4)氨基酸序列(seqidno:56)313m26/313m32重链cdr1(seqidno:57)313m26/313m32重链cdr2(seqidno:58)313m26/313m32重链cdr3(seqidno:59)313m26/313m32轻链cdr1(seqidno:60)313m26/313m32轻链cdr2(seqidno:61)313m26/313m32轻链cdr3(seqidno:62)313m26重链可变区氨基酸序列(seqidno:63)313m26轻链可变区氨基酸序列(seqidno:64)313m26重链可变区核苷酸序列(seqidno:65)313m26轻链可变区核苷酸序列(seqidno:66)
313m32重链可变区氨基酸序列(seqidno:67)313m32轻链可变区氨基酸序列(seqidno:68)具有画底线的预测信号序列的313m32重链(igg1)氨基酸序列(seqidno:69)不具有信号序列的313m32重链(igg1)氨基酸序列(seqidno:70)具有画底线的预测信号序列的313m32轻链氨基酸序列(seqidno:71)不具有信号序列的313m32轻链氨基酸序列(seqidno:72)313m32重链可变区核苷酸序列(seqidno:73)313m32轻链可变区核苷酸序列(seqidno:74)
313m32重链(igg 1)核苷酸序列(seq id no:75)313m32轻链核苷酸序列(seq id no:76)食蟹猕猴tigit(seq id no:77)恒河猴tigit(seq id no:78)
人类tigit氨基酸55-70(seqidno:79)人类tigit氨基酸105-122(seqidno:80)313r14/313r19轻链cdr1(seqidno:81)不具有信号序列的313m33重链(igg4)ver2氨基酸序列(seqidno:82)具有信号序列的313m33重链(igg4)氨基酸序列(seqidno:83)mdwtwrilflvaaatgahsqvqlqesgpglvkpsetlsltcavsgysitsdyawnwirqppgkglewigyisysgstsynpslrsrvtisrdtsknqfflklssvtaadtavyycarrqvglgfaywgqgtlvtvssastkgpsvfplapcsrstsestaalgclvkdyfpepvtvswnsgaltsgvhtfpavlqssglyslssvvtvpssslgtktytcnvdhkpsntkvdkrveskygppcppcpapeflggpsvflfppkpkdtlmisrtpevtcvvvdvsqedpevqfnwyvdgvevhnaktkpreeqfnstyrvvsvltvlhqdwlngkeykckvsnkglpssiektiskakgqprepqvytlppsqeemtknqvsltclvkgfypsdiavewesngqpennykttppvldsdgsfflysrltvdksrwqegnvfscsvmhealhnhytqkslslslgk313m33重链(igg4)核苷酸序列(seqidno:84)atggactggacctggaggatactctttctcgtggctgcagccacaggagcccactcccaggtccagctgcaggagtctggcccaggactggtgaagccttctgagaccctgtccctcacctgcgctgtctctggttactccatcacctccgattatgcctggaactggattcggcagcccccagggaaggggctggagtggattgggtacataagctactctggtagcactagctacaacccatctctccggtcacgggtcacaatatcacgggacacatccaagaaccagttcttcctgaagctgtcctctgtgaccgccgctgacaccgccgtgtattactgtgcaaggagacaggtcgggctggggtttgcttactggggccaaggaaccctggtcaccgtcagctcagccagcacaaagggcccatccgtcttccccctggcaccctgctcccggagcacctccgagagcacagccgccctgggctgcctggtcaaggactacttccccgaacccgttaccgtgtcttggaactccggcgcactgaccagcggcgtgcacaccttccctgctgtcctccaatcctctggactctactccctctcctccgtggtgacagtgccctccagcagcctgggcactaagacctacacctgcaacgtcgatcacaagcccagcaacaccaaggtggacaagagagttgagtccaaatatggacccccatgcccaccttgcccagcacctgagttcctggggggaccatcagtcttcctgttccccccaaaacccaaggacactctcatgatctcccggacccctgaggtcacttgcgtggtggtggacgtgagccaggaagaccccgaggtccagttcaactggtatgtggatggcgtggaggttcataatgccaagacaaagcctcgggaggagcagttcaacagcacctaccgggtggtcagcg
tcctcaccgtcctgcaccaagactggctgaacggcaaggagtacaagtgcaaggtc tccaacaaagggctcccatcctccatcgagaaaaccatctccaaagccaaagggcagccc cgggagccacaggtgtacaccctgcccccatcccaagaggagatgaccaagaaccaagtg tccctgacctgcctggtcaaaggcttctaccccagcgacatcgccgtggagtgggagagc aatgggcagcctgagaacaactacaagaccactcctcccgtgctggactccgacggctcc ttcttcctctactcccggctcaccgtggacaagagcaggtggcaggagggcaatgtcttc tcctgctccgtgatgcatgaggctctgcacaaccactacacacagaagagcctctccctg tctctgggcaaatga生物保藏信息:保藏编号:pta-122180 保藏单位:atcc-美国菌种保藏中心保藏地址:美国弗吉尼亚州马纳萨斯 保藏日期:2015-5-27分类命名:质粒和载体 313r19 vh保藏编号:pta-122181 保藏单位:atcc-美国菌种保藏中心保藏地址:美国弗吉尼亚州马纳萨斯 保藏日期:2015-5-27分类命名:质粒和载体 313r19 vl保藏编号:pta-122346 保藏单位:atcc-美国菌种保藏中心保藏地址:美国弗吉尼亚州马纳萨斯 保藏日期:2015-8-11分类命名:含有合成人cdna的质粒 313m32 vh保藏编号:pta-122347 保藏单位:atcc-美国菌种保藏中心保藏地址:美国弗吉尼亚州马纳萨斯 保藏日期:2015-8-11分类命名:含有合成人cdna的质粒 313m32 lc
再多了解一些
本文用于创业者技术爱好者查询,仅供学习研究,如用于商业用途,请联系技术所有人。
