1.本发明关于使用双硫仑预防电离辐射所引起的胃肠组织损伤的方法。更明确来说,本发明关于单独地或结合其它治疗方法,应用双硫仑来预防放射病胃肠组织损伤以及肿瘤放射治疗所引起的放射性肠炎。
背景技术:
2.急性放射损伤是指机体在短时间内受到大剂量(》1gy)电离辐射照射引起的全身性疾病,称为急性放射病(acute radiation sickness,ars),或统称为急性放射综合症(acute radiation syndrome,ars)。核恐怖袭击、大型核事故等均可产生大批急性放射病病人。根据受损器官的不同,急性放射病分为骨髓型、肠型和脑型三型;根据受照时间长短不同放射病可分为急性、亚急性和慢性。肠型急性放射病(gastrointestinal form of acute radiation sickness,gi-ars)是以呕吐、腹泻、血水便等胃肠道症状为主要特征的非常严重的急性放射病。机体全身或腹部受到大剂量照射后,小肠粘膜发生了广泛坏死脱落,病人出现反复呕吐,呕吐物多含胆汁或血性液体。严重腹泻是极期的突出表现,每天可达20~30次。腹泻以血水便为其特征,血水便中含肠粘膜脱落物。由于肠蠕动功能紊乱,肠套叠,肠梗阻、肠麻痹等发生率较高。肠型放射病死亡高峰在照后10天前后,保守治疗可延长生存期,但因缺乏特效的肠型放射病防治药物,迄今尚无治活的先例。
3.近些年报道对肠型急性放射病小鼠有效的防护剂种类较多,如周期蛋白依赖性激酶(cdk)4/6抑制剂pd 0332991、神经酰胺(ceramide)中和抗体、成纤维细胞生长因子(fgf)、脯氨酸羟化酶抑制剂dmog、toll样受体(tlr5)激动剂cblb502等。考虑到药物的副作用、疗效等因素,目前国内外还没有批准上市的肠型急性放射病防治药物。
4.放射性肠炎(radiation enteritis)是腹腔或盆腔肿瘤患者放射治疗后的一种常见综合征,严重影响患者的生活质量,尚缺乏有效的治疗手段。放射性肠炎多继发于腹内或妇科肿瘤行放射治疗引起,临床上以子宫颈癌患者最为多见。在放射治疗过程中及治疗后,其发病率可达50%~100%,但症状的轻重及病理的损伤程度有很大的差异。小肠放射性损伤常见的部位是末端回肠,可能与回肠多位于盆腔、放射治疗以盆腔照射为多有关。放射性小肠炎时,常常有慢性腹痛,表现为以脐为中心的痉挛性疼痛;肠道吸收功能出现紊乱,可出现腹泻和便秘等症状,但以腹泻为主。严重者可出现肠道出血、穿孔以及梗阻等并发症。放射性直肠炎则主要表现为里急后重、便血和黏液便。
5.参考《中国放射性直肠炎诊治专家共识》(2018版),推荐治疗放射性肠炎的药物有:抗炎类药物包括非甾体类消炎药(柳氮磺胺砒啶、巴柳氮、美沙拉嗪、奥沙拉嗪等)及类固醇类药物(泼尼松龙、倍他米松及氢化可的松)、抗生素类药物(环丙沙星、甲硝唑等)、益生菌、抗氧化剂(维生素a、维生素c、维生素e以及己酮可可碱)、止泻药如咯哌叮胺(易蒙停)、生长抑素如奥曲肽等,这些药物可一定程度上缓解放射性(直)肠炎的胃肠症状,但对射线引起的结直肠损伤没有直接保护作用。以氨磷汀为代表的放射防护剂,可以清除放疗引起的氧自由基,从而保护正常组织,并且不会影响放疗效果,能够对放射性(直)肠炎起到
一定的预防作用,但由于副作用大,《中国放射性直肠炎诊治专家共识》(2018版)没有推荐氨磷汀用于放射性(直)肠炎的防治。
6.考虑到上述方法的这些缺陷,仍然需要开发新的能够预防肠型急性放射病和放射性肠炎的药物,特别是能够是在将接受放射治疗的腹腔、盆腔肿瘤对象中有效预防放射性肠炎发生的药物。
技术实现要素:
7.一方面,本发明提供了双硫仑及其代谢产物在制备用于预防核辐射暴露人员胃肠组织损伤的药物组合物中的用途。
8.另一方面,本发明提供了双硫仑及其代谢产物或包含双硫仑及其代谢产物的药物组合物,其用于预防核辐射暴露人员胃肠组织损伤相关的急性肠型放射病、亚急性肠型放射病和慢性肠型放射病。
9.再一方面,本发明提供了使用双硫仑及其代谢产物或包含双硫仑及其代谢产物的药物组合物预防放射病胃肠组织损伤的方法,包括以下步骤:对将可能受到核袭击后辐射暴露人员或进入核污染区执行任务的救援人员施用双硫仑及其代谢产物或包含双硫仑及其代谢产物的药物组合物。
10.另一方面,本发明提供了双硫仑及其代谢产物在制备用于预防将接受放射治疗的患肿瘤对象的放射性肠炎的药物组合物中的用途。
11.另一方面,本发明提供了双硫仑及其代谢产物或包含双硫仑及其代谢产物的药物组合物,其用于预防将接受放射治疗的患肿瘤对象的放射性肠炎。
12.再一方面,本发明提供了使用双硫仑及其代谢产物或包含双硫仑及其代谢产物的药物组合物预防放射性肠炎的方法,包括以下步骤:对将接受放射治疗的患肿瘤对象施用硫仑及其代谢产物或包含双硫仑及其代谢产物的药物组合物。
13.在一个实施方式中,所述双硫仑及其代谢产物选自以下的一种或多种:二硫化四乙基秋兰姆、
14.二乙基二硫代氨基甲酸、s-甲基-n,n-二乙基二硫代氨基甲酸、s-甲基-n,n-二乙基二硫代氨基甲酸酯亚砜、s-甲基-n,n-二乙基二硫代氨基甲酸硫肟、甲基-n,n-二乙基二硫代氨基甲酸砜、n-乙酰基-硫-(n,n-二乙基氨基甲酰基)半胱氨酸、n-乙酰基-硫-(n,n-二乙基硫代氨基甲酰基)半胱氨酸、n,n-二乙基二硫代氨基甲酸谷胱甘肽缀合物、n,n-二乙基硫代氨基甲酸酯谷胱甘肽缀合物、甲基-n,n-二乙基硫代氨基甲酸酯、s-甲基-n,n-二乙基硫代氨基甲酰硫肟、和s-甲基-n,n-二乙基硫代氨基甲酰砜。
15.在一个实施方式中,所述双硫仑及其代谢产物为双硫仑
16.在一个实施方式中,所述双硫仑代谢产物为二乙基二硫代氨基甲酸。
17.在一个实施方式中,所述双硫仑代谢产物选自以下的一种或多种二乙基二硫代氨基甲酸药学可接受的盐:二乙基二硫代氨基甲酸钠、二乙基二硫代氨基甲酸钠三水合物、二乙基二硫代氨基甲酸铵、二乙基二硫代氨基甲酸二乙铵盐、二乙基二硫羰氨酸铜盐、二乙基二硫代氨基甲酸锌、二乙基二硫代氨基甲酸镉、二乙基二硫代氨基甲酸铅盐、二乙基二硫代氨基甲酸镍、二乙基二硫代氨基甲酸镧、二乙基二硫代氨基甲酸铁盐、二乙基二硫代氨基甲酸亚铁盐、二乙基二硫代氨基甲酸铬、二乙基二硫代氨基甲酸锰、和n,n-二乙基二硫代氨基
甲酸银。
18.在一个实施方式中,所述患肿瘤对象可以为将接受放射和化疗联合治疗的对象。
19.在一个实施方式中,所述患肿瘤对象为患腹部肿瘤对象,优选患腹部肿瘤的人类。
20.在一个实施方式中,所述腹部肿瘤包括选自以下的一种或多种:腹壁肿瘤、胃癌、大肠癌、小肠肿瘤、肝癌、胆肿瘤、胰腺肿瘤、脾肿瘤、腹膜及腹膜后肿瘤、胃肠胰神经内分泌系统肿瘤。
21.在一个实施方式中,所述患肿瘤对象为患盆腔肿瘤对象,优选患盆腔肿瘤的人类。
22.在一个实施方式中,所述盆腔肿瘤包括选自以下的一种或多种:间叶组织源性肿瘤、、腹壁肿瘤、神经源性肿瘤、生殖细胞源性肿瘤。
23.在一个实施方式中,所述患肿瘤对象为将在8小时内,优选4小时内,更优选2小时内,最优选1小时内接受放射治疗的腹部或盆腔肿瘤对象。
24.在一个实施方式中,所述患肿瘤对象为将在8小时内,优选4小时内,更优选2小时内,最优选1小时内接受化疗的腹部或盆腔肿瘤对象。
25.在一个实施方式中,所述药物组合物为适合于选自以下一种的给药方式的剂型:静脉注射给药、口腔黏膜给药、经皮给药和口服给药。
26.在一个实施方式中,所述药物组合物为选自以下的一种剂型:输液剂、注射液、漱口剂,膜剂、气雾剂、片剂、粘附剂、贴剂、舌下剂、崩解剂、棒剂、粉剂、软膏、凝胶、水溶液、混悬液和胶囊剂。
27.在一个实施方式中,所述药物组合物的施用剂量为0.1-30.0mg双硫仑及其代谢产物,优选0.2-20.0mg双硫仑及其代谢产物,更优选1.0-10.0mg双硫仑及其代谢产物,最优选3.0mg双硫仑及其代谢产物,以每kg体重计。
28.在一个实施方式中,所述药物组合物可选地包括选自以下的一种或多种化合物:wr2721、prc-210(aminothiol)、wr-1065、wr-3689、wr-151327、wr-638,wr-77913、wr-44923、半胱胺、aet、硫辛酸、n,n-二乙基硫辛酰胺、mn-sod转基因制剂、cu.zn-sod制剂、fe-sod制剂、gc4419(m40403)、mnbuoe、aeol10150、mntnhex-2-pyp5 (hexyl)、mnte-2-pyp、euk-207、euk-189、euk-134、褪黑素、维生素e及其衍生物、己酮可可碱、谷氨酰胺、tempol(4-hydroxy-2,2,6,6-tetramethylpiperidine-n-oxyl)、依达拉奉(edaravone)、维生素c及其衍生物、维生素a及其衍生物、d-蛋氨酸、乙酰半胱氨酸(acetylcysteine)、谷胱甘肽、3,3'-二吲哚甲烷(3,3
’‑
diindolylmethane)、奥替普拉(oltipraz)、四氢生物蝶呤(tetrahydrobiopterin)、二甲双胍(metformin)、β-葫萝卜素、fty720、rpc1063、baf312、act-128800、krp203、mt-1303、cblb502、cblb612、cblb613、r-spondin1、tat-smad7、帕利夫明(palifermin)、粒单系集落刺激因子(gm-csf),角质细胞生长因子(kgf)、成纤维细胞生长因子(fgf)、表皮生长因子(egf)、转化生长因子(tgf-β)、粒系集落刺激因子(g-csf)、白介素-12、白介素-11、白介素-22、cdk4/6抑制剂如pd0332991等、神经酰胺(ceramide)中和抗体、脯氨酸羟化酶抑制剂dmog、tlr5激动剂cblb502、tlr2激动剂、r-spondin1、wnt信号通路激动剂如bcn057等、溶血磷脂酸受体lpa2激动剂如otp等、糖皮质激素如口服二丙酸倍氯米松(bdp)等。
29.在一个实施方式中,所述放射治疗包括使用选自以下放射线的治疗:α射线、β射线、γ射线、x射线、中子、电子线、质子束、粒子束和其组合。
30.在一个实施方式中,所述放射治疗包括外照射放射治疗和内照射放射治疗。
31.在一个实施方式中,所述放射治疗方法包括常规分割放射治疗和一次大剂量放射治疗。
32.在一个实施方式中,所述放射治疗的一次照射剂量为1-50gy,更优选1-8gy,最优选2gy。
33.在一个实施方式中,所述放射治疗包括使用放射增敏剂。
34.在一个实施方式中,所述放射增敏剂为乏氧细胞放射增敏剂和非乏氧细胞放射增敏剂,
35.其中所述乏氧细胞放射增敏剂选自以下一种或多种:硝基咪唑类(nitroimidazoles),如甲硝唑、咪嗦哒唑、miso(ro-07-0582)、rsu-1096、替拉扎明(tirapazamine)等;和生物还原剂,如甘氨双唑钠、氮氧化合物、醌类化合物以及烟酰胺及其衍生物;
36.其中所述非乏氧细胞放射增敏剂选自以下一种或多种:铂类药物,如顺铂、卡铂、奥沙利铂等;抗代谢药物,如5-fu、卡培他滨、吉西他滨等;拓扑异构酶抑制剂,如喜树碱(camptothecin)、伊立替康(irinotecan)、托泊替康(topotecan),cpt417,bms-286309、依托泊苷(vp-16)等;微管稳定药物,如紫杉醇,多西紫杉醇,帕土匹龙(patupilone)、pbox-15等;第二个线粒体来源的胱氨酸酶激活剂(smac)类似物,如tat-smacn7、sm-164、lcl161等;肿瘤靶向治疗药物,如索拉非尼(sorafenib),埃罗替尼(erlotinib),西妥昔单抗(cetuximab),贝伐珠单抗(bevacizumab),曲妥单抗(trastuzumab)等;光敏剂,如5-氨基酮戊酸、血卟啉单甲醚、血卟啉衍生物(hpd)、二血卟啉醚(dhe)、photofrinⅱ等;dna烷化剂,如替莫唑胺等;和中药提取物,如马蔺子素等。
37.本发明证实双硫仑对电离辐射引起的胃肠组织损伤及相关并发症有很好的预防作用。
附图说明
38.图1.双硫仑(dsf)延长12gy全身照射小鼠照射后小鼠存活时间,促进胃肠组织修复。
39.图1a,dsf对12gy x射线全身照射后小鼠存活时间的影响(n=8);图1b,12gy照射小鼠照后6天小鼠肠组织he染色。
40.图2.双硫仑照前给药促进不同剂量照射小鼠照后3.5天小肠隐窝细胞的再生小鼠10、12和14gy x射线全身照射照后3.5天brdu免疫组化染色及计数(n=4)
41.图3.双硫仑抑制12gy全身照射小鼠照后小肠隐窝细胞p21表达的升高
42.图3a,edta低温孵育法制备的富含隐窝的肠道上皮;图3b,蛋白质印迹法(wb)检测照后不同时间富含隐窝的肠道上皮细胞p21蛋白表达。
43.图4.双硫仑阻止12gy全身照射小鼠照后小肠隐窝细胞凋亡
44.图4a-4b,cleaved caspase3免疫组化检测照后4h和24小肠隐窝细胞凋亡(n=3);图4c-4d,wb检测照后不同时间富含隐窝的肠道上皮细胞puma和(cleaved caspase 3)蛋白表达。
45.图5.双硫仑减轻12gy全身照射小鼠照后小肠隐窝细胞dna损伤
46.图5a,照射后24h小鼠小肠隐窝细胞γh2ax免疫组化染色;图5b,小肠隐窝细胞γh2ax阳性细胞比例(n=3)。
具体实施方式
47.本发明人在筛选防护急性放射病胃肠组织损伤的新型放射防护剂的时候,意外发现,在放射引起的小鼠胃肠组织损伤模型中,仅给予双硫仑的照射对照组中的小鼠在受放射损伤的程度上远远低于单纯照射对照组。这个意外的发现使得本发明人对双硫仑在预防放射损伤中的作用进行了深入的研究,并由此发现双硫仑腹腔给药可以有效预防不同剂量照射引起的胃肠组织损伤。
48.第一方面,本发明提供了双硫仑及其代谢产物在制备用于预防核辐射暴露人员胃肠组织损伤的药物组合物中的用途。
49.另一方面,本发明提供了双硫仑及其代谢产物或包含双硫仑及其代谢产物的药物组合物,其用于预防核辐射暴露人员胃肠组织损伤相关的急性肠型放射病、亚急性肠型放射病和慢性肠型放射病。
50.再一方面,本发明提供了使用双硫仑及其代谢产物或包含双硫仑及其代谢产物的药物组合物预防放射病胃肠损伤的方法,包括以下步骤:对将可能受到核辐射暴露的人员或进入核污染区执行任务的救援人员施用双硫仑及其代谢产物或包含双硫仑及其代谢产物的药物组合物。
51.第二方面,本发明提供了双硫仑及其代谢产物在制备用于预防将接受放射治疗的患肿瘤对象的放射性肠炎的药物组合物中的用途。
52.另一方面,本发明提供了双硫仑及其代谢产物或包含双硫仑及其代谢产物的药物组合物,其用于预防将接受放射治疗的患肿瘤对象的放射性肠炎。
53.再一方面,本发明提供了使用双硫仑及其代谢产物或包含双硫仑及其代谢产物的药物组合物预防放射性肠炎的方法,包括以下步骤:对将接受放射治疗的患肿瘤对象施用硫仑及其代谢产物或包含双硫仑及其代谢产物的药物组合物。
54.双硫仑(disulfiram,dsf),又名戒酒硫,它能非可逆性抑制乙醛脱氢酶的活性,阻断乙醇代谢产物乙醛的氧化代谢,乙醛在体内聚集引发机体的多种不适,从而促进患者建立对酒精的厌恶反射,达到戒酒目的。dsf主要在肝内代谢,分子内二硫键断裂生成含巯基的二硫代氧基甲酸酯(diethyldithiocarbamate,ddtc)及其系列代谢产物(studies on the metabolic activation of disulfiram in rat.evidence for electrophilic s-oxygenated metabolites as inhibitors of aldehyde dehydrogenase and precursors of urinary n-acetylcysteine conjugates,j pharmacol exp ther.1997may;281(2):611-7.)。
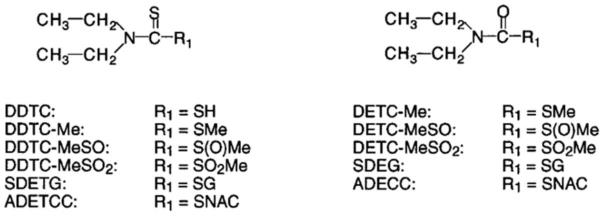
55.术语“双硫仑”(双硫仑)是指以下结构的化合物
[0056][0057]
术语“双硫仑体内代谢产物”是指以下结构的化合物:
[0058][0059]
注:sg表示与谷胱甘肽硫原子缀合;snac表示n-乙酰半胱氨酸硫原子缀合。
[0060]
表一:双硫仑及其体内代谢产物
[0061]
[0062][0063]
表二:双硫仑体内代谢产物药学可接受的盐
[0064]
[0065]
[0066][0067]
术语“对象”是指包括人和非人的哺乳动物,包括但不限于人、猪、狗、兔子、猴子、猫等。本发明的对象选自患有肿瘤的对象。在一个实施方式中,所述对象为人。在本文中,除非特殊说明,术语“对象”、“人员”、“患者”和“受试者”可以互换。
[0068]
术语“急性放射病”是指机体在短时间内受到大剂量(》1gy)电离辐射照射引起的全身性疾病,称为急性放射病(acute radiation sickness,ars),或统称为急性放射综合症(acute radiation syndrome,ars)。根据受损器官的不同,急性放射病分为骨髓型、肠型和脑型三型;根据受照时间长短不同放射病可分为急性、亚急性和慢性。
[0069]
术语“肠型急性放射病”(gastrointestinal form of acute radiation sickness,gi-ars)是指以呕吐、腹泻、血水便等胃肠道症状为主要特征的非常严重的急性放射病。机体全身或腹部受到大剂量照射后,小肠粘膜发生了广泛坏死脱落,病人出现反复呕吐,呕吐物多含胆汁或血性液体。严重腹泻是极期的突出表现,每天可达20~30次。腹泻以血水便为其特征,血水便中含肠粘膜脱落物。由于肠蠕动功能紊乱,肠套叠,肠梗阻、肠麻痹等发生率较高。
[0070]
术语“急性放射病胃肠组织损伤”是指伴有呕吐、腹泻、血水便等胃肠道症状的急性放射病。
[0071]
术语“肿瘤”是指机体在各种致瘤因子作用下,局部组织细胞增生所形成的赘生物。所述肿瘤的定义及分类可参见如由世界卫生组织(who)制定的肿瘤组织学分类第二版(1989-2000年)。在一个实施方式中,所述患肿瘤对象为患腹部肿瘤和盆腔肿瘤对象。
[0072]
术语“腹部肿瘤”包括腹壁肿瘤、胃癌、大肠癌、小肠肿瘤、肝癌、胆肿瘤、胰腺肿瘤、脾肿瘤、腹膜及腹膜后肿瘤、胃肠胰神经内分泌系统肿瘤。
[0073]
术语“盆腔肿瘤”包括间叶组织源性肿瘤、、腹壁肿瘤、神经源性肿瘤、生殖细胞源性肿瘤。
[0074]
术语“放射性肠炎”是指盆腔、腹腔、腹膜后恶性肿瘤经放射治疗引起的肠道并发症。可分别累及小肠、结肠和直肠,故又称为放射性直肠、结肠、小肠炎。根据肠道遭受辐射剂量的大小、时间的长短、发病的缓急,一般将放射病分为急性和慢性两种。又根据射线来源放置的体内外位置的不同将其分为外照射放射病和内照射放射病。在早期肠黏膜细胞更新受到抑制,以后小动脉壁肿胀、闭塞,引起肠壁缺血,黏膜糜烂。晚期肠壁引起纤维化,肠腔狭窄或穿孔,腹腔内形成脓肿、瘘道和肠粘连等。
[0075]
术语“预防”包括降低患有、感染或经历疾病、障碍、病症或病征、其发展和/或进展、和/或其症状的风险。预防的效果可包括潜在疾病的部分的或完全的预防。在本发明中,术语预防无意指疾病被完全避免。在本发明中,术语“预防”不包括对于疾病的治疗。在本发明中,双硫仑及其代谢产物(优选双硫仑)以及包含其的药物需要在疾病发作之前被施用,具体为在对象接受放射治疗前被施用。
[0076]
在一个实施方式中,对象接受放射治疗前接受双硫仑及其代谢产物(优选双硫仑)可选地包括对象同时接受放射治疗和双硫仑及其代谢产物(优选双硫仑)。本发明证实通过
在放射治疗前对患肿瘤对象施用双硫仑及其代谢产物(优选双硫仑),可以有效预防所述患肿瘤对象在接受放射治疗后发生放射性肠炎。
[0077]
在一个实施方式中,所述患肿瘤对象为将在8小时至1小时内接受放射治疗的腹部或盆腔肿瘤对象。在一个实施方式中,所述患肿瘤对象为将在6小时内接受放射治疗的腹部或盆腔肿瘤对象。在一个实施方式中,所述患肿瘤对象为将在5小时内接受放射治疗的腹部或盆腔肿瘤对象。在一个实施方式中,所述患肿瘤对象为将在4小时内接受放射治疗的腹部或盆腔肿瘤对象。在一个实施方式中,所述患肿瘤对象为将在3小时内接受放射治疗的腹部或盆腔肿瘤对象。
[0078]
在一个实施方式中,所述患肿瘤对象为将在2小时内接受放射治疗的腹部或盆腔肿瘤对象。在一个实施方式中,所述患肿瘤对象为将在1小时内接受放射治疗的腹部或盆腔肿瘤对象。在一个实施方式中,所述患肿瘤对象为将在30分钟内接受放射治疗的腹部或盆腔肿瘤对象。
[0079]
术语“剂量”以向对象施用的双硫仑及其代谢产物(优选双硫仑)或药物/药物组合物中所含的双硫仑及其代谢产物(优选双硫仑)的含量计。剂量可根据本领域已知的因素例如待预防的人的疾病状态、年龄、性别和体重而变化。
[0080]
在一个实施方式中,依据对象的体重确定双硫仑及其代谢产物(优选双硫仑)的剂量。在一个实施方式中,双硫仑及其代谢产物(优选双硫仑)的施用剂量为0.1-30.0mg/kg体重。在一个实施方式中,双硫仑的施用剂量为0.2-20.0mg/kg体重。在一个实施方式中,双硫仑及其代谢产物(优选双硫仑)的施用剂量为1.0-10.0mg/kg体重。在一个实施方式中,双硫仑及其代谢产物(优选双硫仑)的施用剂量为3.0-5.0mg/kg体重。
[0081]
术语“放射治疗”包括利用放射线照射肿瘤组织,通过射线激发可直接作用于细胞dna等靶点或与细胞内水分子等相互作用,产生自由基间接作用于细胞dna等靶点,导致肿瘤细胞死亡的肿瘤治疗方法。放射治疗施用的放射线包括放射性同位素产生的α、β、γ射线和各类x射线治疗机或加速器产生的x射线、电子线、质子束及其他粒子束等。放射治疗的作用机制与化学药物治疗不同。在本文中,除非特殊说明,术语“放射治疗”、“放射疗法”和“放疗”可以互换。在一个实施方式中,放射治疗包括使用选自以下放射线的治疗:α射线、β射线、γ射线、x射线、中子、电子线、质子束、粒子束和其组合。
[0082]
放射治疗技术分为外照射和内照射。外照射放射治疗指射线从体外经由身体各种组织进入体内,在肿瘤靶区产生放射效应,杀灭肿瘤。常规外照射放疗是以临床实践经验为基础建立的分割放射治疗(每周5次,每次2gy),被认为是肿瘤放射治疗的标准方法。内照射放射治疗也称为近距离放疗,包括放射性粒子植入放疗和放射性核素靶向肿瘤治疗。
[0083]
根据照射剂量的不同,放射治疗对象可以分为放射高度敏感肿瘤、放射中度敏感肿瘤和放射低度敏感肿瘤。在一个实施方式中,所述放射治疗的一次照射剂量为1-50gy。在一个实施方式中,所述放射治疗的照射剂量为1-8gy。在一个实施方式中,所述放射治疗的照射剂量为2gy。
[0084]
术语“化疗治疗”又称为“化疗”或“化学药物治疗”,其是指使用化学治疗药物杀灭癌细胞达到治疗目的的手段。术语“放射和化疗联合治疗”是指共同采用放射治疗和化学治疗的方法治疗肿瘤。放化疗联合治疗是临床肿瘤治疗中应用最广的治疗手段之一。放化疗联合治疗就是利用放疗治疗直接打击肿瘤的病灶部位,而化疗治疗对患者体内的癌细胞进
行消灭,从而达到治疗的效果。在本发明中,将接受治疗的对象预期将会同时接受放射治疗和化学治疗,或者先接受放射治疗随后再接受化学治疗,或者先接受化学治疗随后再接受放射治疗;前提是上述治疗均在接受本发明的双硫仑及其代谢产物(优选双硫仑)之前进行。
[0085]
在本发明中,可以用于放射和化疗联合治疗的化学治疗药物包括但不限于:直接作用于dna的烷化剂或铂化合物,如美法仑(melphalan)、环磷酰胺(cyclophosphamide)、氧氮磷杂环己烯(oxazaphosphorine)、顺铂(cisplatin)、卡铂(carboplatin)、奥沙利铂(oxaliplatin)、沙铂(satraplatin)、四铂(tetraplatin)、异丙铂(iproplatin)、丝裂霉素(mitomycin)、链佐星(streptozocin)、卡莫司汀(carmustine)(bcnu)、洛莫司汀(lomustine)(ccnu)、白消安(busulfan)、异环磷酰胺(ifosfamide)、链佐星(streptozocin)、噻替派(thiotepa)、苯丁酸氮芥(chlorambucil);氮芥,如二氯甲基二乙胺(mechlorethamine);乙烯亚胺化合物;烷基磺酸盐(alkylsulfonate);干扰dna和rna合成的抗代谢药,如阿糖胞苷(cytarabine)、5-氟脲嘧啶(5-fu)、培美曲塞(pemetrexed)、替加氟(tegafur)、尿嘧啶(uracil)、尿嘧啶氮芥(uracilmustard)、氟达拉滨(fludarabine)、吉西他滨(gemcitabine)、卡培他滨(capecitabine)、巯嘌呤(mercaptopurine)、克拉屈滨(cladribine)、硫鸟嘌呤(thioguanine)、甲氨喋呤(methotrexate)、喷司他丁(pentostatin)、羟基脲(hydroxyurea)、或叶酸;通过抑制酶的作用和有丝分裂或改变细胞膜来干扰dna的抗肿瘤抗生素,福来霉素(phleomycin)、博来霉素(bleomycin)或其衍生物或其盐、chpp、bzpp、mtpp、bapp、利苯霉素(liblomycin)、利福霉素(rifamycin)、放线菌素(actinomycin)、甲烯土霉素(adramycin)、阿霉素、表阿霉素、吡喃阿霉素、柔红霉素、丝裂霉素;来源于动植物成分的植物类抗癌药:如紫杉醇(paclitaxel)[泰素(taxol)]、多西紫杉醇(docetaxel)或泰索帝(taxotere);长春花生物碱,如诺维本(navelbine)、长春碱(vinblastin)、长春新碱(vincristin)、长春地辛(vindesine)或长春瑞滨(vinorelbine);托酚酮生物碱,如秋水仙碱(colchicine)或其衍生物;大环内酯(macrolide),如症登素(maytansine);柄型菌素(ansamitocin)或根霉素(rhizoxin);抗有丝分裂肽,如拟茎点霉毒素(phomopsin)或朵拉司他汀(dolastatin);表鬼臼毒素或鬼臼毒素衍生物,如依托泊苷(etoposide)或替尼泊苷(teniposide);斯的甘辛(steganacin);抗有丝分裂氨基甲酸酯衍生物,如考布他汀(combretastatin)或安非替尼(amphetinile);丙卡巴肼(procarbazine);喜树碱(camptothecin),如依立替康(irinotecan)(盐酸伊立替康和山梨醇注射剂camptosar)或托泊替康(topotecan);激素类抗肿瘤药,如孕酮或雌激素,如雌氮芥(t-66)或甲地孕酮(megestrol);抗雄激素,如氟他胺(flutamide)、康士德(casodex)、尼鲁米特(anandron)或醋酸环丙孕酮(cyproterone acetate);芳香酶抑制剂,如氨鲁米特(aminogluthetimide)、阿那曲唑(anastrozole)、福美坦(formestan)或来曲唑(letrozole);ghrh类似物,如亮丙瑞林(leuprorelin)、布舍瑞林(buserelin)、戈舍瑞林(goserelin)或曲普瑞林(triptorelin);抗雌激素,如他莫昔芬(tamoxifen)或其枸橼酸盐、屈洛昔芬(droloxifene)、曲沃昔芬(trioxifene)、雷洛昔芬(raloxifene)或秦哚昔芬(zindoxifene);17β-雌二醇衍生物,如ici 164,384或ici 182,780、氨鲁米特(aminoglutethimide)、福美坦(formestan)、法倔唑(fadrozole)、非那雄胺(finasteride)、酮康唑(ketoconazole);lh-rh拮抗剂,如醋酸亮丙瑞林(leuprolide);甾
族化合物,如泼尼松(prednisone)、泼尼松龙(prednisolone)、甲泼尼龙(methylprednisolone)、地塞米松(dexamethasone)、布地奈德(budenoside)、氟考龙(fluocortolone)或氟羟氢化泼尼松(triamcinolone);其它杂类抗肿瘤药,如蛋白酶体抑制剂,如波替单抗(bortezomib);酶,如天门冬酰胺酶,聚乙二醇化天门冬酰胺酶(培门冬酶(pegaspargase))或胸苷磷酸化酶抑制剂;干扰素,如干扰素β;白介素,如il-10或il-12;抗-tnfα抗体,如依那西普(etanercept);以及靶向抗肿瘤药物,如vegf受体小分子拮抗剂,如瓦他拉尼(vatalanib)、su-5416、su-6668、su-11248、su-14813、azd-6474,egfr/her2拮抗剂,如ci-1033或gw-2016;egfr拮抗剂,如易瑞沙(iressa)[吉非替尼(gefitineb)zd-1839]、特罗凯(tarceva)、pki-166、ekb-569、hki-272或赫赛汀(herceptin);和靶向癌细胞表面分子的抗体,如阿泊利单抗(apolizumab)或1d09c3等。
[0086]
在本发明中,双硫仑及其代谢产物(优选双硫仑)可进一步与其它已知对放射性放射性肠炎有预防和/或治疗有效或可能有效的化合物组合施用。此化合物包括选自以下的一种或多种化合物:wr2721、prc-210(aminothiol)、wr-1065、wr-3689、wr-151327、wr-638,wr-77913、wr-44923、半胱胺、aet、硫辛酸、n,n-二乙基硫辛酰胺、mn-sod转基因制剂、cu.zn-sod制剂、fe-sod制剂、gc4419(m40403)、mnbuoe、aeol10150、mntnhex-2-pyp5 (hexyl)、mnte-2-pyp、euk-207、euk-189、euk-134、褪黑素、维生素e及其衍生物、己酮可可碱、谷氨酰胺、tempol(4-hydroxy-2,2,6,6-tetramethylpiperidine-n-oxyl)、依达拉奉(edaravone)、维生素c及其衍生物、维生素a及其衍生物、d-蛋氨酸、乙酰半胱氨酸(acetylcysteine)、谷胱甘肽、3,3'-二吲哚甲烷(3,3
’‑
diindolylmethane)、奥替普拉(oltipraz)、四氢生物蝶呤(tetrahydrobiopterin)、二甲双胍(metformin)、β-葫萝卜素、fty720、rpc1063、baf312、act-128800、krp203、mt-1303、cblb502、cblb612、cblb613、r-spondin1、tat-smad7、帕利夫明(palifermin)、粒单系集落刺激因子(gm-csf),角质细胞生长因子(kgf)、成纤维细胞生长因子(fgf)、表皮生长因子(egf)、转化生长因子(tgf-β)、粒系集落刺激因子(g-csf)、白介素-12、白介素-11、白介素-22、cdk4/6抑制剂如pd0332991等、神经酰胺(ceramide)中和抗体、脯氨酸羟化酶抑制剂dmog、tlr5激动剂cblb502、tlr2激动剂、r-spondin1、wnt信号通路激动剂如bcn057等、溶血磷脂酸受体lpa2激动剂如otp等、糖皮质激素如口服二丙酸倍氯米松(bdp)等。
[0087]
在本发明中,双硫仑及其代谢产物(优选双硫仑)可以被制备成为适用于不同施用方式的药物剂型。在一个实施方式中,所述药物为选自适用于以下的一种或多种给药方式的剂型:静脉注射给药、口腔黏膜给药、经皮给药和口服给药。
[0088]
术语“静脉注射剂型”又称为输液剂,是指由静脉滴注输入人体内大剂量注射液。
[0089]
术语“口腔粘膜给药剂型”是指药物经口腔黏膜吸收后直接进入循环系统的给药剂型。药物经口腔粘膜给药可发挥局部和全身的治疗作用。
[0090]
术语“经皮给药”(transdermal drug delivery,tdd)是以皮肤为给药途径,连续地将药物传递到皮肤表面或循环系统中,从而发挥皮肤局部或全身治疗的作用的给药方式。
[0091]
术语“口服给药剂型”包括水溶液、水性混悬液、片剂和胶囊剂。在一个实施方式中,包含双硫仑及其代谢产物(优选双硫仑)的口服给药剂型可进一步包含矫味剂、抑菌剂等附加剂。术语“矫味剂”是指药品中用以改善或屏蔽药物不良气味和味道,使病人难以觉
察药物的强烈苦味(或其它异味如辛辣、刺激等等)的药用辅料,一般包括甜味剂、芳香剂、胶浆剂和泡腾剂四类。
[0092]
在一个实施方式中,所述药物的施用剂量为0.1-30.0mg双硫仑/kg体重,优选0.2-20.0mg双硫仑及其代谢产物(优选双硫仑)/kg体重,更优选1.0-10.0mg双硫仑及其代谢产物(优选双硫仑)/kg体重,最优选3.0-5.0mg双硫仑及其代谢产物(优选双硫仑)/kg体重。
[0093]
在本发明中,包含双硫仑及其代谢产物(优选双硫仑)的药物可以进一步包含药学上可接受的辅料。在一个实施方式中,所述药学上可接受的辅料选自以下的一种或多种:d-泛醇(dexpanthenol)、海藻酸钠、聚维酮碘(povidone iodine),透明质酸钠,果胶、粘稠木聚糖和硫糖铝(sucralfate)。在本文中,除非特殊说明,术语“药物”和“药物组合物”可以互换。
[0094]
在一个实施方式中,包含双硫仑及其代谢产物(优选双硫仑)的药物可进一步与放射增敏剂同时施用。术语“放射增敏剂”是一种化学或药物制剂,当与放射治疗同时应用时可以改变肿瘤细胞对放射的反应性,从而增加对肿瘤细胞的杀伤效应,包括乏氧细胞放射增敏剂和非乏氧细胞放射增敏剂。
[0095]
在一个实施方式中,放射增敏剂为乏氧细胞放射增敏剂或非乏氧细胞放射增敏剂。在一个实施方式中,乏氧细胞放射增敏剂选自以下:硝基咪唑类(nitroimidazoles),如甲硝唑、咪嗦哒唑、miso(ro-07-0582)、rsu-1096、替拉扎明(tirapazamine)等;和生物还原剂,如甘氨双唑钠、氮氧化合物、醌类化合物以及烟酰胺及其衍生物。在一个实施方式中,非乏氧细胞放射增敏剂选自以下:铂类药物,如顺铂、卡铂、奥沙利铂等;抗代谢药物,如5-fu、卡培他滨、吉西他滨等;拓扑异构酶抑制剂,如喜树碱(camptothecin)、伊立替康(irinotecan)、托泊替康(topotecan),cpt417,bms-286309、依托泊苷(vp-16)等;微管稳定药物,如紫杉醇,多西紫杉醇,帕土匹龙(patupilone)、pbox-15等;第二个线粒体来源的胱氨酸酶激活剂(smac)类似物,如tat-smacn7、sm-164、lcl161等;肿瘤靶向治疗药物,如索拉非尼(sorafenib),埃罗替尼(erlotinib),西妥昔单抗(cetuximab),贝伐珠单抗(bevacizumab),曲妥单抗(trastuzumab)等;光敏剂,如5-氨基酮戊酸、血卟啉单甲醚、血卟啉衍生物(hpd)、二血卟啉醚(dhe)、photofrinⅱ等;dna烷化剂,如替莫唑胺等;和中药提取物,如马蔺子素等。
[0096]
本发明证实了双硫仑可以有效预防放射引起的小鼠胃肠组织损伤,延长12gy全身照射小鼠的照后存活时间,促进不同剂量照射小鼠照后3.5天小肠隐窝细胞的再生;发现双硫仑照前给药可显著抑制12gy全身照射小鼠照后小肠隐窝细胞p21表达,阻止隐窝细胞凋亡,并减轻隐窝细胞dna损伤。
[0097]
实施例
[0098]
将参考以下实施例更详细地描述本发明。然而,提供以下实施例仅用于解释本发明,不应被理解为是对本发明的范围和精神的限制。
[0099]
材料和方法:
[0100]
1.1材料、试剂与仪器
[0101]
1.1.1实验动物
[0102]
spf级c57bl/6j雄性小鼠,6-8周龄,体重22~24g购自斯贝福(北京)生物技术有限公司,动物质量合格证号:scxk(京)2019-0010。购回后饲养于军事医学研究院实验动物中
心,饲养温度22
±
2℃,湿度55
±
5%,饲养垫料经γ射线杀菌,每周更换两次。每日光照/黑暗各12h,每笼4-5只小鼠,饲以γ射线消毒的标准饲料,自由饮水。所有小鼠购回后均在动物房饲养一周适应环境后开展实验。
[0103]
1.1.2主要试剂
[0104]
(1)二硫化四乙基秋兰姆(双硫仑)(sigma-aldrich,货号:货号:86720-50g):用90%的0.9%医用生理盐水和5%二甲基亚砜(alfa,货号:042780-1l)以及5%吐温80(innochem,货号:a43489),现用现配。
[0105]
(2)5%山羊血清封闭液:封闭用正常羊血清原液(北京中杉金桥生物技术有限公司,货号zli-9021)0.5ml,加1
×
tbst溶液9.5ml,充分混匀,-20℃保存。
[0106]
(3)20%山羊血清封闭液:封闭用正常羊血清原液(北京中杉金桥生物技术有限公司,货号zli-9021)1ml,加1
×
tbst溶液9ml,充分混匀,-20℃保存
[0107]
(4)5-溴脱氧尿嘧啶核苷(brdu):sigma-aldrich,germany,0.9%医用生理盐水配制
[0108]
(5)anti-brdu rat mab(abcam,货号ab6326)
[0109]
(6)苏木素(sigma-aldrich,germany;货号:zli-9610)
[0110]
(7)伊红(北京中衫金桥,china;货号:zli-9613)
[0111]
(8)中性树胶(北京中衫金桥,china;货号:zli-9555)
[0112]
(9)dab kit 20
×
(北京中杉金桥生物技术有限公司,货号zli-9018)
[0113]
(10)anti-brdu rat mab(abcam,usa货号:ab6326)
[0114]
(11)辣根过氧化物酶(hrp)标记的山羊抗兔(北京中杉金桥生物技术有限公司,货号pv-6001)。
[0115]
(12)辣根过氧化物酶(hrp)标记的山羊抗小鼠(北京中杉金桥生物技术有限公司,货号pv-6002)。
[0116]
(13)488标记山羊抗兔igg(h l)(亲和纯化)(北京中杉金桥生物技术有限公司,货号zf-0511)。
[0117]
(14)594标记山羊抗小鼠igg(h l)(亲和纯化)(北京中杉金桥生物技术有限公司,货号zf0513)。
[0118]
(15)d-pbs缓冲液(biosharp,货号:bl310a)
[0119]
(16)0.5m edta(ph8.0)(solarbio,货号e1170)
[0120]
(17)bca蛋白浓度测定试剂盒:(beyotime/碧云天,货号p0012)
[0121]
(18)特级胎牛血清(翱擎,货号aqmv09900-500ml)
[0122]
(19)cck8(翱擎,货号aq308-500t)
[0123]
(20)sds-page蛋白上样缓冲液(5
×
)(碧云天,货号:p0015l)
[0124]
(21)sds-page电泳液(tris-gly,10x)(碧云天,货号:p0014d)
[0125]
(22)sds-page凝胶快速配制试剂盒(碧云天,货号:p0012ac)
[0126]
(23)anti-p21 antibody epr18021(abcam,货号:ab188224)
[0127]
(24)anti-puma antibody(abcam,货号:ab9643)
[0128]
(25)cleaved caspase-3(asp175)(5a1e)rabbit mab(cell signaling technology,货号:9664s)
[0129]
1.1.3仪器与耗材
[0130]
(1)x射线机(美国rad source technologies,型号rs-2000)。
[0131]
(2)生物组织自动脱水机(浙江省金华市科迪仪器设备有限公司,型号kd-ts1a)。
[0132]
(3)生物组织冷冻包埋机(浙江省金华市科迪仪器设备有限公司,型号kd-bm、bl)。
[0133]
(4)电脑生物组织摊片机(浙江省金华市科迪仪器设备有限公司,型号kd-p)。
[0134]
(5)电脑生物组织烘片机(浙江省金华市科迪仪器设备有限公司,型号kd-p)。
[0135]
(6)轮转式切片机(德国leica公司,型号rm2235)。
[0136]
(7)正置荧光显微镜(德国leica公司,型号db4000)。
[0137]
(8)高品质盖玻片(世泰,货号10212432c)
[0138]
(9)连体包埋盒(世泰,货号1050102w)
[0139]
(10)70um白色细胞滤网(biosharp,货号bs-70-xbs)
[0140]
(11)电泳仪(北京市六一仪器厂型号:dyy-8c型)
[0141]
(12)x射线机(美国rad source technologies,型号rs-2000)。
[0142]
1.2实验方法
[0143]
1.2.1照射条件
[0144]
照射前将小鼠置于自制塑料盒单独的空格内,被放入的小鼠无法自由移动。照射条件为:全身照射,距离50cm,电压6mv,剂量率约60cgy/min,照射后的小鼠立即返还至鼠笼中自由活动及饮食。
[0145]
胸部照射:照射前1%戊巴比妥钠(0.2ml/只,腹腔注射)麻醉小鼠,将鼠仰放入自制照射盒,暴露胸部,其余部分铅板屏蔽,将鼠舌牵拉出口外,照射条件为:电压220kv,电流125ma,剂量率68cgy/min,照射后的小鼠立即返还至鼠笼中自由活动及饮食。
[0146]
1.2.2石蜡包埋的肠道样本的制备
[0147]
(1)颈部脱臼法处死小鼠,浸没于75%酒精2min;
[0148]
(2)打开腹腔,找到肠道与胃结合部位并以此为起点,向下2cm剪短小肠,再向下截取约10cm肠段;
[0149]
(3)小心剥离肠系膜,将取出的小肠截为5段,每段约2cm;
[0150]
(4)使用带软管的的5ml注射器吸取冰pbs,轻轻冲尽肠道内容物;
[0151]
(5)将肠道平直摆在小滤纸片上,置于组织包埋盒内再覆盖一层滤纸,注意不要拉扯、积压肠管,如此可以保证固定时肠道不发生弯曲;
[0152]
(6)将肠道浸泡于4%中性多聚甲醛,固定时间不少于12h;
[0153]
(7)固定后的肠道清水冲洗30min以上,肠道截为约0.4cm/段,注意截面平整且与肠道垂直;
[0154]
(8)肠道脱水,程序如下:
[0155]
70%酒精30min
→
80%酒精15min
→
90%酒精15min
→
95%酒精15min
→
95%酒精15min
→
100%酒精15min
→
100%酒精15min
→
二甲苯15min
→
二甲苯12min
→
石蜡20min
→
石蜡20min
→
石蜡120min,石蜡温度65℃;
[0156]
(9)将肠道竖直摆放,石蜡包埋。
[0157]
1.2.3石蜡包埋的肺组织的制备
[0158]
(1)处死小鼠,剪开胸骨,取出整个肺组织,4%甲醛固定12h以上;
[0159]
(2)肺组织脱水,程序如下:
[0160]
70%酒精30min
→
80%酒精30min
→
90%酒精30min
→
95%酒精30min
→
95%酒精30min
→
100%酒精30min
→
100%酒精30min
→
二甲苯15min
→
二甲苯30min
→
石蜡20min
→
石蜡20min
→
石蜡120min,石蜡温度65℃;
[0161]
(3)整叶肺包埋。
[0162]
1.2.4he染色
[0163]
(1)石蜡样本切片,切片厚度为4-5μm;
[0164]
(2)60℃烤片30min,使样本贴附在载玻片上
[0165]
(3)脱蜡:二甲苯ⅰ,7min;二甲苯ⅱ,7min;二甲苯ⅲ,7min;100%酒精ⅰ,5min;100%酒精ⅱ,5min;90%酒精,3min;80%酒精,3min;70%酒精,3min;60%酒精,3min;蒸馏水,5min;
[0166]
(4)苏木素染色4min,清水冲净多余苏木素后置于盐酸酒精中10s,立即转移至清水中返蓝6min;
[0167]
(5)将玻片浸没于伊红染液2min,清水冲洗多余染液;
[0168]
(6)封片:60%酒精30s,80%酒精30s,90%酒精10s,100%酒精ⅰ2min,100%酒精ⅱ4min,二甲苯5min,中性树脂封片;
[0169]
1.2.5brdu免疫组织化学
[0170]
(1)小鼠肠道取材前2h每只按brdu 120mg/kg单次腹腔注射;
[0171]
(2)肠道取材、包埋如上述;
[0172]
(3)石蜡样本切片,切片厚度为5μm;
[0173]
(4)将切片转移至40℃温水中,待切片完全展开后用载玻片捞起,甩掉水分,60℃烤片30min;
[0174]
(5)脱蜡:二甲苯ⅰ,8min;二甲苯ⅱ,8min;二甲苯ⅲ,8min;100%酒精ⅰ,5min;100%酒精ⅱ,5min;90%酒精,4min;80%酒精,4min;70%酒精,4min;60%酒精,4min;蒸馏水,5min;
[0175]
(6)抗原修复:切片浸没于ph=6.0柠檬酸钠抗原修复液,置于99℃水浴锅中30min,修复完成后冷却至室温;
[0176]
(7)pbs清洗三次,每次3min;
[0177]
(8)切片浸没于2iu hcl溶液20min后,直接滴加胃蛋白酶消化液处理4min;
[0178]
(9)pbs清洗三次,每次3min;
[0179]
(10)滴加3%h2o2处理10min,去除内源性过氧化物酶干扰;
[0180]
(11)pbs清洗三次,每次3min;
[0181]
(12)滴加5%山羊血清封闭液,室温孵育1h;
[0182]
(13)用抗体稀释液将anti-brdu rat mab按1:300稀释,将稀释好的一抗滴加在玻片样本上,4℃过夜孵育;
[0183]
(14)次日取出切片,恢复至室温,pbs清洗三次,每次3min;
[0184]
(15)用抗体稀释液将山羊抗大鼠二抗按1:200稀释,室温孵育1h;
[0185]
(16)pbs清洗三次,每次3min;
[0186]
(17)将dab试剂盒中的a液和b液按1:30混合,得到dab工作液;
[0187]
(18)甩掉玻片上的液体,滴加dab工作液,镜下观察,阳性细胞出现棕色沉淀后立即浸没于pbs中停止反应;
[0188]
(19)苏木素细胞核染色,脱水后中性树胶封片;
[0189]
(20)再生隐窝计数:镜下观察,垂直切面下同一隐窝内存在大于5个brdu 细胞可判定为再生隐窝,计数每个肠环内所有再生隐窝数,每只小鼠计数5-7个肠环
[0190]
1.2.6cleaved-caspase 3、γh2ax免疫组化
[0191]
基本过程与brdu免疫组化相同,但无泡酸步骤。anti-cleaved caspase 3一抗按1:200稀释,采用hrp标记的山羊抗兔二抗;anti-γh2ax一抗按1:1000稀释,采用hrp标记的山羊抗小鼠二抗。
[0192]
1.2.7隐窝提取
[0193]
(1)处死小鼠,打开腹腔,寻找小肠与胃交界处,向下1cm即为小肠取材起始点;剪断小肠,轻轻将小肠拉出,尽量不要扯破肠管,取材长度10cm;
[0194]
(2)在湿润滤纸上尽可能剔尽肠系膜,冰pbs冲洗肠道内容物;
[0195]
(3)剪除肉眼可见的派氏结,沿一侧用小剪刀将肠道剖开,后将组织剪碎为5mm的碎片,转移至50ml离心管中;
[0196]
(4)离心管内加入15-20ml冰pbs,漩涡振荡器上震动15-20s,插入冰内,待组织自然沉淀,去除上层液体,反复清洗,直至液体清澈,一般清洗次数为10-15次;
[0197]
(5)冰dpbs清洗两次,末次尽量去除残留液体,加入15-20ml冰2mm edta;
[0198]
(6)冰上孵育10min,摇床轻晃;然后漩涡振荡器上震动60s,可见上清液变浑浊,吸出上清液,加入15-20ml dpbs摇晃清洗,直至上清清澈,去除dpbs,再次加入2mm edta,冰上孵育10min。然后取出漩涡振荡器上震动10-20s,加入15-20ml dpbs摇晃清洗,直至上清清澈,去除dpbs,再次加入5mm edta,冰上孵育10min。
[0199]
(7)漩涡振荡器震动60s,可见上清液变浑浊,去吸取上清后至离心管,放置冰上,剩余沉淀继续震荡60s,再次吸取上清至同一离心管,离心100g/min,离心2min,去除上清,并使用70μm滤网将液体自然过滤至50ml离心管内,是为馏份1。
[0200]
(8)重新收集过滤后的组织,加入15ml 2mm edta,漩涡振荡器震动20s,重复过滤过程,是为馏份2。重复以上方法得到馏份3。
[0201]
1.2.8western blot
[0202]
1.2.8.1蛋白page胶的配制
[0203]
(1)玻璃板装配,验漏。分离胶配制,并将配制好的分离胶灌入玻璃板,加入异丙醇压平分离胶;
[0204]
(2)待凝固后直至分离胶与异丙醇出现明显分界线,倒出上层异丙醇,加入浓缩胶,直接插入梳子,待凝固。
[0205]
1.2.8.2蛋白凝胶电泳
[0206]
(1)取出page胶,上推胶板以避免漏液,装入垂直槽固定架,装入电泳槽,加入电泳缓冲液;
[0207]
(2)轻柔拔出梳子,以免破坏胶孔,将槽内电泳液补满;
[0208]
(3)按照上样顺序进行点样,并加入蛋白分子量maker;
[0209]
(4)接通电源,先以80v电压电泳浓缩胶30min左右,进入分离胶后改为120v电压继
续电泳,待溴酚蓝至凝胶边缘5cm处停止电泳。
[0210]
1.2.8.3转膜
[0211]
(1)裁剪pvdf膜泡入甲醇中待用,将电泳完的凝胶玻璃板取出,并按照蛋白maker切割目的蛋白所在区域的凝胶;
[0212]
(2)预冷转膜液里放入转膜用的夹子和两块海绵垫,将海绵垫浸湿润,以白色地板为底,按照滤纸,pvdf膜,凝胶,滤纸,黑色底板顺序进行放置,并用滚轮赶走气泡,确保滤纸、海绵与胶之间无气泡。
[0213]
(3)将夹子放入转移槽中,转移槽中放入冰袋,200ma转膜120min.
[0214]
1.2.8.4封闭
[0215]
转膜后将膜于封闭液中封闭1h,封闭液用tbst配的5%脱脂牛奶;
[0216]
1.2.8.5抗体孵育
[0217]
(1)清洗后将膜按照目的蛋白位置剪切标记好,加入稀释的一抗,4℃过夜;
[0218]
(2)再在摇床上用tbst液清洗膜3次,每次10min;
[0219]
(3)清洗后将二抗用5%脱脂牛奶按照1:5000稀释,室温下孵育膜和二抗1h;
[0220]
(4)摇床上用tbst清洗膜三次,每次10min。
[0221]
1.2.8.6显影
[0222]
(1)化学发光检测:将等体积的ecl化学发光试剂盒a液和b液在混合;
[0223]
(2)将显影液均匀涂在pvdf膜上,避光孵育,置入bio-rad自动显影液仪器进行目的蛋白显影成像;
[0224]
(3)凝胶图像分析:利用image lab软件处理系统分析目标带的密度值。
[0225]
1.2.9统计学处理
[0226]
使用graphpad 8.0(graphpad software inc.,usa)软件进行绘图和统计学分析。数据以mean
±
sd表示,数据两两比较时先用f检验计算标准差是否有明显差异,然后用非配对双尾student’s t检验。存活数据绘制kaplan-meier曲线,组间比较使用log-rank分析,剂量-存活曲线使用logistic拟合。所有比较中,p《0.05认为有统计学差异,*p《0.05,**p《0.01,***p《0.001,****p《0.0001。
[0227]
实施例1.双硫仑照前给药延长12gy全身照射小鼠的照后存活时间
[0228]
1.实验分组:
[0229]
将16只雄性c57小鼠随机抽取分成下列2组:
[0230]
照射对照组:腹腔注射对照溶剂(90%saline 5%dmso 5%tween80)0.2ml,n=8;
[0231]
双硫仑(dsf)组:腹腔注射dsf,剂量为100mg/kg,照射前1小时施用,n=8;
[0232]
照射条件:12.0gy全身照射,剂量率约60cgy/min。
[0233]
2.实验方法:
[0234]
参见“材料和方法”部分的1.2节
[0235]
3.实验结果:
[0236]
照射对照组小鼠在照后4天开始出现严重腹泻,在6天内全部死亡,dsf可显著延长小鼠存活时间。病理染色显示,照后6天对照小鼠肠绒毛萎缩,上皮剥脱,dsf组小鼠肠道隐窝增殖旺盛,肠绒毛完整(图1)。以上结果说明,dsf能显著减轻照射对肠绒毛的损伤,延长小鼠的存活时间。
[0237]
实施例2.双硫仑照前给药促进不同剂量照射小鼠照后3.5天小肠隐窝细胞的再生
[0238]
1.实验分组:
[0239]
24只雄性c57小鼠随机抽取分成下列6组:
[0240]
(1)10gy照射对照组:腹腔注射对照溶剂(90%saline 5%dmso 5%tween80)0.2ml,n=4;
[0241]
(2)10gy dsf组:腹腔注射dsf,剂量为100mg/kg,照射前1小时施用,n=4;
[0242]
(3)12gy照射对照组:腹腔注射对照溶剂(90%saline 5%dmso 5%tween80)0.2ml,n=4;
[0243]
(4)12gy dsf组:腹腔注射dsf,剂量为100mg/kg,照射前1小时施用,n=4;
[0244]
(5)14gy照射对照组:腹腔注射对照溶剂(90%saline 5%dmso 5%tween80)0.2ml,n=4;
[0245]
(6)14gy dsf组:腹腔注射dsf,剂量为100mg/kg,照射前1小时施用,n=4;
[0246]
照射条件:依据分组分别为10gy、12gy、14gy全身照射,剂量率约为60cgy/min。
[0247]
2.实验方法:
[0248]
参见“材料和方法”部分的1.2节
[0249]
3.实验结果:
[0250]
小肠隐窝是照后上皮重建的功能单位,小鼠接受10gy、12gy、14gy x射线照射,3.5天后照射对照组再生隐窝的数量分别(73.2
±
7.8)、(22.6
±
6.1)、(11.2
±
4.4)个/肠环,相应的dsf组再生隐窝数量分别为(100.4
±
12.39)、(39.1
±
17.0)、(27.9
±
7.7)个/肠环,分别提高了37%、73%、165%(图2)。由于14gy照后小鼠已达到胃肠综合征的标准,故dsf对放射性肠损伤和胃肠综合征都有良好的防护作用。
[0251]
实施例3.双硫仑抑制12gy全身照射小鼠照后小肠隐窝细胞p21表达的升高
[0252]
1.实验分组:
[0253]
将16只雄性c57小鼠随机抽取分成下列2组:
[0254]
照射对照组:腹腔注射对照溶剂(90%saline 5%dmso 5%tween80)0.2ml,n=2;
[0255]
dsf组:腹腔注射dsf,剂量为100mg/kg,照射前1小时施用,n=2;
[0256]
取材时间:照后30分钟、4小时、24小时。
[0257]
照射条件:12.0gy全身照射,剂量率约60cgy/min。
[0258]
2.实验方法:
[0259]
参见“材料和方法”部分的1.2节
[0260]
3.实验结果:
[0261]
为更准确地检测小肠干细胞、祖细胞在照射及dsf给药后的蛋白表达变化,采用edta低温孵育法分离富集小肠隐窝。p21是细胞周期的负调控因子,通过与细胞周期蛋白-细胞周期蛋白依赖性激酶结合,导致细胞周期阻滞,阻断细胞增殖。免疫印迹显示,dsf能显著抑制12gy照射诱导的p21表达升高(图3)。提示dsf能促进隐窝细胞在照后快速进入细胞周期,启动重建。
[0262]
实施例4.双硫仑阻止12gy全身照射小鼠照后小肠隐窝细胞凋亡
[0263]
1.实验分组:
[0264]
将16只雄性c57小鼠随机抽取分成下列2组:
[0265]
照射对照组:腹腔注射对照溶剂(90%saline 5%dmso 5%tween80)0.2ml,n=3;
[0266]
dsf组:腹腔注射dsf,剂量为100mg/kg,照射前1小时施用,n=3;
[0267]
照射条件:12.0gy全身照射,剂量率约60cgy/min。
[0268]
取材时间:照后4小时、24小时
[0269]
2.实验方法:
[0270]
参见“材料和方法”部分的1.2节
[0271]
3.实验结果:
[0272]
凋亡是照射后细胞死亡的重要方式。小肠上皮细胞对射线非常敏感,照后约2-6h迅速出现p53依赖的第一波凋亡高潮,在照后约24h出现p53非依赖的第二波凋亡高潮。小鼠接受12gy照射后4h、24h分别取材小肠组织,cleaved caspase3检测凋亡细胞。结果显示,照后4h,dsf组隐窝内cleaved caspase3细胞约为对照组的77%,差异有统计学意义,照后24h,两组凋亡细胞均有下降,但dsf组仍显著低于对照组。此外,dsf可明显抑制12gy照后4h、24h小肠隐窝细胞凋亡相关蛋白puma和cleaved caspase3的表达(图4)。上述结果表明,dsf可以抑制照射引起的隐窝细胞凋亡。
[0273]
实施例5.双硫仑减轻12gy全身照射小鼠照后小肠隐窝细胞dna损伤
[0274]
1.实验分组:
[0275]
将16只雄性c57小鼠随机抽取分成下列2组:
[0276]
照射对照组:腹腔注射对照溶剂(90%saline 5%dmso 5%tween80)0.2ml,n=3;
[0277]
dsf组:腹腔注射dsf,剂量为100mg/kg,照射前1小时施用,n=3;
[0278]
照射条件:12.0gy全身照射,剂量率约60cgy/min。
[0279]
取材时间:照后24小时
[0280]
2.实验方法:
[0281]
参见“材料和方法”部分的1.2节
[0282]
3.实验结果:
[0283]
电离辐射产生的自由基诱发dsbs是引起细胞死亡的主要原因。减少照后细胞dsbs的积累,可以避免干细胞死亡,及早解除细胞周期抑制,实现肠绒毛的再生修复。dsbs可诱导损伤点附近的组蛋白h2ax磷酸化为γh2ax,照后24hγh2ax的表达,是反映dsb修复与否灵敏的指标。12gy照后24h免疫组化显示,dsf可将隐窝内γh2ax 细胞的比例从59%降至39%,差异有统计学意义(图5),表明dsf可有效减轻照后小肠隐窝细胞的dna损伤。
再多了解一些
本文用于创业者技术爱好者查询,仅供学习研究,如用于商业用途,请联系技术所有人。