1.本发明涉及细胞培养领域,具体涉及一种检测新型微载体裂解液在细胞中的残留的方法。
背景技术:
2.近年来,细胞治疗研发如火如荼。细胞治疗是利用在体外操作所获得的异体或自体的活细胞,重新回输到体内,让细胞对受损组织进行修复或者杀死病变组织(如肿瘤)。目前细胞治疗主要分为免疫细胞治疗和干细胞治疗。据新药研发监测数据库(cpm)显示,截止目前,中国干细胞治疗研究项目占全球约10%,免疫细胞治疗临床研究占全球约1/3,已经成为仅次于美国的第二大市场。预计至2030年,仅美国fda就有望批准40至60种细胞和基因疗法。同时,随着科研投入的持续增加和技术实力的不断加强,在中国开展的细胞与基因治疗的临床研究正在逐年增加,每年新增数量仅次于美国。中国已成为世界上细胞治疗临床研究最活跃的地区之一。
3.细胞治疗将细胞当作药物对患者进行实施,因此细胞的大规模、高质量的生产是保证细胞治疗效果的重要技术。传统的二维细胞培养方法,有着诸多的不便利因素,例如所需空间大,产量低,不易控制等,这使得大规模培养细胞受到制约。借鉴生物制药、疫苗生产等较为成熟的生物行业的细胞培养技术,采用微载体细胞培养技术是目前公认的最有发展前途的一种培养模式。虽然这门新兴的细胞培养技术是未来医学、制药等领域的热门应用技术,但是目前对于应用在细胞治疗领域还存在一些需要优化和改进的方面。
4.传统的微载体所培养的细胞主要用于收集细胞的产物,如疫苗、蛋白和病毒生产。然而使用传统微载体生产细胞治疗所需的细胞存在着培养后较难将微载体上的细胞有效地收获下来的问题。传统微载体使用领域中,在分离细胞时,需用edta和胰蛋白酶溶液将细胞从微载体表面消化,使细胞脱离微载体表面。细胞脱离微载体后,可用自然沉降法,或通过筛网将微载体过滤去除后,方可离心滤过液,获得细胞。由于需要进一步的分离步骤,增加了整个生产过程的成本和过程的复杂性,且长时间对细胞进行消化会造成细胞受损是常规知识,导致无法获得高品质的细胞制品用于治疗。而且微载体颗粒若无法得到有效去除,其残留将导致后续细胞制品注射体内引起安全性问题。
5.为了解决这个问题,北京华龛生物科技有限公司研发的可降解三维微载体聚集体(cn201910079680.3,商品名为微载片)可以使用微载体裂解液针对微载体进行裂解,使微载体从固态溶解为液态,从而将载体上的细胞释放到溶液中,通过离心的方式,将溶液与细胞分离,从而获得细胞。由于裂解液裂解的是微载体而非对细胞进行消化,因此对细胞温和,保持细胞活性并保留细胞自身分泌的蛋白,从而解决了从微载体上收获细胞后,需要再去除微载体颗粒的繁琐步骤及其安全隐患。虽然解决了传统微载体不利于细胞制品的生产的问题、但由于引入了微载体裂解液,为保障细胞制剂临床应用中的安全性,需要对细胞制剂中微载体裂解液残留进行检测。但是目前还缺乏有效的检测收获细胞中微载体裂解液残留的方法。所以,开发出新的检测微载体裂解液残留的方法对应用微载体培养细胞的临床
应用非常重要。
技术实现要素:
6.本发明提供一种新的微载体裂解液残留检测方法,要求检测者对使用华龛生物的微载体聚集体,3d 微载片(以下均简称为微载片),培养后新鲜收获的细胞,快速进行微载体裂解液成分胶原蛋白酶活性的定量或定性检测,从而保障用于临床细胞治疗的细胞制剂在本项检测内容的安全性。本发明可以通过使用市售试剂盒和新的测试方法,在使用微载体悬浮培养细胞,并使用华龛生物的3ddigest微载体裂解液收获细胞后,可以应用该方法对于收获后的细胞进行检测,从而保障了细胞制剂在本项内容的安全性。
7.本发明提供了一种检测3ddigest微载体裂解液在细胞中的残留的方法,所述方法包括检测样品中的所述微载体裂解液的组成成分,确定所述微载体裂解液在细胞中的残留量;所述样品为采用微载体培养细胞后,使用微载体裂解液裂解微载片后所收获的细胞。
8.可选地,根据上述的方法,所述微载体的组成成分包括胶原蛋白、变性胶原蛋白和/或明胶。
9.可选地,根据上述的方法,所述微载体为北京华龛生物科技有限公司的3d微载片。
10.可选地,根据上述的方法,所述样品通过如下步骤制备:
11.(1)用微载体培养细胞,向包含培养细胞和所述微载体的培养体系中加入所述微载体裂解液,获得单细胞悬液;
12.(2)离心所述单细胞悬液,获得沉淀,离心例如为50-500g;
13.(3)采用清洗液清洗所述沉淀;
14.(4)采用所述清洗液将清洗后的沉淀混悬得到单细胞悬液;
15.(5)静置步骤(4)得到的所述单细胞悬液;
16.(6)离心所述步骤(5)静置后的所述单细胞悬液,获得沉淀,离心例如为50-500g;
17.(7)重复步骤(3)-(6)1-5次后,将获得的沉淀重悬在所述清洗液中作为样品,例如重复步骤(3)-(6)1、2、3、4或5次。
18.所述包含培养细胞的所述微载体的培养体系具体可为微组织,所述微组织可为采用所述微载体和完全培养基培养细胞所获得的。
19.可选地,根据上述的方法,所述步骤(3)中所述沉淀中的细胞数量与所述清洗液的体积比(0.5-5.0)
×
107个:1-10ml。
20.可选地,根据上述的方法,所述清洗液为pbs或生理盐水或hbss。所述pbs为ph 7.0-7.2,溶质为1.058imm kh2p04、5.6002mm na2hp04、154.0041mm nacl,溶剂为水的溶液。所述生理盐水为溶质为0.9g/l nacl,溶剂为水的溶液。所述hbss为ph7.0-7.4,溶质为8g/l nacl、0.4g/l kcl、0.2g/l mgs04·
7h20、0.14g/l cacl2、0.06g/l na2hp04·
2h20、0.06g/l kh2p04、1g/l d-glucose、0.35g/l nahc03。
21.可选地,根据上述的方法,所述步骤(1)包括向所述培养体系中加入细胞冻存液,
降温,液氮保存1周,复溶,离心去除所述细胞冻存液,获得冻存后的培养体系,向所述冻存后的培养体系中加入所述微载体裂解液,获得单细胞悬液。
22.可选地,根据上述的方法,所述步骤(7)包括将所述沉淀重悬在所述细胞冻存液中,降温,液氮保存1周,复溶,离心去除所述冻存液,获得冻存后的细胞,将所述冻存后的细胞重悬在所述清洗液中作为样品。
23.可选地,根据上述的方法,所述微载体裂解液包括胶原蛋白酶。
24.可选地,根据上述的方法,所述微载体裂解液为北京华龛生物科技有限公司的3ddigest微载体裂解液,货号为r001-500。
25.可选地,根据上述的方法,所述微载体裂解液的组成成分为胶原蛋白酶。
26.则具体地,所述检测样品中的所述微载体裂解液的组成成分可包括采用所述胶原蛋白酶消化荧光素标记的dq明胶共轭物以显示荧光,根据所述荧光确定所述样品中微载体裂解液的残留量。
27.例如采用荧光检测法,根据标准曲线计算所述微载体裂解液的残留量。
28.所述标准曲线可按照如下步骤制备:
29.按照梯度浓度配制微载体裂解液标准品,用所述微载体裂解液标准品消化荧光素标记的dq明胶共轭物以显示荧光,测量荧光值,根据所述微载体裂解液标准品的浓度和所述荧光值制备标准曲线。
30.可选地,通过稀释液稀释所述微载体裂解液以配制所述微载体裂解液标准品。
31.加入的稀释液体可为与本发明用于在所述检测中不产生信号干扰、可维持细胞膜完整度的液体(如本发明用于细胞清洗的pbs或生理盐水、培养基或其他常规的细胞培养使用的缓冲液)。
32.所述微载体裂解液标准品的浓度范围,根据不同的微载体、裂解液清洗方法,范围不同。可以根据不同细胞制剂的生产工艺和应用需求进行调整。比如,使用北京华龛生物科技有限公司的3d 微载片(货号f01-100)培养细胞,使用3ddigest微载体裂解液(货号r001-500)裂解载体收获细胞,并使用pbs清洗细胞后,以1
×
107细胞为1个制剂单位时,所述微载体裂解液标准品的浓度为1ng/ml~1000ng/ml。
33.所述检测样品中的所述微载体裂解液的组成成分还可包括采用所述胶原蛋白酶催化falgpa(fa-亮氨酰甘氨酰脯氨酰丙氨酰-oh胶原蛋白酶底物)的比色法,根据od
345nm
吸光度的下降速率确定所述样品中的胶原蛋白酶含量,根据所述胶原蛋白酶含量确定所述样品中微载体裂解液的残留量。
34.例如,采用比色法,根据吸光度的下降速率计算所述胶原蛋白酶的含量,再根据所述胶原蛋白酶的含量确定所述微载体裂解液的残留量。具体为采用所述胶原蛋白酶催化falgpa生成n-(3[2-呋喃基]丙烯酰)-亮氨酸和甘氨酰-脯氨酰-丙氨酸,导致od
345nm
的吸光度下降,根据od
345nm
吸光度的下降速率确定所述样品中的胶原蛋白酶含量,根据所述胶原蛋白酶含量确定所述样品中微载体裂解液的残留量。
[0035]
其中,计算所述胶原蛋白酶的含量具体可包括:混合样品和falgpa获得试样。混合清洗液和falgpa获得空白对照。在钙离子存在时,37℃,每隔1min,检测试样或空白对照od345处吸光度(a),至少检测4次,获得试样和空白对照的吸光度消光速率,分别为
△△
a样
品和
△△
a空白。根据公式胶原蛋白酶活性=((
△△
a试样
‑△△
a空白)
×
反应体系体积)/(falgpa消光系数
×
样品体积)计算所述样品中的所述胶原蛋白酶的含量。
[0036]
上文中,所述细胞可为脐带间充质干细胞。
[0037]
上文中,所述微载体裂解液在细胞中的残留量可为微载体裂解液在样品中残留的具体量或具体浓度,也可为微载体裂解液在样品中残留的相对值,例如微载体裂解液在样品中残留的具体量与采用微载体裂解液裂解微载体时微载体裂解液用量的比例。
[0038]
实验证明,本方法能够定性或者定量检测可降解三维微载体培养后,裂解微载体收获细胞中微载体裂解液残留量。
附图说明
[0039]
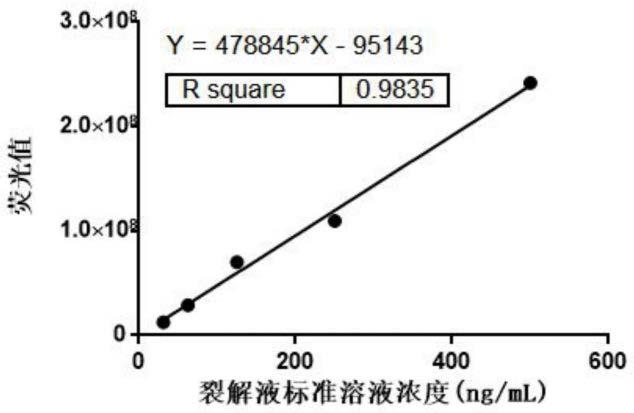
图1为实施例1中的裂解液残留检测的标准曲线。
[0040]
图2为实施例1微载片培养细胞中裂解液残留检测结果。
[0041]
图3为实施例2od345nm处吸光度随时间变化结果。
[0042]
图4为实施例2胶原蛋白酶残留检测结果。
[0043]
图5为实施例3胶原蛋白酶残留检测结果。
[0044]
图6为实施例4裂解液残留检测结果。
[0045]
图7为实施例5裂解液残留检测结果。
[0046]
图8为实施例6裂解液残留检测结果。
[0047]
图9为实施例7裂解液残留检测结果。
具体实施方式
[0048]
下面结合具体实施方式对本发明进行进一步的详细描述,给出的实施例仅为了阐明本发明,而不是为了限制本发明的范围。以下提供的实施例可作为本技术领域普通技术人员进行进一步改进的指南,并不以任何方式构成对本发明的限制。
[0049]
下述实施例中的实验方法,如无特殊说明,均为常规方法,按照本领域内的文献所描述的技术或条件或者按照产品说明书进行。下述实施例中所用的材料、试剂等,如无特殊说明,均可从商业途径得到。
[0050]
如无特别说明,下述定量实验均有三个重复数据,数据取平均值。
[0051]
下述实施例中所涉及的3d微载片为北京华龛生物科技有限公司的3d微载片(货号f01-100),含有变性胶原蛋白等成分。3d微载片由变性胶原蛋白制成的细胞微载片颗粒通过专利技术(cn 201910079680.3)制作成的细胞微载体聚集体。
[0052]
下述实施例中的微载体裂解液为北京华龛生物科技有限公司的3ddigest微载体裂解液(货号为r001-500),含有胶原蛋白酶类等成分。
[0053]
下述实施例中所述试剂盒为赛默飞世尔科技(中国)有限公司的gelatinase/collagenase assay kit(货号e12055),该试剂盒含有荧光素标记的dq明胶共轭物(fluorescein-labeled dq gelatin conjugate)。
[0054]
下述实施例中所涉及的细胞为离体的人脐带间充质干细胞,为本领域常见细胞。
[0055]
下述实施例中的pbs是ph7.0-7.2,溶质为1.0581mm kh2po4、5.6002mm na2hpo4、154.0041mm nacl,溶剂为水的溶液。
[0056]
实施例1、裂解液残留荧光检测法的建立及应用
[0057]
1、标准曲线的绘制
[0058]
将微载体裂解液采用pbs按照以下浓度进行稀释:500ng/ml、250ng/ml、125ng/ml、62.5ng/ml、31.25ng/ml,作为检测标准品。
[0059]
采用gelatinase/collagenase assay kit检测待测样品的荧光值,具体步骤如下:
[0060]
1)在96孔板的实验孔中,加入试剂盒中的1x buffer 80μl;
[0061]
2)在96孔板的实验孔中,加入试剂盒中提前稀释的dq gelatin 20μl;
[0062]
3)加样(冰上操作):加入梯度稀释的裂解液标准品(标准管)或1x buffer(空白管)100μl,室温下避光反应;
[0063]
4)0.5h后,使用酶标仪检测96孔板实验孔的荧光值,检测参数为吸收光波长495nm、发射光波长515nm。
[0064]
以标准溶液的浓度为x轴,
△
a标准(
△
a=荧光值a标准管-荧光值a空白管)为y轴,绘制标准曲线,得到方程y=478845*x-95143。裂解液残留检测的标准曲线结果如图1所示。
[0065]
2、待测样品准备
[0066]
利用3d微载片培养离体的人脐带间充质干细胞,具体方法如下:(1)微载片准备:轻轻夹取5片3d 微载片投入到125ml透气内置叶轮培养瓶(北京华龛生物科技有限公司,sf125,以下简称培养瓶)中,取10ml完全培养基沿培养瓶侧臂加样口加入到培养瓶中,使微载片分散于培养基中,待用;(2)细胞准备:准备5ml细胞悬液,密度为5
×
105个细胞/ml,待用;(3)细胞接种:将细胞悬液加入到培养瓶中,补加完全培养基(北京华龛生物科技有限公司,rmz010-gy),终体积为80ml,拧紧瓶盖;(4)细胞培养:将培养瓶转移到提前安装好的3d minispin单通道生物反应器(北京华龛生物科技有限公司,ftms-1)主机的瓶位中心,通过触屏控制器将搅拌速度设置为恒速40rpm,培养6天,即可得到微组织。
[0067]
将3d微载片培养后的微组织进行裂解,其中微组织饱和度为5
×
106个细胞/片微载片,每片微载片使用3ml微载体裂解液。将微组织裂解至单细胞悬液时,立刻进行离心,离心转速为50-500g。随后使用pbs清洗细胞,1
×
107个细胞使用5ml pbs进行清洗,将清洗后的细胞混悬至单细胞后,静置2min后,离心弃上清,离心转速为50-500g,此为一次清洗。重复清洗步骤3次。最终将细胞重悬在1ml pbs溶液中作为待测品1和待测品2。
[0068]
3、检测待测样品
[0069]
采用gelatinase/collagenase assay kit检测待测样品的荧光值,具体步骤如下:
[0070]
1)在96孔板的实验孔中,加入试剂盒中的1x buffer 80μl;
[0071]
2)在96孔板的实验孔中,加入试剂盒中提前稀释的dq gelatin 20μl;
[0072]
3)加样(冰上操作):加入待测样品(测定管)或1x buffer(空白管)100μl,室温下避光反应:
[0073]
4)0.5h后,使用酶标仪检测96孔板实验孔的荧光值,检测参数为吸收光波长495nm、发射光波长515nm。
[0074]
4、微载片裂解液残留计算
[0075]
将待测样品
△
a(
△
a=荧光值a测定管-荧光值a空白管)带入步骤1所获得的方程得到待测样品的微载体裂解液含量。计算结果如图2所示,待测品1和待测品2中微载体裂解液的残留量分别为190ng和193ng。
[0076]
实施例2、裂解液残留比色检测法的建立及应用
[0077]
比色法采用fa-亮氨酰甘氨酰脯氨酰丙氨酰-oh胶原蛋白酶底物(简称falgpa,百灵威科技有限公司,bif0744)对样品中的胶原蛋白酶活性进行检测。
[0078]
1.配置缓冲液:0.224g羟甲基甘氨酸,2.5ml 5m氯化钠,20ml去离子水,ph调至7.5后,补充2.5ml 100mm氯化钙。
[0079]
2.配置底物:5mg falgpa溶于10ml缓冲液。
[0080]
3.样品准备:根据实施例1中“2、待测样品准备”准备1
×
107个/ml的单悬细胞作为样品。另准备3d digest为阳性对照,pbs为空白对照。
[0081]
4.底物反应:在96孔板的实验孔中,加缓冲液90μl,加入样品10μl混匀,而后再加入100μl的反应混合物,其中底物40μl,缓冲液60μl。在96孔板的阳性对照孔中,加缓冲液90μl,加入阳性对照10μl混匀,而后再加入100μl的反应混合物,其中底物40μl,缓冲液60μl。96孔板的空白孔中,加缓冲液90μl,加入空白对照10μl混匀,而后再加入100μl的反应混合物,其中底物40μl,缓冲液60μl。
[0082]
5.混匀后于酶标仪中检测。检测设置为:动力学模式下检测od345nm处吸光度,37℃,间隔1min,检测60min,如图3。
[0083]
6.计算获得每个样品、阳性对照、空白对照的吸光度消光速率(即吸光度的下降速率)
△△
a样品、
△△
a阳性对照和
△△
a空白,即a
0min-a
60min
/60min。
[0084]
7.胶原蛋白酶活性公式为胶原蛋白酶活性=((
△△
a样品(或
△△
a阳性对照)
‑△△
a空白)
×
反应体系体积)/(falgpa消光系数
×
样品体积(或阳性对照体积)),其中falgpa消光系数为0.53,反应体系体积为0.2,样品体积(或阳性对照体积)为0.01。通过公式计算得出每个样品中的残留的酶以及阳性对照的酶的活性。计算结果如图4所示,样品1、和样品2中胶原蛋白酶的残留量浓度分别为0.004
±
0.002u/ml和0.004
±
0.008u/ml,而阳性对照为0.111 0.002u/ml。
[0085]
8.根据公式计算残留:裂解液残留比例=(样品酶活
×
样品体积)/(阳性对照酶活
×
裂解时裂解液体积)
×
100%。本实施例中,样品为1
×
107个细胞/ml,体积为1ml,收获1
×
107个细胞所使用的裂解液体积为6ml;即样品1和样品2的裂解液残留均为(0.004
×
1)/(0.111
×
6)
×
100%=0.6%。
[0086]
实施例3、裂解液残留样品的清洗次数优化
[0087]
1、按实施例2配置缓冲液和底物。
[0088]
2、待测样品准备
[0089]
1.微组织制备:根据实施例1中制备微组织。
[0090]
2.单悬细胞制备:将3d微载片培养后的微组织进行裂解,其中微组织饱和度为5
×
106个细胞/片微载片,每片微载片使用3ml微载体裂解液(此时细胞浓度为1.67
×
106个/
ml)。将微组织裂解至单细胞悬液时,立刻进行离心,离心转速为50-500g,将离心后的细胞作为清洗前样品,每份清洗前样品为1
×
107个细胞。
[0091]
3.清洗:使用pbs清洗细胞,1
×
107个细胞/剂使用5ml pbs进行清洗,将细胞混悬至单细胞后,静置2min后,离心去除上清。此为1次清洗。取5份清洗前样品分别以此清洗方法清洗0-4次,获得不同清洗次数的细胞。清洗后,将该5份样品分别重悬在1ml pbs置成待测样品。
[0092]
4.另准备3d digest为阳性对照,pbs为空白对照。
[0093]
3、检测样品并计算残留的酶活
[0094]
1.按照实施例2中步骤4-7检测并计算每个样品的酶活。另准备3d digest为阳性对照,pbs为空白对照。
[0095]
结果如图5。结果显示经过至少1次清洗可以大幅降低残留的胶原蛋白酶,清除率(即100%-裂解液残留比例)大于95%。裂解液残留比例(图5中的残留百分比)=(样品酶活
×
样品体积)/(阳性对照酶活
×
裂解时裂解液体积)
×
100%。本实施例中,样品为1
×
107个细胞/ml,体积为1ml,收获1
×
107个细胞所使用的裂解液体积为6ml,阳性对照酶活为0.127u/ml。
[0096]
实施例4、裂解液残留样品的清洗体积优化
[0097]
1、按实施例1绘制标曲。
[0098]
2、待测样品准备
[0099]
1.微组织制备:根据实施例1中制备微组织。
[0100]
2.单悬细胞制备:将3d微载片培养后的微组织进行裂解,其中微组织饱和度为5
×
106个细胞/片微载片,每片微载片使用3ml微载体裂解液。将微组织裂解至单细胞悬液时,立刻进行离心,离心转速为50-500g。
[0101]
3.清洗:使用pbs采用实施例3所述的清洗方法清洗细胞,三份1
×
107个细胞分别使用1ml、5ml或者10ml pbs进行清洗两次。清洗后,将该些1
×
107个细胞分别重悬在1ml pbs置成待测样品。
[0102]
3、检测待测样品
[0103]
按照实施例1步骤3进行样品检测。
[0104]
4、裂解液残留计算
[0105]
按照实施例1步骤4计算微载体裂解液残留。如图6所示,1ml、5ml、10ml pbs清洗的微载体裂解液残留量分别为164ng、155.3ng和134.5ng。结果显示清洗液的体积对微载体裂解液残留量的影响有一定影响,越多清洗液残留量越少。
[0106]
实施例5、裂解液残留样品的清洗液
[0107]
1、按实施例1绘制标曲。
[0108]
2、待测样品准备
[0109]
1.微组织制备:根据实施例1中制备微组织。
[0110]
2.单悬细胞制备:将3d微载片培养后的微组织进行裂解,其中微组织饱和度为5
×
106个细胞/片微载片,每片微载片使用3ml微载体裂解液。将微组织裂解至单细胞悬液时,立刻进行离心,离心转速为50-500g。
[0111]
3.清洗:使用清洗液(pbs、生理盐水或者hbss)清洗细胞,3
×
107个细胞使用5ml清
洗液进行清洗两次。清洗方法与实施例1中的清洗方法相同。清洗后,将该些3
×
107个细胞重悬在1ml相应的清洗液中置成待测样品。
[0112]
3、检测待测样品
[0113]
按照实施例1步骤3进行样品检测。
[0114]
4、裂解液残留计算
[0115]
按照实施例1步骤4计算微载体裂解液残留。如图7所示,采用pbs、生理盐水、hbss清洗的微载体裂解液残留量分别为524ng、384ng和616ng。三种清洗液均可以减少裂解液残留,其中pbs效果最佳。
[0116]
实施例6、新鲜细胞、冻存细胞与冻存微组织所获得的细胞中裂解液残留的对比
[0117]
1、按实施例1绘制标曲。
[0118]
2、待测样品准备
[0119]
1.微组织制备:根据实施例1中制备微组织。
[0120]
2.新鲜细胞制备:将3d微载片培养后的微组织立刻进行裂解,其中微组织饱和度为5
×
106个细胞/片微载片,每片微载片使用3ml微载体裂解液。将微组织裂解至单细胞悬液时,立刻进行离心,离心转速为50-500g。使用pbs清洗细胞,3
×
107个细胞/剂使用5ml清洗液进行清洗三次。清洗方法与实施例1中相同。清洗后,将3
×
107个细胞重悬在1ml的pbs中置成待测样品。
[0121]
3.冻存细胞制备:按照步骤2进行准备的细胞,但在清洗后,将该3
×
107个细胞重悬在1ml细胞冻存液(10体积%dmso和90体积%fbs)混匀后,放入冻存管中进行程序降温至-80℃,24小时候转入液氮保存。放入液氮后1周后,将冻存细胞取出,在37℃水浴锅中复溶后,离心去除冻存液,将该3
×
107个细胞重悬至1ml pbs置成待测样品。
[0122]
4.冻存微组织所获得的细胞制备:按照步骤1准备微组织,将含有3
×
107个细胞的微组织进行常规细胞冻存,即加入1ml细胞冻存液(10%dmso和90%fbs)混匀后,放入冻存管中进行程序降温至-80℃,24小时候转入液氮保存。放入液氮后1周后,将冻存微组织取出,在37℃水浴锅中复溶后,离心去除冻存液。而后根据步骤2制备成3
×
107个细胞重悬在1ml的pbs的待测样品
[0123]
3、检测待测样品
[0124]
按照实施例1步骤3进行样品检测。
[0125]
4、裂解液残留计算
[0126]
按照实施例1步骤4计算微载体裂解液残留。如图8所示,新鲜细胞(新鲜细胞)、冻存细胞(冻存细胞)、与冻存微组织所获得的细胞(冻存微组织)中的裂解液残留量分别为504ng、456ng和534ng,结果显示冻存细胞或者冻存微组织所获得的细胞中的裂解液残留量与新鲜细胞的残留量相似,因此在不能及时检测新鲜细胞时,可以选择将细胞冻存或者将微组织冻存后再裂解清洗,均可以减少裂解液残留。
[0127]
实施例7、细胞密度对裂解液残留的对比
[0128]
1、按实施例1绘制标曲。
[0129]
2、待测样品准备
[0130]
1.微组织制备:根据实施例1中制备微组织。
[0131]
2.新鲜单悬细胞制备:将3d微载片培养后的微组织进行裂解,其中微组织饱和度
为5
×
106个细胞/片微载片,每片微载片使用3ml微载体裂解液。将微组织裂解至单细胞悬液时,立刻进行离心,离心转速为50-500g。
[0132]
3.清洗:使用pbs清洗细胞,1
×
107个细胞/剂使用5ml清洗液进行清洗两次。清洗方法与实施例1相同。清洗后,将5
×
106、1
×
107或3
×
107个细胞分别重悬在1ml相应的清洗液中置成待测样品。
[0133]
3、检测待测样品
[0134]
按照实施例1步骤3进行样品检测。
[0135]
4、裂解液残留计算
[0136]
按照实施例1步骤4计算微载体裂解液残留。如图9所示,5
×
106、1
×
107或3
×
107个细胞/ml的微载体裂解液残留量分别为127ng、191ng和475ng。结果显示随着细胞数越多,其中含有的裂解液残留越多。
[0137]
以上对本发明进行了详述。对于本领域技术人员来说,在不脱离本发明的宗旨和范围,以及无需进行不必要的实验情况下,可在等同参数、浓度和条件下,在较宽范围内实施本发明。虽然本发明给出了特殊的实施例,应该理解为,可以对本发明作进一步的改进。总之,按本发明的原理,本技术欲包括任何变更、用途或对本发明的改进,包括脱离了本技术中已公开范围,而用本领域已知的常规技术进行的改变。按以下附带的权利要求的范围,可以进行一些基本特征的应用。
再多了解一些
本文用于创业者技术爱好者查询,仅供学习研究,如用于商业用途,请联系技术所有人。
