1.本发明涉及二硫键交联透明质酸凝胶领域,特别涉及一种二硫键交联透明质酸凝胶中交联剂残留的检测方法。
背景技术:
2.二硫键交联透明质酸凝胶中,常用的交联剂是二硫键二氨(如胱胺等)或二硫键二酰肼(如3,3
’‑
二硫代双(丙酰肼)等);透明质酸的侧链羧基可在碳化二亚胺等的催化活性下,与该等交联剂的氨基或酰肼基团发生偶联反应,形成酰胺键交联结构。酰胺键交联虽然比较稳定性,但可能存在水解降解反应,其水解产物是二硫键交联剂。
3.二硫键交联剂(二硫键二氨或二硫键二酰肼)存在氨基,氨基的含量可通过显色反应检测。例如,氨基酸的α-氨基可与水合印三酮反应生成紫蓝色化合物,在570nm处具有特征吸收峰,通过吸光值的变化即可定量检测氨基酸的含量,该方法是目前最为常用的检测方法,其具有操作方法简单易行、成本低、不需要昂贵设备等优点。例如,茚三酮比色法测定谷氨酸含量的研究(中国调味品2015, 8:50-52)公开了谷氨酸与印三酮的最低显色浓度为70
µ
g/ml,线性范围为80~140
µ
g/ml(r2仅为0.9964)。然而,印三酮显色法的精度较差,不能满足二硫键交联剂微量残留的检测要求。
4.二硫键是二硫键交联透明质酸中交联剂的特征官能团。二硫键通常在245nm区域呈现弱吸收,浓度较低时该吸收峰几乎不可见,因此不能满足二硫键交联剂微量残留的检测要求。
5.交联剂的残余可能导致潜在的安全性隐患,在二硫键交联透明质酸中,二硫键交联剂的残留定量检测已成为一个亟待解决的问题。在ich(the international conference on harmonization of technical requirements for registration of pharmaceuticals for human use)的《q3b(r2):新药制剂中的杂质》中,对每日最大剂量的药物中的降解产物杂质进行了严格的规定,例如每日最大剂量大于2g时,鉴定限度为0.1%。在二硫键交联透明质酸中,交联键的水解是其降解的主要途径,二硫键交联剂是主要的降解杂质残留。现今尚没有二硫键交联透明质酸凝胶中交联剂微量残留的检测方法,这为其在药物或者医疗器械的广泛应用带来了限制,因此,建立一种有效的二硫键交联透明质酸凝胶中交联剂微量残留的检测方法具有重要意义。
技术实现要素:
6.本发明要解决的技术问题是提供一种精确度高、操作方法简单易行、线性范围广、成本低、能够满足实际需求的二硫键交联透明质酸凝胶中交联剂微量残留的显色检测方法。
7.为解决上述技术问题,本发明提供一种二硫键交联透明质酸凝胶中交联剂残留的检测方法,包括以下步骤:步骤(1)交联剂的标准溶液:精密称取一定量的交联剂标准品,纯水稀释配制成不少于4个浓度梯度、范围为1~10 ppm 的交联剂的标准溶液;步骤(2)待测
样品的降解:精密称取一定体积的二硫键交联透明质酸凝胶用酶降解,酶降解产物溶液为均一透明溶液,无明显的颗粒;步骤(3)降解产物的超滤分离:步骤(2)得到的降解产物置于超滤离心管中,离心后降解产物中的交联剂残留进入滤液;步骤(4) ntsb试剂显色反应:步骤(3)得到的滤液调ph至3~4,再取等体积的滤液和ntsb试剂混合,室温下反应25分钟,412nm
±
2nm测定吸光度;步骤(5)标准曲线的建立:步骤(1)得到的标准品溶液分别按步骤(2)的方法降解,再分别按步骤(3)超滤分离、步骤(4)显色后测定吸光度,并与交联剂的标准溶液的浓度进行线性回归产生标准曲线;步骤(6)交联剂残留的测定:将步骤(4)中的得到的吸光度带入步骤(5)的标准曲线,得到交联剂的残留含量;所述吸光度测定采用紫外-可见分光光度计。
8.具体的,所述交联剂是胱胺二盐酸盐或3,3
’‑
二硫代双。
9.具体的,所述二硫键交联透明质酸凝胶的浓度为3~30mg/ml。
10.具体的,所述酶是透明质酸酶。
11.具体的,所述透明质酸酶采用0.9%氯化钠溶解,酶活为25~75 u/ml。
12.具体的,所述二硫键交联透明质酸与所述透明质酸酶的体积比(v/v)是1:(1~3)。
13.具体的,所述透明质酸酶的降解条件是在37℃的温度下降解20分钟。
14.具体的,所述离心的条件是在6000转/分钟的转速下离心15分钟。
15.具体的,所述调ph至3~4可调换到步骤(3)的离心前。
16.具体的,所述交联剂的标准溶液的浓度梯度分别为1、2、3、4和5 ppm。
17.具体的,所述超滤离心管的截留分子量不大于10kda。
18.具体的,所述室温的范围是10℃~30℃。
19.analysis for disulfide bonds in peptides and proteins(methods enzymol 1987, 143:115-119)公开了二硫键可与2-硝基-5-硫代磺酸苯甲酸(2-nitro-5-thiosulfobenzoate)(ntsb)发生显色反应,在412nm区域呈现强特征吸收峰,其灵敏度很高,可能可以满足微量残留检测的要求,因此,本发明采用ntsb显色法定量检测二硫键交联透明质酸凝胶中二硫键交联剂的微量残留。
20.首先对二硫键交联透明质酸凝胶进行降解,优选采用透明质酸酶进行降解。需要控制酶溶液的活性和酶解时间,以提高本发明检测方法的准确性。当所采用的透明质酸酶溶液活性太低时,所需降解时间较长,影响检测效率;当酶溶液的活性太高时,降解过快,降解过程不易控制,降解产物分子量较低,不利于后续步骤中的离心超滤分离降解产物,影响检测的准确性。
21.本发明具有的有益效果是:本发明提供的二硫键交联透明质酸凝胶中二硫键交联剂微量残留的检测方法,操作方法简单易行,成本低,准确度高,具有良好的精确性,检测能够达到微克级,能够满足实际检测中的需要。
附图说明
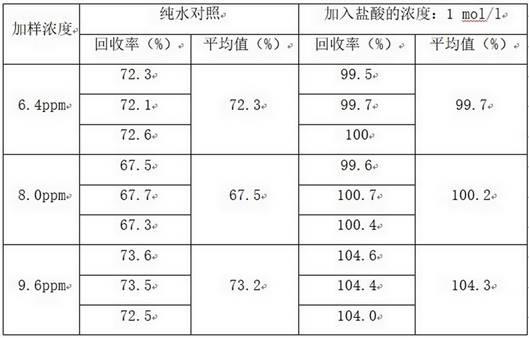
22.为了更清楚地说明本发明的技术方案,下面对本发明所需要使用的附图作简单的介绍,显而易见地,下面描述中的附图仅仅是本发明的一些实施例,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据这些附图获得其他的附图。
23.图1是胱胺二盐酸盐的ntsb显色后的特征吸收谱图;图2是二硫键交联剂的标准曲线。
具体实施方式
24.下面将结合附图,对本发明中的技术方案进行清楚、完整的描述,显然,所描述的实施例是本发明的一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有做出创造性劳动的前提下所获得的所有其它实施例,都属于本发明保护的范围。
25.以下实施例中的设备信息如下:紫外-可见分光光度计(岛津仪器(苏州)有限公司,型号:uv-1900),室温检测。
26.实施例1. 检测条件的确定1.1 ntsb试剂根据analysis for disulfide bonds in peptides and proteins(methods enzymol 1987, 143:115-119)公开的方法配置ntsb试剂。
27.1.2 二硫键交联剂的标准溶液称取二硫键交联剂(胱胺二盐酸盐)0.01g于100ml的容量瓶中,浓度为100μg/ml,定容100ml,然后稀释至不同浓度范围待用。
28.1.3透明质酸酶溶液称取透明质酸酶1mg,加适量0.9%氯化钠溶液,酶的活性浓度为10~100u/ml。
29.1.4 二硫键交联透明质酸的降解取两种浓度((浓度分别为5mg/ml和10mg/ml))的二硫键交联透明质酸钠凝胶(交联剂:胱胺二盐酸盐) 各1 ml,分别置于50ml离心管中,加入透明质酸酶溶液1.92ml,在37℃恒温振荡器中,振荡10~20min。
30.当所采用的透明质酸酶溶液活性太低时,所需降解时间较长,影响检测效率;当酶溶液的活性太高时,降解过快,降解过程不易控制,降解产物分子量较低,不利于后续步骤中的离心超滤分离降解产物,影响检测的准确性。酶的活性浓度以25~75 u/ml为宜,优选50u/ml。当酶的活性浓度为50u/ml时,分别观察不同酶解时间的样品(10min、15min、20min),在酶解10min和15min时,两种浓度的二硫键交联透明质酸钠凝胶降解均不够完全,可观察到明显的颗粒;酶解20min时,颗粒完全降解消失,两种浓度的二硫键交联透明质酸钠凝胶的降解产物为均一透明溶液。因此,在本发明步骤(1)中,透明质酸酶溶液的活性优选50u/ml时,酶解时间优选20min。
31.1.5降解产物溶液的超滤离心分离酶降解产物溶液置于超滤离心管,根据超滤离心管的截留分子量,低于截留分子量的小分子在离心力的作用下进入滤过液,从而实现分离。二硫键交联剂的分子量通常在100~1000da之间(例如,胱胺二盐酸盐为225 da,3,3
’‑
二硫代双(丙酰肼)为238 da),因此超滤离心管的截留分子量优选10kda或更低。6000转/分钟,离心15分钟,降解产物中的二硫键交联剂残留进入超滤离心的滤液。
32.1.6 检测波长的确定二硫键交联剂的ntsb显色后在412nm区域特征吸收峰具有良好的专属性,胱胺二
盐酸盐的ntsb显色后的特征吸收谱图参见图1。其特征吸收峰的最大吸收波长在410~414nm,优选412nm。
33.透明质酸酶等试剂和二硫键交联透明质酸凝胶及其降解产物本身在412nm区域处没有吸收,不存在干扰。此外,经优化降解参数,二硫键交联透明质酸凝胶的降解产物被超滤离心截留,不会进入滤液,因而亦不会干扰ntsb试剂的显色反应,只有二硫键交联剂残留进入超滤离心的滤液,从而与ntsb试剂反应显色。
34.1.7 降解产物溶液ph值的调节降解产物溶液的ph调节对检测精密性具有重要影响,显著影响了加样回收率。
35.按照如下过程考察降解产物溶液ph值对加样回收率的影响:在上述1.5步骤中得到的酶降解产物溶液中加入0.08ml 1mol/l的盐酸(ph 3.2)(以纯水为对照),然后加入三种不同浓度(6.4、8.0、9.6ppm)的二硫键交联剂(胱胺二盐酸盐)的标准溶液1ml,将摇匀的样品倒入超滤离心管中,离心过滤(6000转/分钟,离心15分钟);移取滤过液2ml,加入2ml ntsb试剂,室温反应25分钟,412nm波长处测定吸光度。平行试验3次,各组的代表性回收率结果总结如下表1:表1所加入的0.08 ml盐酸(1mol/l)对检测方法的精密性具有重要的影响,显著提高了加样回收率。当加入的盐酸浓度为0 mol/l(纯水对照),加样回收率仅为67.5~73.2%,不能满足检测方法中关于加样回收率的要求(80~120%)。本发明进行各种尝试,终于发现在酶降解产物溶液加入适当的盐酸,调节ph值为酸性(3~4),显著提高了加样回收率(99.7~104.3%),可以很好满足80~120%加样回收率的要求。因此在本发明中,在降解产物溶液中加入适量酸,调节其ph值为酸性,所采用的酸通常为稀盐酸,酸性ph值优选3~4。
36.实施例2. 标准曲线的建立取纯水1ml,至于50ml离心管中,加入50u/ml的酶溶液1.92ml,在37℃恒温振荡器中,振荡20min,加入0.08ml的1mol/l的盐酸溶液(调ph3~4),摇匀,加入不同浓度二硫键交
联剂(胱胺二盐酸盐)标注溶液1ml,将摇匀的样品倒入超滤离心管中,离心过滤(6000转/分钟,离心15分钟),移取离心后下面的溶液2ml和2ml ntsb分析液,室温下反应25分钟,412nm波长处测定吸光度。
37.吸光度检测结果如下表2(以不经ntsb显色,二硫键245nm的弱特征吸收为对照):表2通过标准曲线可以看出(图2),二硫键交联剂在1~5ppm范围内有良好的线性范围,其线性相关系数(r2)为0.9999,满足检测方法关于线性相关系数(r2)大于0.998的要求。
38.二硫键通常在245nm区域呈现弱吸收,浓度较低时该吸收峰几乎不可见,不能满足二硫键交联剂微量残留的检测要求。
39.实施例3. 检测限和定量限根据《中华人民共和国药典(2020版四部)》指导原则9101《分析方法验证指导原则》确定检测限和定量限。
40.检测限lod=3.3δ/s定量限lod=10δ/s其中δ为10个空白值的标准偏差,s为标准曲线的斜率。
41.检测结果如下表3:表3 实施例4. 精密性按照实施例2的步骤测定,配制6份二硫键交联剂(胱胺盐酸盐)样品(浓度2.5ppm),测定6次,记录吸光度,并且计算相对标准偏差。检测结果如下表4:表4
rsd约为0.6%,具有良好的精密性,满足rsd≤2%的目标要求。
42.实施例5. 准确性 参见实施例1第1.7部分。采用加样回收试验法,在二硫键交联透明质酸凝胶中加入三个不同浓度的二硫键交联剂(胱胺二盐酸盐)标准溶液(6.4ppm、8.0ppm和9.6ppm),测定回收率为99.7~104.3%(rsd 2.2%),可以很好满足80~120%加样回收率的要求。
43.实施例6. 耐用性按照实施例2的步骤测定,配制9份二硫键交联剂(胱胺二盐酸盐)标准溶液(2ppm),412
±
2nm测定吸收,并且计算相对标准偏差。检测结果如下表5:表5rsd为6.95%,具有良好的耐用性,满足rsd≤12%的目标要求。
44.实施例7. 方法的应用取3批次二硫键交联透明质酸凝胶(交联剂:胱胺二盐酸盐)1ml(浓度是10mg/ml),至于50ml离心管中,加入50u/ml的酶溶液1.92ml,在37℃恒温振荡器中,振荡20min,加入0.08ml的1mol/l的盐酸溶液,摇匀,加入纯水1ml,将摇匀的样品倒入超滤离心管中,离心过滤(6000转/分钟,离心15分钟),移取离心后下面的溶液2ml和2ml ntsb分析液,室温下反应25分钟,412nm波长处测定吸光度。根据实施例2建立的标准曲线,计算二硫键交联剂的微量残余。
45.检测结果显示,上述3批次的二硫键交联剂的微量残余在0.5~0.8ppm之间,符合规定。
46.根基ich《q3ar2:新药制剂中的杂质》关于每日最大剂量(大于2g)的药物中的降解产物的鉴定限度为0.1%,以二硫键交联透明质酸有效成分计(10mg/ml),其签订限度为
10ppm。
47.以上所述仅为本发明的较佳实施例而已,并不用以限制本发明,凡在本发明的精神和原则之内,所做的任何修改、等同替换、改进等,均应包含在本发明保护的范围之内。
再多了解一些
本文用于创业者技术爱好者查询,仅供学习研究,如用于商业用途,请联系技术所有人。