1.本发明属于医药领域,具体涉及荜茇酰胺类似物、药物组合物及其制备方法和在制备抗肿瘤药物中的用途。
背景技术:
2.恶性肿瘤严重威胁着人类的生命健康,是全球人类死亡的主要原因之一。现阶段,恶性肿瘤的主要治疗方法有:手术切除、放射治疗、药物治疗、生物治疗等。然而,即使经过以上治疗,肿瘤的远端转移和复发的概率依旧高居不下,使恶性肿瘤治疗成为世界范围最具有挑战性的难题之一。当前,药物治疗仍是肿瘤治疗的主要方法。目前临床上应用的抗肿瘤药物都存在共同的问题:药物选择性较差、毒副作用较大、并且容易产生耐药性。因此,急需研究出新的抗肿瘤药物来解决这些问题。
3.天然产物是开发临床治疗药物的重要来源。天然产物的结构具有高度的化学多样性和生化特异性,这些特征使其很适合作为药物发现的先导结构。但它们一般对肿瘤细胞的选择性较差,往往会导致严重的毒副作用,比如抗恶性肿瘤药物紫杉醇、长春碱、喜树碱等。因此,迫切需要寻找一种选择性较好的药物。
4.荜茇酰胺(piperlongumine,pl),又称荜拔明碱,是从植物荜茇中分离出的一种生物碱类化合物。它的分子式是c
17h19
no5,分子量为317.34,具有顺式(cis)和反式(trans)两种异构体,天然植物中存在的荜茇酰胺主要是反式的,反式荜茇酰胺也是其活性主要形式,顺式荜茇酰胺未表现出明显的细胞毒性。如无特殊说明,本文中的荜茇酰胺均是指反式构型。荜茇酰胺是一种具有广谱生物活性的天然产物,如抗肿瘤、抗炎、抗血小板凝血、抗糖尿病、神经保护作用等。其中荜茇酰胺的抗肿瘤活性成为科研工作者们研究的热点,因其对多种肿瘤细胞展现出优越的选择性抑制作用,而对正常细胞没有表现出明显的毒副作用。这一优异的特点,使得荜茇酰胺成为具有重要价值的先导化合物,为研发高效、低毒的抗肿瘤新药提供了重要的结构基础。因此,本发明旨在探索出具有更好抗肿瘤活性的荜茇酰胺类似物。
5.
技术实现要素:
6.为改善上述技术问题,本发明提供一种式i所示的化合物,其消旋体、立体异构体、
互变异构体、同位素标记物、溶剂化物、多晶型物、前药或它们药学上可接受的盐:
[0007][0008]
其中,r1选自无取代或任选被一个、两个或更多个ra取代的芳基、杂芳基、杂环基;
[0009]
r2不存在或选自无取代或任选被一个、两个或更多个rb取代亚烯基、亚芳基、亚杂芳基;
[0010]
r3选自h、无取代或任选被一个、两个或更多个rc取代烷基、烷氧基、卤代烷基;
[0011]
r4选自c(o)、s(o)2;
[0012]
r5选自h、卤素、烷基、烷氧基、卤代烷基;
[0013]
每个ra、rb、rc相同或不同,彼此独立地选自h、no2、cn、oh、cooh、卤素、氧代(=o)、烷基、烷氧基、环烷基、芳基、杂芳基、杂环基。
[0014]
根据本发明的实施方案,r1可以选自无取代或任选被一个、两个或更多个ra取代的c
6-14
芳基、5-14元杂芳基、3-14元杂环基;
[0015]
r2可以不存在或选自无取代或任选被一个、两个或更多个rb取代亚c
2-12
烯基、亚c
6-14
芳基、亚5-14元杂芳基;
[0016]
r3可以选自h、无取代或任选被一个、两个或更多个rc取代c
1-12
烷基、c
1-12
烷氧基、卤代c
1-12
烷基;
[0017]
r4可以选自c(o)、s(o)2;
[0018]
r5可以选自h、卤素、c
1-12
烷基、c
1-12
烷氧基、卤代c
1-12
烷基;
[0019]
每个ra、rb、rc相同或不同,彼此独立地选自h、no2、cn、oh、cooh、卤素、氧代(=o)、c
1-12
烷基、c
1-12
烷氧基、c
3-12
环烷基、c
6-14
芳基、5-14元杂芳基、3-14元杂环基。
[0020]
根据本发明的实施方案,r1可以选自无取代或任选被一个、两个或更多个ra取代的c
6-14
芳基、5-14元杂芳基、3-14元杂环基;
[0021]
r2可以不存在或选自无取代或任选被一个、两个或更多个rb取代亚c
2-6
烯基、亚c
6-14
芳基、亚5-14元杂芳基;
[0022]
r3可以选自h、无取代或任选被一个、两个或更多个rc取代c
1-6
烷基、c
1-6
烷氧基、卤代c
1-6
烷基;
[0023]
r4可以选自c(o)、s(o)2;
[0024]
r5可以选自h、卤素、c
1-6
烷基;
[0025]
每个ra、rb、rc相同或不同,彼此独立地选自h、no2、cn、卤素、氧代(=o)、c
1-6
烷基、c
1-6
烷氧基。
[0026]
根据本发明的实施方案,r1可以选自无取代或任选被一个、两个或更多个ra取代的下列基团:苯基、萘基、苯并吡嗪基、喹啉基、4h-色烯-4酮基、咔唑基、苯并呋喃基、二苯并呋喃基、2,3-二氢苯并呋喃基、1,3-苯并二氧杂环己烷基、苯并[b]噻吩基、二苯并噻吩基;
[0027]
r2可以不存在或选自无取代或任选被一个、两个或更多个rb取代亚苯基、亚咪唑基、亚吡啶基、亚乙烯基、亚丙烯基;
[0028]
r3可以选自h、甲基;
[0029]
r4可以选自c(o)、s(o)2;
[0030]
r5可以选自h、f、cl、br、i;
[0031]
ra选自h、no2、f、cl、br、i、氧代(=o)、甲基、甲氧基;
[0032]
rb选自h、甲基。
[0033]
优选地,r1为喹啉基,r2为反式亚乙烯基,r3为h,r4为c(o),r5为cl。
[0034]
根据本发明示例性的实施方案,式i化合物选自如下结构:
[0035]
[0036]
[0037][0038]
本发明还提供式i所示化合物的制备方法,包括以下步骤:
[0039][0040]
其中,r1、r2、r3、r4和r5独立地具有上文所述的定义;x选自卤素或oc(o)-c
1-6
烷基,例如为cl或oc(o)c(ch3)3;
[0041]
化合物a与化合物b反应得到式i所示的化合物;
[0042]
根据本发明的实施方案,所述反应在碱作用下进行,所述碱可以为有机金属试剂,例如为正丁基锂、叔丁基锂、甲基锂、二异丙基氨基锂;
[0043]
根据本发明的实施方案,所述反应可以在有机溶剂存在下进行,所述有机溶剂可以例如为二氧六环、四氢呋喃、2-甲基四氢呋喃中的至少一种。
[0044]
本发明还提供一种药物组合物,其包含治疗有效量的式i所示的化合物、其消旋体、立体异构体、互变异构体、同位素标记物、溶剂化物、多晶型物、前药或它们药学上可接受的盐中的至少一种。
[0045]
根据本发明的实施方案,所述药物组合物还包括一种或多种药学上可接受的辅料。
[0046]
根据本发明的实施方案,所述药物组合物还可以进一步含有一种或多种额外的治疗剂。
[0047]
本发明还提供治疗或预防肿瘤疾病的方法,包括给予患者预防或治疗有效量的式i所示的化合物、其消旋体、立体异构体、互变异构体、同位素标记物、溶剂化物、多晶型物、前药或它们药学上可接受的盐中的至少一种。
[0048]
本发明还提供治疗或预防肿瘤疾病的方法,包括给予患者预防或治疗有效量的上述药物组合物。
[0049]
所述肿瘤可以为白血病细胞、乳腺癌细胞、肝癌细胞、肺癌细胞、胃癌细胞和宫颈癌细胞;优选为u937白血病细胞、mcf7乳腺癌细胞、hepg2肝癌细胞、a549肺癌细胞、mgc-803胃癌细胞和hela宫颈癌细胞。
[0050]
在一些实施方案中,所述患者哺乳动物,优选是人。
[0051]
本发明还提供式i所示的化合物、其消旋体、立体异构体、互变异构体、同位素标记
物、溶剂化物、多晶型物、前药或它们药学上可接受的盐中的至少一种在制备药物中的用途。
[0052]
根据本发明的实施方案,所述药物为抗肿瘤药物,如广谱抗肿瘤药物。
[0053]
根据本发明的实施方案,所述肿瘤可以为白血病细胞、乳腺癌细胞、肝癌细胞、肺癌细胞、胃癌细胞和宫颈癌细胞;优选为u937白血病细胞、mcf7乳腺癌细胞、hepg2肝癌细胞、a549肺癌细胞、mgc-803胃癌细胞和hela宫颈癌细胞。
[0054]
有益效果
[0055]
本发明提供了一种荜茇酰胺类似物及其制备方法和在抗肿瘤中的应用。本发明的化合物对包括但不限于对u937(人白血病细胞)、mcf7(人乳腺癌细胞)、hepg2(人肝癌细胞)、a549(人肺癌细胞)、mgc-803(人胃癌细胞)和hela(人宫颈癌细胞)在内的多种肿瘤有明显的抑制作用。可用于制备抗肿瘤药物。
[0056]
术语定义与说明
[0057]
除非另有说明,本技术说明书和权利要求书中记载的基团和术语定义,包括其作为实例的定义、示例性的定义、优选的定义、表格中记载的定义、实施例中具体化合物的定义等,可以彼此之间任意组合和结合。这样的组合和结合后的基团定义及化合物结构,应当属于本技术保护的范围内。
[0058]
除非另有说明,本说明书和权利要求书记载的数值范围相当于至少记载了其中每一个具体的整数数值。例如,数值范围“1-40”相当于记载了数值范围“1-12”中的每一个整数数值即1、2、3、4、5、6、7、8、9、10、11、12,以及数值范围“13-40”中的每一个整数数值即13、14、15、16、17、18、19、20、21、22、23、24、25、26、27、28、29、30、31、32、33、34、35、36、37、38、39、40。此外,当某些数值范围被定义为“数”时,应当理解为记载了该范围的两个端点、该范围内的每一个整数以及该范围内的每一个小数。例如,“0~10的数”应当理解为不仅记载了0、1、2、3、4、5、6、7、8、9和10的每一个整数,还至少记载了其中每一个整数分别与0.1、0.2、0.3、0.4、0.5、0.6、0.7、0.8、0.9的和。
[0059]
应当理解,本文在描述一个、两个或更多个中,“更多个”应当是指大于2,例如大于等于3的整数,例如3、4、5、6、7、8、9或10。
[0060]
本发明使用的“卤素”指氟、氯、溴或碘。
[0061]
术语“烷基”应理解为表示具有1~40个碳原子,例如1-20个碳原子的直链或支链饱和烃基。“c
1-12
烷基”应理解为表示具有1~12个碳原子的直链或支链饱和一价烃基。例如,“c
1-10
烷基”表示具有1、2、3、4、5、6、7、8、9或10个碳原子的直链和支链烷基,“c
1-8
烷基”表示具有1、2、3、4、5、6、7、或8个碳原子的直链和支链烷基,“c
1-6
烷基”表示具有1、2、3、4、5或6个碳原子的直链和支链烷基。所述烷基是例如甲基、乙基、丙基、丁基、戊基、己基、异丙基、异丁基、仲丁基、叔丁基、异戊基、2-甲基丁基、1-甲基丁基、1-乙基丙基、1,2-二甲基丙基、新戊基、1,1-二甲基丙基、4-甲基戊基、3-甲基戊基、2-甲基戊基、1-甲基戊基、2-乙基丁基、1-乙基丁基、3,3-二甲基丁基、2,2-二甲基丁基、1,1-二甲基丁基、2,3-二甲基丁基、1,3-二甲基丁基或1,2-二甲基丁基等或它们的异构体。
[0062]
术语“环烷基”应理解为表示饱和的单环、二环(如稠环、桥环、螺环)烃环或三环烷烃,其具有3~20个碳原子,优选“c
3-12
环烷基”,更优选优选“c
3-8
环烷基”。“c
3-12
环烷基”应理解为表示饱和的一价单环、二环(如稠环、桥环、螺环)烃环或三环烷烃,其具有3~12个碳原
子,优选“c
3-10
环烷基”,更优选优选“c
3-8
环烷基”。术语“c
3-10
环烷基”应理解为表示饱和的一价单环、双环(如桥环、螺环)烃环或三环烷烃,其具有3、4、5、6、7、8、9或10个碳原子。所述c
3-10
环烷基可以是单环烃基,如环丙基、环丁基、环戊基、环己基、环庚基、环辛基、环壬基或环癸基,或者是双环烃基如龙脑基、吲哚基、六氢吲哚基、四氢萘基、十氢萘基、二环[2.1.1]己基、二环[2.2.1]庚基、二环[2.2.1]庚烯基、6,6-二甲基二环[3.1.1]庚基、2,6,6-三甲基二环[3.1.1]庚基、二环[2.2.2]辛基、2,7-二氮杂螺[3,5]壬烷基、2,6-二氮杂螺[3,4]辛烷基,或者是三环烃基如金刚烷基。
[0063]
术语“芳基”应理解为优选表示具有6-20个碳原子(例如6、7、8、9、10、11、12、13、14、15、16、17、18、19、20个碳原子)的芳香性或部分芳香性的单环、双环或三环烃环。“c
6-14
芳基”应理解为优选表示具有6、7、8、9、10、11、12、13或14个碳原子的一价芳香性或部分芳香性的单环、双环或三环烃环(“c
6-14
芳基”),特别是具有6个碳原子的环(“c6芳基”),例如苯基;或联苯基,或者是具有9个碳原子的环(“c9芳基”),例如茚满基或茚基,或者是具有10个碳原子的环(“c
10
芳基”),例如四氢化萘基、二氢萘基或萘基,或者是具有13个碳原子的环(“c
13
芳基”),例如芴基,或者是具有14个碳原子的环(“c
14
芳基”),例如蒽基。当所述c
6-14
芳基被取代时,其可以为单取代或者多取代。并且,对其取代位点没有限制,例如可以为邻位、对位或间位取代。术语“芳基”还包括具有两个或更多个环的多环环系,其中两个或更多个碳为两个相邻环所共有(所述环为“稠环”),其中至少一个环是芳族的且其它环例如可以是环烷基、环烯基、环炔基、芳基和/或杂环基。多环的实例包括但不限于2,3-二氢-1,4-苯并二氧杂环己二烯和2,3-二氢-1-苯并呋喃。
[0064]
术语“杂芳基”应理解为包括这样的单环、二环(如稠环、桥环、螺环)或三环芳族环系:其具有5~20个环原子且包含一个或多个(例如1-5个)独立选自n、o和s的杂原子,例如“5-14元杂芳基”。“5-14元杂芳基”应理解为包括这样的一价单环、双环或三环芳族环系:其具有5、6、7、8、9、10、11、12、13或14个环原子,特别是5或6或9或10个碳原子,且其包含1-5个,优选1-3各独立选自n、o和s的杂原子并且,另外在每一种情况下可为苯并稠合的。“杂芳基”还指其中杂芳族环与一个或多个芳基、脂环族或杂环基环稠合的基团,其中所述连接的根基或点在杂芳族环上。当所述5-14元杂芳基与其它基团相连构成本发明的化合物时,可以为5-14元杂芳基环上的碳原子与其它基团相连,也可以为5-14元杂芳基环上的杂原子与其它基团相连。当所述5-14元杂芳基被取代时,其可以为单取代或者多取代。并且,对其取代位点没有限制,例如可以为杂芳基环上与碳原子相连的氢被取代,或者杂芳基环上与杂原子相连的氢被取代。杂芳基的实例包括但不限于吡啶基、嘧啶基、吡嗪基、哒嗪基、三嗪基、呋喃基、喹啉基、异喹啉基、噻吩基、咪唑基、噻唑基、吲哚基、吡咯基、噁唑基、苯并呋喃基、苯并噻吩基、苯并噻唑基、异噁唑基、吡唑基、三唑基、四唑基、吲唑基、1,2,4-噻二唑基、异噻唑基、苯并噻吩基、嘌呤基、咔唑基、苯并咪唑基、苯并噁唑基、氮杂苯并噁唑基、咪唑并噻唑基、苯并[1,4]二氧杂环己烯基、苯并[1,3]二氧杂环戊烯基等。在一些实施方案中,杂芳基具有3至40个碳原子且在其它实施方案中具有3至20个碳原子。在一些实施方案中,杂芳基包含3至14个、4至14个、3至7个或5至6个成环原子。在一些实施方案中,杂芳基具有1至4个、1至3个或1至2个杂原子。在一些实施方案中,杂芳基具有1个杂原子。
[0065]
术语“杂环基”是指饱和或不饱和的非芳族的环或环系,其包含一个或多个独立选自n、o和s的杂原子且总成环原子数为3-20(如原子数为3、4、5、6、7、8、9、10等)。“3-12元杂
环基”是指饱和的或不饱和的非芳族的环或环系,例如,其是4-、5-、6-或7-元的单环、7-、8-、9-、10-、11-或12-元的二环(如稠环、桥环、螺环)或者三环环系,并且含有至少一个,例如1、2、3、4、5个或更多个选自o、s和n的杂原子,其中n和s还可以任选被氧化成各种氧化状态,以形成氮氧化物、-s(o)-或-s(o)
2-的状态。优选地,所述杂环基可以选自“3-10元杂环基”。术语“3-10元杂环基”意指饱和的或不饱和的非芳族的环或环系,并且含有至少一个选自o、s和n的杂原子。所述杂环基可以通过所述碳原子中的任一个或氮原子(如果存在的话)与分子的其余部分连接。所述杂环基可以包括稠合的或桥连的环以及螺环的环。特别地,所述杂环基可以包括但不限于:4元环,如氮杂环丁烷基、氧杂环丁烷基;5元环,如四氢呋喃基、二氧杂环戊烯基、吡咯烷基、咪唑烷基、吡唑烷基、吡咯啉基;或6元环,如四氢吡喃基、哌啶基、吗啉基、二噻烷基、硫代吗啉基、哌嗪基或三噻烷基;或7元环,如二氮杂环庚烷基。任选地,所述杂环基可以是苯并稠合的。所述杂环基可以是双环的,例如但不限于5,5元环,如六氢环戊并[c]吡咯-2(1h)-基环,或者5,6元双环,如六氢吡咯并[1,2-a]吡嗪-2(1h)-基环。杂环基可以是部分不饱和的,即它可以包含一个或多个双键,例如但不限于二氢呋喃基、二氢吡喃基、2,5-二氢-1h-吡咯基、4h-[1,3,4]噻二嗪基、1,2,3,5-四氢噁唑基或4h-[1,4]噻嗪基,或者,它可以是苯并稠合的,例如但不限于二氢异喹啉基。所述3-12元杂环基与其它基团相连构成本发明的化合物时,可以为3-12元杂环基上的碳原子与其它基团相连,也可以为3-12元杂环基环上杂环原子与其它基团相连。,除非另有说明,其可通过碳或氮来连接,其中-ch
2-基团任选被-c(o)-代替;及其中除非另有相反说明,环氮原子或环硫原子任选被氧化以形成n-氧化物或s-氧化物或环氮原子任选被季铵化;其中环中的-nh任选被乙酰基、甲酰基、甲基或甲磺酰基取代;及环任选被一个或多个卤素取代。应该理解的是,当杂环基中s原子和o原子的总数超过1时,这些杂原子不彼此相邻。若所述杂环基为二环或三环,则至少一个环可任选为杂芳族环或芳族环,条件是至少一个环是非杂芳族的。若所述杂环基为单环,则其一定不是芳族的。杂环基的实例包括但不限于哌啶基、n-乙酰基哌啶基、n-甲基哌啶基、n-甲酰基哌嗪基、n-甲磺酰基哌嗪基、高哌嗪基、哌嗪基、氮杂环丁烷基、氧杂环丁烷基、吗啉基、四氢异喹啉基、四氢喹啉基、二氢吲哚基、四氢吡喃基、二氢-2h-吡喃基、四氢呋喃基、四氢噻喃基、四氢噻喃-1-氧化物、四氢噻喃-1,1-二氧化物、1h-吡啶-2-酮和2,5-二氧代咪唑烷基。
[0066]
术语“螺环”是指两个环共用1个成环原子的环系。
[0067]
术语“稠环”是指两个环共用2个成环原子的环系。
[0068]
术语“桥环”是指两个环共用3个以上成环原子的环系。
[0069]
除非另有说明,杂环基、杂芳基或亚杂芳基包括其所有可能的异构形式,例如其位置异构体。因此,对于一些说明性的非限制性实例,可以包括在其1-、2-、3-、4-、5-、6-、7-、8-、9-、10-、11-、12-位等(如果存在)中的1、2个或更多个位置上取代或与其他基团键合的形式,包括吡啶-2-基、亚吡啶-2-基、吡啶-3-基、亚吡啶-3-基、吡啶-4-基和亚吡啶-4-基;噻吩基或亚噻吩基包括噻吩-2-基、亚噻吩-2-基、噻吩-3-基和亚噻吩-3-基;吡唑-1-基、吡唑-3-基、吡唑-4-基、吡唑-5-基。
[0070]
术语“亚*基”表示有两个键被取代的二价基团。
[0071]
式i化合物还包括其各自所有可能的立体异构体,其是单一立体异构体或所述立体异构体(例如r-异构体或s-异构体,或者e-异构体或z-异构体)的任意比例的任意混合物
的形式。可通过任意适合的现有技术方法(例如色谱法,特别是例如手性色谱法)实现本发明的化合物的单一立体异构体(例如单一对映异构体或单一非对映异构体)的分离。另外,所述化合物还可以互变异构体的形式存在。本发明式i化合物包括所有可能的互变异构体,其是单一互变异构体或所述互变异构体的任意比例的任意混合物的形式。所有这些异构体及它们的混合物都包括在本发明中。
[0072]
本发明的式i化合物、其异构体、前药、药学上可接受的盐以及复合物可以分别以溶剂合物如水合物的形式存在,其中本发明的化合物包含作为所述化合物晶格的结构要素的极性溶剂,特别是例如水、甲醇或乙醇。极性溶剂特别是水的量可以化学计量比或非化学计量比存在。在化学计量溶剂合物(例如水合物)的情况下,可能分别是半溶剂合物、一溶剂合物、倍半溶剂合物、二溶剂合物、三溶剂合物、四溶剂合物、五溶剂合物、半五溶剂合物等。本发明包括所有此类溶剂合物,特别是水合物。
[0073]
本发明式i化合物的药学上可接受的盐可以是例如在链或环中具有氮原子或其他碱性基团的、具有足够碱性的本发明的化合物的酸加成盐,例如与如下无机酸形成的酸加成盐:例如盐酸、氢溴酸、氢碘酸、硫酸、焦硫酸、磷酸或硝酸,或者与如下有机酸形成的酸加成盐:例如甲酸、乙酸、乙酰乙酸、丙酮酸、三氟乙酸、丙酸、丁酸、己酸、庚酸、十一烷酸、月桂酸、苯甲酸、水杨酸、2-(4-羟基苯甲酰基)苯甲酸、樟脑酸、肉桂酸、环戊烷丙酸、二葡糖酸、3-羟基-2-萘甲酸、烟酸、扑酸、果胶酯酸、过硫酸、3-苯基丙酸、苦味酸、特戊酸、2-羟基乙磺酸、衣康酸、氨基磺酸、三氟甲磺酸、十二烷基硫酸、乙磺酸、苯磺酸、对甲苯磺酸、甲磺酸、2-萘磺酸、萘二磺酸、樟脑磺酸、柠檬酸、酒石酸、硬脂酸、乳酸、草酸、丙二酸、琥珀酸、苹果酸、己二酸、藻酸、马来酸、富马酸、d-葡糖酸、扁桃酸、抗坏血酸、葡庚酸、甘油磷酸、天冬氨酸、磺基水杨酸、半硫酸或硫氰酸。
[0074]
另外,具有足够酸性的本发明的化合物的另一种适合的药学上可接受的盐是碱金属盐(例如钠盐或钾盐)、碱土金属盐(例如钙盐或镁盐)、铵盐,或与提供生理学可接受的阳离子的有机碱形成的盐,例如与如下物质形成的盐:n-甲基葡糖胺、二甲基葡糖胺、乙基葡糖胺、赖氨酸、二环己基胺、1,6-己二胺、乙醇胺、葡糖胺、肌氨酸、丝氨醇、三羟基甲基氨基甲烷、氨基丙二醇、1-氨基-2,3,4-丁三醇。另外,碱性含氮基团可用如下试剂季铵化:低级烷基卤化物,例如甲基、乙基、丙基和丁基氯化物、溴化物和碘化物;硫酸二烷基酯,例如硫酸二甲酯、硫酸二乙酯、硫酸二丁酯和硫酸二戊酯;长链卤化物,例如癸基、月桂基、肉豆蔻基和硬脂基氯化物、溴化物和碘化物;芳烷基卤化物如苄基和苯乙基溴化物等。
[0075]
并且,所述药学上可接受的盐还应当包括部分为内盐形式的化合物的药学上可接受的盐。
具体实施方式
[0076]
下文将结合具体实施例对本发明的技术方案做更进一步的详细说明。应当理解,下列实施例仅为示例性地说明和解释本发明,而不应被解释为对本发明保护范围的限制。凡基于本发明上述内容所实现的技术均涵盖在本发明旨在保护的范围内。
[0077]
除非另有说明,以下实施例中使用的原料和试剂均为市售商品,或者可以通过已知方法制备。
[0078]
本发明式i化合物可通过本领域已知的制备方法和工艺参数进行制备。作为实例,
本发明还提供式i化合物的制备方法,包括如下路线实施例1~9中的一个或多个步骤:
[0079]
以下实施例的反应路线中使用的英文具有以下含义:dry表示干燥的;reflux表示回流;overnight表示反应过夜;grubbs 2nd-gen.catalyst表示grubbs ii代催化剂;dimethyl succinate表示丁二酸二甲酯;pivaloyl chloride表示新戊酰氯;dioxane表示1,4-二氧六环;bis(pinacolato)dibron表示双(频哪醇合)二硼;pyridine表示吡啶;carboxyacetic acid表示丙二酸,也称缩苹果酸;tosmic表示对甲苯磺酰甲基异腈;其它英文缩写参考本领域常用解释。
[0080]
实施例1
[0081][0082]
化合物4a的制备:将3-丁烯胺盐酸盐(1.2g,11.155mmol)加入到50ml反应瓶中,加入16ml无水二氯甲烷,搅拌溶解,放入冰水浴中,在氩气保护下依次加入et3n(3.2ml,22.309mmol),dmap(141mg,1.116mmol),2-丁烯酰氯(1.3ml,13.385mmol),然后体系在室温下反应2h。tlc监测反应完后,加入饱和nahco3溶液,用二氯甲烷萃取三次,收集有机相,然后加入适量饱和食盐水洗涤一次,再用无水硫酸镁干燥,过滤,浓缩,得到黄色油状物,经硅胶柱层析纯化,洗脱剂为石油醚:乙酸乙酯(2:1),得到化合物3,透明油状液体,1.358g,收率为87.6%。1h nmr(400mhz,cdcl3)δ6.85
–
6.73(m,1h),6.01(s,1h),5.85
–
5.68(m,2h),5.06(dd,j=15.4,7.8hz,2h),3.36(q,j=6.4hz,2h),2.31
–
2.21(m,2h),1.82(dd,j=6.9,1.0hz,3h).
[0083][0084]
将化合物3(1.358g,9.769mmol)加入到500ml反应瓶中,加入350ml无水二氯甲烷,搅拌溶解,除去溶剂中的氧气,加入grubbs ii代催化剂(207mg,0.244mmol),再除一次溶剂中的氧气,将反应瓶转移至40℃油浴中,在氩气保护下回流2h。tlc监测反应完后,体系冷却至室温,搅拌1h,减压浓缩后得到棕色油状物,柱层析纯化,洗脱剂为石油醚:乙酸乙酯(1:
1),得到化合物4a,棕色固体,898mg,收率为94.7%。1h nmr(400mhz,cdcl3)δ7.04(s,1h),6.66(dt,j=9.8,4.2hz,1h),5.90(dd,j=9.9,1.7hz,1h),3.42(td,j=7.2,2.4hz,2h),2.41
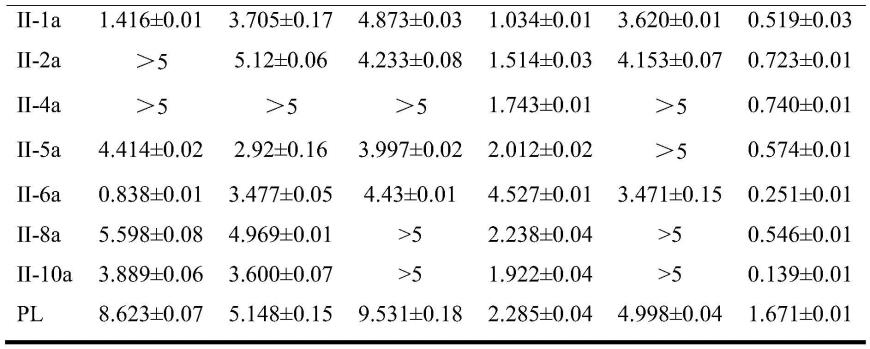
–
2.26(m,2h).
[0085]
实施例2
[0086][0087]
化合物4b的制备:将2-哌啶酮(2g,20.202mmol)加入到50ml反应瓶中,加入25ml无水二氯甲烷,搅拌溶解,置于冰水浴中,在氩气保护下分批缓慢加入五氯化磷(8.4g,40.404mmol),在冰水浴中继续搅拌10min,然后加入zni2(194mg,0.606mmol),体系从冰水浴中取出,回暖至室温搅拌1h,缓慢加入br2(2.1ml,40.404mmol),室温搅拌12h。tlc监测反应完后,体系倒入冰水中,搅拌1h,用二氯甲烷萃取三次,收集有机相,然后加入适量饱和食盐水洗涤一次,再用无水硫酸镁干燥,过滤,浓缩后柱层析纯化,洗脱剂为石油醚:乙酸乙酯(2:1),得到化合物6b,棕色固体,3.05g,产率58.7%。1h nmr(400mhz,cdcl3)δ7.21(s,1h),3.51
–
3.44(m,2h),2.98(dd,j=7.3,4.4hz,2h),2.06
–
1.99(m,2h).
[0088][0089]
将化合物6b(3.05g,11.87mmol)加入到50ml反应瓶中,加入20ml无水dmf,搅拌溶解,再依次加入碳酸锂(1.7g,22.55mmol)和氯化锂(513mg,12.1074mmol),体系转移至130℃油浴,在氩气保护下反应8h。tlc监测反应完后,体系冷却至室温,过滤,减压除去溶剂,用乙酸乙酯萃取三次,收集有机相,然后适量饱和食盐水洗涤一次,再用无水硫酸镁干燥,过滤,浓缩后柱层析纯化,洗脱剂为石油醚:乙酸乙酯(1:1),得到化合物4b,棕色固体,1.56g,产率74.7%。1h nmr(400mhz,cdcl3)δ7.45(s,1h),7.05(t,j=4.6hz,1h),3.49(td,j=7.1,2.6hz,2h),2.43(td,j=7.1,4.7hz,2h).
[0090][0091]
化合物4c的制备:将2-哌啶酮(2g,20.202mmol)加入到100ml反应瓶中,加入60ml氯仿,放入冰水浴中,在氩气保护下分批加入五氯化磷(12.6g,60.606mmol),转移至室温继续搅拌10min,体系转移至65℃油浴,在氩气保护下反应12h。tlc监测反应完后,体系冷却至室温,倒入冰水中,用氢氧化钠溶液调节ph至8~11,用二氯甲烷萃取三次,收集有机相,然后加入适量饱和食盐水洗涤一次,再用无水硫酸镁干燥,过滤,浓缩后加入少量二氯甲烷,过滤得到化合物6c,黄色固体,2.3g,产率65.7%。1h nmr(400mhz,cdcl3)δ7.51(s,1h),3.44(td,j=6.2,2.4hz,2h),2.81
–
2.74(m,2h),2.11
–
2.03(m,2h).
[0092][0093]
将化合物6c(2.3g,13.691mmol)加入到50ml反应瓶中,加入25ml无水dmf,搅拌溶解,再加入碳酸锂(3.034g,41.071mmol),体系转移至120℃油浴,在氩气保护下反应12h。tlc监测反应完后,体系冷却至室温,过滤,减压除去溶剂,用乙酸乙酯萃取三次,收集有机相,然后加入适量饱和食盐水洗涤一次,再用无水硫酸镁干燥,过滤,浓缩后柱层析纯化,洗脱剂为石油醚:乙酸乙酯(1:1),得到化合物4c,棕色固体,1.1g,产率61.1%。1h nmr(400mhz,cdcl3)δ7.39(s,1h),6.78(t,j=4.6hz,1h),3.48(td,j=7.2,2.8hz,2h),2.47(td,j=7.1,4.6hz,2h).
[0094]
实施例3
[0095][0096][0097]
化合物i-1的制备:将3,4,5-三甲氧基苯甲醛(2g,10.204mmol)和丁二酸二甲酯(1.6ml,12.245mmol)加入到50ml反应瓶中,加入15ml无水甲醇溶解,加入新制备的甲醇钠的甲醇溶液(340mg 14.796mmol na加入到4ml无水甲醇中),转移至室温继续搅拌10min,体系转移至65℃油浴,在氩气保护下回流2h。tlc监测反应完后,体系冷却至室温,酸化,用乙酸乙酯萃取三次,收集有机相,然后加入适量饱和食盐水洗涤一次,再用无水硫酸镁干燥,过滤,浓缩后柱层析纯化,洗脱剂为石油醚:乙酸乙酯(2:1),得到化合物8,黄色油状液体,2.1g,产率65.6%。1h nmr(400mhz,cdcl3)δ7.87(s,1h),6.66(s,2h),3.90(s,3h),3.87(s,9h),3.64(s,2h).
[0098][0099]
将化合物8(1,1g,3.548mmol)加入到25ml反应瓶中,加入10ml醋酸酐溶解,然后再加入无水醋酸钠(349mg,4.258mmol),体系转移至130℃油浴,在氩气保护下反应45min。tlc监测反应完后,体系冷却至室温,减压除去溶剂,饱和碳酸氢钠溶液,用乙酸乙酯萃取三次,收集有机相,然后加入适量饱和食盐水洗涤一次,再用无水硫酸镁干燥,过滤,浓缩后加入15ml甲醇溶解,转移至50ml反应瓶,加入碳酸钾(5.2g,37.671mmol),体系转移至65℃油浴,反应2h,tlc监测反应完后,体系冷却至室温,减压除去溶剂,用乙酸乙酯萃取三次,收集有机相,然后加入适量饱和食盐水洗涤一次,再用无水硫酸镁干燥,过滤,浓缩后柱层析纯化,洗脱剂为石油醚:乙酸乙酯(5:1),得到化合物10,白色固体,600mg,两步产率60.8%。1h nmr(400mhz,cdcl3)δ9.50(s,1h),7.97(d,j=1.4hz,1h),7.34(d,j=1.5hz,1h),7.05(s,1h),4.18(s,3h),4.00(d,j=3.2hz,6h),3.97(s,3h),1.58(s,3h).
[0100][0101]
将化合物10(1.1g,3.957mmol)加入到25ml反应瓶中,加入10ml dmf搅拌溶解,再依次加入碳酸铯(2.6g,7.914mmol)和碘甲烷(370μl,5.935mmol),在室温条件下反应12h。tlc监测反应完后,减压除去溶剂,用乙酸乙酯萃取三次,收集有机相,然后加入适量饱和食盐水洗涤一次,再用无水硫酸镁干燥,过滤,浓缩后柱层析纯化,洗脱剂为石油醚:乙酸乙酯(7:1),得到化合物11a,白色固体,1.1g,产率为91.6%。1h nmr(400mhz,cdcl3)δ8.05(d,j=1.3hz,1h),7.30(d,j=1.4hz,1h),7.04(s,1h),4.05(s,3h),4.00(s,3h),3.97(s,3h),3.96(s,3h),3.92(s,3h).
[0102][0103]
将化合物11a(1.1g,3.767mmol)加入到50ml反应瓶中,加入3ml甲醇,3ml四氢呋喃,9ml水,搅拌溶解,再加入氢氧化钠(226mg,5.651mmol),在65℃条件下反应2h。tlc监测反应完后,减压除去溶剂,酸化,过滤,晾干,得到化合物12a,白色固体,950mg,产率为86.4%。
[0104][0105]
将化合物12a(150mg,0.539mmol)加入到25ml反应瓶中,在氩气保护下,加入4ml无水thf,搅拌溶解,体系置于-20℃,然后依次加入无水三乙胺(51μl,0.621mmol)和新戊酰氯(73μl,0.594mmol),体系在-20℃反应1h。tlc监测反应完后,加入1ml饱和碳酸氢钠淬灭反应,用二氯甲烷萃取取三次,收集有机相,然后加入适量饱和食盐水洗涤一次,再用无水硫酸镁干燥,过滤,浓缩后抽干得到化合物13a。将关键中间体4a(63mg,0.648mmol)加入到25ml两口反应瓶中,在氩气保护下,加入4ml无水thf,搅拌溶解,体系置于-78℃,然后加入2.5m的正丁基锂的环己烷溶液(26μl,0.648mmol),反应30min,最后将化合物13a(0.540mmol)加入到体系中,在-78℃条件下反应2h。tlc监测反应完后,加入饱和氯化铵溶液淬灭反应,体系回暖至室温,减压除去溶剂,用乙酸乙酯萃取三次,收集有机相,然后加入适量饱和食盐水洗涤一次,再用无水硫酸镁干燥,过滤,浓缩后柱层析纯化,洗脱剂为石油醚:乙酸乙酯(2:1),得到化合物i-1,黄色油状物,50mg,两步产率25%。1h nmr(400mhz,cdcl3)δ7.51(d,j=1.3hz,1h),7.00(dt,j=9.7,4.2hz,1h),6.97
–
6.93(m,2h),6.02(dt,j=9.8,1.8hz,1h),4.05
–
4.00(m,5h),3.97(s,3h),3.95(s,3h),3.91(s,3h),2.64(tdd,j=6.3,4.2,1.9hz,2h).
13
c nmr(101mhz,cdcl3)δ174.11,165.69,156.04,153.19,149.47,145.49,144.04,132.92,131.97,125.35,121.13,117.98,104.63,102.78,62.16,61.41,56.14,55.80,43.66,24.97.
[0106][0107]
化合物i-2~i-4的参考i-1的制备并结合上述反应路线得到。化合物i-2黄色油状物,产率26.2%。1h nmr(400mhz,cdcl3)δ7.57(dd,j=7.5,4.3hz,3h),7.41(dd,j=10.0,4.6hz,2h),7.35(d,j=7.3hz,1h),7.00(dt,j=8.4,2.2hz,3h),6.00(dt,j=9.7,1.8hz,1h),5.22(s,2h),4.02(t,j=6.4hz,2h),3.96(d,j=6.2hz,6h),3.78(s,3h),2.62(qd,j=6.2,1.8hz,2h).
13
c nmr(101mhz,cdcl3)δ174.03,165.64,155.24,153.29,149.67,145.42,144.12,137.03,132.88,132.13,128.47,127.84,127.68,125.39,121.47,118.39,104.64,104.56,77.36,77.04,76.72,71.25,62.25,61.35,55.78,43.66,24.98.
[0108]
[0109]
化合物i-3白色固体,熔点147.6-148.2℃,产率28.5%。1h nmr(400mhz,cdcl3)δ7.50(d,j=1.3hz,1h),7.39(t,j=4.6hz,1h),6.97(s,1h),6.91(d,j=1.5hz,1h),4.05(t,j=6.5hz,2h),4.01(s,3h),3.98(s,3h),3.95(s,3h),3.91(s,3h),2.67(td,j=6.4,4.7hz,2h).
13
c nmr(101mhz,cdcl3)δ173.76,161.00,156.15,153.26,149.47,145.85,144.18,132.41,131.96,121.10,118.60,118.08,104.71,102.49,77.44,77.12,76.80,62.18,61.43,56.19,55.84,43.88,26.88.
[0110][0111]
化合物i-4黄色固体,熔点114.4-115.0℃,产率30.1%。1h nmr(400mhz,cdcl3)δ7.51(d,j=1.3hz,1h),7.12(t,j=4.6hz,1h),6.97(s,1h),6.92(d,j=1.5hz,1h),4.05(t,j=6.5hz,2h),4.02(s,3h),3.98(s,3h),3.95(s,3h),3.91(s,3h),2.71(td,j=6.4,4.7hz,2h).
13
c nmr(101mhz,cdcl3)δ173.65,161.24,156.19,153.30,149.50,144.23,140.91,132.36,131.97,127.90,121.19,118.15,104.74,102.57,77.39,77.07,76.75,62.16,61.40,56.20,55.83,43.84,25.50.hr-ms(esi-tof)m/z:计算值c
20h20
clno6na[m na]
:428.0879,实验值428.0871.
[0112]
实施例4
[0113][0114]
其中,r的*端与其结构中的左侧基团相连,r的**端与其结构中的右侧基团相连;
[0115][0116]
化合物i-5的制备:将3,4,5-三甲氧基溴苯(1g,4.05mmol)加入到50ml反应瓶中,加入30ml 1,4-二氧六环,搅拌溶解,再依次加入双(频哪醇合)二硼(1.233g,4.856mmol)和醋酸钾(1.747g,17.807mmol),除去体系中的氧气,加入pdcl2(dppf)(148mg,0.202mmol),再除一次氧气,体系转移至110℃油浴,在氩气保护下反应12h。tlc监测反应完后,体系冷却至室温,过滤,减压除去溶剂,用乙酸乙酯萃取三次,收集有机相,然后加入适量饱和食盐水洗涤一次,再用无水硫酸镁干燥,过滤,浓缩,柱层析纯化,洗脱剂为石油醚:乙酸乙酯(16:1),得到化合物15,白色固体,980mg,产率81.7%。1h nmr(400mhz,cdcl3)δ7.05(s,2h),3.92(s,6h),3.89(s,3h),1.36(s,12h).
[0117][0118]
将化合物15(1g,3.401mmol)加入到100ml反应瓶中,加入50ml 1,4-二氧六环和5ml水,搅拌溶解,再依次加入邻溴苯甲酸甲酯(731mg,3.401mmol)和碳酸铯(4.4g,3.401mmol),除去体系中的氧气,加入pd(pph3)4(196mg,0.170mmol),再除一次氧气,体系转移至100℃油浴,在氩气保护下反应12h。tlc监测反应完后,体系冷却至室温,过滤,减压除去溶剂,用乙酸乙酯萃取三次,收集有机相,然后加入适量饱和食盐水洗涤一次,再用无水硫酸镁干燥,过滤,浓缩,柱层析纯化,洗脱剂为石油醚:乙酸乙酯(6:1),得到化合物16a,黄色油状物,860mg,产率84.1%。将化合物16a(633mg,2.103mmol)转移到50ml反应瓶中,加入3ml甲醇,3ml四氢呋喃,9ml水,搅拌溶解,再加入氢氧化钠(168mg,4.206mmol),在60℃条件下反应2h。tlc监测反应完后,减压除去溶剂,酸化,过滤,晾干,得到化合物17a,白色固体,550mg,产率为91.2%。
[0119]
化合物17b和17c的合成结合反应路线并参考17a的合成,化合物17a~17c合成i-5~i-7的操作结合反应路线并参考实施例3中化合物12a到i-1的合成。
[0120][0121]
化合物i-5白色固体,熔点145.9-147.3℃,产率23.5%。1h nmr(400mhz,cdcl3)δ
7.53
–
7.41(m,3h),7.30(dd,j=7.0,1.5hz,1h),6.66(dt,j=9.6,4.2hz,1h),6.48(s,2h),5.60(dt,j=9.8,1.8hz,1h),3.85(s,3h),3.81(s,6h).
13
c nmr(101mhz,cdcl3)δ172.97,164.07,152.91,145.53,138.71,137.26,137.10,136.51,129.77,129.06,127.68,127.46,124.73,105.90,77.35,77.03,76.71,60.87,56.20,41.87,24.31.hr-ms(esi-tof)m/z:计算值c
21h21
no
5 na[m na]
:390.1320,实验值390.1312.
[0122][0123]
化合物i-6黄色油状物,产率21.2%。1h nmr(400mhz,cdcl3)δ7.77(t,j=1.6hz,1h),7.65(ddd,j=7.6,1.8,1.3hz,1h),7.49(d,j=1.6hz,1h),7.46
–
7.41(m,1h),6.99(dt,j=9.7,4.2hz,1h),6.77(s,2h),5.99(dt,j=9.8,1.8hz,1h),4.04(t,j=6.4hz,2h),3.92(s,6h),3.89(s,3h),2.62(tdd,j=6.3,4.2,1.9hz,2h).
13
c nmr(101mhz,cdcl3)δ173.74,165.49,153.47,145.71,141.48,137.89,136.63,136.44,130.24,128.29,127.02,127.00,125.21,104.71,77.41,77.09,76.78,60.95,56.28,43.35,24.94.
[0124][0125]
化合物i-7黄色油状物,产率25.6%。1h nmr(400mhz,cdcl3)δ8.70(d,j=5.0hz,1h),8.59(s,1h),7.36(dd,j=5.0,0.6hz,1h),6.73(dt,j=9.7,4.2hz,1h),6.47(s,2h),5.64(dt,j=9.8,1.8hz,1h),3.86(s,3h),3.82(s,6h).
13
c nmr(101mhz,cdcl3)δ170.39,163.85,153.18,149.53,148.98,146.45,144.41,137.79,132.88,132.45,124.28,120.68,105.98,77.38,77.06,76.74,60.93,56.26,41.50,24.24.
[0126]
实施例5
[0127][0128]
化合物i-8的制备:将3,4,5-三甲氧基苯甲醛(1g,5.097mmol)加入到25ml反应瓶中,加入6ml dmf,搅拌溶解,再依次加入丙二酸(2.1g,20.387mmol)和吡啶(1.66ml,20.387mmol),体系转移至90℃油浴,在氩气保护下反应12h。tlc监测反应完后,体系冷却至室温,减压除去溶剂,酸化,用乙酸乙酯萃取三次,收集有机相,然后加入适量饱和食盐水洗涤一次,再用无水硫酸镁干燥,过滤,浓缩,柱层析纯化,洗脱剂为石油醚:乙酸乙酯(3:1),得到化合物19,白色固体,1.4g,产率93.3%。
[0129][0130]
将化合物19(200mg,0.794mmol)加入到25ml反应瓶中,加入5ml甲醇,搅拌溶解,置于冰水浴中,缓慢滴加草酰氯(169μl,2mmol),移走冰水浴,在氩气保护下室温反应12h。tlc监测反应完后,减压除去溶剂,然后加入饱和碳酸氢钠溶液,用乙酸乙酯萃取三次,收集有
机相,然后加入适量饱和食盐水洗涤一次,再用无水硫酸镁干燥,过滤,浓缩,柱层析纯化,洗脱剂为石油醚:乙酸乙酯(5:1),得到化合物20,白色固体,190mg,产率90.1%。
[0131][0132]
将化合物20(650mg,2.444mmol)和对甲苯磺酰甲基异腈(525mg,2.688mmol)中加入到25ml反应瓶中,加入8ml无水thf,搅拌溶解,置于冰水浴中,缓慢加入氢化钠(88mg,3.665mmol),移走冰水浴,体系转移至80℃油浴,在氩气保护下,反应2h。tlc监测反应完后,体系冷却至室温,加入冰水淬灭,用乙酸乙酯萃取三次,收集有机相,然后加入适量饱和食盐水洗涤一次,再用无水硫酸镁干燥,过滤,浓缩,柱层析纯化,洗脱剂为石油醚:乙酸乙酯(2:1),得到化合物21,白色固体,600mg,产率88.4%。1h nmr(400mhz,cdcl3)δ9.15(s,1h),7.48(d,j=2.0hz,1h),6.79(s,3h),3.89(d,j=1.9hz,9h),3.78(s,3h).
[0133][0134]
化合物21上甲基保护基的操作参考实施例3中化合物11a的制备步骤,得到化合物22。将化合物22(600mg,2.069mmol)转移到50ml反应瓶中,加入3ml甲醇,3ml四氢呋喃,9ml水,搅拌溶解,再加入氢氧化锂(396mg,16.553mmol),在60℃条件下反应2h。tlc监测反应完后,减压除去溶剂,酸化,过滤,晾干,得到化合物23,白色固体,533mg,产率为93.5%。
[0135][0136]
化合物23合成i-8的操作参考实施例3中化合物12a得到i-1的合成。化合物i-8黄色油状物,产率29%。1h nmr(400mhz,cdcl3)δ7.15(d,j=2.4hz,1h),6.62
–
6.55(m,2h),6.48(s,2h),5.56(dt,j=9.7,1.9hz,1h),3.86
–
3.81(m,11h),3.70(s,3h),2.25(tdd,j=6.3,4.2,1.9hz,2h).
13
c nmr(101mhz,cdcl3)δ168.81,165.06,152.70,143.97,136.89,130.89,126.84,125.90,125.24,121.00,119.31,106.70,77.40,77.08,76.76,56.29,43.02,36.59,24.37.
[0137]
实施例6
[0138][0139]
化合物i-9~i-13的合成是以易得到的芳香酸为原料,合成操作步骤结合反应路线参考实施例3中化合12a到i-1的合成。
[0140][0141]
化合物i-9黄色固体,熔点102.1-103.3℃,产率26.2%。1h nmr(400mhz,cdcl3)δ9.01(s,1h),8.17
–
8.12(m,1h),8.10
–
8.04(m,1h),7.86
–
7.75(m,2h),7.05(dt,j=9.7,4.2hz,1h),5.97(dt,j=9.8,1.9hz,1h),4.17(t,j=6.5hz,2h),2.70(tdd,j=6.4,4.2,1.9hz,2h).
13
c nmr(101mhz,cdcl3)δ170.33,164.89,149.03,146.83,143.29,142.57,140.83,130.93,130.52,129.79,129.36,124.58,42.23,24.63.
[0142][0143]
化合物i-10黄色油状物,产率24.6%。1h nmr(400mhz,cdcl3)δ8.89(s,2h),8.31(dd,j=1.9,0.5hz,1h),8.13(dd,j=8.7,0.5hz,1h),7.91(dd,j=8.7,1.9hz,1h),7.04(dt,j=9.7,4.2hz,1h),5.99(dt,j=9.8,1.9hz,1h),4.10(t,j=6.5hz,2h),2.66(tdd,j=6.3,4.2,1.9hz,2h).
13
c nmr(101mhz,cdcl3)δ172.60,165.38,146.21,146.08,145.70,144.12,142.32,137.80,129.54,129.43,128.93,125.03,43.23,24.95.
[0144][0145]
化合物i-11绿色固体,熔点82.3-84.5℃,产率27.4%。1h nmr(400mhz,cdcl3)δ8.25(d,j=8.4hz,1h),8.06(d,j=8.5hz,1h),7.84(dd,j=8.2,1.0hz,1h),7.71(ddd,j=8.4,6.9,1.4hz,1h),7.64
–
7.60(m,1h),7.57(ddd,j=8.1,6.9,1.2hz,1h),7.00(dt,j=
9.8,4.2hz,1h),5.94(dt,j=9.8,1.9hz,1h),4.15(t,j=6.5hz,2h),2.68(tdd,j=6.4,4.2,1.9hz,2h).
[0146][0147]
化合物i-12黄色固体,熔点221.4-222.1℃,产率29.5%。1h nmr(400mhz,cdcl3)δ8.03(d,j=7.8hz,1h),8.01(d,j=1.4hz,1h),7.49
–
7.45(m,1h),7.39(d,j=8.2hz,1h),7.28
–
7.21(m,2h),7.00
–
6.94(m,1h),6.02(dt,j=9.7,1.8hz,1h),4.16(s,3h),4.03
–
3.98(m,5h),2.68
–
2.59(m,2h).
13
c nmr(101mhz,cdcl3)δ174.70,165.94,146.49,144.97,141.86,132.97,126.54,126.04,125.63,123.69,123.22,120.46,119.61,115.76,109.05,107.63,55.78,44.15,32.19,25.05.
[0148][0149]
化合物i-13白色固体,熔点145.8-147.9℃,产率30%。1h nmr(400mhz,cdcl3)δ8.26(s,1h),8.19(dd,j=8.0,1.5hz,1h),7.69(ddd,j=8.7,5.4,1.9hz,1h),7.50
–
7.46(m,1h),7.43
–
7.39(m,1h),7.02(dt,j=9.7,4.2hz,1h),6.01(dt,j=9.8,1.9hz,1h),4.08(t,j=6.4hz,2h),2.62(tdd,j=6.3,4.2,1.9hz,2h).
13
c nmr(101mhz,cdcl3)δ173.53,165.95,165.20,157.22,155.99,146.48,134.18,126.49,125.80,124.98,124.36,124.09,118.20,42.47,24.95.
[0150]
实施例7
[0151][0152]
化合物i-14的制备:将关键中间体4a(63mg,0.648mmol)加入到25ml两口反应瓶中,在氩气保护下,加入4ml无水thf,搅拌溶解,体系置于-78℃,然后加入2.5m的正丁基锂的环己烷溶液(26μl,0.648mmol),反应30min,最后将2-萘磺酰氯(0.5396mmol)加入到体系
中,在-78℃条件下反应2h。tlc监测反应完后,加入饱和氯化铵溶液淬灭反应,体系回暖至室温,减压除去溶剂,用乙酸乙酯萃取三次,收集有机相,然后加入适量饱和食盐水洗涤一次,再用无水硫酸镁干燥,过滤,浓缩后柱层析纯化,洗脱剂为石油醚:乙酸乙酯(2:1),得到化合物i-14,白色固体,熔点97.5-98.7℃,产率为26%。1h nmr(400mhz,cdcl3)δ8.67(s,1h),8.02(d,j=7.9hz,1h),7.98
–
7.93(m,2h),7.90(d,j=8.1hz,1h),7.68
–
7.58(m,2h),6.81(dt,j=9.7,4.2hz,1h),5.84(dt,j=9.8,1.8hz,1h),4.14(t,j=6.5hz,2h),2.58(tdd,j=6.4,4.3,1.8hz,2h).
13
c nmr(101mhz,cdcl3)δ162.97,144.74,135.61,135.35,131.89,130.68,129.62,129.29,128.98,127.89,127.54,125.06,122.94,44.23,25.31.hr-ms(esi-tof)m/z:计算值c
15h13
no3s na[m na]
:310.0516,实验值310.0508.
[0153]
化合物i-15和i-16的操作步骤参考实施例7中i-14的合成。
[0154][0155]
化合物i-15白色固体,熔点136.9-137.5℃,产率27.5%。1h nmr(400mhz,cdcl3)δ8.68(d,j=0.9hz,1h),8.02(d,j=7.6hz,1h),7.97(d,j=1.3hz,2h),7.93
–
7.89(m,1h),7.65(dddd,j=19.5,8.2,6.9,1.4hz,2h),7.19(t,j=4.6hz,1h),4.20(t,j=6.5hz,2h),2.62(td,j=6.5,4.6hz,2h).
13
c nmr(101mhz,cdcl3)δ158.42,145.00,135.48,134.98,131.89,131.16,129.74,129.50,129.16,127.91,127.64,122.94,117.93,44.34,27.28.
[0156][0157]
化合物i-16白色固体,熔点144.7-146.2℃,产率26.3%。1h nmr(400mhz,cdcl3)δ8.68(d,j=0.9hz,1h),8.01(d,j=7.8hz,1h),7.96(d,j=1.3hz,2h),7.94
–
7.87(m,1h),7.64(dddd,j=19.7,8.2,6.9,1.4hz,2h),6.92(t,j=4.6hz,1h),4.18(t,j=6.5hz,2h),2.65(td,j=6.5,4.7hz,2h).
13
c nmr(101mhz,cdcl3)δ158.76,140.33,135.48,134.93,131.87,131.16,129.72,129.53,129.18,127.92,127.67,127.32,122.90,44.28,25.84.
[0158]
实施例8
[0159]
[0160][0161]
化合物ii-1的制备:将苯并呋喃-2-甲醛(185mg,1.267mmol)加入到25ml反应瓶中,加入3ml dmf,搅拌溶解,再依次加入丙二酸(527g,5.069mmol)和吡啶(409μl,5.069mmol),体系转移至90℃油浴,在氩气保护下反应12h。tlc监测反应完后,体系冷却至室温,减压除去溶剂,酸化,用乙酸乙酯萃取三次,收集有机相,然后加入适量饱和食盐水洗涤一次,再用无水硫酸镁干燥,过滤,浓缩后加入少量二氯甲烷,过滤,得到化合物29a,黄色固体,125mg,产率52.5%。
[0162][0163]
将化合物29a(100mg,0.532mmol)加入到25ml反应瓶中,在氩气保护下,加入4ml无水thf,搅拌溶解,体系置于-20℃,然后依次加入无水三乙胺(85μl,0.612mmol)和新戊酰氯(73μl,0.585mmol),体系在-20℃反应1h。tlc监测反应完后,加入1ml饱和碳酸氢钠淬灭反
应,用二氯甲烷萃取取三次,收集有机相,然后加入适量饱和食盐水洗涤一次,再用无水硫酸镁干燥,过滤,浓缩后抽干得到化合物30a。将关键中间体4a(64mg,0.665mmol)加入到25ml两口反应瓶中,在氩气保护下,加入4ml无水thf,搅拌溶解,体系置于-78℃,然后加入2.5m的正丁基锂的环己烷溶液(27μl,0.665mmol),反应30min,最后将化合物30a(0.532mmol)加入到体系中,在-78℃条件下反应2h。tlc监测反应完后,加入饱和氯化铵溶液淬灭反应,体系回暖至室温,减压除去溶剂,用乙酸乙酯萃取三次,收集有机相,然后加入适量饱和食盐水洗涤一次,再用无水硫酸镁干燥,过滤,浓缩后柱层析纯化,洗脱剂为石油醚:乙酸乙酯(3:1),得到化合物ii-1,黄色固体,熔点119.7-120.9℃,两步产率28.2%。1h nmr(400mhz,cdcl3)δ7.61(s,2h),7.57(d,j=7.8hz,1h),7.47(d,j=8.2hz,1h),7.36
–
7.30(m,1h),7.22(t,j=7.5hz,1h),6.96
–
6.91(m,2h),6.06(d,j=9.7hz,1h),4.04(t,j=6.5hz,2h),2.47(tdd,j=6.3,4.2,1.8hz,2h).
13
c nmr(101mhz,cdcl3)δ168.52,165.71,155.52,153.08,145.67,130.19,128.50,126.31,125.69,123.21,122.34,121.65,111.49,111.12,77.43,77.11,76.80,41.71,24.79.
[0164]
化合物ii-2~ii-14、ii-1a~ii-10a以及ii-1b~ii-10b的制备操作结合反应路线并参考实施例8中化合物ii-1的合成。
[0165][0166]
化合物ii-2黄色固体,熔点93.2-94.4℃,产率26.4%。1h nmr(400mhz,cdcl3)δ7.98
–
7.94(m,1h),7.89(d,j=15.8hz,2h),7.78(d,j=16.2hz,1h),7.52(ddd,j=4.8,2.3,0.4hz,1h),7.39
–
7.32(m,2h),6.96(dt,j=9.6,4.2hz,1h),6.08(dt,j=9.7,1.8hz,1h),4.07(t,j=6.5hz,2h),2.49(tdd,j=6.3,4.2,1.8hz,2h).
13
c nmr(101mhz,cdcl3)δ168.82,165.91,156.08,147.99,145.58,133.70,125.92,125.30,124.91,123.86,121.93,121.39,118.65,111.83,41.57,24.81.
[0167][0168]
化合物ii-3白色固体,熔点80.9-82.1℃,产率25.5%。1h nmr(400mhz,cdcl3)δ7.74(d,j=15.2hz,1h),7.56(d,j=15.2hz,1h),7.51(d,j=7.5hz,1h),7.43(d,j=8.2hz,1h),7.37
–
7.31(m,1h),7.25
–
7.20(m,1h),6.94(dt,j=9.6,4.2hz,1h),6.07(dt,j=9.7,1.8hz,1h),4.05(t,j=6.5hz,2h),2.48(tdd,j=6.3,4.2,1.8hz,2h),2.38(s,3h).
13
c nmr(101mhz,cdcl3)δ168.89,165.71,154.82,149.11,145.42,129.92,128.39,126.56,125.84,122.68,120.69,120.01,111.34,41.73,24.82,8.43.
[0169][0170]
化合物ii-4白色固体,熔点101.2-103.2℃,产率27.5%。1h nmr(400mhz,cdcl3)δ7.87(d,j=15.6hz,1h),7.83(d,j=1.5hz,1h),7.63(d,j=2.2hz,1h),7.55(dd,j=16.0,8.7hz,2h),7.48(d,j=8.6hz,1h),6.97
–
6.90(m,1h),6.80
–
6.76(m,1h),6.05(dt,j=9.7,1.8hz,1h),4.05(t,j=6.5hz,2h),2.48(tdd,j=6.3,4.2,1.8hz,2h).
13
c nmr(101mhz,cdcl3)δ169.06,165.88,155.99,145.93,145.47,144.21,130.21,127.97,125.89,124.74,121.81,120.70,111.80,106.83,41.64,24.83.
[0171][0172]
化合物ii-5白色固体,熔点141.3-143.2℃,产率24.3%。1h nmr(400mhz,cdcl3)δ8.18(d,j=1.5hz,1h),7.98(d,j=7.6hz,1h),7.93(d,j=15.6hz,1h),7.70(dd,j=8.6,1.7hz,1h),7.57(dd,j=18.6,11.9hz,3h),7.48(d,j=1.0hz,1h),7.37(dd,j=10.9,4.0hz,1h),6.99
–
6.92(m,1h),6.08(dt,j=9.7,1.7hz,1h),4.07(t,j=6.5hz,2h),2.50(tdd,j=6.3,4.2,1.8hz,2h).
13
c nmr(101mhz,cdcl3)δ168.98,165.92,157.25,156.67,145.55,143.81,130.15,127.93,127.65,125.86,124.87,123.74,123.10,120.91,120.90,120.63,112.00,111.81,41.67,24.84.hr-ms(esi-tof)m/z:计算值c
20h15
no3na[m na]
:340.0952;实验值340.0944.
[0173][0174]
化合物ii-6黄色固体,熔点117.0-119.7℃,产率23.6%。1h nmr(400mhz,cdcl3)δ7.73(d,j=15.6hz,1h),7.50
–
7.47(m,1h),7.39(d,j=15.6hz,1h),7.36
–
7.32(m,1h),6.93(dt,j=9.7,4.2hz,1h),6.77(d,j=8.3hz,1h),6.04(dt,j=9.7,1.8hz,1h),4.61(t,j=8.7hz,2h),4.03(t,j=6.5hz,2h),3.22(t,j=8.7hz,2h),2.46(tdd,j=6.3,4.2,1.9hz,2h).
13
c nmr(101mhz,cdcl3)δ169.20,165.89,162.17,145.33,144.14,130.08,127.98,127.96,125.95,124.57,118.70,109.53,71.85,41.61,29.25,24.83.
[0175][0176]
化合物ii-7白色固体,熔点91.2-93.3℃,产率29.5%。1h nmr(400mhz,cdcl3)δ7.67(d,j=1.0hz,2h),6.99
–
6.90(m,2h),6.83
–
6.80(m,2h),6.07
–
6.02(m,3h),4.03(t,j
=6.5hz,2h),2.51
–
2.44(m,2h).
13
c nmr(101mhz,cdcl3)δ169.15,165.73,147.93,146.57,145.46,138.05,125.81,124.30,122.82,121.67,118.10,109.57,101.46,41.66,24.80.
[0177][0178]
化合物ii-8黄色固体,熔点169.8-171.3℃,产率26.7%。1h nmr(400mhz,cdcl3)δ8.04(d,j=15.5hz,1h),7.32(d,j=15.4hz,1h),7.17(s,1h),7.04(s,1h),6.95(dt,j=9.7,4.2hz,1h),6.06
–
5.99(m,3h),4.04(t,j=6.5hz,2h),2.48(tdd,j=6.3,4.2,1.9hz,2h).
13
c nmr(101mhz,cdcl3)δ168.53,165.81,149.87,147.84,145.60,141.65,128.38,125.78,122.60,117.95,113.03,106.89,102.19,41.61,24.79.
[0179][0180]
化合物ii-9黄色固体,熔点169.7-170.6℃,产率30%。1h nmr(400mhz,cdcl3)δ8.12(d,j=15.5hz,1h),7.54(s,1h),7.32(d,j=15.4hz,1h),7.11(s,1h),7.00
–
6.93(m,1h),6.15(s,2h),6.04(dt,j=9.7,1.8hz,1h),4.05(t,j=6.5hz,2h),2.50(tdd,j=6.3,4.2,1.9hz,2h).
13
c nmr(101mhz,cdcl3)δ167.98,165.81,151.97,148.77,145.94,138.60,128.09,125.78,125.60,107.78,105.58,103.31,41.61,39.64,24.75.
[0181][0182]
化合物ii-10黄色固体,熔点122.9-125.7℃,产率24.2%。1h nmr(400mhz,cdcl3)δ7.95(dd,j=15.3,0.5hz,1h),7.80
–
7.73(m,2h),7.49(s,1h),7.40(d,j=15.1hz,1h),7.37
–
7.32(m,2h),6.95(dt,j=9.6,4.2hz,1h),6.06(dt,j=9.7,1.8hz,1h),4.04(t,j=6.5hz,2h),2.48(tdd,j=6.3,4.2,1.8hz,2h).
13
c nmr(101mhz,cdcl3)δ168.36,165.68,145.52,140.49,140.34,139.67,136.67,128.46,126.03,125.79,124.73,124.32,123.07,122.47,41.65,24.79.
[0183][0184]
化合物ii-11黄色固体,熔点110.4-112.5℃,产率23.3%。1h nmr(400mhz,cdcl3)δ8.13(d,j=15.1hz,1h),7.78
–
7.74(m,1h),7.72
–
7.68(m,1h),6.94(dt,j=9.6,4.2hz,1h),6.06(dt,j=9.7,1.8hz,1h),4.05(t,j=6.5hz,2h),2.54(s,3h),2.52
–
2.45(m,2h).
13
c nmr(101mhz,cdcl3)δ168.63,165.70,145.45,140.65,139.36,136.24,134.84,
134.71,126.36,125.84,124.38,122.63,122.44,122.30,41.69,24.81,12.21.
[0185][0186]
化合物ii-12白色固体,熔点131.2-133.4℃,产率18.4%。1h nmr(400mhz,cdcl3)δ8.30(d,j=1.5hz,1h),8.20
–
8.16(m,1h),7.93(d,j=15.6hz,1h),7.85
–
7.81(m,2h),7.69(dd,j=8.4,1.6hz,1h),7.64(d,j=15.6hz,1h),7.49
–
7.44(m,2h),6.94(dt,j=9.6,4.2hz,1h),6.07(dt,j=9.7,1.8hz,1h),4.06(t,j=6.5hz,2h),2.48(tdd,j=6.3,4.2,1.8hz,2h).
13
c nmr(101mhz,cdcl3)δ168.99,165.92,145.58,143.75,141.37,139.76,136.01,135.13,131.64,127.15,126.35,125.87,124.68,123.07,122.91,121.81,121.73,121.44,41.69,24.84.
[0187][0188]
化合物ii-13黄色固体,熔点123.4-125.2℃,产率21.2%。1h nmr(400mhz,cdcl3)δ9.06(s,1h),8.14
–
8.05(m,3h),7.89(d,j=15.6hz,1h),7.81
–
7.75(m,2h),6.99(dt,j=9.6,4.2hz,1h),6.09(dt,j=9.7,1.8hz,1h),4.09(t,j=6.5hz,2h),2.53(tdd,j=6.3,4.2,1.8hz,2h).
13
c nmr(101mhz,cdcl3)δ168.24,165.71,148.75,145.98,144.88,142.50,142.37,138.56,130.53,130.50,129.87,129.21,128.90,125.55,41.72,24.79.hr-ms(esi-tof)m/z:计算值c
16h13
n3o2[m na]
:302.1008,实验值302.0900.
[0189][0190]
化合物ii-14白色固体,熔点171.8-173.7℃,产率31%。1h nmr(400mhz,cdcl3)δ8.92(dd,j=4.2,1.7hz,1h),8.18(d,j=8.3hz,1h),8.11
–
8.06(m,1h),7.97(dt,j=3.8,1.8hz,2h),7.90(d,j=15.6hz,1h),7.66(d,j=15.6hz,1h),7.43(dd,j=8.3,4.2hz,1h),7.00
–
6.94(m,1h),6.08(dt,j=9.7,1.8hz,1h),4.08(t,j=6.5hz,2h),2.51(tdd,j=6.3,4.2,1.8hz,2h).
13
c nmr(101mhz,cdcl3)δ168.77,165.87,151.18,148.99,145.71,142.47,136.49,133.39,130.08,129.07,128.27,127.99,125.78,123.21,121.76,41.67,24.82.
[0191][0192]
化合物ii-1a白色固体,熔点147.9-149.5℃,产率27.5%。1h nmr(400mhz,cdcl3)δ7.62(d,j=2.7hz,2h),7.58(d,j=7.7hz,1h),7.47(d,j=8.3hz,1h),7.38
–
7.33(m,2h),
7.23(t,j=7.5hz,1h),6.97(s,1h),4.10(t,j=6.4hz,2h),2.59
–
2.49(m,2h).
13
c nmr(101mhz,cdcl3)δ168.25,161.06,155.62,152.88,146.00,131.12,128.45,126.54,123.28,121.72,121.59,119.03,111.59,111.56,41.90,26.74.hr-ms(esi-tof)m/z:计算值c
16h12
brno3na[m na]
:369.9880,实验值369.9872.
[0193][0194]
化合物ii-2a白色固体,熔点161.3-164.2℃,产率25.4%。1h nmr(400mhz,cdcl3)δ7.94(ddd,j=16.9,9.9,6.6hz,3h),7.74(d,j=15.7hz,1h),7.54
–
7.50(m,1h),7.40
–
7.33(m,3h),4.13(t,j=6.5hz,2h),2.53(td,j=6.4,4.7hz,2h).
13
c nmr(101mhz,cdcl3)δ168.53,161.11,156.10,148.27,145.95,134.80,125.40,124.77,123.99,121.46,121.08,119.22,118.60,111.82,41.84,26.71.
[0195][0196]
化合物ii-3a黄色固体,熔点120.4-122.2℃,产率25.2%。1h nmr(400mhz,cdcl3)δ7.75(d,j=15.1hz,1h),7.56(d,j=15.1hz,1h),7.53
–
7.49(m,1h),7.44
–
7.39(m,1h),7.38
–
7.31(m,2h),7.26
–
7.20(m,1h),4.10(t,j=6.5hz,2h),2.52(td,j=6.5,4.6hz,2h),2.38(s,3h).
13
c nmr(101mhz,cdcl3)δ168.50,161.01,154.84,148.94,145.98,129.82,129.17,126.82,122.78,121.30,120.13,119.91,119.03,111.35,41.91,26.74,8.51.
[0197][0198]
化合物ii-4a白色固体,熔点128.5-129.1℃,产率26.5%。1h nmr(400mhz,cdcl3)δ7.93
–
7.80(m,2h),7.64(dd,j=3.6,2.2hz,1h),7.60
–
7.45(m,3h),7.39
–
7.30(m,1h),6.78(dd,j=2.0,1.2hz,1h),4.10(dd,j=8.3,4.5hz,2h),2.52(dd,j=6.3,4.6hz,2h).
13
c nmr(101mhz,cdcl3)δ168.70,161.18,156.13,146.01,145.88,145.23,129.99,128.03,124.90,121.90,120.02,119.19,111.84,106.82,41.80,26.74.
[0199][0200]
化合物ii-5a白色固体,熔点178.7-179.5℃,产率28.3%。1h nmr(400mhz,cdcl3)δ8.18(s,1h),7.95(dd,j=21.9,11.6hz,2h),7.68(d,j=8.6hz,1h),7.57(ddd,j=14.4,7.2,5.5hz,3h),7.48(t,j=7.8hz,1h),7.41
–
7.32(m,2h),4.11(t,j=6.4hz,2h),2.57
–
2.48(m,2h).
13
c nmr(101mhz,cdcl3)δ168.65,161.23,157.43,156.72,145.94,144.90,129.92,128.17,127.71,124.96,123.71,123.17,120.98,120.66,120.16,119.17,112.05,111.83,41.85,26.75.
[0201][0202]
化合物ii-6a黄色固体,熔点149.3-151.2℃,产率29.4%。1h nmr(400mhz,cdcl3)δ7.74
–
7.68(m,1h),7.63(dd,j=8.9,7.8hz,1h),7.34(dd,j=5.0,4.1hz,1h),7.01
–
6.94(m,1h),6.84
–
6.80(m,2h),6.07(t,j=0.9hz,2h),4.09(t,j=6.5hz,2h),2.55
–
2.47(m,2h).
13
c nmr(101mhz,cdcl3)δ168.86,160.95,147.97,146.71,145.84,138.88,123.48,122.64,121.69,119.11,117.82,109.78,101.54,41.91,26.72.
[0203][0204]
化合物ii-7a黄色固体,熔点219.7-220.8℃,产率30.3%。1h nmr(400mhz,cdcl3)δ8.06(d,j=15.5hz,1h),7.36(t,j=4.6hz,1h),7.31(d,j=15.4hz,1h),7.19(s,1h),7.04(s,1h),6.02(s,2h),4.10(t,j=6.5hz,2h),2.53(td,j=6.5,4.6hz,2h).
13
c nmr(101mhz,cdcl3)δ168.21,161.17,150.11,147.93,145.99,142.65,128.17,121.87,119.06,118.14,113.05,106.94,102.26,41.80,26.71.
[0205][0206]
化合物ii-8a黄色固体,熔点143.9-145.5℃,产率25.4%。1h nmr(400mhz,cdcl3)δ8.15(d,j=15.1hz,1h),7.72(ddd,j=9.0,5.7,2.3hz,2h),7.41
–
7.30(m,4h),4.08(t,j=6.3hz,2h),2.56
–
2.45(m,5h).
13
c nmr(101mhz,cdcl3)δ168.29,160.95,145.85,140.58,139.51,136.74,135.86,134.53,126.53,124.43,122.70,122.48,121.48,119.12,41.90,26.71,12.20.hr-ms(esi-tof)m/z:计算值c
17h14
brno2s na[m na]
:397.9829,实验值397.9821.
[0207][0208]
化合物ii-9a红色固体,熔点174.8-176.1℃,产率25.5%。1h nmr(400mhz,cdcl3)δ9.08
–
9.04(m,1h),8.09(ddd,j=21.1,10.0,9.0hz,3h),7.92(s,1h),7.83
–
7.75(m,2h),
7.40(s,1h),4.14(t,j=6.4hz,2h),2.58(dd,j=4.7,1.6hz,2h).
13
c nmr(101mhz,cdcl3)δ168.01,161.11,148.43,146.34,144.90,142.48,142.45,139.47,130.63,130.59,129.89,129.23,128.17,118.72,41.96,26.72.
[0209][0210]
化合物ii-10a白色固体,熔点176.7-178.3℃,产率28.7%。1h nmr(400mhz,cdcl3)δ8.97
–
8.88(m,1h),8.18(t,j=7.9hz,1h),8.08(d,j=8.1hz,1h),7.94(dt,j=25.6,11.9hz,3h),7.64(dd,j=15.6,8.2hz,1h),7.47
–
7.34(m,2h),4.12(t,j=6.5hz,2h),2.62
–
2.50(m,2h).
13
c nmr(101mhz,cdcl3)δ168.36,161.16,151.26,149.09,146.00,143.39,136.44,133.17,130.14,129.07,128.25,128.05,122.58,121.76,119.02,41.83,26.70.
[0211][0212]
化合物ii-1b黄色固体,熔点131.1-132.8℃,产率29.6%。1h nmr(400mhz,cdcl3)δ7.62(d,j=3.7hz,2h),7.57(d,j=6.7hz,1h),7.47(dd,j=8.3,0.7hz,1h),7.38
–
7.32(m,1h),7.25
–
7.20(m,1h),7.09(t,j=4.6hz,1h),6.97(d,j=0.4hz,1h),4.09(t,j=6.5hz,2h),2.57(td,j=6.4,4.8hz,2h).
13
c nmr(101mhz,cdcl3)δ168.14,161.33,155.59,152.86,141.24,131.10,131.09,128.44,128.13,126.55,123.29,121.73,121.56,111.61,111.53,41.82,25.33.
[0213][0214]
化合物ii-2b黄色固体,熔点149.3-150.5℃,产率28.4%。1h nmr(400mhz,cdcl3)δ7.98
–
7.89(m,3h),7.76(d,j=15.7hz,1h),7.52(dt,j=5.2,3.0hz,1h),7.39
–
7.34(m,2h),7.10(t,j=4.6hz,1h),4.12(t,j=6.5hz,2h),2.56(td,j=6.4,4.7hz,2h).
13
c nmr(101mhz,cdcl3)δ168.42,161.42,156.09,148.36,141.20,134.88,128.31,125.41,124.73,124.00,121.46,121.02,118.58,111.83,41.74,25.30.
[0215][0216]
化合物ii-3b黄色固体,熔点78.2-80.3℃,产率26.8%。1h nmr(400mhz,cdcl3)δ7.76(d,j=15.1hz,1h),7.56(d,j=15.2hz,1h),7.54
–
7.49(m,1h),7.42(dd,j=5.0,
4.1hz,1h),7.38
–
7.33(m,1h),7.26
–
7.20(m,1h),7.08(t,j=4.6hz,1h),4.09(t,j=6.5hz,2h),2.57(td,j=6.5,4.6hz,2h),2.38(s,3h).
13
c nmr(101mhz,cdcl3)δ168.47,161.31,154.87,148.94,141.08,129.83,129.26,128.22,126.82,122.77,121.33,120.12,119.87,111.38,41.84,25.35,8.51.
[0217][0218]
化合物ii-4b白色固体,熔点114.5-115.1℃,产率25.5%。1h nmr(400mhz,cdcl3)δ7.87(dd,j=19.4,8.5hz,2h),7.64(d,j=2.2hz,1h),7.54(ddd,j=26.5,9.8,5.2hz,3h),7.09(t,j=4.6hz,1h),6.80
–
6.77(m,1h),4.10(t,j=6.5hz,2h),2.57(dd,j=11.1,6.4hz,2h).
13
c nmr(101mhz,cdcl3)δ168.63,161.48,156.13,146.02,145.26,141.08,129.97,128.28,128.03,124.87,121.92,119.97,111.85,106.83,41.73,25.34.
[0219][0220]
化合物ii-5b黄色固体,熔点154.6-155.9℃,产率27.3%。1h nmr(400mhz,cdcl3)δ8.19(d,j=1.8hz,1h),7.98(ddd,j=7.7,1.3,0.6hz,1h),7.94(d,j=15.5hz,1h),7.70
–
7.67(m,1h),7.61
–
7.52(m,3h),7.48(ddd,j=8.3,7.3,1.4hz,1h),7.41
–
7.35(m,1h),7.10(t,j=4.6hz,1h),4.11(t,j=6.5hz,2h),2.58(td,j=6.5,4.6hz,2h).
13
c nmr(101mhz,cdcl3)δ168.57,161.52,157.42,156.71,156.70,144.91,141.16,129.90,128.26,128.17,127.72,124.96,123.69,123.17,120.97,120.64,120.12,112.06,111.83,41.76,25.35.
[0221][0222]
化合物ii-6b黄色固体,熔点144.7-145.1℃,产率29.4%。1h nmr(400mhz,cdcl3)δ7.74
–
7.69(m,1h),7.64(d,j=15.7hz,1h),7.08(t,j=4.6hz,1h),6.99
–
6.95(m,1h),6.84
–
6.80(m,2h),6.07(s,2h),4.08(t,j=6.5hz,2h),2.56(td,j=6.5,4.6hz,
13
c nmr(101mhz,cdcl3)δ168.78,161.25,147.97,146.70,141.09,139.02,128.20,123.46,122.76,121.71,121.70,117.80,109.81,101.56,41.82,25.32.
[0223][0224]
化合物ii-7b黄色固体,熔点194.2-195.1℃,产率30%。1h nmr(400mhz,cdcl3)δ8.06(d,j=15.5hz,1h),7.31(d,j=15.4hz,1h),7.19(s,1h),7.09(t,j=4.6hz,1h),7.05
(s,1h),6.02(s,2h),4.09(t,j=6.5hz,2h),2.64
–
2.50(m,2h).
13
c nmr(101mhz,cdcl3)δ168.13,161.46,150.12,147.93,142.63,141.24,128.15,128.11,121.81,118.16,113.04,106.89,102.28,41.73,25.31.
[0225][0226]
化合物ii-8b黄色固体,熔点151.7-152.4℃,产率25.4%。1h nmr(400mhz,cdcl3)δ8.16(d,j=15.1hz,1h),7.77(ddd,j=4.0,2.1,0.7hz,1h),7.71(ddd,j=3.3,2.2,0.6hz,1h),7.40
–
7.33(m,3h),7.09(t,j=4.6hz,1h),4.10(dd,j=12.0,5.5hz,2h),2.60
–
2.55(m,2h),2.54(s,3h).
13
c nmr(101mhz,cdcl3)δ168.25,161.28,141.07,140.57,139.49,136.84,135.93,134.50,128.27,126.55,124.44,122.72,122.50,121.39,41.83,25.32,12.26.
[0227][0228]
化合物ii-9b红色固体,熔点135.3-137.8℃,产率26.6%。1h nmr(400mhz,cdcl3)δ9.06(s,1h),8.13
–
8.03(m,3h),7.91(d,j=15.5hz,1h),7.83
–
7.75(m,2h),7.14(t,j=4.6hz,1h),4.13(t,j=6.5hz,2h),2.62(td,j=6.4,4.7hz,2h).
13
c nmr(101mhz,cdcl3)δ167.89,161.38,148.38,144.89,142.44,142.42,141.59,139.48,130.65,130.60,129.86,129.21,128.10,127.93,41.87,25.33.hr-ms(esi-tof)m/z:计算值c
16h12
cln3o2na[m na]
:336.0518,实验值336.0510.
[0229][0230]
化合物ii-10b白色固体,熔点92.5-93.2℃,产率28.7%。1h nmr(400mhz,cdcl3)δ8.95
–
8.90(m,1h),8.18(d,j=8.3hz,1h),8.09(d,j=8.7hz,1h),8.00
–
7.95(m,2h),7.92(d,j=15.6hz,1h),7.64(d,j=15.6hz,1h),7.44(dd,j=8.3,4.2hz,1h),7.12(t,j=4.5hz,1h),4.12(t,j=6.4hz,2h),2.60(dd,j=11.7,5.7hz,2h).
13
c nmr(101mhz,cdcl3)δ168.33,161.50,151.30,149.04,143.43,141.31,136.51,133.11,130.12,129.17,128.24,128.14,128.03,122.50,121.81,41.77,25.32.hr-ms(esi-tof)m/z:计算值c
17h13
cln2o2na[m na]
:335.0566,实验值335.0558.
[0231]
实施例9
[0232][0233]
化合物ii-1c的制备:取25ml反应瓶,向其中加入4ml无水thf,置于冰水浴中,依次加入氢化钠(30g,0.740mmol)和2-膦酰丙酸三乙酯(146μl,0.678mmol),在氩气保护下反应10min,然后加入苯并呋喃-2-甲醛(90mg,0.616mmol),体系从冰水浴中取出,回暖至室温搅拌1h。tlc监测反应完后,加入冰水淬灭反应,减压除去溶剂,酸化,用乙酸乙酯萃取三次,收集有机相,然后加入适量饱和食盐水洗涤一次,再用无水硫酸镁干燥,过滤,浓缩,得到化合物32a。将化合物32a(133mg,0.616mmol)转移到50ml反应瓶中,加入3ml乙醇,3ml四氢呋喃,9ml水,搅拌溶解,再加入氢氧化钠(168mg,4.206mmol),在60℃条件下反应2h。tlc监测反应完后,减压除去溶剂,酸化,过滤,晾干,得到化合物33a,白色固体,90mg,两步产率72%。
[0234][0235]
将化合物33a(90mg,0.446mmol)加入到25ml反应瓶中,在氩气保护下,加入4ml无水thf,搅拌溶解,体系置于-20℃,然后依次加入无水三乙胺(42μl,0.512mmol)和新戊酰氯(61μl,0.490mmol),体系在-20℃反应1h。tlc监测反应完后,加入1ml饱和碳酸氢钠淬灭反应,用二氯甲烷萃取取三次,收集有机相,然后加入适量饱和食盐水洗涤一次,再用无水硫酸镁干燥,过滤,浓缩后抽干得到化合物34a。将关键中间体4c(59mg,0.446mmol)加入到25ml两口反应瓶中,在氩气保护下,加入4ml无水thf,搅拌溶解,体系置于-78℃,然后加入2.5m的正丁基锂的环己烷溶液(18μl,0.446mmol),反应30min,最后将化合物35a(0.446mmol)加入到体系中,在-78℃条件下反应2h。tlc监测反应完后,加入饱和氯化铵溶液淬灭反应,体系回暖至室温,减压除去溶剂,用乙酸乙酯萃取三次,收集有机相,然后加入适量饱和食盐水洗涤一次,再用无水硫酸镁干燥,过滤,浓缩后柱层析纯化,洗脱剂为石油醚:乙酸乙酯(3:1),得到化合物ii-1c,白色固体,熔点153.2-154.9℃,两步产率31.6%。1h nmr(400mhz,cdcl3)δ7.58(ddd,j=7.7,1.3,0.7hz,1h),7.47(dd,j=8.2,0.8hz,1h),7.31
(ddd,j=8.3,7.3,1.3hz,1h),7.25
–
7.20(m,1h),7.08(t,j=4.6hz,1h),6.90
–
6.88(m,1h),6.87(s,1h),3.95(t,j=6.5hz,2h),2.63(td,j=6.5,4.7hz,2h),2.33(d,j=1.1hz,3h).
13
c nmr(101mhz,cdcl3)δ175.07,160.76,155.05,153.51,140.97,134.87,128.38,127.74,125.46,123.11,122.54,121.38,111.28,109.91,43.24,25.32,16.43.
[0236]
化合物ii-2c~ii-4c的制备操作参考实施例9中化合物ii-1c的合成。
[0237][0238]
化合物ii-2c黄色固体,熔点108.1-109.5℃,产率28.5%。1h nmr(400mhz,cdcl3)δ7.07(t,j=4.6hz,1h),6.93(ddd,j=7.9,1.2,0.5hz,1h),6.86(d,j=1.2hz,1h),6.82(t,j=7.8hz,1h),6.79
–
6.75(m,1h),5.97(s,2h),3.94(t,j=6.5hz,2h),2.62(td,j=6.5,4.7hz,2h),2.11(d,j=1.4hz,3h).
13
c nmr(101mhz,cdcl3)δ175.42,160.80,147.37,145.71,140.94,135.83,127.75,126.60,122.07,121.28,118.11,108.28,100.92,43.05,25.33,15.75.
[0239][0240]
化合物ii-3c红色固体,熔点141.9-142.5℃,产率23.6%。1h nmr(400mhz,cdcl3)δ8.85(s,1h),8.07(ddd,j=5.0,3.0,1.2hz,2h),7.79
–
7.71(m,2h),7.12(t,j=4.6hz,1h),6.92(dd,j=2.8,1.3hz,1h),4.03(t,j=6.5hz,2h),2.67(td,j=6.5,4.7hz,2h),2.55(d,j=1.5hz,3h).
13
c nmr(101mhz,cdcl3)δ174.75,160.72,150.66,146.60,143.20,142.22,141.36,140.74,130.24,130.00,129.61,129.03,127.63,126.41,42.62,25.28,16.69.
[0241][0242]
化合物ii-4c黄色油状物,产率21.8%。1h nmr(400mhz,cdcl3)δ8.95(dd,j=4.3,1.7hz,1h),8.20(dd,j=8.5,1.0hz,1h),8.13(d,j=8.8hz,1h),7.86(d,j=1.5hz,1h),7.75(dd,j=8.8,1.9hz,1h),7.46(dd,j=8.3,4.3hz,1h),7.12(t,j=4.6hz,1h),7.05(s,1h),4.01(t,j=6.5hz,2h),2.67(td,j=6.5,4.7hz,2h),2.21(d,j=1.4hz,3h).
13
c nmr(101mhz,cdcl3)δ175.37,160.85,150.34,146.95,141.12,136.80,136.08,134.33,132.26,131.04,128.73,128.49,127.77,121.60,42.96,25.33,15.67.
[0243]
测试例:化合物抗肿瘤细胞增殖活性的测定
[0244]
(1)贴壁细胞增殖抑制活性测定
[0245]
收集处于对数生长期的细胞,计数后,按照4
×
103个/孔,根据公式:c
1v1
=c
2v2
计算出每个96孔板所需细胞悬液量,每孔加入100μl细胞悬液,过夜培养贴壁后,弃去旧培养基,
然后加入含不同药物、不同浓度梯度的培养基,培养72h后,采用srb法测定ic
50
值。
[0246]
srb法:收集处于对数生长期的hepg-2、hela、mcf-7、mgc-803和a549细胞接种到96孔板中,3-4
×
103个/孔。在37℃,含5%co2培养箱中过夜培养使其贴壁,弃去旧培养基,然后加入不同浓度梯度的含药培养基,培养72h后,弃去旧培养基,每孔加入100μl 10%(w/v)三氯乙酸后在4℃固定30min后弃去固定液,用超纯水清洗残留试剂,在65℃条件下烘干,每孔加入100μl 0.4%srb,室温条件下摇床染色20min,弃去染液,再用新配制的1%冰乙酸洗去残留染液,在65℃条件下干燥。最后在每孔加入150μl 10mm unbuffered trisbase,平板振荡5min溶解染料,用酶标仪测量560nm波长处的吸光度值(optical density,od)。抑制率(%)=(od
对照孔
-od
加药孔
)/od
对照孔
×
100%,并计算出抑制率为50%时药物的浓度。实验重复三次,数据以均值和标准差形式列出。
[0247]
(2)悬浮细胞增殖抑制活性测定
[0248]
收集处于对数生长期的细胞,计数后,按照1
×
104个/孔,根据公式:c
1v1
=c
2v2
计算出每个96孔板所需细胞悬液量,每孔加入50μl细胞悬液,每孔加入50μl不同浓度梯度的含药rpmi-1640培养基,培养72h后,采用cck-8法测定ic
50
值。
[0249]
cell counting kit(cck-8)法:收集处于对数生长期的u937细胞,接种到96孔板中,8
×
103个/孔,将含药培养基和细胞悬液一起加到孔内。取三个孔,加入空白培养基,作为空白组。在37℃,含5%co2培养箱中孵育72h。每孔加入10μl cck-8染液,在培养箱中继续孵育3~4h,用酶标仪测量450nm波长处的吸光度值,无药物对照组od值控制在2.0为宜。按照下面公式测定ic
50
值。增殖抑制率的计算公式:抑制率(%)=(od
对照孔
-od
加药孔
)/(od
对照孔
-od
空白孔
)
×
100%。
[0250]
本发明实施例化合物ic
50
值详见下表1-5:
[0251]
表1
[0252][0253]
表2
[0254][0255]
表3
[0256][0257][0258]
表4
[0259][0260]
表5
[0261][0262][0263]
根据以上测试可知,r1中含甲氧基取代时,能够提高化合物的活性;r2为亚乙烯基时,化合物具有更高的活性。
[0264]
以上,对本发明的实施方式进行了说明。但是,本发明不限定于上述实施方式。凡在本发明的精神和原则之内,所做的任何修改、等同替换、改进等,均应包含在本发明的保护范围之内。
再多了解一些
本文用于创业者技术爱好者查询,仅供学习研究,如用于商业用途,请联系技术所有人。