1.本发明涉及农业技术领域,具体涉及一种香蕉枯萎病色谱检测方法。
背景技术:
2.香蕉是热带、亚热带地区广泛种植水果,现已成为全球鲜果贸易量和消费量最大的水果,也被联合国粮农组织(fao)定位为发展中国家继水稻、小麦、玉米之后的第四大粮食作物。然而由土传真菌尖孢镰刀菌古巴转化型(foc)热带1和4号生理小种引起的香蕉枯萎病,特别是4号生理小种近年来迅速在包括我国在内的东南亚17个国家和地区爆发和流行,对香蕉产业的可持续发展造成重大威胁。研究发现香蕉枯萎病菌几乎可以感染所有的香蕉主栽品种,特别是其分泌的毒素
‑‑
白僵菌素和镰刀菌酸在其致病过程中起重要作用。
3.镰刀菌酸(fa)又称萎蔫酸,5-丁基吡啶-2-羧酸(c
10h13
no2),是由尖孢镰刀菌产生的一种寄主非专化性毒素次生代谢,研究人员先后从芝麻、香蕉、棉花、苦瓜等作物枯萎病菌或其培养基中分离该化合物。
4.白僵菌素(bea)是由白僵菌、一些镰刀菌等生物合成的一类n-甲基氨基酸的环状六肽。其最先是从昆虫病原真菌球孢白僵菌中分离得到,近年来研究人员从培养香蕉枯萎病菌热带1和4号生理小种的培养液中陆续分离分离出该致病物,存在一定的转化性,对其致病香蕉毒性机制尚不完全清楚。
5.当前对于香蕉枯萎病的检测主要是在其危害香蕉并表现出明显的症状的前提下,通过病征和实验室分子生物学检测来实现。前者存在不确定性和假阳性,后者耗时且费用较高。目前虽然也有采用液相串联质谱检测镰刀霉菌毒素,但是尚未发现有针对香蕉枯萎病同时检测镰刀菌酸和白僵菌素的技术,因而研究一种香蕉枯萎病色谱检测方法,对香蕉及土壤样品中白僵菌素和镰刀菌酸同时进行精确提取、分离和检测,间接检测香蕉枯萎病尤为必要。
技术实现要素:
6.本发明克服了现有的技术香蕉枯萎病的检测主要是在其危害香蕉并表现出明显的症状的前提下,通过病征和实验室分子生物学检测来实现。前者存在不确定性和假阳性,后者耗时且费用较高的技术问题,提供一种香蕉枯萎病色谱检测方法,其采用超高压液质联用法对香蕉及土壤样品中白僵菌素和镰刀菌酸同时进行精确提取、分离和检测,间接检测香蕉枯萎病。
7.为解决上述问题,本发明采取如下技术方案:
8.一种香蕉枯萎病色谱检测方法,其对香蕉枯萎病代谢毒素
‑‑
白僵菌素和镰刀菌酸的分离和同时检测,具体包括如下步骤:
9.s1样品预处理:向待测样品中加入蒸馏水后匀浆或直接匀浆/混匀得到待测预处理样品;
10.s2样品的提取与净化:
11.准确称取步骤s1得到的待测预处理样品,向待测预处理样品中加入提取溶剂后涡旋提取0.5~2.0min后得到提取液,向提取液中加入盐包后继续涡旋1min,于4000r/min下离心2~10min,将上清液通过装有c
18
、psa的固相萃取小柱净化,收集净化液后过0.22μm有机微孔滤膜;所述待测预处理样品与提取溶剂的比例为1g:1~4ml;所述提取溶剂为酸性乙腈提取液;所述酸性乙腈提取液中含有质量百分比为0.05%~2%的酸性物质;
12.s3分离与鉴定:
13.采用超高压液质联用仪对步骤s2中通过有机微孔滤膜后的净化液进行梯度洗脱分离和质谱检测,其液相洗脱分离条件如下:
14.色谱柱:acquityuplc@hss t3;
15.流动相a:甲酸水溶液,甲酸体积百分比为0.05-0.5%;
16.流动相b:甲酸乙腈溶液,甲酸体积百分比为0.05%~0.5%;
17.流速:0.25ml/min,柱温35℃,进样量2μl;
18.梯度洗脱程序:
[0019][0020]
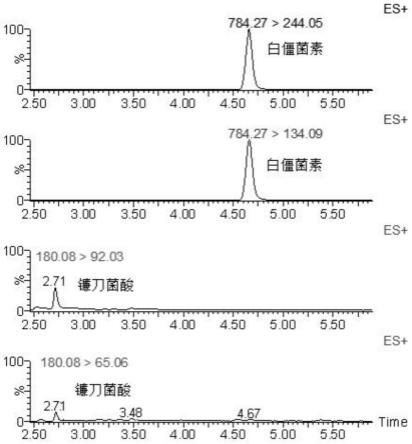
白僵菌素保留时间4.68min,镰刀菌酸保留时间2.71min;
[0021]
其质谱检测条件如下:
[0022]
质谱条件:采用电喷雾离子源es
,多反应监测(mrm)检测;
[0023]
毛细管电压:3.0kv;
[0024]
离子源温度:350℃;
[0025]
脱溶剂气为n2;
[0026]
脱溶剂气流速:n2,400~1000l/h;
[0027]
锥孔气流速:n2,150l/h;
[0028]
碰撞气流速:ar,0.10ml/min;
[0029]
毒素的质谱参数调谐如下:
[0030]
白僵菌素:定量离子对784.27》134.09,锥孔电压54v,碰撞能量30ev;定性离子对784.27》244.05,锥孔电压54v,碰撞能量24ev;
[0031]
镰刀菌酸:定量离子对为180.08》65.06,锥孔电压74v,碰撞能量50ev;定性离子对180.08》92.03,锥孔电压74v,碰撞能量24ev。
[0032]
进一步的,步骤s2中,所述酸性乙腈提取液中含有酸性物质,所述酸性物质为甲酸、乙酸或盐酸中的一种;所述酸性物质的体积百分比为0.05%~2%。
[0033]
进一步的,步骤s2中,所述酸性乙腈提取液中含有体积百分比为0.5%的乙酸。
[0034]
进一步的,所述盐包是含有无水氯化钠、无水硫酸钠、无水硫酸镁、柠檬酸钠、柠檬
酸二钠中一种或几种。
[0035]
进一步的,所述固相萃取小柱内填有50mg c
18
、50mg psa、150mg无水硫酸镁。
[0036]
进一步的,步骤s3中,所述甲酸水溶液中,甲酸的体积百分比0.1%;所述甲酸乙腈溶液中,甲酸的体积百分比0.1%。
[0037]
进一步的,步骤s3中,同时检测白僵菌素和镰刀菌酸的定性、定量离子对,其分子质量分别偏差
±
1,是间接检测确证香蕉枯萎病的方法。
[0038]
进一步的,步骤s1中,所述样品为含枯萎病菌代谢毒物的香蕉样品和土壤样品,所述香蕉样品包括香蕉的茎、叶、果。
[0039]
进一步的,步骤s1中,香蕉的茎、叶及果样品按重量比为1:1的比例加入蒸馏水充分匀浆;土壤样品在室内避光阴干后碾碎过40目筛,混匀,提取前需加入蒸馏水充分润湿。
[0040]
本发明与现有技术相比较具有以下有益效果:
[0041]
(1)本发明采用超高压液质联用法对样品中白僵菌素和镰刀菌酸同时检测,能够在40min内完成样品的提取、净化、分离和检测工作,相较对于传统的病原菌分离和分子鉴定方法,具有检测速度快、灵敏度高、准确性好、操作简单、检测成本低的优点,在鉴定效率和费用上及准确性上都有优势。本发明直接检测样品中香蕉枯萎病致病菌代谢物的含量,检测结果可以直接用来评估农作物种植地土壤环境条件的安全性;也可以作为香蕉健康种苗生产的质量控制,用以判断生产的香蕉健康种苗是否携带枯萎病病原菌,其作为将为香蕉及其它作物健康种苗,条件风险评估方面提供检测数据支持。
[0042]
(2)本发明步骤s2采用乙腈作为提取溶剂,主要是利用其在提取前期(未加盐)能与水溶液互溶,从而能和被提取物充分接触,加入盐后,使水相中乙腈溶解度急剧降低,离心处理后,两者发生分层,上清液再采用通过式固相分散萃取净化,过滤膜后上机检测。本发明采取的样品的提取与净化检测技术,与经典的样品前处理方案:“采用液液萃取、浓缩萃取液,固相萃取小柱净化、洗脱、浓缩、定容,过滤膜上机检测”相比,减少了上机检测前处理步骤,降低净化过程待测物是损失,提高待测物提取率;上机检测前处理时间控制在30min以内,而常规前处理一般需要3~6h,工作效率大大提高。
[0043]
(3)本发明步骤s2中采用酸性乙腈作为提取溶剂,主要是使白僵菌素和镰刀菌酸在提取溶液中维持有机酸理化性质,获得较高的提取率,特别是白僵菌素,由于其水溶性好,很长时间以来没有被发现,主要原因是仅通过有机溶剂比较难使其从水溶液中提取出来。本发明采用酸性乙腈提取液,所述酸性乙腈提取液中含有质量百分比为0.05%~2%的酸性物质;优选为含有0.5%的甲酸、乙酸、盐酸等易挥发酸的酸性乙腈提取液,可以提高两种毒素代谢物在样品提取液体系中的酸稳定性。
[0044]
(4)申请人在建立仪器质谱方法时发现,本发明步骤s3中流动相a采用甲酸水溶液(甲酸体积百分比为0.05-0.5%),流动相b采用甲酸乙腈溶液(甲酸体积百分比0.05%~0.5%),与通常仅流动相a采用甲酸水溶液(甲酸体积百分比为0.05-0.5%)相比,本发明流动相b也采用甲酸乙腈溶液后,两种毒素代谢物信号更强,峰形窄且对称,质谱检测效果更好。
附图说明
[0045]
图1为本发明实施例2中镰刀菌酸和白僵菌素mrm多反应监测离子图。
具体实施方式
[0046]
下面结合实施例和试验对本发明作进一步说明。
[0047]
实施例1:
[0048]
本实施例提供一种土壤样品中香蕉枯萎病菌检测方法,包括:
[0049]
s1样品预处理:四分法采集样品,土壤样品采集后,在室温下充分阴干,再碾碎过40目筛,混匀后得到土壤待测预处理样品,写上标签备用;
[0050]
s2样品的提取与净化:
[0051]
准确称取步骤s1得到的土壤待测预处理样品10.00g,视土壤的干燥程度,向土壤中加入2~3ml蒸馏水,充分湿润土壤;按土壤待测预处理样品与酸性乙腈提取液的比例为1g:2ml向土壤待测预处理样品中加入20.0ml酸性乙腈提取液,涡旋提取2.0min后得到提取液,向提取液中加入3.0g经350℃烘干过的氯化钠粉末(即无水氯化钠粉末)后继续涡旋1min,于4000r/min下离心2min取上清液2.0ml,将所述上清液通过装有50mgc
18
、50mgpsa、150mg无水硫酸镁的通过式固相萃取小柱净化,收集净化液后过0.22μm有机微孔滤膜;
[0052]
其中,所述酸性乙腈提取液即为提取溶剂,其含有体积百分比为0.5%的乙酸;
[0053]
s3分离与测定:
[0054]
采用超高压液质联用仪对步骤s2中通过有机微孔滤膜后的净化液进行梯度洗脱分离和质谱检测,其液相洗脱分离条件如下:
[0055]
色谱柱:acquityuplc@hss t3;
[0056]
流动相a:甲酸水溶液,甲酸体积百分比为0.1%;
[0057]
流动相b:甲酸乙腈溶液,甲酸体积百分比为0.1%;
[0058]
流速:0.25ml/min,柱温35℃,进样量2μl;
[0059]
梯度洗脱程序:
[0060][0061]
白僵菌素保留时间4.68min,镰刀菌酸保留时间2.71min;
[0062]
其质谱检测条件如下:
[0063]
质谱条件:采用电喷雾离子源es
,多反应监测(mrm)检测;
[0064]
毛细管电压:3.0kv;
[0065]
离子源温度:350℃;
[0066]
脱溶剂气为n2;
[0067]
脱溶剂气流速:n2,700l/h;
[0068]
锥孔气流速:n2,150l/h;
[0069]
碰撞气流速:ar,0.10ml/min;
[0070]
毒素的质谱参数调谐如下:
[0071]
白僵菌素:定量离子对784.27》134.09,锥孔电压54v,碰撞能量30ev;定性离子对784.27》244.05,锥孔电压54v,碰撞能量24ev;
[0072]
镰刀菌酸:定量离子对为180.08》65.06,锥孔电压74v,碰撞能量50ev;定性离子对180.08》92.03,锥孔电压74v,碰撞能量24ev。
[0073]
实施例2:
[0074]
本实施例提供一种香蕉球茎、叶中香蕉枯萎病菌检测方法,包括:
[0075]
s1样品预处理:四分法采集样品,按香蕉样品:蒸馏水的质量比为1:1的比例向待测香蕉样品中加入蒸馏水,再放入破壁料理机中匀浆得到香蕉待测预处理样品;
[0076]
s2样品的提取与净化:
[0077]
准确称取步骤s1已经充分匀浆得到的香蕉待测预处理样品20.00g,按土壤待测预处理样品与酸性乙腈提取液的比例为1g:2ml向香蕉待测预处理样品中加入40.0ml酸性乙腈提取液;涡旋提取2.0min后得到提取液,向提取液中加入6g经350℃烘干过的氯化钠粉末(即无水氯化钠粉末)后继续涡旋1min,于4000r/min下离心10min取上清液2ml,将所述上清液通过装有50mgc
18
、50mgpsa、150mg无水硫酸镁的通过式固相萃取小柱净化,收集净化液后过0.22μm有机微孔滤膜;
[0078]
其中,所述酸性乙腈提取液即为提取溶剂,其含质量百分比0.5%乙酸;
[0079]
本实施例中,s3分离与检测同实施例1中的步骤s3;
[0080]
采用上述超高压液质联用仪对香蕉枯萎病代谢毒物镰刀菌酸和白僵菌素进行分析检测,镰刀菌酸和白僵菌素mrm多反应监测离子图见图1,从图1中可见白僵菌素保留时间4.68min,镰刀菌酸保留时间2.71min,峰形窄且对称。
[0081]
试验一
[0082]
根据实施例1和实施例2的样品前处理方法和s3步骤的仪器条件,对香蕉土壤、球茎、全果样品进行添加回收和精密度评价实验,结果见表1。由表1可知,在0.01、0.04、0.2mg/kg样品添加水平下,白僵菌素和镰刀菌酸在土壤中的平均回收率为93.29%~97.09%,相对标准偏差为1.64%~8.23%,在球茎中的平均回收率为95.45%~106.62%,相对标准偏差为0.84%~5.00%,在全果中的平均回收率在87.26%~106.98%,相对标准偏差为0.74%~4.61%。
[0083]
经过仪器检测基质标样的信噪比计算得到:白僵菌素和镰刀菌酸在土壤中最低检测浓度分别为0.01ug/kg、4.38ug/kg。在球茎中最低检测浓度分别为0.04ug/kg、7.79ug/kg,在香蕉全果中最低检测浓度分别为0.03ug/kg、7.63ug/kg,完全符合检测要求,由此可以说明本发明建立的检测方法灵敏度高,重复性好,能够比较精确检出香蕉枯萎病代谢毒物。
[0084]
表1不同香蕉样品中镰刀菌酸和白僵菌素添加回收结果(n=5)
[0085][0086]
试验二
[0087]
根据实施例2的检测方法,对不同浓度酸性乙腈提取液进行添加回收和精密度评价实验。由表2可知,不同浓度的甲酸乙腈和乙酸乙腈对白僵菌素和镰刀菌酸的提取有一定影响,乙腈中酸的浓度为0.05%以上时,两种毒素的添加回收率均达到80%以上,而乙腈中乙酸的浓度为0.5%时,两种毒素的添加回收率均超过93.35%,而含同样浓度的甲酸乙腈,其对白僵菌素的提取无差别,其对镰刀菌酸的提取不超过88%。综合考虑后取含有0.5%乙酸的乙腈作为最佳的提取溶剂。
[0088]
表2不同浓度酸性乙腈对镰刀菌酸和白僵菌素添加回收结果(n=3)
[0089][0090]
试验三
[0091]
香蕉枯萎病在培养菌液中毒素的提取和检测
[0092]
1、香蕉枯萎病菌活化和培养
[0093]
制备马铃薯固体培养基(pda):称取200g马铃薯碎块加入1000ml蒸馏水中,加热煮沸30min,将经过煮沸后的汤通过四层纱布过滤,取下层滤液,向滤液中加入20g葡萄糖,15~20g琼脂粉,继续搅拌溶解并加水定容到2000ml,分装后在121℃下在高压蒸汽灭菌锅中进行高压灭菌20min,冷却后备用。
[0094]
制备察氏培养基:称取硝酸钠3g,磷酸氢二钾1g,七水硫酸镁0.5g,氯化钾0.5g,硫酸亚铁0.01g,蔗糖30g在1000ml去离子水中加热溶解分装后,在121℃下灭菌20min,冷却后备用。
[0095]
2、香蕉枯萎病致病菌尖孢镰刀菌古巴专化型(foc4)由华南农业大学植物病理学系真菌实验室提供。从试管中挑取少量foc4在pda上划线,在黑暗条件下的生化培养箱中28℃培养三代完成菌种活化。用打孔器取出6mm的菌碟放入察氏培养基中,在28℃,180rpm,黑暗的条件下在振荡培养箱中震荡培养。定期取出foc4放入超净工作台中,在40倍的光学显微镜下观察并用血球计数板计数,对同期收集的菌液,准确称取5.00g,按照菌液:乙酸乙腈溶液为1:2的重量比加入10ml含质量百分比0.5%乙酸乙腈溶液,涡旋提取2min后,加入3.0g经350℃烘干氯化钠粉末继续涡旋1min,4000r/min离心5min,取上清液通过装有50mgc
18
、50mgpsa、150mg无水硫酸镁的通过式固相萃取小柱净化,净化液过0.22μm有机微孔滤膜,按实施例2中s3步骤的仪器条件上机检测。活化的香蕉枯萎病致病菌尖孢镰刀菌古巴专化型在察氏培养菌液中不同时间的毒素代谢物积累含量见下表3。
[0096]
表3不同培养时间菌液中白僵菌素和镰刀菌酸含量(n=3)
[0097][0098]
由表3可知,白僵菌素和镰刀菌酸含量随培养时间延长而不断增加,镰刀菌素在培养第3天达到最大值,然后随时间延长略有下降,而白僵菌素在培养期间含量逐渐增加。
[0099]
试验四
[0100]
香蕉枯萎病样品检测比较:
[0101]
本单位日前已进行蕉枯萎病病原菌分子检测与鉴定的相关实验研究,相关内容已经公开,具体公开在文献“广西香蕉枯萎病病原菌4号生理小种的分子检测与鉴定”,莫贱友等著,《南方农业学报》,第2012年第43期。本试验利用该文献中相同的病菌菌株感染的香蕉样品进行对比实验。该文献中,香蕉枯萎病样品为:采集广西香蕉主产区疑似枯萎病的香蕉病体样品6份,对应编号1~6号,香蕉品种主要是威廉斯、西贡蕉。该文献中分离病株球茎和病原纯化,以获得病菌菌株,本次实验采用文献中相同病菌菌株感染的香蕉枯萎病样品进行检测,其中对应的编号相同,阴性对照也为未感病的盆栽威廉斯香蕉苗,阳性对照也为接种香蕉枯萎病菌1号和4号生理小种并表现出明显症状的盆栽威廉斯香蕉苗,实验时取球茎样品匀浆制样,进行毒素代谢物白僵菌素和镰刀菌酸定性和定量检测。
[0102]
其中,香蕉枯萎病病原菌分子检测与鉴定的检测方法和检测结果同样记载在上述
文献中。而依照本发明实施例2的检测方法,对上述不同球茎样品进行匀浆制样,进行毒素代谢物白僵菌素和镰刀菌酸定性和定量检测,不同样品中的白僵菌素和镰刀菌酸进行提取检测结果如下表4:
[0103]
表4不同样品中白僵菌素和镰刀菌酸含量(n=2)
[0104][0105]
“‑”
表示未检出或低于仪器检出限。
[0106]
由表4可知,除阴性对照m外,其它样品均同时检测到了香蕉枯萎病代谢毒素——白僵菌素和镰刀菌酸,香蕉枯萎病尖孢镰刀菌古巴专化型1号生理小种其白僵菌素的检出浓度略高于镰刀菌酸,而其它样品包括香蕉枯萎病尖孢镰刀菌古巴专化型4号生理小种,其镰刀菌酸检出浓度均高于白僵菌素。与上述文献中记载的pcr检测结果基本一致,但仍无法根据检测浓度的高低区分是哪个生理小种,但两种致病生理小种为目前我国香蕉上主要致病菌。
[0107]
根据上述本发明色谱检测方法和传统的病原菌检测的结果比较可知,本发明专利提出的采用色谱检测方法鉴定毒素,检测香蕉枯萎病是可行的,与传统的病原菌检测相比,本发明具有快速、简便且精确的优点,在鉴定效率和费用上及准确性上都有优势。由于本发明涉及两种毒素同时检测,且白僵菌素之前很少被发现,目前尚未有假阳性的现象,因此,本发明的检测结果可以直接用来评估农作物种植地土壤环境条件的安全性,也可以作为香蕉健康种苗生产的质量控制,用以判断生产的香蕉健康种苗是否携带枯萎病病原菌。其可以为香蕉及其它作物健康种苗,条件风险评估方面提供检测数据支持。
[0108]
上述说明是针对本发明较佳可行实施例的详细说明,但实施例并非用以限定本发明的专利申请范围,凡本发明所提示的技术精神下所完成的同等变化或修饰变更,均应属于本发明所涵盖专利范围。
再多了解一些
本文用于创业者技术爱好者查询,仅供学习研究,如用于商业用途,请联系技术所有人。