1.本发明涉及抗冠状病毒领域,特别地,涉及一种九节茶或其提取物、清热消炎宁制剂在 制备抗冠状病毒药物中的应用。此外,本发明还涉及一种包括上述清热消炎宁制剂的制备方 法。
背景技术:
2.冠状病毒属于套氏病毒目,冠状病毒科,是目前自然界已知的最大rna病毒。冠状病毒 在现实中感染非常普遍,自然宿主分布广泛,且感染通常有一段潜伏期,其感染宿主主要是 禽类和哺乳动物。第一例人冠状病毒(hcov)于1965年从普通感冒患者的鼻腔分泌物中分离 出来,命名为hcov-229e。此后,不同的冠状病毒被陆续从人体内分离出来。冠状病毒感染 宿主后,受感染宿主体内的病毒基因组会持续复制、突变、重组,不仅引起宿主呼吸系统、 消化系统和神经系统疾病,而且变异的累积还可能产生跨宿主感染。病毒对热敏感,紫外线、 来苏水、0.1%过氧乙酸及1%克辽林等都可在短时间内将病毒杀死。冠状病毒为直径100~160 nm的球形颗粒,包膜形似冠状突起,核衣壳呈螺旋对称,冠状病毒是正义单链rna病毒, 其5’端具甲基化的帽子,编码一个多聚蛋白,该多聚蛋白包含16个非结构蛋白,参与基因组 的转录和复制,而其3’端有poly a尾巴,编码一系列结构蛋白,包括棘突蛋白s、小分子包 膜蛋白e、膜蛋白m、核衣壳蛋白n,以及只见于少数冠状病毒的血凝素蛋白。除了编码结 构蛋白的基因外,还有一些辅助蛋白,这些辅助蛋白具有物种特异性,并且对于病毒的复制 不可或缺。
3.既往已知感染人的冠状病毒有6种,分别是人冠状病毒hcov-229e、hcov-oc43、 hcov-nl63和hcov-hku1,以及严重急性呼吸系统综合征冠状病毒sars-cov和中东呼吸 综合症冠状病毒mers-cov;sars-cov-2是目前已知的第7种可以感染人的冠状病毒。以上 冠状病毒中,前4种冠状病毒会引发较轻微症状的普通感冒,而后3种则会导致严重症状且 传染性强,甚至引发致死的病毒性肺炎。寻找能够有效抗冠状病毒的药物已经迫在眉睫。
4.九节茶又名肿节风,其药用历史悠久,历代医书都有记载其广泛的用药价值,具有清热 解毒、抗菌消炎、清肺止咳、祛风除湿、舒筋活络、活血止痛、接骨续伤等功效。而我司研 制的清热消炎宁片是根据“热者寒之,温者清之”的传统中医原则,采用天然药材九节茶或其研 制而成的中药制剂,现已列入湖南、内蒙古地方医保乙类。
5.中国专利cn102793731b公开了九节茶提取物在降低流感病毒易感性上的应用;文 献(中药肿节风抗感染作用研究进展,李际强等)公开了中药肿节风具有抗菌、消炎、 镇痛、抗肿瘤及免疫调节作用,临床应用不良反应较少。但是,目前尚未见将九节茶 或其提取物、清热消炎宁制剂在制备抗冠状病毒药物中的应用的报道。
6.因为人冠状病毒基因变异的高发,使其传播速度加快、感染能力增强、患者感染后症状 加重。因此,有必要对人冠状病毒和动物携带的冠状病毒变异或流行情况进行监控和研究, 并研制和发现更多的抗人冠状病毒药物,以更好地应对将来可能发生的新型人冠状
病毒的流 行。
技术实现要素:
7.本发明提供了一种九节茶或其提取物、清热消炎宁制剂在制备抗冠状病毒药物中的应用 及其制备方法,以解决针对冠状病毒缺乏有效防治药物的技术问题。
8.本发明采用的技术方案如下:
9.本发明一种九节茶或其提取物在制备抗冠状病毒药物中的应用。
10.本发明所称九节茶为金粟兰科植物,又称草珊瑚sarcandra glabra(thunb.)nakai,为干燥的 地上部分。
11.九节茶历史悠久,历代医书都有记载其广泛的药用价值,具有清热解毒、清肺止咳、祛 风除湿、舒筋活络、活血止痛、接骨续伤等功效。
12.进一步地,九节茶中异嗪皮啶的质量百分比不少于0.02%。九节茶提取物中异嗪皮啶的质 量百分比不少于0.26%。九节茶中的有效活性成分之一为异嗪皮啶。
13.优选地,冠状病毒为人冠状病毒hcov-229e。上述清热消炎宁制剂在测试浓度范围内(12.5 μg/ml~500μg/ml)对mdck细胞无明显细胞毒性,而且,其在一定程度上抑制了hcov-229e 病毒在细胞内的复制增殖。
14.根据本发明的另一方面,还提供了一种清热消炎宁制剂在制备抗冠状病毒药物中的应用, 清热消炎宁制剂为采用上述应用中的九节茶或其提取物与药用辅料组合的单方制剂。
15.九节茶,其药用历史悠久,历代医书都有记载其广泛的用药价值,具有清热解毒、抗菌 消炎、清肺止咳、祛风除湿、舒筋活络、活血止痛、接骨续伤等功效。而我司研制的清热消 炎宁片是根据“热者寒之,温者清之”的传统中医原则,采用天然药材九节茶或其研制而成的中 药制剂,现已列入湖南、内蒙古地方医保乙类。上述九节茶在制备抗冠状病毒药物的新用途, 能有效的抑制冠状病毒在细胞内的复制增殖,应用于人冠状病毒致高危症状感染。
16.清热消炎宁制剂是以清泻里热为主要作用的清热药,其药性寒凉,具有清热泻火、解毒、 清虚热等功效,多靶点、多途径发挥作用。清热消炎宁制剂作为抗菌消炎药已在临床长期应 用,其安全性、药物代谢特性、毒副作用已经明确。上述清热消炎宁制剂在抗冠状病毒药物 中的新应用。上述清热消炎宁制剂中的制剂可以为胶囊、片剂、丸剂、颗粒剂、冲剂、注射 药剂或喷剂等。
17.优选的,所述的清热消炎宁制剂在制备抗冠状病毒感染引发的呼吸道感染疾病药物中的 应用。
18.优选的,所述清热消炎宁制剂在制备抗冠状病毒感染引发的急性上呼吸道感染或急性下 呼吸道感染的药物中的应用。
19.进一步,所述清热消炎宁制剂在制备抗冠状病毒药物中的应用,所述清热消炎宁制剂体 内抑制冠状病毒主要成分异嗪皮啶剂量使用范围不少于2.31mg/kg体重/每日。
20.根据本发明的另一方面,还提供了一种清热消炎宁制剂的制备方法,包括以下步骤:
21.s1、混合制软材:将九节茶提取物、玉米淀粉、糊精进行干法混合,再加入95%的乙
醇 进行湿法混合,制得软材;
22.s2、干燥:对软材加热干燥,控制水分在5%~7%,获得干燥物料;
23.s3、整粒:对干燥物料进行整粒;
24.s4、总混:整粒后的干燥物料与硬脂酸镁混合均匀,获得总物料;
25.s5、压片:对总物料进行压片,获得素片;
26.s6、包衣:将包衣粉与水混合均匀,获得包衣液,包衣液均匀喷雾在素片表面,干燥, 冷却,获得清热消炎宁制剂。
27.上述清热消炎宁制剂的制备方法,包括混合制软材、干燥、整粒、总混、压片、包衣, 上述清热消炎宁制剂的制备,主要为清热消炎宁片剂,制备的片剂生产工艺和设备简单,操 作方便,自动化程度高,劳动强度低,生产效率高。上述九节茶提取物作为九节茶提取物中 的一种。清热消炎宁制剂的制备方法为清热消炎宁片的制备方法。
28.进一步地,步骤s1中九节茶提取物、玉米淀粉、糊精的质量比为(22~24)∶(0.5~1. 5)∶(1~1.5),95%的乙醇与九节茶提取物的质量比为1∶(3~6);
29.步骤s4中硬脂酸镁与九节茶提取物的质量比为1∶(85~96);
30.步骤s6中包衣粉与九节茶提取物的质量比为1∶(34~38),包衣液的固含量为18%~ 24%。
31.进一步地,包衣的具体步骤包括:将包衣粉与水混合均匀,获得包衣液;将素片置包衣 锅内,开启包衣锅的加热系统,控制转速6~8转/分,进风口温度85℃以上,出风口温度不 得低于50℃,片床温度为40℃~45℃;开启喷液系统,使包衣液喷雾在素片表面,保持片床 的温度为35℃~40℃,转速为8~10转/分;待素片表面均匀喷雾一层包衣液后,调节转速为 10~12转/分,继续喷雾包衣液,直至所有包衣液喷完,干燥5min,关闭热风,滚光冷却15min 后出锅,获得清热消炎宁制剂。
32.上述清热消炎宁片剂的制备方法具体包括以下步骤:
33.s1、混合制软材:将285kg~315kg的九节茶提取物、12.7kg的玉米淀粉、15kg的糊精, 用高速混合制粒机进行干法混合,混合1~2分钟,混合均匀,再加入80kg的95%的乙醇在 卧式湿法混和制粒机进行湿法混合,混合2~4分钟,混合均匀,制得软材;
34.s2、干燥:将软材在加热设备中加热干燥,温度设置为50~70℃,干燥5~10min,控制 水分在5%~7%,获得干燥物料;
35.s3、整粒:对干燥物料进行整粒,采用摇摆式颗粒机,用14目筛网对干燥物料进行整粒;
36.s4、总混:在二维运动混合机中将整粒后的干燥物料与3.3kg的硬脂酸镁混合10min, 获得总物料;
37.s5、压片:选取φ10mm浅凹冲模,用旋转式压片机操作,压片机转速10~38转/分,对 总物料进行压片,获得素片,素片硬度不小于4kg;
38.s6、包衣:将8.4kg的包衣粉与水混合均匀,获得包衣液,包衣液的固含量为18%~24%, 将素片置于包衣锅内,开启包衣锅的加热系统,控制转速6~8转/分,进风口温度85℃以上, 出风口温度不得低于50℃,片床温度为40℃~45℃;开启喷液系统,使包衣液喷雾在素片表 面,保持片床的温度为35℃~40℃,转速为8~10转/分;待素片表面均匀喷雾一层包衣液后, 调节转速为10~12转/分,继续喷雾包衣液,直至所有包衣液喷完,干燥5min,
关闭热风, 滚光冷却15min后出锅,获得清热消炎宁片剂。
39.进一步地,九节茶提取物的制备方法包括以下步骤:对九节茶饮片加水提取二次,过滤, 合并滤液;将滤液进行双效浓缩,浓缩至相对密度为1.25~1.3(60℃)的稠膏,收膏;将收 膏后的稠膏干燥,获得干浸膏;将干浸膏进行粗法破碎,再进行细法粉碎,过筛,获得九节 茶提取物。
40.进一步地,稠膏干燥的具体步骤包括:将稠膏在配料罐中加热至60℃搅拌均匀,再转入 真空带式干燥机进行干燥,真空带式干燥机采用四段式加热,第一段、第二段、第三段加热 温度为100℃~110℃,第四段加热温度均为10℃~30℃,进料速度为15l/h~25l/h,履带 速度为120mm/min~150mm/min,真空度为-0.095mpa~-0.1mpa。
41.上述九节茶提取物的制备方法具体包括以下步骤:
42.对600kg九节茶饮片由投料口投入直筒提取罐中,分四锅提取,加水提取二次,第一次 加入九节茶饮片的6倍量水,提取1.5小时,第二次加入九节茶饮片的4倍量水,提取1小时, 经双联过滤器过滤,合并滤液;
43.将滤液进行双效浓缩,打开真空系统,控制真空度为-0.04mpa~-0.08mpa,开启加热及 冷凝系统蒸发水分,加热温度为60℃~70℃,获得稠膏;
44.将稠膏共浓缩收8min~10min,收膏至相对密度为1.25~1.3(60℃);
45.将收膏后的稠膏在配料罐中加热至60℃搅拌均匀,再转入真空带式干燥机进行干燥,真 空带式干燥机采用四段式加热,第一段、第二段、第三段加热温度均为100℃~110℃,第四 段加热温度均为10℃~30℃,筒体温度不超过60℃,进料速度为15l/h~25l/h,履带速度 为120mm/min~150mm/min,真空度为-0.095mpa~-0.1mpa,获得干浸膏;
46.将干浸膏置于粗碎机进行粗法破碎,再在粉碎机进行细法粉碎,过100目筛,获得九节 茶提取物。
47.本发明具有以下有益效果:本发明的九节茶或其提取物、清热消炎宁制剂在制备抗冠状 病毒药物中的应用,上述九节茶或其提取物在制备抗冠状病毒药物属于新用途,能有效的抑 制冠状病毒在细胞内的复制增殖,应用于人冠状病毒致高危症状感染。所述清热消炎宁制剂 抑制人冠状病毒hcov-229e的ec
50
值小于等于45.94μg/ml。
48.体内实验药效表明,所述清热消炎宁制剂通过增加淋巴细胞cd3
、cd4
和nk细胞水平, 提高ifn-γ表达,从而抑制人冠状病毒hcov-229e在肺泡中的复制。所述清热消炎宁制剂通 过tlr4/myd88/ikk/iκb通路抑制tnf-α、il-1β和vcam-1水平,改善人冠状病毒hcov-229e 感染引起肺组织的炎症损伤。
49.本发明的九节茶或其提取物、清热消炎宁制剂在治疗由人冠状病毒hcov-229e感染性支 气管炎-肺炎模型及急性咽炎模型中取得了良好的疗效,能显著减少支气管、肺脏及咽部组织 的病变程度、改善动物体内巨噬细胞、淋巴细胞等免疫细胞及il-6、tnf-α等相关炎症因子 的表达,具有显著的抗冠状病毒的作用。
50.除了上面所描述的目的、特征和优点之外,本发明还有其它的目的、特征和优点。对本 发明作进一步详细的说明。
附图说明
51.图1为清热消炎宁片干膏粉对冠状病毒载量的影响图;
52.a:正常对照组;b:模型对照组;c:连花清瘟胶囊组;d:清热消炎宁片干膏粉低剂量组; e:清热消炎宁片干膏粉中剂量组;f:清热消炎宁片干膏粉高剂量组;
53.图2为各组蛋白表达条带图;
54.a:正常对照组;b:模型对照组;c:连花清瘟胶囊组;d:清热消炎宁片干膏粉低剂量组; e:清热消炎宁片干膏粉中剂量组;f:清热消炎宁片干膏粉高剂量组;
55.图3为各组蛋白表达相对定量图;
56.a:正常对照组;b:模型对照组;c:连花清瘟胶囊组;d:清热消炎宁片干膏粉低剂量组; e:清热消炎宁片干膏粉中剂量组;f:清热消炎宁片干膏粉高剂量组。
具体实施方式
57.需要说明的是,在不冲突的情况下,本技术中的实施例及实施例中的特征可以相互组合。 下面将结合实施例来详细说明本发明。
58.实施例
59.清热消炎宁片来自本实验中心,批号:090201001,含量:成品每片含有九节茶提取物0.38 g,成品每片重约为0.42g;
60.利巴韦林喷雾剂,400mg/瓶,蓬莱诺康药业有限公司,批号:200218;
61.重组人干扰素α-2b凝胶,规格1.0
×
105iu/克,10g/支,兆科药业(合肥)有限公司,批 号:20200202;
62.冠状病毒(hcov-229e),atcc-vr-740,购自美国atcc;
63.鼻病毒(rhv),atcc-vr-1187,购自美国atcc;
64.呼吸道合胞病毒(rsv),atcc-vr-26pq,购自美国atcc;
65.人宫颈癌细胞(h1hela)购自北京北纳创联生物技术研究院;
66.人胚肺细胞(mrc-5)、人喉表皮样癌细胞(hep-2)购自武汉普诺赛生命科技有限公司;
67.dmem培养基,购自hyclone公司,批号:af29498404;
68.胎牛血清(fbs),100ml/瓶,美国sciencell公司产品,批号:26399。
69.实施例1
70.清热消炎宁片剂的制备方法具体包括以下步骤:
71.s1、混合制软材:将301.14kg的九节茶提取物、12.7kg的玉米淀粉、15kg的糊精,用 高速混合制粒机进行干法混合,混合2分钟,混合均匀,再加入80kg的95%的乙醇在卧式湿 法混和制粒机进行湿法混合,混合4分钟,混合均匀,制得软材;
72.s2、干燥:将软材在加热设备中加热干燥,温度设置为60℃,干燥8min,控制水分在 5%~7%,获得干燥物料327kg;
73.s3、整粒:对干燥物料进行整粒,采用摇摆式颗粒机,用14目筛网对干燥物料进行整粒, 获得整粒物料325.56kg;
74.s4、总混:在二维运动混合机中将整粒后的干燥物料与3.3kg的硬脂酸镁混合10min, 获得总物料324.62kg;
75.s5、压片:选取φ10mm浅凹冲模,用旋转式压片机操作,压片机转速30转/分,对总物 料进行压片,获得素片322.54kg,素片硬度不小于4kg;
76.s6、包衣:将8.4kg的包衣粉与水混合均匀,获得包衣液,包衣液的固含量为20%,将 素片置于包衣锅内,开启包衣锅的加热系统,控制转速8转/分,进风口温度85℃以上,出风 口温度不得低于50℃,片床温度为845℃;开启喷液系统,使包衣液喷雾在素片表面,保持 片床的温度为840℃,转速为810转/分;待素片表面均匀喷雾一层包衣液后,调节转速为108 转/分,继续喷雾包衣液,直至所有包衣液喷完,干燥5min,关闭热风,滚光冷却15min后 出锅,获得清热消炎宁片剂331.83kg。
77.九节茶提取物的制备方法具体包括以下步骤:
78.称取九节茶饮片2962.96kg,共五份,每份592.59kg,由投料口投入直筒提取罐中,分 五锅提取,加饮用水提取两次,第一次加入药材的6倍量水3600kg,提取1.5小时,第二次 加入药材4倍量水2400kg,提取1小时,每次提取结束后放液,药液经双联过滤器过滤后, 由药液泵转入提取液储罐中,合并两次滤液,滤液总量25500l;
79.将滤液进行双效浓缩,打开真空系统,吸取滤液至适当液位后,再开启加热及冷凝系统 蒸发水分,浓缩过程中控制真空度为0.06mpa,一效温度控制为68℃,二效温度控制为63℃, 获得稠膏;
80.将稠膏共浓缩收膏9h 46min,两次浓缩收膏相对密度分别为1.26及1.25;
81.将收膏后的稠膏在配料罐中加热至60℃搅拌均匀,再转入真空带式干燥机进行干燥,真 空带式干燥机采用四段式加热,第一段、第二段、第三段加热温度均为105℃,第四段加热温 度均为25℃,筒体温度不超过60℃,进料速度为15l/h,履带速度为140mm/min,真空度为
ꢀ‑
0.095mpa,获得干浸膏304.61kg;
82.将干浸膏置于粗碎机进行粗法破碎,再在粉碎机进行细法粉碎,获得九节茶提取物干膏 粉301.14kg,收率为98.86%,异嗪皮啶含量为2.9mg/g。
83.实施例2
84.2.1细胞培养
85.人宫颈癌细胞(h1hela)、人胚肺细胞(mrc-5)、人喉表皮样癌细胞(hep-2),均为贴 壁生长细胞,培养基选用含10%fbs的dmem培养基,生长状态良好时,每隔2~3d可进 行传代。在净化工作台中弃去培养基,用1
×
pbs清洗2~3次,然后加入适量的0.25% trypsin-edta消化,约2~5min后,待细胞脱落,加入适量的含10%fbs的dmem培养基 以终止胰酶的消化作用,吹打成单细胞悬液,转入ep管中,以1000rpm离心5min。弃去培 养基,加入新鲜的培养基重悬,按细胞密度约为1
×
105/ml接种到新的培养瓶中,放置于37℃、 5%co2培养箱中培养至对数生长期。
86.2.2病毒的扩增
87.(1)mrc-5细胞扩增hcov-229e
88.将mrc-5细胞接种于培养瓶中,当细胞密度达到70~80%时去掉部分的培养基,剩余的 刚好覆盖细胞,加入适量的hcov-229e病毒,待病毒吸附于细胞表面后(约3h左右,每隔 30min轻轻晃动培养板,使病毒吸附均匀),更换不含fbs的新鲜dmem培养基,置于33℃、 5%co2加湿的恒温培养箱中培养。观察细胞开始产生病变至不再产生病变时(一般为2~7d) 采取反复冻融法,于3000rpm离心10min以除去细胞残渣,收集上清液,获得hcov-229e 病毒液,分装于冻存管中,标注后于-80℃中短期保存或液氮中长期保存,备用。
89.(2)hep-2细胞扩增rsv
90.将hep-2细胞接种于培养瓶中,当细胞密度达到70~80%时去掉部分的培养基,剩余的 刚好覆盖细胞,加入适量的rsv病毒,待病毒吸附于细胞表面后(约3h左右,每隔30min 轻轻晃动培养板,使病毒吸附均匀),更换不含fbs的新鲜dmem培养基,置于37℃、5%co2加湿的恒温培养箱中培养。观察细胞开始产生病变至不再产生病变时(一般为2~6d)采取 反复冻融法,于3000rpm离心10min以除去细胞残渣,收集上清液,获得rsv病毒液,分 装于冻存管中,标注后于-80℃中短期保存或液氮中长期保存,备用。
91.(3)h1hela细胞扩增rhv
92.将h1hela细胞接种于培养瓶中,当细胞密度达到70~80%时去掉部分的培养基,剩余 的刚好覆盖细胞,分别加入适量的rhv病毒,待病毒吸附于细胞表面后(约3h左右,每隔 30min轻轻晃动培养板,使病毒吸附均匀),更换不含fbs的新鲜培养基,置于37℃、5%co2加湿的恒温培养箱中培养。观察细胞开始产生病变至不再产生病变时(一般为2~6d)采取 反复冻融法,于3000rpm离心10min以除去细胞残渣,收集上清液分装于冻存管中,获得 rhv病毒液,标注后于-80℃中短期保存或液氮中长期保存,备用。
93.2.3将收集的病毒液进行tcid
50
的测定
94.分别将mrc-5、hep-2、h1hela单细胞悬液100μl接种在96孔细胞培养板中,待细胞 单层长满到70%~80%的密度时,即可进行病毒接种;
95.分别对hcov-229e病毒液、rsv病毒液、rhv病毒液取100μl进行10倍比稀释,共6 个稀释梯度,分别为10-1
,10-2
,10-3
,10-4
,10-5
,10-6
病毒稀释液;
96.病毒接种:弃去96孔板中原有的培养液,并用pbs液洗涤细胞2次,相对应的进行病毒 接种,每个病毒稀释浓度设重复的8个孔,每孔加入100μl的病毒稀释液,同时设未接种病 毒的对照孔,重复2个孔,加入细胞培养液100μl;将96孔板细胞板置于33℃~37℃,5%co2细胞培养箱中,培养1h,每隔15min,将培养板取出并轻柔晃动,促进病毒吸附细胞,将96 孔细胞培养板转移至培养箱,补充至100μl病毒稀释液,并做标记。每天在倒置显微镜下观 察细胞出现cpe的情况,记录出现有cpe的孔数,按reed-mench公式计算病毒的tcid
50 (tcid
50
,半数组织培养感染剂量,又称50%组织细胞感染量,即指能在培养板孔或试管内 引起半数细胞病变或死亡所需的病毒量,用以表征病毒的滴度)。
97.tcid
50
=高于50%cpe的病毒最高稀释对数 距离比例值
×
稀释倍数的对数;
98.距离比例值=(高于50%cpe的百分比-50%)
÷
(高于50%cpe的百分比-低于50%cpe 的百分比)。
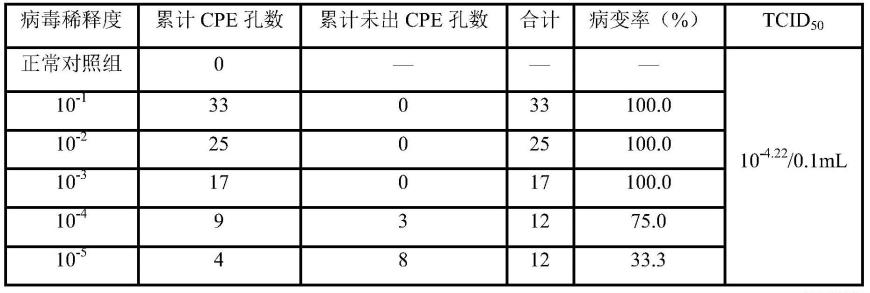
99.表1 hcov-229e对mrc-5细胞的半数病毒感染量
100.[0101][0102]
表2 rsv对hep-2细胞的半数病毒感染量
[0103][0104]
表3 rhv对h1hela细胞的半数病毒感染量
[0105][0106]
tcid
50
的测定结果如表1、表2和表3所示,冠状病毒(hcov-229e)、呼吸道合胞病毒 (rsv)和鼻病毒(rhv)的半数病毒感染量tcid
50
分别为10-4.22
/0.1ml、10-3.85
/0.1ml和 10-3.36
/0.1ml,上述病毒分别做1.66
×
104倍、7.08
×
103倍和2.29
×
103倍稀释时,取0.1ml接种 细胞,可使50%细胞产生病变。取100个tcid
50
病毒量,即分别稀释166倍、70.8倍和22.9 倍进行体外抗病毒试验。
[0107]
实施例3
[0108]
细胞毒性试验
[0109]
用10%fbs的dmem培养基配制系列浓度的清热消炎宁片溶液,浓度梯度分别为:500.0、 100.0、50.0、25.0、12.5μg/ml,加入至已培养的96孔板mrc-5细胞,37℃、5%co2加湿 的恒温培养箱中培养72h,加入mtt,继续培养4h,在492nm波长下测得各孔的od值, 计算细胞的ic
50
(ic
50
为半抑制浓度,或称半抑制率,达到50%抑制效果时抑制剂的浓度)。
[0110]
用10%fbs的dmem培养基配制系列浓度的清热消炎宁片溶液,浓度梯度分别为:500.0、 100.0、50.0、25.0、12.5μg/ml,加入至已培养的96孔板hep-2细胞,37℃、5%co2加湿的 恒温培养箱中培养72h,加入mtt,继续培养4h,在492nm波长下测得各孔的od值,计 算细胞的ic
50
。
[0111]
用10%fbs的dmem培养基配制系列浓度的清热消炎宁片溶液,浓度梯度分别为:500.0、 100.0、50.0、25.0、12.5μg/ml,加入至已培养的96孔板h1hela细胞,37℃、5%co2加湿 的恒温培养箱中培养72h,加入mtt,继续培养4h,在492nm波长下测得各孔的od值, 计算细胞的ic
50
。
[0112]
用10%fbs的dmem培养基配制系列浓度的干扰素α-2b溶液,浓度梯度分别为:1
×
103、 5
×
102、2.5
×
102、1.25
×
102、6.25
×
10iu/ml,加入至已培养的96孔板mrc-5细胞,37℃、5% co2加湿的恒温培养箱中培养72h,加入mtt,继续培养4h,在492nm波长下测得各孔的 od值,计算细胞的ic
50
。
[0113]
用10%fbs的dmem培养基配制系列浓度的利巴韦林溶液,浓度梯度分别为:500.0、 100.0、50.0、25.0、12.5μg/ml,加入至已培养的96孔板hep-2细胞,37℃、5%co2加湿的 恒温培养箱中培养72h,加入mtt,继续培养4h,在492nm波长下测得各孔的od值,计算 细胞的ic
50
。
[0114]
用10%fbs的dmem培养基配制系列浓度的利巴韦林溶液,浓度梯度分别为:500.0、 100.0、50.0、25.0、12.5μg/ml,加入至已培养的96孔板h1hela细胞,37℃、5%co2加湿 的恒温培养箱中培养72h,加入mtt,继续培养4h,在492nm波长下测得各孔的od值, 计算细胞的ic
50
。
[0115]
表4清热消炎宁片的细胞毒性结果
[0116][0117]
表5利巴韦林、干扰素α-2b的细胞毒性结果
[0118]
炎宁片对冠状病毒(hcov-229e)的ec
50
为45.94μg/ml,明显优于干扰素α-2b对冠状病毒 (hcov-229e)的ec
50
的64.98iu/ml,且清热消炎宁片对鼻病毒(rhv)和呼吸道合胞病毒 (rsv)的ec
50
均大于》100.0μg/ml,清热消炎宁片在一定程度上抑制了hcov-229e病毒在 细胞内的复制增殖,其抗hcov-229e病毒的效果明显优于抗rsv和rhv病毒,也说明了清 热消炎宁片对抗冠状病毒(hcov-229e)具有特异性。
[0135]
表6对hcov-229e感染mrc-5细胞的影响
[0136][0137]
表7对rhv感染h1hela细胞的影响
[0138][0139][0140]
表8受对rsv感染hep-2细胞的影响
[0141][0142]
实施例5
[0143]
清热消炎宁片干膏粉对感染冠状病毒小鼠一般生理的影响
[0144]
选取spf级balb/c小鼠96只,雌雄各半,体重10.2~13.9g,按性别和体重随机分为6 组,分别为正常对照组、模型对照组、连花清瘟胶囊组(0.546g/kg)、清热消炎宁片低、中、 高剂量组(8.72、17.44、34.89g生药/kg),每组16只动物。各组动物按20ml/kg经口灌胃给 予相应浓度的药液,正常对照组和模型对照组口服给予等体积的纯水,1次/日,连续给药7 天。除正常对照组外,各组小鼠于第3天给药后30min,腹腔注射100mg/kg的环磷酰胺进行 免疫抑制,次日乙醚轻微麻醉经鼻滴入hcov-229e冠状病毒液100μl/只(感染前进行滴度测 定,约为106tcid
50
/ml),正常对照组经鼻滴入等体积的空白培养基。给药期间每天对各组动 物进行称重,比较动物体重在试验期间的变化。结果如表9,清热消炎宁片干膏粉低剂量组小 鼠体重增长明显(p≤0.05或p≤0.01)。各给药组小鼠体重均明显高于模型对照组(p≤0.05 或p≤0.01)。
[0145]
表9清热消炎宁片干膏粉对感染冠状病毒小鼠体重的影响(n=16)
[0146][0147][0148]
注:与正常对照组比较
p≤0.01;与模型对照组比较
*
p≤0.05,
**
p≤0.01。
[0149]
实施例6
[0150]
清热消炎宁片干膏粉对感染冠状病毒小鼠肺指数、肺组织病理学的影响
[0151]
分组、造模与给药同实施例5中试验方法,对小鼠肺脏进行称重并计算肺指数,另外肺 组织进行he染色,根据炎症细胞浸润程度进行评分。结果如表10、11所示,连花清瘟胶囊 组、清热消炎宁片干膏粉低、中、高剂量组肺脏指数均明显下降(p≤0.01)。对感染冠状病毒 小鼠肺组织病理状况,清热消炎宁片干膏粉低剂量具有明显改善作用(p≤0.05)。
[0152]
表10清热消炎宁片干膏粉对感染冠状病毒小鼠肺指数的影响(n=10)
[0153]
组别剂量(g生药/kg)肺指数正常对照组-8.40
±
0.76模型对照组-12.39
±
1.05
连花清瘟胶囊组0.546g/kg10.68
±
1.53
**
清热消炎宁片干膏粉低剂量组8.7210.65
±
1.38
**
清热消炎宁片干膏粉中剂量组17.4410.74
±
0.86
**
清热消炎宁片干膏粉高剂量组34.8910.19
±
1.48
**
[0154]
注:与正常对照组比较
p≤0.01;与模型对照组比较
**
p≤0.01。
[0155]
表11清热消炎宁片干膏粉对感染冠状病毒小鼠肺组织病理的影响(n=10)
[0156]
组别剂量(g干膏粉/kg)病理评分正常对照组-0.0
±
0.0模型对照组-0.7
±
0.7
连花清瘟胶囊组0.546g/kg0.2
±
0.4清热消炎宁片干膏粉低剂量组8.720.1
±
0.3
*
清热消炎宁片干膏粉中剂量组17.440.3
±
0.5清热消炎宁片干膏粉高剂量组34.890.2
±
0.4
[0157]
注:与正常对照组比较
p≤0.01;与模型对照组比较
*
p≤0.05。
[0158]
实施例7
[0159]
清热消炎宁片干膏粉对肺组织冠状病毒载量的影响
[0160]
分组、造模与给药同实施例5中试验方法,采用相对定量pcr法检测冠状病毒载量。结 果如图1所示,连花清瘟胶囊组、清热消炎宁片干膏粉低、中、高剂量组病毒mrna表达明 显下降(p≤0.01)。
[0161]
实施例8
[0162]
清热消炎宁片干膏粉对肺泡灌洗液il-1β、tnf-α、ifn-γ、il-4和vcam-1含量的影响
[0163]
分组、造模与给药同实施例5中试验方法,利用elisa试剂盒检测肺泡灌洗液中il-1β、 tnf-α、ifn-γ、il-4和vcam-1的含量。结果如表12所示,连花清瘟胶囊组、清热消炎宁 片干膏粉中、高剂量组tnf-α、il-1β和vcam-1水平均明显降低(p≤0.05或p≤0.01),其 中连花清瘟胶囊可以有效降低il-4水平(p≤0.05),清热消炎宁片干膏粉高剂量可以显著提 高ifn-γ水平(p≤0.05)。
[0164]
表12清热消炎宁片干膏粉对感染冠状病毒小鼠细胞因子的影响(n=6)
[0165][0166]
注:与正常对照组比较
p≤0.05,
p≤0.01;与模型对照组比较
*
p≤0.05,
**
p≤0.01。
[0167]
实施例9
[0168]
清热消炎宁片干膏粉对肺组织免疫细胞数量的影响
[0169]
分组、造模与给药同实施例5中试验方法,采用流式细胞仪检测小鼠肺脏中巨噬细胞、 淋巴细胞(cd3
、cd4
)以及nk细胞的水平。结果如表13所示,清热消炎宁片干膏粉高剂 量组巨噬细胞水平明显降低(p≤0.01),淋巴细胞cd3
、cd4
和nk细胞水平明显升高(p≤ 0.01)。清热消炎宁片干膏粉低、中剂量组巨噬细胞水平显著降低(p≤0.05或p≤0.01),中剂 量组的淋巴细胞cd3
、cd4
水平显著上调(p≤0.01)。
[0170]
表13清热消炎宁片干膏粉对感染冠状病毒小鼠免疫细胞的影响(n=6)
[0171][0172]
注:与正常对照组比较
p≤0.01;与模型对照组比较
*
p≤0.05,
**
p≤0.01。
[0173]
实施例10
[0174]
清热消炎片干膏粉对肺组织tlr4、myd88与ikk-β、iκb及其磷酸化蛋白(p-iκb)表达的 影响
[0175]
tlr4/myd88/ikk/iκb信号通路是机体炎症体系中的重要组成部分,其广泛参与多种疾病 的发生与调控。分组、造模与给药同实施例5中试验方法,采用western blot检测小鼠肺脏中 tlr4、myd88与ikk-β、iκb及其磷酸化蛋白(p-iκb)的表达,对蛋白表达进行定量分析。 结果如图2、图3所示,其中连花清瘟胶囊组tlr4、iκb和p-iκb蛋白表达明显降低(p≤0.05 或p≤0.01);清热消炎片干膏粉中剂量组tlr4、ikk-β蛋白表达明显下降(p≤0.05),高剂量 组myd88、ikk-β、iκb的蛋白表达显著下降(p≤0.05或p≤0.01)。
[0176]
以上结果提示清热消炎宁片干膏粉具有明显体内外抗冠状病毒的药效作用。
[0177]
以上所述仅为本发明的优选实施例而已,并不用于限制本发明,对于本领域的技术人员 来说,本发明可以有各种更改和变化。凡在本发明的精神和原则之内,所作的任何修改、等 同替换、改进等,均应包含在本发明的保护范围之内。
再多了解一些
本文用于创业者技术爱好者查询,仅供学习研究,如用于商业用途,请联系技术所有人。