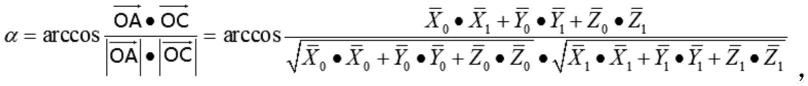
1.本发明涉及生物技术和医学诊断领域,具体而言,本发明涉及一种胃癌的生物标志物、针对其的检测试剂以及相应地它们在胃癌检测中的应用。
背景技术:
2.胃癌(gastric cancer,gc)是世界范围内最严重的消化道恶性肿瘤之一,是继肺癌和肝癌之后的第三大癌症相关死亡原因。根据globocan数据库的最新统计数据,2020年全球约有超过100万例新增的胃癌病例和约769,000例胃癌患者死亡,严重威胁人类健康和影响人类生活质量。
3.胃癌在早期的时候几乎没有症状,大多数胃癌患者在确诊时存在局部晚期或远端转移情况,平均总生存期为10-12个月。经手术切除肿瘤的iiic期患者5年生存率仅为18%,但是经手术治疗的ia期和ib期患者的5年生存率分别为94%和88%。因此,胃癌患者的生存周期与该疾病的尽早诊断和治疗密切相关。
4.目前临床上最常见的是采用内窥镜检查即胃镜检查来诊断胃癌。但是,胃镜检查的敏感性仅为69.0%,而且缺点也比较突出。比如,一些患者因害怕胃镜检查的侵入性和过程中的痛苦不适而拒绝进行必要的检查;大范围的胃镜筛查将给不发达国家的卫生预算带来沉重负担,并且在低发病率地区也并不适合。另一方面,实际上也并不必要仅因害怕发生胃癌就接受该检查。因此,需要寻找一种新的胃癌检测方法,其一方面能替代胃镜检查,另一方面能够主要针对胃癌高危人群实现早期的有效检测。
5.随着“液体活检”策略的深入人心,使用血清中的生理指标或参数来检测潜在胃癌更容易被人接受;该类检测比内窥镜或手术活检的侵入性更小,使医生能够更早地发现疾病,并可以定量化监测胃肿瘤的动态和发展,以及治疗效率和化疗耐药情况。癌胚抗原(cea)、癌抗原19-9(ca19-9)和癌抗原72-4(ca72-4)被认为是临床上公认的消化道肿瘤生物标志物。然而,它们在胃癌患者中的阳性率低于40%,敏感性和特异性不足以独立使用诊断胃癌。
6.如果血液生物标志物要用于一般人群的早期检测,那么它应具有稳定的检测可重复性,并且可以通过普通实验室的设备在血液样本中得以轻松测量;此外,它应在患者出现临床症状之前就存在于血液中,能够以高特异性鉴别癌症。相较于传统的血液标志物,肿瘤相关抗原的自身抗体更加符合这些要求。肿瘤相关抗原往往是肿瘤组织中表达水平异常升高的、突变的、错误折叠的或翻译后异常修饰的蛋白质分子,它们可以引发体液免疫反应,导致自身抗体的产生。针对肿瘤相关抗原的自身抗体具有化学性质稳定、易于检测、在癌症早期阶段就有较高滴度等特性;同时,抗体检测技术如蛋白芯片和免疫磁珠分析法等的发展,实现了肿瘤自身抗体的检测通量的进一步增加,由此可以克服单个肿瘤自身抗体敏感性较低的问题,使它们更有可能用于临床。这类抗体已经在多种癌症的患者血清中被发现,并已逐步成为可临床应用的新型标志物。
7.单个自身抗体在胃癌检测中的敏感性差异很大,并且尚未发现以哪个自身抗体为
靶标,能兼顾敏感性和特异性地实现胃癌的有效检测。相比之下,多种自身抗体的同时检测可以从多个角度判断受试者,也可以在较高的特异性情况下,实现相对高的敏感性。已有研究者建立了由多个肿瘤相关抗原的自身抗体组成的检测模型,例如zhang等人建立了由c-myc、p53、cyclin b1、p62、koc、imp1和survivin的自身抗体组成的检测模型,发现该组合的灵敏性为52.7%,特异性为89.9%;zayakin等人建立了一组由45种抗原组成的检测芯片,检测灵敏性和特异性分别为58.7%和89.7%。
8.但是,目前已经提出的分子组合检测胃癌仍存在敏感性不够高的问题。不限于任何理论,推测造成敏感性不高的原因在于,癌症患者之间抗原的异质性很高,因此某些肿瘤相关抗原的自身抗体没有达到统计学意义,但被纳入胃癌标志物检测模型,导致整体检测结果的可重复性低,降低了检测模型的应用价值。但是,自身抗体在胃癌的风险管理中仍然是重要的参考依据,因为相较于其他标志物,自身抗体具有一个得天独厚的优势就是凭借肿瘤早期所分泌的微量抗原就可以通过体液免疫反应产生,从而被检测出来,而其他循环系统中的标志物(循环肿瘤细胞、蛋白质、外泌体、游离dna等)都是随着肿瘤的不断增大而逐渐出现在血液中,所反映的信息相对滞后,因此自身抗体作为胃癌早期检测标志物具有巨大的应用潜力。除了不同的自身抗体标志物组合之外,还可以尝试将自身抗体标志物与常规肿瘤标志物相结合,来建立更有效的胃癌早检模型。
9.目前本领域迫切需要更精确、更有效的血液生物标志物,这些标志物应该能够提供胃癌早期检测、临床分期、治疗反应监测和预后方面的信息,从而实现胃癌患者的更好的疾病管理。
技术实现要素:
10.为解决因内窥镜检查的侵入性和过程中带来的痛苦不适、单一自身抗体或抗原在早期胃癌检测中灵敏性差异大等问题,本发明的发明人开发了一种以血液为检测样本的能够敏感地发现早期胃癌的检测方法,在该检测方法中采用了一种新型的胃癌相关的生物标志物,通过检测受试者血液中的该生物标志物,可以避免内窥镜检查为受试者带来的痛苦不适;同时相对于本领域已知的其他胃癌相关的标志物,该生物标志物尤其是提高了胃癌早期的检查敏感性以及特异性,由此可以实现对胃癌的早期筛查。
11.因此,本发明的一个目的是提供一种胃癌相关的生物标志物,所述生物标志物为自身抗体组合、抗原组合、或自身抗体与抗原的组合。
12.本发明的另一个目的是提供用于检测所述生物标志物的试剂,即检测所述自身抗体组合、抗原组合、或自身抗体与抗原的组合的试剂。
13.本发明的还一个目的是提供所述生物标志物或用于检测所述生物标志物的试剂在制备用于胃癌的患病风险预测、筛查、预后评估、治疗效果监测或复发监测等产品中的用途。
14.本发明的再一个目的是提供一种试剂盒,其包含用于检测所述生物标志物的试剂,所述试剂盒用于对胃癌进行检测或诊断。
15.本发明的又一个目的是提供一种用于胃癌的患病风险预测、筛查、预后评估、治疗效果监测或复发监测的方法。
16.本发明的技术方案如下。
17.一方面,本发明提供一种胃癌的生物标志物,所述生物标志物为:
18.(i)自身抗体组合;
19.(ii)抗原组合;或
20.(iii)自身抗体与抗原的组合。
21.在本发明提供的生物标志物中,(i)中的所述自身抗体组合包括以下自身抗体中的至少两种:抗imp2自身抗体、抗ny-eso-1自身抗体、抗bmi自身抗体、抗cenbp自身抗体、抗cage自身抗体、抗psmc1自身抗体、抗rassf7自身抗体、抗pbrm1自身抗体、抗copb1自身抗体和抗gnas自身抗体。“至少两种”例如是抗rassf7自身抗体和抗psmc1自身抗体。
22.在本发明的上下文中,“自身抗体”是指人体内存在的抗相应蛋白或抗原(诸如imp2)的抗体。在本发明的上下文中,术语“蛋白”与“抗原”或“肿瘤抗原”可互换使用。该蛋白或抗原为本领域已知蛋白,具有如下登记号(uniprotkb数据库):
23.imp2:q96t52
24.ny-eso-1:o75638
25.bmi:p35226
26.cenbp:p07199
27.cage:q8tc20
28.psmc1:p62191
29.rassf7:q02833
30.pbrm1:q86u86
31.copb1:p53618
32.gnas:o95467
33.优选地,所述自身抗体组合包括以下自身抗体中的至少三种:抗ny-eso-1自身抗体、抗cage自身抗体、抗psmc1自身抗体、抗rassf7自身抗体、抗pbrm1自身抗体、抗copb1自身抗体和抗gnas自身抗体。“至少三种”例如是抗rassf7自身抗体、抗psmc1自身抗体和抗ny-eso-1自身抗体。
34.更优选地,所述自身抗体组合包括以下自身抗体中的至少四种:抗ny-eso-1自身抗体、抗cage自身抗体、抗psmc1自身抗体、抗rassf7自身抗体、抗pbrm1自身抗体、抗copb1自身抗体和抗gnas自身抗体。“至少四种”例如是抗rassf7自身抗体、抗ny-eso-1自身抗体、抗cage自身抗体和抗psmc1自身抗体。
35.根据本发明具体实施方式,所述自身抗体组合包括以下自身抗体:
36.(1)抗rassf7自身抗体和抗psmc1自身抗体;
37.(2)抗rassf7自身抗体、抗psmc1自身抗体和抗ny-eso-1自身抗体;
38.(3)抗rassf7自身抗体、抗psmc1自身抗体和抗cage自身抗体;
39.(4)抗rassf7自身抗体、抗psmc1自身抗体和抗pbrm1自身抗体;
40.(5)抗rassf7自身抗体、抗psmc1自身抗体和抗copb1自身抗体;
41.(6)抗rassf7自身抗体、抗psmc1自身抗体和抗gnas自身抗体;
42.(7)抗rassf7自身抗体、抗psmc1自身抗体、抗ny-eso-1和抗cage自身抗体;
43.(8)抗rassf7自身抗体、抗psmc1自身抗体、抗ny-eso-1自身抗体和抗pbrm1自身抗体;
44.(9)抗rassf7自身抗体、抗psmc1自身抗体、抗ny-eso-1自身抗体和抗copb1自身抗体;
45.(10)抗rassf7自身抗体、抗psmc1自身抗体、抗ny-eso-1自身抗体和抗gnas自身抗体;
46.(11)抗rassf7自身抗体、抗psmc1自身抗体、抗ny-eso-1自身抗体、抗cage自身抗体和抗pbrm1自身抗体;
47.(12)抗rassf7自身抗体、抗psmc1自身抗体、抗ny-eso-1自身抗体、抗cage自身抗体和抗copb1自身抗体;
48.(13)抗rassf7自身抗体、抗psmc1自身抗体、抗ny-eso-1自身抗体、抗cage自身抗体和抗gnas自身抗体;
49.(14)抗rassf7自身抗体、抗psmc1自身抗体、抗ny-eso-1自身抗体、抗cage自身抗体、抗pbrm1自身抗体、抗copb1自身抗体和抗gnas自身抗体;
50.(15)抗rassf7自身抗体、抗psmc1自身抗体、抗ny-eso-1自身抗体、抗cage自身抗体、抗pbrm1自身抗体、抗copb1自身抗体和抗bmi自身抗体;
51.(16)抗rassf7自身抗体、抗psmc1自身抗体、抗ny-eso-1自身抗体、抗cage自身抗体、抗pbrm1自身抗体、抗copb1自身抗体和抗cenbp自身抗体;
52.(17)抗rassf7自身抗体、抗psmc1自身抗体、抗ny-eso-1自身抗体、抗cage自身抗体、抗pbrm1自身抗体、抗copb1自身抗体、抗gnas自身抗体、抗bmi自身抗体、抗cenbp自身抗体和抗copb1自身抗体。
53.在本发明提供的生物标志物中,(ii)中的所述抗原组合包括以下蛋白中的至少两种:tff3、ca72-4、pgi、ca19-9和pgii。“至少两种”是例如pgii和tff3。
54.该蛋白为本领域已知蛋白,具有如下登记号(uniprotkb数据库):
55.tff3:q07654
56.ca72-4:p49841
57.pgi:q4vxa6
58.ca19-9:p07359
59.pgii:p20142
60.在本发明提供的生物标志物中,(iii)中的所述自身抗体与抗原的组合包括以下自身抗体中的至少两种:抗imp2自身抗体、抗ny-eso-1自身抗体、抗bmi自身抗体、抗cenbp自身抗体、抗cage自身抗体、抗psmc1自身抗体、抗rassf7自身抗体、抗pbrm1自身抗体、抗copb1自身抗体和抗gnas自身抗体;和,以下蛋白中的至少一种:tff3、ca72-4、pg-i、ca19-9和pgii。
61.优选地,所述自身抗体与抗原的组合包括以下自身抗体中的至少五种:抗ny-eso-1自身抗体、抗cage自身抗体、抗psmc1自身抗体、抗rassf7自身抗体、抗pbrm1自身抗体、抗copb1自身抗体和抗gnas自身抗体;和,以下蛋白中的至少一种:pg-i、tff3和pgii。
62.更优选地,所述自身抗体与抗原的组合包括以下自身抗体:抗ny-eso-1自身抗体、抗cage自身抗体、抗psmc1自身抗体、抗rassf7自身抗体、抗pbrm1自身抗体、抗copb1自身抗体和抗gnas自身抗体;和,以下肿瘤抗原:tff3和pgii。
63.根据本发明具体实施方式,所述自身抗体与抗原的组合包括:
64.(1)抗rassf7自身抗体、抗psmc1自身抗体和tff3;
65.(2)抗rassf7自身抗体、抗psmc1自身抗体和pgii;
66.(3)抗rassf7自身抗体、抗psmc1自身抗体、tff3和pgii;
67.(4)抗rassf7自身抗体、抗psmc1自身抗体、抗ny-eso-1自身抗体和tff3;
68.(5)抗rassf7自身抗体、抗psmc1自身抗体、抗ny-eso-1自身抗体和pgii;
69.(6)抗rassf7自身抗体、抗psmc1自身抗体、抗ny-eso-1自身抗体、tff3和pgii;
70.(7)抗rassf7自身抗体、抗psmc1自身抗体、抗ny-eso-1自身抗体、抗cage和tff3;
71.(8)抗rassf7自身抗体、抗psmc1自身抗体、抗ny-eso-1自身抗体、抗cage自身抗体和pgii;
72.(9)抗rassf7自身抗体、抗psmc1自身抗体、抗ny-eso-1自身抗体、抗cage自身抗体、tff3和pgii;
73.(10)抗rassf7自身抗体、抗psmc1自身抗体、抗ny-eso-1自身抗体、抗cage自身抗体、抗pbrm1自身抗体、抗copb1、抗gnas自身抗体和tff3;
74.(11)抗rassf7自身抗体、抗psmc1自身抗体、抗ny-eso-1自身抗体、抗cage自身抗体、抗pbrm1自身抗体、抗copb1自身抗体、抗gnas自身抗体和ca72-4;
75.(12)抗rassf7自身抗体、抗psmc1自身抗体、抗ny-eso-1自身抗体、抗cage自身抗体、抗pbrm1自身抗体、抗copb1自身抗体、抗gnas自身抗体和pg-i;
76.(13)抗rassf7自身抗体、抗psmc1自身抗体、抗ny-eso-1自身抗体、抗cage自身抗体、抗pbrm1自身抗体、抗copb1自身抗体、抗gnas和ca19-9;
77.(14)抗rassf7自身抗体、抗psmc1自身抗体、抗ny-eso-1自身抗体、抗cage自身抗体、抗pbrm1自身抗体、抗copb1自身抗体、抗gnas和pgii;
78.(15)抗rassf7自身抗体、抗psmc1自身抗体、抗ny-eso-1自身抗体、抗cage自身抗体、抗pbrm1自身抗体、抗copb1自身抗体、抗gnas自身抗体、tff3和pgii;
79.(16)抗rassf7自身抗体、抗psmc1自身抗体、抗ny-eso-1自身抗体、抗cage自身抗体、抗pbrm1自身抗体、抗copb1自身抗体、抗gnas自身抗体、tff3和ca72-4;
80.(17)抗rassf7自身抗体、抗psmc1自身抗体、抗ny-eso-1自身抗体、抗cage自身抗体、抗pbrm1自身抗体、抗copb1自身抗体、抗gnas自身抗体、ca72-4和ca19-9;
81.(18)抗rassf7自身抗体、抗psmc1自身抗体、抗ny-eso-1自身抗体、抗cage自身抗体、抗pbrm1自身抗体、抗copb1自身抗体、抗gnas自身抗体、pg-i和pgii;
82.(19)抗rassf7自身抗体、抗psmc1自身抗体、抗ny-eso-1自身抗体、抗cage自身抗体、抗pbrm1自身抗体、抗copb1自身抗体、抗gnas自身抗体、tff3、pg-i和pgii;
83.(20)抗rassf7自身抗体、抗psmc1自身抗体、抗ny-eso-1自身抗体、抗cage自身抗体、抗pbrm1自身抗体、抗copb1自身抗体、抗gnas自身抗体、tff3、pg-i、pgii、ca72-4和ca19-9。
84.根据本发明,所述自身抗体和抗原均分别为受试者的全血、血清、血浆、组织或细胞、组织间隙液、脑脊液或尿液中的自身抗体和抗原。其中,所述组织或细胞为胃组织或细胞、胃癌组织或细胞或者胃癌的癌旁组织或细胞。其中,所述受试者为哺乳动物,优选为灵长类哺乳动物,更优选为人。
85.优选地,所述自身抗体为iga(例如iga1、iga2)、igm或igg(例如igg1、igg2、igg3、
igg4)。
86.按照组织病理学分类,所述胃癌包括腺癌、腺鳞癌、鳞癌或类癌,其中所述腺癌还包括乳头状癌、管状腺癌、低分化腺癌、黏液腺癌和印戒细胞癌。按照发病部位分类,所述胃癌包括胃底贲门癌、胃体癌和胃窦癌。按照分化程度分类,所述胃癌包括低分化胃癌、中分化胃癌、高分化胃癌。按照tnm分期,所述胃癌包括早期胃癌、中期胃癌、晚期胃癌。
87.优选地,所述胃癌为低分化胃癌。优选地,所述胃癌为腺癌。优选地,所述胃癌为早期胃癌。
88.根据本发明,该生物标志物即自身抗体组合、抗原组合或自身抗体与抗原的组合可以在受试者的样本(例如血浆或血清)中进行检测。在本发明中,自身抗体或抗原的“存在”或“不存在”与“阳性”或“阴性”可互换使用;对此进行判断为本领域常规技术。例如,可以通过导致该组合中任何自身抗体出现的肿瘤相关抗原与其之间的抗原抗体特异性反应进行检测。肿瘤抗原可以通过与对应的单克隆抗体进行抗原抗体特异性反应进行检测。
89.因此相应地,另一方面,本发明还提供一种用于检测本发明所述生物标志物的试剂。
90.取决于具体技术手段,所述试剂可以是用于酶联免疫吸附法(elisa)、蛋白/肽段芯片检测、免疫印迹、微珠免疫检测或微流控免疫检测等的试剂。优选地,所述试剂用于通过抗原抗体反应对本发明所述的生物标志物进行检测,例如通过elisa或荧光或化学发光免疫检测。
91.进一步地,所述试剂为:
92.(i)抗原组合;
93.(ii)抗体组合;或
94.(iii)抗原与抗体的组合。
95.在本发明提供的生物标志物中,(i)中的所述抗原组合包括以下蛋白中的至少两种:imp2、ny-eso-1、bmi、cenbp、cage、psmc1、rassf7、pbrm1、copb1和gnas。“至少两种”例如是rassf7和psmc1。
96.优选地,所述抗原组合包括以下蛋白的至少三种:ny-eso-1、cage、psmc1、rassf7、pbrm1、copb1和gnas。“至少三种”例如是rassf7、psmc1和ny-eso-1。
97.更优选地,所述抗原组合包括以下蛋白中的至少四种:ny-eso-1、cage、psmc1、rassf7、pbrm1、copb1、gnas。“至少四种”例如是rassf7、ny-eso-1、cage和psmc1。
98.根据本发明具体实施方式,所述抗原组合包括以下蛋白:
99.(1)rassf7和psmc1;
100.(2)rassf7、psmc1和ny-eso-1;
101.(3)rassf7、psmc1和cage;
102.(4)rassf7、psmc1和pbrm1;
103.(5)rassf7、psmc1和copb1;
104.(6)rassf7、psmc1和gnas;
105.(7)rassf7、psmc1、ny-eso-1和cage;
106.(8)rassf7、psmc1、ny-eso-1和pbrm1;
107.(9)rassf7、psmc1、ny-eso-1和copb1;
108.(10)rassf7、psmc1、ny-eso-1和gnas;
109.(11)rassf7、psmc1、ny-eso-1、cage和pbrm1;
110.(12)rassf7、psmc1、ny-eso-1、cage和copb1;
111.(13)rassf7、psmc1、ny-eso-1、cage和gnas;
112.(14)rassf7、psmc1、ny-eso-1、cage、pbrm1、copb1和gnas;
113.(15)rassf7、psmc1、ny-eso-1、cage、pbrm1、copb1和bmi;
114.(16)rassf7、psmc1、ny-eso-1、cage、pbrm1、copb1和cenbp;
115.(17)rassf7、psmc1、ny-eso-1、cage、pbrm1、copb1、gnas、bmi、cenbp和copb1。
116.在本发明提供的生物标志物中,(ii)中的所述抗体组合包括以下抗体中的至少两种:抗tff3抗体、抗ca72-4抗体、抗pgi抗体、抗ca19-9抗体和抗pgii抗体。“至少两种”是例如抗pgii抗体和抗tff3抗体。
117.在本发明提供的生物标志物中,(iii)中的所述抗原与抗体的组合包括以下蛋白中的至少两种:imp2、ny-eso-1、bmi、cenbp、cage、psmc1、rassf7、pbrm1、copb1和gnas;和,以下抗体中的至少一种:抗tff3抗体、抗ca72-4抗体、抗pg-i抗体、抗ca19-9抗体和抗pgii抗体。
118.优选地,所述抗原与抗体的组合包括以下蛋白中的至少五种:ny-eso-1、cage、psmc1、rassf7、pbrm1、copb1和gnas;和,以下抗体中的至少一种:抗pg-i抗体、抗tff3抗体和抗pgii抗体。
119.更优选地,所述抗原与抗体的组合包括以下蛋白:ny-eso-1、cage、psmc1、rassf7、pbrm1、copb1和gnas;和,以下抗体:抗tff3抗体和抗pgii抗体。
120.根据本发明具体实施方式,所述抗原与抗体的组合包括:
121.(1)rassf7、psmc1和抗tff3抗体;
122.(2)rassf7、psmc1和抗pgii抗体;
123.(3)rassf7、psmc1、抗tff3抗体和抗pgii抗体;
124.(4)rassf7、psmc1、ny-eso-1和抗tff3抗体;
125.(5)rassf7、psmc1、ny-eso-1和抗pgii抗体;
126.(6)rassf7、psmc1、ny-eso-1、抗tff3抗体和抗pgii抗体;
127.(7)rassf7、psmc1、ny-eso-1、cage和抗tff3抗体;
128.(8)rassf7、psmc1、ny-eso-1、cage和抗pgii抗体;
129.(9)rassf7、psmc1、ny-eso-1、cage、抗tff3抗体和抗pgii抗体;
130.(10)rassf7、psmc1、ny-eso-1、cage、pbrm1、copb1、gnas和抗tff3抗体;
131.(11)rassf7、psmc1、ny-eso-1、cage、pbrm1、copb1、gnas和抗ca72-4抗体;
132.(12)rassf7、psmc1、ny-eso-1、cage、pbrm1、copb1、gnas和抗pg-i抗体;
133.(13)rassf7、psmc1、ny-eso-1、cage、pbrm1、copb1、gnas和抗ca19-9抗体;
134.(14)rassf7、psmc1、ny-eso-1、cage、pbrm1、copb1、gnas和抗pgii抗体;
135.(15)rassf7、psmc1、ny-eso-1、cage、pbrm1、copb1、gnas、抗tff3抗体和抗pgii抗体;
136.(16)rassf7、psmc1、ny-eso-1、cage、pbrm1、copb1、gnas、抗tff3抗体和抗ca72-4抗体;
137.(17)rassf7、psmc1、ny-eso-1、cage、pbrm1、copb1、gnas、抗ca72-4抗体和抗ca19-9抗体;
138.(18)rassf7、psmc1、ny-eso-1、cage、pbrm1、copb1、gnas、抗pg-i抗体和抗pgii抗体;
139.(19)rassf7、psmc1、ny-eso-1、cage、pbrm1、copb1、gnas、抗tff3抗体、抗pg-i抗体和抗pgii抗体;
140.(20)rassf7、psmc1、ny-eso-1、cage、pbrm1、copb1、gnas、抗tff3抗体、抗pg-i抗体、抗pgii抗体、抗ca72-4抗体和抗ca19-9。
141.又一方面,本发明提供所述生物标志物或试剂在制备用于胃癌的患病风险预测、筛查、预后评估、治疗效果监测或复发监测的产品中的用途,或者在制备用于检测受试者样本中自身抗体和/或蛋白的浓度的产品中的用途。
142.按照组织病理学分类,所述胃癌包括腺癌、腺鳞癌、鳞癌或类癌,其中所述腺癌还包括乳头状癌、管状腺癌、低分化腺癌、黏液腺癌和印戒细胞癌。按照发病部位分类,所述胃癌包括胃底贲门癌、胃体癌和胃窦癌。按照分化程度分类,所述胃癌包括低分化胃癌、中分化胃癌、高分化胃癌。按照tnm分期,所述胃癌包括早期胃癌、中期胃癌、晚期胃癌。
143.优选地,所述胃癌为低分化胃癌。优选地,所述胃癌为腺癌。优选地,所述胃癌为早期胃癌。
144.所述受试者为哺乳动物,优选为灵长类哺乳动物,更优选为人。所述样本为受试者的全血、血清、血浆、组织或细胞、组织间隙液、脑脊液或尿液;其中优选地,所述组织或细胞为胃组织或细胞、胃癌组织或细胞或者胃癌的癌旁组织或细胞。
145.优选地,所述产品为试剂盒;更优选地,所述试剂盒是用于酶联免疫吸附法(elisa)、蛋白/肽段芯片检测、免疫印迹、微珠免疫检测或微流控免疫检测等的试剂盒;优选地,所述试剂盒用于通过抗原抗体反应对所述生物标志物进行检测,例如为elisa试剂盒或荧光或化学发光免疫检测试剂盒。
146.再一方面,本发明提供一种试剂盒,其包含本发明所述的试剂。
147.取决于具体技术手段,所述试剂盒可以是用于酶联免疫吸附法(elisa)、蛋白/肽段芯片检测、免疫印迹、微珠免疫检测或微流控免疫检测等的试剂盒。优选地,所述试剂盒用于通过抗原抗体反应对本发明的生物标志物进行检测,例如为elisa试剂盒或荧光或化学发光免疫检测试剂盒。
148.因此,优选地,试剂盒为酶联免疫吸附法(elisa)检测试剂盒。即,采用该试剂盒,通过酶联免疫吸附法来检测受试者的样本中所述生物标志物是否是阳性的。相应地,所述试剂盒还可包括用于对所述生物标志物进行elisa检测的所需其他组分,这些均是本领域公知的。出于检测目的,例如,试剂盒中的蛋白和/或抗体可连接有标签肽,例如his标签、链霉亲和素标签、myc标签;又如,该试剂盒可以包括固相载体,如具有可固定蛋白和/或抗体的微孔的载体,如酶标板;或者微珠或磁珠固相载体。还可以包括用于将蛋白和/或抗体固定于固相载体上的吸附蛋白、血液如血清的稀释液、洗涤液、带有酶标记的二抗或者荧光或化学发光的物质的二抗、显色液、终止液等。通过间接或直接包被在固相载体表面的蛋白和/或抗体,和待测样本中的自身抗体和/或蛋白进行反应形成抗原-抗体复合物的原理来检测样本中的相应自身抗体和/或蛋白的浓度。
149.还一方面,本发明提供一种用于胃癌的患病风险预测、筛查、预后评估、治疗效果监测或复发监测的方法,其包括以下步骤:
150.(1)对来自受试者的样本进行本发明提供的自身抗体组合、抗原组合或者自身抗体与抗原的组合中的每个自身抗体和/或抗原的定量;
151.(2)将所述自身抗体和/或抗原的量与参考阈值进行比较,在其高于参考阈值时,确定所述受试者具有胃癌患病风险、患有胃癌、预后不良、治疗效果差或具有复发风险。
152.在步骤(1)中,所述定量包括采用本发明提供的试剂(即抗原组合、抗体组合或抗原与抗体的组合)或包含该试剂的试剂盒对所述自身抗体组合、抗原组合或自身抗体与抗原的组合中的每个自身抗体和/或抗原进行检测。
153.所述受试者为哺乳动物,优选为灵长类哺乳动物,更优选为人。按照组织病理学分类,所述胃癌包括腺癌、腺鳞癌、鳞癌或类癌,其中所述腺癌还包括乳头状癌、管状腺癌、低分化腺癌、黏液腺癌和印戒细胞癌。按照发病部位分类,所述胃癌包括胃底贲门癌、胃体癌和胃窦癌。按照分化程度分类,所述胃癌包括低分化胃癌、中分化胃癌、高分化胃癌。按照tnm分期,所述胃癌包括早期胃癌、中期胃癌、晚期胃癌。
154.优选地,所述胃癌为低分化胃癌。优选地,所述胃癌为腺癌。优选地,所述胃癌为早期胃癌。
155.根据本发明,所述样本为受试者的全血、血清、血浆、组织或细胞、组织间隙液、脑脊液或尿液;其中优选地,所述组织或细胞为胃组织或细胞、胃癌组织或细胞或者胃癌的癌旁组织或细胞。
156.在步骤(2)中,所述参考阈值可以是来自健康人或健康人群的参照水平;例如,可以被定义为经身体检查确认未患有癌症的人群的平均值加2个标准偏差。
157.与现有技术相比,本发明提供了一种针对胃癌的生物标志物,其为自身抗体组合、抗原组合或自身抗体与抗原的组合。实验证明,本发明的自身抗体组合、抗原组合或自身抗体与抗原组合具有良好的检测敏感性,如在胃癌早期,本发明所提供的抗原组合中的每一种抗原可达到60%以上的敏感性;自身抗体组合可达到60%以上的敏感性;自身抗体与抗原的组合可达到80%以上的敏感性。
158.并且,早期检测胃癌的临床意义在于肿瘤发现的越早期,肿瘤病人的预后情况更好。本发明鉴定的生物标志物在早期胃癌中有足够高的敏感性,尤其是在实验的中国人群中;同时还具有足够高的检测特异性。
附图说明
159.以下,结合附图来详细说明本发明的实施方案,其中:
160.图1:每个自身抗体在肿瘤组和对照组的水平分布散点图。
161.图2:每个自身抗体在胃癌人群中的敏感性分析结果。
162.图3:每个蛋白在肿瘤组和对照组的水平分布散点图。
163.图4:每个蛋白在胃癌人群中的敏感性分析结果。
164.图5:自身抗体组合在整体胃癌人群中的敏感性分析结果。
165.图6:自身抗体与抗原的组合在整体胃癌人群中的敏感性分析结果。
166.图7:自身抗体与抗原的组合分别在早期胃癌、胃腺癌和低分化胃癌中的敏感性分
析结果。
具体实施方式
167.在本发明中,术语“抗原”或术语“抗原蛋白”可互换使用。术语“抗体”和“自身抗体”在本发明中可以互换。此外,本发明中涉及以下实验操作或定义。应注意,本发明还可采用本领域其他常规技术进行实施,并不仅限于以下实验操作。
168.(一)重组抗原蛋白的制备
169.将肿瘤抗原的cdna片段克隆到含6xhis标记的pet28(a)表达载体上。在抗原的n端或c端,引入链霉亲和素蛋白或类似物(结合生物素的标签蛋白)。获得的重组表达载体转化大肠杆菌进行表达。上清表达的蛋白通过ni-nta亲和柱和离子柱进行纯化。当蛋白表达在包涵体内,用6m盐酸胍对蛋白进行变性处理,并在体外按照标准方法进行复性折叠,然后通过6xhis标签进行ni-nta亲和柱纯化,获得抗原蛋白。
170.(二)血清或血浆的制备和保存
171.胃癌患者血清或血浆在患者最初诊断为胃癌,尚未接受任何放化疗及手术治疗时收集。血浆或血清按标准临床程序制备,置于-80℃冰箱中长期保存。
172.(三)elisa检测
173.通过酶联免疫吸附测定(elisa)定量样本中自身抗体标志物的浓度。纯化的肿瘤抗原通过其标签链霉亲和素或类似物固定到微孔表面。微孔预包被生物素标记的牛血清白蛋白(bsa)。血清或血浆样本用磷酸盐缓冲稀释1∶110倍,加入微孔进行反应(50毫升/孔)。用洗液冲洗未结合的血清或血浆成分后,每孔加入辣根过氧化物酶(hrp)偶联的抗-人igg进行反应。然后加入反应底物tmb(3,3
′
,5,5
′‑
四甲基联苯胺)进行显色。加入终止溶液(1n hcl),吸亮度为450nm单光谱进行酶标仪进行读值(od)。用标准曲线定量血清自身抗体浓度。
174.通过夹心法酶联免疫吸附测定定量样本中抗原标志物的浓度。将特异性抗体与固相载体连接,形成固相抗体,洗涤除去未结合的抗体及杂质;加受检标本,即血清或血浆样本用磷酸盐缓冲稀释1∶110倍,加入微孔进行反应(50毫升/孔),使之与固相抗体接触反应一段时间,让标本中的抗原与固相载体上的抗体结合,形成固相抗原复合物。洗涤除去其他未结合的物质。加辣根过氧化物酶(hrp)偶联的抗-人igg进行反应。然后加入反应底物tmb(3,3
′
,5,5
′‑
四甲基联苯胺)进行显色。加入终止溶液(1n hcl),吸亮度为450nm单光谱进行酶标仪进行读值(od)。此时固相载体上带有的酶量与标本中受检物质的量正相关。夹心式复合物中的酶催化底物成为有色产物。根据颜色反应的程度进行该抗原的定性或定量。
175.(四)自身抗体和/或抗原蛋白的临界值(cutoff值)
176.自身抗体和/或抗原水平的cutoff值被定义为等于对照组(所述对照组为经身体检查确认未患有癌症的人群)中健康对照队列的平均值加2个标准偏差(sd)。
177.(五)单个自身抗体和抗原蛋白的阳性、阴性判断
178.对于每种自身抗体和/或抗原蛋白测定,阳性反应定义为对样本中自身抗体和/或抗原蛋白的水平进行定量后,将其与cutoff值进行比较,≥cutoff值为阳性;相应地,阴性反应定义为<cutoff值为阴性。
179.(六)自身抗体和/或抗原蛋白组合的阳性判断
180.由于单个自身抗体和/或单个抗原蛋白的阳性率低,为了增加自身抗体和/或抗原蛋白检出的阳性率,分析结果时联合多个自身抗体和/或联合多个抗原蛋白的结果来判断预测效果。规则是:(1)在样本中检测多个自身抗体,只要有其中一个或者多个自身抗体显示阳性,则判断抗体组合结果为阳性;而如果所有的自身抗体均为阴性,则判断结果为阴性。(2)在样本中检测多个抗原蛋白,只要有其中一个或多个抗原蛋白显示为阳性,则判断结果为阳性;而如果所有的抗原蛋白为阴性,则判断结果为阴性。(3)在样本中同时检测多个自身抗体和多个抗原蛋白,只要其中有一个或多个自身抗体和/或抗原蛋白为阳性,则判断结果为阳性;而如果所有的抗体和抗原蛋白为阴性,则判断结果为阴性。
181.(七)统计分析方法
182.使用graphpad prism v.6(graphpad prism软件,加利福尼亚州圣地亚哥)和针对windows的ibm spss statistics 23(ibm,纽约,纽约),使用mann-whitney u检验对两组进行了统计学分析。在分析每个参数之间的关系时,执行了spearman的相关分析。
183.(八)敏感性和特异性判断
184.敏感性:金标准诊断全部胃癌病例中,自身抗体、自身抗体组合、抗原蛋白、抗原蛋白组合和自身抗体与抗原蛋白组合检测结果为阳性的病例占全部有病病例的比例。
185.特异性:金标准诊断全部无病的受试者中,自身抗体、自身抗体组合、抗原蛋白、抗原蛋白组合和自身抗体与抗原蛋白组合检测结果为阴性的受试者占全部无病受试者的比例。
186.以下参照具体的实施例来说明本发明。本领域技术人员能够理解,这些实施例仅用于说明本发明,其不以任何方式限制本发明的范围。样本采集已经受试者或患者知情同意,且获得监管部门的批准。
187.下述实施例中的实验方法,如无特殊说明,均为常规方法。下述实施例中所用的原料、试剂材料等,如无特殊说明,均为市售购买产品。
188.实施例1患者血清样本中单一自身抗体敏感性和特异性检测
189.本实施例包括健康体检人群115例和胃癌患者93例,进行自身抗体标志物的筛选。健康体检人群来自不少于3个不同体检中心。所有的胃癌患者血清都是在患者诊断为胃癌尚未接受任何放化疗及手术治疗时收集的,并在-80℃冰箱保存。
190.患者信息见表1。
191.表1:患者特征
[0192] 胃癌患者数量93病理亚型腺癌46鳞状细胞癌2印戒细胞癌7其他42分期早期47中期21
晚期11其他14
[0193]
注:4例患者同时为腺癌和印戒细胞癌;
[0194]
分期定义:(1)早期:胃癌0期、ia、ib期,包含但不限于tisn0m0,t1n0m0,t1n1m0,t2n0m0;(2)中期:胃癌ii a期,ii b期,包含但不限于t1n2m0,t2n1m0,t3n0m0,t1n3m0,t2n2m0,t3n1m0,t4an0m0;(3)晚期:胃癌iiia、iiib、iiic、iv期,包含但不限于t2n3m0,t3n2m0,t4bn1m0,t3n3m0,t4an2m0,t4bn0m0,t4bnim0,t4an3m0,t4bn2m0,t4bn3m0及所有包含m1的分期;(4)其他:不在早期、中期、晚期中的分期。
[0195]
将胃癌抗原经过表达纯化后包被到96孔板表面,封闭后和稀释1∶110倍的93位胃癌血清或体检对照人群血清反应,接着和抗人igg抗体-hrp辣根过氧化氢酶反应,然后进行显色反应,并用酶标仪od450nm波长检测。表2和图2示出检测敏感性和特异性。
[0196]
表2:血清样本中单个自身抗体作为标志物的敏感性和特异性
[0197]
序号自身抗体敏感性(%)特异性(%)1anti-ny-eso-115.0598.262anti-cage11.8399.133anti-rassf734.4193.044anti-pbrm17.5398.265anti-copb17.5398.266anti-gnas7.5396.527anti-psmc115.0596.528anti-imp25.3899.139anti-bmi6.4510010anti-cenbp4.30100
[0198]
以上10个自身抗体在肿瘤组和对照组的水平分布散点图见图1。由于肿瘤患者免疫系统的强弱不同,加上肿瘤产生机理多样性,单个肿瘤自身抗体在肿瘤患者的分布敏感性低,通常只有11%-40%之间。使用mann whitney test进行自身抗体在肿瘤组和对照组的水平分布的统计分析,发现抗rassf7、cage、copb1和bmi的抗体在肿瘤组和对照组的水平分布有显着不同(p<0.05)。
[0199]
实施例2患者血清样本中单一抗原敏感性和特异性检测
[0200]
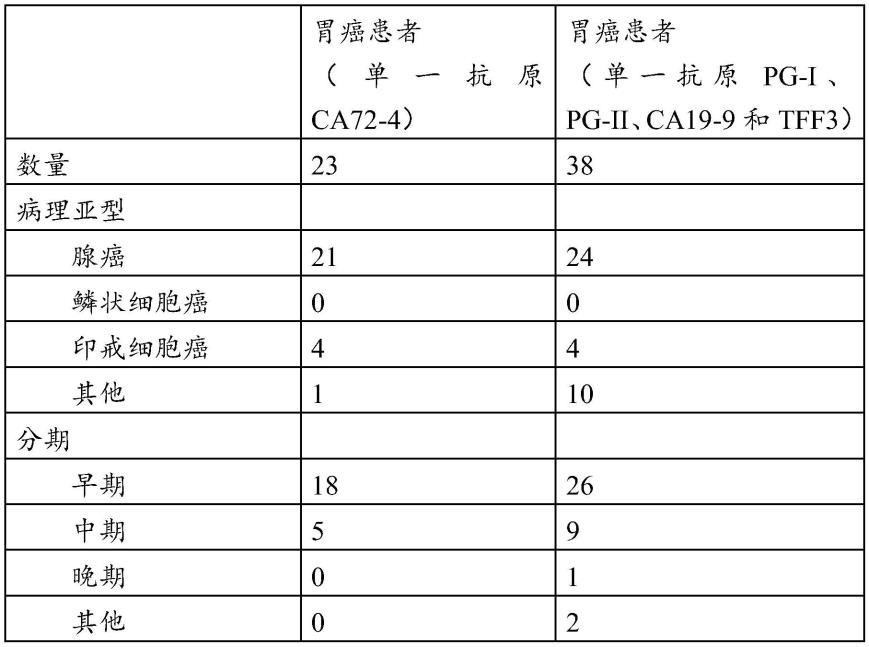
本实施例包括健康体检人群23例(用于单一抗原ca72-4的检测)、56例(用于单一抗原pg-i、pg-ii、ca19-9和tff3的检测)和胃癌患者23例(用于单一抗原ca72-4的检测),38例(用于单一抗原pg-i、pg-ii、ca19-9和tff3的检测),进行肿瘤抗原标志物的筛选。健康体检人群来自不少于3个不同体检中心。所有的胃癌患者血清都是在患者诊断为胃癌尚未接受任何放化疗及手术治疗时收集的,并在-80℃冰箱保存。
[0201]
患者信息见表3。
[0202]
表3:胃癌患者特征表
[0203][0204]
注:3例患者同时为腺癌和印戒细胞癌;
[0205]
分期定义:同实施例1。
[0206]
采用市售对应的单克隆抗体(tff3:r&d,货号dy4407;ca72-4:eastcoast bio,货号hm710;pg-i:eastcoast bio,货号hm321;pg-ii:eastcoast bio,货号hm323;ca19-9:ra biosources,货号mc061),采用夹心法elisa检测候选抗原分子,封闭后和稀释1∶110倍的胃癌血清或体检对照人群血清反应,接着和抗人igg抗体-hrp辣根过氧化氢酶反应,然后进行显色反应,并用酶标仪od450nm波长检测。表4和图4显示检测敏感性和特异性。
[0207]
表4:单个肿瘤抗原作为标志物的敏感性和特异性
[0208]
序号抗原敏感性(%)特异性(%)1ca72-421.741002pg-i21.0596.433pg-ii23.681004ca19-910.5396.435tff352.6396.43
[0209]
以上5个抗原在肿瘤组和对照组的水平分布散点图见图3。由于肿瘤患者免疫系统的强弱不同,加上肿瘤产生机理多样性,单个肿瘤抗原在肿瘤患者的分布敏感性最高能达到50%以上。使用mann whitney test进行肿瘤抗原在肿瘤组和对照组的水平分布的统计分析,发现抗原ca72-4、pg-i、pg-ii和tff3在肿瘤组和对照组的水平分布有显着不同(p<0.05)。
[0210]
实施例3筛选自身抗体组合、抗原组合或自身抗体与抗原的组合
[0211]
针对上述总计15种分子,按照以下层次进行筛选:
[0212]
1、由于本研究的目的是寻找早期胃癌的检测标志物,首先剔除一部分在胃癌早期阳性检出率低的分子,即使这类分子在胃癌中期阳性检出率比较高。
[0213]
2、剔除和其他分子有重叠阳性检出、没有单独阳性贡献率的分子。
[0214]
(i)生物标志物为自身抗体组合的筛选:
[0215]
从表2的10个抗体中选择不同自身抗体,形成不同的自身抗体组合,并使用对应的检测试剂对其进行检测,结果见表5。
[0216]
[0217]
确定一组优选的自身抗体组合,包括以下抗体:anti-ny-eso-1、anti-cage、anti-psmc1、anti-rassf7、anti-pbrm1、anti-copb1和anti-gnas,敏感性和特异性分别是65.59%和86.97%,见表6和图5。
[0218]
表6:自身抗体组合作为标志物的检测结果
[0219]
人群数目阳性数目敏感性特异性93(患者)6165.59% 115(健康)1586.97%
[0220]
(ii)生物标志物为抗体与抗原的组合的筛选:
[0221]
从表2的10个抗体中选择不同抗体,同时从表4的5个抗原中选择不同的抗原,形成不同的抗体 抗原组合,并使用对应的检测试剂对其进行检测,结果见表7。
[0222]
copb1和anti-gnas;所述抗原包括以下抗原:tff3和pg-ii。所述抗体与抗原组合的敏感性和特异性分别是82.35%和87.50%,见表8和图6。
[0225]
表8:肿瘤自身抗体与抗原蛋白的组合的检测结果
[0226]
人群数目阳性数目敏感性特异性34(患者)2882.35% 56(健康)7 87.50%
[0227]
所述抗体与抗原的组合根据受试者工作特征曲线,在胃癌不同分型和/或分期中的敏感性和特异性见表9及图7。
[0228]
表9:胃癌不同分型和/或分期中的敏感性和特异性
[0229]
分期敏感性(%)特异性(%)auc早期77.7887.500.8264腺癌88.0085.450.8673低分化胃癌85.7185.710.8571
[0230]
本发明提供的自身抗体组合以及自身抗体与抗原的组合,作为生物标志物兼具高敏感性和高特异性,在胃癌、尤其是早期胃癌、胃腺癌、低分化胃癌的检测中有重要应用意义。
[0231]
以上对本发明具体实施方式的描述并不限制本发明,本领域技术人员可以根据本发明作出各种改变或变形,只要不脱离本发明的精神,均应属于本发明所附权利要求的范围。
再多了解一些
本文用于创业者技术爱好者查询,仅供学习研究,如用于商业用途,请联系技术所有人。