1.本发明属于动物饲料技术领域,具体涉及一种促进反刍动物生长和改善瘤胃发酵的组合物及其应用。
背景技术:
2.钴(co)是维生素b
12
(vb
12
)结构中的必要活性成分,在动物体内自身生成量很少,绝大部分是随着饲料或者饲料添加剂进入体内,以合成维生素b
12
的形式被吸收(任晓文等,2010;龙建华等,2018)。underwood等(1935)和marston等(1940)通过研究发现缺钴导致绵羊的地方性消瘦病,确认了反刍动物必需的第六种微量元素—钴。王润莲等(2006)研究不同钴源对肉羊维生素b12的合成及瘤胃发酵的影响,结果表明:硫酸钴和氯化钴对肉羊瘤胃维生素b12合成及瘤胃发酵的效果相近,明显促进了瘤胃挥发性脂肪酸的产生。乙酸钴次之,氧化钴最低。5,6-二甲基苯并咪唑(5,6-dmb)是一种天然苯并咪唑衍生物,是生物发酵合成的重要前体物质(李昆太等,2008)。在微生物合成vb
12
的培养基内,添加5,6-dmb能提高丙酮酸杆菌合成vb
12
的速率(王鹏等,2007;马蕙等,2008)。5,6-dmb作为合成钴胺素的前体物,能与腺苷钴啉醇胺结合生成脱氧腺苷钴胺素,5,6-dmb缺乏会导致钴胺素合成受阻。综上所述,5,6-二甲基苯并咪唑(5,6-dmb)和co是反刍动物瘤胃微生物合成vb
12
的重要前体物质,对机体能量代谢有着重要的作用,5,6-dmb和co的缺乏都影响vb
12
的合成。而vb
12
常规作用为影响婴幼儿的正常发育,同时它还保护叶酸在细胞内的转移和储存,保证神经系统功能健全。
3.动物养殖一直是追求快速生长为最终目的,为了达到动物快速生长的目的,给动物提供高精饲料是常规的饲养方法。高精饲料中富含碳水化合物、蛋白质和脂肪等营养成分,为动物生长发育提供充足的养分。然而,在高精料饲粮条件下,碳水化合物在瘤胃中的微生物发酵以产生丙酮酸为主。机体产生的部分丙酮酸在瘤胃上皮细胞内转变为乳酸,使瘤胃丙酮酸代谢发生障碍,导致瘤胃酸中毒,改变瘤胃ph值、瘤胃发酵以及瘤胃微生物活性,影响动物消化和饲料利用,进而影响动物的生长。然而目前关于如何克服长期高精饲料饲喂动物给动物生长带来的影响的研究较少。
技术实现要素:
4.有鉴于此,本发明的目的在于提供一种促进反刍动物生长和改善瘤胃发酵的组合物,通过促进体内vb
12
合成量调控丙酮酸代谢,进而提高瘤胃液ph值、瘤胃发酵和瘤胃微生物区系,提高反刍动物消化代谢,进而促进反刍动物生长。
5.本发明的目的还在于提供一种促进反刍动物生长的饲料,以上述组合物作为添加剂添加到高比例精料的饲粮中解决长期饲喂高精饲粮带来的瘤胃酸中毒的问题,改善反刍动物的消化代谢以及吸收利用。
6.本发明提供了一种促进反刍动物生长和提高机体vb
12
合成量的组合物,包括钴和5,6-二甲基苯并咪唑;
7.所述钴和5,6-二甲基苯并咪唑的质量比为1:(100~210)。
8.优选的,所述钴和5,6-二甲基苯并咪唑的质量比为1:128.2。
9.本发明提供了一种促进反刍动物生长的饲料,包括所述组合物和基础日粮。
10.优选的,所述组合物的质量为51.53~77.67mg/kg基础日粮。
11.优选的,所述基础日粮的总量为100%计,干物质为91.33%;所述干物质包括17.13%的粗蛋白质和1.91%的粗脂肪、纤维素13.59%、半纤维素9.71%、木质素3.31%、钙1.02%、磷0.55%;
12.所述基础日粮的代谢能为9.63mj/kg。
13.本发明提供了所述组合物或所述饲料在促进反刍动物生长中的应用。
14.本发明提供了所述组合物或所述饲料在促进反刍动物消化代谢中的应用。
15.优选的,所述促进反刍动物消化代谢包括以下瘤胃环境的调控:降低瘤胃乳酸含量、改善瘤胃发酵和调节瘤胃微生物区系。
16.优选的,所述瘤胃环境的调控是通过提高维生素b
12
合成量来调控丙酮酸代谢途径,降低乳酸合成关键酶活性、减少乳酸的生成实现。
17.优选的,所述反刍动物包括绵羊。
18.本发明提供的促进反刍动物生长和提高机体vb
12
合成量的组合物,包括钴和5,6-二甲基苯并咪唑;所述钴和5,6-二甲基苯并咪唑的质量比为1:(100~210)。本发明从vb
12
前体物质的角度调控瘤胃发酵,瘤胃微生物在体内合成vb
12
,进而提高反刍动物消化代谢,最终实现促进反刍动物生长发育的目的。本发明试验结果表明,将所述组合物添加到基础日粮中饲喂动物,与不添加所述组合物的对照组相比,反刍动物的日增重有显著提高,说明所述组合物能显著提高反刍动物的生长性能。
19.本发明提供了所述组合物或所述饲料在促进反刍动物消化代谢中的应用。本发明试验结果表明,钴和5,6-二甲基苯并咪唑的添加显著提高反刍动物体内vb
12
含量,提高反刍动物营养物质的表观消化率和营养元素和能量摄入,进一步测定血液中乳酸浓度以及乳酸合成关键酶表明,减少了瘤胃中乳酸的生成,提高了瘤胃液ph值,同时挥发性脂肪酸和mcp含量也是先呈升高后降低的变化趋势,调控了丙酮酸代谢途径;此外,通过分析瘤胃微生物种群群落和菌群结构结果表明,钴和5,6-二甲基苯并咪唑合成的vb
12
还能调整瘤胃微生物区系。可见,本发明添加5,6-dmb和co提高维生素b
12
合成量来调控丙酮酸代谢途径,降低乳酸合成关键酶活性、减少乳酸的生成,从而提高瘤胃液ph,改善瘤胃发酵,调节瘤胃微生物区系,为促进反刍动物生长发育进一步提供科学理论依据。
附图说明
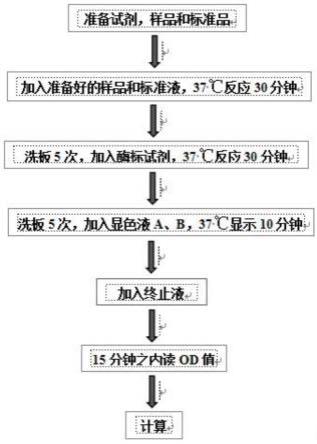
20.图1为vb
12
测定流程图;
21.图2为瘤胃中微生物信息分析流程图;
22.图3为样品稀释曲线;
23.图4为α-多样性分析结果;
24.图5为otu的venn图;
25.图6为otu水平分析的pls-da图;
26.图7为门水平菌群相对丰度结果图;
27.图8为属水平菌群相对丰度图。
具体实施方式
28.本发明提供了一种促进反刍动物生长和改善瘤胃发酵的组合物,包括钴和5,6-二甲基苯并咪唑;所述钴和5,6-二甲基苯并咪唑的质量比为1:(100~210)。
29.本发明对5,6-二甲基苯并咪唑和钴的来源没有特殊限制,采用本领域所熟知的商品来源即可。在本发明实施例中,5,6-二甲基苯并咪唑购买于上海源叶生物科技有限公司,其分析纯≥99%。在本发明实施例中,所述钴以氯化钴的形式添加。所述氯化钴购买于河北远大中正生物科技有限公司。所述钴和5,6-二甲基苯并咪唑的质量比优选为1:128.2。
30.在本发明中,所述组合物的制备方法没有特殊限制,采用本领域所熟知的组合物的制备方法即可,例如将钴和5,6-二甲基苯并咪唑混合得到。
31.本发明提供了一种促进反刍动物生长的饲料,包括所述组合物和基础日粮。所述组合物的质量优选为51.53~77.67mg/kg基础日粮。
32.在本发明中,每千克所述基础日粮中所述组合物的添加质量为62.25~92.75mg。所述基础日粮包括按照质量比为7:3混合的高精饲料和粗饲料。在本发明实施例中,所述基础日粮的总量为100%计,干物质为91.33%;所述91.33%的干物质主要包括17.13%的粗蛋白质和1.91%的粗脂肪、纤维素13.59%、半纤维素9.71%、木质素3.31%、钙1.02%、磷0.55%;所述基础日粮的代谢能为9.63mj/kg。在本发明实施例中,分别设置了三组不同添加量的饲料配方,具体为含有51.28mg/kg 5,6-二甲基苯并咪唑和0.25mg/kg钴的基础日粮(低剂量配方)、含64.10mg/kg 5,6-二甲基苯并咪唑和0.50mg/kg钴的的基础日粮(中剂量配方)和含76.92mg/kg 5,6-二甲基苯并咪唑和0.75mg/kg钴的基础日粮(高剂量配方)。所述基础日粮参照肉羊饲养标准(ny/t-816-2004)1.2倍水平进行配制。
33.在本发明中,所述饲料的制备方法,优选为将所述组合物添加到预混料中混合均匀,将混合均匀的预混料与蛋白质饲料、能量饲料等混合均匀制成精料补充料,将精料补充料与粗饲料按照一定比例混合制成反刍动物的全混合饲粮,饲粮的配制参照肉羊饲养标准(ny/t-816-2004)进行。所述饲粮的每次投喂量优选为0.65-0.78kg(实际生产中可根据肉羊饲养标准(ny/t-816-2004)进行调整),更优选为0.74kg。一天投喂两次,早7点半和晚7点半各一次。所述反刍动物的月龄优选为8月龄。所述反刍动物优选为绵羊。
34.本发明提供了所述组合物或所述饲料在促进反刍动物生长中的应用。
35.在本发明中,所述组合物或饲料适用于所有种类的反刍动物,例如羊、牛等。本发明实施例中,以绵羊为例具体说明促生长方案。
36.在本发明中,以平均日增重为指标评价所述组合物或饲料对反刍动物生长性能的影响,结果表明,与对照组相比,投喂所述组合物或所述饲料的反刍动物的日增重呈极显著提高,并且中剂量配方的日增重显著高于低剂量配方和高剂量配方。同时干物质采食量同日增重一样,有相同的变化趋势。
37.本发明提供了所述组合物或所述饲料在促进反刍动物消化代谢中的应用。
38.在本发明中,所述促进反刍动物消化表现在提高营养物质表观消化率和降低营养元素和能量的代谢。本发明实施例表明,干物质、有机物、粗蛋白质、粗脂肪、纤维素、半纤维素、钙、磷、总能等营养物质的消化量和消化率均极显著升高;同时5,6-dmb和co对绵羊氮、
钙、磷、能量的保留量和保留率极显著提高。
39.在本发明中,所述促进反刍动物消化代谢优选包括以下瘤胃环境的调控:降低瘤胃乳酸含量、改善瘤胃发酵和调节瘤胃微生物区系。所述瘤胃环境的调控优选是通过提高维生素b
12
合成量来调控丙酮酸代谢途径,降低乳酸合成关键酶活性、减少乳酸的生成实现。
40.在本发明中,反刍动物机体所需要的营养物质主要是依靠瘤胃发酵获取的,反刍动物摄入的营养物质在瘤胃中被瘤胃微生物降解和吸收,而瘤胃内环境稳定性是影响反刍动物吸收和消化营养物质的主要因素之一,瘤胃内环境的稳定性直接或间接影响微生物活性,如瘤胃ph、nh
3-n、vfa和mcp等指标都是影响瘤胃内环境稳定的因素。因此本发明中所述改善瘤胃发酵的评价指标优选为瘤胃液ph值、瘤胃液nh
3-n浓度、瘤胃液vfa浓度以及瘤胃液mcp含量。瘤胃液ph值在一般条件下其范围在5.50~6.80之间所述瘤胃液ph值随着饲喂时间推移饲喂5h时,逐渐上升,且中剂量配方的提高程度优于低剂量配方和高剂量配方;随着5,6-dmb和co添加水平的增加,ph值增高,变化范围范围为5.55~6.49,接近临界值,但未超出正常范围。其中对照组在饲喂后的各时间点内ph值远低于各试验组,这可能是5,6-dmb和co对绵羊机体调控所引起的,说明添加不同水平的5,6-dmb和co可能影响了绵羊瘤胃内微生物的生长,有效抑制了乳酸生成,进而提高瘤胃液ph值。瘤胃液nh
3-n浓度与日粮蛋白质水平相关,在nh
3-n有效范围为5.0-30.0mg/100ml时,瘤胃微生物活力随日粮蛋白水平升高而升高,此时nh
3-n浓度同样表现为上升趋势。本发明nh
3-n浓度变化范围为12.56-29.84mg/100ml,属于有效范围内,但在饲喂后1h和3h,各试验组nh
3-n浓度均极显著高于对照组,且试验ⅱ组还极显著高于试验ⅰ、ⅲ组。在饲喂后5h和7h,试验ⅱ组显著高于对照组。vb
12
能够增加原虫和细菌的数量,各试验组nh
3-n浓度的升高,这可能是vb
12
增强了微生物的活力,因此导致nh
3-n浓度提升。瘤胃液nh
3-n浓度处在一个动态平衡当中,众多研究表明不同添加水平与形式都会对瘤胃nh
3-n影响不同,因此上述研究结果不一致的原因可能是由于钴的添加形式、添加水平所引起的。vfa的含量和组成可充分反应瘤胃碳水化合物消化代谢情况,在高精料日粮条件下,在5,6-dmb和co的添加水平为64.10mg/kg和0.50mg/kg时可明显增加总挥发性脂肪酸的产生,使其中丙酮酸比例显著增加。并且随着5,6-dmb和co的添加水平先增高后降低,出现这样试验结果的原因可能是瘤胃微生物利用钴合成vb
12
,而vb
12
通过一系列复杂的生化反应使丙酮酸最终转变为葡萄糖,最终表现出在日粮中添加钴促进了瘤胃丙酮酸生成与代谢,而随着瘤胃丙酮酸浓度的增加使瘤胃总挥发性脂肪酸含量增加,使得整体vfa比例发生变化。但过高剂量的钴可能会阻碍微生物生长,这可能就是本发明中试验ⅱ组丙酮酸高于试验ⅲ组的原因。反刍动物机体中60%~65%的蛋白含量由瘤胃液mcp供应,同时瘤胃液mcp含量也是反映瘤胃微生物利用氨氮的能力和瘤胃微生物种群、数量的重要指标,添加不同水平5,6-dmb和co后,mcp平均含量均极显著高于对照组,主要是vb
12
能够提高瘤胃如谷氨酰胺合成酶和天冬酰胺合成酶等不同的氨酶的活性,从而促进了谷氨酸和天冬氨酸等的合成,因此有效提升了mcp的合成。而且添加不同水平5,6-dmb和co后nh
3-n浓度的增加也为mcp的合成提供了有利条件。
41.在本发明中,所述降低乳酸含量优选为瘤胃液中l-乳酸、d-乳酸浓度。乳酸含量随着饲喂时间的延长,呈下降趋势,在饲喂后5h,对照组显著高于三个配方处理组。为了进一步研究乳酸含量变化的分子机制,还测定了瘤胃代谢相关酶d活力,包括ldh、pk、mdh和sdh。其中ldh和pk随着组合物添加剂量的升高,呈先下降后升高的趋势。mdh和sdh活性随着组合
物添加剂量的升高而升高,并且中剂量配方的提高程度优于低剂量配方和高剂量配方。
42.在本发明中,调节瘤胃微生物区系优选包括提高瘤胃微生物的多样性、条了物种群落数量、提高了厚壁菌门和拟杆菌门优势物种的相对丰度。其中,瘤胃液菌群中门水平丰度前10的菌门主要是厚壁菌门(firmicutes)、拟杆菌门(bacteroidetes)、变形菌门(proteobacteria)等,相对丰度以厚壁菌门和拟杆菌门较高,为优势物种。瘤胃液菌群中属水平相对丰度前10的菌属主要是普氏菌属(prevotella)、无氧瘤胃细菌属(uncultured-rumen-bacterium)、奎因氏菌属(quinella)等,其中普氏菌属(prevotella)在两组绵羊瘤胃液细菌中占比最高,且中剂量配方组显著高于对照组。
43.下面结合实施例对本发明提供的一种促进反刍动物生长和改善瘤胃发酵的组合物及其应用进行详细的说明,但是不能把它们理解为对本发明保护范围的限定。
44.实施例1
45.一种促进反刍动物生长和改善瘤胃发酵的的饲料的制备方法及饲喂
46.1.原料来源说明
47.5,6-dmb购买于上海源叶生物科技有限公司,其分析纯≥99%。
48.氯化钴购买于河北远大中正生物科技有限公司。
49.2.饲料的配方设计
50.本试验选取24只8月龄左右,体重(39.23
±
2.61kg)体况相近且健康的哈萨克公羊,在试验前安装好永久性瘤胃瘘管,随机分为4组,每组6只。对照组饲喂精粗比为7:3的基础日粮,试验i、ⅱ、ⅲ组分别参照肉羊饲养标准(ny/t-816-2004)配制,40kg育肥羊日增重0.2kg/d,dmi(1.3kg/d),换算5,6-dmb添加梯度为51.28mg/kg、64.10mg/kg、76.92mg/kg(dm),钴的添加梯度为0.25mg/kg、0.50mg/kg和0.75mg/kg。其中钴以氯化钴的形式添加,沸石粉作为载体),具体见表1。试验共26d,其中预试期14d,正试期12d。
51.表1 不同分组处理
[0052][0053]
3.饲养管理及日粮组成
[0054]
试验动物均单圈饲养,安装固定采食槽,自由采食和饮水。每天分别于7:30、19:30饲喂,每次饲喂量为当日总量的一半。5,6-dmb和co提前称好混于25g精料中,确认试验羊全部采食后,再饲喂其他饲粮,饲喂时先精后粗,少喂多添,以保证日粮精粗比不变。每日饲喂量根据前一日的采食量进行增减,以使每日的剩料量为饲喂量的2%~4%。
[0055]
基础饲粮参照肉羊饲养标准(ny/t-816-2004)配制,饲粮组成及营养水平见表2。
[0056]
表2 日粮组成及营养水平(干物质基础,%)
[0057][0058][0059]
注:1)预混料为每千克精料补充料提供:维生素a 10 000iu,维生素d
3 2 550iu,维生素e 20iu,烟酸20mg,生物素0.06mg,硫酸铜22mg,硫酸铁94mg,硫酸锰80mg,硫酸锌88mg,碘化钾0.75mg,亚硒酸钠0.50mg,钙0.35%,磷0.125%,氯化钠0.80%
[0060]
2)表中代谢能为计算值,其余营养成分均为实测值。
[0061]
4.样品的采集与处理
[0062]
1)饲料原料的采集
[0063]
从试验正试期前一天开始每天分别取混合精料、玉米秸秆和苜蓿干草样品,连续取8d,试验结束后将3种饲料原料样品分别充分混合均匀,采用四分法取样,全部粉碎过40目筛后密封保存于干燥阴凉处,用于备测饲料常规营养成分。
[0064]
2)剩料的采集
[0065]
正试期每日晨饲前收集剩料,阴干后密封保存。正试期每天07:00分别收集各羊的全部剩料,称重后放入已编号的样品袋中阴干后常温保存。
[0066]
3)粪和尿的收集
[0067]
在消化代谢试验正试期采用全收粪尿法,使用自制粪袋、尿袋对所有试验羊的粪便和尿液进行收集。于每天07:00分别收集各羊的全部鲜粪,称重。并取10%粪样,用10%稀硫酸进行喷洒固氮,标号后放置在干净且干燥的阴暗处,进行自然阴干,称重并放入已编号的样品袋中,常温下保存。动物试验结束后在实验室将样品过40目筛粉碎备测。
[0068]
在收粪的同时收集全部尿液,在瓶中上下摇晃混匀称重后,取5%尿样,倒入已编号的事先加有2ml10%稀硫酸的样品瓶中,于-20℃保存。
[0069]
4)瘤胃液的采集、预处理及保存
[0070]
瘤胃液采集时间为饲喂前记为0h、饲喂后1、3、5、7h共计5个时间点采集,每只羊每个时间点采集60-80ml瘤胃液于100ml塑料烧杯中,立即测定ph值,然后分装于已编号的10ml冻存管中,立即放入-20℃冰箱冷冻保存待测,部分样品放入-80℃超低温冰箱冷冻保存。
[0071]
5)血液的采集、预处理及保存
[0072]
血液采集时间点为饲喂前记为0h、饲喂后1、3、5、7h共计5个时间点。采集试验羊颈静脉血液10ml至肝素钠抗凝的采血管中,3500r/min,离心15min,收集血清至1.5ml eppendorf管中,-20℃保存待测。
[0073]
5.测定指标与方法
[0074]
1)生产性能的测定
[0075]
以试验开始当天晨饲前体重作为初始体重,之后每隔7d进行称重并记录,以消化代谢试验结束当天晨饲前体重为终末体重,按照公式i计算平均日增重。
[0076]
平均日增重=(末重-初重)/试验天数公式i
[0077]
添加不同水平5,6-二甲基苯并咪唑和钴对绵羊生长性能的影响如表3所示,与对照组相比,试验ⅰ、ⅱ、ⅲ组绵羊的干物质采食量和日增重均极显著提高(p《0.01);试验ⅱ组的干物质采食量极显著高于试验ⅰ、ⅲ组(p《0.01),试验ⅱ组的日增重显著高于试验ⅰ、ⅲ组(p《0.05);试验ⅰ组与试验ⅲ组相比,干物质采食量和日增重均无显著性差异(p》0.05)。试验ⅱ组的末重与对照组相比在线性效应上差异显著(p《0.05),其他各组之间差异均不显著(p》0.05)。
[0078]
表3 添加不同水平5,6-dmb和co对绵羊生长性能的影响(n=6)
[0079][0080]
注:同行数据肩标不同大写字母表示差异极显著(p《0.01),肩标不同小写字母表示差异极显著(p《0.05),肩标相同字母或无字母标注表示差异不显著(p》0.05)。下同。
[0081]
2)常规营养成分的测定
[0082]
粪、饲料样品以及剩料中的干物质(dm)、有机物(om)、粗蛋白(c p)、粗脂肪(ee)、磷(p)、能量(ge)采用常规饲料分析方法(张丽英,2007);钙(ca)含量采用邻甲酚酞比色法测定(傅启高等,1996);纤维素(cel)、半纤维素(hc)、木质素(lignin)含量则采用van soes t方法测定(1991);尿液中氮(n)、钙(ca)、磷(p)的测定方法同上。
[0083]
以上样品测定均在新疆农业大学动物科学学院动物营养实验室进行。
[0084]
添加不同水平5,6-二甲基苯并咪唑和钴对绵羊消化代谢的影响结果
[0085]
添加不同水平5,6-二甲基苯并咪唑和钴对绵羊营养物质表观消化率的影响
[0086]
如表4所示:与对照组相比,试验ⅰ、ⅱ、ⅲ组的干物质、有机物、粗蛋白质、粗脂肪、
纤维素、半纤维素、木质素、钙、磷和总能的摄入量均极显著提高(p《0.01);且试验ⅱ组极显著高于试验ⅰ、ⅲ组(p《0.01);试验ⅰ组与试验ⅲ组相比差异不显著(p》0.05)。与对照组相比,绵羊粪中干物质、有机物、粗蛋白质、粗脂肪、纤维素、半纤维素、钙、磷的排出量均呈不同程度的降低;与对照组相比,试验ⅰ组粪中磷的排出量在总体和二次效应上呈显著降低(p《0.05),试验ⅱ组粪中有机物、纤维素、半纤维素、磷的排出量在二次效应上呈显著(p《0.05)或极显著降低(p《0.01);其他各组之间差异不显著(p》0.05);绵羊粪中干物质、粗蛋白质、粗脂肪、钙、总能的排出量各组之间均差异不显著(p》0.05)。粪中木质素的排出量试验ⅱ、ⅲ组与对照组相比均极显著提高(p《0.01),试验ⅱ组与试验ⅲ组和试验ⅰ组与对照组之间差异不显著(p》0.05)。
[0087]
与对照组相比,试验ⅰ、ⅱ、ⅲ组的干物质、有机物、粗蛋白质、粗脂肪、纤维素、半纤维素、钙、磷、总能的消化量和消化率均极显著升高(p《0.01);且试验ⅱ组的干物质、有机物、纤维素、半纤维素、钙、磷、总能的消化量和消化率极显著高于试验ⅰ、ⅲ组(p《0.01);试验ⅰ组与试验ⅲ组相比差异不显著(p》0.05)。粗蛋白质、粗脂肪的消化量试验ⅱ组极显著高于试验ⅰ、ⅲ组(p《0.01),试验ⅰ组与试验ⅲ组之间差异不显著(p》0.05);粗蛋白质、粗脂肪的消化率三个试验组间均无显著性差异(p》0.05)。绵羊对木质素的消化量和消化率的影响各组之间均差异不显著(p》0.05)。
[0088]
表4 添加不同水平5,6-dmb和co对绵羊表观消化率的影响(n=6)
[0089]
[0090][0091][0092]
添加不同水平5,6-二甲基苯并咪唑和钴对绵羊氮、钙、磷、能量代谢的影响
[0093]
如表5所示:与对照组相比,试验组绵羊氮、钙、磷、能量的摄入量均极显著增加(p《0.01);且试验ⅱ组极显著高于试验ⅰ、ⅲ组(p《0.01);试验ⅰ组与试验ⅲ组间无显著性差异(p》0.05)。试验ⅱ组绵羊粪中磷排出量与对照组相比在二次效应上呈极显著降低(p《
0.01);试验ⅰ组粪中磷排出量在二次效应上显著低于对照组(p《0.05);试验ⅰ组尿中磷排出量极显著低于对照组(p《0.01);试验ⅱ、ⅲ组尿磷显著低于对照组(p《0.05);试验ⅱ组与试验ⅲ组相比粪、尿中磷的排出量差异不显著(p》0.05)。绵羊从粪、尿中排出的能量、氮、钙的量各组之间均差异不显著(p》0.05)。
[0094]
与对照组相比,添加不同水平5,6-dmb和co对绵羊氮、钙、磷、能量的保留量和保留率极显著提高(p《0.01);其中试验ⅱ组钙、磷的保留率极显著高于试验ⅲ组(p《0.01),显著高于试验ⅰ组(p《0.05),试验ⅰ组与试验ⅲ组间差异不显著(p》0.05)。试验ⅱ组氮、能量的保留率和氮、钙、磷、能量的保留量均极显著高于试验ⅰ、ⅲ组(p《0.01);试验ⅰ组与试验ⅲ组间保留量和保留率均差异不显著(p》0.05)。
[0095]
表5 添加不同水平5,6-dmb和co对绵羊氮、钙、磷、能量代谢的影响(n=6)
[0096]
[0097][0098]
3)瘤胃发酵参数的测定
[0099]
试验正试期间于饲喂前0h、饲喂后1、3、5和7h五个时间点用自制真空负压瘤胃液抽取装置抽取瘤胃液,4层纱布过滤后,并立即测定并记录瘤胃液ph值(型号为mettler toledo-fe2 000的ph仪),然后依照测定指标分装保存。
[0100]
瘤胃液中nh
3-n浓度采用靛酚蓝比色法测定(冯宗慈等,2010);瘤胃液中的挥发性脂肪酸使用日本岛津gc 2010型气相色谱仪进行测定,测定指标包括:乙酸、丙酸、丁酸、异丁酸、戊酸、异戊酸以4-甲基戊酸为内标(zhang等,2017);瘤胃液中mcp含量的测定参照李琛(2021)的测定方法。
[0101]
4)乳酸及瘤胃代谢相关酶的测定
[0102]
瘤胃液、血清中的l-乳酸和d-乳酸浓度分别采用分光光度法和酶联免疫吸附法送至南京建成生物工程研究所检测;乳酸脱氢酶(ldh)、丙酮酸激酶(pk)、苹果酸脱氢酶(mdh)、琥珀酸脱氢酶(sdh)采用分光光度法送至南京建成生物工程研究所检测。
[0103]
添加不同水平5,6-二甲基苯并咪唑和钴对绵羊瘤胃发酵的影响结果
[0104]
添加不同水平5,6-二甲基苯并咪唑和钴对绵羊瘤胃液ph值的影响
[0105]
由表6可知,添加不同水平5,6-dmb和co条件下,瘤胃液的ph值变化趋势一致,平均值分别为5.91、6.04、6.12、6.04;各组瘤胃液ph值在饲喂后3h达到最低,后随着饲喂时间的推移,瘤胃液ph值逐渐回升。在饲喂后1、3和5h,试验ⅰ、ⅱ、ⅲ组均极显著高于对照组(p《
0.01),其中试验ⅱ组在饲喂后5h显著高于试验ⅰ、ⅲ组(p《0.05);在饲喂后7h,试验ⅱ组极显著高于对照组(p《0.01),显著高于试验ⅰ、ⅲ组(p《0.05)。试验ⅰ、ⅲ组显著高于对照组(p《0.05)。在同一时间点随着添加水平的升高,瘤胃液ph值呈先升高后降低变化趋势,且5,6-dmb和co添加水平为100mg/d和0.50mg/kg提升最快。
[0106]
表6 添加不同水平5,6-dmb和co对绵羊瘤胃液ph值的影响(n=6)
[0107][0108]
添加不同水平5,6-二甲基苯并咪唑和钴对绵羊瘤胃液nh
3-n浓度的影响
[0109]
由表7可知,添加不同水平5,6-dmb和co条件下,各组内绵羊瘤胃液nh
3-n浓度,随着饲喂时间的推移,呈先升高后降低变化趋势,在饲喂后1h,瘤胃液nh
3-n浓度均达到最高。在饲喂后1h和3h,试验ⅰ、ⅱ、ⅲ组均极显著高于对照组(p《0.01),其中试验ⅱ组极显著高于试验ⅰ、ⅲ组(p《0.01);在饲喂后5h和7h,与对照组相比,试验ⅱ组在二次效应上显著升高(p《0.05)。试验ⅰ组与试验ⅲ组相比均差异不显著(p》0.05)。各组内绵羊瘤胃液nh
3-n平均浓度分别为16.87、19.25、21.40和18.75mg/100ml,且5,6-dmb和co添加水平为64.10mg/kg和0.50mg/kg时浓度最高。
[0110]
表7 添加不同水平5,6-dmb和co对绵羊瘤胃液nh
3-n浓度的影响(n=6)
[0111][0112]
添加不同水平5,6-二甲基苯并咪唑和钴对绵羊瘤胃液vfa浓度的影响
[0113]
由表8可知,绵羊瘤胃液总vfa浓度随着5,6-dmb和co添加水平的增加呈先升高后降低的变化趋势,平均浓度分别为103.05、107.21、109.57和105.17mmol/l,在饲喂后3h,各组内总vfa浓度达到峰值,与对照组相比,试验ⅱ组总vfa浓度显著升高(p《0.05);试验ⅰ、ⅱ、ⅲ组间均差异不显著(p》0.05)。
[0114]
绵羊瘤胃液乙酸浓度随着5,6-dmb和co添加水平的增加呈先升高后降低的变化趋势,平均浓度为66.21、68.92、70.57和67.65mmol/l,在饲喂后3h,各组内乙酸浓度达到峰值,各组间均差异不显著(p》0.05)。
[0115]
绵羊瘤胃液丙酸浓度随着5,6-dmb和co添加水平的增加呈先升高后降低的变化趋势,平均浓度为20.32、21.74、23.52和22.18mmol/l,在饲喂后1h和3h,与对照组相比,试验ⅰ、ⅱ、ⅲ组丙酸浓度均差异极显著(p《0.01)。其中试验ⅱ组极显著高于试验ⅰ、ⅲ组(p《0.01),试验ⅰ、ⅲ组之间差异不显著(p》0.05);在饲喂后5h,与对照组相比,试验ⅰ、ⅱ、ⅲ组丙酸浓度均差异显著(p《0.05),试验ⅰ、ⅱ、ⅲ组之间差异不显著(p》0.05)。
[0116]
绵羊瘤胃液中丁酸、异丁酸、戊酸、异戊酸的浓度随着5,6-dmb和co添加水平的增加无明显趋势,其中在饲喂后5h,对照组戊酸浓度在线性效应上显著高于试验ⅱ组(p《0.05)。
[0117]
绵羊瘤胃液乙酸/丙酸的值随着5,6-dmb和co添加水平的增加呈先降低后升高的变化趋势,平均值为3.30、3.21、3.06和3.08。在饲喂后1h,对照组极显著高于试验ⅱ组(p《0.01);在饲喂后3h,对照组在线性效应上显著高于试验ⅱ组(p《0.05);试验ⅰ、ⅲ组之间均无显著性差异(p》0.05)。
[0118]
表8 添加不同水平5,6-dmb和co对绵羊瘤胃液vfa浓度的影响(n=6)
[0119]
[0120]
[0121][0122]
添加不同水平5,6-二甲基苯并咪唑和钴对绵羊瘤胃液mcp含量的影响由表9可知,添加不同水平5,6-dmb和co条件下,各组内绵羊瘤胃液mcp含量,随着饲喂时间的推移,呈先升高后降低变化趋势,在饲喂后3h,瘤胃液mcp含量达到最高,试验ⅰ、ⅱ、ⅲ组均极显著高于对照组(p《0.01);在饲喂后5h和7h,试验ⅱ、ⅲ组在线性效应上均显著高于对照组(p《0.05);试验ⅰ、ⅱ、ⅲ组间在各时间点内均无显著性差异(p》0.05)。各组内绵羊瘤胃液mcp平均含量分别为116.35、131.62、142.95和142.81μg/ml,且5,6-dmb和co添加水平为64.10mg/
kg和0.50mg/kg时浓度最高。
[0123]
表9 添加不同水平5,6-dmb和co对绵羊瘤胃液mcp含量的影响(n=6)
[0124][0125]
5)维生素b
12
含量的测定
[0126]
瘤胃液、血清及尿液中维生素b
12
含量采用酶联免疫分析试剂盒进行测定,该试剂盒应用双抗体夹心法,购于江苏晶美生物科技有限公司。vb
12
测定流程图见图1,操作步骤如下:
[0127]
1.标准品的稀释。
[0128]
2.加样:分别设空白孔(空白对照孔不加样品及酶标试剂,其余各步操作相同)、标准孔、待测样品孔。在酶标包被板上标准品准确加样50μl,待测样品孔中先加样品稀释液40μl,然后再加待测样品10μl(样品最终稀释度为5倍)。加样将样品加于酶标板孔底部,尽量不触及孔壁,轻轻晃动混匀。
[0129]
3.温育:用封板膜封板后置37℃温育30min。
[0130]
4.配液:将30倍浓缩洗涤液用蒸馏水30倍稀释后备用。
[0131]
5.洗涤:小心揭掉封板膜,弃去液体,甩干,每孔加满洗涤液,静置30s后弃去,如此重复5次,拍干。
[0132]
6.加酶:每孔加入酶标试剂50μl,空白孔除外。
[0133]
7.温育:操作同3。
[0134]
8.洗涤:操作同5。
[0135]
9.显色:每孔先加入显色剂a50μl,再加入显色剂b50μl,轻轻震荡混匀,37℃避光显色10min。
[0136]
10.终止:每孔加终止液50μl,终止反应(此时蓝色立转黄色)。
[0137]
11.测定:以空白孔调零,450nm波长依序测量各孔的吸光度(od值)。测定应在加终止液后15min以内进行。
[0138]
计算:以标准物的浓度为横坐标,od值为纵坐标,在坐标纸上绘出标准曲线,根据样品的od值由标准曲线查出相应的浓度;再乘以稀释倍数;或用标准物的浓度与od值计算出标准曲线的直线回归方程式,将样品的od值代入方程式,计算出样品浓度,再乘以稀释倍
数,即为样品的实际浓度。
[0139]
添加不同水平5,6-二甲基苯并咪唑和钴对绵羊体内维生素b
12
含量的影响结果
[0140]
添加不同水平5,6-二甲基苯并咪唑和钴对绵羊瘤胃液中维生素b
12
含量的影响
[0141]
由表10可知,添加不同水平5,6-dmb和co条件下,随着饲喂时间的推移,对照组绵羊瘤胃内维生素b
12
含量呈逐渐降低趋势,而试验ⅰ、ⅱ、ⅲ组绵羊瘤胃内维生素b
12
含量,呈先升高后降低的变化趋势。在饲喂后3h,试验ⅰ、ⅱ、ⅲ组绵羊瘤胃内维生素b
12
含量达到峰值且均极显著高于对照组(p《0.01)。在饲喂后5h和7h,试验ⅱ、ⅲ组瘤胃内维生素b
12
含量在线性效应上均显著高于对照组(p《0.05),试验ⅱ、ⅲ组之间差异不显著(p》0.05)。各组内绵羊瘤胃液维生素b
12
平均含量分别为39.80、41.91、42.47和42.16nmol/l,且5,6-dmb和co添加水平为64.10mg/kg和0.50mg/kg时维生素b
12
含量最高。
[0142]
表10 添加不同水平5,6-dmb和co对绵羊瘤胃液中维生素b
12
含量的影响(n=6)
[0143][0144]
添加不同水平5,6-二甲基苯并咪唑和钴对绵羊血清和尿中维生素b
12
含量的影响
[0145]
由表11可知,添加不同水平5,6-dmb和co对绵羊血清和尿中vb
12
含量无显著影响(p》0.05)。
[0146]
表11 添加不同水平5,6-dmb和co对绵羊血清和尿中维生素b
12
含量的影响(n=6)
[0147][0148]
6)测定绵羊血液中生化指标
[0149]
绵羊血液生化指标包括l-乳酸和d-乳酸浓度、绵羊血清ast、alt、alp和ldh酶活
性、含氮物浓度和其他血清生化指标(葡萄糖(glu)浓度、tg、cho、hdl、ldl含量)。血液生化指标使用生化组贝克曼au5821自动分析仪进行测定。
[0150]
添加不同水平5,6-二甲基苯并咪唑和钴对绵羊血液生化指标的影响
[0151]
添加不同水平5,6-二甲基苯并咪唑和钴对绵羊血清l-乳酸和d-乳酸浓度的影响
[0152]
由表12可知,绵羊血清l-乳酸浓度随着添加5,6-dmb和co水平的上升呈逐渐下降趋势,在饲喂后1h,对照组和试验ⅰ组均显著高于试验ⅱ、ⅲ组(p《0.05);在饲喂后5-7h,对照组显著高于试验ⅱ、ⅲ组(p《0.05);各组内绵羊血清l-乳酸平均浓度分别为1.92、1.79、1.60和1.59mmol/l。绵羊瘤胃液d-乳酸平均浓度分别为2.76、2.70、2.40和2.42μg/ml,且不同处理组之间均无显著性差异(p》0.05)。
[0153]
表12 添加不同水平5,6-dmb和co对绵羊血清l-乳酸和d-乳酸的影响(n=6)
[0154][0155]
添加不同水平5,6-二甲基苯并咪唑和钴对绵羊血清酶活性的影响
[0156]
由表13可知,添加不同水平5,6-dmb和co对绵羊血清ast、alt、alp和ldh活性均无显著影响(p》0.05)。
[0157]
表13 添加不同水平5,6-dmb和co对绵羊血清酶活性的影响(n=6)
[0158][0159]
添加不同水平5,6-二甲基苯并咪唑和钴对绵羊血清含氮物的影响由表14可知,对照组绵羊血清bun含量显著高于试验ⅱ、ⅲ组(p《0.05),此外与对照组相比,添加不同水平5,6-dmb和co对绵羊tp、alb、glo含量无显著影响(p》0.05)。
[0160]
表14 添加不同水平5,6-dmb和co对绵羊血清含氮物含量的影响(n=6)
[0161][0162]
添加不同水平5,6-二甲基苯并咪唑和钴对绵羊其他血清生化指标的影响
[0163]
由表15可知,添加不同水平5,6-dmb和co对绵羊血清葡萄糖(glu)浓度有影响,其中试验ⅱ、ⅲ组的绵羊glu浓度显著高于对照组和试验ⅰ组(p《0.05)。与对照组相比,添加不同水平5,6-dmb和co对绵羊tg、cho、hdl、ldl含量无显著影响(p》0.05)。
[0164]
表15 添加不同水平5,6-dmb和co对绵羊其他血清生化指标的影响(n=6)
[0165][0166]
7)微生物多样性的测定
[0167]
选取饲喂后3h,对照组(dz)和试验ⅱ组(sy2)的瘤胃液样品送至北京百迈克生物
科技股份有限公司进行微生物多样性的测定。使用dna提取试剂盒提取瘤胃液微生物dna,根据保守区16s rrna基因v3 v4区进行扩增,扩增长度约为419bp。对保守区取得的引物进行pcr扩增、纯化、定量和均一化形成测序文库,建好的文库进行文库质检,质检合格的文库用illumina novaseq 6 000进行测序,测出的高质量原始数据进行修剪、去污优化原始数据,得到有效数据。使用usearch软件对97%的相似度水平进行聚类、获得otu。对序列深度稀释至50 000,进行归一化处理,使用mothur软件进行alpha多样分析,计算物种丰富度和多样性。其中包括chao1、ace、shannon、simpson指数。使用qiime软件进行主成分分析、显著物种差异分析。微生物信息分析流程如图2所示。
[0168]
添加不同水平5,6-二甲基苯并咪唑和钴对绵羊瘤胃微生物区系的影响
[0169]
1)稀释曲线分析
[0170]
由图3稀释曲线可以看出,各样本otus数量在测序条数达到20 000条以上时,曲线趋于平稳,说明本试验测序量达到饱和,该样本量能够反映瘤胃液中绝大部分微生物物种信息。
[0171]
2)alpha多样性分析
[0172]
对照组(dz)和试验ⅱ组(sy2)的α-多样性比较指数(chao、ace、shannon、simpson)的比较结果如图4所示,对照组simpson指数显著高于试验ⅱ组(p《0.05),说明试验ⅱ组的物种多样性高于对照组。(*表示p《0.05;**表示是p《0.01)
[0173]
3)物种群落分析
[0174]
如图5所示,对照组(dz)和试验ⅱ组(sy2)的otus数分别为1 209和1 222个,两组间共有的otus为1187个,对照组独有的otus为22个占总数的1.82%,试验ⅱ组独有的otus为35个占总数的2.86%。
[0175]
如图6所示,用pls-da即最小偏二乘法判别分析可以很直观的看出,两组间明显分散,且分散距离较大。图中component1和component2分别代表两组间微生物otu发生偏移的疑似影响因素。在本试验条件下,添加5,6-dmb和co为主要影响因素,对照组和试验ⅱ组的微生物otu在component1发生了明显偏移。
[0176]
4)菌群结构分析
[0177]
如图7所示,对照组(dz)和试验ⅱ组(sy2)瘤胃液菌群中门水平丰度前10的菌门主要是厚壁菌门(firmicutes)、拟杆菌门(bacteroidetes)、变形菌门(proteobacteria)等,相对丰度以厚壁菌门和拟杆菌门较高,为优势物种。其中试验ⅱ组变形菌门相对丰度极显著高于对照组(p《0.01),其余菌门在添加5,6-dmb和co后丰度无显著性差异(p》0.05)。
[0178]
如图8所示,对照组(dz)和试验ⅱ组(sy2)瘤胃液菌群中属水平相对丰度前10的菌属主要是普氏菌属(prevotella)、无氧瘤胃细菌属(uncultured-rumen-bacterium)、奎因氏菌属(quinella)等,其中普氏菌属(prevotella)在两组绵羊瘤胃液细菌中占比最高,且试验ⅱ组显著高于对照组(p《0.05),其他各菌属在添加5,6-dmb和co后丰度无显著性差异(p》0.05)。
[0179]
由表16可知,添加100mg/d 5,6-dmb和0.50mg/kg co后,绵羊瘤胃液中变形菌门极显著高于对照组(p《0.01),普氏菌属显著高于对照组(p《0.05)。
[0180]
表16 添加5,6-dmb和co对绵羊门、属水平菌群相对丰度的影响(n=6)
[0181][0182][0183]
由上述实施例结果可知,添加5,6-dmb和co可促进绵羊生长和消化代谢,通过提高维生素b
12
合成量来调控丙酮酸代谢途径,降低乳酸合成关键酶活性、减少乳酸的生成,从而提高瘤胃液ph,改善瘤胃发酵,调节瘤胃微生物区系,为促进反刍动物生长发育进一步提供科学理论依据。
[0184]
以上所述仅是本发明的优选实施方式,应当指出,对于本技术领域的普通技术人员来说,在不脱离本发明原理的前提下,还可以做出若干改进和润饰,这些改进和润饰也应视为本发明的保护范围。
再多了解一些
本文用于创业者技术爱好者查询,仅供学习研究,如用于商业用途,请联系技术所有人。