1.本发明涉及铂类抗癌药技术领域,具体而言,涉及一种铂药碳纳米点及其制备方法、碳纳米点蛋白复合物及应用。
背景技术:
2.传统的化疗药例如顺铂等一类二价铂类复合物,是一类具有抗癌活性的金属配合物,由b.rosenborg等人在1965年首次发现可以抑制肿瘤细胞生长后,就广泛应用于癌症化学治疗,在化疗药物中占有重要的位置(nature1965,205,698.)。之后陆续又有卡铂,奥沙利铂等二价铂类复合物等抗癌药被批准上市。然而一般的铂类复合物口服无效,临床使用方法多为以静脉滴注的方式给药,静脉注射后,顺铂等在血浆中迅速消失,快速分布全身,尤其是在肝、肾、大小肠及皮肤中分布最多,因此毒副作用大,如引起肾毒性、骨髓抑制及胃肠道副作用等(chem.rev.2014,114,4470-4495)。同时,顺铂等铂类复合物在血液中的半衰期短,因而达到病灶部位的比例很低,药效较差。
3.光控释放铂类药物是一种个性化的医疗手段,利用特定光照的环境下,在时间和空间上精确实现在病灶处释放包载的药物分子,具有药物利用率高、毒副作用低等诸多优点,为各种重大疾病,如肿瘤的精准治疗提供了新思路。传统的光控释药体系分为物理装载和化学键结合两种方式。物理装方式具有载药率低、输送过程药物泄露等问题,限制其进一步应用。通过共价键结合的方式,可以有效克服这一情况。然而,当前具有可光控的铂药主要为小分子化合物,缺点是水溶性差、肿瘤富集能力差、循环时间短等(nat.rev.cancer.3(2003)380-387)。
4.鉴于此,特提出本发明。
技术实现要素:
5.本发明的目的在于提供一种铂药碳纳米点及其制备方法、碳纳米点蛋白复合物及应用,以改善上述技术问题。
6.本发明是这样实现的:
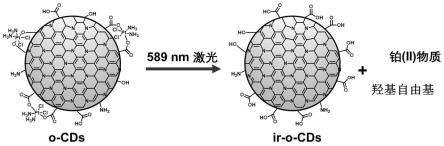
7.第一方面,本发明提供了一种铂药碳纳米点,其包括可见光吸收特性的碳基内核,碳基内核配位结合有四价铂元素,铂药碳纳米点在光照射条件下可还原得到二价铂类化合物和羟基自由基,优选地,光照射波长为200nm-1200nm。
8.第二方面,本发明提供了一种铂药碳纳米点的制备方法,其包括将二取代芳香化合物与四价铂类复合物进行溶剂热反应,以获得铂药碳纳米点。
9.可选地,二取代芳香化合物为苯、萘、蒽或菲的二取代化合物;和/或,四价铂类复合物选自氧化顺铂和二酸顺铂中的至少一种,氧化顺铂的化学式为
10.可选地,二取代芳香化合物为二胺的芳香化合物。
11.可选地,二取代芳香化合物为式(i)或式(ⅱ)所示的化合物;
[0012][0013]
式(i)和式(ⅱ)中,r1、r2各自独立地选自-(ch2)mnh2、-o(ch2)nnh2、-(ch2)moh、-o(ch2)noh、-(ch2)mno2、-o(ch2)nno2、-(ch2)mcooh、-o(ch2)ncooh中的任意一种;m和n分别取0~10。
[0014]
可选地,r1、r2各自独立地选自-nh2、-onh2、-oh、-no2、-ono2、-cooh、-ocooh中的任意一种;和/或,四价铂类复合物为氧化顺铂。
[0015]
可选地,二取代芳香化合物为以下化合物中的至少一种:
[0016][0017]
可选地,二取代芳香化合物为
[0018]
第三方面,本发明还提供了一种碳纳米点蛋白复合物,其由上述铂药碳纳米点和大分子蛋白复合得到。
[0019]
第四方面,本发明还提供了上述铂药碳纳米点或碳纳米点蛋白复合物在制备治疗抗肿瘤药物中的应用。
[0020]
本发明具有以下有益效果:铂药碳纳米点及其蛋白复合物具有可调控的光响应释放特性,在光照的情况下,可还原得到二价铂类抗癌药,强肿瘤杀伤性的羟基自由基,及引起肿瘤细胞内的酸化,因此,既降低铂类药物副作用的问题,又提高了传统顺铂的抗癌效果;相比传统的单药顺铂,该铂药碳纳米点具有形式多样性,其蛋白复合后可提高在体内的循环时间及肿瘤部位的富集。
附图说明
[0021]
为了更清楚地说明本发明实施例的技术方案,下面将对实施例中所需要使用的附图作简单地介绍,应当理解,以下附图仅示出了本发明的某些实施例,因此不应被看作是对范围的限定,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据这些附图获得其他相关的附图。
[0022]
图1为铂药碳纳米点光照反应的原理图;
[0023]
图2为实施例1的铂药碳纳米点的透射电镜图;
[0024]
图3为实施例1的铂药碳纳米点的eds图;
[0025]
图4为实施例1的铂药碳纳米点的xps谱图;
[0026]
图5为实施例1的铂药碳纳米点的pt 4f能谱图;
[0027]
图6为实施例1的铂药碳纳米点的o1s能谱图;
[0028]
图7为实施例1的铂药碳纳米点的n1s能谱图;
[0029]
图8为实施例1的铂药碳纳米点的氢谱核磁谱图;
[0030]
图9为实施例1的铂药碳纳米点的电子自旋能谱图;
[0031]
图10为实验例三中的铂药碳量子点光照流程图;
[0032]
图11为实验例四中的铂药碳纳米点@bsa的透射电镜图;
[0033]
图12为实验例四中的铂药碳纳米点@bsa的紫外和荧光光谱图;
[0034]
图13为实验例五中的铂药碳纳米点在光照或者谷胱甘肽还原环境下的铂药缓释曲线;
[0035]
图14为实验例六中的铂药碳量子点在光照下ph值变化曲线;
[0036]
图15为实验例七中的铂药碳量子点与铂药碳纳米点@bsa不同孵育时间的细胞内铂含量;
[0037]
图16为实验例七中的铂药碳量子点与铂药碳纳米点@bsa分别于4t1细胞共同孵育4h后的荧光显微镜图片;
[0038]
图17为实验例八中铂药碳纳米点对4t1乳腺癌细胞的抑制效果图;
[0039]
图18为实验例八中铂药碳纳米点@bsa对4t1乳腺癌细胞的抑制效果图;
[0040]
图19为实验例九中顺铂、铂药碳量子点、铂药碳量子点@bsa光照前后对4t1乳腺癌细胞的磷酸化组蛋白h2ax(p-h2a.x)的分子印迹图;
[0041]
图20为实验例九中铂药碳量子点、铂药碳量子点@bsa光照前后对4t1乳腺癌细胞活性氧表达的作用;
[0042]
图21为实验例九中铂药碳量子点、铂药碳量子点@bsa光照前后在fer-1抑制下对4t1乳腺癌细胞的凋亡作用流式细胞图;
[0043]
图22为实验例十中顺铂、铂药碳量子点、铂药碳量子点@bsa光照后对4t1乳腺癌细胞中钙网蛋白(crt)、高迁移率族蛋白b1(hmgb1)的免疫荧光图片;
[0044]
图23为实验例十一铂药碳量子点光照前后对4t1小鼠肿瘤生长抑制作用的示意图;
[0045]
图24为实验例十一铂药碳量子点光照前后对4t1小鼠远端肿瘤生长抑制作用的示意图;
[0046]
图25为实验例十一铂药碳量子点照前后对4t1小鼠的生存曲线;
[0047]
图26为实验例十一铂药碳量子点照前后对4t1小鼠肺转移照片。
具体实施方式
[0048]
为使本发明实施例的目的、技术方案和优点更加清楚,下面将对本发明实施例中的技术方案进行清楚、完整地描述。实施例中未注明具体条件者,按照常规条件或制造商建议的条件进行。所用试剂或仪器未注明生产厂商者,均为可以通过市售购买获得的常规产品。
[0049]
下面对本发明提供的一种铂药碳纳米点及其制备方法、碳纳米点蛋白复合物及应用进行具体说明。
[0050]
本发明的一些实施方式提供了一种铂药碳纳米点,其包括碳基内核,所述碳基内核化学键合有四价铂元素,碳基内核具有可见光吸收性,铂药碳纳米点在光照射条件下可还原得到二价铂类化合物和羟基自由基,优选地,光照射波长为200nm-1200nm。
[0051]
参见图1,可见光照射下,碳基内核产生空穴-电子对,激发态电子被铂(iv)捕获发生还原反应,并释放含铂(ii)的化合物;价带上光激发形成的空穴在纳米粒子表面与水溶液中的氢氧根离子发射氧化反应,形成羟基自由基,并导致水溶液ph值的下降。
[0052]
本发明的一些实施方式提供了一种铂药碳纳米点的制备方法,其包括将二取代芳香化合物与四价铂类复合物进行溶剂热反应,以获得铂药碳纳米点。
[0053]
具体地,一些实施方式中,二取代芳香化合物为苯、萘、蒽或菲的二取代化合物;和/或,四价铂类复合物选自氧化顺铂和二酸顺铂中的至少一种,氧化顺铂的化学式为
[0054]
一些实施方式中,二取代芳香化合物为二胺的芳香化合物。
[0055]
一些实施方式中,二取代芳香化合物为式(i)或式(ⅱ)所示的化合物;
[0056][0057]
式(i)和式(ⅱ)中,r1、r2各自独立地选自-(ch2)mnh2、-o(ch2)nnh2、-(ch2)moh、-o(ch2)noh、-(ch2)mno2、-o(ch2)nno2、-(ch2)mcooh、-o(ch2)ncooh中的任意一种;m和n分别取0~10。
[0058]
例如,反应式可为:
[0059][0060]
一些较佳的实施方式中,r1、r2各自独立地选自-nh2、-onh2、-oh、-no2、-ono2、-cooh、-ocooh中的任意一种;和/或,四价铂类复合物为氧化顺铂。
[0061]
进一步地,二取代芳香化合物为以下化合物中的至少一种:
[0062][0063]
较佳地,二取代芳香化合物为此时,反应过程为:
[0064][0065]
上述反应过程中,氧化顺铂的羟基和氨基配位结合进而将氧化顺铂负载于碳基内核上。需要说明的是,二胺的芳香化合物包括但不限于邻苯二胺、对苯二胺、间苯二胺、及萘
蒽菲等任意两个胺基的排列组合中的一种。
[0066]
一些实施方式中,为了使得碳纳米点能够更好的形成,二取代芳香化合物与四价铂类复合物的摩尔比为1~1000:1~1000,优选为1~100:1~100,更优选为1~3:1~3,例如,二取代芳香化合物与四价铂类复合物可为1:1。
[0067]
具体的,溶剂热反应过程中,为了使得反应物能够充分混合反应,其反应过程需要在溶剂体系中进行,则用于溶解二取代芳香化合物和四价铂复合物的反应溶剂包括但不限于二甲基亚砜、n,n
’‑
二甲基甲酰胺、水、甲酸、乙醇、乙醚、四氢呋喃、叶酸和丙酮中的至少一种。即反应溶剂可以单独选择二甲基亚砜、n,n
’‑
二甲基甲酰胺、水、甲酸、乙醇、乙醚、四氢呋喃、叶酸或丙酮,也可以选择这些物质中的两种或两种以上的混合物,混合比例不限。
[0068]
进一步地,一些实施方式中,二取代芳香化合物与反应溶剂的比例为0.001g~1g/ml。
[0069]
进一步地,一些实施方式中,溶剂热反应的温度为100~250℃,例如可以为100℃、110℃、120℃、130℃、140℃、150℃、160℃、170℃、180℃、190℃、200℃、210℃、220℃、230℃、240℃或250℃等,反应时间为1-10小时,例如,1小时、2小时、3小时、4小时、5小时、6小时、7小时、8小时、9小时或10小时等。
[0070]
本发明的一些实施方式还提供了一种碳纳米点蛋白复合物,其由上述铂药碳纳米点和大分子蛋白复合得到。
[0071]
该碳纳米点蛋白复合物具有高效的细胞内吞效率和肿瘤富集效率。铂药碳纳米点富集的癌细胞或肿瘤,在可见光照波段射下,可快速产生高细胞毒性的pt(ii)化合物和羟基自由基,并下调细胞内及肿瘤部位的ph值,使癌细胞产生免疫原性死亡,杀死癌细胞的同时,激活机体的抗肿瘤免疫反应。
[0072]
本发明的一些实施方式还提供了上述铂药碳纳米点或碳纳米点蛋白复合物在制备治疗抗肿瘤药物中的应用。上述实施方式中的铂药碳纳米点及其蛋白复合物可作为高效的光活性抗癌药物,应用于肿瘤精准治疗。
[0073]
以下结合实施例对本发明的特征和性能作进一步的详细描述。
[0074]
实施例1
[0075]
本实施例提高了一种铂药碳纳米点的制备方法,其具体操作为:
[0076]
称取0.1g氧化顺铂和0.1g邻苯二胺。随后加入30mln,n-二甲基甲酰胺于聚四氟乙烯反应釜,随后放入烘箱中以200℃反应6h。随后取出溶液,透析过滤,冷冻干燥,得到铂药碳纳米点固体。
[0077]
实施例2
[0078]
本实施例提高了一种铂药碳纳米点的制备方法,其具体操作为:
[0079]
称取1g氧化顺铂和0.1g间苯二胺。随后加入20ml n,n-二甲基甲酰胺于聚四氟乙烯反应釜,随后放入烘箱中以250℃反应4h。随后取出溶液,透析过滤,冷冻干燥,得到铂药碳纳米点固体。
[0080]
实施例3
[0081]
本实施例提高了一种铂药碳纳米点的制备方法,其具体操作为:
[0082]
称取0.1g氧化顺铂和1g对苯二胺。随后加入40ml二甲基亚砜于聚四氟乙烯反应釜,随后放入烘箱中以180℃反应9h。随后取出溶液,透析过滤,冷冻干燥,得到铂药碳纳米
点固体。
[0083]
实施例4
[0084]
本实施例提高了一种铂药碳纳米点的制备方法,其具体操作为:
[0085]
称取0.5g二酸顺铂和1g邻苯二胺。随后加入30ml n,n-二甲基甲酰胺于聚四氟乙烯反应釜,随后放入烘箱中以210℃反应8h。随后取出溶液,透析过滤,冷冻干燥,得到铂药碳纳米点固体。
[0086]
实验例一
[0087]
对实施例1得到的铂药碳纳米点的化合物的结构进行紫外分析、荧光光谱分析和xps光谱分析。其透射电镜图如图2所示,该碳纳米点尺寸为5nm左右,高倍下晶格条纹间距为0.21nm,证明铂碳纳米点成功制备。对该铂碳纳米点的元素进行eds和xps分析的结果分别如图3和图4所示,可知,其具有c、n、o、cl、pt信号,说明铂成功参与碳纳米点的形成。pt的xps能谱结果显示pt 4f的电子结合能在75.5ev和78.8ev,为pt(iv)结构化合物(如图5所示)。
[0088]
实施例二
[0089]
对实施例1得到的铂药碳纳米点化合物的光活化性能进行xps光谱、1h nmr和esr能谱分析。其在光照前后xps能谱显示n1s中的pt(nh3)2拟合峰和o1s中的pt-o拟合峰降低,证明光照下铂药释放(图6和图7)。并且光照后收集的缓释产物的xps能谱显示pt 4f的电子结合能在76.0ev和72.8ev,为pt(ii)结构化合物(如图5所示),证明释放的铂物质为二价高毒性铂药。同时,光照后的铂药碳纳米点化合物的xps能谱显示o1s中的cooh拟合峰显著增加,这一结果同样在1h nmr谱图中得到(如图8所示)。随后与电子自旋捕获剂dmpo结合,光照前后检测铂药碳纳米点所产生何种活性氧。电子自旋能谱(esr)结果证实不光照的情况下并没有羟基自由基产生,一旦光照后,能显著产生明显的羟基自由基(如图9所示),进一步说明铂药碳纳米点化合物具有降低周围环境ph值的能力。
[0090]
实验例三
[0091]
将实施例1的铂药碳纳米点溶解在水、生理盐水、缓冲溶液、组织培养液或体液中的一种,其中,激发光可选自的波长为300nm-1200nm(例如图10中的589nm激光);光动力照射时间可选自0-10小时;所述的光动力的照射装置可选自为激光或led灯光;光动力的功率可选自0-5w/cm2之间。将其配成溶液,然后施加波长为400-650nm的激光,功率为0.1-1.0w/cm2,该铂药碳纳米点在光照射下还原得到二价顺铂抗癌药。
[0092]
实验例四
[0093]
为了提高碳纳米点的光学性能和细胞內吞能力,使用牛血清蛋白进行与实施例1的铂药碳纳米点进行复合,铂药碳纳米点与牛血清蛋白的比例为0.5:10的质量比。通过透射电镜对复合后的纳米点进行观测,可知通过牛血清蛋白复合后,尺寸从5nm左右提高到50纳米左右(如图11所示)。随后对牛血清蛋白复合前后的铂药碳纳米点进行紫外-可见吸收和荧光测试,结果如图12所示,紫外吸收光谱的吸收峰没有发生较大变化,但是荧光光谱曲线显示通过牛血清蛋白复合可显著提高铂药碳纳米点的荧光。
[0094]
实验例五
[0095]
进行药物缓释测试,使用1000截留分子量的透析袋装载2ml的0.5mg/ml浓度的实施例1的铂药碳纳米点,随后放入50ml不同的pbs缓冲溶液中,包括10mm的谷胱甘肽或者
589nm激光(5min间隔、0.5w/cm2)。结果如图13所示,实施例1的铂药碳纳米点在光照后铂药迅速释放,在4小时内光照五次后释放率达到40%,而相同时间下在谷胱甘肽环境下的释放率只有10%左右,说明具有良好的光控释放率。说明释放速率显著优于谷胱甘肽等还原介质。
[0096]
实验例六
[0097]
随后进行ph值的测试,采用ph计作为ph值测试手段。在不同溶度的铂药碳纳米点溶液进行光照,激光功率为0.1-1.0w/cm2,照射时间为1-30min,激光波长为380-650nm。如图14所示,实施例1的铂药碳纳米点在589nm的照射下ph值降低,以0.25mg/ml为例,在0.5w/cm2光照10分钟下,最终ph值可降至6.5以下。
[0098]
实施例七
[0099]
随后进行细胞內吞测试,实施例1的铂药碳纳米点与实施例四的铂药碳纳米点@bsa在同样浓度下研究不同时间细胞內铂含量。采用的溶度为10μm pt。通过icp-ms手段,如图15所示,随着与细胞共培养时间增加,铂药碳纳米点@bsa在细胞的富集显著增加,在12小时富集最大后富集下降。相比铂药碳纳米点,包覆bsa后的铂药碳纳米点富集能力达到19倍。荧光显微镜图片同样证明这一趋势(如图16所示)。
[0100]
实验例八
[0101]
随后进行光照细胞毒性测试,分别以1.0、2.5、5.0、10、20、40μm铂浓度的实施例1的铂药碳纳米点和实施例1的铂药碳纳米点@bsa与4t1细胞共培养,在培养6小时后,采用589nm激光器,以0.5w/cm2的功率照射10min,随后继续孵育满48h。如图17和图18所示,实施例1的铂药碳纳米点在光照后其毒性迅速提高,相比纯碳点,包裹bsa的碳点的浓度在10μm具有显著抑制效果,而纯碳点需40μm才有明显抑制效果。
[0102]
实验例九
[0103]
随后对细胞水平中死亡方式和活性氧表达进行研究,分别使用10μm铂浓度的顺铂、实施例1的铂药碳量子点、实施例1的铂药碳量子点@bsa在589nm激光照射下对4t1乳腺癌细胞的磷酸化组蛋白h2ax(p-h2a.x)表达能力。如图19所示,铂药碳量子点@bsa在光照后所产生的p-h2a.x低于相同浓度的顺铂,说明铂药碳量子点@bsa对细胞的毒性不仅仅来源于铂药对dna的损伤。因此,进一步通过活性氧的表达研究其对细胞死亡方式,如图20所示,在铁死亡抑制剂fer-1的作用下,铂药碳量子点@bsa对4t1细胞所产生的ros部分被抑制,说明铂药碳量子点@bsa光照后产生的活性氧参与细胞铁死亡。如图21所示,进一步采用流式细胞仪研究铂药碳量子点@bsa光照后对4t1细胞的死亡,在fer-1加入后可抑制细胞的死亡,进一步说明该细胞具有铁死亡特征。
[0104]
实施例十
[0105]
随后进行免疫细胞死亡(icd)的研究,使用10μm铂浓度的顺铂、实施例1的铂药碳量子点、实施例1的铂药碳量子点@bsa在589nm激光照射下对4t1乳腺癌细胞的免疫相关因子:钙网蛋白(crt)和高迁移率族蛋白b1(hmgb1)表达。如图22所示,药碳量子点@bsa在589nm激光照射下4t1细胞膜表面的钙网蛋白表达以及细胞核中的高迁移率族蛋白b1的消失,说明诱导免疫细胞死亡。
[0106]
实施例十一
[0107]
动物实验显示,具有原位4t1肿瘤的babl/c小鼠在肿瘤长到80mm3时进行一次尾静
脉注射,分别注射一次200μl的2mg/kg浓度的顺铂、实施例1的铂药碳量子点、实施例1的铂药碳量子点@bsa,对于光照组采用589nm激光,0.5w/cm2功率和10min照射时间。如图23所示,铂药碳纳米点@bsa组在光照后具有明显的抑制效果,说明其具有显著的光控治疗作用。而且,铂药碳纳米点@bsa组在光照后对远端肿瘤同样具有明显的抑制效果,说明具有显著的免疫治疗作用(图24)。
[0108]
实施例十二
[0109]
随后在治疗14天后对4t1肿瘤的babl/c小鼠的所有肿瘤进行切除,并且继续观察小鼠。其生存曲线如图25所示,实施例1的铂药碳量子点@bsa光照组处理的小鼠在30天后依然存活,而其他对照组均有小鼠死亡。随后对小鼠进行解剖,得到不同的肺。如图26所示,铂药碳量子点@bsa光照组处理的小鼠肺部没有明显的肿瘤产生,而其他对照组具有大量的肿瘤转移到肺脏,说明铂药碳量子点@bsa光控治疗能产生显著的免疫,从而抑制肺转移。
[0110]
综上所述,本发明实施方式中的铂药碳纳米点及其蛋白复合物具有可调控的光响应释放特性,在光照的情况下,可还原得到二价铂类抗癌药,强肿瘤杀伤性的羟基自由基,及引起肿瘤细胞内的酸化,因此,既降低铂类药物副作用的问题,又提高了传统顺铂的抗癌效果。此外,相比传统的单药顺铂,本发明实施方式的铂药碳纳米点具有形式多样性,其蛋白复合后可提高在体内的循环时间及肿瘤部位的富集。
[0111]
以上所述仅为本发明的优选实施例而已,并不用于限制本发明,对于本领域的技术人员来说,本发明可以有各种更改和变化。凡在本发明的精神和原则之内,所作的任何修改、等同替换、改进等,均应包含在本发明的保护范围之内。
再多了解一些
本文用于创业者技术爱好者查询,仅供学习研究,如用于商业用途,请联系技术所有人。
