1.本技术属于细胞染色技术领域,尤其涉及在悬浮液状态下的细胞染色技术,尤其涉及悬浮液状态下的细胞染色前处理的方法及试剂。
背景技术:
2.在生物体体液或分泌物的细胞检测中,通常采用细胞染色技术来区分不同种类、不同形态、不同状态的细胞。
3.用于明场观察检测的常规细胞染色技术中,通常是将待检测样本涂抹在透明载体如载玻片上,等检测样本干燥后,再依次滴入具有不同染色效果的染液及缓冲液,混合均匀完成染色后,再冲洗掉影响观测的染液及缓冲液主体,再等待染色样本干燥后,完成整个染色过程,形成用于明场观测的染色后的样本涂片。现有技术中的干片染色步骤极其繁琐耗时,染色效率极低,无法大批量进行样本细胞染色。且每个步骤的操作都需训练有素的专业操作者,才能制作出合格的观测样本。且干片染色需要的时间较长,效率较低,在大批量样本检测时候成本效率都不能满足现实的需求。
4.血细胞在液体环境即在悬浮液中染色时,无需干片制作的复杂过程;但是在悬浮液中进行染色时,染色液中的盐环境、或有机溶剂、表面活性剂的存在,往往会使血细胞形态的剧烈变化,如皱缩、破裂等。最终导致血液细胞液体在上述环境下染色后,无法输出完整的临床信息:如细胞的数量信息、形态信息、分类信息等。且染色的效果由于在悬浮液中容易受到各种组分的影响,要么难以染色,要么染色着色的需要时间较长;且对不同的细胞,很难在较为均衡的时间窗口达到同等水平的染色效果。
5.名词解释:cas编号(casregistrynumber或称casnumber,casrn,cas#),又称cas登录号或cas登记号码,是某种物质(化合物、高分子材料、生物序列(biologicalsequences)、混合物或合金)的唯一的数字识别号码。其由美国化学会的下设组织化学文摘社(chemicalabstractsservice,简称cas)构建。该社负责为每一种出现在文献中的物质分配一个cas编号,避免了化学物质有多种名称的麻烦,使数据库的检索更为方便。
6.纯化水是指符合《中国药典(2015版)》纯化水标准的水,其主要参数为:ph值为4.4-7.6之间,使用离线电导率仪检测,25℃温度下,标示装量不大于10ml(毫升)时,电导率不大于25μs/cm(微西门子每厘米)的水。
7.瑞吉氏染色液是指,以伊红、美兰、天青为主要染色物质,经过一定的加工工艺,形成的液态染色液。如珠海贝索生物技术有限公司的姬姆萨染色液(货号ba-4017)。
8.瑞氏(wright)染色液是指:以伊红和美蓝为主要染料,经一定有机溶剂溶解、混合、经化学作用后,形成的染色液。如北京索莱宝科技有限公司的瑞氏染色液(货号g1040)吉姆萨(giemsa)染色液是指:以酸性伊红和天青为主要染料,经一定有机溶剂溶解、混合、经化学作用后,形成的染色液。如珠海贝索生物技术有限公司的姬姆萨染色液(货号ba-4219)。
9.新亚甲蓝染色液是指:以新亚甲蓝作为主要染料,通过一定的有机或无机溶剂溶解后,形成的染色液。如珠海贝索生物技术有限公司的姬姆萨染色液(货号ba-4003)。
10.煌焦油蓝染色液是指:以灿烂甲酚蓝为主要染料,通过一定的有机或无机溶剂溶解后,形成的染色液。如北京索莱宝科技有限公司的瑞氏染色液(货号g1410)。
11.迪夫染色液是指,以水溶性伊红和美兰、天青ⅱ,为主要染料,以水为主要溶剂,经一定工艺形成的染色液。如北京索莱宝科技有限公司的瑞氏染色液(货号g1541)。
技术实现要素:
12.本技术要解决的技术问题在于避免现有技术上述不足之处,提出了一种简单高效的前处理试剂及制备方法和细胞染色方法及前处理方法,在细胞在进入悬浮液中染色之前先进行前处理,使细胞状态调整为适合进行悬浮液染色的状态,非常适用于规模化批量化的样本细胞染色。
13.本技术解决上述问题的技术方案是一种前处理试剂用于细胞在悬浮液中染色的前处理,其组分,以体积百分比计,包括0.5%-5%稳定剂,95%-99.5%缓冲液。
14.本方案中的稳定剂,一方面使细胞膜表面膜蛋白发生交联,使在细胞膜表面形成网状结构,保持细胞形态;另一方面破坏细胞膜的磷脂双分子层,增加细胞膜的透过性,使后续染料进入细胞的效率一致,且快速;使细胞染色的时间变短,染色均一性变高。
15.所述的前处理试剂其组分,以体积百分比计,包括1%-3%稳定剂,97%-99%缓冲液。优选地,前处理试剂其组分,以体积百分比计,包括1.75%稳定剂,98.25%缓冲液。
16.所述前处理试剂的ph值范围为6.5-8.1;或所述前处理试剂的ph值范围为6.8-7.6。
17.所述稳定剂的组分,以体积百分比计,包括33.3%-50%戊二醛溶液,50%-66.7%醛类溶液;或所述稳定剂的组分,以体积百分比计,包括40%-50%戊二醛溶液,50%-60%醛类溶液。
18.优选地,所述稳定剂的组分,以体积百分比计,包括42.9%戊二醛溶液和57.1%甲醛溶液。
19.所述醛类溶液中的醛类物质包括甲醛、乙醛、丙醛、多聚甲醛中的任意一种或多种。
20.所述稳定剂的组分,以体积百分比计,包括21.1%-48.3%戊二醛溶液,51.7%-88.9%醇类溶液。
21.所述醇类溶液中的醇类物质包括无水甲醇或无水乙醇。
22.所述戊二醛溶液是戊二醛的质量百分比为50%的戊二醛溶液;所述醛类溶液是醛类物质的质量百分比为37%的醛类溶液。
23.优选地,所述甲醛溶液是甲醛的质量百分比为37%的甲醛溶液。
24.所述缓冲液的组分,以体积百分比计,包括10%-50%磷酸缓冲液,50%-90%纯化水;或所述缓冲液的组分,以体积百分比计,包括20%-40%磷酸缓冲液,60%-80%纯化水。
25.所述前处理试剂中,磷酸盐浓度0.02m(摩尔/升)至0.1m(摩尔/升)。
26.无论磷酸缓冲液中的磷酸盐浓度如何,需要保证配制成前处理试剂后,在前处理试剂中磷酸盐浓度0.02m(摩尔/升)至0.1m(摩尔/升),以保证前处理试剂的前处理效果,既能保持细胞形态,又能增加细胞膜的透过性,使后续染色均一性能提高。
27.所述磷酸缓冲液的组分,以体积百分比计,包括5.3%-73.5%磷酸二氢盐溶液和26.5%-94.7%磷酸氢二盐溶液。磷酸缓冲液的ph值为6.4-8.0。
28.所述磷酸缓冲液的组分,以体积百分比计,包括13%-51%磷酸二氢盐溶液和49%-87%磷酸氢二盐溶液;磷酸缓冲液的ph值为6.8.-7.6。
29.优选地,所述磷酸缓冲液的组分,以体积百分比计,包括28%磷酸二氢盐溶液和72%磷酸氢二盐溶液。
30.优选地,所述磷酸二氢盐溶液的磷酸二氢盐浓度是0.2m(摩尔/升);所述磷酸氢二盐溶液的磷酸氢二盐浓度是0.2m(摩尔/升)。
31.本技术解决上述问题的技术方案还可以是一种前处理试剂制备方法,用于制备所述的前处理试剂,包括以下步骤,步骤d:取戊二醛溶液和醛类溶液以33.3%:66.7%至50%:50%的体积比进行混合,制得稳定剂;步骤e:将步骤d制得的稳定剂和缓冲液以0.5:99.5至5:95的体积比混合制得前处理试剂。
32.所述的前处理试剂制备方法,在步骤d之前还包括以下步骤:步骤a:配制0.2m(摩尔/升)磷酸二氢盐溶液的步骤;称取定量无水磷酸二氢盐,溶于相应容积的纯化水中,定容制得0.2m(摩尔/升)磷酸二氢盐溶液;步骤b:配制0.2m(摩尔/升)磷酸氢二盐溶液的步骤;称取定量无水磷酸氢二盐,溶于相应容积的纯化水中,定容制得0.2m(摩尔/升)磷酸二氢盐溶液;步骤c:利用步骤a制得的磷酸二氢盐溶液和步骤b制得的磷酸氢二盐溶液混合配制成ph值为6.4-8.0的磷酸缓冲液;步骤e中所用的缓冲液是步骤c制得的磷酸缓冲液;磷酸缓冲液的用量配比,会使制得的前处理试剂中磷酸盐浓度范围是0.02m(摩尔/升)至0.1m(摩尔/升);前处理试剂ph值范围为6.5-8.1。上述步骤a和步骤b不分先后顺序。
33.本技术解决上述问题的技术方案还可以是前处理方法,一种前处理方法,使用了上述的前处理试剂对待染色样本进行细胞染色之前的前处理;包括以下步骤:步骤1:将待染色样本和前处理试剂以1:49至1:399的体积比混合均匀,完成待染色样本的前处理。
34.本技术解决上述问题的技术方案还可以是一种细胞染色方法,用于在悬浮液中对细胞进行染色;在加入染色液之前采用了上述的前处理方法对待染色样本进行了前处理。
35.所述的细胞染色方法,在悬浮液中加入的染色液包括:瑞吉氏染色液、瑞氏染色液、吉姆萨染色液、新亚甲蓝染色液、煌焦油蓝染色液、迪夫快速染色液中的任意一种或多种。
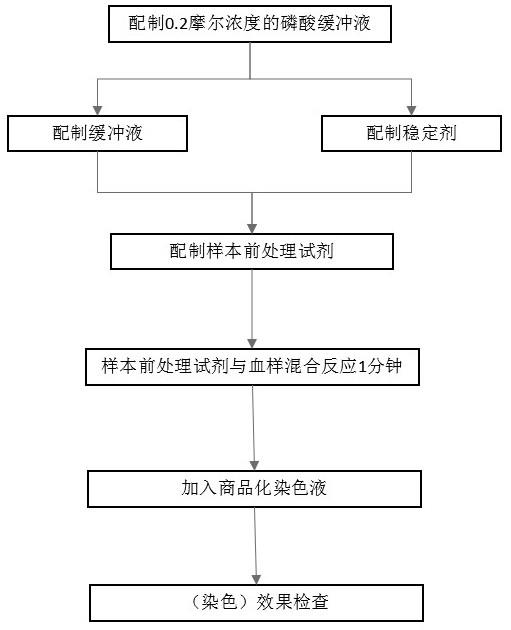
36.同现有技术相比较,本技术的有益效果是:1.待染色样本中的细胞尤其是血液样品中的血细胞,经过前处理试剂的前处理,血液细胞的结构能保存完好,能更真实地保存其临床状态下的真实结构信息;2.经过前处理方法处置后的血细胞,在配合染色液使用后,血液细胞中的红细胞和白细胞的染色后的状态比较均衡,能在同一时间节点,达到统一的颜色度,方便进行后续的观测;3.上述前处理试剂处理后的待处理样本悬浮液,细胞染色时间缩短至1分钟-3分钟,染色效率大大提升;4.染色前处理试剂配制方法简单,组分也非常容易获得;是非常方便高效的染色前处理方案;5.经过这样的前处理过程,使细胞染色操作简单,能实现傻瓜式的染色操作,使其适用于多种应用场景。如即时检验、急救、床边,战地等多种缺乏专业人员、大型设备和复杂检验环境的条件下。
附图说明
37.图1是前处理试剂制备方法以及用前处理试剂对待染色样本进行前处理方法和细胞染色方法的流程示意图;图2至图4分别是实施例1至实施例3中的前处理试剂处理后再进行染色后获得的染色后细胞悬浮液在平铺后获得的显微图片;图2不同细胞密度下的染色效果图,样本与前处理试剂的体积比为1:149,视野下细胞数量适中,分布均匀,染色通透;图3不同细胞密度下的染色效果图,样本与前处理试剂的体积比为1:49,细胞数量大,排列紧密,易遮挡血小板的染色信息;图4不同细胞密度下的染色效果图,样本与前处理试剂的体积比为1:399,细胞数量小,分布稀疏,染色效果一般;图2、图3、图4为不同密度下的染色4分钟的效果图,三种比例均可得到好的细胞分布染色效果,其中图2的效果最佳。
38.图5至图7分别是实施例4至实施例6中的前处理试剂处理后再进行染色后获得的染色后细胞悬浮液在平铺后获得的显微图片;图5不同稳定剂浓度下染色效果图,稳定剂与缓冲液的体积比为1.75:98.25,染色后细胞区分度明显;图6不同稳定剂浓度下染色效果图,稳定剂与缓冲液的体积比为5:95,染色后细胞区分度不明显,白细胞核浅染;图7不同稳定剂浓度下染色效果图,稳定剂与缓冲液的体积比为0.5:99.5,染色后细胞区分度不明显;红细胞大小有收缩,白细胞核与细胞质区分度稍差;图5、图6、图7为一组不同稳定剂浓度下的染色4分钟的效果图,其中三种稳定剂与缓冲液的体积比均可获得较好的染色效果,其中图5红细胞结构完好、白细胞核染色结构清晰,红细胞与白细胞、血小板区分明显,其染色最佳。
39.图8至图10分别是实施例7至实施例9中的前处理试剂处理后再进行染色后获得的染色后细胞悬浮液在平铺后获得的显微图片;图8不同磷酸盐浓度的前处理试剂前处理后的下染色效果图,实施例7中,前处理试剂中磷酸盐浓度为0.06m(摩尔/l),如图8可见细胞结构完好,染色后细胞区分度明显;实施例8中,前处理试剂中磷酸盐浓度为0.1m(摩尔/l),如图9可见细胞结构完好,染色白细胞核与细胞质区分度一般;实施例8中前处理试剂中的磷酸盐浓度为0.02m(摩尔/l),如图10所示红细胞结构有形变,染色白细胞核与细胞质区分度尚可;图8、图9、图10为不同磷酸盐浓度的前处理试剂前处理后再染色4分钟的效果图,前处理试剂中的磷酸盐浓度从0.02m(摩尔/l)到0.1m(摩尔/l)条件,均可得到好的染色结果,其中图8红细胞、白细胞结构更完整,白细胞染色区分更明显,其条件最佳。
40.图11至图13分别是实施例10至实施例12中的前处理试剂处理后再进行染色后获得的染色后细胞悬浮液在平铺后获得的显微图片;图11不同前处理试剂ph值下染色效果图,前处理试剂ph值为7.2时,细胞结构完好,不同细胞区分度好;图12不同前处理试剂ph值下染色效果图,前处理试剂ph值为8.0时,细胞染色过深,白细胞核内形态无法分辨;图13不同前处理试剂ph值下染色效果图,前处理试剂ph值为6.4时,细胞浅染,且红细胞形态有胀大;图11、图12、图13为不同ph条件下的前处理试剂前处理后,再进行4分钟染色的染色效果图。ph值从6.4至8.0染色效果较好,其中图11的红细胞细胞形态与白细胞的染色效果更优。缓冲液的ph值和前处理试剂的ph值之间差异并不太大;缓冲液的ph值主导了前处理试剂的ph值。
41.图14至图16分别是实施例13至实施例15中的前处理试剂处理后再进行染色后获
得的染色后细胞悬浮液在平铺后获得的显微图片;图14用甲醇取代稳定剂中的甲醛,甲醇在稳定剂中的体积占比为80%;图15用甲醇取代稳定剂中的甲醛,甲醇在稳定剂中的体积占比为57.1%;图16用甲醇取代稳定剂中的甲醛,甲醇在稳定剂中的体积占比为88.9%;图14、图15、图16中,以不同体积占比的甲醇取代稳定剂中的甲醛,该体系4分钟染色效果较好,其中图14中白细胞染色均一、核轮廓清晰,红细胞形态完整。甲醇包括无水甲醇,或达等量无水甲醇相同效果的其他浓度的甲醇溶液也可以。
42.图17至图19分别是实施例16至实施例18中的前处理试剂处理后再进行染色后获得的染色后细胞悬浮液在平铺后获得的显微图片;图17用乙醇取代稳定剂中的甲醛,乙醇在稳定剂中的体积占比为80%;图18用乙醇取代稳定剂中的甲醛,乙醇在稳定剂中的体积占比为57.1%;图19用乙醇取代稳定剂中的甲醛,乙醇在稳定剂中的体积占比为88.9%;图17、图18、图19中,以不同体积占比的乙醇取代稳定剂中的甲醛,该体系4分钟染色效果较好,其中图17中白细胞染色均一、核轮廓清晰,红细胞形态完整。乙醇包括无水乙醇,或达等量无水乙醇相同效果的其他浓度的乙醇溶液也可以。
43.上述显微图片的显微放大倍数均为400倍;上述显微照片中,细胞以“三维”结构在悬浮液中处于悬浮状态,不同细胞在悬浮液中的位置差异,不同细胞会处于不同的显微成像的对焦面上;且显微镜对视野的聚焦区域通常选择在视野中间区域,视野边缘因为球差、像差等原因会有虚焦,因此部分图片的边缘中的细胞影像略有模糊;为了更好显示,在其他证明文件中提供了图2至图19的彩色图片。
具体实施方式
44.以下结合各附图对本技术的实施方式做进一步详述。
45.图1是前处理试剂制备方法以及用前处理试剂对待染色样本进行前处理方法和细胞染色方法的流程示意图。
46.如图1所示,包括以下步骤:步骤1:配制0.2m磷酸二氢钠溶液:称取23.99克无水磷酸二氢钠,溶于800毫升纯化水中,定容至1000毫升;步骤2:配制0.2m磷酸氢二钠溶液;称取28.39克无水磷氢二钠,溶于800毫升纯化水中,定容至1000毫升;步骤3:配制最佳0.2m磷酸缓冲液体系;将0.2m磷酸二氢钠溶液与0.2m磷酸氢二钠溶液按照28:72的体积比混合,此时0.2m磷酸缓冲液ph值为7.2;步骤4:把步骤:3的磷酸缓冲液与纯化水按照3:7的体积比混合,配制成缓冲液;步骤5:取50%的戊二醛和37%的甲醛,按照7.5:10的体积比进行混合,配制成稳定剂;步骤6:将步骤4制得的磷酸缓冲液与步骤5获得的稳定剂按照体积比为1.75:98.25的比例混合,配置成前处理试剂;前处理试剂中磷酸盐浓度是0.06m(摩尔/升);前处理试剂ph值为7.3;步骤7:取新鲜血液样本按照样本:前处理试剂=1:149的体积比进行混合,反应1分钟;步骤8:在步骤7制得的混合液中加入合适比例的商品化瑞吉氏染色液,混匀,在显
微镜下拍照。
47.在实施例1至实施例3中,将样本与样本处理试剂分别按1:49,1:149以及1:399的比例进行混合后,加入商品化的瑞吉氏染色液,进行染色试验;以实施例2为例,取样本和样本处理液的体积比为1:149;操作如下,取0.005ml新鲜血液样本,加入到0.745ml样本处理试剂中,混匀并反应1分钟;再加入10ul商品化的瑞吉氏染色液,混匀后镜检拍照。图2是用实施例1的前处理试剂处理后再进行染色后获得的染色后细胞悬浮液在平铺后获得的显微图片;图3是用实施例2的前处理试剂处理后再进行染色后获得的染色后细胞悬浮液在平铺后获得的显微图片;图4是用实施例3的前处理试剂处理后再进行染色后获得的染色后细胞悬浮液在平铺后获得的显微图片。
48.在实施例4至实施例6中,能显示不同的稳定剂含量,对样本前处理的影响;在实施例4至实施例6中,以50%戊二醛与37%甲醛为基础材料,配制稳定剂;将稳定剂与缓冲液分别以体积比0.5:99.5、5:95,以及1.75:98.25的比例分别配成样本处理试剂;取0.005ml新鲜血液样本,加入到0.495ml样本处理试剂中,混匀并反应1分钟;再加入10ul商品化的瑞吉氏染色液,混匀后镜检拍照。图5至图7分别是实施例4至实施例6中的前处理试剂处理后再进行染色后获得的染色后细胞悬浮液在平铺后获得的显微图片。
49.在实施例7至实施例9的前处理试剂制备以及前处理方法和染色方法中,包括以下步骤:步骤1:将0.2m磷酸二氢盐溶液与0.2m磷酸氢二盐溶液按照体积比28:72的比例混合,配制成ph值等于7.2,浓度为0.2m(摩尔/升)的磷酸缓冲液;步骤2:将0.2m的磷酸缓冲液与纯化水分别按照体积比1:9,5:5,及3:7,稀释成磷酸缓冲液;步骤3:将稳定剂中50%戊二醛溶液与37%甲醛溶液按照体积比等于42.9:57.1的比例混合,得到稳定剂;步骤4:将稳定剂分别加入上述磷酸缓冲液中,磷酸缓冲液与稳定剂的体积比为98.25:1.75,配制成前处理试剂,此时前处理试剂中的磷酸盐浓度分别是0.02m、0.1m与0.06m;ph为7.2;步骤5:取0.005ml新鲜血液样本,加入到0.495ml样本处理试剂中,混匀并反应1分钟;再加入10ul商品化的瑞吉氏染色液,混匀后镜检拍照。图8至图10分别是实施例7至实施例9中的前处理试剂处理后再进行染色后获得的染色后细胞悬浮液在平铺后获得的显微图片。
50.在实施例10至实施例12中,能看到不同ph值环境对样本前处理的影响;在实施例10至实施例12中,先配制作“0.2m磷酸盐缓冲液体系”。
51.在实施例10至实施例12中,包括以下步骤:步骤1:先配制0.2m磷酸二氢钠溶液:称取23.99克无水磷酸二氢钠,溶于800毫升纯化水中,定容至1000毫升;步骤2:再配制0.2m磷酸氢二钠溶液;称取28.39克无水磷氢二钠,溶于800毫升纯化水中,定容至1000毫升;步骤3:再配制最佳0.2m磷酸缓冲液;在实施例10中,将0.2m磷酸二氢钠溶液与0.2m磷酸氢二钠溶液按照28:72的体积比混合,此时0.2m磷酸缓冲液ph值为7.2;在实施例
11中,配制0.2m一般范围上限磷酸缓冲液体系,是将0.2m磷酸二氢钠溶液与0.2m磷酸氢二钠溶液按照5.3:94.7的体积比混合,此时0.2m磷酸缓冲液ph值为8.0;在实施例12中,配制0.2m一般范围下限磷酸缓冲液体系,将0.2m磷酸二氢钠溶液与0.2m磷酸氢二钠溶液按照73.5:26.5的体积比混合,此时0.2m磷酸缓冲液ph值为6.4;步骤4:将上述三种0.2m磷酸缓冲液与纯化水按3:7的体积混合,配制成三种不同ph值的缓冲液;步骤5:再将稳定剂中50%戊二醛溶液与37%甲醛溶液按照体积比等于42.9:57.1的比例混合,得到稳定剂;步骤6:将稳定剂分别加入上述ph值分别为7.2、8.0、6.4的磷酸缓冲液中,磷酸缓冲液与稳定剂的体积比为98.25:1.75,分别配制成实施例10至12的前处理试剂;此时前处理试剂中的磷酸盐浓度是0.06m,此时前处理试剂的ph值分别为7.3、8.1、6.5;步骤7:再取0.005ml新鲜血液样本,加入到0.495ml样本处理试剂中,混匀并反应1分钟;步骤8:再加入10ul商品化的瑞吉氏染色液,混匀后镜检拍照。图11至图13分别是实施例10至实施例12中的前处理试剂处理后再进行染色后获得的染色后细胞悬浮液在平铺后获得的显微图片。
52.在实施例13至实施例15的前处理试剂制备以及前处理方法和染色方法中,包括以下步骤:步骤1:将0.2m磷酸二氢盐溶液与0.2m磷酸氢二盐溶液按照体积比28:72的比例混合,配制成ph值等于7.2,浓度为0.2m(摩尔/升)的磷酸缓冲液;步骤2:将0.2m的磷酸缓冲液与纯化水按照体积比3:7,稀释成磷酸缓冲液;步骤3:将稳定剂中50%戊二醛溶液与无水甲醇溶液分别按照体积比等于20%:80%、42.9%:57.1%、11.1%:88.9%的比例混合,得到稳定剂;步骤4:将稳定剂分别加入上述磷酸缓冲液中,磷酸缓冲液与稳定剂的体积比为98.25:1.75,配制成前处理试剂;此时前处理试剂中的磷酸盐浓度分别是0.02m、0.1m与0.06m,前处理试剂的ph值为7.2;取0.005ml新鲜血液样本,加入到0.495ml样本处理试剂中,混匀并反应1分钟;再加入10ul商品化的瑞吉氏染色液,混匀后镜检拍照。图14至图16分别是实施例13至实施例15中的前处理试剂处理后再进行染色后获得的染色后细胞悬浮液在平铺后获得的显微图片。
53.在实施例16至实施例18的前处理试剂制备以及前处理方法和染色方法中,包括以下步骤:步骤1:将0.2m磷酸二氢盐溶液与0.2m磷酸氢二盐溶液按照体积比28:72的比例混合,配制成ph值等于7.2,浓度为0.2m(摩尔/升)的磷酸缓冲液;步骤2:将0.2m的磷酸缓冲液与纯化水按照体积比3:7,稀释成磷酸缓冲液;步骤3:将稳定剂中50%戊二醛溶液与无水乙醇溶液分别按照体积比等于20%:80%、42.9%:57.1%、11.1%:88.9%的比例混合,得到稳定剂;步骤4:将稳定剂分别加入上述磷酸缓冲液中,磷酸缓冲液与稳定剂的体积比为98.25:1.75,配制成实施例16至18的前处理试剂,此时前处理试剂中的磷酸盐浓度均是0.06m,ph值为7.3;
步骤5:取0.005ml新鲜血液样本,加入到0.495ml样本处理试剂中,混匀并反应1分钟;再加入10ul商品化的瑞吉氏染色液,混匀后镜检拍照。图17至图19分别是实施例16至实施例18中的前处理试剂处理后再进行染色后获得的染色后细胞悬浮液在平铺后获得的显微图片。
54.本技术中的前处理试剂以及前处理方法,细胞染色试剂和方法中,其技术效果包括多个方面。新鲜的体液或分泌物样本,其内的细胞具有生物活性。本技术的前处理,能在细胞膜表面膜蛋白发生交联,使在细胞膜表面形成网状结构,保持细胞形态,同时破坏细胞膜的磷脂双分子层,增加细胞膜的透过性;这样对细胞膜的特性进行了处理,一方面能保持好的细胞形态,同时借保持细胞形态也保持了细胞内部物质的活性,使细胞内部的内环境比较接近细胞原始的生理环境,细胞内部的细胞器活性保持的时间会更长。在染色液进入细胞内部后,能发挥细胞内部细胞器的活性,达到对细胞快速染色的目的。
55.本技术设计的细胞染色试剂和染色方法,能在体液或分泌物在液态的悬浮液中完成细胞染色。其适用的样本包括各种生物体液如血液,分泌物如尿液或白带等。
56.本技术中的细胞染色方法,待染色样本中的细胞是在液态的悬浮液中完成染色过程,且用于染色液及稀释液的环境为比较接近生物生理状态,因此在染色过程中,细胞活性保持的较好,一方面能利用细胞与溶液中染料分子共同的布朗运动,及静电作用力,进行染色反应,染色速度更快,效率更高;另一方面,由于在这样的染色环境下,细胞活性保持的比较好,通过前处理后的待染色样本,能实现快速均衡的细胞染色,特别适用于活体细胞染色的前处理,能大大提高细胞染色效率。
57.本技术中的方法,样品染色试剂和样品之间的配比的比率设定合理,能对样本中的活体细胞进行染色,操作简单、染色快、染色效果更好,染色结果更有利于细胞形态和种类鉴别,其染色后的溶液可直接适用于明场下的细胞形态分析和检测,并能根据染色后的细胞形态和图形特征分析,进一步地进行细胞分类和细胞分类计数。
58.在医疗应用领域还未见在让细胞在溶液状态中,对血液样本进行体外活染,即采用带有色基团的化合物染料,对血液细胞进行直接染色,并依据血液细胞在明视场显微镜下的染色结果中所呈现的细胞特征进行细胞分类分析。本技术方法染色后的体液或分泌物,其所呈现的细胞特征包括细胞的大小、颜色、形态、细胞核的形状、颜色、胞浆的颜色、胞浆内颗粒物的颜色、多少。本技术中的染色后的样本适用于细胞的形态学分析,基于细胞特征的分析如细胞形态和染色的着色度,可以进行细胞的分类识别和计数。
59.相比现有技术中的染色方法、试剂,本技术的主要特色在于,本技术在染色时,样本细胞的状态是处于生理或接近生理的状态。相比现有技术中的染色方法、试剂,本技术的主要特色还在于,染色时的反应环境与操作完全不一样,本技术中不涉及干燥和清洗的流程;本技术中,样本中的细胞一直处于液体溶液环境,用前处理试剂地样本进行前处理后,使各种待染色的目标细胞具有较为均衡的被染色特征,进行染色反应,染色效率更高,不同细胞着色效率更均衡。
60.上述试剂和方法能对样本中的活性细胞进行高效的前处理和高效染色,对操作者的要求不高、染色均匀、耗时短,能实现傻瓜化的染色过程;避免了现有技术中细胞染色操作繁琐,专业要求高,耗时长,易染色不均,染色材料成本高的不足之处。前处理和染色操作简单,能实现傻瓜式的染色操作,使其适用于多种应用场景。如即时检验这样的场景,也适
用于急救、床边,战地等多种缺乏大型专业设备、专业人员及复杂检验环境的应用场景。
61.以上所述仅为本技术的实施例,并非因此限制本技术的专利范围,凡是利用发明说明书及附图内容所作的等效结构或等效流程变换,或直接或间接运用在其他相关的技术领域,均同理包括在本技术的专利保护范围内。
再多了解一些
本文用于创业者技术爱好者查询,仅供学习研究,如用于商业用途,请联系技术所有人。