1.本发明属于药物领域,具体而言,本发明涉及提取得到的天然产物2-(3',4'-二羟苯基)-1,3-苯并二氧戊环-5-醛在制备降尿酸药物中的用途,本发明还涉及所述提取物的新的制备方法。
背景技术:
2.随着生活水平的提高,人们的饮食结构逐渐向高嘌呤食物模式转变,糖分、酒精、高脂、高蛋白的大量摄入,使得血尿酸生成增多、血尿酸水平持续升高,导致高尿酸血症,引起痛风和肾结石,并可加速肾脏和心血管疾病的进展。高尿酸血症的发病率逐年上升,已经成为继高血压、高血脂和高血糖之后的“第四高”,由高尿酸血症引起的痛风、肾结石以及心血管疾病等严重影响人们的工作生活,并带来极大的经济负担。
3.目前高尿酸血症主要是通过药物治疗,常用药物包括黄嘌呤氧化酶抑制剂,例如别嘌呤醇、非布司他;排尿酸剂,例如苯磺唑酮、苯溴马隆、丙磺舒;尿酸盐氧化酶,例如聚乙二醇重组尿酸酶、普瑞凯希、拉布立酶。但是现有的药物治疗会引起较强的不良反应,比如急性肝损伤、肾功能衰竭等严重副作用。因此开发能够降低体内尿酸水平且副作用小的药物一直倍受关注。
4.2-(3',4'-二羟苯基)-1,3-苯并二氧戊环-5-醛(2-(3',4'-dihydroxyphenyl)-1,3-benzodioxole-5-carboxaldehyde)是一种天然产物,其结构如下:
[0005][0006]
文献报道该化合物从柠檬香草(melissa officinalis l.)、白线文殊兰(crinum asiaticum l.var.sinicum baker)、大血藤(sargentodoxa cuneata)、大黄药(elsholtzia penduliflor)中提取分离得到,具有抗氧化、抑菌、抗病毒、抗肿瘤、骨增强等方面的作用(planta medica 64(1998)555-558;jp特开平11-12270a;kr10-0902167b1;chemistry&biodiversity-vol.6(2009),1751-1757;cn111714490a;nat prod res.2022feb;36(3):719-725)。但是,尚未发现有关2-(3’,4
’‑
二羟苯基)-1,3-苯并二氧戊环-5-醛在降尿酸方面的报道。此外,该化合物的现有提取方法存在来源不丰富、分离提取效率低等问题。
技术实现要素:
[0007]
本发明首次发现了2-(3',4'-二羟苯基)-1,3-苯并二氧戊环-5-醛在降尿酸方面的作用,其能够抑制黄嘌呤氧化酶,从而抑制尿酸生成,进而降低血液中的尿酸浓度。此外,本发明还发现平卧菊三七(gynura procumbens(lour.)merr.)中存在2-(3',4'-二羟苯
醛。
[0023]
在一个实施方案中,步骤1包括:将平卧菊三七(gynura procumbens(lour.)merr.)干燥地上全株用40-80%乙醇-水加热回流提取2-3次,合并提取液并减压浓缩,得粗提物。
[0024]
在一个实施方案中,步骤2包括:将粗提物用水悬浮,利用大孔吸附树脂进行初步分离,所得馏分再用硅胶开放柱分离,随后用ods开放柱分离,最后通过高效液相制备,得到2-(3',4'-二羟苯基)-1,3-苯并二氧戊环-5-醛。优选的,所述大孔树脂柱为hp-20大孔树脂柱。
[0025]
优选的,步骤2包括:将粗提物用水悬浮,利用hp-20大孔吸附树脂进行初步分离,依次用不同比例的乙醇-水(10:90至95:5)洗脱,得到3个馏分gp-60-10、gp-60-50、gp-60-95;将gp-60-50馏分用硅胶开放柱分离,依次用不同比例的二氯甲烷-乙酸乙酯-甲醇(100:0:0至0:0:100)洗脱,得到6个馏分gp-60-50-1、gp-60-50-2、gp-60-50-3、gp-60-50-4、gp-60-50-5、gp-60-50-6;将gp-60-50-3馏分采用ods开放柱分离,依次用不同比例的甲醇-水(10:90至100:0)洗脱,得到8个馏分gp-60-50-3-1、gp-60-50-3-2、gp-60-50-3-3、gp-60-50-3-4、gp-60-50-3-5、gp-60-50-3-6、gp-60-50-3-7、gp-60-50-3-8;将gp-60-50-3-2馏分通过高效液相制备,得到2-(3',4'-二羟苯基)-1,3-苯并二氧戊环-5-醛。
[0026]
优选的,步骤2包括:将粗提物用水悬浮,利用hp-20大孔吸附树脂进行初步分离,依次用10:90的乙醇-水、50:50的乙醇-水、95:5的乙醇-水分别洗脱3-7个柱体积,得到3个馏分gp-60-10、gp-60-50、gp-60-95;将gp-60-50馏分用硅胶开放柱分离,依次用100:0:0的二氯甲烷-乙酸乙酯-甲醇、90:10:0的二氯甲烷-乙酸乙酯-甲醇、80:20:0的二氯甲烷-乙酸乙酯-甲醇、50:50:0的二氯甲烷-乙酸乙酯-甲醇、20:80:0的二氯甲烷-乙酸乙酯-甲醇、0:0:100的二氯甲烷-乙酸乙酯-甲醇分别洗脱3-7个柱体积,得到6个馏分gp-60-50-1、gp-60-50-2、gp-60-50-3、gp-60-50-4、gp-60-50-5、gp-60-50-6;将gp-60-50-3馏分采用ods开放柱分离,依次用10:90的甲醇-水、20:80的甲醇-水、25:75的甲醇-水、30:70的甲醇-水、35:65的甲醇-水、40:60的甲醇-水、50:50的甲醇-水、100:0的甲醇-水分别洗脱3-7个柱体积,得到8个馏分gp-60-50-3-1、gp-60-50-3-2、gp-60-50-3-3、gp-60-50-3-4、gp-60-50-3-5、gp-60-50-3-6、gp-60-50-3-7、gp-60-50-3-8;将gp-60-50-3-2馏分通过高效液相制备,制备条件:20:80的甲醇-水,甲醇中含1
‰
甲酸,得到2-(3',4'-二羟苯基)-1,3-苯并二氧戊环-5-醛。
[0027]
本发明中,在未有其他说明的情况下,液体之间的比例是指体积比。
[0028]
本发明具有以下有益效果:
[0029]
1.本发明发现了2-(3',4'-二羟苯基)-1,3-苯并二氧戊环-5-醛具有良好的黄嘌呤氧化酶抑制活性,能够抑制尿酸生成,降低血液中的尿酸浓度,因此可将其用以治疗高尿酸血症或痛风。
[0030]
2.本发明首次发现平卧菊三七(gynura procumbens(lour.)merr.)中存在2-(3’,4
’‑
二羟苯基)-1,3-苯并二氧戊环-5-醛,并从中提取分离得到该化合物。
附图说明
[0031]
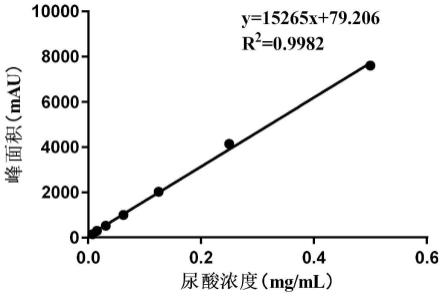
图1为尿酸标准曲线;
[0032]
图2为酶浓度摸索曲线;
[0033]
图3为别嘌呤醇ic
50
抑制曲线。
[0034]
图4为2-(3’,4
’‑
二羟苯基)-1,3-苯并二氧戊环-5-醛ic
50
抑制曲线。
具体实施方式
[0035]
以下将对发明的优选实例进行详细描述。所举实例是为了更好地对发明内容进行,并不是发明内容仅限于实例。根据发明内容对实施方案的非本质的改进和调整,仍属于发明范畴。
[0036]
下面实施例中的实验方法,如无特殊说明,均为常规方法。实施例中未注明具体技术或条件者,按照本领域内的文献所描述的技术或条件,或者按照产品说明书进行。
[0037]
实验仪器:
[0038]
核磁共振:bruker av-400兆赫,瑞士布鲁克公司
[0039]
高分辨质谱:waters synapt g2 tof,英国沃特世公司
[0040]
旋光测定仪:jasco p-1020
[0041]
紫外测定仪:jasco v-550
[0042]
红外测定仪:jasco ft/ir-480plus
[0043]
分析型高效液相色谱仪:dionexultimate 3000
[0044]
紫外检测器:spd-m20a;泵:ultimate 3000;自动进样系统:ultimate 3000
[0045]
制备型高效液相色谱仪:shimadzu lc-6ad
[0046]
紫外检测器:spd-m20a;泵:lc-6ad
[0047]
分析色谱柱:phenomenex genmini c18(5μm,4.6
×
250mm)
[0048]
实验试剂:
[0049]
二氯甲烷、乙酸乙酯、甲醇、无水乙醇:分析纯,广东光华科技股份有限公司
[0050]
甲醇:色谱纯,山东禹王实业有限公司
[0051]
乙腈:色谱纯,广东光华科技股份有限公司
[0052]
甲酸:天津市大茂化学试剂厂
[0053]
氘代试剂:meod(δh 3.30/δc 49.0)北京伊诺凯科技有限公司
[0054]
柱层析大孔树脂填料:hp-20,日本三菱化工
[0055]
柱层析硅胶:100-200目和200-300目,青岛海洋化工有限公司
[0056]
硅胶薄层板:青岛海洋化工有限公司
[0057]
ods:60-80μm,日本ymc
[0058]
黄嘌呤:上海源叶生物科技有限公司,批号:a11a9m58302,纯度:98%
[0059]
别嘌呤醇:上海毕得医药科技有限公司,批号:anw369,纯度:99.91%
[0060]
尿酸:上海吉至生化科技有限公司,批号:u1222c322,纯度:98%
[0061]
黄嘌呤氧化酶:北京博奥森生物技术有限公司
[0062]
nah2po4·
2h2o:上海生工生物工程股份有限公司,批号:c721ba0014,纯度:99%
[0063]
na2h
p
o4·
7h2o:上海生工生物工程股份有限公司,批号:a626ba0003,纯度:99%。
[0064]
实施例1:化合物提取分离过程
[0065]
平卧菊三七干燥地上全株20.0kg,通过5倍量60%乙醇-水热回流提取3次,每次3
小时,合并提取液并减压浓缩,得到粗提物(gp-60)4.7kg。将粗提物用水悬浮,利用hp-20大孔吸附树脂进行初步分离,依次用乙醇-水(10:90)、乙醇-水(50:50)、乙醇-水(95:5)分别洗脱5个柱体积,得到3个馏分gp-60-10(2.8kg)、gp-60-50(414.6g)、gp-60-95(69.5g)。将gp-60-50馏分用硅胶开放柱分离,依次二氯甲烷-乙酸乙酯-甲醇(100:0:0)、二氯甲烷-乙酸乙酯-甲醇(90:10:0)、二氯甲烷-乙酸乙酯-甲醇(80:20:0)、二氯甲烷-乙酸乙酯-甲醇(50:50:0)、二氯甲烷-乙酸乙酯-甲醇(20:80:0)、二氯甲烷-乙酸乙酯-甲醇(0:0:100)分别洗脱5个柱体积,得到6个馏分gp-60-50-1(1.90g)、gp-60-50-2(3.77g)、gp-60-50-3(3.46g)、gp-60-50-4(4.21g)、gp-60-50-5(7.94g)、gp-60-50-6(186.60g)。将gp-60-50-3馏分采用ods开放柱分离,依次用甲醇-水(10:90)、甲醇-水(20:80)、甲醇-水(25:75)、甲醇-水(30:70)、甲醇-水(35:65)、甲醇-水(40:60)、甲醇-水(50:50)、甲醇-水(100:0)分别洗脱5个柱体积,得到8个馏分gp-60-50-3-1(0.21g)、gp-60-50-3-2(0.65g)、gp-60-50-3-3(0.47g)、gp-60-50-3-4(0.23g)、gp-60-50-3-5(0.17g)、gp-60-50-3-6(0.13g)、gp-60-50-3-7(0.17g)、gp-60-50-3-8(0.51g)。将gp-60-50-3-2馏分通过高效液相制备,制备条件:甲醇-水(20:80,甲醇中含1
‰
甲酸),流速1ml/min,得到化合物(t
r:
11.5min,32.3mg),所得化合物纯度为95%。
[0066]
所述化合物理化常数如下:
[0067]
黑色粉末,uv(meoh)λ
max
(logε)207(4.47),232(4.38),278(4.25),312(4.19)nm;ir(kbr)ν
max 3553,3475,3414,3238,1646,1600,1530,1446,1391,1296,1161,1119,623cm
–1;hr-esi-ms(negative)给出m/z 257.0454[m-h]-(c
14
h9o5,计算值为257.0450);1h和
13
c nmr见表1。
[0068]
表1化合物的核磁数据及归属(1h 400mhz;
13
c 100mhz;meod)
na2hpo4·
7h2o,加水至1000ml;按照187:13的比例分别量取nah2po4·
2h2o和na2hpo4·
7h2o溶液混合即得ph为5.5的磷酸缓冲溶液。
[0079]
0.02u/ml黄嘌呤氧化酶:将5u黄嘌呤氧化酶溶解至800μl超纯水中,平均分装至4个ep管中,并用超纯水分别稀释至1ml,混匀后继续平均分装至5个ep管中,并继续用超纯水分别稀释至1ml,混匀后取其中1个ep管,取80μl黄嘌呤氧化酶溶液,用pbs稀释至1ml即得浓度为0.02u/ml的黄嘌呤氧化酶。
[0080]
1.0m naoh:取naoh固体颗粒4g,用水溶解至100ml即可。
[0081]
1.0m hcl:取3.75ml 12m的hcl,用水溶解至45ml即可。
[0082]
0.24mm黄嘌呤溶液:取9.12mg黄嘌呤粉末,用pbs溶解至250ml即可,可加入少量1.0m naoh助溶。
[0083]
3实验步骤
[0084]
1)称取1mg尿酸,溶于1ml 53.6g/l的na2hpo4·
7h2o溶液中,然后依次对半稀释,最终配制成0.5、0.25、0.125、0.0625、0.03125、0.015625和0.0078125mg/ml浓度的尿酸溶液,超声离心处理完成后,进行高效液相分析,以尿酸浓度为横坐标,以积分峰面积为纵坐标进行回归分析,绘制标准曲线。
[0085]
2)将黄嘌呤氧化酶设置7个浓度梯度(0.25、0.16、0.08、0.04、0.02、0.01和0.005u/ml),在96孔板上按照加样顺序依次加入50μl pbs、50μl不同浓度的黄嘌呤氧化酶以及150μl黄嘌呤底物,在25℃的条件下孵育15min,15min后加入80μl 1m的hcl终止反应。反应完成后分别取样,超声离心处理完成后,进行高效液相分析,绘制酶浓度曲线,确定后续反应的酶浓度。
[0086]
3)确定了后续反应的酶浓度之后,即可对单体化合物(50μm)进行抑制黄嘌呤氧化酶活性的测定。对照组在96孔板上按照加样顺序依次加入50μl pbs、50μl黄嘌呤氧化酶和150μl黄嘌呤底物,实验组在96孔板上按照加样顺序依次加入50μl单体化合物、50μl黄嘌呤氧化酶和150μl黄嘌呤底物,25℃条件下孵育15min,15min后加入80μl 1m的hcl终止反应,每组三个复孔。反应完成后分别取样,超声离心处理完成后,进行高效液相分析,通过计算即可得到各个单体化合物的抑制率。
[0087]
4)将单体化合物设置200、100、50、25、12.5、6.25、3.125和1.5625μm的浓度梯度,每组三个复孔。在同样的测试条件下测试各个浓度下的单体化合物的黄嘌呤氧化酶抑制率,绘制抑制率曲线,并得出ic
50
值。
[0088]
4结果计算与统计分析
[0089]
黄嘌呤氧化酶抑制率(%)=(对照组尿酸量-实验组尿酸量)/对照组尿酸量
×
100%
[0090]
5高效液相色谱测试条件
[0091]
色谱柱:phenomenex genmini c18(5μm,4.6
×
250mm)
[0092]
流动相:甲醇-磷酸缓冲溶液(ph 5.5)
[0093]
进样量:30μl
[0094]
流速:1ml/min
[0095]
条件:0min(10%)-5min(10%)
[0096]
紫外检测波长:292nm
[0097]
6活性测试结果
[0098]
1)将7个不同浓度的尿酸溶液进行高效液相分析,以尿酸浓度为横坐标,以积分峰面积为纵坐标进行回归分析,绘制标准曲线,结果如图1所示。
[0099]
2)待7个不同浓度的黄嘌呤氧化酶与底物黄嘌呤反应完成后,分别取样进行高效液相分析,以酶浓度为横坐标,以生成尿酸量为纵坐标绘制曲线,结果如图2所示。通过曲线结果,选择酶浓度为0.02u/ml进行后续分析。
[0100]
3)阳性药和化合物测试结果见表2和图3、图4。
[0101]
表2化合物抑制xod氧化酶活性
[0102][0103]
最后说明的是,以上优选实施例仅用于说明本发明的技术方案而非限制,尽管通过上述优选实施例已经对本发明进行了详细的描述,但本领域技术人员应当理解,可以在形式上和细节上对其作出各种各样的改变,而不偏离本发明权利要求书所限定的范围。
再多了解一些
本文用于创业者技术爱好者查询,仅供学习研究,如用于商业用途,请联系技术所有人。