用于放射治疗规划的mr成像
技术领域
1.本发明涉及磁共振(mr)成像领域。本发明关于一种对位于mr设备的检查体积中的对象进行mr成像的方法。本发明还涉及一种mr设备和一种在mr设备上运行的计算机程序。
背景技术:
2.利用磁场与核自旋之间的相互作用来形成二维或三维图像的图像-形成mr方法现在被广泛使用,特别是在医学诊断领域,因为对于软组织成像,它在许多方面与其他成像方法相比具有优势,它不需要电离辐射并且通常不是侵入性的。
3.总体上,根据mr方法,要检查的患者的身体布置在强而均匀的磁场b0中,磁场b0的方向同时定义测量所依据的坐标系的轴(通常是z-轴)。磁场b0根据能够通过施加已定义频率(所谓的拉莫尔频率,或mr频率)的电磁交变场(rf场)来激发(自旋共振)的磁场强度为单个核自旋产生不同的能级。从宏观的角度来看,单个核自旋的分布会产生整体磁化,当磁场b0垂直于z-轴延伸时,能够通过施加合适频率的电磁脉冲(rf脉冲)将所述整体磁化偏转出平衡状态,从而使磁化执行围绕z-轴的旋进运动。旋进运动描述圆锥的表面,所述圆锥的孔径角称为翻转角。翻转角的幅度取决于所施加的电磁脉冲的强度和持续时间。在所谓的90
°
脉冲的情况下,自旋从z-轴偏转到横向平面(翻转角90
°
)。
4.rf脉冲终止后,磁化松弛,恢复到初始平衡状态,其中,z方向上的磁化再次以第一时间常数t1(自旋晶格或纵向松弛时间)建立,并且在垂直于z方向的方向上以第二时间常数t2(自旋-自旋或横向松弛时间)松弛。能够以在垂直于z轴的方向上测量磁化的变化的方式,通过接收rf线圈来检测磁化的变化,所述rf线圈被布置和定向在mr设备的检查体积内。在施加例如90
°
脉冲之后,横向磁化的衰减,伴随着(由局部磁场不均匀性引起的)核自旋从具有相同相位的有序状态转变为所有相位角是均匀分布的状态(相移)。能够通过重新聚焦脉冲(例如180
°
脉冲)来补偿相移。这会在接收线圈中产生回波信号(自旋回波)。
5.为了在体内实现空间分辨率,沿三个主轴延伸的线性磁场梯度叠加在均匀磁场b0上,导致自旋共振频率的线性空间依赖性。然后在接收线圈中拾取的信号包含不同频率的分量,这些不同频率的分量能够与身体内的不同位置相关联。经由接收线圈获得的信号数据对应于空间频域,并且被称为k-空间数据。k-空间数据通常包括用不同相位编码采集的多条线。每条线都是通过收集一些样本来数字化的。通过傅里叶变换将一组k-空间数据转换为mr图像。
6.辐射治疗或放射治疗是使用电离辐射的治疗,总体上作为癌症治疗的一部分,以控制或杀死恶性细胞。电离辐射通常以精确的调整剂量并由直线加速器递送,以选择性地治疗病变组织。几年前已经报道了基于mr成像执行的剂量计算,其中mr成像被用作计算机断层扫描的补充模式。无论如何,由于mr成像在描绘待照射的解剖结构方面提供卓越的软组织对比度和高的精确度(与计算机断层扫描相比),因此基于以mr成像作为唯一的模态来执行放射治疗规划的所有步骤的概念(所谓的仅-mr成像放射治疗)变得越来越重要。
7.在仅-mr放射治疗规划中,在几何上校正的mr成像是非常重要的,因为目标肿瘤和
风险中的器官是基于mr图像来描绘的,并且基于这些描绘来执行针对治疗的剂量规划和患者定位。人们对使用仅-mr变体来消除冗余ct扫描有强烈的兴趣,并且更重要的是避免已被证明是在几毫米量级上的ct-mr配准期间的几何不确定性。mr图像的几何精度受到各种类型失真的限制。系统水平上的失真源于所使用的mr设备固有的梯度非线性和b0场不均匀性。在基于每-系统参考数据的图像重建期间,这两种效果都得到了很大程度的校正。然而,脂肪的化学位移和磁化率效应会引起失真,这取决于患者的解剖结构,因此通常需要额外的数据采集来执行校正。磁化率的空间变化,在具有大磁化率差异的界面(例如空气/组织或骨骼/金属)处最为明显,使人体头部的b0场不均匀性高达约4ppm,这可能使大脑中的静脉窦/组织界面处的扭曲高达4mm。由于磁化率的变化引起的化学位移和患者特异性失真通常通过以高读出带宽进行扫描来解决。此外,使用多次采集梯度回波(gre)序列的精确b0映射越来越多地用于量化和校正与b0场不均匀性相关的此类失真。多次采集梯度回波序列包括多个射频(rf)激励脉冲。在每个rf激励脉冲之后采集一个或多个梯度回波,同时在各个rf激励之后,在不同的回波时间上采集一个或多个梯度回波。多次采集梯度回波序列的一个非常实际的范例是二次采集梯度回波序列。这种二次采集梯度回波序列包括在各个rf激励脉冲之后的两次连续梯度回波采集,并且各次采集的梯度回波具有不同的回波时间。在这种成像序列中,在两个不同的回波时间上采集梯度-召回(gradient-recalled)回波信号数据,并从在两个不同的回波时间上的信号相位差异中导出b0图。信号相位与局部场强度成正比。然而,这种序列需要额外的扫描时间和图像处理步骤(例如相位展开)来应用校正。
8.最近,已经提出了一种用于评估仅-mr放射治疗规划中的图像失真的新颖的快速的方法,所述方法使用源自多点dixon(mdixon)成像的b0图(参见weiss等人的“a novel and rapid approach to estimate patient-specific distortions based on mdixon mri”(phys.med.biol.2019,64(15):155002))。使用mdixon成像是有利的,因为它通常为了在仅-mr放射治疗规划工作流程中生成合成ct图像的目的而执行(参见berker等人的“mri-based attenuation correction for hybrid pet/mri systems:a 4-class tissue segmentation technique using a combined ultrashort-echo-time/dixon mri sequence”(j.nucl.med.2012,53:796-804);tyagi等人的“dosimetric and workflow evaluation of first commercial synthetic ct software for clinical use in pelvis”(phys.med.biol.2017,62(8):2961-2975))。mdixon mr成像数据的这种二次使用还导致固有地同时采集b0图和放射治疗规划数据,这最小化由于患者运动而引起的错位风险。至于失真校正,mdixon方法允许仅使用基于mdixon的b0图来校正大部分患者特异性的失真。由于这种场图是在mdixon重建中估计的,目的是根据ct模拟的要求进行水/脂肪分离,因此相应的校正节省了专用的场映射步骤的完整扫描时间,通常为2-4分钟,并且因此节省了比mdixon扫描本身的扫描时间更多的时间。
9.然而,事实证明,当使用基于mdixon的b0映射方法时,扫描时间的减少是以b0图的保真度降低为代价的(参见如上引用的weiss等人的文章)。尽管一方面从mdixon成像导出的失真与从专用的b0映射导出的失真之间的差异总体上远小于通过纯b0映射估计的总失真,但在两种方法之间观察到的几乎所有大于50%的差异都是非常局部地出现在具有大的b0空间变化的区域。如果失真估计中的这些局部误差出现在要通过放射治疗治疗的位置,则它们变得非常重要。肿瘤可能不会按规划接受全部剂量,或者风险器官可能会接受比规
划更高的剂量。
技术实现要素:
10.从前述内容可以容易地理解,需要一种改进的mr成像技术。因此,本发明的目的是提供一种能够以最少的扫描时间实现在几何上校正的仅-mr放射治疗规划的方法。
11.根据本发明,公开了一种对位于mr设备的检查体积中的患者的身体进行mr成像的方法。方法包括以下步骤:
[0012]-采集表示身体的至少一个区域的第一mr成像数据;
[0013]-分析所述第一mr成像数据,以描绘所述身体区域内的至少一个解剖结构;
[0014]-使用多点dixon序列来采集所述身体区域的第二mr成像数据;
[0015]-从所述第二mr成像数据导出b0图;
[0016]-分析所述b0图,以确定所述b0图的至少一个低保真区域;
[0017]-执行b0映射,以使用限制到所述描绘出的解剖结构和所述低保真区域完全或部分重叠的至少一个区域的多次采集梯度回波序列来细化b0图;并且
[0018]-使用细化后的b0图来校正所述第一和/或第二mr成像数据中的几何失真。
[0019]
本发明提出,例如使用t
2-加权的mr成像序列来采集所述第一mr成像数据,所述t
2-加权的mr成像序列为描绘诸如肿瘤或风险器官的解剖结构提供合适的对比度。使用多点dixon方法来采集所述第二mr成像数据。这种mdixon数据用于在仅-mr放射治疗规划工作流程中生成合成ct图像的目的。由于第一和第二mr成像数据是在相同的参考帧中通过相同的模态采集的,所以解剖结构的描绘能够被转移到第二mr成像数据(以及得到的合成ct图像),而不损失几何精度。
[0020]
根据已知的mdixon技术,利用脂肪质子与水质子之间的谱差异来分离从含水组织发出的mr信号和从脂肪组织发出的mr信号。在mdixon中,k-空间的多次采集以不同的回波时间重复。最简单的mdixon技术,2-点dixon,采集两个完整的k-空间数据集,其中,第二次采集中的脂肪磁化在各自的回波时间处相对于第一次采集是异相的。通过对复杂的mr信号数据集进行简单的加法或减法来获得分开且不同的水和脂肪图像。总体上,通过mdixon技术能够获得b0图、水图和脂肪图。具体的优点是,使用mdixon的b0映射是非常快的,并且除了b0图之外,还(以水图和脂肪图的形式)提供有关视野内的水分布和脂肪分布的有用信息。根据本发明,利用b0图来确定和校正由b0的空间分布引起的几何图像失真。
[0021]
本发明方法的基本步骤是分析mdixon b0图以确定一个或多个低保真区域的步骤。如以上所指出的,mdixon b0图仅在非常有限的区域内缺乏保真度,从而b0图的精度在广泛的区域中完全足以以足够的精度校正失真。因此,提出自动识别在基于mdixon的b0映射和相关失真估计中的误差很大的那些区域,从而折衷剂量规划。提出使用限制到所述描绘的解剖结构和所述低保真区域重叠的至少一个区域的梯度回波序列来自动执行专用b0映射来细化b0图。以这种方式,通过仅在与放射治疗规划相关的那些区域中,即在能够假设mdixon b0精度不足的那些区域中,但仅在与要接受放射治疗处置的区域重叠的这些低保真区域,即在被所描绘的解剖结构覆盖的区域中,(使用多次-采集梯度回波序列,具体地使用二次采集梯度回波序列)采集常规b0图,将扫描时间消耗b0映射限制到所要求的最小值。
[0022]
在各个重叠区域中以这种方式细化的b0图最终用于校正第一和/或第二mr成像数
据,从而在最短扫描时间实现高水平的几何精度。
[0023]
在优选实施例中,b0图在b0梯度的幅度和与b0相关联的几何失真的幅度均高于各自的预定阈值的位置处被确定为低保真度。以这种方式,只有那些区域将受到经细化的b0映射,这可能会导致剂量规划中的大误差。这些区域的特征在于大的几何失真(即高b0偏差)以及同时b0的高空间梯度(即b0的强烈空间变化)。能够由用户选择各个阈值,以实现扫描时间与几何上校正性之间的最佳折衷。
[0024]
降低的b
0-图的保真度与采用灵活回波间距的单点或两点mdixon成像显著相关(即,并非用于磁共振信号的水和脂肪分量的同相和异相)。因此,在本发明的方法的另一实施方式中,将这种单点mdixon或两点mdixon序列与至少三点mdixon序列相组合,以细化b0图,其中,所述描绘出的解剖结构和所述低保真度区域完全或部分重叠。
[0025]
在另一个优选实施例中,通过将hounsfield单位值分配给第二mr成像数据的每个像素或体素,从校正后的第一和/或第二mr成像数据计算模拟ct图像。对于在生成放射治疗计划中的实际剂量计算,需要模拟ct图像,因为具有分配给每个图像位置的hounsfield单位值的ct图像提供所需的成像组织的辐射衰减特性。已知提供水/脂肪分离的mdixon成像对于在仅-mr放射治疗规划工作流程中生成合成ct图像的目的是有效的(参见上面引用的参考资料)。还可以基于第一mr成像数据、任何进一步可用的mr成像数据或这些数据的任何组合来计算模拟ct图像。相同区域的任何附加mr对比度信息都能够用于确定针对每个图像位置的hounsfield单位。
[0026]
在本发明的可能的实施例中,分析第一mr成像数据的步骤涉及手动或自动分割相关解剖结构(例如,肿瘤或风险器官)。当使用自动分割时,本发明的方法能够以全自动方式执行。
[0027]
在又一个优选实施例中,所描绘的解剖结构与所确定的b0图的低保真区域的叠加被显示给用户。这会通知用户剂量规划中的潜在误差。用户可以通过调整剂量计划来做出反应。这具体地在低保真区域(部分)与所描绘的肿瘤或风险器官相交的区域中可以是可取的。
[0028]
如此描述的本发明的方法能够通过mr设备来执行,所述mr设备包括:至少一个主磁线圈,其用于在检查体积内生成均匀稳定的磁场b0;多个梯度线圈,其用于生成在检查体积内的不同空间方向上的切换的磁场梯度;至少一个rf线圈,其用于在检查体积内生成rf脉冲;一个或多个接收线圈,其用于从位于检查体积内的对象接收mr信号;控制单元,其用于控制rf脉冲和切换的磁场梯度的时间连续;以及,重建单元。本发明的方法通过mr设备的重建单元和/或控制单元的相应编程来实施。
[0029]
本发明的方法能够有利地在目前临床使用的大多数mr设备中实施。为此,仅需要利用在计算机上运行的计算机程序,通过所述计算机程序控制mr设备,使得其执行本发明的上述方法步骤。计算机程序可以存在于数据载体上或存在于数据网络中,以便被下载以安装在mr设备的控制单元中。
附图说明
[0030]
附图公开了本发明的优选实施例。但是应当理解,附图仅是为了说明的目的而设计的,而不是作为对本发明的限制的定义。在附图中:
[0031]
图1示出了用于执行本发明方法的mr设备;
[0032]
图2以流程图示意性示出了本发明的方法;
[0033]
图3以流程图示意性示出了分析b0图以确定低保真区域的过程;
[0034]
图4示出了说明本发明方法的背景的mr图像数据。
具体实施方式
[0035]
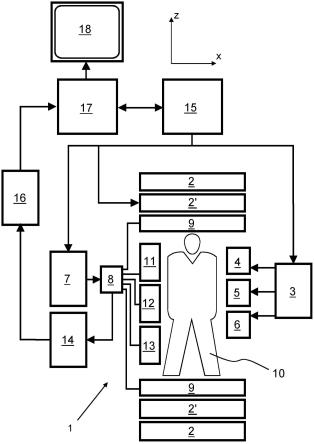
参考图1,示出了mr设备1。所述设备包括超导或电阻主磁体线圈2,从而沿z轴通过检查体积创建基本上均匀的、时间上恒定的主磁场b0。所述设备还包括一组匀场线圈2’,其中,流过组2’的各个匀场线圈的电流是可控的,以用于使检查体积内的b0偏差最小化。
[0036]
磁共振生成和操纵系统应用一系列rf脉冲和切换的磁场梯度来反转或激发核磁自旋、诱发磁共振、重新聚焦磁共振、操纵磁共振、在空间上或以其他方式对磁共振进行编码、使自旋饱和、等等,以执行mr成像。
[0037]
更具体地,梯度脉冲放大器3沿检查体积的x、y和z轴将电流脉冲施加到选定的一些全身梯度线圈4、5和6。数字rf频率发射器7经由发射/接收开关8将rf脉冲或脉冲包发射到身体rf线圈9,以将rf脉冲发射到检查体积中。典型的mr成像序列由彼此结合在一起的短持续时间的rf脉冲片段包组成,并且,任何已施加的磁场梯度都实现了对核磁共振的选定操纵。rf脉冲用于饱和、激发共振、反转磁化、重新聚焦共振或操纵磁共振和选择位于检查体积中的身体10的一部分。mr信号也由身体rf线圈9拾取。
[0038]
为了生成身体10的有限区域的mr图像,一组局部阵列rf线圈11、12、13与被选择用于成像的区域相邻放置。阵列线圈11、12、13能够用作接收线圈,以接收由身体-线圈rf传输诱发的mr信号。
[0039]
产生的mr信号由身体rf线圈9和/或阵列rf线圈11、12和13拾取,并由优选地包括前置放大器(未示出)的接收器14解调。接收器14经由发送/接收开关8连接到rf线圈9、11、12和13。
[0040]
主计算机15控制匀场线圈2’以及梯度脉冲放大器3和发射器7,以生成多个mr成像序列中的任何一个,例如回波平面成像(epi)。对于所选序列,接收器14在每个rf激励脉冲之后快速连续地接收单个或多个mr数据线。数据采集系统16执行所接收信号的模数转换,并将每条mr数据线转换成适合于进一步处理的数字格式。在现代mr设备中,数据采集系统16是专门用于采集原始图像数据的独立计算机。
[0041]
最终,数字原始图像数据由重建处理器17重建为图像表示,所述重建处理器17应用傅里叶变换或其他适当的重建算法,例如sense。mr图像可以表示穿过患者的平面切片、平行平面切片的阵列、三维体积等。图像随后被存储在图像存储器中,可以例如经由提供所得到mr图像的人类可读显示的视频监视器18访问所述图像存储器,以将图像表示的切片、投影或其他部分转换为用于可视化的适当的格式。
[0042]
本发明的方法的实施例参考图2-4并进一步参考图1描述如下:
[0043]
在将身体10定位在主磁体线圈2的检查体积中之后,在步骤21中例如使用t2加权的扫描开始第一次mr成像扫描,以采集第一mr成像数据。第一mr成像数据表示身体10的解剖体的区域。
[0044]
在步骤22中,手动地(例如,由放射科医师交互分析显示在视频监视器18上的第一
mr成像数据)或者通过本领域本身已知的合适的自动分割技术来执行对至少一个解剖结构(例如,要治疗的肿瘤或在放射治疗中应防止被照射的风险器官)的描绘。描绘的结果可以是仅覆盖所描绘的解剖结构的边界的图(以下称为trb图)。边界的宽度可以是根据肿瘤或风险器官的类型的预设参数。
[0045]
在步骤23中,采集覆盖身体10的解剖体的相同区域的第二mr成像数据。为此目的采用多点dixon技术。步骤23包括从所采集的mdixon数据中导出脂肪图、水图和b0图。
[0046]
在步骤24中,分析所导出的b0图,以确定一个或多个低保真区域。这涉及图3中描绘的步骤。在步骤33中,为每个图像位置计算b0图的空间梯度的幅度。在步骤34中生成覆盖幅度大于预定阈值的所有区域(即指示所有图像位置)的图g。在步骤35中,计算覆盖在各个图像位置处由b0图产生的几何失真大于其他预定的阈值的所有区域的图d。局部几何失真的度量可以是例如由相应的局部b0值引起的像素/体素偏移的幅度。最后,在步骤36中,计算图e=g∩d,它覆盖了由图g和d覆盖的所有区域。e标记图像位置,在所述图像位置处,能够预期b0图的低保真度。e仅涵盖在其中已知mdixon b0图容易出错的那些区域。能够预期的是,在这些低保真区域中仅基于mdixon b0图的几何校正将导致针对放射治疗处置的剂量规划中的显著错误,因为几何失真本身及其空间变化很大。
[0047]
在步骤25中,在视频监视器18上显示低保真图e与在步骤22中描绘解剖结构的结果的叠加。这通知了用户关于剂量规划中的潜在错误。用户可以通过调整剂量规划来做出反应,这在图e与图trb重合的区域中可以是可取的。
[0048]
在步骤26中,计算图r=e∩trb,其指示所描绘的解剖结构和b0图的低保真区域(完全或部分)重叠的图像区域,即,肿瘤或风险器官边界处的b0图的易出错区域。
[0049]
在步骤27中确定覆盖图r的视场。视场可以被细分为几个不同的区域。在步骤28中,对所确定的视场执行使用多次-采集梯度回波成像序列的自动专用b0映射扫描。b0映射扫描可以由几次子扫描组成,每次子扫描都针对视场的不同区域。
[0050]
然后在步骤29中,通过将mdixon b0图的b0值替换为从这些区域中的专用b0映射扫描获得的对应值,在由图r指示的区域中相应地更新mdixon b0图。结果是细化的,即更高保真度的b0图。
[0051]
在步骤30中,然后使用经细化的b0图来校正第一和第二mr成像数据中的几何失真。
[0052]
在步骤31中,根据失真-校正过的第二mr成像数据来计算模拟ct图像。这涉及将hounsfield单位值分配给第二mr成像数据的每个像素或体素。
[0053]
在步骤32中,用户/放射科医师使用模拟ct图像以及经几何校正的第一mr成像数据来执行针对放射治疗的剂量规划。如果在步骤22中使用自动分割来描绘肿瘤和风险器官,则所有步骤21-31都能够完全自动执行。具体地,能够在mdixon扫描后立即直接更新b0图的自动采集。这意味着患者不必停留在mr设备1的检查体积中。因此能够最大化患者吞吐量。
[0054]
还必须要注意的是,在典型情况下,映射r中将只包含非常少的区域或甚至根本不包含区域。这意味着专用b0映射扫描所需的额外采集时间或者为零,或者至少非常小。因此,如果与用于全视场的传统b0映射相比,本发明提出的方法结合了失真校正的高精度和非常短的采集时间。
[0055]
图4示出了头/颈区域的mr图像数据的矢状切片的范例。两个顶部图像(图4a和4b)的图像值指示局部几何图像失真(b
0-诱发的体素偏移的幅度)。顶部图像(图4a)示出了从mdixon b0图导出的几何失真。下方图像(图4b)示出了从传统专用b0映射导出的几何失真。图4c的第三图像示出了图4a和图4b的两个图像的差异。图4d的图像是示出为解剖参考的mdixon同相图像。能够看出,在具有低空间变化的区域(例如,由白色圆圈42指示的区域)中,mdixon很好地估计了几何失真。超过50%的差异出现在b0的具有高空间变化区域中(圆圈41)。如能够在图4中看到的,保真度低的mdixon b0图主要围绕鼻腔、口腔和耳腔、蝶窦和牙齿填充物。如果要通过放射治疗处置的肿瘤或要防止被照射的风险器官在这些区域之一内,如果几何校正仅基于mdixon b0图,则存在严重的未配准和错误的剂量计算的风险。为此,本发明提出仅在相关区域中以有针对性的方式细化mdixon b0图。
再多了解一些
本文用于创业者技术爱好者查询,仅供学习研究,如用于商业用途,请联系技术所有人。