使用离子液体的托法替尼表面递送
发明背景
1.托法替尼是一种janus激酶(jak)抑制剂,有时口服施用以治疗类风湿性关节炎、牛皮癣性关节炎和溃疡性结肠炎。
技术实现要素:
2.本公开的一个方面针对一种将托法替尼递送至皮肤或通过皮肤递送的方法。本公开的另一方面针对一种局部抑制表皮层、真皮层、皮下组织层或肌肉组织内jak-1、jak-2、tyk-2和jak-3中的至少一者的活性的方法。本公开的另一方面针对一种表面组合物,所述表面组合物包含托法替尼或其药学上可接受的盐和离子液体,所述离子液体的量足以使治疗有效量的托法替尼到达皮肤内或皮肤以外的目标深度。
3.在某些实施方案中,本文公开一种将托法替尼递送至皮肤或通过皮肤递送的方法,所述方法包括向皮肤施用药物组合物,所述药物组合物包含托法替尼或其药学上可接受的盐和离子液体,所述离子液体的量足以使治疗有效量的托法替尼到达皮肤内或皮肤以外的目标深度,其中所述离子液体包含胆碱阳离子和脂肪酸阴离子。
4.在某些实施方案中,本文公开一种局部抑制表皮层、真皮层、皮下组织层或肌肉组织内jak-1、jak-2、tyk-2和jak-3中的至少一者的活性的方法,所述方法包括向皮肤施用药物组合物,所述药物组合物包含托法替尼或其药学上可接受的盐和离子液体,所述离子液体的量足以使治疗有效量的托法替尼到达皮肤内或皮肤以外的目标深度,其中所述离子液体包含胆碱阳离子和脂肪酸阴离子。
5.在某些实施方案中,本文公开一种表面组合物,所述表面组合物包含托法替尼或其药学上可接受的盐和离子液体,所述离子液体的量足以使治疗有效量的托法替尼到达皮肤内或皮肤以外的目标深度,其中所述离子液体包含胆碱阳离子和脂肪酸阴离子。
附图说明
6.本公开的新颖特征在所附权利要求书中特别地加以阐述。参考以下阐述说明性实施方案的具体实施方式将获得对本公开的特征和优点的更好理解,其中使用本公开的原理,并且其中附图为:
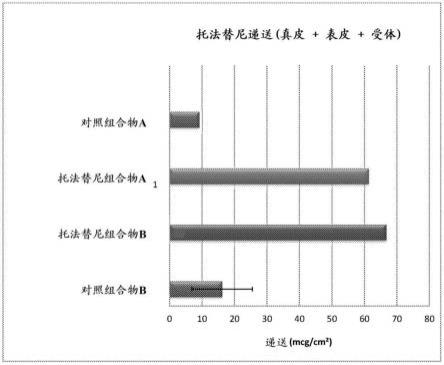
7.图1示出与通过用相同量的2-(2-乙氧基乙氧基)乙醇代替离子液体的第一对照组合物,和呈含有2%油醇的基于peg的软膏形式的包含托法替尼的第二对照组合物相比,根据本公开的一些实施方案的两种包含托法替尼和离子液体的非限制性表面组合物的递送。
具体实施方式
8.在某些实施方案中,本文公开一种表面组合物,所述表面组合物包含托法替尼或其药学上可接受的盐和离子液体,所述离子液体的量足以使治疗有效量的托法替尼到达皮肤内或皮肤以外的目标深度,其中所述离子液体包含胆碱阳离子和脂肪酸阴离子。托法替尼
9.3-((3r,4r)-4-甲基-3-[甲基-(7h-吡咯并[2,3-d]嘧啶-4-基)-氨基]-哌啶-1-基)-3-氧代丙腈(即,托法替尼)具有以下结构式3-((3r,4r)-4-甲基-3-[甲基-(7h-吡咯并[2,3-d]-嘧啶-4-基)-氨基]-哌啶-1-基)-3-氧代丙腈的合成描述于wo 2001/42246和wo 2002/096909中,所述专利共同转让给本发明的受让人并且以全文引用的方式并入本文中。3-((3r,4r)-4-甲基-3-[甲基-(7h-吡咯并[2,3-d]-嘧啶-4-基)-氨基]-哌啶-1-基)-3-氧代丙腈单柠檬酸盐的制备描述于us 6,965,027中。
[0010]
托法替尼和其药学上可接受的盐(诸如单柠檬酸盐)也可用作诸如酶janus激酶(jak)的蛋白激酶的抑制剂。因而,托法替尼和其药学上可接受的盐(诸如单柠檬酸盐)有时是作为免疫抑制剂口服施用的疗法,用于器官移植、异种移植、狼疮、多发性硬化、类风湿性关节炎、牛皮癣、i型糖尿病和糖尿病并发症、癌症、哮喘、特应性皮炎、自身免疫性甲状腺病症、溃疡性结肠炎、克罗恩病、阿尔茨海默病、白血病和其他将需要免疫抑制的适应症。本公开涉及将托法替尼经表面施用于皮肤中或通过皮肤施用,这提出了独特的挑战,尤其是当潜在的疾病或疾患需要将治疗有效量的托法替尼以不同的目标深度递送至皮肤中或通过皮肤递送时。离子液体
[0011]
在某些实施方案中,本文描述包含离子液体的组合物,所述离子液体包含胆碱阳离子和脂肪酸阴离子。在一些实施方案中,所述组合物还包含药学上可接受的溶剂。在一些实施方案中,所述脂肪酸是肉豆蔻烯酸、棕榈油酸、十六碳烯酸、油酸、反油酸、香叶酸、异油酸、亚油酸、反亚油酸、α-亚麻酸、花生四烯酸、二十碳五烯酸、芥酸、二十二碳六烯酸、丙酸、丁酸、戊酸、己酸、庚酸、辛酸、壬酸、癸酸、十一烷酸、月桂酸、十三烷酸、肉豆蔻酸、十五烷酸、棕榈酸、十七烷酸、硬脂酸、十九烷酸、花生酸、二十一烷酸、山嵛酸、二十三烷酸、二十四烷酸、二十五烷酸、蜡酸、二十七烷酸、褐煤酸、二十九烷酸、蜂花酸、三十一烷酸、紫胶蜡酸、三十三烷酸、三十四烷酸、蜡塑酸(ceroplastic acid)或三十六烷酸。在一些实施方案中,所述脂肪酸是香叶酸。在一些实施方案中,所述脂肪酸包含9至14个碳。在一些实施方案中,所述离子液体在室温下是液体。在一些实施方案中,所述离子液体在低于100℃时是液体。
[0012]
在一些实施方案中,所述离子液体是低共熔溶剂(des)。在一些实施方案中,des包含过量的羧酸盐,它排除1:1离子配对。在一些实施方案中,des还包含氢键供体。在一些实施方案中,所述氢键供体是尿素或柠檬酸。在一些实施方案中,通过改变氢键供体来调节des的溶剂特性。在一些实施方案中,des的铵盐与氢键供体相互作用。在一些实施方案中,所述des具有低于任一个别组分(例如脂肪酸和胆碱)的熔点。
[0013]
在一些实施方案中,所述离子液体包含1:0.5至1:10的胆碱阳离子:脂肪酸阴离子的摩尔比。在一些实施方案中,胆碱阳离子:脂肪酸阴离子的摩尔比为约1:0.5、1:0.6、1:0.7、1:0.8、1:0.9、1:1.0;1:1.1、1:1.2、1:1.3、1:1.4、1:1.5、1:1.6、1:1.7、1:1.8、1:1.9、
1:2.0、1:2.1、1:2.2、1:2.3、1:2.4、1:2.5、1:2.6、1:2.7、1:2.8、1:2.9、1:3.0、1:3.1、1:3.2、1:3.3、1:3.4、1:3.5、1:3.6、1:3.7、1:3.8、1:3.9、1:4.0、1:4.1、1:4.2、1:4.3、1:4.4、1:4.5、1:4.6、1:4.7、1:4.8、1:4.9.1:5.0、1:5.1、1:5.2、1:5.3、1:5.4、1:5.5、1:5.6、1:5.7、1:5.8、1:5.9、1:6.0、1:6.1、1:6.2、1:6.3、1:6.4、1:6.5、1:6.6、1:6.7、1:6.8、1:6.9、1:7.0、1:7.1、1:7.2、1:7.3、1:7.4、1:7.5、1:7.6、1:7.7、1:7.8、1:7.9、1:8.0、1:8.1、1:8.2、1:8.3、1:8.4、1:8.5、1:8.6、1:8.7、1:8.8、1:8.9、1:9.0、1:9.1、1:9.2、1:9.3、1:9.4、1:9.5、1:9.6、1:9.7、1:9.8、1:9.9或约1:10。在一些实施方案中,胆碱阳离子:脂肪酸阴离子的摩尔比为约1:1.1、1:1.2、1:1.3、1:1.4、1:1.5、1:1.6、1:1.7、1:1.8、1:1.9或1:2.0。
[0014]
在一些实施方案中,胆碱阳离子和脂肪酸阴离子在离子液体中呈某一摩尔比。在一些实施方案中,胆碱阳离子和脂肪酸阴离子是呈1:1摩尔比。在一些实施方案中,本文中使用术语组合物b来指组合物或离子液体,其包含1:1摩尔比的胆碱阳离子与香叶酸阴离子。在一些实施方案中,组合物b不包含水。
[0015]
在其他实施方案中,胆碱阳离子和脂肪酸阴离子是呈1:2摩尔比。在一些实施方案中,本文中使用术语组合物a来指组合物或离子液体,其包含1:2摩尔比的胆碱阳离子与香叶酸阴离子。在一些实施方案中,组合物a不包含水。
[0016]
在一些实施方案中,胆碱的化学结构是:其中x-是药学上可接受的阴离子。
[0017]
在一些实施方案中,术语胆碱是指含有n,n,n-三甲基乙醇铵阳离子的季铵盐类。在一些实施方案中,在胆碱结构右侧的x-表示药学上可接受的阴离子。在一些实施方案中,x-是碳酸氢根、碳酸根、乙酸根、柠檬酸根、酒石酸根、酒石酸氢根、乳酸根、氯化物、溴化物或碘化物。在一些实施方案中,x-是碳酸氢根。在一些实施方案中,胆碱是消炎剂。
[0018]
在一些实施方案中,胆碱是呈药学上可接受的盐形式。药学上可接受的盐的类型包括但不限于酸加成盐,所述酸加成盐通过使所述化合物的游离碱形式与药学上可接受的以下各物反应而形成:无机酸,诸如盐酸、氢溴酸、硫酸、硝酸、磷酸、偏磷酸等;或有机酸,诸如乙酸、丙酸、己酸、环戊基丙酸、乙醇酸、丙酮酸、乳酸、丙二酸、琥珀酸、苹果酸、马来酸、富马酸、三氟乙酸、酒石酸、柠檬酸、苯甲酸、3-(4-羟基苯甲酰基)苯甲酸、肉桂酸、扁桃酸、甲烷磺酸、乙烷磺酸、1,2-乙烷二磺酸、2-羟基乙烷磺酸、苯磺酸、甲苯磺酸、2-萘磺酸、4-甲基双环-[2.2.2]辛-2-烯-1-甲酸、葡庚糖酸、4,4
’‑
亚甲基双-(3-羟基-2-烯-1-甲酸)、3-苯基丙酸、三甲基乙酸、叔丁基乙酸、月桂基硫酸、葡糖酸、谷氨酸、羟基萘甲酸、水杨酸、硬脂酸、己二烯二酸等。
[0019]
在一些实施方案中,香叶酸或3,7-二甲基-2,6-辛二烯酸的化学结构是:
[0020]
在一些实施方案中,香叶酸是呈药学上可接受的盐形式。药学上可接受的盐的类型包括但不限于当存在于母体化合物中的酸性质子被金属离子,例如碱金属离子(例如锂、
钠、钾)、碱土离子(例如镁或钙)或铝离子置换时;或与有机碱配位时形成的盐。可接受的有机碱的实例包括但不限于乙醇胺、二乙醇胺、三乙醇胺、缓血酸胺和n-甲基葡糖胺。可接受的无机碱的实例包括但不限于氢氧化铝、氢氧化钙、氢氧化钾、碳酸钠和氢氧化钠。
[0021]
在一些实施方案中,使用任何合适的标准合成反应来合成胆碱和脂肪酸。在一些实施方案中,以线性顺序使用所述反应来提供所述化合物,或者所述反应可以用于合成随后通过任何合适方法接合的片段。在一些实施方案中,用于合成胆碱或脂肪酸的起始材料是合成的或获自商业来源。在一些实施方案中,通过在-70℃下从70wt%香叶酸/30wt%丙酮的溶液中重复(5-7x)再结晶,从市售工业级(sigma-aldrich,st.louis,mo.)中纯化香叶酸。在一些实施方案中,通过1h nmr光谱法和电导率测量来评估香叶酸的纯度。在一些实施方案中,术语香叶酸是指香叶酸或其盐。在一些实施方案中,香叶酸是抗微生物剂。托法替尼表面组合物
[0022]
在一些实施方案中,组合物中的每种组分均以所述组合物的百分比(%)描述,诸如托法替尼、离子液体、药学上可接受的载体和任选的其他组分。在一些实施方案中,所述组合物的%是百分比浓度体积/体积(v/v)或百分比浓度重量/体积(w/v)。
[0023]
在某些实施方案中,本文公开一种表面组合物,所述表面组合物包含托法替尼或其药学上可接受的盐和离子液体,所述离子液体的量足以使治疗有效量的托法替尼到达皮肤内或皮肤以外的目标深度,其中所述离子液体包含胆碱阳离子和脂肪酸阴离子。
[0024]
在一些实施方案中,所述药物组合物包含约0.01%至约10%的托法替尼或其药学上可接受的盐。在一些实施方案中,所述药物组合物包含约0.1%至约8%的托法替尼或其药学上可接受的盐。在一些实施方案中,表面软膏包含约0.1%至约5%的托法替尼或其药学上可接受的盐。在一些实施方案中,目标深度为约0.05mm至约20mm。在一些实施方案中,目标深度为约0.1mm至约15mm。在一些实施方案中,目标深度为约1mm至约10mm
[0025]
在一些实施方案中,所述药物组合物允许治疗有效量的托法替尼至少到达表皮层。在一些实施方案中,所述药物组合物允许治疗有效量的托法替尼至少到达真皮层。
[0026]
在一些实施方案中,所述药物组合物允许治疗有效量的托法替尼至少到达皮下组织层。在一些实施方案中,所述药物组合物允许治疗有效量的托法替尼至少到达肌肉组织。
[0027]
在一些实施方案中,所述脂肪酸是选自由以下组成的组:肉豆蔻烯酸、棕榈油酸、十六碳烯酸、油酸、反油酸、香叶酸、异油酸、亚油酸、反亚油酸、α-亚麻酸、花生四烯酸、二十碳五烯酸、芥酸、二十二碳六烯酸、丙酸、丁酸、戊酸、己酸、丙二酸、庚酸、辛酸、壬酸、癸酸、十一烷酸、月桂酸、十三烷酸、肉豆蔻酸、十五烷酸、棕榈酸、十七烷酸、硬脂酸、十九烷酸、花生酸、二十一烷酸、山嵛酸、二十三烷酸、二十四烷酸、二十五烷酸、蜡酸、二十七烷酸、褐煤酸、二十九烷酸、蜂花酸、三十一烷酸、紫胶蜡酸、三十三烷酸、三十四烷酸、蜡塑酸或三十六烷酸。在一些实施方案中,所述脂肪酸是选自由以下组成的组:油酸、香叶酸、己酸和丙二酸。在一些实施方案中,所述脂肪酸是香叶酸。
[0028]
在一些实施方案中,所述离子液体是低共熔溶剂(des)。在一些实施方案中,所述离子液体包含胆碱阳离子和脂肪酸阴离子,其摩尔比在1:1至1:4的胆碱阳离子:脂肪酸阴离子范围内。在一些实施方案中,所述离子液体包含胆碱阳离子和脂肪酸阴离子,其摩尔比为1:2的胆碱阳离子:脂肪酸阴离子。
[0029]
在一些实施方案中,所述药物组合物基本上由托法替尼和所述离子液体组成。在
一些实施方案中,所述药物组合物还包含药学上可接受的载体。在一些实施方案中,所述药学上可接受的载体是水性载体。在一些实施方案中,所述药学上可接受的载体包含软膏基质。
[0030]
在一些实施方案中,所述离子液体以约1%至约99%的浓度存在于药物组合物中。在一些实施方案中,所述离子液体以约5%至约90%的浓度存在于药物组合物中。在一些实施方案中,所述离子液体以约10%至约80%的浓度存在于药物组合物中。在一些实施方案中,所述离子液体以约15%至约70%的浓度存在于药物组合物中。在一些实施方案中,所述离子液体以约20%至约60%的浓度存在于药物组合物中。在一些实施方案中,所述离子液体以约30%至约50%的浓度存在于药物组合物中。在一些实施方案中,所述离子液体以约35%至约45%的浓度存在于药物组合物中。在一些实施方案中,所述离子液体以约40%的浓度存在于药物组合物中。
[0031]
在一些实施方案中,所述药物组合物还包含渗透增强剂。在一些实施方案中,所述渗透增强剂是2-(2-乙氧基乙氧基)乙醇或油醇。在一些实施方案中,所述渗透增强剂是2-(2-乙氧基乙氧基)乙醇。在一些实施方案中,所述药物组合物包含约1%至约20%的2-(2-乙氧基乙氧基)乙醇。在一些实施方案中,所述药物组合物包含约5%至约15%的2-(2-乙氧基乙氧基)乙醇。在一些实施方案中,所述药物组合物包含约10%的2-(2-乙氧基乙氧基)乙醇。
[0032]
在一些实施方案中,所述药物组合物基本上不含2-(2-乙氧基乙氧基)乙醇。在一些实施方案中,所述药物组合物基本上不含油醇。
[0033]
在一些实施方案中,所述组合物包含约0.1%至99%浓度的所述离子液体。在一些实施方案中,所述组合物包含约1%至40%浓度的所述离子液体。在一些实施方案中,所述组合物包含约1%至20%浓度的所述离子液体。在一些实施方案中,所述组合物包含约5%至20%浓度的所述离子液体。在一些实施方案中,所述组合物包含约5%至40%浓度的所述离子液体。在一些实施方案中,所述组合物包含约20%至40%浓度的所述离子液体。在一些实施方案中,所述组合物包含约20%至60%浓度的所述离子液体。在一些实施方案中,所述组合物包含约20%至80%浓度的所述离子液体。
[0034]
在一些实施方案中,所述组合物包含约0.1%至99%浓度的所述离子液体,和约1%至约99.9%浓度的药学上可接受的溶剂。在一些实施方案中,所述组合物包含约1%至40%浓度的所述离子液体,和约60%至约99%浓度的药学上可接受的溶剂。在一些实施方案中,所述组合物包含约20%至40%浓度的所述离子液体,和约80%至约99%浓度的药学上可接受的溶剂。在一些实施方案中,所述组合物包含约20%浓度的所述离子液体和约80%浓度的药学上可接受的溶剂。在一些实施方案中,所述组合物包含约40%浓度的所述离子液体和约60%浓度的药学上可接受的溶剂。
[0035]
在一些实施方案中,所述组合物包含约1%至50%浓度的所述离子液体,和约50%至99%浓度的药学上可接受的溶剂。在一些实施方案中,所述组合物包含约1%至50%浓度的所述离子液体,和约50%至99%浓度的水。在一些实施方案中,所述水是去离子水或水。
[0036]
在一些实施方案中,所述组合物包含约1%至50%浓度的所述离子液体,约1%至50%浓度的药学上可接受的溶剂,和约1至5%浓度的胶凝剂。在一些实施方案中,所述组合
物包含约1%至50%浓度的所述离子液体,和约1%至50%浓度的水。
[0037]
在一些实施方案中,所述药学上可接受的溶剂是己二酸二异丙酯。在一些实施方案中,所述组合物包含约20%浓度的己二酸二异丙酯。在一些实施方案中,所述组合物包含约1%至40%浓度的所述离子液体,和约60%至约99%浓度的己二酸二异丙酯。
[0038]
在一些实施方案中,所述组合物包含所述组合物的约50%至90%浓度的凝胶基质。在一些实施方案中,所述组合物包含所述组合物的约50%、60%、70%、80%或90%浓度的凝胶基质。
[0039]
在一些实施方案中,制备包含胆碱阳离子和脂肪酸阴离子的离子液体包括:(a)在室温下在溶剂中以预定比率混合胆碱和脂肪酸;和(b)在真空中去除溶剂。在一些实施方案中,所述脂肪酸是香叶酸。在一些实施方案中,所述溶剂是水。在一个特定实施方案中,所述水是去离子水。在一些实施方案中,去除溶剂包括旋转蒸发。在一些实施方案中,去除溶剂包括加热离子液体、对离子液体施加真空或它们的组合。在一些实施方案中,制备离子液体还包括干燥离子液体。在一些实施方案中,加热离子液体包括将离子液体加热至60℃。在一些实施方案中,进行加热持续至少10分钟、20分钟、30分钟、1小时、2小时、3小时、4小时、5小时、6小时、7小时、8小时、9小时、10小时、11小时、12小时、24小时、36小时、48小时或60小时。在一些实施方案中,施加在-100kpa下的真空。在一些实施方案中,施加真空持续至少10分钟、20分钟、30分钟、1小时、2小时、3小时、4小时、5小时、6小时、7小时、8小时、9小时、10小时、11小时、12小时、24小时、36小时、48小时或60小时。
[0040]
在一些实施方案中,离子液体已经去除在离子液体制备过程中使用的溶剂。在一些实施方案中,离子液体不包含水。
[0041]
在一些实施方案中,胆碱是胆碱碳酸氢盐。在一些实施方案中,胆碱是在80%wt胆碱碳酸氢盐溶液中的胆碱。在一些实施方案中,所述预定比率是1:1、1:2、1:3或1:4的胆碱阳离子:脂肪酸阴离子比率。在一个实施方案中,所述比率是摩尔比。在另一实施方案中,所述比率是重量比。
[0042]
在一些实施方案中,分离所述组合物还包括纯化离子液体。在一些实施方案中,纯化离子液体包括使用常规技术,包括但不限于过滤、蒸馏、结晶和色谱法。在一些实施方案中,制备离子液体还包括分离纯化的离子液体托法替尼表面递送
[0043]
在某些实施方案中,本文公开一种将托法替尼递送至皮肤或通过皮肤递送的方法,所述方法包括向皮肤施用药物组合物,所述药物组合物包含托法替尼或其药学上可接受的盐和离子液体,所述离子液体的量足以使治疗有效量的托法替尼到达皮肤内或皮肤以外的目标深度,其中所述离子液体包含胆碱阳离子和脂肪酸阴离子。
[0044]
在一些实施方案中,所述药物组合物包含约0.01%至约10%的托法替尼或其药学上可接受的盐。在一些实施方案中,所述药物组合物包含约0.1%至约8%的托法替尼或其药学上可接受的盐。在一些实施方案中,所述药物组合物包含约0.1%至约5%的托法替尼或其药学上可接受的盐。
[0045]
在一些实施方案中,目标深度为约0.05mm至约20mm。在一些实施方案中,目标深度为约0.1mm至约15mm。在一些实施方案中,目标深度为约1mm至约10mm。
[0046]
在一些实施方案中,所述药物组合物允许治疗有效量的托法替尼至少到达表皮
层。在一些实施方案中,在表皮层的托法替尼的量足以抑制表皮层内jak-1、jak-2、tyk-2和jak-3中的至少一者的活性。
[0047]
在一些实施方案中,所述药物组合物允许治疗有效量的托法替尼至少到达真皮层。在一些实施方案中,在真皮层的托法替尼的量足以抑制真皮层内jak-1、jak-2、tyk-2和jak-3中的至少一者的活性。
[0048]
在一些实施方案中,所述药物组合物允许治疗有效量的托法替尼至少到达皮下组织层。在一些实施方案中,在皮下组织层的托法替尼的量足以抑制皮下组织层内jak-1、jak-2、tyk-2和jak-3中的至少一者的活性。
[0049]
在一些实施方案中,所述药物组合物允许治疗有效量的托法替尼至少到达肌肉组织。在一些实施方案中,在肌肉组织中的托法替尼的量足以抑制肌肉组织内jak-1、jak-2、tyk-2和jak-3中的至少一者的活性。
[0050]
在一些实施方案中,由所述药物组合物提供的至少到达表皮层的托法替尼的总量是由用相同量的2-(2-乙氧基乙氧基)乙醇代替所述离子液体的对照组合物提供的至少到达表皮层的托法替尼的总量的至少1.5倍。在一些实施方案中,由所述药物组合物提供的至少到达表皮层的托法替尼的总量是由用相同量的2-(2-乙氧基乙氧基)乙醇代替所述离子液体的对照组合物提供的至少到达表皮层的托法替尼的总量的至少2倍。在一些实施方案中,由所述药物组合物提供的至少到达表皮层的托法替尼的总量是由用相同量的2-(2-乙氧基乙氧基)乙醇代替所述离子液体的对照组合物提供的至少到达表皮层的托法替尼的总量的至少2.5倍。在一些实施方案中,由所述药物组合物提供的至少到达表皮层的托法替尼的总量是由用相同量的2-(2-乙氧基乙氧基)乙醇代替所述离子液体的对照组合物提供的至少到达表皮层的托法替尼的总量的至少3倍。
[0051]
在一些实施方案中,由所述药物组合物提供的至少到达表皮层的托法替尼的总量是由包含基于peg的软膏和2%油醇的对照组合物提供的至少到达表皮层的托法替尼的总量的至少2倍。在一些实施方案中,由所述药物组合物提供的至少到达表皮层的托法替尼的总量是由包含基于peg的软膏和2%油醇的对照组合物提供的至少到达表皮层的托法替尼的总量的至少3倍。在一些实施方案中,由所述药物组合物提供的至少到达表皮层的托法替尼的总量是由包含基于peg的软膏和2%油醇的对照组合物提供的至少到达表皮层的托法替尼的总量的至少4倍。在一些实施方案中,由所述药物组合物提供的至少到达表皮层的托法替尼的总量是由包含基于peg的软膏和2%油醇的对照组合物提供的至少到达表皮层的托法替尼的总量的至少5倍。
[0052]
在一些实施方案中,所述药物组合物每天施用一次或多次。在一些实施方案中,如与治疗有效剂量的口服托法替尼相比,所述药物组合物提供减少的托法替尼全身暴露。
[0053]
在一些实施方案中,所述脂肪酸是选自由以下组成的组:肉豆蔻烯酸、棕榈油酸、十六碳烯酸、油酸、反油酸、香叶酸、异油酸、亚油酸、反亚油酸、α-亚麻酸、花生四烯酸、二十碳五烯酸、芥酸、二十二碳六烯酸、丙酸、丁酸、戊酸、己酸、丙二酸、庚酸、辛酸、壬酸、癸酸、十一烷酸、月桂酸、十三烷酸、肉豆蔻酸、十五烷酸、棕榈酸、十七烷酸、硬脂酸、十九烷酸、花生酸、二十一烷酸、山嵛酸、二十三烷酸、二十四烷酸、二十五烷酸、蜡酸、二十七烷酸、褐煤酸、二十九烷酸、蜂花酸、三十一烷酸、紫胶蜡酸、三十三烷酸、三十四烷酸、蜡塑酸或三十六烷酸。在一些实施方案中,所述脂肪酸是选自由以下组成的组:油酸、香叶酸、己酸和丙二
酸。在一些实施方案中,所述脂肪酸是香叶酸。
[0054]
在一些实施方案中,所述离子液体是低共熔溶剂(des)。
[0055]
在一些实施方案中,所述离子液体包含胆碱阳离子和脂肪酸阴离子,其摩尔比在1:1至1:4的胆碱阳离子:脂肪酸阴离子范围内。在一些实施方案中,所述离子液体包含胆碱阳离子和脂肪酸阴离子,其摩尔比为1:2的胆碱阳离子:脂肪酸阴离子。
[0056]
在一些实施方案中,所述药物组合物基本上由托法替尼和所述离子液体组成。在一些实施方案中,所述药物组合物还包含药学上可接受的载体。在一些实施方案中,所述药学上可接受的载体是水性载体。在一些实施方案中,所述药学上可接受的载体包含软膏基质。
[0057]
在一些实施方案中,所述离子液体以约1%至约99%的浓度存在于药物组合物中。在一些实施方案中,所述离子液体以约5%至约90%的浓度存在于药物组合物中。在一些实施方案中,所述离子液体以约10%至约80%的浓度存在于药物组合物中。在一些实施方案中,所述离子液体以约15%至约70%的浓度存在于药物组合物中。在一些实施方案中,所述离子液体以约20%至约60%的浓度存在于药物组合物中。在一些实施方案中,所述离子液体以约30%至约50%的浓度存在于药物组合物中。在一些实施方案中,所述离子液体以约35%至约45%的浓度存在于药物组合物中。在一些实施方案中,所述离子液体以约40%的浓度存在于药物组合物中。
[0058]
在一些实施方案中,所述药物组合物还包含渗透增强剂。在一些实施方案中,所述渗透增强剂是2-(2-乙氧基乙氧基)乙醇或油醇。在一些实施方案中,所述渗透增强剂是2-(2-乙氧基乙氧基)乙醇。在一些实施方案中,所述药物组合物包含约1%至约20%的2-(2-乙氧基乙氧基)乙醇。在一些实施方案中,所述药物组合物包含约5%至约15%的2-(2-乙氧基乙氧基)乙醇。在一些实施方案中,所述药物组合物包含约10%的2-(2-乙氧基乙氧基)乙醇。
[0059]
在一些实施方案中,所述药物组合物基本上不含2-(2-乙氧基乙氧基)乙醇。在一些实施方案中,所述药物组合物基本上不含油醇。jak抑制
[0060]
在某些实施方案中,本文公开一种局部抑制表皮层、真皮层、皮下组织层或肌肉组织内jak-1、jak-2、tyk-2和jak-3中的至少一者的活性的方法,所述方法包括向皮肤施用药物组合物,所述药物组合物包含托法替尼或其药学上可接受的盐和离子液体,所述离子液体的量足以使治疗有效量的托法替尼到达皮肤内或皮肤以外的目标深度,其中所述离子液体包含胆碱阳离子和脂肪酸阴离子。
[0061]
在一些实施方案中,所述药物组合物包含约0.01%至约10%的托法替尼或其药学上可接受的盐。在一些实施方案中,所述药物组合物包含约0.1%至约8%的托法替尼或其药学上可接受的盐。在一些实施方案中,表面软膏包含约0.1%至约5%的托法替尼或其药学上可接受的盐。
[0062]
在一些实施方案中,目标深度为约0.05mm至约20mm。在一些实施方案中,目标深度为约0.1mm至约15mm。在一些实施方案中,目标深度为约1mm至约10mm。
[0063]
在一些实施方案中,所述药物组合物允许治疗有效量的托法替尼至少到达表皮层。在一些实施方案中,在表皮层的托法替尼的量足以抑制表皮层内jak-1、jak-2、tyk-2和
jak-3中的至少一者的活性。
[0064]
在一些实施方案中,所述药物组合物允许治疗有效量的托法替尼至少到达真皮层。在一些实施方案中,在真皮层的托法替尼的量足以抑制真皮层内jak-1、jak-2、tyk-2和jak-3中的至少一者的活性。
[0065]
在一些实施方案中,所述药物组合物允许治疗有效量的托法替尼至少到达皮下组织层。在一些实施方案中,在皮下组织层的托法替尼的量足以抑制皮下组织层内jak-1、jak-2、tyk-2和jak-3中的至少一者的活性。
[0066]
在一些实施方案中,所述药物组合物允许治疗有效量的托法替尼至少到达肌肉组织。在一些实施方案中,在肌肉组织中的托法替尼的量足以抑制肌肉组织内jak-1、jak-2、tyk-2和jak-3中的至少一者的活性。
[0067]
在一些实施方案中,由所述药物组合物提供的至少到达表皮层的托法替尼的总量是由用相同量的2-(2-乙氧基乙氧基)乙醇代替所述离子液体的对照组合物提供的至少到达表皮层的托法替尼的总量的至少1.5倍。在一些实施方案中,由所述药物组合物提供的至少到达表皮层的托法替尼的总量是由用相同量的2-(2-乙氧基乙氧基)乙醇代替所述离子液体的对照组合物提供的至少到达表皮层的托法替尼的总量的至少2倍。在一些实施方案中,由所述药物组合物提供的至少到达表皮层的托法替尼的总量是由用相同量的2-(2-乙氧基乙氧基)乙醇代替所述离子液体的对照组合物提供的至少到达表皮层的托法替尼的总量的至少2.5倍。在一些实施方案中,由所述药物组合物提供的至少到达表皮层的托法替尼的总量是由用相同量的2-(2-乙氧基乙氧基)乙醇代替所述离子液体的对照组合物提供的至少到达表皮层的托法替尼的总量的至少3倍。
[0068]
在一些实施方案中,由所述药物组合物提供的至少到达表皮层的托法替尼的总量是由包含基于peg的软膏和2%油醇的对照组合物提供的至少到达表皮层的托法替尼的总量的至少2倍。在一些实施方案中,由所述药物组合物提供的至少到达表皮层的托法替尼的总量是由包含基于peg的软膏和2%油醇的对照组合物提供的至少到达表皮层的托法替尼的总量的至少3倍。在一些实施方案中,由所述药物组合物提供的至少到达表皮层的托法替尼的总量是由包含基于peg的软膏和2%油醇的对照组合物提供的至少到达表皮层的托法替尼的总量的至少4倍。在一些实施方案中,由所述药物组合物提供的至少到达表皮层的托法替尼的总量是由包含基于peg的软膏和2%油醇的对照组合物提供的至少到达表皮层的托法替尼的总量的至少5倍。
[0069]
在一些实施方案中,所述药物组合物每天施用一次或多次。在一些实施方案中,如与治疗有效剂量的口服托法替尼相比,所述药物组合物提供减少的托法替尼全身暴露。
[0070]
在一些实施方案中,所述脂肪酸是选自由以下组成的组:肉豆蔻烯酸、棕榈油酸、十六碳烯酸、油酸、反油酸、香叶酸、异油酸、亚油酸、反亚油酸、α-亚麻酸、花生四烯酸、二十碳五烯酸、芥酸、二十二碳六烯酸、丙酸、丁酸、戊酸、己酸、丙二酸、庚酸、辛酸、壬酸、癸酸、十一烷酸、月桂酸、十三烷酸、肉豆蔻酸、十五烷酸、棕榈酸、十七烷酸、硬脂酸、十九烷酸、花生酸、二十一烷酸、山嵛酸、二十三烷酸、二十四烷酸、二十五烷酸、蜡酸、二十七烷酸、褐煤酸、二十九烷酸、蜂花酸、三十一烷酸、紫胶蜡酸、三十三烷酸、三十四烷酸、蜡塑酸或三十六烷酸。在一些实施方案中,所述脂肪酸是选自由以下组成的组:油酸、香叶酸、己酸和丙二酸。在一些实施方案中,所述脂肪酸是香叶酸。
[0071]
在一些实施方案中,所述离子液体是低共熔溶剂(des)。在一些实施方案中,所述离子液体包含胆碱阳离子和脂肪酸阴离子,其摩尔比在1:1至1:4的胆碱阳离子:脂肪酸阴离子范围内。在一些实施方案中,所述离子液体包含胆碱阳离子和脂肪酸阴离子,其摩尔比为1:2的胆碱阳离子:脂肪酸阴离子。
[0072]
在一些实施方案中,所述药物组合物基本上由托法替尼和所述离子液体组成。在一些实施方案中,所述药物组合物还包含药学上可接受的载体。在一些实施方案中,所述药学上可接受的载体是水性载体。在一些实施方案中,所述药学上可接受的载体包含软膏基质。
[0073]
在一些实施方案中,所述离子液体以约1%至约99%的浓度存在于药物组合物中。在一些实施方案中,所述离子液体以约5%至约90%的浓度存在于药物组合物中。在一些实施方案中,所述离子液体以约10%至约80%的浓度存在于药物组合物中。在一些实施方案中,所述离子液体以约15%至约70%的浓度存在于药物组合物中。在一些实施方案中,所述离子液体以约20%至约60%的浓度存在于药物组合物中。在一些实施方案中,所述离子液体以约30%至约50%的浓度存在于药物组合物中。在一些实施方案中,所述离子液体以约35%至约45的浓度存在于药物组合物中。在一些实施方案中,所述离子液体以约40%的浓度存在于药物组合物中。
[0074]
在一些实施方案中,所述药物组合物还包含渗透增强剂。在一些实施方案中,所述渗透增强剂是2-(2-乙氧基乙氧基)乙醇或油醇。在一些实施方案中,所述渗透增强剂是2-(2-乙氧基乙氧基)乙醇。在一些实施方案中,所述药物组合物包含约1%至约20%的2-(2-乙氧基乙氧基)乙醇。在一些实施方案中,所述药物组合物包含约5%至约15%的2-(2-乙氧基乙氧基)乙醇。在一些实施方案中,所述药物组合物包含约10%的2-(2-乙氧基乙氧基)乙醇。
[0075]
在一些实施方案中,所述药物组合物基本上不含2-(2-乙氧基乙氧基)乙醇。在一些实施方案中,所述药物组合物基本上不含油醇。
[0076]
在一些实施方案中,施用于个体的组合物的量和治疗时长取决于个体的属性,包括但不限于健康状况、重量、疾患的严重程度、先前疗法和治疗医师的判断。在一些实施方案中,施用于个体的组合物的量是通过常规实验(例如,剂量递增临床试验)确定的。
[0077]
在一些实施方案中,如本文所述的表面组合物抑制表皮层内jak-1、jak-2、tyk-2和jak-3中的至少一者的活性达10%、15%、20%、25%、30%、35%、40%、45%、50%、55%、60%、65%、70%、75%、80%、85%、90%、95%或超过95%。
[0078]
在一些实施方案中,如本文所述的表面组合物抑制真皮层内jak-1、jak-2、tyk-2和jak-3中的至少一者的活性达10%、15%、20%、25%、30%、35%、40%、45%、50%、55%、60%、65%、70%、75%、80%、85%、90%、95%或超过95%。
[0079]
在一些实施方案中,如本文所述的表面组合物抑制皮下组织层内jak-1、jak-2、tyk-2和jak-3中的至少一者的活性达10%、15%、20%、25%、30%、35%、40%、45%、50%、55%、60%、65%、70%、75%、80%、85%、90%、95%或超过95%。
[0080]
在一些实施方案中,如本文所述的表面组合物抑制肌肉内jak-1、jak-2、tyk-2和jak-3中的至少一者的活性达10%、15%、20%、25%、30%、35%、40%、45%、50%、55%、60%、65%、70%、75%、80%、85%、90%、95%或超过95%。
[0081]
在一些实施方案中,每天一次将所述组合物涂覆于个体的皮肤。在一些实施方案中,每天1、2、3、4或5次将所述组合物涂覆于个体的皮肤。在一些实施方案中,每天2次将所述组合物涂覆于个体的皮肤。在一些实施方案中,每天2次(例如,早晨和晚上)将所述组合物涂覆于个体的皮肤。在一些实施方案中,每天、每隔一天、每三天、每周两次、每周一次或每月一次将所述组合物涂覆于个体的皮肤。在一些实施方案中,将所述组合物涂覆于个体的皮肤一次。在一些实施方案中,将所述组合物涂覆于个体的皮肤持续1周、2周、3周、1个月、2个月或3个月或更长的时间段。在一些实施方案中,将所述组合物涂覆于皮肤,直到消除与jak(jak-1、jak-2、tyk-2和/或jak-3)的活性相关的疾病或疾患的症状。在一些实施方案中,将所述组合物涂覆于皮肤,直到减轻与jak(jak-1、jak-2、tyk-2和/或jak-3)的活性相关的疾病或疾患的症状。在一些实施方案中,本文所述的表面托法替尼组合物提供其中托法替尼的改进的稳定性或较少降解。在一些实施方案中,在一些实施方案中,本文所述的表面托法替尼组合物提供其中托法替尼的改进的稳定性或较少降解。在一些实施方案中,本文所述的表面托法替尼组合物在存储条件(例如室温)下在至少约1天、至少约2天、至少约3天、至少约4天、至少约5天、至少约6天、至少约1周、至少约2周、至少约3周、至少约4周、至少约5周、至少约6周、至少约7周、至少约8周、至少约3个月、至少约4个月、至少约5个月或至少约6个月的任何时期内,对于化合物降解是稳定的(例如,低于30%降解、低于25%降解、低于20%降解、低于15%降解、低于10%降解、低于8%降解、低于5%降解、低于3%降解、低于2%降解或低于1%降解)。在其他实施方案中,本文所述的制剂在至少约1周的时期内对于托法替尼降解是稳定的。本文还描述了在至少约1个月的时期内对于托法替尼降解稳定的制剂。
[0082]
某些非限制性实施方案实施方案1.一种将托法替尼递送至皮肤或通过皮肤递送的方法,所述方法包括向皮肤施用药物组合物,所述药物组合物包含托法替尼或其药学上可接受的盐和离子液体,所述离子液体的量足以使治疗有效量的托法替尼到达皮肤内或皮肤以外的目标深度,其中所述离子液体包含胆碱阳离子和脂肪酸阴离子。实施方案2.实施方案1的方法,其中所述药物组合物包含约0.01%至约10%的托法替尼或其药学上可接受的盐。实施方案3.实施方案1的方法,其中所述药物组合物包含约0.1%至约8%的托法替尼或其药学上可接受的盐。实施方案4.实施方案1的方法,其中所述药物组合物包含约0.1%至约5%的托法替尼或其药学上可接受的盐。实施方案5.实施方案1-4中任一项的方法,其中目标深度为约0.05mm至约20mm。实施方案6.实施方案1-4中任一项的方法,其中目标深度为约0.1mm至约15mm。实施方案7.实施方案1-4中任一项的方法,其中目标深度为约1mm至约10mm。实施方案8.实施方案1-7中任一项的方法,其中所述药物组合物允许治疗有效量的托法替尼至少到达表皮层。实施方案9.实施方案8的方法,其中在表皮层的托法替尼的量足以抑制表皮层内jak-1、jak-2、tyk-2和jak-3中的至少一者的活性。实施方案10.实施方案1-9中任一项的方法,其中所述药物组合物允许治疗有效量
的托法替尼至少到达真皮层。实施方案11.实施方案10的方法,其中在真皮层的托法替尼的量足以抑制真皮层内jak-1、jak-2、tyk-2和jak-3中的至少一者的活性。实施方案12.实施方案1-11中任一项的方法,其中所述药物组合物允许治疗有效量的托法替尼至少到达皮下组织层。实施方案13.实施方案12的方法,其中在皮下组织层的托法替尼的量足以抑制皮下组织层内jak-1、jak-2、tyk-2和jak-3中的至少一者的活性。实施方案14.实施方案1-13中任一项的方法,其中所述药物组合物允许治疗有效量的托法替尼至少到达肌肉组织。实施方案15.实施方案14的方法,其中在肌肉组织中的托法替尼的量足以抑制肌肉组织内jak-1、jak-2、tyk-2和jak-3中的至少一者的活性。实施方案16.实施方案1-15中任一项的方法,其中由所述药物组合物提供的至少到达表皮层的托法替尼的总量是由用相同量的2-(2-乙氧基乙氧基)乙醇代替所述离子液体的对照组合物提供的至少到达表皮层的托法替尼的总量的至少1.5倍。实施方案17.实施方案1-15中任一项的方法,其中由所述药物组合物提供的至少到达表皮层的托法替尼的总量是由用相同量的2-(2-乙氧基乙氧基)乙醇代替所述离子液体的对照组合物提供的至少到达表皮层的托法替尼的总量的至少2倍。实施方案18.实施方案1-15中任一项的方法,其中由所述药物组合物提供的至少到达表皮层的托法替尼的总量是由用相同量的2-(2-乙氧基乙氧基)乙醇代替所述离子液体的对照组合物提供的至少到达表皮层的托法替尼的总量的至少2.5倍。实施方案19.实施方案1-15中任一项的方法,其中由所述药物组合物提供的至少到达表皮层的托法替尼的总量是由用相同量的2-(2-乙氧基乙氧基)乙醇代替所述离子液体的对照组合物提供的至少到达表皮层的托法替尼的总量的至少3倍。实施方案20.实施方案1-19中任一项的方法,其中由所述药物组合物提供的至少到达表皮层的托法替尼的总量是由包含基于peg的软膏和2%油醇的对照组合物提供的至少到达表皮层的托法替尼的总量的至少2倍。实施方案21.实施方案1-19中任一项的方法,其中由所述药物组合物提供的至少到达表皮层的托法替尼的总量是由包含基于peg的软膏和2%油醇的对照组合物提供的至少到达表皮层的托法替尼的总量的至少3倍。实施方案22.实施方案1-19中任一项的方法,其中由所述药物组合物提供的至少到达表皮层的托法替尼的总量是由包含基于peg的软膏和2%油醇的对照组合物提供的至少到达表皮层的托法替尼的总量的至少4倍。实施方案23.实施方案1-19中任一项的方法,其中由所述药物组合物提供的至少到达表皮层的托法替尼的总量是由包含基于peg的软膏和2%油醇的对照组合物提供的至少到达表皮层的托法替尼的总量的至少5倍。实施方案24.实施方案1-23中任一项的方法,其中所述药物组合物每天施用一次或多次。实施方案25.实施方案1-24中任一项的方法,其中如与治疗有效剂量的口服托法替尼相比,所述药物组合物提供减少的托法替尼全身暴露。
实施方案26.实施方案1-25中任一项的方法,其中所述脂肪酸是选自由以下组成的组:肉豆蔻烯酸、棕榈油酸、十六碳烯酸、油酸、反油酸、香叶酸、异油酸、亚油酸、反亚油酸、α-亚麻酸、花生四烯酸、二十碳五烯酸、芥酸、二十二碳六烯酸、丙酸、丁酸、戊酸、己酸、丙二酸、庚酸、辛酸、壬酸、癸酸、十一烷酸、月桂酸、十三烷酸、肉豆蔻酸、十五烷酸、棕榈酸、十七烷酸、硬脂酸、十九烷酸、花生酸、二十一烷酸、山嵛酸、二十三烷酸、二十四烷酸、二十五烷酸、蜡酸、二十七烷酸、褐煤酸、二十九烷酸、蜂花酸、三十一烷酸、紫胶蜡酸、三十三烷酸、三十四烷酸、蜡塑酸或三十六烷酸。实施方案27.实施方案1-25中任一项的方法,其中所述脂肪酸是选自由以下组成的组:油酸、香叶酸、己酸和丙二酸。实施方案28.实施方案1-25中任一项的方法,其中所述脂肪酸是香叶酸。实施方案29.实施方案1-28中任一项的方法,其中所述离子液体是低共熔溶剂(des)。实施方案30.实施方案1-29中任一项的方法,其中所述离子液体包含胆碱阳离子和脂肪酸阴离子,其摩尔比在1:1至1:4的胆碱阳离子:脂肪酸阴离子范围内。实施方案31.实施方案1-29中任一项的方法,其中所述离子液体包含胆碱阳离子和脂肪酸阴离子,其摩尔比为1:2的胆碱阳离子:脂肪酸阴离子。实施方案32.实施方案1-30中任一项的方法,其中所述药物组合物基本上由托法替尼和所述离子液体组成。实施方案33.实施方案1-30中任一项的方法,其中所述药物组合物还包含药学上可接受的载体。实施方案34.实施方案33的方法,其中所述药学上可接受的载体是水性载体。实施方案35.实施方案33的方法,其中所述药学上可接受的载体包含软膏基质。实施方案36.实施方案1-35中任一项的方法,其中所述离子液体以约1%至约99%的浓度存在于药物组合物中。实施方案37.实施方案1-35中任一项的方法,其中所述离子液体以约5%至约90%的浓度存在于药物组合物中。实施方案38.实施方案1-35中任一项的方法,其中所述离子液体以约10%至约80%的浓度存在于药物组合物中。实施方案39.实施方案1-35中任一项的方法,其中所述离子液体以约15%至约70%的浓度存在于药物组合物中。实施方案40.实施方案1-35中任一项的方法,其中所述离子液体以约20%至约60%的浓度存在于药物组合物中。实施方案41.实施方案1-35中任一项的方法,其中所述离子液体以约30%至约50%的浓度存在于药物组合物中。实施方案42.实施方案1-35中任一项的方法,其中所述离子液体以约35%至约45%的浓度存在于药物组合物中。实施方案43.实施方案1-35中任一项的方法,其中所述离子液体以约40%的浓度存在于药物组合物中。实施方案44.实施方案1-43中任一项的方法,其中所述药物组合物还包含渗透增
强剂。实施方案45.实施方案44的方法,其中所述渗透增强剂是2-(2-乙氧基乙氧基)乙醇或油醇。实施方案46.实施方案44的方法,其中所述渗透增强剂是2-(2-乙氧基乙氧基)乙醇。实施方案47.实施方案46的方法,其中所述药物组合物包含约1%至约20%的2-(2-乙氧基乙氧基)乙醇。实施方案48.实施方案46的方法,其中所述药物组合物包含约5%至约15%的2-(2-乙氧基乙氧基)乙醇。实施方案49.实施方案46中任一项的方法,其中所述药物组合物包含约10%的2-(2-乙氧基乙氧基)乙醇。实施方案50.实施方案1-43中任一项的方法,其中所述药物组合物基本上不含2-(2-乙氧基乙氧基)乙醇或油醇。实施方案51.一种局部抑制表皮层、真皮层、皮下组织层或肌肉组织内jak-1、jak-2、tyk-2和jak-3中的至少一者的活性的方法,所述方法包括向皮肤施用药物组合物,所述药物组合物包含托法替尼或其药学上可接受的盐和离子液体,所述离子液体的量足以使治疗有效量的托法替尼到达皮肤内或皮肤以外的目标深度,其中所述离子液体包含胆碱阳离子和脂肪酸阴离子。实施方案52.实施方案51的方法,其中所述药物组合物包含约0.01%至约10%的托法替尼或其药学上可接受的盐。实施方案53.实施方案51的方法,其中所述药物组合物包含约0.1%至约8%的托法替尼或其药学上可接受的盐。实施方案54.实施方案51的方法,其中所述药物组合物包含约0.1%至约5%的托法替尼或其药学上可接受的盐。实施方案55.实施方案51-54中任一项的方法,其中目标深度为约0.05mm至约20mm。实施方案56.实施方案51-54中任一项的方法,其中目标深度为约0.1mm至约15mm。实施方案57.实施方案51-54中任一项的方法,其中目标深度为约1mm至约10mm。实施方案58.实施方案51-57中任一项的方法,其中所述药物组合物允许治疗有效量的托法替尼至少到达表皮层。实施方案59.实施方案58的方法,其中在表皮层的托法替尼的量足以抑制表皮层内jak-1、jak-2、tyk-2和jak-3中的至少一者的活性。实施方案60.实施方案51-59中任一项的方法,其中所述药物组合物允许治疗有效量的托法替尼至少到达真皮层。实施方案61.实施方案60的方法,其中在真皮层的托法替尼的量足以抑制真皮层内jak-1、jak-2、tyk-2和jak-3中的至少一者的活性。实施方案62.实施方案51-61中任一项的方法,其中所述药物组合物允许治疗有效量的托法替尼至少到达皮下组织层。实施方案63.实施方案62的方法,其中在皮下组织层的托法替尼的量足以抑制皮
下组织层内jak-1、jak-2、tyk-2和jak-3中的至少一者的活性。实施方案64.实施方案51-63中任一项的方法,其中所述药物组合物允许治疗有效量的托法替尼至少到达肌肉组织。实施方案65.实施方案64的方法,其中在肌肉组织中的托法替尼的量足以抑制肌肉组织内jak-1、jak-2、tyk-2和jak-3中的至少一者的活性。实施方案66.实施方案51-65中任一项的方法,其中由所述药物组合物提供的至少到达表皮层的托法替尼的总量是由用相同量的2-(2-乙氧基乙氧基)乙醇代替所述离子液体的对照组合物提供的至少到达表皮层的托法替尼的总量的至少1.5倍。实施方案67.实施方案51-65中任一项的方法,其中由所述药物组合物提供的至少到达表皮层的托法替尼的总量是由用相同量的2-(2-乙氧基乙氧基)乙醇代替所述离子液体的对照组合物提供的至少到达表皮层的托法替尼的总量的至少2倍。实施方案68.实施方案51-65中任一项的方法,其中由所述药物组合物提供的至少到达表皮层的托法替尼的总量是由用相同量的2-(2-乙氧基乙氧基)乙醇代替所述离子液体的对照组合物提供的至少到达表皮层的托法替尼的总量的至少2.5倍。实施方案69.实施方案51-65中任一项的方法,其中由所述药物组合物提供的至少到达表皮层的托法替尼的总量是由用相同量的2-(2-乙氧基乙氧基)乙醇代替所述离子液体的对照组合物提供的至少到达表皮层的托法替尼的总量的至少3倍。实施方案70.实施方案51-69中任一项的方法,其中由所述药物组合物提供的至少到达表皮层的托法替尼的总量是由包含基于peg的软膏和2%油醇的对照组合物提供的至少到达表皮层的托法替尼的总量的至少2倍。实施方案71.实施方案51-69中任一项的方法,其中由所述药物组合物提供的至少到达表皮层的托法替尼的总量是由包含基于peg的软膏和2%油醇的对照组合物提供的至少到达表皮层的托法替尼的总量的至少3倍。实施方案72.实施方案51-69中任一项的方法,其中由所述药物组合物提供的至少到达表皮层的托法替尼的总量是由包含基于peg的软膏和2%油醇的对照组合物提供的至少到达表皮层的托法替尼的总量的至少4倍。实施方案73.实施方案51-69中任一项的方法,其中由所述药物组合物提供的至少到达表皮层的托法替尼的总量是由包含基于peg的软膏和2%油醇的对照组合物提供的至少到达表皮层的托法替尼的总量的至少5倍。实施方案74.实施方案51-73中任一项的方法,其中所述药物组合物每天施用一次或多次。实施方案75.实施方案51-74中任一项的方法,其中如与治疗有效剂量的口服托法替尼相比,所述药物组合物提供减少的托法替尼全身暴露。实施方案76.实施方案51-75中任一项的方法,其中所述脂肪酸是选自由以下组成的组:肉豆蔻烯酸、棕榈油酸、十六碳烯酸、油酸、反油酸、香叶酸、异油酸、亚油酸、反亚油酸、α-亚麻酸、花生四烯酸、二十碳五烯酸、芥酸、二十二碳六烯酸、丙酸、丁酸、戊酸、己酸、丙二酸、庚酸、辛酸、壬酸、癸酸、十一烷酸、月桂酸、十三烷酸、肉豆蔻酸、十五烷酸、棕榈酸、十七烷酸、硬脂酸、十九烷酸、花生酸、二十一烷酸、山嵛酸、二十三烷酸、二十四烷酸、二十五烷酸、蜡酸、二十七烷酸、褐煤酸、二十九烷酸、蜂花酸、三十一烷酸、紫胶蜡酸、三十三烷
(2-乙氧基乙氧基)乙醇。实施方案98.实施方案96的方法,其中所述药物组合物包含约5%至约15%的2-(2-乙氧基乙氧基)乙醇。实施方案99.实施方案96的方法,其中所述药物组合物包含约10%的2-(2-乙氧基乙氧基)乙醇。实施方案100.实施方案51-93中任一项的方法,其中所述药物组合物基本上不含2-(2-乙氧基乙氧基)乙醇或油醇。实施方案101.一种表面组合物,所述表面组合物包含托法替尼或其药学上可接受的盐和离子液体,所述离子液体的量足以使治疗有效量的托法替尼到达皮肤内或皮肤以外的目标深度,其中所述离子液体包含胆碱阳离子和脂肪酸阴离子。102.实施方案101的组合物,其中所述药物组合物包含约0.01%至约10%的托法替尼或其药学上可接受的盐。实施方案103.实施方案101的组合物,其中所述药物组合物包含约0.1%至约8%的托法替尼或其药学上可接受的盐。实施方案104.实施方案101的组合物,其中所述药物组合物包含约0.1%至约5%的托法替尼或其药学上可接受的盐。实施方案105.实施方案101-104中任一项的组合物,其中目标深度为约0.05mm至约20mm。实施方案106.实施方案101-104中任一项的组合物,其中目标深度为约0.1mm至约15mm。实施方案107.实施方案101-104中任一项的组合物,其中目标深度为约1mm至约10mm。实施方案108.实施方案101-107中任一项的组合物,其中所述药物组合物允许治疗有效量的托法替尼至少到达表皮层。实施方案109.实施方案101-108中任一项的组合物,其中所述药物组合物允许治疗有效量的托法替尼至少到达真皮层。实施方案110.实施方案101-109中任一项的组合物,其中所述药物组合物允许治疗有效量的托法替尼至少到达皮下组织层。实施方案111.实施方案101-110中任一项的组合物,其中所述药物组合物允许治疗有效量的托法替尼至少到达肌肉组织。实施方案112.实施方案101-111中任一项的组合物,其中由所述药物组合物提供的至少到达表皮层的托法替尼的总量是由用相同量的2-(2-乙氧基乙氧基)乙醇代替所述离子液体的对照组合物提供的至少到达表皮层的托法替尼的总量的至少1.5倍。实施方案113.实施方案101-111中任一项的组合物,其中由所述药物组合物提供的至少到达表皮层的托法替尼的总量是由用相同量的2-(2-乙氧基乙氧基)乙醇代替所述离子液体的对照组合物提供的至少到达表皮层的托法替尼的总量的至少2倍。实施方案114.实施方案101-111中任一项的组合物,其中由所述药物组合物提供的至少到达表皮层的托法替尼的总量是由用相同量的2-(2-乙氧基乙氧基)乙醇代替所述离子液体的对照组合物提供的至少到达表皮层的托法替尼的总量的至少2.5倍。
实施方案115.实施方案101-111中任一项的组合物,其中由所述药物组合物提供的至少到达表皮层的托法替尼的总量是由用相同量的2-(2-乙氧基乙氧基)乙醇代替所述离子液体的对照组合物提供的至少到达表皮层的托法替尼的总量的至少3倍。实施方案116.实施方案101-115中任一项的组合物,其中由所述药物组合物提供的至少到达表皮层的托法替尼的总量是由包含基于peg的软膏和2%油醇的对照组合物提供的至少到达表皮层的托法替尼的总量的至少2倍。实施方案117.实施方案101-115中任一项的组合物,其中由所述药物组合物提供的至少到达表皮层的托法替尼的总量是由包含基于peg的软膏和2%油醇的对照组合物提供的至少到达表皮层的托法替尼的总量的至少3倍。实施方案118.实施方案101-115中任一项的组合物,其中由所述药物组合物提供的至少到达表皮层的托法替尼的总量是由包含基于peg的软膏和2%油醇的对照组合物提供的至少到达表皮层的托法替尼的总量的至少4倍。实施方案119.实施方案101-115中任一项的组合物,其中由所述药物组合物提供的至少到达表皮层的托法替尼的总量是由包含基于peg的软膏和2%油醇的对照组合物提供的至少到达表皮层的托法替尼的总量的至少5倍。实施方案120.实施方案101-119中任一项的组合物,其中所述脂肪酸是选自由以下组成的组:肉豆蔻烯酸、棕榈油酸、十六碳烯酸、油酸、反油酸、香叶酸、异油酸、亚油酸、反亚油酸、α-亚麻酸、花生四烯酸、二十碳五烯酸、芥酸、二十二碳六烯酸、丙酸、丁酸、戊酸、己酸、丙二酸、庚酸、辛酸、壬酸、癸酸、十一烷酸、月桂酸、十三烷酸、肉豆蔻酸、十五烷酸、棕榈酸、十七烷酸、硬脂酸、十九烷酸、花生酸、二十一烷酸、山嵛酸、二十三烷酸、二十四烷酸、二十五烷酸、蜡酸、二十七烷酸、褐煤酸、二十九烷酸、蜂花酸、三十一烷酸、紫胶蜡酸、三十三烷酸、三十四烷酸、蜡塑酸或三十六烷酸。实施方案121.实施方案101-119中任一项的组合物,其中所述脂肪酸是选自由以下组成的组:油酸、香叶酸、己酸和丙二酸。实施方案122.实施方案101-119中任一项的组合物,其中所述脂肪酸是香叶酸。实施方案123.实施方案101-122中任一项的组合物,其中所述离子液体是低共熔溶剂(des)。实施方案124.实施方案101-123中任一项的组合物,其中所述离子液体包含胆碱阳离子和脂肪酸阴离子,其摩尔比在1:1至1:4的胆碱阳离子:脂肪酸阴离子范围内。实施方案125.实施方案101-123中任一项的组合物,其中所述离子液体包含胆碱阳离子和脂肪酸阴离子,其摩尔比为1:2的胆碱阳离子:脂肪酸阴离子。实施方案126.实施方案101-125中任一项的组合物,其中所述药物组合物基本上由托法替尼和所述离子液体组成。实施方案127.实施方案101-125中任一项的组合物,其中所述药物组合物还包含药学上可接受的载体。实施方案128.实施方案127的组合物,其中所述药学上可接受的载体是水性载体。实施方案129.实施方案127的组合物,其中所述药学上可接受的载体包含软膏基质。实施方案130.实施方案101-129中任一项的组合物,其中所述离子液体以约1%至
约99%的浓度存在于药物组合物中。实施方案131.实施方案101-129中任一项的组合物,其中所述离子液体以约5%至约90%的浓度存在于药物组合物中。实施方案132.实施方案101-129中任一项的组合物,其中所述离子液体以约10%至约80%的浓度存在于药物组合物中。实施方案133.实施方案101-129中任一项的组合物,其中所述离子液体以约15%至约70%的浓度存在于药物组合物中。实施方案134.实施方案101-129中任一项的组合物,其中所述离子液体以约20%至约60%的浓度存在于药物组合物中。实施方案135.实施方案101-129中任一项的组合物,其中所述离子液体以约30%至约50%的浓度存在于药物组合物中。实施方案136.实施方案101-129中任一项的组合物,其中所述离子液体以约35%至约45%的浓度存在于药物组合物中。实施方案137.实施方案101-129中任一项的组合物,其中所述离子液体以约40%的浓度存在于药物组合物中。实施方案138.实施方案101-137中任一项的组合物,其中所述药物组合物还包含渗透增强剂。实施方案139.实施方案138的组合物,其中所述渗透增强剂是2-(2-乙氧基乙氧基)乙醇或油醇。实施方案140.实施方案138的组合物,其中所述渗透增强剂是2-(2-乙氧基乙氧基)乙醇。实施方案141.实施方案140的组合物,其中所述药物组合物包含约1%至约20%的2-(2-乙氧基乙氧基)乙醇。实施方案142.实施方案140的组合物,其中所述药物组合物包含约5%至约15%的2-(2-乙氧基乙氧基)乙醇。实施方案143.实施方案140的组合物,其中所述药物组合物包含约10%的2-(2-乙氧基乙氧基)乙醇。实施方案144.实施方案101-137中任一项的组合物,其中所述药物组合物基本上不含2-(2-乙氧基乙氧基)乙醇或油醇。某些术语
[0083]
本文所用的术语仅是出于描述特定情形的目的,而非旨在限制。论述以下术语以说明如本说明书中所用的术语的含义,以及本领域技术人员对这些术语的理解。除非本文另外清楚地指出,否则如本文和所附权利要求书中所用,单数形式“一(a/an)”和“所述”包括复数个提及物。还应注意,可起草权利要求书以排除任何任选要素。因此,本陈述旨在用作与权利要求要素的陈述一起使用如“单独”、“仅”等的此类排他性术语或使用“否定性”限制的前置基础。
[0084]
本文中使用前面有术语“约”的数值来呈现某些范围。本文中使用术语“约”为其后的精确数字以及接近或近似所述术语之后数字的数字提供文字支持。在确定数字是否接近或近似特定陈述的数字时,接近或近似的未陈述的数字可以是如下数字,它在提出所述数
字的上下文中提供所述特定陈述的数字的大体等效物。在提供值的范围时,应理解在那个范围的上限与下限之间的每个中间值(除非本文另外清楚地指出,否则所述中间值达到下限单位的十分之一)和在那个所陈述范围中的任何其他所陈述值或中间值均涵盖于本文所述的方法和组合物内。这些较小范围的上限和下限可以独立地包括在所述较小范围内并且也涵盖于本文所述的方法和组合物内,从属于所陈述范围内的任何特定排除的极限。在所陈述范围包括所述极限中的一个或两个的情况下,排除那些所包括的极限中的任一个或两个的范围也包括在本文所述的方法和组合物中。
[0085]
术语“个体”、“患者”或“受试者”可互换使用。所述术语均不要求或仅限于以卫生保健工作者(例如医生、注册护士、执业护士、医师助理、护理员或临终关怀工作者)的监督(例如持续或间歇的)为特征的情况。此外,这些术语是指人类或动物受试者。
[0086]“治疗(treating/treatment)”是指治疗性治疗和预防措施两者,其中目的是预防或减缓(减轻)靶向性病理疾患或病症。需要治疗的那些包括已经患有所述病症的那些,以及易患所述病症的那些,或将预防所述病症的那些。例如,如果在根据本公开的方法接受治疗量的组合物后,受试者显示以下一项或多项的可观察到和/或可测量的减少或缺乏:红斑减少;红筋的出现减少;丘疹和脓疱,那么受试者或哺乳动物成功地“治疗”红斑痤疮。
[0087]
如本文所用,术语“有效量”或“治疗有效量”是指施用的足够量的剂或化合物,其将在一定程度上缓解所治疗的疾病或疾患的一种或多种症状。结果可以是疾病的征兆、症状或病因的减轻和/或缓解,或者生物系统的任何其他所需改变。例如,用于治疗用途的“有效量”是包括如本文所公开的化合物的组合物提供疾病症状的临床上显著的降低而无不适当的不良副作用所需的量。在任何个别情形中,适当的“有效量”可以使用诸如剂量递增研究的技术来确定。术语“治疗有效量”包括例如预防有效量。本文所公开的化合物的“有效量”是有效实现所需的药理学效应或治疗改进而无不适当的不良副作用的量。应理解,“有效量”或“治疗有效量”可由于所述化合物的代谢、受试者的年龄、重量、一般状况、所治疗的疾患、所治疗的疾患的严重程度以及处方医师的判断的变化而因受试者而异。仅举例来说,治疗有效量可以通过常规实验,包括但不限于剂量递增临床试验来确定。
[0088]
除非另外定义,否则本文使用的所有技术和科学术语均具有与本文所述的方法和组合物所属领域的普通技术人员通常所理解相同的含义。尽管与本文所述的那些相似或等效的任何方法和材料也可用于本文所述的方法和组合物的实践或测试,但现在描述代表性的说明性方法和材料。非限制性实施例实施例1:含有呈1:1摩尔比的胆碱阳离子和香叶酸阴离子的离子液体(离子液体b)的制备
[0089]
将纯化的gmp penta香叶酸(311.0g,1.848mol)放置于2l圆底烧瓶中。将所述烧瓶放置于20℃的水浴中并搅拌。接着用加料漏斗缓慢地(逐滴)添加胆碱碳酸氢盐(381.7g,1.848mol)于水(sigma,c7519,209ml)中的80%溶液,总加料时间为120min。将烧瓶搅拌过夜(12h)以最大化所得co2的逸出。将烧瓶放置于旋转蒸发仪中并在室温(20℃)和小真空(30毫巴)下去除剩余的co2。在不再观察到呈泡沫形式的co2生成后,将所述浴加热至60℃并将真空增加至-100kpa以去除所产生的水。在通过旋转蒸发仪的干冰阱上的冷凝不再观察到水蒸发后,在60℃和-100kpa下进一步加热所述烧瓶,再持续36h以干燥最终产物。获得
475g产物(94.7%产率)。hplc分析显示97.9%纯度。实施例2:含有呈1:2摩尔比的胆碱阳离子和香叶酸阴离子的离子液体(离子液体a)的制备
[0090]
向500ml圆底烧瓶中的2当量(9.88g.,0.059摩尔)的纯香叶酸(在-70℃下从70%香叶酸/30%丙酮中再结晶5次)中添加1当量的胆碱碳酸氢盐(80wt%溶液,6.06g,0.029mol)。在室温下搅拌所述混合物,直到不再生成co2。通过在60℃下旋转蒸发持续20min来去除溶剂,并在真空烘箱中在60℃下干燥产物持续48h。
[0091]
在25℃下的物理表征:水中的溶解度=0.5m;密度=0.990g/ml;电导率=0.0431ms/cm;粘度=1345cp。实施例3:含有呈1:2摩尔比的胆碱阳离子和香叶酸阴离子的离子液体(离子液体a)的替代制备
[0092]
将纯化的gmp penta香叶酸(155g,0.921mol)放置于1l圆底烧瓶中。将所述烧瓶放置于20℃的水浴中并搅拌。接着用加料漏斗缓慢地(逐滴)添加胆碱碳酸氢盐(95.1g,0.460)于水(sigma,c7519,批号:059k1526v,209ml)中的80%溶液,总加料时间为35min。将烧瓶搅拌过夜(12h)以最大化所得co2的逸出。将烧瓶放置于旋转蒸发仪中并在室温(20℃)和小真空(30毫巴)下去除剩余的co2。在不再观察到呈泡沫形式的co2生成后,将所述浴加热至60℃并将真空增加至-100kpa以去除所产生的水。在通过旋转蒸发仪的干冰阱上的冷凝不再观察到水蒸发后,在60℃和-100kpa下进一步加热所述烧瓶,再持续36h以干燥最终产物。获得197g笼形物(96%产率)。1h-nmr谱看来与cb-0001的1h-nmr谱相似。hplc分析显示95.1%纯度。实施例4:含有呈1:3摩尔比的胆碱阳离子和香叶酸阴离子的离子液体的制备
[0093]
向1000ml圆底烧瓶中的3当量(14.56g.,0.087摩尔)的纯香叶酸(在-70℃下从70%香叶酸/30%丙酮中再结晶5次)中添加1当量的胆碱碳酸氢盐(80wt%溶液,6.06g,0.029mol)。在室温下搅拌所述混合物,直到不再生成co2。通过在60℃下旋转蒸发持续
20min来去除溶剂,并在真空烘箱中在60℃下干燥产物持续48h。实施例5:含有呈1:4摩尔比的胆碱和香叶酸的离子液体的制备
[0094]
向800ml圆底烧瓶中的4当量(19.76g.,0.118摩尔)的纯香叶酸(在-70℃下从70%香叶酸/30%丙酮中再结晶5次)中添加1当量的胆碱碳酸氢盐(80wt%溶液,6.06g,0.029mol)。在室温下搅拌所述混合物,直到不再生成co2。通过在60℃下旋转蒸发持续20min来去除溶剂,并在真空烘箱中在60℃下干燥产物持续48h。实施例6:含有托法替尼和离子液体的表面组合物(托法替尼组合物a)的制备
[0095]
使托法替尼、离子液体a(根据实施例2)和水混合在一起,直到获得均质组合物。表1:托法替尼组合物a组分浓度(w/w)托法替尼0.5%离子液体a40%水59.5%实施例7:含有托法替尼、离子液体和的表面组合物(托法替尼组合物b)的制备
[0096]
使托法替尼、离子液体a(根据实施例2)、2-(2-乙氧基乙氧基)乙醇和水混合在一起,直到获得均质组合物。表2:托法替尼组合物b表2:托法替尼组合物b实施例8:含有托法替尼和的表面组合物(对照组合物a)的制备
[0097]
使托法替尼、2-(2-乙氧基乙氧基)乙醇和水混合在一起,直到获得均质组合物。表3:对照组合物a实施例9:含有基于peg的软膏中的托法替尼和油醇的表面组合物(对照组合物b)的制备
[0098]
根据wo2012/137111(表28)来制备含有0.5%托法替尼、2%油醇和软膏载体的软膏组合物。
实施例10:托法替尼组合物的皮肤通量分析
[0099]
使用静态franz池设置来测量以下四种组合物的托法替尼递送(n=3,对于每种组合物)。1.托法替尼组合物a(n=3)2.托法替尼组合物b(n=3)3.对照组合物a(n=3)4.对照组合物b(n=3)
[0100]
在franz池中执行研究,其中人尸体皮肤被夹在含有生理盐水的受体室上。皮肤样品厚度是在0.24
–
0.53mm之间。将测试组合物涂覆于皮肤的表面并进行封闭。在37℃下24h后,用生理盐水洗涤皮肤样品的表面并剥离胶带以去除残留在皮肤样品的外表面上的组合物。接着在甲醇:生理盐水1:1v/v中提取皮肤样品。真皮层和表皮层被一起提取而未进行分离。受体是在直接取样的皮肤下方的生理盐水。通过hplc对这些样品中的托法替尼的浓度进行定量。
[0101]
托法替尼的累积皮肤通量显示于图1中。数据表明,与包括油醇和作为渗透增强剂的两种对照组合物相比,根据本公开的非限制性实施方案的两种含有离子液体的组合物导致显著增加的托法替尼渗透。
[0102]
虽然本公开的优选实施方案已在本文中显示和描述,但此类实施方案仅以举例的方式提供,这对本领域的技术人员将是显而易见的。在不背离本公开的情况下,本领域的技术人员现将想到众多变化、改变和替代。应理解,本文所述的本公开的实施方案的多种替代方案可以用于实践本公开。预期以下权利要求书限定本公开的范围并且由此涵盖这些权利要求和其相等物的范围内的方法和结构。
再多了解一些
本文用于创业者技术爱好者查询,仅供学习研究,如用于商业用途,请联系技术所有人。