一种cel-cso/taxol nps纳米药物及应用
技术领域
1.本发明涉及一种逆转乳腺癌紫杉醇耐药性的纳米药物,具体涉及一种cel-cso/taxol nps纳米药物及应用,属于抗癌药物技术领域。
背景技术:
2.乳腺癌是女性最常见的恶性肿瘤之一,发病率占全身各种恶性肿瘤的7-10%,仅次于子宫癌,已成为威胁妇女健康的主要病因。目前化疗仍然是治疗恶性肿瘤最为有效的方法之一,但多药耐药性是导致肿瘤治疗失败最为常见的原因,它的发生涉及到肿瘤微环境、细胞膜、细胞质及细胞核中的多种途径组合来共同完成的,所以形成的机制较为复杂。逆转多药耐药是肿瘤治疗整个过程中的必经之路,因此对肿瘤多药耐药的逆转及其机制研究对恶性肿瘤的防治具有重要意义。
3.雷公藤红素不仅在抗炎、抗氧化、抗肥胖及免疫抑制等方面具有突出的药理活性作用,近年来临床及实验研究还发现雷公藤红素具备高效、广泛的抗肿瘤活性,但由于其水溶性差、毒性大等原因限制了其应用。紫杉醇(taxol)作为微管稳定剂,是使用最广泛的抗肿瘤药物之一,在乳腺癌、子宫内膜癌、非小细胞肺癌、膀胱癌和宫颈癌等多种癌症中具有广泛的疗效及活性;然而随着人体肿瘤的抗性增强和免疫差异,出现的耐药问题限制了其在临床的广泛应用,导致其生物利用程度变低。
4.因此,如何实现雷公藤红素和紫杉醇的有效共载,可有望获得对耐药乳腺癌协同增效的治疗效果。
技术实现要素:
5.本发明的目的是:解决现有技术中存在的问题,提供一种cel-cso/taxol nps纳米药物及应用,通过将雷公藤红素壳寡糖偶联物cel-cso作为载体,与紫杉醇taxol在水介质中自组装形成cel-cso/taxol nps纳米药物,该纳米药物可以显著逆转乳腺癌mcf-7/taxol细胞的耐药性,且该纳米药物中的celastrol和taxol对mcf-7/taxol的逆转耐药性具有协同作用。
6.为实现上述目的,本发明采用了以下技术方案:一种cel-cso/taxol nps纳米药物,以雷公藤红素壳寡糖偶联物cel-cso为载体,与紫杉醇taxol在水介质中自组装形成,所述雷公藤红素壳寡糖偶联物cel-cso由本技术人公开的申请号为202110069921.3的制备方法制备得到。
7.所述雷公藤红素壳寡糖偶联物cel-cso与紫杉醇taxol在水介质中自组装的方法为:雷公藤红素壳寡糖偶联物cel-cso与紫杉醇taxol分别溶于甲醇溶液中,将得到的雷公藤红素壳寡糖偶联物cel-cso甲醇溶液和紫杉醇taxol甲醇溶液进行混合,混合后的溶液旋蒸除去甲醇,加入去离子水重悬并充分水化过滤,最终得到cel-cso/taxol nps纳米药物。
8.所述cel-cso/taxol nps纳米药物中以质量分数计,紫杉醇taxol:雷公藤红素壳寡糖偶联物cel-cso=1:5~15。
9.优选的,所述cel-cso/taxol nps纳米药物中以质量分数计,紫杉醇taxol:雷公藤红素壳寡糖偶联物cel-cso=1:10。
10.所述雷公藤红素壳寡糖偶联物cel-cso甲醇溶液的质量浓度为0.5~5mg/ml,紫杉醇taxol甲醇溶液的质量浓度为0.5~5mg/ml。
11.一种cel-cso/taxol nps纳米药物在制备耐药乳腺癌药物上的应用。
12.所述cel-cso/taxol nps纳米药物的应用中,cel-cso/taxol nps纳米药物通过阻断pi3k/akt/nf-κb途径抑制p-gp蛋白表达,减少药物外排,对mcf-7/taxol细胞进行逆转耐药性。
13.所述cel-cso/taxol nps纳米药物的应用中,cel-cso/taxol nps纳米药物通过阻止ros/pi3k/akt/hif-1α的活化,抑制hif-1α蛋白表达,诱导乳腺癌耐药细胞发生氧损伤及凋亡,对mcf-7/taxol细胞进行逆转耐药性。
14.所述cel-cso/taxol nps纳米药物的应用中,cel-cso/taxol nps纳米药物通过pi3k/akt/nf-κb信号通路介导或激活内源性凋亡途径,促使线粒体损伤,进而释放cyto-c并激活caspase级联反应,诱导乳腺癌耐药细胞凋亡,对mcf-7/taxol细胞进行逆转耐药性。
15.本发明的有益效果是:
16.1)本发明通过将雷公藤红素壳寡糖偶联物cel-cso作为载体,与紫杉醇taxol在水介质中自组装形成cel-cso/taxol nps纳米药物,该纳米药物可以显著逆转乳腺癌mcf-7/taxol细胞的耐药性,表现为诱导癌细胞凋亡抑制其增殖、抑制较高的耐药细胞毒性和抑制癌细胞侵袭及转移。
17.2)本发明制备的cel-cso/taxol nps纳米药物,通过逆转耐药乳腺癌细胞的体外试验,表明该纳米药物通过阻断pi3k/akt/nf-κb途径抑制p-gp蛋白表达,减少药物外排,明显改善taxol在mcf-7/taxol细胞内的累积,使得乳腺癌耐药细胞对化疗药物更敏感,对mcf-7/taxol细胞进行逆转耐药性。
18.3)本发明制备的cel-cso/taxol nps纳米药物,通过逆转耐药乳腺癌细胞的体外试验,表明该纳米药物通过阻止ros/pi3k/akt/hif-1α的活化,抑制hif-1α蛋白表达,导致胞内ros积累,促使乳腺癌耐药肿瘤细胞发生氧损伤及凋亡,对mcf-7/taxol细胞进行逆转耐药性。
19.4)本发明制备的cel-cso/taxol nps纳米药物,通过逆转耐药乳腺癌细胞的体外试验,表明该纳米药物通过pi3k/akt/nf-κb信号通路介导或者激活内源性凋亡途径(线粒体凋亡途径),促使线粒体损伤,进而释放cyto-c并激活caspase级联反应,诱导乳腺癌耐药细胞凋亡,以克服乳腺癌肿瘤细胞的耐药性。
20.5)本发明还通过各实验组的细胞体外实验,表明本发明cel-cso/taxol nps纳米药物中的celastrol和taxol对mcf-7/taxol的逆转耐药性具有协同作用。
附图说明
21.图1为本发明cel-cso/taxol nps纳米药物的核-壳结构示意图;
22.图2为由具体实施例制备的纳米药物的微观形貌结构图;
23.图3为由具体实施例制备的纳米药物的粒径和zeta电位图;
24.图4为由具体实施例制备的纳米药物的储存稳定性和不同介质中稳定性对照图;
25.图5为由具体实施例制备的纳米药物的释放效应图;
26.图6为本发明采用cck-8法检测mcf-7/taxol细胞对紫杉醇taxol的耐药性能图;
27.图7为本发明采用cck-8法检测各用药组对mcf-7及mcf-7/taxol细胞的毒性图;
28.图8为本发明cel-cso/taxol nps纳米药物对mcf-7及mcf-7/taxol细胞凋亡的影响图;
29.图9为本发明cel-cso/taxol nps纳米药物在mcf-7及mcf-7/taxol细胞内的摄取与分布图;
30.图10为本发明激光共聚焦显微镜观察不同治疗组对mcf-7/taxol细胞内ros产生的水平图;
31.图11为本发明cel-cso/taxol nps纳米药物对mcf-7/taxol细胞伤口愈合能力的影响图;
32.图12为本发明cel-cso/taxol nps纳米药物对mcf-7/taxol细胞迁移能力的影响图;
33.图13为本发明cel-cso/taxol nps纳米药物对耐药相关蛋白p-gp表达的影响图;
34.图14为本发明cel-cso/taxol nps纳米药物对凋亡相关蛋白表达的影响图;
35.图15为本发明cel-cso/taxol nps纳米药物对ros/pi3k/akt/nf-κb/hif-1α通路蛋白表达的影响图。
具体实施方式
36.下面结合附图和具体实施例对本发明作进一步的解释说明。
37.1、cel-cso/taxol nps纳米药物的制备。
38.以下实施例中实验试剂雷公藤红素壳寡糖偶联物cel-cso由本技术人公开的申请号为202110069921.3的制备方法制备得到;紫杉醇采购自安徽京和生物药业科技有限公司,货号为:33069-62-4;无水甲醇采购自天津市富宇精细化工有限公司,货号为:65-56-1。
39.实验设备旋转蒸发器采用buchi的仪器;智能控温磁力搅拌器为巩义市予华仪器有限责任公司的仪器;涡旋振荡仪为海门市其林贝尔仪器制造有限公司的仪器;纯化水系统为sigma-aldrich公司的仪器;水浴锅为上海一恒科学仪器有限公司的仪器;粒径分析仪为美国布鲁克海文仪器公司的仪器;透射电子显微镜为日本电子株式会社的仪器。
40.实施例:一种cel-cso/taxol nps纳米药物的制备方法,包括以下步骤:
41.s1、将10mg雷公藤红素壳寡糖偶联物cel-cso溶于10ml甲醇中,55℃条件下采用涡旋振荡仪充分震荡超声溶解,得到质量浓度为1mg/ml的雷公藤红素壳寡糖偶联物cel-cso甲醇溶液,将5mg紫杉醇taxol溶于5ml甲醇中,充分搅拌溶解后得到质量浓度为1mg/ml的紫杉醇taxol甲醇溶液;
42.s2、将上述步骤s1中得到的雷公藤红素壳寡糖偶联物cel-cso甲醇溶液和紫杉醇taxol甲醇溶液进行混合,体积控制在6ml,按质量比计,混合溶液中的紫杉醇taxol:雷公藤红素壳寡糖偶联物cel-cso=1:10;
43.s3、将上述步骤s2中的混合溶液放入45℃的旋转蒸发器中旋蒸除去甲醇,加入6ml去离子水进行重悬,并在磁力搅拌器上室温充分水化4h;
44.s4、将上述步骤s3中水化后的混合溶液放入55℃的超声水浴锅中进行超声水浴
15min,再通过0.22μm的聚碳酸酯滤膜器过滤,最终得到cel-cso/taxol nps纳米药物。
45.采用单因素试验和正交试验测定得出上述实施例中制备的纳米药物理化性质较佳,对上述实施例制备的cel-cso/taxol nps纳米药物进行形貌结构表征及理化性质进行测定。
46.如图1所示,cel-cso偶联物形成由亲水外壳cso和疏水内腔cel组成的纳米粒结构,紫杉醇taxol与雷公藤红素壳寡糖纳米粒cel-cso nps能够很好的供载,形成了具有“核-壳结构”的cel-cso/taxol nps纳米药物。采用tem观察cel-cso/taxol nps纳米药物的微观形貌结构,如图2所示,电镜下cel-cso/taxol nps颗粒分布均匀,呈圆形或椭圆形,符合纳米粒结构形态。
47.如图3所示,该cel-cso/taxol nps纳米药物粒径约为152.95nm,多分散系数pdi为0.115,提示比较均一,且表面带正电荷,zeta电位约为30.7mv。另外在激光的照射下,发现去离子水和taxol中没有廷德尔效应,而合成的cel-cso/taxol nps纳米药物较cel-cso nps的廷德尔效应更为明显。
48.运用高效液相色谱法hplc和紫外分光光度计uv-vis分别检测cel-cso/taxol nps纳米药物中taxol和celastrol的包封率及载药量。该纳米药物实现了对taxol和celastrol的有效共载,taxol和celastrol的包封率分别为(56.62
±
5.78)%和(82.65
±
11.86)%,载药量分别为(1.92
±
0.32)%和(3.78
±
0.24)%。以上结果说明cel-cso/taxol nps纳米药物对taxol和celastrol具有比较好的携载能力,可以实现两种抗肿瘤药物的有效共载。
49.如图4所示,运用粒径-电位分析仪对cel-cso/taxol nps纳米药物稳定性的检测。其中图4-a~图4-c为cel-cso/taxol nps纳米药物的粒径、pdi及zeta电位随时间变化图,在7天内,发现cel-cso/taxol nps纳米药物在4℃条件下的粒径和zeta电位均无显著变化,且pdi保持在0.1至0.2之间,表明该纳米药物比较稳定。图4-d、图4-e为cel-cso/taxol nps纳米药物在不同介质中的粒径和pdi随时间变化图;将cel-cso/taxol nps纳米药物置于(条件:37℃,100rpm)温床中振荡离心,模拟体内环境,在12h内发现cel-cso/taxol nps纳米药物在pbs、rpmi1640、rpmi 10%fbs及pbs 10%fbs中粒径变化不大,而在fbs中则比较明显;同样在12h内发现该纳米药物在rpmi1640和rpmi 10%fbs的pdi变化不明显,表明该纳米药物比较稳定。
50.如图5所示,采用透析法测定cel-cso/taxol nps纳米药物在pbs缓冲溶液(ph=7.4和5.5)中taxol的体外释放性能,模拟其在血流中的情况和肿瘤区域的酸性微环境。两种反应都在37℃下进行,在ph=7.4条件下,48h后taxol的释放量约为15.74%;ph为5.5时,taxol的释放速度明显加快,48h后达到77.71%。因此,上述累积释放曲线表明,cel-cso/taxol nps纳米药物的释放具有酸性和时间依赖性。
51.上述实验证明cel-cso/taxol nps纳米药物有望通过联合celastrol和taxol获得对耐药乳腺癌协同增效的治疗效果。
52.3、针对上述实施例制备的cel-cso/taxol nps纳米药物进行逆转耐药乳腺癌细胞的体外实验。
53.经研究发现,pi3k/akt的异常激活是调节肿瘤mdr的关键环节,如pi3k/akt通过诱导abc转运蛋白参与mdr过程、pi3k/akt/nf-κb途径的异常激活与mdr相关、pi3k/akt途径的异常激活通过增强抗凋亡基因(例如bcl-2和xiap)和减少促凋亡基因(例如bax)来调节
mdr,抵消了化疗诱导的细胞凋亡。
54.针对上述问题,判断该纳米药物是否通过ros/pi3k/akt/nf-κb/hif-1α通路的异常激活来调节肿瘤mdr。采用graphpad prism 8.0统计学软件处理并分析实验结果,计量资料采用来表示,多组间比较,服从正态分布且方差齐则用单因素方差分析one-way anova,组间两两比较采用t检验student’s t test,p《0.05表示具有统计学意义。
55.1)实验材料与仪器。
56.人源乳腺癌细胞mcf-7购买自美国模式培养物研究所american type culture collection,atcc;人源乳腺癌耐药细胞mcf-7/taxol购买自北纳生物科技有限公司bena culture collection,bncc;bca蛋白定量试剂盒购买自南京建成生物工程研究所;ao染色试剂盒、ros检测试剂盒、cck-8试剂盒均购买自北京索莱宝科技有限公司,细胞凋亡检测试剂盒购买自杭州联科生物技术谷粉有限公司;nf-κb抗体、akt抗体、p-akt抗体、cyto-c抗体、caspase-9抗体均购买自cell signaling公司;actin抗体购买自武汉博士德生物工程有限公司;hif-1α购买自abways technology公司;pi3k抗体、p-gp抗体、bax抗体、bcl-2抗体、caspase-3抗体、羊抗兔二抗、羊抗鼠二抗均购买自proteintech公司。
57.2)cel-cso/taxol nps纳米药物对mcf-7/taxol细胞的耐药逆转作用试验。
58.将乳腺癌细胞株mcf-7和乳腺癌耐药细胞株mcf-7/taxol培养在5%co2、95%湿度及37℃的恒温条件下,后进行细胞的复苏、传代、冻存和计数培养。采用cck-8试剂盒分别检测游离taxol、cel-cso、taxol/cel-cso mix及cel-cso/taxol nps纳米药物组对正常乳腺癌细胞mcf-7及其乳腺癌耐药细胞mcf-7/taxol相对应的细胞毒性,评价cel-cso/taxol nps纳米药物逆转乳腺癌耐药性的能力。
59.用graphpad prism计算出细胞的存活率、细胞半数抑制浓度ic
50
值,再依据各个给药组的ic
50
值计算出耐药指数和逆转耐药指数;其中细胞存活率=(给药组-空白组)/(对照组-空白组)
×
100%;耐药指数=耐药细胞taxol药物组的ic
50
值/正常细胞taxol药物组的ic
50
值
×
100%;逆转耐药指数=耐药细胞taxol药物组的ic
50
值/耐药细胞其他给药组中taxol的ic
50
值
×
100%。
60.检测结果如图6和图7所示,其中图6-a为mcf-7及mcf-7/taxol细胞的镜下照片图(
×
200);可见耐药乳腺癌细胞mcf-7/taxol较正常mcf-7细胞形态上明显发生锐化,呈现出细胞质皱缩浑浊及胞核增大的现象。图6-b为cck-8法检测紫杉醇taxol对mcf-7及mcf-7/taxol细胞的存活百分率的影响图(n=6),紫杉醇共同作用mcf-7及mcf-7/taxol细胞24h后,mcf-7和mcf-7/taxol细胞的半数抑制率ic
50
值分别为(23.07
±
0.43)μg/ml与(252.40
±
15.70)μg/ml,根据上述公式得出耐药乳腺癌细胞mcf-7/taxol的耐药指数为10.94,证明该细胞具明显的耐药性。
61.图7-a、图7-b为不同给药组对mcf-7及mcf-7/taxol细胞的存活百分率的影响图(n=6),在mcf-7细胞中游离taxol的ic
50
值为(23.07
±
0.43)μg/ml,单独加入cel-cso中celastrol的ic
50
值为(3.73
±
0.31)μg/ml;随着cel-cso的加入,可发现taxol/cel-cso mix物理共混的ic
50
值为(1.73
±
0.16)μg/ml,cel-cso/taxol nps纳米药物的ic
50
值为(1.32
±
0.06)μg/ml,这说明taxol/cel-cso mix物理共混和cel-cso/taxol nps纳米药物,在cel-cso加入后,其中的celastrol和化疗中的taxol产生了协同效应,抗肿瘤作用增强,
但cel-cso/taxol nps纳米药物的疗效明显优于taxol/cel-cso mix物理共混;在mcf-7/taxol细胞中,taxol/cel-cso mix物理共混的ic
50
值为(1.56
±
0.07)μg/ml,cel-cso/taxol nps纳米药物的ic
50
值为(1.08
±
0.05)μg/ml,说明taxol/cel-cso mix物理共混和cel-cso/taxol nps纳米药物成功逆转了乳腺癌肿瘤细胞的耐药性,但纳米药物的效果更好。
62.图7-c为mcf-7与mcf-7/taxol细胞ic
50
值对比图(n=3),图7-d为taxol/cel-cso mix和cel-cso/taxol nps纳米药物对mcf-7/taxol细胞的逆转耐药指数值图,在mcf-7/taxol细胞中,由游离taxol、taxol/cel-cso mix物理共混及cel-cso/taxol nps纳米药物各自的ic
50
值,上述公式计算求得taxol/cel-cso mix物理共混及cel-cso/taxol nps纳米药物的逆转耐药指数分别为162.42和233.92,说明cel-cso/taxol nps纳米药物能更好的克服乳腺癌肿瘤细胞的耐药性。
63.3)cel-cso/taxol nps纳米药物对mcf-7和mcf-7/taxol细胞凋亡影响试验。
64.研究发现,紫杉醇可以通过抑制细胞内微管蛋白作用,使细胞dna损伤、染色体融合及分裂停止,进而诱导细胞凋亡。
65.采用流式细胞术fcm分别检测正常control(对照组)、游离taxol(1.5μg/ml)、cel-cso(celastrol浓度为3μg/ml)、taxol/cel-cso mix(taxol与celastrol浓度为1.5μg/ml和3μg/ml)及cel-cso/taxol nps(taxol与celastrol浓度为1.5μg/ml和3μg/ml)纳米药物各给药组对正常乳腺癌细胞mcf-7及其乳腺癌耐药细胞mcf-7/taxol的细胞凋亡诱导情况,并采用ao单独染色法,用激光共聚焦显微镜clsm观察各组药物对mcf-7/taxol细胞凋亡镜下形态变化的影响。
66.在流式细胞仪上测定其fitc、pi的荧光强度,并用cytexprt软件分析各给药组细胞凋亡的情况。ao染色法染色结果:正常细胞被均匀染成绿色荧光;凋亡细胞则胞质内出现染色质固缩,细胞核碎裂成点状,被染成大小不一、致密浓染的黄绿色颗粒或见胞质芽状突起。
67.检测结果如图8和表1、表2所示,其中图8-a~图8-c为各不同给药组对mcf-7及mcf-7/taxol细胞凋亡的诱导作用和定量分析图(n=3),采用annexin v-fitc/pi双染色法评价mcf-7和mfc-7/taxol细胞凋亡率。
68.表1为cel-cso/taxol nps纳米药物对mcf-7细胞的凋亡影响表
[0069][0070]
表1为cel-cso/taxol nps纳米药物对mcf-7/taxol细胞的凋亡影响表
[0071][0072][0073]
与正常组相比较,**p《0.01,***p《0.001,与taxol组相比较,#p《0.05,##p《0.01,###p《0.01。
[0074]
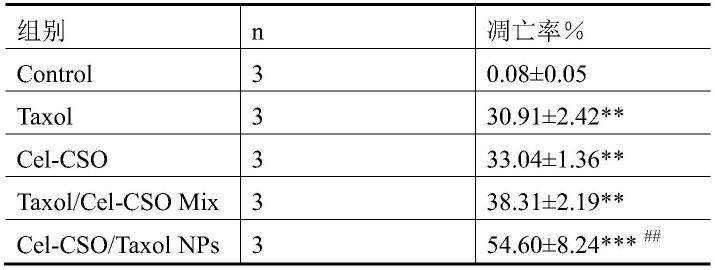
各给药组作用24h后,mcf-7细胞的凋亡率分别为(30.91
±
2.42)%、(33.04
±
1.36)%、(38.31
±
2.19)%和(54.60
±
8.24)%,而mcf-7/taxol细胞的凋亡率分别为(23.08
±
3.09)%、(31.17
±
1.25)%、(46.38
±
0.80)%和(69.11
±
0.89)%;不含任何药物的细胞作为正常对照组;与正常组相比,其他各给药组促进mcf-7和mcf-7/taxol细胞的凋亡水平逐渐升高(p<0.01);相比与其他个给药组,cel-cso/taxol nps纳米药物在相同浓度下促进mcf-7和mcf-7/taxol细胞的凋亡水平明显升高(p<0.05)。
[0075]
图8-d为ao染色法镜下观察各组药物对mcf-7/taxol细胞的凋亡情况图(比例尺:20μm),在mcf-7/taxol细胞中,无药物作用下,正常细胞形态均一,且被均匀染成绿色荧光;随着各组药物加入后,与其他各给药组相比,cel-cso/taxol nps纳米药物镜下呈现出更多的凋亡细胞,胞质内出现染色质固缩,细胞核碎裂成点状,被染成大小不一、致密浓染的黄绿色颗粒或见胞质芽状突起,这表明cel-cso/taxol nps纳米药物诱导细胞凋亡程度越明显,对克服乳腺癌肿瘤细胞的耐药性就越强。
[0076]
4)cel-cso/taxol nps纳米药物在mcf-7和mcf-7/taxol细胞内的摄取及分布情况试验。
[0077]
采用激光共聚焦显微镜clsm分别观察cel-cso/taxol nps(taxol与celastrol浓度为1.5μg/ml和3μg/ml)纳米药物经正常乳腺癌细胞mcf-7及其耐药乳腺癌细胞mcf-7/taxol中cel-cso/taxol nps纳米药物携载化疗药物taxol的入胞及其细胞内的分布情况,初步评价cel-cso/taxol nps纳米药物对p-gp外排功能的抑制。
[0078]
mcf-7/taxol细胞的主要耐药机制是p-gp的过度表达,作为经典的abc转运蛋白,p-gp可以通过atp供能将多种抗癌药物(如taxol)顺利排出体外。由于紫杉醇taxol自身不带荧光,于是采用带有绿色荧光的香豆素-6(coumarin-6)来代替紫杉醇taxol,根据第一部分纳米药物制备的方法同样来制备cel-cso/coumarin-6nps纳米药物,经过24h细胞贴壁后,用含有cel-cso/coumarin-6nps纳米药物(coumarin-6与celastrol浓度为1.5μg/ml和3μg/ml)的培养基来处理mcf-7和mcf-7/taxol细胞,激光共聚焦显微镜下观察coumarin-6本身的绿色荧光,同时观察细胞核被染成的蓝色荧光,以此模拟coumarin-6判断紫杉醇taxol的入胞及入核情况。
[0079]
检测结果如图9所示,其中图9-a为cel-cso/taxol nps纳米药物作用mcf-7细胞10min、1h及4h后的摄取情况图(n=3,比例尺:10μm),图9-b为cel-cso/taxol nps纳米药物作用mcf-7/taxol细胞10min、1h及4h后的摄取情况图(n=3,比例尺:10μm);可见mcf-7和
mcf-7/taxol细胞核被dapi染色呈蓝色,当培养时间从10min延长到4h时,香豆素-6的荧光强度逐渐递增,且这种绿色荧光在细胞质中均可见;mcf-7/taxol细胞核中的绿色荧光在4h时最多,但大部分依旧聚集在胞质中。上述结果表明,cel-cso/taxol nps纳米药物可被mcf-7/taxol和mcf-7细胞内化,转化为有效的抗乳腺癌药物分子。
[0080]
5)cel-cso/taxol nps纳米药物对mcf-7/taxol细胞内活性氧ros产生的影响试验。
[0081]
癌细胞中ros的产生和迅速积累是造成细胞死亡的主要原因之一。研究发现,雷公藤红素能够通过ros依赖性机制来显著增加细胞质和线粒体中的ros含量,进而诱导细胞凋亡、dna损伤和细胞周期停滞。由于dcfh-da作为荧光探针可定位细胞中ros的产生,因此采用荧光探针法观察各给药组对乳腺癌耐药细胞mcf-7/taxol中活性氧ros生成效率的影响;再次利用细胞免疫荧光技术检测mcf-7/taxol细胞膜上或中p-糖蛋白p-gp的分布情况;
[0082]
采用激光共聚焦显微镜clsm分别观察对照和各给药组诱导mcf-7/taxol细胞内活性氧自由基(ros)的产生情况。激光共聚焦显微镜下,观察药物作用后细胞内dcf的荧光强度,进而判断细胞内ros的产量(使用488nm激发波长,525nm发射波长,实时或逐时间点检测刺激前后荧光的强弱。此外dcf的荧光光谱与fitc极为相似,可以用fitc的参数来设置检测dcf)。
[0083]
检测结果如图10所示,mcf-7/taxol细胞分别与游离taxol、cel-cso、taxol/cel-cso mix及cel-cso/taxol nps纳米药物组孵育12h后,观察正常组和taxol组基本无绿色荧光,说明细胞中ros产生较少;然而随着cel-cso加入,发现cel-cso、taxol/cel-cso mix及cel-cso/taxol nps纳米药物组的绿色荧光逐渐增强,说明细胞中ros水平也在不断增加,尤其在cel-cso/taxol nps纳米药物组中ros水平增加的最为明显。以上结果表明,cel-cso的加入能够显著增加细胞中ros的产生,以此加速细胞的氧损伤及死亡。
[0084]
6)cel-cso/taxol nps纳米药物对mcf-7/taxol细胞的伤口愈合能力影响试验。
[0085]
采用wound assay检测细胞的伤口愈合能力,并利用倒置显微镜分别观察对照和各给药组对mcf-7/taxol细胞伤口愈合能力的影响;用image j软件测定出各组细胞的伤口面积,根据公式计算出伤口愈合率:伤口愈合率(%)=(初始伤口面积-各时间点伤口面积)/初始伤口面积
×
100%。
[0086]
检测结果如图11所示,其中图11-a为各不同给药组对mcf-7/taxol细胞12h和24h后伤口愈合能力的情况图(
×
200),图11-b为对mcf-7/taxol细胞12h和24h后的伤口愈合能力的定量分析图(n=3);正常组细胞在12h和24h伤口愈合率分别为(16.33
±
2.13)%和(37.69
±
3.90)%,taxol组细胞在12h和24h伤口愈合率分别为(14.12
±
1.32)%和(24.05
±
1.15)%,说明taxol组细胞的伤口愈合能力受药物影响不大,具有明显的耐药性;而与其他各给药组相比,cel-cso/taxol nps纳米药物组对mcf-7/taxol细胞伤口愈合抑制作用最强,该组在12h和24h伤口愈合率仅分别为-(16.44
±
2.67)%和-(25.05
±
2.05)%。以上结果表明,该纳米药物不仅明显抑制了细胞的伤口愈合能力,还逆转了乳腺癌细胞的耐药性。
[0087]
7)cel-cso/taxol nps纳米药物对mcf-7/taxol细胞迁移能力的影响试验。
[0088]
肿瘤细胞的侵袭和迁移常出现在恶性耐药肿瘤中,抑制肿瘤细胞侵袭和迁移是保证患者预后的关键因素。采用transwell小室法检测细胞的迁移能力,并利用倒置显微镜分
xl,它们能通过激活线粒体后的caspase级联反应来改变线粒体膜通透性,触发cyto-c或caspase的释放,导致细胞凋亡。抗凋亡蛋白如bcl-xl和bcl-2,通过阻止线粒体释放cyto-c来刺激细胞存活,而促凋亡蛋白如bax和bad,诱导细胞内线粒体释放cyto-c,促使caspase级联反应来诱导细胞凋亡。bcl-2不仅能抑制线粒体外膜通透性,也是一种抑制细胞凋亡的癌基因,在肿瘤的多药耐药中一直过表达;bcl-2的过度表达通常会导致癌细胞对癌症因子产生耐药性,这与pi3k/akt通路的异常变化有关。
[0098]
采用western blotting细胞免疫荧光法来分别检测对照和各给药组对mcf-7/taxol细胞中凋亡相关蛋白p-gp表达情况,并采用激光共聚焦显微镜clsm观察验证cel-cso/taxol nps纳米药物对pi3k/akt/nf-κb异常激活介导凋亡相关蛋白表达的影响结果。
[0099]
检测结果如图14所示,其中图14-a为wb法检测mcf-7/taxol细胞中凋亡相关蛋白条带图,图14-b为对凋亡相关蛋白的定量分析图(n=3);与其它各给药组相比,cel-cso/taxol nps纳米药物组中促凋亡蛋白bax、cyto-c、cleaved-caspase-9及cleaved-caspase-3表达显著增加,而抗凋亡蛋白bcl-2明显受到抑制,说明cel-cso/taxol nps纳米药物在细胞中持续释放的celastrol和taxol可能通过pi3k/akt/nf-κb信号通路介导或者激活内源性凋亡途径(线粒体凋亡途径)促使线粒体损伤,进而释放cyto-c并激活caspase级联反应,诱导乳腺癌耐药细胞凋亡,以克服乳腺癌肿瘤细胞的耐药性。
[0100]
10)cel-cso/taxol nps纳米药物对ros/pi3k/akt/nf-κb/hif-1α通路的影响检测。
[0101]
研究发现,akt活化引起hif-1α高表达后,启动了对癌细胞中ros的降解,而抑制hif-1α的表达后,可导致ros累积。
[0102]
检测结果如图15所示,其中图15-a、图15-b为wb法检测mcf-7/taxol细胞中ros/pi3k/akt/nf-κb/hif-1α通路相关蛋白条带图,图15-c为对各给药组通路相关蛋白的定量分析(n=3);经过对照和各给药组作用mcf-7/taxol细胞24h后,发现与其它给药组相比,taxol/cel-cso mix及cel-cso/taxol nps纳米药物组均能显著抑制细胞中hif-1α的表达,但cel-cso/taxol nps纳米药物组对hif-1α的抑制更明显,说明cel-cso/taxol nps纳米药物在细胞中释放的雷公藤红素通过ros依赖性机制显著增加细胞质和线粒体中的ros含量,进而引起的dna损伤及癌细胞凋亡与抑制hif-1α有关,这也与对mcf-7/taxol细胞内ros的检测结果相一致。以上结果表明,cel-cso/taxolnps纳米药物中的雷公藤红素能通过抑制hif-1α表达,导致细胞中ros持续累积,进而引起dna损伤及癌细胞凋亡。
[0103]
为验证cel-cso/taxol nps纳米药物通过ros/pi3k/akt/nf-κb/hif-1α通路异常活化,对多药耐药相关蛋白p-gp、缺氧诱导因子-1α(hif-1α),以及对内源性凋亡途径(即线粒体凋亡途径)的影响,采用wb技术来分别检测对照和各给药组对mcf-7/taxol细胞中通路相关蛋白pi3k、akt、p-akt及nf-κb的表达情况。
[0104]
由图15-b为对各给药组通路相关蛋白的定量分析图(n=3)和图15-c所示,经各给药物组处理mcf-7/taxol细胞24h后,与其它给药组相比,taxol/cel-cso mix及cel-cso/taxol nps纳米药物组均能显著抑制通路相关蛋白pi3k、akt、p-akt及nf-κb的表达,但cel-cso/taxol nps纳米药物组的治疗效果更明显。以上结果表明,该纳米药物能通过阻断ros/pi3k/akt/nf-κb/hif-1α通路抑制多药耐药相关蛋白p-gp、缺氧诱导因子-1α(hif-1α)表达,以及介导或者激活内源性凋亡途径(即线粒体凋亡途径)来逆转乳腺癌肿瘤细胞的耐药
性,以此增强cel-cso/taxol nps纳米药物中celastrol和taxol协同诱导的细胞凋亡,这也与8)和9)的实验结果相一致。
[0105]
综合上述试验结果,表明由本发明制备得到的cel-cso/taxol nps纳米药物可以显著逆转乳腺癌mcf-7/taxol细胞的耐药性,表现为诱导癌细胞凋亡抑制其增殖、抑制较高的耐药细胞毒性和抑制癌细胞侵袭及转移。
[0106]
本发明制备的cel-cso/taxol nps纳米药物可通过几种不同的机制对mcf-7/taxol细胞进行逆转耐药:
[0107]
1)通过阻断pi3k/akt/nf-κb途径抑制p-gp蛋白表达,减少药物外排,明显改善taxol在mcf-7/taxol细胞内的累积,使得乳腺癌耐药细胞对化疗药物更敏感;
[0108]
2)通过阻止ros/pi3k/akt/hif-1α的活化,抑制hif-1α蛋白表达,导致胞内ros积累,促使乳腺癌耐药肿瘤细胞发生氧损伤及凋亡;
[0109]
3)通过pi3k/akt/nf-κb信号通路介导或者激活内源性凋亡途径(线粒体凋亡途径),促使线粒体损伤,进而释放cyto-c并激活caspase级联反应,诱导乳腺癌耐药细胞凋亡,以克服乳腺癌肿瘤细胞的耐药性。
[0110]
通过各实验组的细胞体外实验,表明本发明制备的cel-cso/taxol nps纳米药物中的celastrol和taxol对mcf-7/taxol的逆转耐药性具有协同作用。
[0111]
以上所述,仅用以说明本发明的技术方案而非限制,本领域普通技术人员对本发明的技术方案所做的其他修改或者等同替换,只要不脱离本发明技术方案的精神和范围,均应涵盖在本发明的权利要求范围当中。
再多了解一些
本文用于创业者技术爱好者查询,仅供学习研究,如用于商业用途,请联系技术所有人。