一种合成n-取代-α
,
β-二氨基酸酯的方法
技术领域
1.本发明属于有机合成技术领域,具体涉及一种基于n,o-缩醛类化合物合成n-取代-α,β-二氨基酸酯的方法。
背景技术:
2.α,β-二氨基酸酯类化合物是一类重要的有机分子,是许多生物活性物质的关键结构单元。在天然产物,如含羞草和金合欢种子中α,β-二氨基酸酯是含量较高的分子成分(phytochemistry 1977, 16, 565.);还可作为血管紧张素转换酶(ace)抑制剂依那普利的类似物被附以药用价值(j. med. chem. 1985, 28, 434.)等。
3.α,β-二氨基酸酯的结构复杂,具有两个相邻的含氮手性中心,通过普适方法合成较为困难,尤其是特定对映体的合成。在此背景下,已有的α,β-二氨基酸酯合成方法如:通过在酸性条件下氧化甲醇取代的咪唑啉合成α,β-二氨基酯(collect. czech. chem.commun. 2000, 65, 1580.);通过还原亚氨基酯与硝基化合物反应生成的β-硝基-α-氨基酸,从而得到α,β-二氨基酯(j. am. chem. soc. 2001, 123, 5843.)但合成成本较高。因此,发明一种经济实用的α,β-二氨基酯的合成方法具有重要研究价值。
技术实现要素:
4.本发明合成的n-取代-α,β-二氨基酸不仅是许多生物活性分子的核心骨架,也是有机合成中的重要合成子。因此,拓展新型α,β-二氨基酸衍生物的类型,实现生物活性分子的高效合成具有重要研究意义。
5.为了实现上述目的,本发明提供了一种n-取代-α,β-二氨基酸酯类化合物的合成方法,所述n-取代-α,β-二氨基酸酯类化合物具有式ⅰ所示结构:。
6.其中,r1选自饱和烷基、芳基、取代芳基、吲哚基的任意一种。
7.r2选自芳基、取代芳基、萘基中的任意一种。
8.r3、r4选自苄基、取代苄基、烷基、氢中相同或不同的任意两种。
9.r5选自甲基、乙基、异丙基、环己基、苄基、丁烯基、丁炔基、氢的任意一种。
10.所述取代芳基、取代苄基的取代基为卤素原子、氰基、烷氧基、饱和烷基的任意一种。
11.该方法包括:氮气保护下,向干燥反应器中依次加入吖内酯、n-o缩醛、醇类、碱以及溶剂,一定温度下搅拌至反应完毕,经柱层析分离可得到n-取代-α,β-氨基酸酯类化合
物,其化学过程见反应式ⅱ: 。
12.所述碱选自碳酸钾、碳酸锂、碳酸银、碳酸铯、碳酸钠
、
碳酸氢钠、吡啶、三乙胺、四氢吡咯、四甲基胍、三氟乙酸、二异丙胺、4-二甲氨基吡啶、2,2,6,6-四甲基哌啶、1,4-二氮杂二环[2.2.2]辛烷、1,8-二氮杂双环(5.4.0)十一-7-烯中任意不同的一种。
[0013]
所述溶剂选自甲苯、甲醇、乙腈、二甲醚、二乙醚、二氯甲烷、四氢呋喃、甲基叔丁基醚中的任意不同的一种。
[0014]
所述醇类选自甲醇、乙醇、异丙醇、环己醇、苯甲醇、3-丁烯-1-醇、3-丁炔-1-醇中的任意一种。
[0015]
所述的n-o缩醛、吖内酯、路易斯碱、醇类的摩尔比为1.0:(2/3-1.5):0.1。
[0016]
反应时间为24-48h。
[0017]
反应温度为35-60℃。
[0018]
在反应后用石油醚和乙酸乙酯的混合溶剂进行柱层析分离。
[0019]
本发明的有益效果为:本发明提供了一种n-取代α,β-氨基酸酯类化合物的合成方法科学合理,具有收率高、底物适用面广、操作简单、后处理方便等优点。
附图说明
[0020]
图1为实施例1的1h nmr图谱;图2为实施例1的
13
c nmr图谱;图3为实施例1的
19
f nmr图谱。
[0021]
图4为实施例2的1h nmr图谱;图5为实施例2的
13
c nmr图谱。
[0022]
图6为实施例3的1h nmr图谱;图7为实施例3的
13
c nmr图谱。
[0023]
图8为实施例4的1h nmr图谱;图9为实施例4的
13
c nmr图谱。
[0024]
图10为实施例5的1h nmr图谱;图11为实施例5的
13
c nmr图谱。
[0025]
图12为实施例6的1h nmr图谱;图13为实施例6的
13
c nmr图谱。
具体实施方式
[0026]
在本文中通过具体实施例对本发明的方法进行说明,但本发明并不局限于此,在本发明的技术构思范围内,进行任何的修改、等同替换和改进等,均应包括在本发明的保护范围之内。
[0027]
实例1:反应方程式如下:
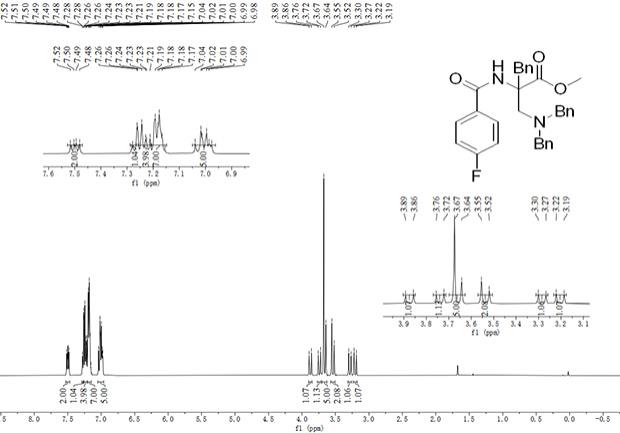
12.0, 3.5 hz, 1h), 5.00 (dd, j = 12.0, 3.5 hz, 1h), 3.87 (dd, j = 14.1, 3.0 hz, 1h), 3.70 (dd, j = 13.5, 3.0 hz, 1h), 3.61
ꢀ–ꢀ
3.47 (m, 4h), 3.33 (dd, j = 13.7, 2.6 hz, 1h), 3.19 (dd, j = 14.1, 2.9 hz, 1h).。
[0043]
13
c nmr (101 mhz, cdcl3) δ 173.04, 167.56, 138.54, 135.80, 135.28, 134.74, 131.28, 130.02, 129.07, 128.61, 128.58, 128.43, 128.22, 128.06, 126.91, 126.88, 126.67, 67.84, 66.58, 58.47, 57.78, 38.04.。
[0044]
实例5:反应方程式如下: 。
[0045]
氮气保护下,将化合物1d(0.12mmol)、2b(0.1mmol)、四氢吡咯(0.7mg,10mol%)加入干燥的反应器中,再加入无水甲醇(0.1ml)和甲基叔丁基醚(0.9ml),60℃下搅拌至反应结束。完成反应后,用旋转蒸发仪浓缩反应液得到粗产品。用石油醚和乙酸乙酯40:1的混合液柱层析分离,得到纯3db,产率为85%。
[0046]
3db的核磁数据如下:1h nmr (400 mhz, cdcl3) δ 7.71
ꢀ–ꢀ
7.66 (m, 2h), 7.48 (td, j = 6.2, 5.2, 3.1 hz, 1h), 7.41 (t, j = 7.4 hz, 2h), 7.21
ꢀ–ꢀ
7.14 (m, 3h), 7.07 (dd, j = 7.1, 2.4 hz, 2h), 3.82 (s, 3h), 3.77 (d, j = 13.5 hz, 1h), 3.65 (d, j = 14.1 hz, 1h), 3.30 (d, j = 13.5 hz, 1h), 2.95 (d, j = 14.1 hz, 1h), 2.52 (q, j = 7.1 hz, 4h), 0.88 (t, j = 7.1 hz, 6h).。
[0047]
13
c nmr (101 mhz, cdcl3) δ 173.74, 167.40, 136.21, 135.68, 131.28, 129.90, 128.55, 128.12, 126.79, 126.71, 66.98, 57.31, 52.38, 47.85, 37.93, 11.73.。
[0048]
实例6:反应方程式如下: 。
[0049]
氮气保护下,将化合物1d(0.12mmol)、2c(0.1mmol)、四氢吡咯(0.7mg,10mol%)加入干燥的反应器中,再加入无水甲醇(0.1ml)和甲基叔丁基醚(0.9ml),60℃下搅拌至反应结束。完成反应后,用旋转蒸发仪浓缩反应液得到粗产品。用石油醚和乙酸乙酯40:1的混合液柱层析分离,得到纯3dc,产率为95%。
[0050]
3dc的核磁数据如下:1h nmr (400 mhz, cdcl3) δ 7.56
ꢀ–ꢀ
7.50 (m, 2h), 7.49
ꢀ–ꢀ
7.44 (m, 1h), 7.37 (t, j = 7.6 hz, 2h), 7.30
ꢀ–ꢀ
7.27 (m, 1h), 7.23 (d, j = 7.0 hz, 2h), 7.18 (dd, j = 7.6, 5.3 hz, 6h), 7.15
ꢀ–ꢀ
7.09 (m, 3h), 7.00 (dd, j = 6.4, 3.0 hz, 2h), 3.95 (d, j = 14.1 hz, 1h), 3.80 (d, j = 13.5 hz, 1h), 3.66 (d, j = 9.4 hz, 5h), 3.50 (dd, j = 14.0, 7.0 hz, 2h), 3.24
ꢀ–ꢀ
3.15 (m, 2h).。
[0051]
13
c nmr (101 mhz, cdcl3) δ 173.50, 167.41, 138.43, 137.36, 135.80, 135.09, 132.64, 131.46, 130.32, 129.81, 129.12, 128.53, 128.35, 128.32, 128.21, 127.09, 126.85, 126.80, 67.09, 58.89, 58.09, 57.45, 52.60, 50.19, 38.01.。
[0052]
由上述实例可以看出,按照本发明所述,可以对n-取代-α,β-二氨基酸酯类化合物进行多样化高效合成。
再多了解一些
本文用于创业者技术爱好者查询,仅供学习研究,如用于商业用途,请联系技术所有人。