1.本发明涉及一种用于杀死肿瘤细胞的医药品,其包含与肿瘤细胞表面的靶标物质结合的物质和细胞毒素的结合物、以及他拉泊芬钠(talaporfin sodium)、卟吩姆钠(porfimer sodium)或维替泊芬(verteporfin)。
背景技术:
2.在日本国内因癌症而死亡的人一年多达37万人,自1981年以来持续成为死因的第一位。目前为止,日本国内外开发了对于众多癌症的治疗方法,但有效药物尚未出现。
3.虽然开发了所谓的低分子的抗癌剂(癌症化学疗法),但不仅药效并不总是很强,而且因强烈副作用给患者造成的痛苦大,并不能说是理想的医药品。抗体药物由于对癌症的特异性强的特征,能够减轻在低分子抗癌剂中观察到的强烈副作用,从而被广泛使用,但对实体癌有效的抗体药物的数量很少。为了强化药效,开发了adc(抗体药物复合体),但包括毒性方面在内尚未达到令人满意的要求。
4.另外,作为新型抗体药物的免疫治疗抗体(检查点抑制剂)以新的机理对广泛的癌症种类显示强的药效,但是,已知有效的患者并不是很多,且根据情况显示出甚至死亡的剧烈的副作用。
5.另一方面,从治疗部位局限化、减轻副作用的考虑出发,开发了pdt(photo dynamic therapy:光动力疗法)。pdt通过对患处照射使聚集于肿瘤部位的光敏色素活化的波长的光进行治疗的方法,在肺癌等中显示了一定的效果,但不能说获得了令人满意的药效。
技术实现要素:
6.发明所要解决的技术问题
7.在这样的状况下,本发明的发明人感到开发副作用小、药效强的医药品的必要性,从而完成了本开发。本发明将提供副作用小的用于杀死肿瘤细胞的医药品作为所要解决的技术问题。
8.用于解决技术问题的技术方案
9.pdt是使增感色素聚集于肿瘤组织,对其照射光,由此破坏肿瘤细胞的方法。作为pdt中使用的增感色素,已知有他拉泊芬钠(talaporfin sodium)、卟吩姆钠(porfimer sodium)或维替泊芬(verteporfin)等水溶性高、肿瘤聚集性高的增感色素,均已经用于肺癌等的治疗。pdt是侵袭性小的治疗方法,但存在药效并不一定能满足要求的缺点。
10.pci(photochemicalinternalization,光化学内化法)是通过使光增感剂聚集于核内体膜并对其照射光而破坏核内体膜的方法。可以认为,由此,将被封入核内体膜内的抗癌剂、免疫毒素释放到细胞质内,将肿瘤细胞破坏。出于聚集于核内体膜的目的,pci的色素与pdt不同,使用磺化四苯基卟吩(tpcs2a)、铝酞菁(alpcs2a)等两亲性的光增感剂。
11.然而,两亲性的磺化四苯基卟吩(tpcs2a)、铝酞菁(alpcs2a)担心存在:(1)担心神
经毒性;(2)集聚于核内体膜以外的细胞膜而产生细胞损伤性;(3)肿瘤聚集性低,产生非特异性副作用等缺点。
12.为了解决目前为止的问题,我们进行了深入努力,结果发现,水溶性高的他拉泊芬钠、卟吩姆钠或维替泊芬存在低浓度时提高核内体膜的透过性的无法预料的效果。进而发现通过将与肿瘤细胞表面的靶标物质结合的物质和细胞毒素的结合物、以及他拉泊芬钠、卟吩姆钠或维替泊芬组合,能够显著强化细胞损伤性和肿瘤特异性,从而完成了本发明。
13.根据本发明,提供以下的发明。
14.<1>一种用于杀死肿瘤细胞的医药品,其包含:
15.与肿瘤细胞表面的靶标物质结合的物质和细胞毒素的结合物;和
16.他拉泊芬钠、卟吩姆钠或维替泊芬。
17.<2>如<1>所述的医药品,其中,与肿瘤细胞表面的靶标物质结合的物质为抗体、抗体片段、配体或肽。
18.<3>如<1>或<2>所述的医药品,其中,细胞毒素为皂草素(saporin)、白树毒素(gelonin)或绿脓杆菌外毒素。
19.<4>如<1>至<3>中任一项所述的医药品,其中,肿瘤细胞为在细胞表面表达有表皮生长因子受体(epidermal growth factor receptor,egfr,erbb1、erbb2、erbb3、erbb4)、间皮素(mesothelin)、肝配蛋白a型受体2(ephrin type-a receptor 2,epha2)、磷脂酰肌醇蛋白聚糖3(glypican 3,gpc3)、钙黏蛋白17(cadherin 17,cdh17)、或环形交叉轴突导向受体同源物1(roundabout homolog 1,robo1)的细胞。
20.<5>如<1>至<4>中任一项所述的医药品,其中,肿瘤细胞为头颈癌、肺癌、肝癌、大肠癌、皮肤癌、食管癌、胃癌、宫颈癌、子宫内膜癌、间皮瘤、脑肿瘤、恶性黑色素瘤、乳腺癌、胆管癌、胰腺癌、卵巢癌、肾癌、膀胱癌、前列腺癌或恶性淋巴瘤、骨肉瘤的任意癌细胞。
21.<6>如<1>至<5>中任一项所述的医药品,其通过如下工序杀死肿瘤细胞:
22.(1)使上述结合物与肿瘤细胞接触的工序;
23.(2)使他拉泊芬钠、卟吩姆钠或维替泊芬与上述肿瘤细胞接触的工序;和
24.(3)通过以对活化他拉泊芬钠、卟吩姆钠或维替泊芬有效的波长照射上述肿瘤细胞,从而杀死上述细胞的工序。
25.<7>如<1>至<5>中任一项所述的医药品,其通过如下工序杀死肿瘤细胞:
26.(1)使他拉泊芬钠、卟吩姆钠或维替泊芬与肿瘤细胞接触的工序;
27.(2)使上述结合物与上述肿瘤细胞接触的工序;和
28.(3)通过以对活化他拉泊芬钠、卟吩姆钠或维替泊芬有效的波长照射上述肿瘤细胞,从而杀死上述细胞的工序。
29.<8>如<1>至<5>中任一项所述的医药品,其通过如下工序杀死肿瘤细胞:
30.(1)使上述结合物与他拉泊芬钠、卟吩姆钠或维替泊芬接触肿瘤细胞的工序;和
31.(2)然后,通过以对活化他拉泊芬钠、卟吩姆钠或维替泊芬有效的波长照射上述肿瘤细胞,从而杀死上述细胞的工序。
32.<a>一种杀死肿瘤细胞的方法,其包括:
33.(1)使与肿瘤细胞表面的靶标物质结合的物质和细胞毒素的结合物接触肿瘤细胞
的工序;
34.(2)使他拉泊芬钠、卟吩姆钠或维替泊芬与上述肿瘤细胞接触的工序;和
35.(3)通过以对活化他拉泊芬钠、卟吩姆钠或维替泊芬有效的波长照射上述肿瘤细胞,杀死上述细胞的工序。
36.<b>一种杀死肿瘤细胞的方法,其包括:
37.(1)使与肿瘤细胞表面的靶标物质结合的物质和细胞毒素的结合物以及他拉泊芬钠、卟吩姆钠或维替泊芬与上述肿瘤细胞接触的工序;
38.(2)然后,通过以对活化他拉泊芬钠、卟吩姆钠或维替泊芬有效的波长照射上述肿瘤细胞,杀死上述细胞的工序。
39.发明的效果
40.根据本发明,能够提供副作用小的、用于杀死肿瘤细胞的医药品。
附图说明
41.图1表示a431细胞损伤性试验中的细胞存活率。
42.图2表示a549细胞损伤性试验中的细胞存活率。
43.图3表示mkk7细胞损伤试验中的细胞存活率。
44.图4表示mda-mb-453细胞损伤试验中的细胞存活率。
45.图5表示a431/pep-t细胞损伤试验中的细胞存活率。
46.图6表示a431/维替泊芬细胞损伤试验中的细胞存活率。
具体实施方式
47.以下,对本发明的实施方式进行详细说明。
48.<本发明的概要>
49.本发明的发明人研究了药效强且副作用小的肿瘤的治疗方法的结果,认为利用光的局部提高药效的pdt、pci的方法具有可能性。但是,pdt存在药效弱的缺点,pci的药效、毒性均无法令人满意。
50.因此,本发明的发明人进行深入努力,结果首次发现了作为水溶性的增感色素的他拉泊芬、卟吩姆钠或维替泊芬通过光照射使核内体的透过性提高。通过将该“色素”、“与肿瘤细胞表面的靶标物质结合的物质和细胞毒素的结合物”和“对肿瘤的光照射”组合,发现了药效强且副作用的风险小的治疗方法,从而完成了本发明。
51.即,在本发明中,与肿瘤细胞表面的靶标物质结合的物质和细胞毒素的结合物在与肿瘤结合后被内包于核内体。可以认为,对另外(或同时)添加的他拉泊芬钠、卟吩姆钠或维替泊芬照射光,使核内体内的免疫毒素(或其分解物)释放到细胞质内,能够将肿瘤细胞杀死。
52.他拉泊芬钠、卟吩姆钠和维替泊芬是水溶性的,具有两亲性的磺化四苯基卟吩(tpcs2a)、铝酞菁(alpcs2a)这样的定位于膜上引起的副作用的风险小的优点。进而,吸收波长为与血红蛋白的吸收波长不重复的664nm,因此光的到达深度也深。
53.<关于杀死细胞的方法的方式>
54.作为本发明中的杀死肿瘤细胞的方法,可以列举:在(1)与肿瘤细胞表面的靶标物
质结合的物质和细胞毒素的结合物、(2)以及他拉泊芬钠、卟吩姆钠或维替泊芬的共存在下,(3)照射使他拉泊芬钠、卟吩姆钠或维替泊芬活化的波长的光的方式。
55.作为更加具体的方式,也可以通过(1)在投予与肿瘤细胞表面的靶标物质结合的物质和细胞毒素的结合物后,(2)投予他拉泊芬钠、卟吩姆钠或维替泊芬,然后(3)照射使他拉泊芬钠、卟吩姆钠或维替泊芬活化的波长的光来实现。
56.作为另外的其它方式,也可以通过(1)在投予他拉泊芬钠、卟吩姆钠或维替泊芬后,(2)投予与肿瘤细胞表面的靶标物质结合的物质和细胞毒素的结合物,然后(3)照射使他拉泊芬钠、卟吩姆钠或维替泊芬活化的波长的光来实现。
57.另外,作为其它方式,也可以通过同时投予(1)与肿瘤细胞表面的靶标物质结合的物质和细胞毒素的结合物、以及(2)他拉泊芬钠、卟吩姆钠或维替泊芬,然后(3)照射使他拉泊芬钠、卟吩姆钠或维替泊芬活化的波长的光来实现。
58.<光敏色素>
59.在本发明中,使用他拉泊芬钠、卟吩姆钠或维替泊芬作为增感剂。
60.他拉泊芬钠也被称为laserphyrin、npe6、monoaspartyl chlorin e6,是pdt中使用的增感色素。
61.另外,作为其它方式,也可以使用卟吩姆钠(porfimer sodium)作为增感色素。卟吩姆钠是也被称为光敏素(photofrin)的pdt色素。
62.另外,作为其它方式,也可以使用维替泊芬(verteporfin)作为增感色素。维替泊芬是也被称为维速达尔(visudyne)的pdt色素。
63.<与肿瘤细胞表面的靶标物质结合的物质>
64.作为与肿瘤细胞表面的靶标物质结合的物质,可以列举抗体、抗体片段、配体、或肽等,但没有特别限定。
65.在作为与肿瘤细胞表面的靶标物质结合的物质使用抗体的情况下,可以使用与肿瘤细胞表面上的靶标物质(例如,表皮生长因子受体(egfr,erbb1、erbb2、erbb3、erbb4)、间皮素、肝配蛋白a型受体2(epha2)、磷脂酰肌醇蛋白聚糖3(gpc3)、钙黏蛋白17(cdh17)、钙黏蛋白3(cdh3)、环形交叉轴突导向受体同源物1(robo1)等蛋白质)特异性结合的抗体。
66.本发明中使用的抗体的种类没有特别限制,可以为小鼠抗体、人抗体、大鼠抗体、兔抗体、绵羊抗体、骆驼抗体、鸡抗体等、或以使对人的异种抗原性降低等为目的而人为改变的基因重组型抗体、例如嵌合抗体、人源化抗体等的任意一种。基因重组型抗体可以使用已知的方法来制造。嵌合抗体为包含人以外的哺乳动物、例如小鼠抗体的重链、轻链的可变区和人抗体的重链、轻链的恒定区的抗体,能够通过将编码小鼠抗体的可变区的dna与编码人抗体的恒定区的dna连结,将其整合到表达载体并导入宿主使其产生来获得。人源化抗体是将人以外的哺乳动物、例如小鼠抗体的互补决定区(cdr)移植到人抗体的互补决定区得到的,其通常的基因重组方法也是已知的。具体而言,由制作为具有与末端部重叠的部分的数个寡核苷酸通过pcr法合成以连结小鼠抗体的cdr与人抗体的框架区(framework region;fr)的方式设计的dna序列。将所得到的dna与编码人抗体恒定区的dna连结,接着,整合到表达载体,将其导入宿主使其产生来获得(ep239400号公报、国际公开wo96/02576号公报等)。
67.另外,人抗体的获得方法也是已知的。例如,将人淋巴细胞在体外(in vitro)用所
希望的抗原或表达所希望的抗原的细胞敏化,使敏化淋巴细胞与人骨髓瘤细胞、例如u266融合,也能够得到具有对抗原的结合活性的所希望的人抗体(参照日本特公平1-59878)。另外,能够通过将具有人抗体基因的全部谱系(repertoire)的转基因动物用所希望的抗原来免疫,能够获得所希望的人抗体(参照wo93/12227、wo92/03918、wo94/02602、wo94/25585、wo96/34096、wo96/33735)。进而,也已知使用人抗体文库通过筛选来获得人抗体的技术。例如,能够使人抗体的可变区作为单链抗体(scfv)通过噬菌体展示法在噬菌体的表面表达,选择与抗原结合的噬菌体。如果分析所选择的噬菌体的基因,则能够确定编码与抗原结合的人抗体的可变区的dna序列。得知与抗原结合的scfv的dna序列后,能够将该序列制作适当的表达载体,获得人抗体。这些方法已经是公知的,能够参考wo92/01047、wo92/20791、wo93/06213、wo93/11236、wo93/19172、wo95/01438、wo95/15388。
68.与肿瘤细胞结合的抗体优选为人源化或人抗体,但不限定于此。
69.另外,这些抗体只要不丧失识别由肿瘤细胞表面上的抗原基因编码的蛋白质的全长或一部分的特性即可,也可以为抗体片段(fragment)等的低分子化抗体或抗体的修饰物等。抗体的片段是指保持着与robo1的结合能力的抗体的部分。作为抗体片段的具体例,例如能够列举fab、fab’、f(ab’)2、fv、diabody、单链抗体片段(scfv)等。为了得到这样的抗体片段,构建编码这些抗体片段的基因,将其导入表达载体后,在适当的宿主细胞中使其表达即可。作为抗体的修饰物,也可以使用与聚乙二醇(peg)等各种分子结合的抗体。
70.编码单克隆抗体的dna能够通过惯用的方法(例如使用能够与编码单克隆抗体的重链和轻链的基因特异性结合的寡核苷酸探针)容易地分离、确定序列。杂交瘤细胞是这样的dna的优选的起始材料。一旦分离之后,能够将dna插入表达载体,重组到e.coli细胞、cos细胞、cho细胞或不转化就不产生免疫球蛋白的骨髓瘤细胞等宿主细胞,由重组宿主细胞产生单克隆抗体。
71.作为与肿瘤细胞表面的靶标物质结合的物质,能够使用配体。在肿瘤细胞表面上的靶标物质例如为表皮生长因子受体(egfr,erbb1、erbb2、erbb3、erbb4)、间皮素、肝配蛋白a型受体2(epha2)等受体的情况下,能够使用针对上述受体的配体。
72.作为与肿瘤细胞表面的靶标物质结合的物质,也能够使用肽。只要是本领域技术人员,就能够设计和制造与肿瘤细胞表面的靶标物质结合的肽。
73.<细胞毒素>
74.细胞毒素优选具有细胞毒性的蛋白质,但不限定于此,可以是博来霉素这样的合成或天然的具有抗癌作用的化合物、或adc中使用的化合物。
75.作为具有细胞毒性的蛋白质的优选方式,能够列举皂草素、白树毒素、绿脓杆菌外毒素、赖氨酸a链、脱糖链赖氨酸a链、核糖体失活蛋白质、α-箒曲菌素(α-sarcin)、曲霉素、局限曲霉素(restrictocin)、核糖核酸酶、表鬼臼毒素、白喉毒素、雪卡毒素及其突变体、基因重组体。
76.<与肿瘤细胞表面的靶标物质结合的物质和细胞毒素的结合物>
77.与肿瘤细胞表面的靶标物质结合的物质和细胞毒素必须直接或间接地结合。
78.在作为与肿瘤细胞表面的靶标物质结合的物质使用抗体或其片段的情况下,使其与细胞毒素直接化学结合的方法可以使用已知的adc(antibody drug conjugate;抗体药物复合体)中所用的结合方法。另外,在细胞毒素为蛋白质的情况下,也可以使用2官能性的
交联剂。
79.另外,在细胞毒素为蛋白质的情况下,也可以通过制成将毒素与抗体或其片段进行基因重组地融合而成的蛋白质,制作免疫毒素。
80.作为另外的其它方法,也可以使用将抗体或其片段与细胞毒素利用第二结合对间接结合的方法。作为第二结合对的例子,可以利用亲和素-生物素、抗体-半抗原等。
81.另外,在本发明中也可以代替抗体与毒素结合而成的免疫毒素,而使用与肿瘤细胞表面的靶标物质结合的肽或配体、和毒素的结合物。
82.<给药方法和给药量>
83.将本发明的医药品向具有肿瘤(例如癌症等)的受试体给药时的给药方法没有特别限定。
84.与肿瘤细胞表面的靶标物质结合的物质和细胞毒素的结合物例如能够通过静脉给药、动脉给药、肌肉内给药、皮下给药、皮内给药、腹腔内给药或口服给药来进行给药。另外,还有对肿瘤组织及其周边以局部注射、涂布、喷雾等的方式给药的方法。
85.他拉泊芬钠、卟吩姆钠或维替泊芬例如能够通过静脉给药、动脉给药、肌肉内给药、皮下给药、皮内给药、腹腔内给药或口服给药来进行给药。另外,还有对肿瘤组织及其周边以局部注射、涂布、喷雾等的方式给药等的方法。
86.与肿瘤细胞表面的靶标物质结合的物质和细胞毒素的结合的给药量没有特别限定,例如能够以1μg/体重kg~100mg/体重kg、优选以10μg/体重kg~10mg/体重kg给药。
87.他拉泊芬钠、卟吩姆钠或维替泊芬的给药量没有特别限定,例如能够以1μg/体重kg~100mg/体重kg、优选以10μg/体重kg~10mg/体重kg给药。
88.给药次数没有特别限定,能够进行1次以上到多次(1次到20次、优选1次到10次),例如每2~4周、或每1~2个月进行。另外,光照射次数也没有特别限定,可以进行1次以上到多次。
89.<作为对象的细胞、疾病>
90.作为本发明的医药品的给药对象的肿瘤是在表面表达有表皮生长因子受体(egfr,erbb1、erbb2、erbb3、erbb4)、间皮素、肝配蛋白a型受体2(epha2)、磷脂酰肌醇蛋白聚糖3(gpc3)、钙黏蛋白17(cdh17)、钙黏蛋白3(cdh3)、或环形交叉轴突导向受体同源物1(robo1)等的肿瘤。
91.具体而言,能够列举头颈癌、肺癌,肝癌、大肠癌、皮肤癌、食管癌、胃癌、宫颈癌、子宫内膜癌、间皮瘤、脑肿瘤、恶性黑色素瘤、乳腺癌、胆管癌、胰腺癌、卵巢癌、肾癌、膀胱癌、前列腺癌或恶性淋巴瘤、骨肉瘤等的癌症。
92.另外,本发明除了人类(人)的疾病的治疗以外,还可以用于狗、猫、马等的人以外的动物类的治疗。
93.实施例
94.实施例1:
95.<材料的获得>
96.作为egfr表达株,从株式会社kac(京都,日本)获得a431(源自人上皮样细胞癌的细胞系)。作为抗egfr抗体,从selleck biotech株式会社(东京,日本)获得cetuximab。作为光增感剂,从medchemexpress公司(新泽西州)购买他拉泊芬钠(talaporfin sodium)来使
用。由king do way(18pcs e27,amazon.co.jp)购买在650nm具有峰波长的led灯(54w)。
97.<细胞培养>
98.a431使用在dulbecco改良eagle培养基(dmem)的含高葡萄糖培养基中添加有10%胎牛血清的培养基,在37℃、co2浓度5%的条件下进行培养。
99.<免疫毒素制备>
100.将溶解于pbs(-)的cetuximab和溶解于超纯水的ez-link磺基-nhs-lc-生物素化试剂(thermo fisher scientific,马萨诸塞州)以成为1︰40的摩尔比的方式混合,使其反应后,使用pd spintrap g-25(ge healthcare life sciences,英国)进行纯化。将所得到的生物素化西妥昔单抗(cetuximab)和链霉亲和素-皂草素(streptavidin-saporin)(biotin-z internalization kit[kit-27-z],advanced targeting systems,加利福尼亚)逐次当量混合,在室温反应30分钟,由此得到加成了皂草素的西妥昔单抗(it-cetuximab)。
[0101]
<细胞损伤性试验>
[0102]
在96孔板将a431每1孔接种1.0
×
104个,培养过夜后,按照以下的3种条件,进行免疫毒素、光增感剂的添加和光照射,比较置于各条件下的细胞损伤的程度。
[0103]
条件1:仅添加0.006-4nm浓度的it-cetuximab
[0104]
条件2:添加0.006-4nm浓度的it-cetuximab和30μm的他拉泊芬钠
[0105]
条件3:在添加0.006-4nm浓度的it-cetuximab和30μm的他拉泊芬钠后进行光照射(650nm、37.6mj/cm2)
[0106]
按照各条件添加it-cetuximab和他拉泊芬钠,16小时后将细胞用pbs(-)清洗一次,新加入不添加药剂的培养基。对条件3的细胞组在4小时后进一步将650nm的光以成为37.6mj/cm2的方式进行光照射。
[0107]
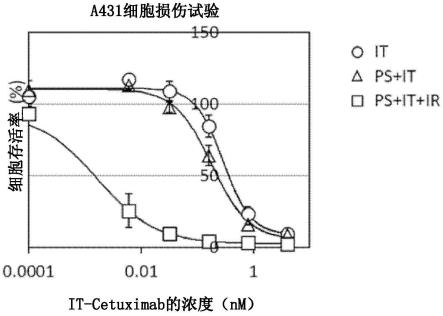
培养72小时后,在各孔中各添加10μl cck-8试剂盒溶液(cell counting kit-8,同仁化学研究所,日本),反应1小时到2小时后,测定各自的450nm的吸收。使用所得到的结果按照以下的计算式计算出细胞存活率(图1)。
[0108]
细胞存活率(%)=(a-c)/(b-c)
×
100
[0109]
其中,a表示各检体的吸光度,b表示不添加it的阴性对照检体的吸光度,并且c表示仅为培养基的吸光度。
[0110]
ec50值使用作为开源分析软件的imagej,拟合出sigmoid曲线,求出表示50%存活率的it-cetuximab浓度(表1)。
[0111]
<结果>
[0112]
对于a431细胞系,it-cetuximab确认到浓度依赖性细胞损伤活性,其50%效果浓度(ec50)为0.36nm。另外,在条件2的同时添加it-cetuximab和laserphyrin的组中,虽然具有对it-cetuximab的浓度依赖性活性,但其ec50为0.23nm,与条件1的结果相比几乎没有变化,没有观察到laserphyrin添加造成的影响。另一方面,在添加it-cetuximab和laserphyrin进而进行光照射的条件3中,细胞损伤活性显著增大,其ec50为1.5pm。
[0113]
[表1]
[0114]
it-cetuximab对a431的ec50
[0115] 条件ec50
条件1it-cetuximab0.36nm条件2it-cetuximab laserphyrin0.23nm条件3it-cetuximab laserphyrin 光照射1.5pm
[0116]
实施例2:
[0117]
<材料的获得>
[0118]
作为egfr表达株,从株式会社kac(京都,日本)获得a549(人肺癌细胞)。抗egfr抗体的cetuximab、光增感剂的他拉泊芬钠、在650nm具有峰波长的led灯与实施例1中使用的各者相同。
[0119]
<细胞培养>
[0120]
a549使用在dulbecco改良eagle培养基(dmem)的含高葡萄糖培养基添加有10%胎牛血清的培养基,在37℃、co2浓度5%的条件下进行培养。
[0121]
<免疫毒素制备>
[0122]
加成了皂草素的cetuximab(it-cetuximab)使用与实施例1中制成的产物相同的物质。
[0123]
<细胞损伤性试验>
[0124]
在96孔板将a549每1孔接种2.5
×
103个,培养过夜后,按照以下的3种条件,进行免疫毒素、光增感剂的添加和光照射,比较置于各条件下的细胞损伤的程度。
[0125]
条件1:仅添加0.006-4nm浓度的it-cetuximab
[0126]
条件2:添加0.006-4nm浓度的it-cetuximab和30μm的他拉泊芬钠
[0127]
条件3:添加0.006-4nm浓度的it-cetuximab和30μm的他拉泊芬钠后进行光照射(650nm、37.6mj/cm 2
)
[0128]
按照各条件,添加it-cetuximab和他拉泊芬钠,16小时后使用pbs(-)将细胞清洗一次,新加入不添加药剂的培养基。对条件3的细胞组在4小时后,将650nm的光以成为37.6mj/cm 2
的方式进行光照射。
[0129]
培养72小时后,在各孔中各添加10μl cck-8试剂盒溶液,反应1小时到2小时后,测定各自的450nm的吸收。通过与实施例1同样得到吸光度,由此计算细胞存活率(图2)和表示50%存活率的it-cetuximab浓度(表2)。
[0130]
<结果>
[0131]
对于a549细胞系,it-cetuximab确认到浓度依赖性细胞损伤活性,其50%效果浓度(ec50)为0.70nm。另外,在同时添加条件2的it-cetuximab和laserphyrin的组中,虽然具有对it-cetuximab的浓度依赖性活性,但其ec50为1.4nm,与条件1的结果相比几乎没有变化,没有观察到laserphyrin添加带来的影响。另一方面,在添加it-cetuximab和laserphyrin进而进行光照射的条件3下,细胞损伤活性明显增大,其ec50为6.9pm。
[0132]
[表2]
[0133]
it-cetuximab对a549的ec50
[0134] 条件ec50条件1it-cetuximab0.70nm条件2it-cetuximab laserphyrin1.4nm条件3it-cetuximab laserphyrin 光照射6.9pm
[0135]
实施例3:使用her2表达株(mkn7、mda-mb-453)、他拉泊芬钠、it-trastuzumab的细胞损伤试验
[0136]
<细胞培养>
[0137]
作为her2表达株,使用mkn7(人胃癌由来细胞)和mda-mb-453(人乳腺癌细胞)进行实验。mkn7使用在rpmi1640培养基中添加了10%胎牛血清的培养基,在37℃、co2浓度5%的条件下进行培养。另外,mda-mb-453使用在l-15培养基中添加了10%胎牛血清的培养基,在37℃、co2浓度0%的条件下进行培养。
[0138]
<免疫毒素制备>
[0139]
作为抗her2抗体使用曲妥珠单抗(trastuzumab)(selleck biotech株式会社),利用与实施例1的免疫毒素制备方法同样的手法,得到了加成了皂草素的曲妥珠单抗(it-trastuzumab)。
[0140]
<细胞损伤性试验>
[0141]
在96孔板中将mkn7和mda-mb-453在每1孔中接种1
×
104个,培养过夜后,按照以下的3种条件,进行免疫毒素、光增感剂的添加和光照射,比较置于各条件下的细胞损伤的程度。
[0142]
条件1:仅添加0.032-20nm浓度的it-trastuzumab
[0143]
条件2:添加0.032-20nm的it-trastuzumab和20μm的他拉泊芬钠
[0144]
条件3:添加0.032-20nm浓度的it-trastuzumab和20μm的他拉泊芬钠后,进行光照射(650nm、37.6j/cm2)
[0145]
按照各条件,添加it-trastuzumab和他拉泊芬钠,16小时后将细胞利用pbs(-)清洗一次,新加入不添加药剂的培养基。对条件3的细胞组进一步在4小时后,以650nm的光成为37.6j/cm2的方式进行光照射。
[0146]
培养72小时后,在各孔中各添加10μl cck-8试剂盒溶液,反应1小时到2小时后,测定各自的450nm的吸收。利用与实施例1同样得到吸光度,由此计算出细胞存活率(图3和图4)和表示50%存活率的it-trastuzumab浓度。
[0147]
<结果>
[0148]
对mkn7细胞系仅添加it-trastuzumab的组在本次添加的浓度范围(20nm以下)中基本没有观察到细胞损伤活性。另外,在条件2的同时添加it-trastuzumab和laserphyrin的组中,同样也没有观察到细胞损伤活性,没有看到laserphyrin添加造成的影响。而在添加it-trastuzumab和laserphyrin进而进行了光照射的条件3下,观察到了浓度依赖性的细胞损伤活性,其ec50为1.01nm。对于mda-mb-453细胞系同样仅在条件3下观察到了浓度依赖性的细胞损伤活性,其ec50为0.12nm。
[0149]
实施例4:使用egfr表达株(a431)、他拉泊芬钠、肽毒素(pep-t)的细胞损伤试验
[0150]
<细胞培养>
[0151]
作为egfr表达株使用a431进行了实验。a431的培养与实施例1同样使用在dulbecco改良eagle培养基(dmem)的含高葡萄糖培养基中添加了10%胎牛血清的培养基,在37℃、co2浓度5%的条件下进行培养。
[0152]
<肽-毒素的制备>
[0153]
作为与egfr结合的物质已知有肽分子。例如在2005年从噬菌体展示肽文库鉴定得
到的肽ge11(序列:yhwygytpqnvi)[li,z.et al.identification and characterization of a novel peptide ligand of epidermal growth factor receptor for targeted delivery of therapeutics.faseb j.2005,19,1978-1985.]、通过计算机设计发现的6-mer肽d4(序列:larllt)等[song,s.et al.novel peptide ligand directs liposomes toward egf-r high-expressing cancer cells in vitro and in vivo.faseb j.2009,23,1396-1404.]。在本发明中使用了ge11的类似物且确认了与egfr的结合的肽(序列:yhwygytpenvi)。
[0154]
该肽的c末端进行了生物素修饰的产物从cosmo bio株式会社购入,用于实验。将购入的生物素肽与streptavidin-saporin各以当量混合,在室温反应30分钟,由此得到了加成了皂草素的肽(pet-t)。
[0155]
<细胞损伤性试验>
[0156]
在96孔板将a431每1孔接种1
×
104个,培养过夜后,按照以下的3种条件,进行pep-t、光增感剂的添加和光照射,比较置于各条件下的细胞损伤的程度。
[0157]
条件1:仅添加0.032-20nm浓度的pep-t
[0158]
条件2:添加0.032-20nm浓度的pep-t和20μm的他拉泊芬钠
[0159]
条件3:添加0.032-20nm浓度的pep-t和20μm的他拉泊芬钠后进行光照射(650nm、37.6j/cm2)
[0160]
按照各条件添加pep-t和他拉泊芬钠,16小时后将细胞使用pbs(-)清洗一次,新加入不添加药剂的培养基。对条件3的细胞组进一步在4小时后以650nm的光成为37.6j/cm2的方式进行光照射。
[0161]
培养72小时后,在各孔中各添加10μl cck-8试剂盒溶液,反应1小时到2小时后,测定各自的450nm的吸收。利用与实施例1同样得到吸光度,由此计算出细胞存活率(图5)和表示50%存活率的pep-t浓度。
[0162]
<结果>
[0163]
对a431细胞系仅添加pep-t的组在本次添加的浓度范围(20nm以下)中基本没有观察到细胞损伤活性。另外,在条件2的同时添加了pep-t和laserphyrin的组中也同样没有观察到细胞损伤活性,没有观察到laserphyrin添加带来的影响。另一方面,在添加pep-t和laserphyrin且进一步进行了光照射的条件3中,观察到了浓度依赖性的细胞损伤活性,其ec50为0.70nm。
[0164]
实施例6:使用egfr表达株(a431)、维替泊芬(verteporfin)、it-cetuximab的细胞损伤试验
[0165]
<材料的获得>
[0166]
作为光增感剂的维替泊芬从cayman chemical公司(美国)获得。
[0167]
作为egfr表达株的a431、抗egfr抗体的西妥昔单抗、650nm具有峰波长的led灯使用与实施例1中使用的各者相同。
[0168]
<细胞培养>
[0169]
a431使用在dulbecco改良eagle培养基(dmem)的含高葡萄糖培养基中添加了10%胎牛血清的培养基,在37℃、co2浓度5%的条件下进行培养。
[0170]
<免疫毒素制备>
[0171]
加成了皂草素的西妥昔单抗(it-cetuximab)使用与实施例1中制成的it-cetuximab相同。
[0172]
<细胞损伤性试验>
[0173]
在96孔板中将a431每1孔接种1
×
104个,培养过夜后,按照以下的3种条件,进行免疫毒素、光增感剂的添加和光照射,比较置于各条件下的细胞损伤的程度。
[0174]
条件1:仅添加0.006-4nm浓度的it-cetuximab
[0175]
条件2:添加0.006-4nm浓度的it-cetuximab和0.7μm的维替泊芬
[0176]
条件3:添加0.006-4nm浓度的it-cetuximab和0.7μm的维替泊芬后进行光照射(650nm、2.82j/cm 2
)
[0177]
按照各条件添加it-cetuximab,其20小时后添加维替泊芬。进而在2小时后将细胞使用pbs(-)清洗一次,新加入不添加药剂的培养基。对条件3的细胞组以650nm的光成为2.82j/cm2的方式进行光照射。
[0178]
培养72小时后,在各孔中各加入10μl cck-8试剂盒溶液,反应1小时到2小时后,测定各自的450nm的吸收。利用与实施例1同样得到吸光度,由此计算出细胞存活率(图6)和表示50%存活率的it-cetuximab浓度。
[0179]
<结果>
[0180]
对于a431细胞系,it-cetuximab确认到了浓度依赖性的细胞损伤活性。另外,在条件2的同时添加了it-cetuximab和维替泊芬的组中,观察到了对it-cetuximab的浓度依赖性的损伤活性,其ec50为0.3nm。与添加了it-cetuximab单体的情况相比,通过添加维替泊芬,可以观察到细胞损伤活性增加的倾向。进而在添加it-cetuximab和维替泊芬且进一步进行了光照射的条件3下,细胞损伤活性进一步增大,其ec50为0.05nm。
再多了解一些
本文用于创业者技术爱好者查询,仅供学习研究,如用于商业用途,请联系技术所有人。
