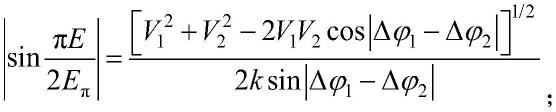
1.本技术属于植物生理学技术领域,具体涉及一种烟草原生质体中蛋白质组的提取和检测方法。
背景技术:
2.细胞层面的植物生理学研究中,往往需要对植物细胞内容物进行全组分提取和分析检测,从而为相关分子调节机理研究奠定技术基础。烟草(nicotiana tabacum)作为植物学研究中的模式植物之一,对烟草细胞内容物研究往往具有较好代表性。
3.植物细胞结构中,因为细胞壁结构往往具有独立性,因此,一般可将植物细胞分为细胞壁和原生质体两个部分,也即,原生质体是指细胞壁缺失的细胞。对于植物内容物提取和分析,往往以原生质体为分析研究对象,从而确保研究结果的准确性。
4.蛋白质组学研究中,往往需要对细胞内容物中特定的全蛋白组分进行提取。而且实际研究中,蛋白组学研究往往是通过对比分析一定环境条件变化(例如非生物因素下的胁迫处理)所导致的蛋白组分或者丰度变化来确定相关调节路径,从而为分子调节路径的研究奠定机理基础。因此,蛋白质组提取的完整度、准确度以及相关检测分析精度,对于实际研究结果往往具有实质性影响。
技术实现要素:
5.本技术目的在于提供一种烟草原生质体中蛋白质组的提取和检测方法,从而为相关烟草蛋白质组学研究奠定一定技术基础。
6.本技术所采取的技术方案简述如下。
7.一种烟草原生质体中蛋白质组的提取和检测方法,该方法以烟草原生质体为提取对象,具体包括如下步骤:(一)备料按照现有技术,以烟草叶肉细胞为原料,常规制备烟草原生质体备用;(二)细胞裂解将原生质体样品溶于十二烷基硫酸钠 (sds) 缓冲液中,超声破碎;破碎后,加入预冷的丙酮,在-20℃条件下沉淀4小时以上;具体操作参考为:将原生质体样品(1ml样品,样品中细胞量不少于106个)溶于1-5 ml的十二烷基硫酸钠 (sds) 缓冲液中,溶解后转入10 ml规格的离心管中,冰上放置;以60%的功率超声30-60秒 (超声2s,停止3s,总时间为30~60s)进行破碎;超声破碎后,加入4-6体积预冷的丙酮,在-20℃下沉淀4小时以上;(三)获得全蛋白将步骤(二)中沉淀处理后混合液进行离心,弃上清,并用预冷丙酮清洗后,用重悬液进行重悬(前述用量条件下,1-3 ml用量),再次超声处理后,离心收集获得全蛋白;所述重悬液:重悬液中含有6-8 m尿素和50 mm碳酸氢铵;
具体操作参考为:将步骤(二)中沉淀处理后混合液在4℃条件下,13000-20000 g离心5-20分钟,留沉淀;用1毫升预冷丙酮对沉淀进行重悬清洗后,4℃、13000-20000 g离心5-20分钟(重复此操作两次以确保清洗效果);留沉淀;将沉淀物用1-3 ml重悬液进行重悬,并进行超声处理(60%的功率,总超声处理5min,期间,超声2s,停止3s);超声处理结束后,4℃、13000-20000 g离心5-20分钟,收集所得即为全蛋白;对收集全蛋白,进一步可利用(bca)蛋白测定试剂盒对蛋白浓度进行测定;(四)检测取步骤(三)中所提取全蛋白样品进行如下预处理:(1)将全蛋白与终浓度5 mm的二硫苏糖醇 (dtt)混合均匀后,56℃条件下孵育30 min;然后用40 mm碘乙酰胺 (iaa) 在黑暗条件下将蛋白质烷基化处理30 min;再后补加dtt至终浓度10 mm,并继续黑暗条件下处理10min;(2)将上述蛋白质烷基化后样品用50 mm碳酸氢铵稀释后,加入胰蛋白酶,摇床上37
°
c酶解消化处理12-24小时;以质量比计,蛋白:胰蛋白酶=(25-50):1;(3)对步骤(2)中消化后样品,利用hlb固相萃取柱 (spe)进行脱盐处理,并用1%三氟乙酸(tfa)对所得多肽样品进行洗涤(一般洗涤3次);最后,用1-3 ml 80% 乙腈 (acn) 和0.1% tfa从hlb固相萃取柱 (spe)洗脱样品,干燥后-80℃保存备检;最终检测时,根据数据采集方式不同可分为:数据依赖采集(data-dependent acquisition, dda)方法和数据非依赖采集方法(data-independent acquisition, dia);具体而言:数据依赖采集( dda)方法:流动相a:0.1%甲酸
‑ꢀ
ms水;流动相b:0.1%甲酸
‑ꢀ
ms can;线性梯度:分析过程中,选择响应值最大的30-50个离子进行二级采集;tof-ms的质量范围为350 ~ 1250 m/z,高分辨率模式(》 2.5万),采集时间为250 ms;加热后毛细管的喷雾电压设置为2.5 kv,温度设置为150℃;
使用proteinpilot软件(ab sciex, 5.0版本)处理数据文件;使用 k326数据库,参考参数如下:酶设定为胰蛋白酶,cys烷基化反应是碘乙酰胺的固化反应;当最小肽长度设置为7时,错误发现率(fdr)小于1.0%;数据非依赖采集( dia)方法: lc参数条件与上述条件相同;构建了80个动态窗口,质量范围350 ~ 1500 da,离子积累时间为20-50 ms;通过peakview软件(version2.1.10, ab sciex)的swath量化,与离子库(. wiff and .wiffscan file)匹配;从软件proteinpilot (ab sciex, 5.0版本)导出;设定肽提取窗口参数:每个蛋白5个肽段,每个肽段4个片段离子,肽置信分≥99%,fdr≤1%,提取离子色谱(xic)提取窗口时间为10 min, xic窗口为0.01 da;将蛋白和肽定量信息导出为。mrkv文件,导入marker view软件(version 1.2.1.1, ab sciex)进行面积和归一化和t检验。
8.本技术中,基于烟草蛋白质组研究需要,发明人对烟草蛋白质组提取方法和检测方法进行了优化,并结合相关非生物因素胁迫处理,对烟草蛋白质成分变化情况进行了初步研究。结果表明,本技术所提供的提取方法和检测方法,灵敏度较高,可有效支撑代谢蛋白质组研究应用,从而可为相关分子调节通路研究、基因功能研究奠定良好的技术基础,表现出较好的实用价值。
附图说明
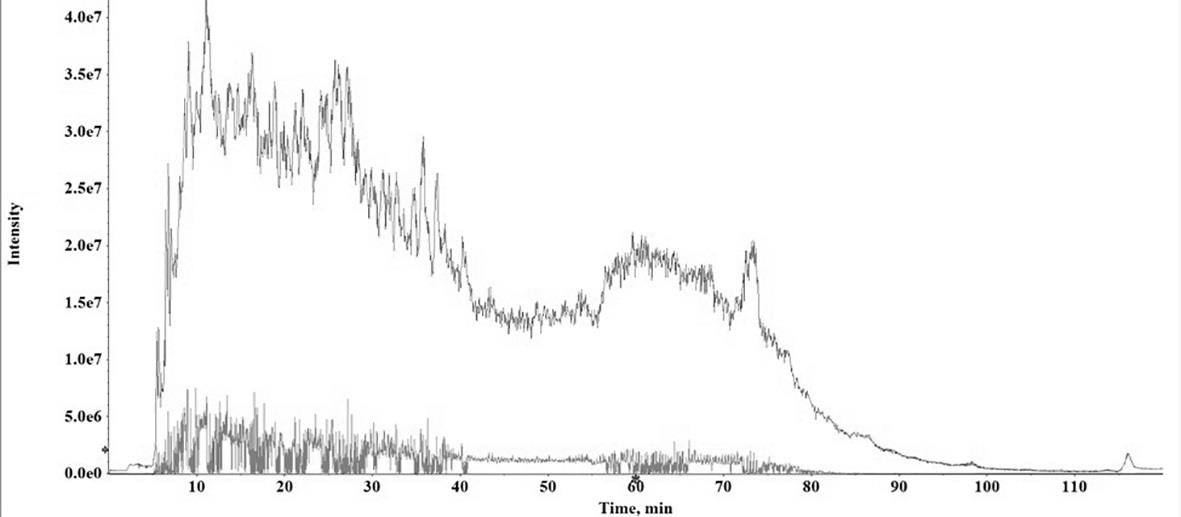
9.图1 烟草叶肉细胞原生质体的dda质谱色谱图;图2 烟草叶肉细胞原生质体的dia质谱色谱图;图 3对照组和处理组的opls-图;图 4对照组和处理组的s-plot图;图 5对照组和处理组差异蛋白热图。
具体实施方式
10.下面结合实施例对本技术做进一步的解释说明。在介绍具体实施例前,就下述实施例中部分实验背景情况简要介绍说明如下。
11.生物材料:烟草(nicotiana tabacum)k326,常见栽培和研究用烟草品种;申请人作为专业性烟草研究机构,长期保存有该研究材料;主要实验设备:tripletof 5600 质谱仪、eksperttm nano lc 415液相系统(与质谱仪联用)、trap柱(chromxp c18-cl、3μm、120 a,350μm
×
0.5毫米)、色谱柱(c18
ꢀ‑ꢀ
cl
ꢀ–ꢀ
120,3μm,120 a,75μm
×
15cm),均为ab sciex(usa)公司产品。
12.实施例1以k326烟草叶肉细胞中蛋白质组提取和检测为例,就相关技术方案详介如下。
13.(一)备料按照现有技术,以烟草叶肉细胞(30~35日叶龄)为原料,常规制备烟草原生质体,
最后,将所制备烟草叶肉原生质体,400-600 rpm 离心后,弃上清,留沉淀备用(沉淀即为原生质体)。
14.原生质体制备时,具体可参考如下操作:取苗龄30日左右叶片1片,切成宽度10mm左右均匀的细丝,置于离心管中,加入8 ml混合酶溶液(1% 纤维素酶、0.5% 离析酶和9% cpw9溶液),轻微振荡使烟草细丝与酶液充分混合;置于恒温摇床上,28℃酶解2.5 h;酶解结束后,过滤(去除未酶解的叶片组织);将滤液离心5 min去除上清,沉淀即为原生质体细胞。
15.(二)细胞裂解将原生质体样品溶于十二烷基硫酸钠 (sds) 缓冲液中,超声破碎;破碎后,加入预冷的丙酮,在-20℃条件下沉淀4小时以上;具体操作参考为:将原生质体样品(原生质体细胞量为106个左右)溶于1 ml的十二烷基硫酸钠 (sds) 缓冲液中,溶解后转入10 ml规格的离心管中,冰上放置;以60%的功率超声60秒 (超声2s,停止3s,总时间为60s)进行破碎;超声破碎后,加入4倍体积预冷的丙酮,在-20℃下沉淀4小时上。
16.(三)获得全蛋白将步骤(二)中沉淀处理后混合液进行离心,弃上清,并用预冷丙酮清洗后,用重悬液进行重悬,再次超声处理后,离心收集获得全蛋白;所述重悬液(水溶液):含有8 m尿素和50 mm碳酸氢铵;具体操作参考为:将步骤(二)中沉淀处理后混合液在4℃条件下,15000 g离心10分钟,留沉淀;用1毫升预冷丙酮对沉淀进行重悬清洗后,4℃、15000 g离心10分钟(重复此操作两次以确保清洗效果);留沉淀;将沉淀物用2 ml重悬液进行重悬,并进行超声处理(60%的功率,总超声处理5min,期间,超声2s,停止3s);超声处理结束后,4℃、15000 g离心10分钟,收集所得即为全蛋白;对收集全蛋白,采用bicinconiic acid (bca)蛋白测定试剂盒 (thermo scientific公司产品),以牛血清白蛋白 (bsa) (2 mg/ml)为标准来对所得全蛋白浓度进行测定。测定结果为:0.16 mg/ml。
17.(四)检测取步骤(三)中所提取全蛋白样品进行如下预处理:(1)将全蛋白(100 μg)与终浓度5 mm的二硫苏糖醇 (dtt)混合均匀后,56℃条件下孵育30 min;然后用40 mm碘乙酰胺 (iaa) 在黑暗条件下将蛋白质烷基化处理30 min;再后补加dtt至终浓度10 mm,并继续黑暗条件下处理10min;(2)将上述蛋白质烷基化后样品用50 mm碳酸氢铵稀释后,加入胰蛋白酶,摇床上37
°
c酶解消化处理16小时;以质量比计,蛋白:胰蛋白酶=50:1;(3)对步骤(2)中消化后样品,利用hlb固相萃取柱 (spe)进行脱盐处理,并用1%三氟乙酸(tfa)对所得多肽样品进行洗涤(洗涤3次);
最后,用3 ml 80% 乙腈 (acn) 和0.1% tfa从hlb固相萃取柱 (spe)洗脱样品,干燥后-80℃保存备检;最终检测时,根据数据采集方式不同可分为:数据依赖采集(data-dependent acquisition, dda)方法和数据非依赖采集方法(data-independent acquisition, dia)。
18.数据依赖采集( dda)方法:液质联用分析时:流动相a:0.1%甲酸
‑ꢀ
ms水;流动相b:0.1%甲酸
‑ꢀ
ms can;线性梯度:分析过程中,对响应值最大的30-50个离子进行二级采集;tof-ms(飞行时间质谱)分析时,分析参数设置为:质量范围为350 ~ 1250 m/z,高分辨率模式(》 2.5万),采集时间为250 ms;加热后毛细管的喷雾电压设置为2.5 kv,温度设置为150℃。
19.使用proteinpilot软件(ab sciex, 5.0版本)处理数据文件。
20.同时,结合申请人所构建拥有的 k326数据库进行对比分析,参考参数如下:酶设定为胰蛋白酶,cys烷基化反应是碘乙酰胺的固化反应;当最小肽长度设置为7时,错误发现率(fdr)小于1.0%。
21.数据非依赖采集( dia)方法: lc(液相色谱)参数条件与上述条件相同;分析过程中,构建了80个动态窗口,质量范围350 ~ 1500 da,离子积累时间为20-50 ms;通过peakview软件(version2.1.10, ab sciex)的swath量化,与离子库(wiff and .wiffscan file)匹配;从软件proteinpilot (ab sciex, 5.0版本)导出;设定肽提取窗口参数:每个蛋白5个肽段,每个肽段4个片段离子,肽置信分≥99%,fdr≤1%,提取离子色谱(xic)提取窗口时间为10 min, xic窗口为0.01 da;将蛋白和肽定量信息导出为mrkv文件,导入marker view软件(version 1.2.1.1, ab sciex)进行面积和归一化和t检验。
22.对正常情况下所得原生质体但不同采集方法所得结果进行分析(图1、图2),可以看出,相关蛋白检测梯度是较为合适的,洗脱也是较为均匀,且二级图谱采集是较为合理的,可以用于实际的检测分析应用。
23.为进一步考察评估本技术蛋白质组检测方法的灵敏性,发明人对所制备的烟草叶肉细胞原生质体进行cd处理(10
ꢀµ
m 处理),并进一步对其蛋白质组变化情况进行了检测分
析。结果表明:对照组中,共鉴定出大于3000个蛋白质,而通过对处理组和对照组样品的蛋白质组进行的统计学分析(分别用t-test(p《0.05)和simca软件的vip值 (vip》1)对两组结果进行了分析),共得到了453个差异蛋白质。具体而言:通过对图3的opls-图分析,可以说明处理后和处理前相比样品明显分离,组间有显著差异,这为进一步蛋白区分和鉴定奠定了基础;而图4的s-plot 图,则给出了对差异贡献较大的变量即差异蛋白的分布情况,这为进一步区别蛋白的区分奠定了基础;图5 为差异蛋白热图,则是对差异蛋白的情况的可视化处理,从而便于更加直观筛选研究目的蛋白;而且相关数据结果表明:处理后差异蛋白半数以上呈下降趋势,小半数据则呈上升趋势,据此可为进一步筛选和明确哪些蛋白可能参与了烟草抗cd的功能提供进一步的指导和参考。
再多了解一些
本文用于创业者技术爱好者查询,仅供学习研究,如用于商业用途,请联系技术所有人。