在昆虫中的重组蛋白生产
1.相关申请的交叉引用
2.本技术要求2020年3月15日提交的美国临时专利申请序列号62/989,725的优先权权益,所述申请的内容特此以引用的方式整体并入本文。
技术领域
3.本发明属于重组生物技术领域,特别是蛋白质表达领域。本发明涉及使用昆虫幼虫或蛹以分批和/或连续方式高效生产重组蛋白。特别是,属于下组的那些:黑水虻(hermetia illucens)(通常称为黑士兵蝇(black soldier fly))、短翅灶蟋(gryllodes sigillatus)(通常称为热带家蟋(tropical house cricket))、黑蟋蟀(gryllus assimilis)(通常称为牙买加田野蟋蟀(jamaican field cricket))、家蟋蟀(acheta domesticus)(通常称为家蟋(house crickets))、面包虫(tenebrio molitor)(通常称为黄粉虫(yellow mealworm))、黑粉虫(tenebrio obscurus)(通常称为暗粉虫(dark mealworm))、黑菌虫(alphitobius diaperinus)(通常称为小粉虫(lesser mealworms))。本发明总体上涉及一种通过遗传转化自宿主生物体中表达目标蛋白(poi)的方法。此外,本发明还涉及包含外源核酸的转化的昆虫本身。
背景技术:
4.重组dna技术的出现是一项重大突破,它使在各种异源系统中生产重组蛋白成为可能。重组蛋白在食品、饮料、化妆品和制药行业有广泛的应用(puetz,j.,等人processes 2019,7,476)。多种平台可用于生产用于工业和治疗用途的重组蛋白,包括细菌、酵母、真菌、植物、哺乳动物和昆虫细胞。然而,这些不同的宿主系统有几个限制。原核培养系统如细菌可用于生产小肽和短肽,但不能生产需要折叠和翻译后修饰(诸如糖基化)的复杂蛋白质(puetz,j.,等人processes 2019,7,476)。酵母的使用可能有利于部分克服这一限制,并且生产的蛋白质的下游纯化相对简单。然而,酵母的使用不适合于生产哺乳动物蛋白或蛋白酶敏感性蛋白(palomares,l.,等人methods in molecular biology 2004,267)。使用动物细胞(诸如哺乳动物和昆虫细胞)可以克服多重限制。特别是,中国仓鼠卵巢细胞(cho)是生产哺乳动物治疗性蛋白的金标准平台。然而,用于培养动物细胞的培养基的高成本是大规模生产中的一个具有挑战性的限制(puetz,j.,等人processes2019,7,476)。基于生物反应器的系统的生产成本和线性成本一直阻碍基于蛋白质的产品在不同行业中的潜在用途。关于这一点,开发用于大规模快速且成本效益好地生产重组蛋白的创新平台至关重要。因此,需要生产重组蛋白的替代方法。
技术实现要素:
5.本发明公开了在黑水虻、短翅灶蟋、黑蟋蟀、家蟋蟀、面包虫、黑粉虫、黑菌虫中商业化生产重组蛋白的方法,其包括产生编码目标重组蛋白的基因的拷贝,然后通过采用不同方法将目的基因递送至昆虫体内以介导其在宿主中的表达。本发明的一个目的是提供一
个用于使用昆虫产生具有商业潜力的重组蛋白的平台,所述平台预期具有成本效益好、具有快速生产周期和高生产产率等多重优势。因此,其代表了通常使用的平台的有希望的替代。
6.在一方面,本文公开了一种转化的昆虫,其包含至少一种外源基因,其中所述昆虫属于选自由以下组成的组的属:扁角水虻属(hermetia)、灶蟋属(gryllodes)、田野蟋蟀属(gryllus)、家蟋属(acheta)、粉虫属(tenebrio)和粉甲属(alphitobius)。还提供了许多实施方案,这些实施方案可以应用于本文描述的本发明的任何方面。例如,在一些实施方案中,外源基因包含在昆虫的体细胞内或者外源基因包含在昆虫的种系内。在一些实施方案中,外源基因是可稳定遗传的。在一些实施方案中,昆虫是选自由以下组成的组的种属:黑水虻、短翅灶蟋、黑蟋蟀、家蟋蟀、面包虫、黑粉虫或黑菌虫,优选地,昆虫是黑水虻。在一些实施方案中,昆虫是选自由以下组成的组的粉虫:面包虫、黑粉虫和家蟋蟀。在一些实施方案中,昆虫是胚胎、幼虫、蛹或成虫。在一些实施方案中,昆虫表达由至少一种外源基因编码的重组蛋白。在一些实施方案中,昆虫表达至少2mg、5mg、10mg、15mg、20mg或25mg的重组蛋白或至少30mg、35mg、40mg、45mg的重组蛋白。在一些实施方案中,重组蛋白占昆虫表达的总蛋白的至少10%、15%、20%、25%、30%、35%、40%、45%、50%、55%、60%、65%或70%。在一些实施方案中,重组蛋白选自由以下组成的组:抗体、抗原、抗原结合分子、酶、激素、疫苗组分和病毒样粒子。在一些实施方案中,至少一种外源基因通过转座子介导的整合被整合到昆虫基因组中。在一些实施方案中,至少一种外源基因在黑腹果蝇hsp70启动子的控制下。
7.在一方面,本文公开的是一种饲养的昆虫,其来源于本文公开的转化的昆虫,其中所述饲养的昆虫包含至少一种外源基因。还提供了许多实施方案,这些实施方案可以应用于本文描述的本发明的任何方面。例如,在一些实施方案中,饲养的昆虫表达由至少一种外源基因编码的重组蛋白。饲养的昆虫可以从转化的昆虫中去除1、2、3、4或5代,或者可以从转化的昆虫中去除超过5代。
8.在一方面,本文公开的是来源于本文所述的转化的昆虫或本文所述的饲养的昆虫的蛹。还提供了许多实施方案,这些实施方案可以应用于本文描述的本发明的任何方面。
9.在一方面,本文公开的是来源于本文公开的转化的昆虫或本文公开的饲养的昆虫的幼虫。还提供了许多实施方案,这些实施方案可以应用于本文描述的本发明的任何方面。
10.在一方面,本文公开的是来源于本文公开的转化的昆虫或本文公开的饲养的昆虫的卵。还提供了许多实施方案,这些实施方案可以应用于本文描述的本发明的任何方面。
11.在一方面,本文公开的是来源于本文公开的转化的昆虫或本文公开的饲养的昆虫的成虫昆虫。还提供了许多实施方案,这些实施方案可以应用于本文描述的本发明的任何方面。
12.在一方面,本文公开的是产生自本文公开的转化的昆虫或本文公开的饲养的昆虫的生物质。还提供了许多实施方案,这些实施方案可以应用于本文描述的本发明的任何方面。
13.在一方面,本文公开的是分离自本文公开的转化的昆虫或本文公开的饲养的昆虫的重组蛋白。还提供了许多实施方案,这些实施方案可以应用于本文描述的本发明的任何方面。例如,在一些实施方案中,蛋白选自由以下组成的组:抗体、抗原、抗原结合分子、酶、
激素、疫苗组分和病毒样粒子。
14.在一方面,本文公开了一种用于生产蛋白质的方法,其包括:a.转化第一阶段的选自由以下组成的组的昆虫:黑水虻、短翅灶蟋、黑蟋蟀、家蟋蟀、面包虫、黑粉虫或黑菌虫,其中转化导致表达盒整合到昆虫的基因组中,并且其中所述表达盒包含编码异源蛋白的基因,其中所述异源基因在热激启动子的控制下;b.对处于第二阶段的转化的昆虫进行热激;以及c.自转化的昆虫中收获包含所述蛋白质的生物质。还提供了许多实施方案,这些实施方案可以应用于本文描述的本发明的任何方面。例如,在一些实施方案中,第一阶段是卵或胚胎。在一些实施方案中,第二阶段是幼虫、蛹或成虫。
15.在一方面,本文公开了一种用于生产蛋白质的方法,其包括:a.转化选自由以下组成的组的昆虫:黑水虻、短翅灶蟋、黑蟋蟀、家蟋蟀、面包虫、黑粉虫或黑菌虫,其中转化导致表达盒整合到昆虫的种系中,并且其中所述表达盒包含编码异源蛋白的基因;b.培育转化的昆虫以产生后续代次昆虫;以及c.自后续代次昆虫中收获包含所述蛋白质的生物质。还提供了许多实施方案,这些实施方案可以应用于本文描述的本发明的任何方面。例如,在一些实施方案中,所述方法进一步包括在收获生物质的步骤之前大量饲养后续代次昆虫的步骤。在一些实施方案中,转化步骤在昆虫卵或胚胎阶段进行。在一些实施方案中,生物质自幼虫、蛹或成虫阶段收获。在一些实施方案中,异源基因在热激启动子的控制下,并且所述方法进一步包括在收获生物质之前热激后续代次昆虫。在一些实施方案中,热激启动子是黑腹果蝇hsp70启动子。在一些实施方案中,昆虫表达至少2mg、5mg、10mg、15mg、20mg或25mg的异源蛋白,或者昆虫表达至少30mg、35mg、40mg、45mg的异源蛋白。在一些实施方案中,异源蛋白占昆虫表达的总蛋白的至少10%、15%、20%、25%、30%、35%、40%、45%、50%、55%、60%、65%或70%。在一些实施方案中,所述方法进一步包括自生物质中分离异源蛋白。在一些实施方案中,所述方法进一步包括自生物质中富集或部分纯化异源蛋白。在一些实施方案中,转化步骤包括转座子介导的表达盒的整合。在一些实施方案中,转化步骤进一步包括提供在昆虫中具有活性的转座酶,并且其中表达盒在每个末端侧接有转座因子。在一些实施方案中,转座酶作为辅助质粒上的编码区或由核酸编码的编码区或作为转座酶蛋白提供。在一些实施方案中,所述昆虫是黑水虻。在一些实施方案中,昆虫是选自由以下组成的组的粉虫:面包虫、黑粉虫和家蟋蟀。在一些实施方案中,转化步骤包括表达盒的物理或化学递送。在一些实施方案中,转化步骤包括注射、dna粒子轰击、电穿孔、注射后电穿孔、水动力、超声或磁转染。在一些实施方案中,异源蛋白选自由以下组成的组:抗体、抗原、抗原结合分子、酶、激素、疫苗组分和病毒样粒子。
16.在一方面,本文公开的是一种异源蛋白,其通过本文公开的方法中的任一种生物制造。还提供了许多实施方案,这些实施方案可以应用于本文描述的本发明的任何方面。例如,在一些实施方案中,表达载体表达病毒样粒子(vlp)。
17.在一方面,本文公开的是一种vlp,其通过本文公开的方法中的任一种生物制造。还提供了许多实施方案,这些实施方案可以应用于本文描述的本发明的任何方面。
18.在一方面,本文公开的是一种疫苗组分,其通过本文公开的方法中的任一种生物制造。还提供了许多实施方案,这些实施方案可以应用于本文描述的本发明的任何方面。例如,在一些实施方案中,所述方法进一步包括自转化的幼虫的整个身体中分离异源蛋白。在一些实施方案中,所述方法进一步包括自转化的幼虫的血淋巴、脂肪体或分泌腺中分离异
源蛋白。
19.在一方面,本文公开的是一种分离的异源蛋白,其通过本文公开的方法中的任一种产生。还提供了许多实施方案,这些实施方案可以应用于本文描述的本发明的任何方面。
20.在一方面,本文公开了一种用于产生转化的昆虫的方法,其包括通过提供在昆虫中具有活性的转座酶和表达盒来转化黑水虻的昆虫卵或胚胎,其中表达盒包含编码异源蛋白的基因并且其中表达盒在每个末端侧接有转座因子,由此转化导致表达盒整合到昆虫的基因组中。还提供了许多实施方案,这些实施方案可以应用于本文描述的本发明的任何方面。例如,在一些实施方案中,转座酶作为辅助质粒上的编码区或由核酸编码的编码区或作为转座酶蛋白提供。在一些实施方案中,表达盒包含在昆虫的体细胞内。在一些实施方案中,表达盒包含在昆虫的种系内。在一些实施方案中,昆虫表达至少2mg、5mg、10mg、15mg、20mg或25mg的异源蛋白,或者昆虫表达至少30mg、35mg、40mg、45mg的异源蛋白。在一些实施方案中,异源蛋白占昆虫表达的总蛋白的至少10%、15%、20%、25%、30%、35%、40%、45%、50%、55%、60%、65%或70%。在一些实施方案中,所述方法进一步包括自昆虫中收获异源蛋白。在一些实施方案中,所述方法进一步包括:a.培育转化的昆虫以产生后续代次昆虫;以及b.自后续代次昆虫中收获包含异源蛋白的生物质。
21.在一方面,本文公开的是一种转化的昆虫,其通过本文公开的方法中的任一种产生。还提供了许多实施方案,这些实施方案可以应用于本文描述的本发明的任何方面。
22.在一方面,本文公开的是一种转化的蛹,其通过本文公开的方法中的任一种产生。还提供了许多实施方案,这些实施方案可以应用于本文描述的本发明的任何方面。
23.在一方面,本文公开的是一种转化的胚胎,其通过本文公开的方法中的任一种产生。还提供了许多实施方案,这些实施方案可以应用于本文描述的本发明的任何方面。
24.在一方面,本文公开的是一种转化的幼虫,其通过本文公开的方法中的任一种产生。还提供了许多实施方案,这些实施方案可以应用于本文描述的本发明的任何方面。
25.在一方面,本文公开的是一种转化的昆虫群体,其通过本文公开的方法中的任一种产生,其中所述方法进一步包括在收获生物质的步骤之前大量饲养转化的昆虫的步骤。还提供了许多实施方案,这些实施方案可以应用于本文描述的本发明的任何方面。
附图说明
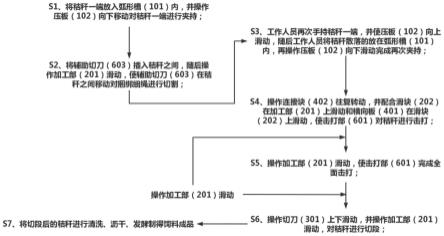
26.图1示出了辅助质粒,其含有在黑腹果蝇hsp70启动子控制下的piggybac转座酶。
27.图2示出了供体质粒,其含有在功能性启动子的控制下的编码目标蛋白的cdna。
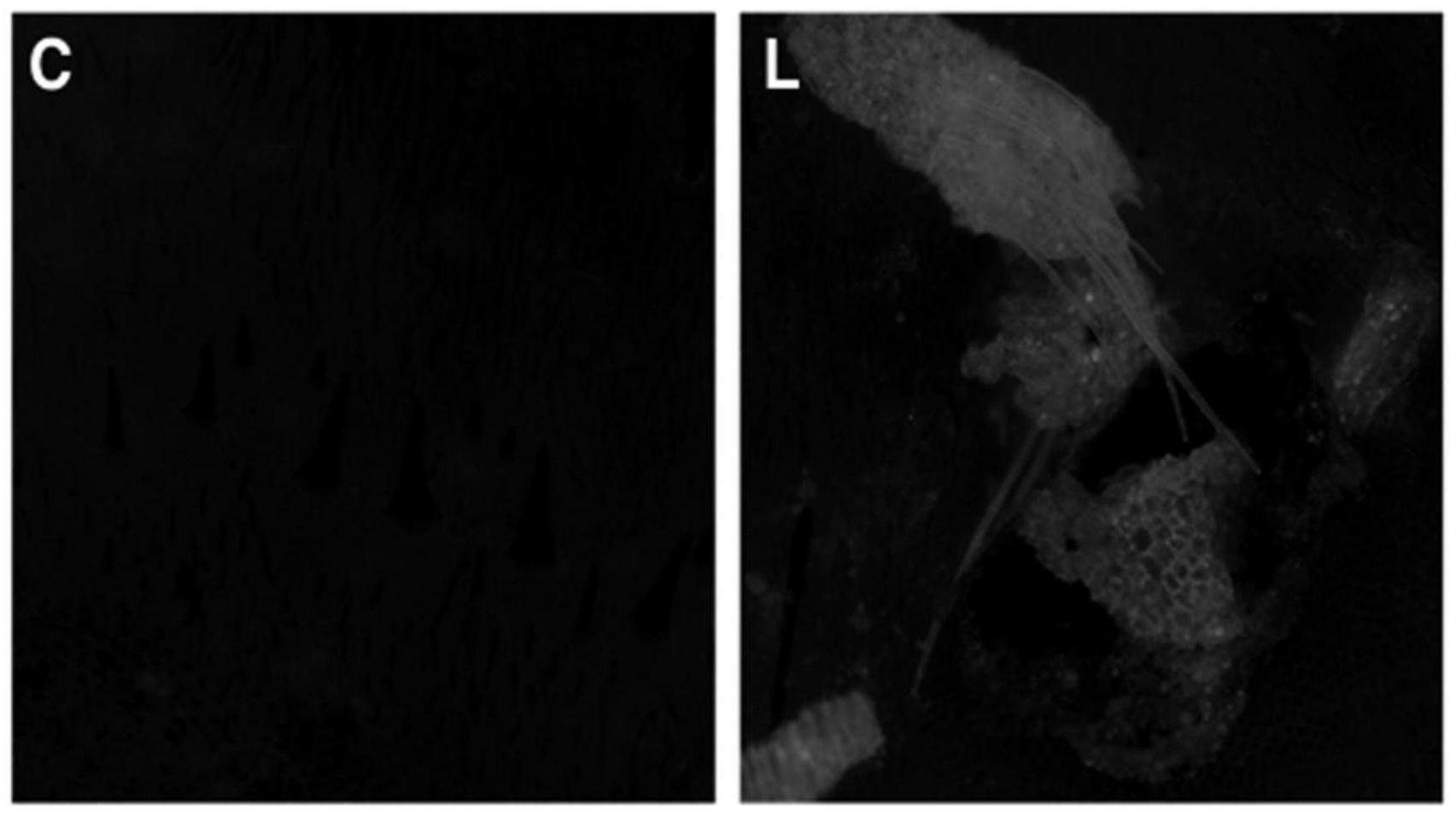
28.图3示出了取自我们最近的表达研究中对照(c)和转基因(t)黑水虻(bsf)5龄幼虫的图像。转基因(t)幼虫中的mneongreen荧光呈簇状存在,在整个幼虫体中可见(示出了中段的一部分)。在对照(c)幼虫中未观察到荧光。
具体实施方式
29.在描述本发明的代表性实施方案时,说明书可能已经将本发明的方法和/或过程呈现为特定的步骤顺序。然而,在所述方法或过程不依赖于本文所述的特定步骤顺序的范围内,所述方法或过程不应限于所描述的特定步骤顺序。如本领域普通技术人员将理解,其他步骤顺序是可能的。因此,说明书中阐述的特定步骤次序不应被解释为对权利要求的限
制。此外,涉及本发明的方法和/或过程的权利要求不应限于按所写的次序执行它们的步骤,并且本领域技术人员可以容易地理解,顺序可以被改变并且仍然保持在本发明的精神和范围内。应当理解,本发明不限于本文所述的特定方法、方案、材料、试剂和物质等。本文使用的术语仅为了描述特定实施方案的目的,并不旨在限制本发明的范围,本发明的范围只受所附权利要求/条目限定。
30.在本发明中,黑水虻、短翅灶蟋、黑蟋蟀、家蟋蟀、面包虫、黑粉虫、黑菌虫用作生产具有商业潜力的重组蛋白的平台。用于生产目标蛋白的方法包括用含有能够表达目标蛋白的重组dna的表达系统转化昆虫。在本发明中,宿主昆虫在从卵期至蛹期范围内的不同发育阶段被目的基因转化。
31.使用活昆虫作为重组蛋白的生产平台是一种有希望的方法。在此方法中,昆虫被用作小型生物工厂来获得所需的蛋白质。昆虫是高效的蛋白质生产者,因为它们具有加速了的新陈代谢。与昆虫细胞系和其他平台相比,完整昆虫介导的蛋白质表达提供多重优势,包括昆虫产生大量重组蛋白的能力以及生产成本的显著降低。昆虫作为活的生物工厂,因其生产的多功能性、可扩展性、自动化可能性、效率和开发速度,构成了昆虫细胞、常规发酵技术以及植物来源的蛋白质的有希望的替代。例如,昆虫作为活的生物工厂避免了使用生物反应器来表达蛋白质的必要性。生物反应器是生产新的和现有的重组蛋白的技术和经济障碍,因为它们效率低下、价格昂贵、技术复杂(需要数年时间建造、难以验证、需要高素质的人员对其进行操作、容易受到污染且不可靠)。此外,生物反应器还面临可扩展性有限的问题。与生产数毫克/升的重组蛋白的昆虫细胞培养系统相比,昆虫幼虫可以生产高达数克或数百克/升的重组蛋白/升。
32.黑士兵蝇是一种非选择性昆虫,它以任何饲料来源为食,同时中和致病菌,这使蛋白质生产过程更加容易。本发明的发明人在深入研究后,找到了上述问题的解决方法,即在属于双翅目(dipteran),更优选属于物种黑水虻的卵、幼虫或蛹中的蛋白质表达系统,其与其他昆虫物种相比效率更高,而且允许前所未有的自动化规模(放大),这提高了效率并降低了与重组蛋白表达相关的成本,特别是在工业规模上。与每个周期可以产生多达1000个卵的黑士兵蝇或粉虫相比,甘蓝银纹夜蛾(cabbage looper)和蚕每个周期产生的卵相对较少。黑士兵蝇是在很近的地方生产的,不会形成茧(与甘蓝银纹夜蛾和蚕不同),这意味着它们可以在小区域内生产。这支持对它们实施垂直农法和垂直堆叠以扩大生产的能力。
33.在一些昆虫物种(诸如蚕)中与某些发育阶段的遗传转化相关的技术问题在黑士兵蝇的卵中没有遇到。在果蝇和小鼠等其他生物体中开发的注射方法在蚕体内效果不佳,因为卵壳坚硬而结实,并且细玻璃毛细管的尖端无法穿透卵子。然而,标准转化技术可以很容易地穿透黑士兵蝇的卵,这使得种系转化的建立过程比蚕容易得多。
34.因此,本发明涉及利用大规模饲养的昆虫进行可扩展的重组蛋白生产的潜力,所述昆虫优选属于黑水虻物种的昆虫。这种昆虫从卵孵化后在18天内身长增长大约24倍,而体重增长大约9,000倍。
35.如在说明书中使用的,除非另有说明,否则“一个/种(one/a/an)”可以意指“至少一个/种”或“一个/种或多个/种”。如本文在权利要求中所用,当与词语“包含”结合使用时,词语“一个/种(a/an)”可以意指一个/种或多于一个/种。如本文中所用,“另一个/种(another)”可以意指至少第二个/种或更多个/种。
36.根据本发明,术语“幼虫”是指从许多昆虫的卵中孵化出来的未成熟的、无翅的并且通常蠕虫样摄食的形式。它在经过几次蜕皮时主要改变大小,并且最后转变成成虫从中出现的蛹或蝶蛹。
37.术语“蛹”是指一些昆虫经历转变的一个生命阶段。蛹期仅存在于经历四个生命阶段;胚胎、幼虫、蛹和成虫的全变态昆虫,即经历完全变态的昆虫中。
38.如本文所用,“重组dna”是指并非天然存在的人工dna形式,其通过一条或多条dna链的组合或插入进行操作以组合dna。
39.如本文所用,“重组蛋白”是指来源于重组dna的蛋白质。此类蛋白质可以用于造福人类和动物,并且可以具有工业、商业或治疗用途。
40.从昆虫生物质产生的目标重组蛋白可以是任何蛋白质序列,包括但不限于抗体、酶、生长因子、细胞因子、激素、信号肽、结构蛋白、转运蛋白、储存蛋白、融合蛋白、白细胞介素、人工设计的蛋白、亚单位疫苗、单克隆抗体、细胞表面受体、激素受体、膜转运蛋白、细胞周期蛋白、fab片段、纳米抗体、亲和体和其他抗体模拟物、病毒抗原、病毒样粒子、病毒受体、荧光蛋白、融合蛋白、胆碱酯酶、肽酶、激酶、磷酸酶、人腺苷脱氨酶、磷脂酶、无脊椎动物免疫蛋白、ras效应物、抗菌肽或任何其他已知蛋白质。
41.本发明的重组蛋白的来源没有限制。优选地,所述蛋白质来源于哺乳动物、细菌、病毒、真菌、植物或水产养殖生物蛋白质。
42.如本文所用,“表达系统”包括参与特定基因表达的重组dna元件,诸如基因本身和/或控制该基因表达的因子(例如,启动子)。
43.转基因昆虫的成功产生可以通过种系或体细胞转化来实现。
44.如本文所用,“转基因昆虫”是指以瞬时或稳定方式表达外源核酸的昆虫。
45.如本文所用,“稳定的表达”是指由于外源核酸整合到宿主生物体的基因组中而发生的基因表达。
46.如本文所用,“瞬时表达”是指由于外源核酸媒介物存在于宿主生物体细胞内而不整合到宿主基因组中而发生的基因表达。
47.如本文所用,“种系转化”是指通过靶向宿主生物体的生殖细胞而发生、以被遗传并传给下一代的遗传转化。
48.如本文所用,“体细胞转化”是指发生在宿主生物体体细胞中的遗传转化。
49.在一些实施方案中,遗传转化由非病毒表达系统介导,所述系统包括但不限于转座子、重组酶、整合酶、zfn、talen和crispr/cas技术。
50.转座子:
51.转座子是遗传元件,其能够在物种基因组内从一个位置“跳跃”或转座到另一个位置。它们广泛分布在包括昆虫在内的动物中。转座子在其宿主物种内是有活性的,这是由于由元件本身编码的、或通过其他方式(诸如通过注射转座酶编码mrna、使用编码转座酶的第二编码序列或添加转座酶蛋白本身)提供的转座酶蛋白的活性。对转座机制理解的进步导致了基于转座子的遗传工具的开发,这些工具可以用于基因转移。
52.可以使用在所需昆虫中具有活性的任何转座因子。然而,优选地,转座因子选自由以下组成的组:minos、mariner、hermes、sleeping beauty和piggybac。
53.piggybac是来源于杆状病毒宿主粉纹夜蛾(trichoplusia ni)的转座子。handler
等人,(1998)pnas(usa)95:7520-5描述了它在地中海果蝇(medfly)种系转化中的用途。
54.minos是一种转座因子,其在地中海果蝇中具有活性。美国专利号5,840,865中描述了minos,所述专利通过引用整体并入本文。在前述美国专利中描述了使用minos来转化昆虫。
55.mariner是最初从果蝇中分离出来的转座子,但后来也在几种无脊椎动物和脊椎动物物种中发现。国际专利申请wo99/09817中描述了使用mariner来转化生物体。
56.hermes来源于常见的家蝇。美国专利号5,614,398中描述了其在产生转基因昆虫中的用途,所述专利以引用的方式整体并入本文。
57.位点特异性重组酶:
58.位点特异性重组酶催化核酸片段的插入或切除。这些酶识别用于识别和重组的相对较短、独特的核酸序列。实例包括cre(sternberg等人,j mol biol,1981,150:467-486)、flp(broach,等人,cell 1982,29:227-234;美国专利号5,654,182;5,885,386;6,140,129;和6,175,058)和r(matsuzaki,等人,j bacteriology,1990,172:610-618)。使用位点特异性重组酶来操作核酸的实例描述于美国专利号5,527,695;5,654,182;5,677,177;5,801,030;5,919,676;6,091,001;6,110,736;6,143,557;6,156,497;6,171,861;6,187,994;和6,262,341中。对这些系统重组机制的理解的进步导致了基于它们的遗传工具的开发,这些工具可以用于基因转移。
59.根据本发明,可以使用重组酶介导的盒交换(rmce)技术。rmce技术允许交换大的dna序列。该技术基于产生一个用转基因工程改造的亲本系,所述转基因侧接有特异性重组酶位点(例如,loxp、lox511)。然后可以引入含有第二转基因(也侧接有特异性重组酶位点)的交换质粒。在表达重组酶(例如,cre)的辅助质粒的存在下,将交换质粒 转基因转染到亲本系中。重组酶催化整合到亲本系中的第一转基因与交换质粒转基因之间的交换,从而完成所需的基因转移。
60.锌指核酸酶(zfn)
61.zfn属于一类人工限制酶,其包含两个域:dna结合锌指域和dna切割域。这类核酸酶可以经工程改造以靶向dna的特定区域以进行基因组操作。dna结合域能够识别9-bp靶标。dna切割域必须首先二聚化才能够在靶基因组中诱导双链断裂(urnov,f.等人,nat rev genet 2010,11,636
–
646)。
62.转录激活因子样效应子核酸酶(talen)
63.talen是另一种常用的基因编辑工具,它与zfn类似,由两个域组成:dna结合域和dna切割域。dna结合域来源于转录激活因子样效应子(tale),所述效应子由细菌分泌以在结合特定的调控元件后调节宿主植物细胞中它们各自的基因(joung,j.k.等人,molecular cell biology 2013,14(1),49
–
55)。talen可以经工程改造以结合特定的基因组区域,用于基因编辑目的,其中它们在靶标识别后引入双链断裂。
64.crispr/cas系统
65.聚集规则间隔短回文重复序列(crispr)和crispr相关蛋白(cas)技术最近已成为一种强大的工具,由于其灵活性、高保真度和设计简单性而彻底改变了基因组编辑领域。crispr/cas系统是rna引导的dna切割系统,其包含cas核酸内切酶和指导rna(grna)。grna由结合在一起的2个称为tracrrna和crrna的短rna分子组成。tracrrna形成负责结合cas核
酸内切酶的支架序列,而crrna含有负责结合靶dna的可变序列(间隔区),称为原型间隔区。crispr/cas作用机制取决于cas酶识别称为原型间隔区相邻基序(pam)的序列,然后间隔区与靶区域结合,从而激活cas核酸内切酶活性。cas核酸内切酶活性导致在靶基因组区域形成双链断裂,然后通过细胞修复机制对其进行修复以进行基因组操作(terns m.p.,等人,molecular cell,2018,72(3),404
–
412)。
66.根据本发明,转化的昆虫的产生需要通过任何可能的方式将表达系统引入宿主昆虫,所述方式包括但不限于本领域已知的物理和化学方法。在一种转化形式中,通过使用微量移液器将dna直接显微注射到细胞中。或者,可以使用高速弹道学将小dna相关粒子推入细胞中。在另一种形式中,细胞因聚乙二醇的存在而被透化,从而允许dna通过扩散进入细胞。也可以通过将原生质体与其他含有dna的实体融合来将dna引入细胞中。这些实体包括小细胞、细胞、溶酶体或其他可融合的脂质表面体。电穿孔也是一种公认的用于将dna引入细胞中的方法。在这种技术中,细胞经受高场强电脉冲,所述电脉冲可逆地渗透生物膜,从而允许外源dna序列进入。
67.用于遗传转化的质粒dna浓度包括任何会导致成功转基因的量。优选使用的浓度为10-20、20-30、30-40、40-50、50-60、60-70、70-80、80-90、90-100、100-200、200-300、300-400、400-500、500-600、600-700、700-800、800-900、900-1000ug/ml。较少使用较低浓度,诸如0.1-0.2、0.2-0.3、0.3-0.4、0.4-0.5、0.5-0.6、0.6-0.7、0.7-0.8、0.8-0.9、0.9-1ug/ml。
68.在其他实施方案中,遗传转化由病毒载体介导,包括但不限于杆状病毒、浓核病毒、fhv病毒、水疱性口炎病毒(vsv)、慢病毒、腺病毒、腺相关病毒、痘病毒载体、爱泼斯坦-巴尔病毒、逆转录病毒、细小病毒或单纯疱疹病毒。
69.根据本发明,“杆状病毒表达载体(bev)”是指经过遗传修饰以引导外源基因表达的重组杆状病毒。bev广泛用于在培养的昆虫细胞和昆虫幼虫中表达该基因。用于外源基因表达的两种最常见的分离株是加州苜蓿多核多角体病毒(acmnpv)和家蚕(蚕)核型多角体病毒(bmnpv)。bev被引入昆虫,昆虫被感染,并且病毒在昆虫内复制。
70.在bev中,外源基因编码序列通常置于病毒启动子的转录控制之下。因此,外源基因的转录通常需要病毒因子。
71.根据本发明,可以通过不同的方法将包括bev的病毒载体引入到处于任何发育阶段的昆虫中。一种方法是经由口服施用、单独注射、气溶胶喷雾、浸泡或通过任何物理或化学方法用病毒感染昆虫幼虫。
72.根据本发明,幼虫或蛹可以在感染bev或任何病毒载体之前经受应激。术语“应激”是指将幼虫或蛹置于应激(例如,热激)下,而不导致死亡。经受应激后,幼虫或蛹会恢复并正常表达蛋白质。在本发明的一些实施方案中,应激可以通过以下方式(单独或组合)实现:将幼虫或蛹保持在低温或高于正常生长温度但低于耐受温度的温度下、使幼虫或蛹挨饿、将幼虫或蛹置于空气减少的环境中、用辐射照射幼虫或蛹或用化学剂处理幼虫或蛹。在一些实施方案中,将幼虫或蛹保持在约2℃至约15℃、优选约3℃至约15℃、更优选约4℃至约15℃、约4℃至约12℃、约5℃至约15℃或约4℃至约10℃、最优选约4℃至约6℃、约4℃至约8℃或约4℃至约10℃的低温下。在其他实施方案中,将幼虫或蛹保持在约30℃至45℃、优选约32℃至45℃、约32℃至42℃、约32℃至40℃、约35℃至45℃或约35℃至40℃的较高温度下。在一些实施方案中,幼虫或蛹通过用低剂量的uv照射来处理。在其他实施方案中,通过
将幼虫或蛹置于空气减少的环境中来处理。更优选地,空气减少5%至50%。在一些实施方案中,将幼虫或蛹禁食至少两天。优选地,将幼虫或蛹禁食两天、三天或四天。
73.用于遗传转化的重组病毒载体的剂量包括能够实现成功感染和转基因表达的任何剂量。优选地,使用的感染复数(moi)为0.001-0.01moi、0.01-0.1moi、0.1-1moi、1-3moi、3-5moi、5-10moi、10-15moi、15-20moi、20-30moi、30-40moi、40-50moi、50-60moi、60-70moi、70-80moi、80-90moi和90-100moi。
74.如本文所述的“感染复数”是指在感染期间每个细胞添加的病毒体的数量。
75.如本文所述的“病毒体”是指病毒在宿主细胞外的完整感染形式,其具有核酸核心和衣壳。
76.用于驱动外源核酸基因表达的启动子可以是在宿主生物体中起作用的任何启动子,其中所述启动子是诱导型或组成型启动子。可以使用的启动子的实例包括但不限于hsp70、cmv、cag、pgk、tre、u6、uas、t7、sp6、lac、arabad、trp或ptac。
77.如本文所用,“诱导型启动子”是指仅在特定情况下具有活性并且可以从关闭状态切换到开启状态的启动子。
78.如本文所用,“组成型启动子”是指允许其相关基因持续表达的未调节启动子。
79.优选的诱导型启动子是热激蛋白hsp70启动子(它是通过提高幼虫培养的温度来诱导的)和四环素诱导型表达系统(heinrich等人,pnas 2000,97:8229-8232)。
80.在本发明的某些实施方案中,热激可用于诱导hsp70的表达,其由29、30、31、32、33、34、35、36、37、38、39、40、41、42摄氏度的升高的温度诱导。
81.也可以使用其他合适的启动子,诸如mtn启动子、tet-on、tet-off系统。
82.使用的组成型启动子包括在宿主昆虫物种中起作用的任何启动子,无论是来源于物种本身还是任何其他昆虫物种。
83.组成型启动子可以是细胞质肌动蛋白启动子。黑腹果蝇细胞质肌动蛋白启动子已被克隆(act5c),并且在蚊子中具有很高的活性(huynh等人,j.mol.biol.1999,288:13-20)。细胞质肌动蛋白基因及其启动子也可以从其他昆虫中分离出来。
84.其他实例包括多聚泛素启动子、细胞质微管蛋白启动子、黑腹果蝇copia ltr、ds47、opie1、opie2。
85.也可以使用其他启动子,诸如黑腹果蝇adh、微管蛋白、pgk、cmv、ubc或cagg,但不太常见。
86.在其他实施方案中,可以使用控制分泌的多肽的启动子(任选地与适当的信号序列一起)以指导分泌蛋白质至血淋巴。例如,可以采用幼虫血清蛋白启动子。
87.根据本发明,可以采用数种方法来实现种系转化。这些方法包括但不限于将所需的表达系统显微注射到宿主昆虫的早期胚胎中。在一些实施方案中,在产卵0-10、10-20、30-40、40-50、50-60、60-70、80-90、90-100、100-110、110-120分钟时向早期胚胎进行显微注射。在其他实施方案中,新产下的胚胎可以在特定条件下储存以延迟其发育,然后之后用于显微注射。
88.在另一方面,本发明提供了一种用于产生亚单位疫苗的方法。
89.如本文所用,“疫苗”可以定义为生物制剂,并且可以定义为提供针对特定疾病的获得性免疫的生物制剂。
90.如本文所用的“亚单位疫苗”定义为包括亚病毒组分的疫苗,这些组分经翻译后修饰并正确折叠以充当免疫原。
91.在一些实施方案中,亚单位疫苗是病毒样粒子。该方法涉及在宿主生物体中表达一种或多种能够自组装形成病毒样粒子的病毒结构蛋白。病毒样粒子(vlp)是多蛋白结构,其模仿标准天然病毒的组织和结构,但缺乏病毒基因组,并且可以产生更安全且更便宜的疫苗候选。
92.在一些实施方案中,该方法还涉及分离病毒样粒子,其中可以从细胞上清液中回收vlp,并使用用于纯化病毒的相同程序进行纯化。可以对vlp进行工程改造以增加免疫反应的范围。vlp也可以经工程改造来区分其免疫反应和感染诱导的免疫反应。
93.在本说明书中,术语“能够自组装的粒子”是指由至少一种自发组装的组分形成的粒子。该成分可以是多肽或非肽化合物。
94.本发明还涉及使用红色荧光蛋白诸如dsred作为昆虫幼虫中基因表达的报告基因,从而使靶标的基因表达能够被肉眼识别。
95.在一些实施方案中,在幼虫中表达的珊瑚红荧光融合蛋白诸如dsred可以在正常实验室光线下在幼虫中被人眼辨别。表达的珊瑚红荧光蛋白颜色为红色或粉红色,并且足够明亮,在阳光直射下肉眼可见,无需使用任何修复工具,从而使表达靶融合蛋白的昆虫能够容易地被识别,并且无需任何繁琐的分子分析。
96.本发明的方法还涉及通过任何方便的方法从昆虫幼虫或蛹中分离目标重组蛋白。合适的方法包括将完整昆虫幼虫/蛹和/或切碎的昆虫幼虫/蛹与提取缓冲液混合以用于进行下游处理来分离目标重组蛋白。
97.虽然可以使用完整昆虫幼虫和/或切碎的幼虫,但本发明通常用切碎的或以其他方式制成不完整的幼虫进行。最初,幼虫可能会被粉碎或破碎。
98.在粉碎之前,可以洗涤收获的幼虫以去除任何污垢和微粒,并进行净化以确保幼虫没有病原体或其他污染物,这是获得安全和高质量最终产品的关键步骤。
99.在被切碎之前,幼虫可能会被冷冻。冷冻有助于最大限度地减少幼虫的均质化。幼虫可被剁碎、通过冲击诸如用锤子或木槌破裂、碾碎或以其他方式破坏成碎片或粉碎。根据其他实施方案,昆虫是冷冻干燥的。
100.在一些实施方案中,昆虫衍生的重组蛋白、疫苗、抗体、肽或化学品经由色谱纯化、蒸馏、蒸发、吸附或结晶进行纯化。
101.本发明中使用的作为实例的黑士兵蝇(bsf)来自水虻科(straiomyi dae family)的双翅目,常见于世界的暖温带和热温带(warm and tropi cal temperate areas)(hoc,b.,等人plos one 2019)。bsf的高潜力归因于许多因素,诸如它们贪婪的食欲、6-7周之间范围内的短生命周期及其使它们能够在不利的条件下茁壮成长的复原力本质(joly,g.,等人iwmi 2019)。另外,它们能够消耗广泛的基质,如食物垃圾、厨房垃圾、稻草、动物粪便和排泄污泥。据报道,bsfl可抑制有害细菌和昆虫害虫的生长(wang,y.,等人foods 2017,6)。此外,成蝇没有口器,没有报道过它们会传播疾病,它们也不需要喂养,这代表了它们在大规模生产中的一个巨大优势,因为它们不需要特别的照顾(rindhe,s.,等人int.j.curr.microbiol.app.sci 2019,8,1329-1342)。昆虫从卵孵化后在18天内身长增长大约24倍,而体重增长大约9,000倍。
102.本发明中使用的热带家蟋(短翅灶蟋)和家蟋(家蟋蟀)属于直翅目(order orthoptera),蟋蟀科(family gryllidae)。热带家蟋的饲养有许多优势,包括它们在极端环境条件下的复原力、大规模饲养的巨大潜力和耐受高群体密度的能力。此外,幼虫中的蛋白质含量在60%至70%之间变化(van huis,a.等人wageningen academic publishers 2017)。牙买加田野蟋蟀(黑蟋蟀)表现出相同的特征,但程度较低,并且蛋白质含量在50%至65%之间变化。
103.本发明还包括不同粉虫物种的幼虫,诸如面包虫、黑粉虫和家蟋蟀,通常分别称为黄粉虫、暗粉虫和小粉虫。这些物种属于鞘翅目(order coleoptera),拟步甲科(family tenebrionidae)。与蟋蟀类似,该幼虫在极端条件下茁壮成长,适合大规模饲养,并且具有50%至65%范围内的高蛋白质含量。
104.可以经由病毒或非病毒递送方法将目的基因引入宿主昆虫物种。
105.在一些实施方案中,本发明可用于开发针对导致世界目前面临的covid-19大流行的sars-cov-2病毒的疫苗。疫苗开发过程经历了两个主要步骤。首先是开发和审批。第二阶段是大规模生产,这一阶段使用典型方法非常具有挑战性且成本效益非常差。在现有基础设施的情况下,本发明有可能在短短4天内生产出数公斤的疫苗。此外,它的成本更低,使疫苗可以在全球范围内分发。
106.在一些实施方案中,目标蛋白可以是抗体、酶、细胞因子、激素、信号肽、结构蛋白、转运蛋白、储存蛋白、融合蛋白、白细胞介素或人工设计的蛋白。
107.在一些实施方案中,用于驱动目的基因表达的启动子可以是hsp70、cmv、cag、pgk、tre、u6、uas、t7、sp6、lac、arabad、trp或ptac。
108.为了便于本发明的实践,示例性程序描述在以下非限制性实施例中。
109.实施例
110.下面将参考实施例进一步详细地描述本发明,但本发明不限于以下实施例。
111.实施例1:饲养昆虫
112.黑水虻
113.饲养bsf的过程从卵开始。几天后,卵在装满优质食物源的孵化容器中孵化。孵化后,幼虫将以水分含量为70%的食物源为食五天。然后从容器中收获5天龄的幼虫,并在有机垃圾上饲养大约两周,直到它们转变为预蛹。然后收获预蛹并置于黑暗的笼子中大约10天,以允许蛹化发生。蛹化后,成蝇出现在交配发生的爱笼中。这些笼子配有光源、为蝇补水的湿布和一种称为eggies的适合产卵的介质。交配后,雌性将卵放入eggies中,并且饲养周期结束。
114.面包虫
115.饲养粉虫的过程从卵开始。交尾后4至17天产卵。单个雌性平均可以产生500个卵。胚胎发育持续4至6天,发育可通过稍微升高温度(25℃至27℃)来加速。幼虫期以50%燕麦片、2.5%啤酒酵母和47.5%小麦粉的饮食饲养,温度为28℃,相对湿度为60%,8l16d。成熟的幼虫平均重0.2g,并且长25-35mm。在这个阶段之后,幼虫变成蛹,这个阶段持续5至6天,并且以成年个体告终。
116.实施例2:通过piggybac转座子系统在特定身体部位进行体细胞转化
117.来自文昌鱼(branchiostoma lanceolatum)的编码mneongreen蛋白的基因已在黑
士兵蝇(bsf)中表达。体细胞转基因是通过使用piggybac转座子系统实现的。使用的piggybac系统包含两个载体:辅助质粒和供体质粒。
118.构建了辅助质粒(图1)。它含有受黑腹果蝇hsp70启动子控制的piggybac转座酶(pbase)。
119.构建了供体质粒(图2)。它含有受黑腹果蝇hsp70启动子控制的编码mneongreen荧光蛋白的cdna。
120.本文所述的cdna是来自信使rna的dna拷贝。
121.对于体细胞表达,向健康的五龄bsf幼虫(幼虫数量为55只)注射500nl由辅助质粒和供体质粒组成的混合dna溶液。混合后,每种质粒的浓度为500ng/μl。注射后立即施加电击(15v)。使用的体积是0.25辅助和0.25供体。使用的固定方法是在两张载玻片之间进行机械固定。随后将幼虫用37℃热激处理30分钟以激活转座酶表达。
122.在用荧光显微镜成像之前,通过在37℃热激处理30分钟后检测幼虫组织中的mneongreen特异性荧光来监测mneongreen的表达。bsf幼虫使用gfp2滤光片组(leica:激发滤光片480/40nm,抑止滤光片510lp)(一种与mneongreen荧光兼容的滤光片组)用leica荧光显微镜筛选(图3)。55只幼虫中有86%存活,55只幼虫中有80%表达荧光。
123.实施例3:经由piggybac转座子系统对黑水虻(bsf)进行种系转化
124.a.通过显微注射
125.种系转基因是通过使用piggybac转座子系统实现的。bsf野生型菌株用于所有实验;蝇在标准条件下饲养。如前所述,使用前胚层胚胎进行供体质粒以及表达转座酶的辅助质粒的dna注射(loukeris tg,等人science.1995;270(5244):2002-5;rubin gm,等人science.1982;218(4570):348-53)。
126.使用的piggybac系统包含两个载体:辅助质粒和供体质粒。关于供体质粒,使用了两种mneongreen构建体:一种构建体使用诱导型启动子(果蝇hsp70)来驱动mneongreen表达,而另一种使用组成型启动子(果蝇肌动蛋白5c启动子)。bsf幼虫与hsp70/mneongreen基因在正常饲养温度(22、23、24、25、26、27、28摄氏度)下显示出低水平的荧光,并且在暴露于热激10-20分钟、20-30分钟、30-40分钟、40-50分钟、50-60分钟后荧光升高。使用的热激温度为28-29、29-30、30-31、31-32、32-33、33-34、34-35、35-36、36-37、37-38、38-39、39-40、40-41、41-42、42-43、43-44、44-45摄氏度。bsf幼虫与肌动蛋白5c/mneongreen基因显示组成型高水平的mneongreen荧光。mneongreen在bsf的所有组织中均有表达。使用免疫印迹测定也在转基因昆虫中检测到mneongreen蛋白。
127.在典型的转基因实验中,将供体质粒dna和辅助质粒dna的混合物共同注射到前胚层(产卵后0-2小时)bsf胚胎中。为了检测转基因bsf,来源于注射胚胎(g0代)的蝇通过与受体菌株回交进行繁殖,并在幼虫阶段单独测试它们的后代是否表达mneongreen。mneongreen的表达是通过使用标准的落射荧光显微镜对相隔一天的幼虫(通过hsp-mneongreen质粒注射)进行一次或多次连续热激处理后检测幼虫组织中的mneongreen特异性荧光来监测的。
128.b.通过电穿孔:
129.将未脱绒或脱绒的新卵放入装有500μl电穿孔缓冲液的0.2cm电极间隙比色皿(bio-rad)中。各种电压(350v/cm至1700v/cm)被用来进行实验。脱绒的卵是脆弱的,并且容
易干燥。对一些未脱绒的卵进行电穿孔,2个脉冲被30秒的间隔分开。成虫的存活的电穿孔bsf蝇分别与野生型昆虫交配,以开始产生独立的蝇系。
130.在电穿孔缓冲液中,用200ng/μl含有egfp或dsred的供体载体和300ng/μl编码piggybac转座酶的高活性变体的辅助质粒对新产的bsf卵进行电穿孔。
131.bsf幼虫使用gfp2滤光片组(leica:激发滤光片480/40nm,抑止滤光片510lp)或dsred滤光片组(leica:激发滤光片545/30nm,抑止滤光片620/60nm)用leica荧光显微镜筛选。幼虫和成虫均用于筛选。
132.将表达dsred的完整冷冻幼虫在fitzmill粉碎装置中剁碎,刀片侧朝前,移除筛网。幼虫以三种不同的速度剁碎:3000rpm、6000rpm和9000rpm。使用端对端混合将粉碎的幼虫生物质与提取缓冲液混合。在提取过程中取出样品进行分析,以确定粗略的提取率和相对于完整幼虫的总体提取水平。使用半定性sds-page考马斯染色凝胶或用dsred特异性多克隆抗体的蛋白质印迹来检测dsred。使用kodak 1成像系统对条带进行光密度测定。
133.实施例4:经由piggybac转座子系统对面包虫进行种系转化
134.面包虫胚胎从夜间产卵(年龄达24小时)中收集,用2.5%漂白剂洗涤,并放置在玻璃载玻片的边缘进行显微注射。以比率400ug/ml:100ug/ml注射供体质粒和辅助质粒。注射后,将胚胎在湿度室中孵育,并且将蛹置于含面包虫饮食的有盖培养皿中,温度均为28℃且相对湿度均为60%。将卵中出现的幼虫置于面包虫饮食中并进行筛选用于转基因表达。使蛹孵化,并筛选成虫用于转基因表达。
135.实施例5:杆状病毒介导的递送和转基因表达:
136.1.杆状病毒表达载体的产生:
137.一旦编码目标蛋白的外源基因被组装,它就会被包装到杆状病毒转移载体中。转移载体是一种基于质粒的载体,它含有将目的基因整合到病毒dna所需位点所必需的病毒基因组区域。在构建转移载体后,将其与病毒基因组一起共转染到培养的昆虫细胞系中,用于重组杆状病毒的产生和扩增。然后从培养的细胞中分离且纯化重组杆状病毒,然后以所需的滴度递送到宿主昆虫物种中。
138.2.重组杆状病毒的递送:
139.a.将重组杆状病毒注射到幼虫中:
140.含有目的基因的重组杆状病毒是在能够驱动昆虫幼虫中基因表达的强启动子的影响下构建的。出芽病毒形式或杆粒形式的杆状病毒被注射到处于其5龄发育阶段的bsf幼虫的血腔中。在注射之前,将幼虫置于冰中以限制它们的运动并方便其注射。5-50μl滴度约为1x10
7 pfu/ml的重组杆状病毒用于微针注射。
[0141]“杆粒”是指质粒构建体,其含有在转染到细胞中时足以产生杆状病毒的核酸序列。
[0142]
b.通过气溶胶感染用重组杆状病毒感染昆虫幼虫:
[0143]
通过气溶胶感染的方式将封闭形式的重组杆状病毒(odv)引入5龄发育阶段的昆虫幼虫中。气溶胶喷雾含有2ml浓度为1x10
7 pfu/ml的重组杆状病毒溶液。
[0144]
c.通过口服接种用重组杆状病毒感染昆虫幼虫:
[0145]
使5龄幼虫挨饿24小时,然后喂食混合有封闭形式的重组杆状病毒(odv)的饮食。
[0146]
3.转基因表达分析:
[0147]
通过上述任一途径感染含有荧光蛋白(mneongreen、egfp或dsred)的重组杆状病毒后,以特殊饮食饲养幼虫,并将其保持在70%湿度、23-25℃的加湿室中并且暴露于16:8光周期(l:d)循环。通过荧光显微术目测监测表达。对其进行接种并将其孵育4天后,收集幼虫体液用于后续分析。通过sds page电泳分析体液中所含的蛋白质(sambrook和russell,2001,molecular cloning,a8.40-a8.55)。进一步使用pvdf膜进行蛋白质印迹免疫测定。
[0148]
实施例6:crispr/cas介导的稳定整合
[0149]
在此实施例中,目的基因(goi)的基因组整合经由crispr/cas技术实现。如先前提到的,crispr/cas技术为由grna和pam序列识别介导的精确稳定基因组整合提供了一种有吸引力的替代方法。使用crispr进行基因组插入的一种方式是使用靶标和辅助质粒,如(hovemann bt,等人gene.1998oct 9;221(1):1-9;bassett a,等人methods.2014sep;69(2):128-36)所描述。
[0150]
crispr靶序列通过三步过程进行鉴定。第一步是创建一个基于bsf参考基因组的脱靶数据库。该数据库是通过在整个基因组中循环搜索cas12a酶的pam序列tttn来创建的。第二步是在感兴趣的区域发现可能的crispr指导rna靶序列。搜索肌动蛋白5c基因(ncbi id:loc119646467)和基因上游的2k碱基区两者以进行发现。选择肌动蛋白5c的理由是因为它是在bsf的不同生命周期中始终前1%高度表达的基因之一。此外,该基因被高度可及的dna区域包围,这是成功的crispr整合的一个决定性特征。基因区域的发现产生了22个可能的cas12a指导rna靶序列,而上游区域的发现产生了166个可能的靶序列。
[0151]
靶序列识别的第三阶段是根据适当的性能矩阵对发现的可能的cas12a靶标进行排序。使用的主要性能矩阵是最小化与第一步中创建的脱靶数据集的匹配。如果靶序列之间存在联系,则选择折叠自由能最小且gc含量更好的序列。在肌动蛋白5c基因内发现的22个cas12a靶序列中,三个在bsf脱靶数据库中匹配为零。选择的最佳指导rna tttgggttgagtggagcctcggtc具有59%的gc含量和-3.6的自由能。对于上游区域发现的166个靶序列,选择的最佳序列tttcaacggtcgccaggctagggt具有58%的gc含量和-3.2的自由能。
[0152]
从维多利亚多管发光水母(aequorea victoria)中分离出的增强型绿色荧光蛋白(egfp)通过两种方法在bsf中表达。第一个是肌动蛋白5c基因内部的整合,其中供体模板编码goi,没有启动子,因为敲入的基因将依赖于肌动蛋白5c的转录机制。在这种情况下,基因将被1k同源臂包围。第二种方法是基因上游区域的整合,这需要带有合适启动子的供体模板,即除了goi之外的果蝇肌动蛋白5c。供体模板中较长的插入物需要1.5k的较长同源臂来围绕插入物。
[0153]
辅助质粒含有grna序列,其靶向u6启动子下的位点和组成型活性启动子多泛素下的cas12a。具有肌动蛋白5c/egfp的bsf幼虫显示组成型高水平的egfp荧光。egfp在大多数(如果不是所有)bsf组织中都有表达。使用如上述基于转座子的技术操作的昆虫中所述的测定也在转基因昆虫中检测到egfp蛋白。通过pcr和测序确认egfp基因组整合到靶位点中。如本文所述的术语“引物”是指用作dna复制起点的核酸链。
[0154]
实施例7:粉碎以促进蛋白质回收
[0155]
将幼虫粉碎以通过使它们形成颗粒混合物来增加幼虫的流动性并增加幼虫的表面积、减少目标蛋白扩散所需的距离、增加从幼虫中回收的蛋白质的产量和/或提供其他益
处。通常,幼虫被破坏成尺寸为约1mm至约1cm的碎片。该过程可以使用从完整幼虫到约50微米碎片的任何大小的碎片。使用具有约0.5mm至约2.5mm的粗略直径的颗粒可以获得有利的结果。一个替代实施方案包括将幼虫压成尺寸通常为约0.1mm至约5mm、并且更通常为约0.5mm至约2mm的薄片。根据一个具体实施方案,将幼虫剁碎成约2mm量级的颗粒。
[0156]
1.通过碾磨粉碎:
[0157]
一种技术涉及用碾磨机粉碎昆虫幼虫。可以使用的具体碾磨机是fitzmill碾磨机。根据一种技术,可以操作机器使得刀片朝向向前的方向,从而产生颗粒形式的冷冻幼虫。碾磨机可以以不同的速度运行,以将幼虫切碎至不同程度。例如,碾磨机可以以约3000至约9000rpm运行。具体实施方案使用了约3000、约6000或约9000rpm。粉碎可以在降低的温度下进行。例如,粉碎可以在约-100℃至约30℃的温度范围内进行。一个具体实施方案在约4℃下进行。
[0158]
2.通过锥形球磨碾碎粉碎:
[0159]
第二种技术涉及用锥形球磨机粉碎。可以使用的具体碾磨机是quadro comil。碾磨机可以以不同的速度且以各种配置运行,以将幼虫切碎至不同程度。
[0160]
3.通过撞击粉碎:
[0161]
第三种技术涉及通过撞击粉碎。这种方法在极端寒冷的条件下,用刀片、锤子或木槌的平边敲击幼虫。
[0162]
4.通过筛分或筛选粉碎:
[0163]
第四种技术包括通过“筛分”装置或筛网剥落要改变大小的材料。撞针的刀片或平面都可以朝向幼虫。可以通过将幼虫刮过或拖过筛网或筛子来控制大小减小。
[0164]
如果幼虫感染了杆状病毒,则通过暴露于伽马射线照射来进一步加工经加工的幼虫生物质。这种照射的目的是灭活杆状病毒,并且也使得粉末无菌。通过对昆虫幼虫进行生物测定,对每个批次进行测试以证明杆状病毒不再具有活性,以检查是否发生感染。
[0165]
然后可以将幼虫的碎片、完整幼虫、完整昆虫和/或昆虫碎片与提取缓冲液混合。提取缓冲液可以包括靶蛋白可溶于其中的任何组分。根据一个实施方案,缓冲液包含具有4至8的ph的50mm tris、0至300nm nacl和0至5mmβ-巯基乙醇。
[0166]
缓冲液可以与昆虫或与粉碎的昆虫部分以多种比率混合。该比率可以取决于执行的运行次数。例如,如果进行多次运行,则该比率可能会偏向更多昆虫。可以使用的比率实例为1:3昆虫:缓冲液。
[0167]
一旦昆虫/昆虫碎片和缓冲液组合,它们就可以混合。可以用多种不同的设备以多种方式进行混合。例如,混合在一起可以用直立圆筒混合(end over end mixing)或用顶置轻质混合机(overhead lightening mixer)进行。
[0168]
在混合昆虫碎片后,可以从幼虫或幼虫碎片中提取目标蛋白,并将碎片从含有目标蛋白的缓冲液中分离出来。提取和澄清可以单独或一起进行。提取和分离可以以多种不同的方式进行。例如,可以使用滗析、筛分、筛选、低速离心、逆流提取、滗析离心、中空管或大口径中空纤维或板框切向流过滤、和/或渗滤提取。可以进行多于一次提取和/或分离步骤。此外,一种或多种不同的方法可以用于提取和分离。所使用的提取和分离技术两者可能均至少部分取决于所涉及的蛋白质和昆虫碎片的大小,以及其他因素。提取可能需要约15至约45分钟。提取感兴趣的蛋白质或材料的时间范围很大程度上取决于感兴趣的蛋白质或
材料以及提取过程中使用的缓冲液,并且范围可以为15秒至长达4小时。
[0169]
可以控制的其他提取参数可以包括温度、离心速度和潜在切向流过滤步骤的标称截留分子量(nmwco)范围。通常,提取在约4℃至约45℃的温度范围内进行。根据两个具体实施方案,提取可在约4℃或约20℃的温度下进行。用于提取的离心可以以约2,000x g至约15,000x g的速度进行。用于提取的潜在切向流过滤步骤的标称截留分子量(nmwco)范围可以是约100kda nmwco至约0.22微米。
[0170]
可以在约4℃至约45℃的温度范围内进行澄清。根据一个具体实施方案,在约4℃的温度下进行澄清。可以进行用于澄清的离心可以以约2,000x g至15,000x g的速度进行。另外,可以用约0.01mm至约1mm的筛网大小进行澄清。一个具体实施方案是用约0.5mm的筛网大小进行的。用于澄清的潜在切向流过滤步骤的标称截留分子量(nmwco)可以在约100kda nmwco至约0.22微米的范围内。
[0171]
本发明可用于从所涉及的生物体中分离任何蛋白产物或其他所需材料或组分。例如,可以分离昆虫幼虫表达或可能表达的任何蛋白质,无论是天然的还是重组的。
[0172]
实施例8:重组蛋白的纯化
[0173]
将含蛋白质的缓冲液与其他昆虫部分分离后,将蛋白质从缓冲液中分离。这是利用已知的用于分离蛋白质的方法进行的。例如,通过切向流过滤、液-液提取、柱层析、沉淀、膜结合、和/或任何其他已知过程来分离蛋白质。
[0174]
进行分离过程直至达到所需的蛋白质纯度。通常,处理蛋白质直至达到至少约85%的纯度。更通常地,蛋白质为至少约90%纯。在某些情况下,蛋白质为至少约95%纯。处理蛋白质直至其具有针对其最终用途有效通常所必需的纯度。
[0175]
sars-cov2刺突蛋白的纯化
[0176]
本实施例描述了黑士兵蝇幼虫中全长sars-cov2刺突蛋白的优化的纯化过程。需要三个色谱步骤以达到纯度大于95%,所述步骤包括两个离子交换步骤和一个中间体疏水相互作用色谱步骤。
[0177]
简而言之,收集收获的幼虫并在-60℃下冷冻,直到它们准备好用于重组蛋白、总蛋白和蛋白酶测定。将冷冻的幼虫解冻,并在具有4至8的ph的50mm tris、0至300mm nacl和0至5mm微米过滤器中均质化。
[0178]
使用非离子去污剂从细胞膜中提取刺突蛋白,并通过10,000
×
g离心30分钟去除不溶性材料。使用包括阴离子交换、亲和捕获和尺寸排阻色谱法的过程纯化s蛋白寡聚体。在纯化过程中,去污剂浓度降低,使s三聚体形成更高有序的蛋白质-蛋白质胶束纳米粒子。将纯化的s纳米粒子通过0.2微米过滤器并储存在-80℃。
[0179]
使用4-12%梯度聚丙烯酰胺凝胶(invitrogen)通过sds-page分析sars-cov刺突蛋白样品,用gelcode blue染色试剂(pierce,rockford,il)染色,并使用onedscan系统(bd biosciences,rockville,md)通过扫描光密度测定进行量化。使用bca(二奎啉甲酸蛋白测定,pierce biochemicals)测定纯化的刺突蛋白的总蛋白浓度,并且使用zetasizer nano(malvern instruments,pa)使用制造商推荐的方法的标准品β-巯基乙醇,通过动态光散射检测s蛋白粒径和样品均一性。匀浆在4℃下以25,000
×
g离心30分钟以去除大碎屑。离心后,还使用0.22进一步澄清上清液。
[0180]
重组蛋白产量
[0181]
每只幼虫的重组蛋白产量在2mg以上。优选地,重组蛋白的产量为每只幼虫30mg-35mg。幼虫重量大约为0.3g,其中干物质为40%。干物质的45%是蛋白质,重组蛋白可以达到总蛋白产量的10-50%。通过使用来自昆虫的内源启动子并优化密码子,产量提高到60%以上(在黑士兵蝇的情况下,约为35mg/一只幼虫)。
[0182]
实施例9:从血淋巴中回收重组蛋白
[0183]
通过从昆虫中回收血淋巴来回收含有蛋白质的悬浮液,这很容易通过给昆虫放血来完成。放血后,血淋巴会经历氧化反应,并且颜色变得又黑又粘稠。通过将样品冷藏并通过添加抗氧化剂(诸如谷胱甘肽)减缓氧化反应。经由离心从血淋巴中沉淀出血细胞。对所得上清液进行测定或冷冻保存以备后用。合适的蛋白质纯化系统包括高效液相色谱、亲和结合柱和本领域普通技术人员已知的其他类似技术,所述技术用于容易地进一步从上清液中分离目标蛋白。
[0184]
实施例10:在昆虫幼虫中生产vlp
[0185]
a.fmdv型vlp o/ind/r2/75
[0186]
fmdv型vlp o/ind/r2/75在黑士兵蝇的昆虫幼虫中产生。根据kumer等人,2016(kumar,m.,等人,2016.virusdisease,27(1),84
–
90)描述的方法,将编码此类vlp的重组bev感染到bsf昆虫幼虫中。简而言之,将50μl重组杆状病毒注射到每只幼虫的血腔中。每天观察幼虫因杆状病毒感染引起的行为、摄食习性和死亡率的变化。以1-8感染后天数(dpi)的规定时间间隔进行完整幼虫提取物的制备和血淋巴的收集。
[0187]
在1、2、3、4、5、6、7和8dpi从bsf收集的血淋巴(2.5ml)通过20%-60%蔗糖梯度(20%、30%、40%、50%和60%蔗糖各0.5ml)纯化,所述纯化通过在5ml异质同晶聚合物(polyallomer)管中在4℃下以120000
×
g超速离心16小时进行。超速离心后,从下至上收集0.5ml各级分,并在s-elisa中进行测试。对血淋巴和整个幼虫提取物进行s-elisa。简而言之,96孔elisa板涂有50微升(μl)在兔中募集的fmdv抗146s血清,该血清以1:1000稀释在碳酸盐-碳酸氢盐缓冲液(ph 9.6)中,并在37℃下孵育1小时。向每孔添加50μl体积的所有试剂。孵育后,板用pbst(含有0.05%吐温-20的磷酸盐缓冲盐水(pbs))洗涤三次。一式两份添加样品,其中有四个孔各自用于阳性(病毒抗原)和阴性(sf9细胞抗原)对照。如前所述将板孵育且洗涤。然后将以1:4000稀释在封闭缓冲剂(pbst 5%成年供体牛血清)中的抗146s豚鼠示踪抗体添加到每个孔中。在37℃孵育1小时后洗涤板,并添加以1:3000稀释在封闭缓冲剂中的与辣根过氧化物酶缀合的抗豚鼠igg并孵育。洗涤后,添加新鲜制备的邻苯二胺/过氧化氢底物并在37℃下孵育15分钟以显色。然后使用1m h2so4停止反应。在具有620nm参考波长的elisa读取器中,在492nm处读取板吸光度。阳性-阴性截止值计算为四个中间体空白孔的两倍平均值
±
标准偏差。
[0188]
通过分光光度法测定根据从感染的bsf幼虫收集的血淋巴峰值部分的重组蛋白含量的vlp量。纯化的vlp通过260nm和280nm处的分光光度读数进行量化。
[0189]
b.hiv gag 1vlp:
[0190]
将人类密码子优化的十八烷基化hiv-1c亚型gag基因与不同的调控元件偶联并克隆到piggybac质粒中。该质粒与编码piggybac转座酶的辅助质粒共转化到bsf的前胚层卵中。
[0191]
然后从转基因bsf幼虫或蛹(g1)中纯化vlp,如lynch等人,2010(lynch ag,等人,
2010,bmc biotechnology,10:30)所述。
[0192]
通过引用并入
[0193]
所有提及的出版物、专利和专利申请特此以引用的方式整体并入本文,如同每个单独出版物、专利或专利申请具体地和单独地被指示为以引用的方式并入一样。在有冲突的情况下,将以本技术(包括本文中的任何定义)为准。
[0194]
等效方案
[0195]
本领域技术人员仅仅使用常规试验将认识到或者能够确定本文所描述的发明的具体实施方案的许多等效方案。此类等效方案旨在由以下权利要求涵盖。
再多了解一些
本文用于创业者技术爱好者查询,仅供学习研究,如用于商业用途,请联系技术所有人。