1.本发明属于病毒学和肿瘤学领域,更具体地,本发明涉及一种新型溶瘤腺病毒载体、由其包装的病毒及其应用。
背景技术:
2.溶瘤病毒是一类能在肿瘤细胞中特异性复制而不影响正常组织生存稳态的基因工程病毒,是继免疫检查点抑制剂之后的又一抗肿瘤生物疗法。以牛痘病毒、柯萨奇病毒、腺病毒、呼肠孤病毒、单纯疱疹病毒和麻疹病毒等病毒为载体构建的溶瘤病毒正在进行广泛的临床前及临床试验。其中的腺病毒载体是目前最具应用前景的疫苗载体之一,其具有高表达、可同时诱导特异性体液免疫和细胞免疫反应、安全性好、易于制备、无需佐剂等优点,被广泛应用于各种预防性或治疗性疫苗的研发如:埃博拉疫苗、寨卡疫苗、hiv疫苗、流感疫苗、疟疾疫苗、新型冠状病毒疫苗等。同时,在肿瘤基因治疗领域,腺病毒也常用作基因治疗及溶瘤疫苗构建,溶瘤腺病毒已成为最具发展前景的抗肿瘤免疫疗法之一。其中,应用最广泛的是人血清5型腺病毒(adhu5),然而,由于75-80%的个体中存在抗adhu5的预存中和抗体,以adhu5为载体的疫苗,其免疫效果受预存中和抗体的影响,不仅削弱其免疫效果,而且可能增强副反应。为避免这一问题,研究者选择稀有血清型或其它种属来源的腺病毒作为疫苗载体。黑猩猩型腺病毒只流行于非洲的黑猩猩中,人群中一般不含抗黑猩猩型腺病毒的中和抗体,故基于黑猩猩型腺病毒载体的产品,其综合免疫效果优于adhu5。
3.由于腺病毒基因组相对较大,一般的分子生物学方法难以完成重组腺病毒载体的构建,因此,腺病毒载体的构建依然是一个技术瓶颈。本发明人致力于此方面的研究,在以往的研究中已经进行了腺病毒载体的一些改良工作,然而进一步的、更符合本领域要求或临床所需的改造方案仍然是需要的。
技术实现要素:
4.本发明的目的在于提供一种新型溶瘤腺病毒载体、由其包装的病毒及其应用。
5.在本发明的第一方面,提供一种制备溶瘤腺病毒载体的方法,包括基于黑猩猩型腺病毒adc68基因组序列,改造其e1序列、e3序列和e4序列,所述改造包括:(1)在e1区保留e1a序列(删除其它序列),利用肿瘤特异性启动子驱动e1a表达;(2)删除e3区序列(部分或全部);和(3)改造e4序列,以c亚型人腺病毒基因组e4序列中orf6和/或orf6/7替换其e4序列中orf6和/或orf6/7;可选地,还以c亚型人腺病毒基因组e4序列中orf4和/或orf3替换其e4序列中orf4和/或orf3;较佳地还删除其e4序列中orf1、orf2和/或orf3;其中,在e1区或e3区引入增强抑癌效果的基因(如溶瘤基因)的表达盒(如e1a后面或肿瘤特异性启动子之前)。
6.在本发明的另一方面,提供一种溶瘤腺病毒载体,包括以黑猩猩型腺病毒adc68基因组为基础的序列,其中e1序列、e3序列、e4序列被改造,所述改造包括:(1)在e1区保留e1a序列(删除其它序列),利用肿瘤特异性启动子驱动e1a表达;(2)删除e3区序列(部分或全
部);和,(3)改造e4序列,以c亚型人腺病毒基因组e4序列中orf6和/或orf6/7替换其e4序列中orf6和/或orf6/7;可选地,还以c亚型人腺病毒基因组e4序列中orf4和/或orf3替换其e4序列中orf4和/或orf3;较佳地还删除其e4序列中orf1、orf2和/或orf;其中,在e1区或e3区引入增强抑癌效果的基因(溶瘤基因)的表达盒。
7.在一个优选例中,所述c亚型人腺病毒包括(但不限于):人血清5型腺病毒adhu5,adhu1,adhu2,adhu6;较佳地为adhu5。
8.在另一优选例中,所述肿瘤特异性启动子包括选自(但不限于):人端粒酶逆转录酶(htert)启动子,survivin启动子、环氧化酶(cox-2)启动子,甲胎蛋白(afp)启动子,e2f-1启动子或ki67启动子,或其组合。
9.在另一优选例中,所述的增强抑癌效果的基因包括(但不限于)编码选自下组因子的基因:csf2,p53,tnf-α,il-21,il-12,il-6,il-4,cd40l,pd-l1单抗,或其组合;较佳地为csf2,p53,或其组合。
10.在另一优选例中,(2)中,所述的增强抑癌效果的基因为2个或多个时,以连接序列进行操作性连接;较佳地,所述连接序列包括(但不限于):f2a,p2a,t2a,ires,gggsgggs。
11.在另一优选例中,(2)中,所述表达盒中,可选的还包括(但不限于):以下可操作性相连的元件:信号肽编码序列、连接序列、终止子等。
12.在另一优选例中,所述重组腺病毒载体中,可选的还包括(但不限于):报告基因的表达盒;反向末端重复序列;和/或酶切位点;较佳地包括:i-ceui,pi-scei,swai,paci。
13.在另一优选例中,(1)中,e1序列的删除区域为e1b 19k和e1b 55k区域;较佳地为adc68基因组第1444-3403bp位。
14.在另一优选例中,(2)中,e3序列的删除区域为全部序列或选自orf2~orf8区域的至少2、3、4、5、6或7个orf序列(较佳地,以增强抑癌效果的基因的表达盒取代e3序列中全部序列或选自orf2~orf8区域的至少2、3、4、5、6或7个orf序列);较佳地删除区域为orf2~orf8区域,更佳地该区域adc68基因组第27446-31423位。
15.在另一优选例中,(3)中,e4序列改造包括选自(但不限于):(a)以c亚型人腺病毒基因组e4序列中orf6/7和orf6替换其e4序列中orf6/7和orf6,删除其e4序列中orf1、orf2和orf3;(b)以c亚型人腺病毒基因组e4序列中orf6、orf4和orf3替换其e4序列中orf6、orf4和orf3的序列,删除其e4序列中orf1、orf2、orf6/7;(c)以c亚型人腺病毒基因组e4序列中orf6/7和orf6替换其e4序列中orf6/7和orf6的序列;或,(d)以c亚型人腺病毒基因组e4序列中orf6、orf4替换其e4序列中orf6、orf4,删除其e4序列中orf1、orf2和orf3、orf6/7;较佳地,所述的重组腺病毒载体是seq id no:1所示核苷酸序列的载体。
16.在另一优选例中,所述e3或e4的改造包括选自:
17.(i)以增强抑癌效果的基因的表达盒取代e3序列中orf2~orf8;且以c亚型人腺病毒基因组e4序列中orf6/7和orf6替换其e4序列中orf6/7和orf6,删除其e4序列中orf1、orf2和orf3;
18.(ii)以增强抑癌效果的基因的表达盒取代e3序列中orf2~orf8;且以c亚型人腺病毒基因组e4序列中orf6、orf4和orf3替换其e4序列中orf6、orf4和orf3的序列;删除其e4序列中orf1、orf2、orf6/7;
19.(iii)以增强抑癌效果的基因的表达盒取代e3序列中orf2~orf8;且以c亚型人腺
病毒基因组e4序列中orf6/7和orf6替换其e4序列中orf6/7和orf6的序列;
20.(iv)以增强抑癌效果的基因的表达盒取代e3序列中orf2~orf8;且以c亚型人腺病毒基因组e4序列中orf6、orf4和orf3替换其e4序列中orf6、orf4和orf3的序列;删除其e4序列中orf1、orf2、orf6/7;
21.(v)以增强抑癌效果的基因的表达盒取代e3序列中orf2~orf8且以c亚型人腺病毒基因组e4序列中orf6/7和orf6替换其e4序列中orf6/7和orf6的序列;
22.(vi)以增强抑癌效果的基因的表达盒取代e3序列中orf2~orf8;且以c亚型人腺病毒基因组e4序列中orf6、orf4替换其e4序列中orf6、orf4;删除其e4序列中orf1、orf2和orf3、orf6/7。
23.在本发明的另一方面,提供前面任一所述的溶瘤腺病毒载体的用途,用于组装重组溶瘤腺病毒,该重组溶瘤腺病毒用于抑制肿瘤。
24.在本发明的另一方面,提供一种重组溶瘤腺病毒,其由前面任一所述的溶瘤腺病毒载体包装获得。
25.在本发明的另一方面,提供一种制备所述的重组溶瘤腺病毒的方法,包括:(a)制备前面任一所述的溶瘤腺病毒载体;和(b)将(a)的溶瘤腺病毒载体转染病毒生产细胞,从而包装获得重组的溶瘤腺病毒。
26.在一个优选例中,所述的病毒生产细胞是可以实现病毒包装的细胞;较佳地包括:hek293细胞,293t细胞等。
27.在本发明的另一方面,提供所述的重组溶瘤腺病毒的用途,用于表达溶瘤效应物,该溶瘤效应物可特异性靶向于肿瘤并抑制肿瘤;较佳地,所述肿瘤包括:结直肠癌、结肠癌、肝癌、肺癌、宫颈癌、黑色素瘤、鼻咽癌、骨肉瘤、胰腺癌、食管癌、胃癌、乳腺癌、前列腺癌、白血病、口腔癌、唾液腺肿瘤、鼻腔与鼻旁窦恶性肿瘤、喉癌、耳部肿瘤、眼部肿瘤、甲状腺肿瘤、纵隔肿瘤、胸壁、胸膜肿瘤、小肠肿瘤、胆道肿瘤、胰腺与壶腹周围肿瘤、肠系膜与腹膜后肿瘤、肾脏肿瘤、肾上腺肿瘤、膀胱肿瘤、前列腺癌、睾丸肿瘤、阴茎癌、子宫内膜癌、卵巢恶性肿瘤、恶性滋养细胞肿瘤、外阴癌与阴道癌、恶性淋巴瘤、多发性骨髓瘤、软组织肿瘤、骨肿瘤、皮肤及附件肿瘤、神经系统肿瘤、小儿肿瘤;更佳地,所述肿瘤包括:结直肠癌、肝癌、肺癌、宫颈癌、黑色素瘤。
28.在另一优选例中,所述重组溶瘤腺病毒通过促进肿瘤细胞发生时间依赖性凋亡而诱导肿瘤凋亡;或通过诱导caspase3激活、p53激活、阻滞细胞周期而抑制肿瘤。
29.在另一优选例中,所述重组溶瘤腺病毒通过诱导肿瘤细胞自噬而诱导肿瘤凋亡。
30.在另一优选例中,所述肿瘤特异性启动子为人端粒酶逆转录酶(htert)启动子,所述肿瘤为端粒酶阳性的肿瘤。
31.在本发明的另一方面,提供一种抗肿瘤的药物组合物或药盒,所述的药物组合物或药盒中含有:有效量的所述的重组溶瘤腺病毒;和药学上可接受的载体。
32.在本发明的另一方面,提供一种用于制备溶瘤腺病毒的试剂盒,包括:前面任一所述的溶瘤腺病毒载体;以及,病毒生产细胞。
33.本发明的其它方面由于本文的公开内容,对本领域的技术人员而言是显而易见的。
附图说明
34.图1、padc68xy1、padc68xy5、padc68xy6、padc68xy7、padc68xy8、padc68xy9、padc68xy10腺病毒病毒载体的主要元件示意图。
35.图2、padc68xy7、双条件复制型溶瘤腺病毒载体padc68xy-r1、padc68xyr1-csf2、padc68xyr1-p53、padc68xyr1-csf2-p2a-p53(p2a图中未示)。
36.图3、bglii、mfei和xhoi限制性内切酶分别进行酶切鉴定,检测重组溶瘤腺病毒载体的准确性。
37.图4、重组溶瘤腺病毒蛋白表达情况的western blot检测。
38.图5a~k、低、中、高剂量下各个溶瘤腺病毒对于不同的肿瘤细胞的促凋亡作用的折线图。
39.图6a-b、溶瘤病毒感染早期(24h)(a)以及感染晚期(48h)(b),利用流式细胞法检测各个溶瘤腺病毒对于a375细胞系的促凋亡作用。
40.图7a-d、溶瘤腺病毒在小鼠体内对肿瘤的抑制作用的动物处理流程(a);不同溶瘤腺病毒在小鼠水平上均可显著抑制黑色素瘤的生长(b,c,d)。
具体实施方式
41.腺病毒的基因组比较大,以其进行载体改造较为困难,周期长。以野生型腺病毒为材料,提取其基因组为模板,进行载体改造存在野生型腺病毒残留的风险。同时,如何提高其载量也是本领域所需要的。为此,本发明人经过深入的研究,揭示了一种新型腺病毒载体,并在该新型载体的基础上引入了一个或多个外源增强抑癌效果的基因(如溶瘤基因),实现高效表达。同时,该复合型溶瘤腺病毒可以极为显著地抑制肿瘤、杀伤能力强。
42.术语
43.如本文所用,术语“特异性表达”是指目的基因(如本发明中为增强抑癌效果的基因)在特定的时间和/或特定的组织表达。在这类启动子调控下,基因往往只在肿瘤部位表达、或大部分(如大于80%、85%、90%、95%、98%、99%)在肿瘤部位表达。
44.如本发明所用,所述的“元件”是指一些对于蛋白的表达有用的一系列功能性的核酸序列,本发明中,所述的“元件”被系统地构建以形成一种表达构建体。所述的“元件”的序列可以是本发明中所提供的那些,也包括它们的变体,只要这些变体基本上保留了所述“元件”的功能,其通过插入或删除一些碱基(如1-50bp/nt;较佳地1-30bp/nt,更佳地1-20bp/nt,更佳地1-10bp/nt),或进行随机或定点突变等来获得。
45.如本发明所用,所述的“操作性连接”或“可操作性相连”是指两个或多个核酸区域或核酸序列的功能性的空间排列。例如:启动子区被置于相对于目的基因核酸序列的特定位置,使得核酸序列的转录受到该启动子区域的引导,从而,启动子区域被“可操作地连接”到该核酸序列上。
46.如本发明所用,所述的“表达盒”是指包含有表达目的基因所需的所有必要元件的基因表达系统,通常其包括以下元件:启动子、目的基因序列,终止子;此外还可选择性包括信号肽编码序列等。这些元件是操作性相连的。
47.如本发明所用,所述的“构建物(或称构建体)”指一种已经通过人为干预,使其含有按照自然界中不存在的序列所组合和排列的dna片段的单链或者双链dna分子。所述的“构建物”包括表达载体;或者,所述的“构建物”被包含在表达载体中、作为表达载体的一部分。
48.如本发明所用,所述的“外源”或“异源”是指来自不同来源的两条或多条核酸或蛋白质序列之间的关系,或来自不同来源的核酸与宿主细胞之间的关系。例如,如果核酸与宿主细胞的组合通常不是天然存在的,则核酸对于该宿主细胞来说是异源的。特定序列对于其所插入的细胞或生物体来说是“外源的”。
49.如本发明所用,所述的“含有”,“具有”或“包括”包括了“包含”、“主要由
……
构成”、“基本上由
……
构成”、和“由
……
构成”;“主要由
……
构成”、“基本上由
……
构成”和“由
……
构成”属于“含有”,“具有”或“包括”的下位概念。
50.如本发明所用,“有效量”或“有效剂量”是指可对人和/或动物产生功能或活性的且可被人和/或动物所接受的如本发明所用。
51.如本发明所用,“药学上可接受的”的成分是适用于人和/或哺乳动物而无过度不良副反应(如毒性、刺激和变态反应)的,即具有合理的效益/风险比的物质。术语“药学上可接受的载体”指用于治疗剂给药的载体,包括各种赋形剂和稀释剂。
52.腺病毒载体
53.腺病毒的基因组比较大,在先前的技术中,本发明人尝试了较多的改造策略,包括针对其基因组中e1和e3进行改造,删除全部或部分的基因,但是鉴于其e4区域的重要作用,现有技术中尚没有针对其e4进行系统性改造的先例。本发明人发现,可以针对e4进行全部或部分改造,以c亚型人腺病毒基因组中相应的区域进行替换、或有限地进行序列删减,可以获得复制能力、感染能力增强的病毒,甚至还可以实现外源基因插入容量的增大。
54.为了提高安全性,用作疫苗载体的腺病毒通常为复制缺陷型,即删除了e1基因。因此,通常用整合了adhu5 e1基因的hek 293细胞包装和扩增非复制型腺病毒。e4 orf6是一个多功能蛋白,参与病毒复制的多个过程,对于腺病毒的复制极为重要。orf6可与e1b 55-kda结合,形成orf6-e1b复合物,该复合物在转录后阶段促进主要晚期病毒mrna的输出,从而加强晚期病毒基因的表达,同时抑制宿主蛋白的合成。在腺病毒感染的细胞中,orf6-e1b复合物还参与抑制e1a诱导的p53激活,从而使p53降解,抑制宿主细胞凋亡。而且,orf6可间接提高病毒dna合成效率。orf3与orf6功能相似,可部分或完全补偿彼此的缺失。尽管adhu5 e1b 55k和e4 orf6蛋白之间的相互作用相对保守,但adc68的e4orf6蛋白与adhu5的e4 orf6蛋白同源性较低,与adhu5 e1b 55k的结合可能不稳定或效率降低,导致非复制型黑猩猩腺病毒产量降低。为避免出现以上问题,提高重组腺病毒adc68的产量,本发明的具体实施例中,将adc68的e4序列全部或部分替换成adhu5的e4序列,设计成多个分别带有不同e4序列的重组adc68载体。adhu5属于c型人腺病毒,与c型腺病毒家族中的其他血清型腺病毒(如adhu1,adhu2,adhu6)e4 orf6蛋白相似度极高(》98%),可以预见,本发明中adc68 e4的改造,除采用adhu5基因组相对应的序列作替换,亦可采用c型人腺病毒家族中的其他血清型腺病毒基因组的对应序列进行替换。
55.在进行e4区域改造的同时,本发明人也改造了e1区和e3区,该两个区域的改造使得高效的溶瘤成为可能。对于e1区,本发明人将肿瘤特异性启动子克隆至e1a基因前,调控腺病毒e1a的表达,同时删除e1b 19k和e1b 55k;本发明人发现,e1a的保留可以有利于所插入的外源基因(如本发明中为增强抑癌效果的基因)的复制和表达,对于外源基因的高效表
达是尤其有利的。对于e3区,本发明人删除了其全部或部分orf区,较佳地删除区域为选自orf2~orf8区域的至少2、3、4、5、6或7个orf序列;更佳地删除orf2~orf8区域。本发明人发现,e3区中orf1或orf9区域并非必须,它们被删除也能实现良好的外源基因的表达;然而,保留orf1或orf9区域则有利于更高效地表达,获得更为理想的效果。
56.作为本发明的优选方式,所述的肿瘤特异性启动子为人端粒酶逆转录酶(htert)启动子。htert启动子只在端粒酶阳性的细胞中有转录活性,而大多数正常体细胞中端粒酶表达受抑制,绝大多数(85%~90%或更高)的肿瘤细胞高表达端粒酶,如乳腺癌细胞、肝癌细胞、肾癌细胞等。从而,在所述重组腺病毒载体中设置该启动子,可驱动增强抑癌效果的基因选择性在端粒酶阳性的肿瘤细胞复制,诱导其凋亡,而对正常细胞影响很小。
57.作为一些可选择的方式,所述的重组腺病毒载体中还可包括选自以下操作性相连的元件或基因:外源基因表达盒;报告基因的表达盒;反向末端重复序列和/或酶切位点。应理解,报告基因、酶切位点等元件的设计有时候是为了在进行研究时提供方便观测或检测的途径,而当将本发明的重组腺病毒载体或重组腺病毒应用于临床药学领域时,其并非是必要的;或者,可以在所述报告基因的位置上以能表达具有药学活性的目的蛋白的基因替代。
58.所述的表达载体通常还含有复制起点和/或标记基因等。根据本发明的提示,本领域的技术人员熟知的方法能用于构建本发明所需的表达载体。这些方法包括体外重组dna技术、dna合成技术、体内重组技术等。所述的dna序列可有效连接到表达载体中的适当启动子(如cmv)上,以指导mrna合成。表达载体还包括翻译起始用的核糖体结合位点和转录终止子。此外,表达载体优选地包含一个或多个选择性标记基因,以提供用于选择转化的宿主细胞的表型性状。
59.本发明所述的表达载体中,在e3区引入增强抑癌效果的基因(如溶瘤基因)的表达盒,从而表达可抑制肿瘤的活性蛋白。作为一些可选的实施方式,所述的增强抑癌效果的基因包括(但不限于)编码下组因子的基因:粒细胞巨噬细胞集落刺激因子(csf2),p53,tnf-α,il-21,il-12,il-6,il-4,cd40l,pd-l1单抗,或其组合。所述的增强抑癌效果的基因可以是单条,也可以是两条或多条,只要其编码基因的长度在所述腺病毒可容纳的包装容量内。作为本发明的优选方式,所述增强抑癌效果的基因为csf2,p53,或其组合。
60.本发明中还包括具有与上述增强抑癌效果的基因相同功能的序列变异形式或简并体。所述的序列变异形式包括例如:其所编码的蛋白与野生型蛋白相比,若干个(通常为1-20个,最佳地1-10个,还更佳如1-8个、1-5个)氨基酸的缺失、插入和/或取代,以及在c末端和/或n末端添加或缺失一个或数个(例如为20个以内,较佳地为10个以内,更佳地为5个以内)氨基酸。例如,进行1个氨基酸的取代。任何与上述增强抑癌效果的基因编码的蛋白的序列同源性高(比如同源性为70%或更高;优选地同源性为80%或更高;更优选地同源性为90%或更高,如同源性95%,98%或99%)的、且保留相同功能/活性的蛋白及其相应的基因也可包括在本发明内。本发明也包括所述增强抑癌效果的基因的片段,其能编码具有抑癌活性的蛋白片段。
61.本发明的表达载体中的各元件是可操作性连接的,从而有利于病毒的包装或目的基因(增强抑癌效果的基因)的有效表达。
62.本发明人也优化了增强抑癌效果的基因的表达,优选地,所述增强抑癌效果的基
因的表达盒中,包括以下可操作性相连的元件:启动子、增强抑癌效果的基因和终止子。当多条增强抑癌效果的基因进行共同表达时,可利用本领域已知的连接子来进行连接,例如但不限于f2a,(gly4ser)3连接序列等。
63.作为本发明的可选方式,在需要的情况下,还可在表达载体中设置信号肽编码序列,kozak序列,wpre元件,poly(a)信号等。
64.作为本发明的更优选方式,所述所述启动子为cmv启动子。所述cmv启动子可使得增强抑癌效果的基因以较为合适的方式和表达量进行表达、与htert启动子驱动的e1a的表达相匹配,为两者发挥较好的协同作用奠定基础。
65.作为本发明的优选方式,采用基于合成生物学的技术构建本发明的新型腺病毒载体。与传统生物学的研究方向相反,合成生物学是从最基本的要素开始一步步建立零部件,在此过程中设计、修改遗传物质,最终获得理想的新生物体。但是,应理解,除了合成生物学的技术,在获得了本发明的技术方案后,其它构建本发明的腺病毒载体的方法也应被包含在本发明中。
66.本发明不仅获得了一系列基于黑猩猩型腺病毒的新型载体adc68xy,改造后的载体较传统的adc68载体更适宜在病毒包装细胞中生长、繁殖,产量高,从而可降低产品的生产成本。而且,本发明改造后的载体外源基因装载量也大大提高了,进一步增加了腺病毒载体的适用性。在本发明的一个实施例中,将两种增强抑癌效果的基因同时插入到e3区域,可实现共同表达。
67.根据本发明及现有技术所公开的信息,进行了适当的变化且仍然保留其原有功能的上述元件的变异体也包括在本发明中。例如,在严格条件下与本发明限定的序列杂交且具有相同功能序列变异体。如本发明所用,术语“严格条件”是指:(1)在较低离子强度和较高温度下的杂交和洗脱,如0.2
×
ssc,0.1%sds,60℃;或(2)杂交时加有变性剂,如50%(v/v)甲酰胺,0.1%小牛血清/0.1%ficoll,42℃等;或(3)仅在两条序列之间的相同性至少在50%,优选55%以上、60%以上、65%以上、70%以上、75%以上、80%以上、85%以上或90%以上,更优选是95%以上时才发生杂交。例如,所述序列也可为这些所限定序列的互补序列。
68.本发明的各元件所指向的基因的核苷酸全长序列或其片段通常可以用pcr扩增法、重组法或人工合成的方法获得。对于pcr扩增法,可根据本发明所公开的有关核苷酸序列,尤其是开放阅读框序列来设计引物,并用市售的cdna库或按本领域技术人员已知的常规方法所制备的cdna库作为模板,扩增而得有关序列。当序列较长时,常常需要进行两次或多次pcr扩增,然后再将各次扩增出的片段按正确次序拼接在一起。
69.作为本发明的优选方式,可采用合成生物学技术,全基因组合成所述重组溶瘤腺病毒载体,经线性化后在hek 293细胞中成功包装,并扩增出遗传稳定的重组腺病毒。这一方法不仅省时省力,而且不需依赖野生型腺病毒基因dna。这一发明为新型腺病毒载体的构建提供了一种快速有效的方法,有利于拓展腺病毒载体的应用。
70.本发明为新型腺病毒载体的构建提供了一种快速有效的方法,有利于拓展腺病毒载体的应用,该腺病毒载体可容纳的外源基因的长度更为灵活,为应用腺病毒载体来表达更多种类的蛋白提供了基础。且由于黑猩猩型腺病毒adc68在人群中很少流行,人群中一般不存在相应的中和抗体,不会被针对adhu5的抗体所中和。
71.本发明的载体可应用于各种基础研究和临床应用,譬如作为各种各样的基因的表达载体,也可应用于疫苗研发、基因治疗等。基于本发明的载体可进一步插入一个或多个抗肿瘤的外源基因,开发出效果更佳的重组溶瘤腺病毒。
72.本发明建立了以合成生物学制备重组腺病毒载体的新策略,这种策略无需获得野生型腺病毒,避免复杂的克隆过程,直接合成重组腺病毒的分子克隆,省时省力。这一策略解决了构建重组腺病毒载体的技术瓶颈,为重组腺病毒载体的发展和推广应用提供了坚实的理论和技术支撑。
73.溶瘤腺病毒
74.虽然人为修饰或改造已经赋予溶瘤病毒靶向入侵肿瘤细胞的特性,但单纯的溶瘤病毒载体仍不足以完全破坏肿瘤组织。因此,将外源基因插入溶瘤病毒载体以期提高抗肿瘤作用是值得关注的。本发明中,通过腺病毒载体的优化改进,在e3区插入外源的增强抑癌效果的基因的表达盒,在e1区运用促进复制和表达的有效元件,以及优化改造e4区,获得了独特的、溶瘤效果优异的溶瘤腺病毒。
75.获得所述含有外源的增强抑癌效果的基因的腺病毒表达载体后,将之转染病毒生产细胞,进行病毒的繁殖。转染后的一段时间后,可以收获病毒。所述的病毒生产细胞可以是本领域公知的各种能够繁殖腺病毒的细胞,例如hek293细胞等。
76.作为本发明的优选方式,收获的病毒可反复感染病毒生产细胞,持续传代。病毒滴度(tcid
50
)的测定可以根据本领域常规方法进行。所获得的重组腺病毒也包含在本发明中。
77.本发明的重组腺病毒载体生成的重组腺病毒能高效转染哺乳动物细胞、易于扩增及纯化、毒性低,其表达效率高且长久。本发明的腺病毒载体表达重组工艺简单、价格低廉、疗效持久。本发明的腺病毒载体表达获得的腺病毒,外源基因装载量高。
78.尽管本发明所述重组溶瘤腺病毒带有了增强抑癌效果的基因的表达盒,但是其表达特性没有受到影响,可实现高效表达,联合增强抑癌效果的基因共同发挥抑制肿瘤的效果。
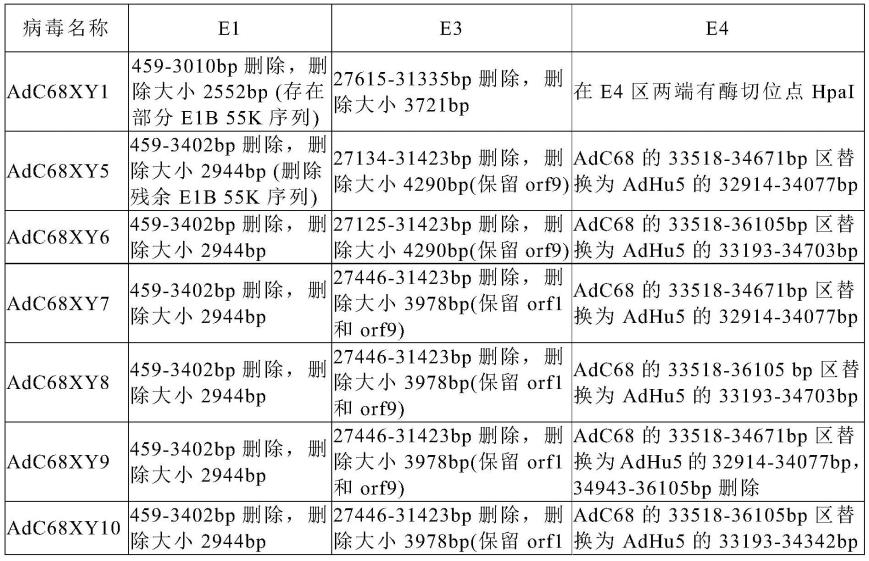
79.在本发明的具体实施例中,一方面具体验证了条件复制型腺病毒载体的溶瘤效果;另一方面具体验证了基于此载体进一步开发的重组溶瘤病毒的应用价值。
80.本发明的溶瘤腺病毒具有针对肿瘤的广谱适用性。在本发明的实施例中,对于多种多样的肿瘤细胞进行了实验测试,结果证实了该溶瘤腺病毒具有广谱的肿瘤杀伤作用,其主要的体外杀伤机制是促进肿瘤细胞发生时间依赖性凋亡。在正常动物体内实验中也证实了此溶瘤腺病毒具有明显的抑瘤作用,表明了其体内靶向性好,活性理想。本发明的溶瘤腺病毒特异性和安全性好,可实现靶向性给药或瘤内给药、避免全身性给药,可在达到高效抗肿瘤效果的同时减弱毒副反应,降低用药量或用药成本。
81.组合物、试剂盒或药盒
82.本发明还提供了一种组合物,它含有有效量的所述的腺病毒,以及药学上可接受的载体。较佳地,所述的腺病毒表达增强抑癌效果的基因(如溶瘤基因)。例如,所述的增强抑癌效果的基因包括但不限于编码下组因子的基因:csf2,p53,tnf-α,il-21,il-12,il-6,il-4,cd40l,pd-l1单抗。
83.通常,可将所述腺病毒配制于无毒的、惰性的和药学上可接受的水性载体介质中,其中ph通常约为5-8,较佳地,ph约为6-8。
84.本发明的药物组合物可以被制成针剂形式,例如用生理盐水或含有葡萄糖和其他辅剂的水溶液通过常规方法进行制备。活性成分(腺病毒)的给药量是治疗有效量,例如每天约0.1微克/千克体重-约10毫克/千克体重。当然,具体剂量还应考虑给药途径、病人健康状况等因素,这些都是熟练医师技能范围之内的。
85.基于本发明的新发现,还提供了一种试剂盒/药盒,其中包括所述的腺病毒表达载体或所述的腺病毒。所述的试剂盒/药盒还可包括病毒生产细胞(如293细胞),培养基等。
86.此外,所述的试剂盒/药盒中还可包括说明表达方法后腺病毒使用方法的使用说明书。
87.下面结合具体实施例,进一步阐述本发明。应理解,这些实施例仅用于说明本发明而不用于限制本发明的范围。下列实施例中未注明具体条件的实验方法,通常按照常规条件如j.萨姆布鲁克等编著,分子克隆实验指南,第三版,科学出版社,2002中所述的条件,或按照制造厂商所建议的条件。
88.细胞
89.hek 293细胞株购自中国科学院上海细胞库,培养液为含有10%胎牛血清的dmem。
90.除非另外说明,实施例中的其它各个细胞系均购于中国科学院上海细胞库。
91.限制性内切酶、感受态细胞、基因组序列
92.所有限制性内切酶购自new england biolabs。
93.腺病毒adc68序列参照genbank公布序列,即genbank登录号:ac_000011。
94.腺病毒人血清型5型(adhu5)的e4序列参照genbank登录号:ac_000008.1。
95.pcr酶及同源重组酶购自南京诺唯赞生物科技股份有限公司。
96.数据分析
97.作图及数据分析均使用graphpad prism 8软件,各组之间的统计学差异均使用one way anova法分析,p《0.05被认为有统计学差异。
98.实施例1、adc68xy系列腺病毒载体分子克隆的设计
99.首先,本发明人将adc68基因组序列中的部分e1和e3的部分序列删除。e1删除2552个碱基(删除区域为第459-3010位,从而可获得复制缺陷型腺病毒载体。e3删除3721个碱基(删除区域为第27615-31335位)。e1/e3删除可使外源基因插入的容量达7.5kb左右。
100.本发明人在e1删除区域加入酶切位点i-ceui/pi-scei(便于在此区域插入外源基因),e3删除区域加入酶切位点swai(以便在此区域也可插入外源基因),在adc68基因组的itr两侧分别加上paci酶切位点(便于将重组腺病毒质粒用paci线性化)。
101.为了便于观察该新型重组腺病毒的包装,本发明人在e1删除区的i-ceui和pi-scei酶切位点之间插入cmv-egfp序列,获得padc68xy1-egfp(申请号202110193614.6)使获得的重组腺病毒(adc68xy1-egfp)带有绿色荧光标记。
102.在adc68xy1基础上,本发明人对其进行改造,将e1区域、e3区域进行进一步删除,e4区部分替换为adhu5来源,得到系列重组腺病毒载体adc68xy5-10。各载体具体改造方案见表1(表中adc68序列位点的计算基于genbank登录号:ac_000011的序列;adhu5序列位点的计算基于genbank登录号:ac_000008.1的序列)。
103.表1
[0104][0105][0106]
实施例2、padc68xy系列腺病毒载体的分子克隆及鉴定
[0107]
基于以上设计的重组腺病毒padc68xy1-egfp分子克隆序列,人工合成该分子克隆。
[0108]
在获得的腺病毒载体padc68xy1-egfp基础上,本发明人用按实施例1表1所描述以及图1所示的设计方案,利用等温重组分子克隆方法,对adc68的e1、e3和e4序列进行改造,分别获得padc68xy5-egfp、padc68xy6-egfp、padc68xy7-egfp、padc68xy8-egfp、padc68xy9-egfp、padc68xy10-egfp腺病毒病毒载体。
[0109]
将获得的系列腺病毒质粒padc68xy-egfp用多种酶(mfei、apai、xhoi)酶切后,经1%琼脂糖凝胶电泳,通过dna条带证明系列腺病毒质粒padc68xy-egfp分子克隆是完整、正确的。
[0110]
将以上获得的重组腺病毒质粒padc68xy1-egfp、padc68xy5-egfp、padc68xy6-egfp、padc68xy7-egfp、padc68xy8-egfp、padc68xy9-egfp、padc68xy10-egfp各取2ug,用paci酶切线性化。
[0111]
根据lipofectamine 2000转染试剂盒的使用说明,将酶切后的腺病毒质粒dna转染密度约70%的hek 293细胞(6孔板)。转染前,换成无血清培养基,加入dna/脂质体复合物,转染5小时后,换含10%fbs、1%双抗的dmem培养基。在荧光显微镜下隔日观察egfp荧光强度及细胞病变,直至hek 293细胞出现大量噬斑时收集细胞,在室温与-80℃超低温冰箱之间反复冻融3次,3500rpm/min离心10min,收集上清置于-80℃超低温冰箱保种。
[0112]
转染后,随着时间的推移,绿色荧光表达发生变化:荧光逐渐富集并形成簇状,最终形成噬斑,说明在hek 293细胞中黑猩猩来源的复制缺陷型腺病毒adc68xy1-egfp、adc68xy5-egfp、adc68xy6-egfp、adc68xy7-egfp、padc68xy8-egfp、adc68xy9-egfp、adc68xy10-egfp都成功包装并复制出具有感染性的病毒颗粒。
[0113]
不同改造的腺病毒拯救所需时间(由重组腺病毒质粒转染到细胞中,得到重组腺病毒的时间),外源基因装载量和病毒产量存在一定差异,具体情况见表2。
[0114]
表2
[0115][0116][0117]
结果显示,e4区域替换为adhu5来源的序列后,可显著地提高腺病毒产量。e3区域orf1、orf9的保留,有助于提高腺病毒产量。e4区域部分删除(orf1-2或orf1-3)仍可拯救出腺病毒,并可进一步提高外源基因的装载量,但orf6或orf6/7必须保留;其中,orf6/7或orf6的存在有利于获得相对更高的病毒产量。
[0118]
实施例3、溶瘤腺病毒载体padc68xy-r1及重组溶瘤腺病毒的构建
[0119]
前述建立的padc68xy7-egfp复制缺陷型腺病毒:e1完全删除,e3部分删除(加入酶切位点swai),e4 orf6/7、orf6替换为hu5对应序列。
[0120]
以此载体为模板,本发明人进一步对e1区进行改造,删除egfp表达框,在其
△
e1区第459-3402bp位之间引入人端粒酶逆转录酶(htert)启动子,并重新引入e1a基因,使htert位于e1a基因前(htert-e1a)。
[0121]
根据上述,本发明人在e1区设置了htert启动子调控腺病毒e1a表达的元件。该e1区中,e1b 19k和e1b 55k已被删除。e1b 19k和e1b 55k的删除可增加此腺病毒载体的外源基因装载量。
[0122]
上述建立的载体,为双条件复制型溶瘤腺病毒载体padc68xy-r1,如图2。其全长核苷酸序列如seq id no:1,其中,第25599~25608位之间的序列可由外源基因所插入(也即外源基因替换其第25600~25607位的碱基)。
[0123]
本发明人将此载体用apai、mfei和xhoi限制性内切酶进行酶切鉴定,证明得到的溶瘤腺病毒载体正确无误,见图3。
[0124]
实施例4、携带外源基因的重组溶瘤腺病毒载体的建立
[0125]
csf2基因(seq id no:2):经密码子优化后,由北京擎科生物技术有限公司合成。
[0126]
野生型p53基因(seq id no:3):从a549细胞系中提取rna,逆转录获得。
[0127]
将两外源基因(csf2基因或p53基因)分别克隆至pshuttle-cmv穿梭质粒上,同时构建以口蹄疫病毒2a(f2a)连接的共表达载体(csf2基因和p53基因共表达,f2a位于两者的编码基因之间)。
[0128]
将三个穿梭质粒(单独携带csf2基因或p53基因,及同时携带csf2基因和p53基因)
的完整表达框同源重组至swai线性化的溶瘤腺病毒载体padc68xy-r1的
△
e3区。构建得到重组溶瘤腺病毒载体padc68xyr1-csf2、padc68xyr1-p53、padc68xyr1-csf2-p2a-p53,见图2。
[0129]
用bglii、mfei和xhoi限制性内切酶分别进行酶切鉴定,证明得到的重组溶瘤腺病毒载体正确无误,见图3。
[0130]
实施例5、质粒转染及腺病毒拯救、扩增、纯化
[0131]
将前述构建的腺病毒质粒经pac i酶切线性化后转染hek 293细胞系(转染试剂:x-tremegene hp dna transfection reagent,roche),待细胞出现》50%病变后收集细胞,在-80℃与室温间反复冻融3次以充分裂解细胞,获取腺病毒原液,并逐步扩大培养病毒。
[0132]
通过氯化铯密度梯度离心纯化重组腺病毒,分光光度法测定病毒od260值,病毒滴度为1.1
×
10
13
vp/ml。
[0133]
tcid50实验测定病毒感染单位(iu)。
[0134]
实施例6、蛋白水平检测外源基因的表达情况
[0135]
western blot检测外源基因表达水平。为排除人细胞系基因组中本底p53表达水平的影响,本发明人选择p53缺陷型人结直肠腺癌细胞系nci-h508作为靶细胞。
[0136]
用不同剂量(108vp、109vp、10
10
vp)的重组溶瘤腺病毒adc68xyr1-csf2、adc68xyr1-p53、adc68xyr1-csf2-p2a感染nci-h508细胞系,以空载溶瘤腺病毒adc68xy-r1(图4中标为con)和未感染的nci-h508细胞(图4中标为wt)为阴性对照。
[0137]
24h后,收集细胞及细胞上清,分别检测胞内蛋白p53及上清中分泌蛋白csf2的表达。细胞上清与上样缓冲液混合后煮沸,-20℃保存,细胞则用ripa裂解液(碧云天)冰上裂解后与上样缓冲液混合,煮沸,-20℃保存。分别以8%及10%的聚丙烯酰胺凝胶分离p53和csf2样品蛋白,印迹至pvdf膜,分别以p53(rabbit polyclonal anti-p53 antibody,sino biological)和csf2抗体(rabbit polyclonal anti-csf2 antibody,sino biological)4℃孵育过夜,再孵育室温相应二抗一小时。以gapdh作为内参(hrp-conjugated gapdh antibody,proteintech)。最终使用化学发光检测系统(tanon 4600全自动化学发光图像分析系统)成像。
[0138]
结果显示,重组溶瘤腺病毒adc68xyr1-csf2、adc68xyr1-p53、adc68xyr1-csf2-p2a均可正确表达各自的外源基因csf2和p53,且表达量随着病毒量增加而增高,呈剂量依赖性,见图4。
[0139]
该结果表明,本发明构建的重组表达载体可以装载较长的外源基因,并实现了多个基因的高效表达。
[0140]
进一步地,为了测试溶瘤载体padc68xy-r1对于长度更长的外源基因的装载量、以及考察不同基因置于不同区的可行性,本发明人将pd-1单抗(参考jr,b.d.,et al."the pd-1/pd-l1 axis modulates the natural killer cell versus multiple myeloma effect:a therapeutic target for ct-011,a novel monoclonal anti-pd-1antibody."blood 116.13(2010):2286-2294.)表达框置于δe1区,将csf2-f2a-p53表达框置于δe3区,两个表达框共同构建于padc68xy-r1载体中。以前述同样的方法进行质粒转染及腺病毒拯救。
[0141]
结果显示,padc68xy-r1足以装载高达6.5kb的外源基因,可成功拯救获得重组溶
瘤腺病毒。如前述进行扩增和纯化,可获得高滴度的病毒。
[0142]
实施例7、细胞增殖实验
[0143]
为了检测各溶瘤腺病毒对不同肿瘤细胞的体外杀伤作用,本发明人使用cck8检测试剂盒(苏州新赛美生物技术有限公司)测定一系列细胞系感染不同剂量(1moi 10moi 100moi)adc68xy7、adc68xy-r1,adc68xyr1-csf2,adc68xyr1-p53,adc68xyr1-csf2-p53后的增殖情况。
[0144]
检测方法具体为:在96孔板中,按2x104细胞/孔提前接种细胞,24h后感染不同的腺病毒,每个条件设置6个复孔。感染后72h,每孔加入10ul cck-8检测试剂,37℃培养箱孵育2h,检测od450处的吸光度(biotek elx808),每次均设置不含细胞的空白孔。细胞存活率定义为(od450溶瘤病毒-od450空白值)/(od450复制缺陷对照组-od450空白值),每个细胞系重复三次该实验。
[0145]
结果如图5,高剂量的adc68xy-r1、adc68xyr1-csf2,adc68xyr1-p53,adc68xyr1-csf2-p53可有抑制多种肿瘤细胞系的增殖,如人结直肠癌细胞系difi,人结肠癌细胞系sw620,人肝癌细胞系huh 7,人宫颈鳞癌细胞系siha,小鼠黑色素瘤细胞系yumm 5.2,前列腺癌细胞系rm-1,小鼠结肠癌细胞系ct-26等。在低、中、高三种剂量下,各种溶瘤病毒对difi和huh 7细胞系的杀伤性均较好。除此之外,中剂量的adc68xyr1-p53对hct-8,sw620,siha,yumm 5.2四种细胞系杀伤作用强于其他溶瘤腺病毒,可能与野生型p53基因的体外促凋亡作用有关。
[0146]
ncm 460为正常肠上皮细胞系,与其他肿瘤细胞系相比,溶瘤腺病毒对正常细胞系的杀伤作用明显弱于各肿瘤细胞,表明本组溶瘤病毒具有较好的靶向性和广谱性。
[0147]
实施例8、流式细胞术分析细胞凋亡
[0148]
对高剂量溶瘤腺病毒感染的a375细胞系进行annexin/pi凋亡染色,并设置24h、48h两个时间点,以动态监测溶瘤病毒的促凋亡作用。
[0149]
具体方法为:a375细胞铺6孔板,次日汇合度达80%,感染100moi adc68xy-r1、adc68xyr1-csf2,adc68xyr1-p53,adc68xyr1-csf2-p53,感染后24h、48h用胰蛋白酶消化贴壁细胞并收集,预冷pbs洗涤两次,与带有绿色荧光探针的annexin v-fitc和红色荧光的碘化丙啶(pi)染色液孵育(annexin v-fitc细胞凋亡检测试剂盒,碧云天),将细胞悬液过100-200目滤网后,上机检测(bd facsverse)。使用flowjo 7.6软件分析凋亡细胞所占比例:早期凋亡细胞群:annexinv-fitc( )pi(-),晚期凋亡细胞及死细胞群:annexinv-fitc( )pi( )。
[0150]
结果显示,溶瘤病毒感染早期(24h),与pbs或复制缺陷型adc68xy7相比,溶瘤病毒adc68xy-r1,adc68xyr1-csf2,adc68xyr1-p53,adc68xyr1-csf2-p53均能促进细胞的早期凋亡,见图6a。
[0151]
而感染48h,早期凋亡细胞比例减少,尤其对于adc68xyr1-csf2,adc68xyr1-p53,死亡细胞大多由晚期凋亡或坏死细胞构成。说明溶瘤病毒的促凋亡作用具有一定的时间依赖性,见图6b。
[0152]
实施例9、溶瘤腺病毒在小鼠体内对肿瘤的抑制作用
[0153]
前面,本发明人验证了各溶瘤腺病毒在体外细胞水平上可抑制肿瘤细胞的增殖,接下来,本发明人通过肿瘤异种移植动物模型进行肿瘤的治疗,进一步探讨溶瘤腺病毒在
体内对肿瘤细胞的抑制作用。
[0154]
具体方法为:将3x105个yumm5.2细胞悬浮于100μl预冷pbs中,皮下接种于6-8周龄雌性c57bl/6小鼠背部。接种后约7天可见肿瘤,使用以下公式计算肿瘤体积(v):v(mm3)=1/2
×
长
×
宽
×
宽,肿瘤的体积达到50mm3时,将小鼠随机分为6组,每组5只,分别接受pbs,adc68xy7、adc68xy-r1,adc68xyr1-csf2,adc68xyr1-p53,adc68xyr1-csf2-p53瘤内注射。108pfu病毒稀释于50μl pbs中,每2-3天注射一次,重复4次,每2天使用游标卡尺测量一次肿瘤体积,肿瘤体积超过2000mm3实施安乐死(图7a)。
[0155]
根据肿瘤体积的长期监测数据可知,不同溶瘤腺病毒在小鼠水平上均可显著抑制黑色素瘤的生长,以adc68xyr1-p53抑制效果最好(图7b-d)。p53的促凋亡作用并不完全依赖于免疫系统而发挥,其具有明显的溶瘤优势。这一点在b16黑色素瘤模型小鼠中也得到验证。
[0156]
在本发明提及的所有文献都在本技术中引用作为参考,就如同每一篇文献被单独引用作为参考那样。此外应理解,在阅读了本发明的上述讲授内容之后,本领域技术人员可以对本发明作各种改动或修改,这些等价形式同样落于本技术所附权利要求书所限定的范围。
再多了解一些
本文用于创业者技术爱好者查询,仅供学习研究,如用于商业用途,请联系技术所有人。