治疗常染色体显性bestrophin病及其评估方法
1.政府支持声明
2.本发明是根据美国国立卫生研究院(national institutes of health)授予的ey006855在政府支持下完成的。政府对本发明享有一定的权利。
背景技术:
3.人best1(hbestl)中的突变导致一系列与特征性黄斑病变相关的统称为bestrophin病的视网膜疾病表型。迄今为止,已经鉴定了hbest1中近300个单等位基因或双等位基因突变,并且与不同发病、严重程度和进展的遗传性视觉缺陷相关。bestrophin病的临床表现范围广泛,从常染色体显性玻璃体视网膜脉络膜病变(advirc)的罕见病症中影响周边视网膜和玻璃体的广泛症状到通常限于中央视网膜中的黄斑和旁黄斑区的明确临床异常,如best卵黄样黄斑营养不良(bvmd)和更广泛的常染色体隐性bestrophin病(arb)。bvmd,作为具有不完全外显率的常染色体显性性状遗传,以及隐性形式(arb),是bestrophin病中最常见和研究最深入的青少年黄斑营养不良,其特征在于眼电图(eog)明显异常,伴随着视网膜色素上皮(rpe)细胞内脂褐素物质的过度累积,形成局灶性和多灶性视网膜下病变,并因此丧失中央视觉。
4.虽然在1905年首先描述了bestrophin病,但由于缺乏可靠的动物模型来进行机制研究,对其病理机制的理解以及治疗发展的任何进展都受到了阻碍。最近对best1相关视网膜病的自发性动物模型的鉴定已被证明在疾病机制的研究和新治疗策略的开发中至关重要。自发性犬best1疾病模型(cbest;犬多灶性视网膜病变(caninemultifocal retinopathy,cmr)是犬中自然发生的常染色体隐性病症,其由与人bestrophin病相同的遗传缺陷引起,并且捕获在患者中观察到的全部临床表现。迄今为止,在13个狗品种中已经鉴定出cbest视网膜病变,并且是由以常染色体隐性方式遗传的犬best1直向同源物(cbest1-c.73c》t/p.r25*、-c.482g》a/p.g161d,或-c,1388delc/p463fs)中的三种不同突变之一引起的。所有三种突变都会导致受感染的纯合狗具有一致的临床表型,并对疾病相关突变的所有主要方面及其在人中描述的分子后果进行建模。概括的临床和分子特征谱,包括犬黄斑区病变的显著诱因,使得cbest成为极具吸引力的模型系统,不仅用于解决bestrophin病的分子病理学背后的原理,而且用于验证新的治疗策略。
5.需要对用于治疗常染色体显性疾病(即由单等位基因best1基因突变引起的best1相关疾病)的方法和用于评估对bestrophin病的潜在治疗的有效性的方法进行改进。
技术实现要素:
6.在一个方面,提供了一种治疗受试者的bestrophin病的方法。该方法包括向受试者的眼睛施用一定剂量的包含编码人best1蛋白的核酸序列的重组腺相关病毒(raav)载体。在一个实施例中,受试者具有一个突变的best1等位基因。在另一实施例中,bestrophin病是best卵黄样黄斑营养不良(bvmd)、常染色体显性玻璃体视网膜脉络膜病变(advirc)或成年型卵黄样黄斑营养不良(avmd)。
7.在另一方面,提供了一种评估bestrophin病的方法。该方法包括向受试者的眼睛施用一定剂量的包含编码人best1蛋白的核酸序列的重组腺相关病毒(raav)载体。在一个实施例中,受试者具有两个突变的best1等位基因。在另一实施例中,受试者具有一个突变的best1等位基因。该方法包括进行体内视网膜横截面成像以评估纵向反射率分布(lrp)、评价光适应和/或暗适应眼睛中is/os至视网膜色素上皮(rpe)和/或elm至rpe的距离,以及形成光增强视网膜下微脱落中的一个或多个。在一个实施例中,通过通过恢复rpe顶端微绒毛结构,重建rpe细胞和光感受器(pr)外节(rpe-pr界面的细胞体系结构)之间的适当并置,和恢复不溶性视锥特异性光感受器间基质(ipm)中的挽救视网膜微体系结构的一种或多种指标来评估治疗效果。在另一实施例中,使用超高分辨率光学相干层析成像(oct)执行视网膜成像以示出所述lrp。
8.在另一方面,提供了一种用于评估对bestrophin病的治疗的方法。该方法包括获得携带best1基因突变的受试者;施用疗法;以及测量挽救视网膜微体系结构、恢复rpe顶端微绒毛结构、重建rpe细胞和光感受器(pr)外节(rpe-pr界面的细胞体系结构)之间的适当并置,和恢复不溶性视锥特异性光感受器间基质(ipm)的一个或多个指标,以确定治疗效果。
9.在另一方面,提供了一种治疗受试者的bestrophin病的方法。该方法包括向受试者的眼睛施用一定剂量的包含编码人best1蛋白的核酸序列的重组腺相关病毒(raav)载体,其中该受试者具有至少一个突变的best1等位基因。在一个实施例中,raav载体的剂量是a)以约1.0
×
10
10
载体基因组(vg)/ml至约1.0
×
10
13
vg/ml的浓度施用;或b)约5.0
×
108vg/眼睛至约5.0
×
10
12
vg/眼睛。在一个实施例中,受试者是犬、小鼠、大鼠、非人灵长类动物或人。
10.在另一实施例中,bestrophin病是best卵黄样黄斑营养不良(bvmd)、常染色体显性玻璃体视网膜脉络膜病变(advirc)或成年型卵黄样黄斑营养不良(avmd)、色素性视网膜炎(rp)、或小角膜、视杆视锥营养不良、或白内障。在另一实施例中,将raav载体施用于受试者的视网膜。在另一实施例中,raav载体通过视网膜下、玻璃体内或脉络膜上腔注射施用。在另一实施例中,核酸序列在眼睛的视网膜色素上皮(rpe)中表达人best1蛋白。在另一实施例中,编码best1蛋白的核酸序列在人vmd2启动子(hvmd2)的控制下。在又一实施例中,raav载体的剂量以约1.0
×
10
10
vg/ml至约3.0
×
10
12
vg/ml,任选地约1.5
×
10
10
vg/ml的浓度施用。在又一实施例中,raav载体的剂量以约1.0
×
10
11
vg/ml至约7.5
×
10
11
vg/ml的浓度施用。在又一实施例中,raav载体的剂量以约3.0
×
10
11
vg/ml至约6.0
×
10
11
vg/ml,约7.5
×
10
11
vg/ml至约1.0
×
10
13
vg/ml或约3.5
×
10
12
vg/ml的浓度施用。在另一实施例中,raav载体的剂量以在约50ul和500ul之间的体积施用。在另一实施例中,raav载体的剂量以约150ul、约300ul或约500ul的体积施用。在又一实施例中,施用的raav载体的剂量为约5.0
×
108vg/眼睛至约1.5
×
10
10
vg/眼睛,任选地约7.5
×
108vg/眼睛。
11.在又一实施例中,施用的raav载体的剂量为约1.0
×
10
10
vg/眼睛至约1.0
×
10
11
vg/眼睛,任选地4.5
×
10
10
vg/眼睛。在又一实施例中,施用的raav载体的剂量为约1.0
×
10
11
vg/眼睛至约5.0
×
10
12
vg/眼睛。在再一实施例中,施用的raav载体的剂量为约1.0
×
10
12
vg/眼睛。
12.在另一实施例中,raav载体包含aav2、aav3、aav4、aav5、aav6、aav7、aav8、aav9、
rpe距离中的一种或多种。在另一实施例中,体内视网膜成像包含评估反应性神经胶质增生和/或细胞迁移。在又一实施例中,体内视网膜成像包含评估穿透具有星形胶质增生的onl层的缪勒氏(muller)神经胶质神经干/突起。在另一实施例中,使用超高分辨率光学相干层析成像(oct)执行视网膜成像以示出lrp。在另一实施例中,视网膜成像包含cslo/sd-oct、电生理学或适应动力学。
22.在某些实施例中,该方法进一步包括当存在一种或多种指示best1疾病的视网膜变化时治疗受试者。在一个实施例中,使用如本文所述的方法治疗受试者。
23.根据本发明的以下详细描述,本发明的其它方面和优点将变得显而易见。
附图说明
24.图1示出了共焦图像,其说明与来自对照受试者的野生型(wt)视网膜组织相比,cbest(r25
*
/r25
*
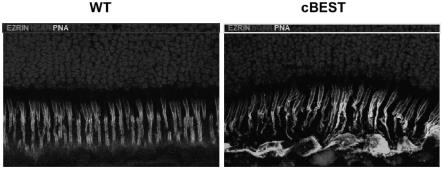
)突变视网膜的分子病理学。用抗ezrin(绿色)和人视锥抑制蛋白(红色)结合花生凝集素植物凝集素(pna,青色)和dapi(蓝色)对视网膜冷冻切片进行免疫标记,以详细说明视锥光感受器外节的天然细胞外区室化丧失和rpe与相邻光感受器os之间相互作用丧失导致视网膜下微脱离的结构变化。
25.图2示出了使用spectralis sd/oct或徕卡(leica)/bioptigen envisu r2210sd-octuhr系统获得的视网膜信息wt、cbest-杂合(r25
*
)和cbest-纯合(r25
*
/p463fs)模型的横截面视网膜图像的比较。与来自spectralis sd-oct(在中心(spectralis)和右侧(徕卡/bioptigen envisu r2210)列)的放大图像相比,基于这些uhr图像的纵向反射率分布(lrp)也显示在右侧(leica/bioptigen envisu r2210)。
26.图3示出了与来自uhr oct的lrp图像和视网膜分层的对应示意图相关的wt(顶部)和cbest杂合(r25
*
)(底部)视网膜的离体分析的结果。
27.图4示出了cbest杂合(r25
*
)(顶部)和wt(底部)视网膜中的分子病理学。用抗ezrin(绿色)、hcar(红色)和pna(白色)测定来自cbest-r25
*-het和wt对照视网膜的视网膜冷冻切片以描绘rpe顶端表面和相关微绒毛,检查rpe-pr接合和ipm。与生成的lrp相比,分析共焦显微照片以确定lrp峰的来源和cbest-het突变视网膜中异常lrp的潜在因素。
28.图5示出了来自spectralis sd-oct或徕卡/bioptigen envisu r2210 sd-uhr oct系统的横截面图像与来自wt、cbest杂合和cbest纯合突变视网膜的对应免疫标记切片的比较。
29.图6示出了施用aav介导的best1基因扩增疗法后rpe/pr界面处视网膜微体系结构的挽救。
30.图7a至7d展示了cbest1-杂合和cbest1-纯合的狗模型与野生型(wt)相比的视网膜表型。图7a示出了野生型(wt)狗视网膜的基于超高分辨率光纤的傅立叶域光学相干层析成像。图像示出了体内和体外数据相关。图7b示出了cbest1-杂合(cbest-het)狗模型的视网膜表型。示出了cbest-het突变模型中的rpe-pr界面的异常微体系结构。ros和cos的延长与外界膜(elm)-rpe距离增加相关,rpe顶端表面存在l/ms-和rds(prph2)-阳性碎片,其指示cbest-hets中的异常pos-rpe并置和相互作用。图7c和7d示出了野生型和cbest-het模型的2-d(图7c)和3-d(图7d)视网膜成像的比较。图7c和7d示出了cos和ros的显著延长,以及is/os的拉伸和弯曲。
31.图8a和8b展示了在cbest-纯合和cbest-杂合突变模型中,缪勒氏神经胶质(mg)细胞的活化和反应性星形胶质增生促进cbest视网膜中的炎性环境。可以看到缪勒氏神经胶质突起延伸到达rpe细胞。
32.图8c展示了cbest-het视网膜中缪勒氏神经胶质的激活。40x(顶部)和100x(底部)共焦图像示出了cbest-hets中的反应性神经胶质增生。神经胶质原纤维酸性蛋白(gfap-绿色)的上调是视网膜应激的指标。还可见onl厚度的波动(顶面板)、inl-onl细胞迁移(顶面板)和视网膜表面的升高(ss拉伸-顶面板)。
33.图9进一步展示了与wt相比,cbest1-杂合狗模型的视网膜表型。
34.图10展示了aav介导的best1基因扩增疗法在aav-best1注射后恢复视网膜稳态并防止cbest突变视网膜中的神经胶质改变。缪勒氏神经胶质的激活限于未治疗的视网膜区域,其与视网膜下的微脱离相关。
35.图11示出了本研究中登记的注射cbest-ar raav2-hbest1的眼睛的总结。所有接受1.15
×
10
11
或更高剂量的眼睛都显示有好转。
36.图12示出了对注射后经长达74周cbest-ar治疗的受试者的评价。
37.图13示出了与公开的cbest受试者相比的cbest眼睛给药。
38.图14a至14d展示了cbest突变模型中的rpe-光感受器界面结构和aav介导的best1基因扩增疗法后视网膜微体系结构的挽救(a)犬wt对照视网膜(年龄:71周)、(b)cbest-r25
*-杂合突变(年龄:16周)、(c)cbest-r25*/p463fs突变-未治疗的视网膜(116周),和(d)cbest-r25*/p463fs突变视网膜aav-best1-视网膜下注射后74周检查治疗的(tx)。在cbest突变视网膜(b)具有单等位基因best1突变的cbest-het(箭头)和(c)携带双等位基因best1突变的cbest突变(括号)中检测到与视网膜下间隙扩大(elm至rpe距离)和受损的光感受器间基质(ipm)相关的rpe-pr界面结构异常,用pna(花生凝集素植物凝集素)标记(白色)测定。注意,cbest aav-best1治疗的视网膜(d)中细胞外基质的显著恢复与wt对照(a)相当。pna:花生凝集素植物血凝素已知为其选择性结合光感受器间基质(ipm)的视锥不溶性细胞外基质微区。dapi(4',6-二脒基-2-苯基吲哚)是一种核复染剂。
39.图15a和15b展示了在cbest中aav介导的best1基因疗法后脂质稳态的重建(a)未酯化(游离)胆固醇的空间分布,其在正常和cbest1-r25
*
突变视网膜中通过固醇结合探针菲律宾菌素(钴蓝)可见。注意病变组织中过量的自发荧光rpe沉积物。在12个月大的cbest与年龄匹配的对照视网膜中的酯化胆固醇(钴蓝)的组织化学检测。用荧光中性脂质示踪染料bodipy 493/503(绿色)染色的cbest和年龄匹配对照的代表性视网膜冷冻切片,以及wt和cbest-r25
*
突变体视网膜之间pos层中ec-bodipy 493/503信号的定量。使用非配对t检验将观察到的差异评价为具有统计学意义(
*
p《0.05)。用溶血色素油红o(oro,玫瑰)测定犬野生型和cbest1感染的视网膜中的ec分布图。示出了受影响的rpe(箭头)和视网膜下空间中的oro阳性内含物(特写)。突变与对照视网膜中的抗-4-hne标记(红色)。在描绘肥大rpe细胞的顶端轮廓的cbest视网膜中观察到hne加合物在外节内的分散分布。用碘化丙啶或dapi复染细胞核。(b)与对照组相比,cbest-r25
*
突变视网膜中视网膜下间隙稳态的恢复。
具体实施方式
40.在某些方面,本文提供治疗bestrophin病的方法。本文还提供了用于评价受试者
(包括携带cbest1突变的受试者)视网膜表型的方法。该方法特别适用于在用于研究和开发的动物模型中评估疗法的有效性,以及在临床环境中诊断或评价受试者的治疗。因此,被治疗的受试者可以是best1等位基因中具有突变的动物模型或人受试者。
41.在某些实施例中,本文提供了用于治疗、延缓或阻止患有常染色体显性(ad)best1相关眼部疾病的哺乳动物受试者的疾病进展的方法。在某些实施例中,受试者在best1基因等位基因中携带突变,或已被鉴定为患有或有发展成bestrophin病的风险。受试者best1基因中的特定突变可能是杂合的,具有一个野生型等位基因,导致常染色体显性(ad)bestrophin病。在某些实施方案中,ad bestrophin病可以是best卵黄样黄斑营养不良(bvmd)、成年型卵黄样黄斑营养不良(avmd)、常染色体显性玻璃体视网膜脉络膜病变(advirc)或色素性视网膜炎(rp)。在某些实施例中,治疗方法包括提供如本文所述的病毒载体。
42.先前已经描述了best1相关视网膜病、犬best(cbest)的天然存在的犬模型。(guziewicz等人,bestrophin基因突变导致犬多灶性视网膜病变:best疾病的新动物模型(bestrophin gene mutations cause canine multifocal retinopathy:a novel animal model for best disease),《眼科研究与视力学(invest ophthalmol vis sci.)》2007,通过引用并入本文)。简而言之,该模型利用犬best1(cbest1)基因纯合突变的狗,并且可由在该基因座鉴定的三种突变中的任一种产生。该模型的纯合突变狗表现出人纯合隐性best1疾病相关突变的所有主要方面以及其在人中描述的分子后果。
43.如本文所述,cbest1杂合突变(cbest-het)狗的体内和离体检查揭示中间表型,指示单倍不足是best疾病的主要机制。因此,犬cbest-het是第一个常染色体显性best卵黄样黄斑营养不良(bvmd)的自发动物模型。本文描述的工作是cbest-het表型的首次鉴定,其使得能够将cbest-het模型用于各种诊断和治疗应用,如本文进一步描述的。cbest-het模型可用于评价疗法(例如,aav介导的best1基因扩增疗法)的潜在效果,用于治疗常染色体显性best1相关眼部疾病,例如bvmd。此外,在携带单拷贝突变best1等位基因的受试者中鉴定表型异常可能有助于评价疗法和评估人群中bestrophin病治疗的改进方法,特别是在那些患有常染色体显性疾病的人群中。此外,有时亚临床表型的可观察的和可测量的特征允许增强个体受试者和患者群体的鉴定,该个体受试者和患者群体可以是aav介导的best1基因扩增疗法的候选者。
44.本文还提供了用于治疗患有常染色体显性bestrophin病或有发展为常染色体显性bestrophin病的风险的受试者的组合物和方法。
45.本文使用的所有科学和技术术语对于生物学、生物技术和分子生物学领域的技术人员而言具有其已知和常规的含义,并且通过参考公开的文本,其为本领域技术人员提供了本技术中使用的许多术语的一般指导。然而,为了清楚起见,某些术语如本文所提供的那样定义。
46.如本文所用的术语“约”当指可测量的值例如量、持续时间等时,意指涵盖从指定值高达
±
10%的变化;此类变化适于执行所公开的方法。
47.如在该说明书和所附权利要求中使用的,单数形式“一个(a、an、the)”包括复数指示物,除非内容另有明确规定。因此,术语“一个”(a、an)、“一个或多个”和“至少一个”在本文中可互换使用。因此,例如,“载体”包括两个或更多个载体等。
48.说明书中的各种实施例使用“包含”语言来呈现,其包括其它组件或方法步骤。当使用“包含”时,应当理解,相关实施例包括使用“由
…
组成”术语,其不包括其它组件或方法步骤以及“基本上由
…
组成”术语,其不包括实质上改变实施例或发明的性质的任何组件或方法步骤的描述。
49.best1属于阴离子通道的bestrophin家族,其包括best2(607335)、best3(607337)和best4(607336)。bestrophins是跨膜(tm)蛋白,其共享含有高含量芳族残基的同源区域,包括不变的arg-phe-pro(rfp)基序。bestrophin基因共享保守的基因结构,具有几乎相同大小的8个rfp-tm结构域编码外显子和高度保守的外显子-内含子边界。
50.omim db(www.ncbi.nlm.nih.gov/omim)列出了与hbest1基因突变相关的5种表型,统称为“bestrophin病”,其中第一次发病是在1905年(由friedrich best)描述的,并且最新的发现是在2006年(常染色体隐性bestrophin病(arb))。常染色体隐性形式(arb)可由纯合突变(两个等位基因上存在相同突变)或复合杂合突变(同一基因的两个等位基因都携带突变,但突变不同)引起。如本文所用,术语“双等位基因”或“常染色体隐性(ar)”涵盖了两种原因。
51.burgess等人,(best1的双等位基因突变导致人明显的视网膜病变(biallelic mutation of best1 causes a distinct retinopathy in humans),《美国人遗传学杂志(am j hum genet.)》2008年1月;82(l):19-31)描述了一种独特的视网膜疾病,它们被称为常染色体隐性bestrophin病(arb)。该疾病的特征包括中枢视觉丧失、特征性视网膜病变、无眼电图(eog)光峰升高和视网膜电图(erg)降低。没有患者表现出best疾病特有的卵黄样病变,但表现出视网膜色素上皮(rpe)反射的扩散不规则性,包括分散的点状斑点。所有患者均显示在黄斑区域感觉神经视网膜内和/或下方有液体累积。所有患者均为远视眼,2个家系中有3人都患有闭角型青光眼。在所有患者中观察到的eog光峰升高的严重降低与在best疾病和advirc中观察到的类似。
52.bestrophin病的常染色体显性形式由bestrophin基因中的单等位基因突变引起(bbestrophin-1)。本文所用的术语“常染色体显性(ad)best疾病”可指由best1基因中的杂合突变引起的任何疾病。此类突变可以包括杂合状态的突变。此类病症包括best卵黄样黄斑营养不良、常染色体显性玻璃体视网膜脉络膜病变、成年型卵黄样黄斑营养不良和mrcs综合征。
53.best卵黄样黄斑营养不良(bvmd或vmd2),也称为best疾病,是一种早发性常染色体显性遗传疾病,其特征是视网膜下腔有大量脂褐质样物质沉积,会产生类似于卵黄的特征性黄斑病变(“卵黄样”)。尽管best疾病的诊断通常在童年时期进行,但更常见的是在更晚的时间和生命的第六十年做出。此外,典型的卵黄样病变仅在疾病的自然演变的有限时期内存在;之后,受影响的区会变得深沉且不规则的色素沉着,并且发生称为“炒鸡蛋”的过程,在该点处,病变可能表现为“牛眼”。这种疾病是进行性的,可能会出现视力丧失。best疾病的定义特征是眼电图(eog)的亮峰/暗谷比小于1.5,在临床视网膜电图(erg)中没有畸变。如谱系所评价的,甚至best1突变的其它无症状携带者也将表现出改变的eog。组织病理学上,该疾病已显示为与过度脂褐质积聚、局部rpe萎缩区域和rpe下方异常纤维状物质沉积相关的全身性视网膜色素上皮(rpe)异常,类似于玻璃疣。还报道了bruch膜偶然破裂并伴有新生血管形成,尽管对于广泛的脉络膜新血管形成没有注意到best疾病。
54.bvmd通常存在于几个阶段,尽管并非所有个体都可能进展超过早期阶段。
55.1期(卵黄前期)由正常黄斑或细微rpe色素变化、eog异常和视敏度(va)为20/20组成。
56.2期(卵黄状阶段)由边界清楚、0.5至5mm圆形、隆起的黄色或橙色病变组成,具有蛋黄外观;通常以凹为中心;可能是多焦点的;眼底的其余部分具有正常的外观。va为20/20至20/50。
57.3期(假性前房积脓期)由积聚在具有液面的囊肿中的视网膜下空间中的黄色物质组成。黄色物质随着位置的延长变化而移动(60至90分钟)。该期已在8至38岁的个体中进行了描述。va为20/20至20/50。
58.4期(卵黄破裂期)由于均匀卵黄样病变的破裂而出现的炒鸡蛋组成。可以注意到色素结块和早期萎缩性变化。视敏度可能中度恶化。va为20/20至20/100。
59.5期(萎缩期)由随着时间的推移消失的黄色物质和保留的rpe萎缩区组成。该外观难以与黄斑变性的其它原因区分开。在该期,视敏度可能更显着地恶化。va可以降低到小于20/200。
60.6期(cnvm/疤痕期)发生在萎缩期之后,其中脉络膜新血管形成可能发展并导致发白的视网膜下纤维疤痕。参见,例如,maggon等人,best卵黄样黄斑营养不良,《印度武装部队医学杂志(med j armed forces india.)》,2008年10月;64(4):379-381,其通过引用并入本文。
61.成年型卵黄样黄斑营养不良(avmd)是黄斑变性的最常见形式之一。avmd发病的年龄变化很大,但患者在50岁之前往往保持无症状。avmd的临床特征是相对良性的,包括小的视网膜下卵黄样黄斑病变、疾病进展较慢和眼电图(eog)轻度恶化。在一些情况下,avmd与prph2、best1、impg1或impg2突变的常染色体显性遗传有关。
62.常染色体显性玻璃体视网膜脉络膜病变(advirc或vrcp)是影响眼睛若干部分的病症,包括填充眼睛的透明凝胶(玻璃体)、排列在眼睛后部的光敏组织(视网膜)和视网膜内的血管网络(脉络膜)。advirc中的眼睛异常可导致不同程度的视力损害,从轻度降低到完全丧失,尽管患有该病症的一些人具有正常的视力。advirc是由bestrophin-1基因的杂合突变引起的。
63.色素性视网膜炎是属于色素性视网膜病变组的视网膜营养不良。色素性视网膜炎的特征是眼底检查中可见的视网膜色素沉积和视杆光感受器细胞的原发性丧失,随后是视锥光感受器的继发性丧失。患者通常患有夜盲症和中周视野丧失。随着病症的发展,他们失去了远周边视野,最终也失去了中央视觉。色素性视网膜炎-50(rp50)由best1基因的杂合突变引起的,而某些类型的色素性视网膜炎可以是常染色体隐性的。
64.mrcs综合征(微角膜、视杆视锥营养不良、白内障和后葡萄肿)是一种罕见的遗传性视网膜营养不良病症,其特征是双侧小角膜、视杆视锥营养不良、白内障和后葡萄肿,没有其它系统性特征。夜盲是典型的表现,眼球震颤、斜视、散光和闭角型青光眼可能是相关的发现。由于粉状白内障引起的进行性视敏度恶化导致从无光感到20/400范围内的不良视力。mrcs是由best1基因的杂合突变引起的。
65.在某些实施例中,本文提供了用于治疗、延缓或阻止患有常染色体显性best1相关眼部疾病的哺乳动物受试者的失明进展的方法。在某些实施例中,受试者在best1基因等位
基因中携带突变,或已被鉴定为患有或有发展成bestrophin病的风险。受试者best1基因中的特定突变可能是杂合的,具有一个野生型等位基因。在某些实施例中,受试者对于突变的best1等位基因是杂合的,导致常染色体显性bestrophin病。ad bestrophin病可选自bvmd、avmd、advirc、rp和mrcs。在某些实施例中,治疗方法包括提供如本文所述的病毒载体。
66.在本发明的某些实施例中,受试者患有“眼部疾病”,例如常染色体显性bestl相关眼部疾病。此类眼部疾病的临床征兆包括但不限于周边视力下降、视网膜变性、中央(阅读)视力下降、夜视能力下降、色觉丧失、视敏度下降、光感受器功能下降、色素改变以及最终失明。
67.视网膜变性是一种视网膜病变,其是由细胞的进行性死亡引起的视网膜变性组成的。视网膜变性有几个原因,包括动脉或静脉阻塞、糖尿病性视网膜病、r.l.f./r.o.p.(晶状体后纤维增生/早产儿视网膜病变),或疾病(通常是遗传的)。视网膜变性的征兆和症状包括但不限于视力受损、夜盲症、视网膜脱落、光敏感、隧道视觉和周边视觉丧失至完全丧失视觉。视网膜变性和重塑涵盖由遗传性视网膜疾病(如本文所述的那些)和其它对眼睛/视网膜的损伤(包括创伤和视网膜脱落)引发的分子、细胞和组织水平上的一组病理。这些视网膜变化和明显的可塑性导致神经元重新布线和重新编程事件,其包括基因表达的改变、新生神经突形成以及新突触的形成,通过树突树的改变和额外的轴突生长在双极细胞中产生破坏性电路。此外,神经元沿缪勒氏细胞柱在视网膜的整个纵轴上迁移,显示出改变的代谢信号,并且视网膜色素上皮(rpe)侵入视网膜形成色素性骨针,这是rp疾病的典型临床观察结果。参见bryan william jones、robert e.marc和rebecca l.pfeiffer的《视网膜变性、重塑和可塑性(retinal degeneration,remodeling and plasticity)》。
68.如本文所用,术语“受试者”是指哺乳动物,包括人、兽医或农场动物、家畜或宠物以及通常用于研究的动物。在某些实施例中,这些方法的受试者是人。在某些实施例中,受试者是犬科动物。在其它实施例中,受试者是非人灵长类动物。其它合适的受试者包括但不限于鼠科动物、大鼠、猫、猪、牛、羊等。如本文所用,术语“受试者”可与“患者”互换使用。在某些实施例中,受试者是适合于研究目的的实验室动物(包括但不限于小鼠、大鼠、犬和非人灵长类动物),其已经被遗传修饰以例如在内源best1基因中引入突变或引入编码突变best1的转基因。在某些实施例中,动物受试者已被修饰以表达异源best1基因,例如hbest1或突变hbest1。在另一实施例中,动物受试者是cbest1-杂合突变体。在某些实施例中,受试者是如本文所述的cbest杂合突变模型狗。转基因动物可以通过本领域普通技术人员已知的任何方法(例如,锌指核酸酶、talen和/或crispr/cas核酸酶系统)产生。
69.在某些实施例中,受试者是有发展为bestrophin病的风险的人(例如,具有bestrophin病家族史)或具有一个或多个经证实的best1基因突变。在又一实施例中,受试者已表现出bestrophin病的临床征兆。在另一实施例中,受试者已经表现出视网膜病变的征兆,其也指示bestrophin病。在某些实施例中,受试者已被诊断患有bestrophin病。在又一实施例中,受试者还没有表现出bestrophin病的临床征兆。在一个实施例中,受试者患有或有发展为ad bestrophin病的风险。在一个实施例中,bestrophin病是bvmd。在另一实施例中,bestrophin病是avmd。在另一实施例中,bestrophin病是advirc。在另一实施例中,bestrophin病是rp。在另一实施例中,bestrophin病是mrcs。
70.尽管best疾病的诊断通常在童年时期进行,但更常见的是在更晚的时间和生命的
第六十年做出,使用眼底检查和眼电图(eog)等传统技术。本文鉴定的细微表型变化可用于早期诊断ad best疾病,以及缺乏先前用于鉴定的肉眼视网膜和视觉变化的个体。因此,在某些实施例中,本文所述的技术用于鉴定患有或有发展为常染色体显性best疾病的风险的受试者。在其它实施例中,本文所述的技术用于鉴定受试者是否适合接受best疾病的基因替代疗法,例如本文所述的aav介导的best1基因扩增疗法。
71.在一个实施例中,受试者为10岁或更小。在另一实施例中,受试者为15岁或更小。在另一实施例中,受试者为20岁或更小。在另一实施例中,受试者为25岁或更小。在另一实施例中,受试者为30岁或更小。在另一实施例中,受试者为35岁或更小。在另一实施例中,受试者为40岁或更小。在另一实施例中,受试者为45岁或更小。在另一实施例中,受试者为50岁或更小。在另一实施例中,受试者为55岁或更小。在另一实施例中,受试者为60岁或更小。在另一实施例中,受试者为65岁或更小。在另一实施例中,受试者为70岁或更小。在另一实施例中,受试者为75岁或更小。在另一实施例中,受试者为80岁或更小。在另一实施例中,受试者是新生儿,1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、24、25、26、27、28、29、30、31、32、33、34、35、36、37、38、39、40、41、42、43、44、45、46、47、48、49、50、51、52、53、54、55、56、57、58、59、60、61、62、63、64、65、66、67、68、69、70、71、72、73、74、75、76、77、78、79、80、81、82、83、84、85、86、87、88、89、90岁或以上。
72.如本文所用,术语“治疗(treatment)”及其变体(例如“treat、treating”)是指试图改变被治疗个体的自然过程的临床干预,并且可用于预防或在临床病理学过程期间进行。因此,“治疗”可包括以下中的一种或多种:减轻眼部疾病(例如bestrophin病)的发作或进展、预防疾病、减轻疾病症状的严重程度、或延缓其进展(包括失明的进展)、消除疾病症状、延迟疾病的发作或监测疾病的进展或给定受试者的治疗效果。
73.因此,在某些实施例中,在疾病发作之前施用疗法。在另一实施例中,在视力损伤或丧失开始之前施用疗法。在另一实施例中,在视力损伤或丧失开始之后施用疗法。在又一实施例中,与未患病的眼睛相比,当视杆和/或视锥或光感受器的功能或剩余小于90%时,施用疗法。
74.在又一实施例中,当被治疗的受试者表现出bvmd的i期(卵黄前期)至iii期(卵黄破裂期或假性前房积脓)的症状时施用疗法。在另一实施例中,在表现出i期症状之前施用疗法。在另一实施例中,在表现出i期症状之后施用疗法。在另一实施例中,在表现出ii期症状之前施用疗法。在另一实施例中,在表现出ii期症状后施用疗法。在另一实施例中,在表现出iii期症状之前施用疗法。在另一实施例中,在表现出iii期症状后施用疗法。在另一实施例中,在表现出iv期症状之前施用疗法。在另一实施例中,在表现出iv期症状后施用疗法。在另一实施例中,在表现出v期症状之前施用疗法。在另一实施例中,在表现出v期症状后施用疗法。
75.如本文所用,“疗法”是指旨在治疗受试者现有的疾病病症或减少、延迟、抑制或消除受试者中疾病或疾病症状的发作或进展的任何形式的干预。治疗可以是旨在通过提供编码功能蛋白的核酸来补充、恢复或增强基因表达水平的基因扩增疗法。因此,在某些实施例中,该方法包括施用载体,特别是基因疗法载体。在某些实施例中,疗法是具有犬best1(cbest1)或人best1(hbest1)的重组aav。合适的载体还可以编码基因组编辑系统(例如crispr/cas)的组分,该基因组编辑系统被设计成例如插入基因序列、替换基因序列或基因
序列的一部分,或校正内源best1基因序列中的突变。
76.用于描述核酸序列或蛋白质的术语“异源的”是指该核酸或蛋白质来源于与其表达的宿主细胞或受试者不同的生物体或同一生物体的不同物种。
77.本文所用的术语“转基因”是指在本说明书所述的表达盒、raav基因组、重组质粒或生产质粒、载体或宿主细胞中的启动子或表达控制序列控制下的外源或工程化的编码蛋白质的核酸序列。在某些实施例中,转基因是编码功能性best1蛋白的best1序列或其片段。
78.在某些实施例中,该方法包括向受试者施用病毒载体。合适的病毒载体优选地是复制缺陷型的并且选自靶向眼部细胞的那些。病毒载体可以包括任何适用于基因疗法的病毒,其中载体包括编码旨在受试者中介导治疗效果的蛋白质的核酸序列。合适的基因疗法载体包括但不限于腺病毒;疱疹病毒;慢病毒;逆转录病毒;但是,为了便于理解,本文将腺相关病毒称为示范性病毒载体。
79.因此,一方面,提供了重组腺相关病毒(raav)载体。raav包含aav衣壳和包装在其中的载体基因组。在一个实施例中,载体基因组包含:(a)aav 5'反向末端重复序列(itr)序列;(b)启动子;(c)任选的增强子;(d)编码人best1的编码序列;(e)多聚a尾巴;和(f)aav 3'itr。在一个实施例中,best1序列编码全长bestrophin蛋白。在一个实施例中,best1序列是uniprot登录号076090-1的蛋白质序列,其通过引用并入本文。(参见,例如,guziewicz等人,《美国国家科学院院刊(pnas)》,2018年3月20日;115(12):e2839-e2848,其通过引用并入本文)。
80.在某些实施例中,该方法包括递送具有编码正常best1基因或其片段的核酸序列的载体(例如基因疗法载体)。本文所用的术语“best1”是指全长基因本身或功能片段,如下文进一步定义。编码正常best1基因或其片段的核酸序列可以来源于天然表达best1基因或其同源物的任何哺乳动物。在某些实施例中,best1基因序列来源于受试者打算治疗的相同哺乳动物。因此,在某些实施例中,best1基因衍生自人序列(如例如在nm_001139443.1、nm_001300786.1、nm_001300787.1、nm_001363591.1nm_001363592.1、_001363593.1和nm_004183.4中的任一个中提供的)。在某些实施例中,best1序列编码具有uniprotkb-076090-1、076090-3或076090-4的氨基酸序列的蛋白质。在其它实施例中,best1基因衍生自犬序列(如例如nm_001097545.1中提供的)。在某些实施例中,best1序列编码具有uniprotkb-a5h7g8-1氨基酸序列的蛋白质。在该方法的某些实施例中,将人best1(hbest1)基因递送至除人以外的哺乳动物(例如犬、大鼠、小鼠或非人灵长类动物模型)以例如评估疗法的效果。在某些实施例中,best1序列是全长人best1的序列。术语“片段”或“功能片段”是指保留全长蛋白质功能的任何片段,尽管不一定处于相同的表达或活性水平。人或其它best1序列的功能片段可由本领域技术人员确定。在某些实施例中,best1序列来源于犬科动物。在其它实施例中,对best1序列进行某些修饰以增强在靶细胞中的表达。此类修饰包括密码子优化(参见,例如,美国专利号7,561,972、7,561,973和7,888,112,通过引用并入本文)。
81.如本文所用的术语“腺相关病毒”、“aav”或“aav血清型”是指数十种天然存在的和可获得的腺相关病毒,以及人工aav。在从人或非人灵长类(nhp)分离或工程化并充分表征的aav中,人aav2是作为基因转移载体开发的第一aav;它已广泛用于不同靶组织和动物模型中的有效基因转移实验。除非另有说明,本文所述的aav衣壳、itr和其它选择的aav组分可容易地选自任何aav,包括但不限于aav1、aav2、aav3、aav4、aav5、aav6、aav7、aav8、aav9、
aav8bp、aav2-7m8和aavanc80、任何已知的或提及的aav或待发现的aav的变体或其变体或混合物。参见例如wo2005/033321,其通过引用并入本文。在另一实施例中,aav选自aav10、aav11、aav12、lk01、lk02、lk03、aav4-1、aav-2i8、rh10和/或rh74。在另一实施例中,aav衣壳是aav8bp衣壳,其优先靶向双极细胞。参见wo 2014/024282,其通过引用并入本文。在另一实施例中,aav衣壳是aav2-7m8衣壳,其已经显示优先递送至外层视网膜。参见,dalkara等人,一种新的腺相关病毒的体内定向进化,用于从玻璃体进行治疗性外视网膜基因递送(in vivo-directed evolution of a new adeno-associated virus for therapeutic outer retinal gene delivery from the vitreous),《科学转化医学(sci transl med)》5卷,189ra76(2013),其通过引用并入本文。在一个实施例中,aav衣壳是aav8衣壳。在另一实施例中,aav衣壳是aav9衣壳。在另一实施例中,aav衣壳是aav5衣壳。在另一实施例中,aav衣壳是aav2衣壳。
82.如本文所用,“人工aav”意指但不限于具有非天然存在的衣壳蛋白的aav。此类人工衣壳可以通过任何合适的技术产生,使用选择的aav序列(例如,vpl衣壳蛋白的片段)与异源序列组合,该异源序列可以从不同的选择的aav、相同aav的非连续部分、从非aav病毒来源,或从非病毒来源获得。人工aav可以是但不限于假型化aav、嵌合aav衣壳、重组aav衣壳或“人源化aav衣壳”。假型载体可用于本发明,其中一种aav的衣壳被异源衣壳蛋白取代。在一个实施例中,aav2/5和aav2-7m8是示范性的假型载体。
83.用于描述核酸序列或蛋白质的术语“异源的”是指该核酸或蛋白质来源于与其表达的宿主细胞或受试者不同的生物体或同一生物体的不同物种。术语“异源的”当用于指质粒、表达盒或载体中的蛋白质或核酸时,指示该蛋白质或核酸与另一序列或亚序列一起存在,该另一序列或亚序列与所讨论的蛋白质或核酸在自然界中彼此没有相同的关系。
84.为了将表达盒或raav基因组或生产质粒包装到病毒体中,itr是在与表达盒相同的构建体中顺式所需的唯一aav组分。在一个实施例中,从aav基因组中除去用于复制(rep)和/或衣壳(cap)的编码序列,并以反式或通过包装细胞系提供以生成aav载体。
85.用于生成和分离适于递送给受试者的aav病毒载体的方法是本领域已知的。参见例如美国专利7790449;美国专利7282199;wo 2003/042397;wo 2005/033321、wo2006/110689;和us 7588772 b2]。在一个系统中,用编码侧翼为itr的转基因的构建体和编码rep和cap的构建体瞬时转染生产细胞系。在第二个系统中,用编码侧翼为itr的转基因的构建体瞬时转染稳定提供rep和cap的包装细胞系。在这些系统的每一个中,aav病毒体是响应辅助腺病毒或疱疹病毒的感染而产生的,需要从污染病毒中分离raav。最近,已经开发了不需要用辅助病毒感染来恢复aav的系统,所需的辅助功能(即腺病毒e1、e2a、va和e4或疱疹病毒ul5、ul8、ul52和ul29以及疱疹病毒聚合酶)也由该系统反式提供。在这些较新的系统中,可以通过用编码所需辅助功能的构建体瞬时转染细胞来提供辅助功能,或者可以将细胞工程化稳定含有编码辅助功能的基因,其表达可以在转录或转录后水平受到控制。
86.术语“分离的”是指材料从其原始环境(例如,如果它是天然存在的,则为自然环境)中除去。例如,存在于活体动物中的天然存在的多核苷酸或多肽不是分离的,但是从天然系统中的一些或所有共存物质中分离的相同多核苷酸或多肽是分离的,即使随后被重新引入到天然系统中。此类多核苷酸可以是载体的一部分和/或此类多核苷酸或多肽可以是组合物的一部分,并且仍然是分离的,因为此类载体或组合物不是其自然环境的一部分。
87.在又一系统中,通过用基于杆状病毒的载体感染,将侧翼为itr和rep/cap基因的表达盒引入昆虫细胞中。关于这些生产系统的综述,一般参见例如zhang等人,2009,“用于大规模重组腺相关病毒生产的腺病毒-腺相关病毒杂交体(adenovirus-adeno-associated virus hybrid for large-scale recombinant adeno-associated virus production)”,《人基因疗法(human gene therapy)》,20:922-929,其内容通过引用整体并入本文。制备和使用这些和其它aav生产系统的方法也描述于以下美国专利中,其各自的内容以全文引用的方式并入本文中:5,139,941;5,741,683;6,057,152;6,204,059;6,268,213;6,491,907;6,660,514;6,951,753;7,094,604;7,172,893;7,201,898;7,229,823;和7,439,065。一般参见,例如,grieger和samulski,2005,“腺相关病毒作为基因疗法载体:载体开发、生产和临床应用(adeno-associated virus as a gene therapy vector:vector development,production and clinical applications)”《生化工程生物技术进展(adv.biochem.engin/biotechnol)》,99:119-145;buning等人,2008,“腺相关病毒载体技术的最新发展(recent developments in adeno-associated virus vector technology)”《基因医学杂志(j.gene med)》,10:717-733;以及以下引用的参考文献,其中的每一个通过引用整体并入本文。
88.用于构建本发明任何实施例的方法是核酸操作领域技术人员已知的,包括基因工程、重组工程和合成技术。参见,例如,green和sambrook等人,分子克隆:实验室手册(molecular cloning:a laboratory manual),冷泉港出版社(cold spring harbor press),冷泉港,纽约(2012)。类似地,生成raav病毒体的方法是众所周知的并且选择合适的方法并不限制本发明。参见,例如,k.fisher等人,(1993)《病毒学杂志(j.virol.),70:520-532和美国专利第5,478,745号。
89.在某些实施例中,raav表达盒、载体和/或病毒包含aav反向末端重复序列、编码best1的核酸序列和指导编码蛋白在宿主细胞中表达的表达控制序列。在其它实施例中,raav表达盒、病毒和/或载体还包含内含子、kozak序列、多聚a、转录后调控元件等中的一种或多种。在一个实施例中,转录后调控元件是土拨鼠肝炎病毒(whp)转录后调控元件(wpre)。
90.表达盒、载体和质粒包括可使用本领域已知的技术(包括例如本文所述的密码子优化)针对特定物种进行优化的其它组分。
91.本文所述的盒、载体、质粒和病毒或其它组合物的组分包括启动子序列作为表达控制序列的一部分。在一个实施例中,启动子是天然hvmd2启动子。在另一实施例中,启动子是细胞特异性的。术语“细胞特异性”是指为重组载体选择的特定启动子可以指导best1编码序列在特定眼部细胞类型中的表达。在一个实施例中,启动子对转基因在rpe中的表达是特异性的。在一个实施例中,启动子对转基因在光感受器细胞中的表达是特异性的。在另一实施例中,启动子对在视杆和视锥中的表达是特异性的。在另一实施例中,启动子对在视杆中的表达是特异性的。在另一实施例中,启动子对在视锥中的表达是特异性的。在一个实施例中,光感受器特异性启动子是人视紫红质激酶启动子。已显示视紫红质激酶启动子在视杆和视锥中均具有活性。参见例如sun等人,用靶向视杆和视锥的启动子进行的基因疗法挽救了由aipl1突变引起的视网膜变性(gene therapy with a promoter targeting both rods and cones rescues retinal degeneration caused by aipl1 mutations),《基因
疗法(gene ther)》,2010年1月;17(1):117-131,其通过引用整体并入本文。在一个实施例中,修饰启动子以添加一个或多个限制性位点以促进克隆。
92.在一个实施例中,启动子是天然hvmd2启动子或其修饰形式。参见,guziewicz等人,《美国公共科学图书馆
·
综合(plos one)》,2013年10月15日;8(10):e75666,其通过引用并入本文。
93.在一个实施例中,启动子是人视紫红质启动子。在一个实施例中,修饰启动子以包括对用于克隆的末端的限制。参见,例如,nathans和hogness,编码人视紫红质基因的分离和核苷酸序列分析(isolation and nucleotide sequence of the geneencoding human rhodopsin),《美国国家科学院院刊》,81:4851-5(1984年8月),其通过引用整体并入本文。在另一实施例中,启动子是人视紫红质启动子的一部分或片段。在另一实施例中,启动子是人视紫红质启动子的变体。
94.其它示范性启动子包括人g蛋白偶联受体蛋白激酶1(grk1)启动子(genbank登录号ay327580)。在另一实施例中,启动子是grk1启动子的292nt片段(位置1793-2087)(参见,beltran等人,《基因疗法》,2010 17:1162-74,其通过引用整体并入本文)。在另一优选的实施例中,启动子是人光感受器间类视黄醇结合蛋白近端(irbp)启动子。在一个实施例中,启动子是hirbp启动子的235nt片段。在一个实施例中,启动子是rpgr近侧启动子(shu等人,调查眼科学与视觉科学(iovs),2102年5月,其以全文引用方式并入本文)。可用于本发明的其它启动子包括但不限于视杆视蛋白启动子、红绿视蛋白启动子、蓝色视蛋白启动子、cgmp-β-磷酸二酯酶启动子(qgueta等人,《调查眼科学与视觉科学》,2000年12月;41(13):4059-63)、小鼠视蛋白启动子(以上引用的beltran等人2010)、视紫红质启动子(mussolino等人,《基因疗法》,2011年7月,18(7):637-45)、视锥转导素的α-亚基(morrisseyet等人,《bmc发育生物学(bmc dev,biol)》,2011年1月,11:3)、β磷酸二酯酶(pde)启动子、色素性视网膜炎(rp1)启动子(nicord等人,《基因医学杂志》,2007年12月,9(12):1015-23)、nxnl2/nxnl1启动子(lambard等人,《美国公共科学图书馆
·
综合》,2010年10月,5(10):el3025)、rpe65启动子、视网膜变性慢/外周蛋白2(rds/perph2)启动子(cai等人,《实验眼科研究(exp eye res)》,2010年8月;91(2):186-94);和vmd2启动子(kachi等人,《人基因疗法》,2009(20:31-9))。这些文件中的每一个都通过引用整体并入本文。在另一实施例中,启动子选自人ef1α启动子、视紫红质启动子、视紫红质激酶、光感受器间结合蛋白(irbp)、视锥视蛋白启动子(红-绿、蓝)、含有红-绿视锥基因座控制区域的视锥视蛋白上游序列、视锥转导和转录因子启动子(神经视网膜亮氨酸拉链(nrl)和光感受器特异性核受体nr2e3、bzip)。
95.在另一实施例中,启动子是普遍存在的或组成型启动子。合适的启动子的实例是具有巨细胞病毒(cmv)增强子元件的杂交鸡β-肌动蛋白(cba)启动子。在另一实施例中,启动子是cb7启动子。其它合适的启动子包括人β-肌动蛋白启动子、人伸长因子-1α启动子、巨细胞病毒(cmv)启动子、猿猴病毒40启动子和单纯疱疹病毒胸苷激酶启动子。参见,例如,damdindorj等人,(2014年8月)腺相关病毒载体中组成型启动子的比较分析(a comparative analysis of constitutive promoters positioned in adeno-associated viral vectors),《美国公共科学图书馆
·
综合》,9(8):el06472。其它合适的启动子包括病毒启动子、组成型启动子、可调节启动子[参见例如wo 2011/126808和wo 2013/04943]。或者,可在本文所述的表达盒、raav基因组、载体、质粒和病毒中使用对生理提示有反应的启
动子。在一个实施例中,由于aav载体的大小限制,启动子的大小很小,在1000bp以下。在另一实施例中,启动子在400bp以下。其它启动子可由本领域技术人员选择。
[0096]
在进一步的实施例中,启动子选自sv40启动子、二氢叶酸还原酶启动子和磷酸甘油激酶(pgk)启动子、视紫红质激酶启动子、视杆视蛋白启动子、红-绿视蛋白启动子、蓝色视蛋白启动子、光感受器间结合蛋白(irbp)启动子和cgmp-β-磷酸二酯酶启动子、噬菌体λ(pl)启动子、单纯疱疹病毒(hsv)启动子、四环素控制的反式激活应答启动子(tet)系统、长末端重复(ltr)启动子、例如rsv ltr、momlv ltr、biv ltr或hiv ltr、莫洛尼鼠肉瘤病毒的u3区域启动子、粒酶a启动子、金属硫蛋白基因的调节序列、cd34启动子、cd8启动子、胸苷激酶(tk)启动子、b19细小病毒启动子、pgk启动子、糖皮质激素启动子、热休克蛋白(hsp)启动子、例如hsp65和hsp70启动子、免疫球蛋白启动子、mmtv启动子、劳斯肉瘤病毒(rsv)启动子、lac启动子、camv 35s启动子、胭脂碱合成酶启动子、mnd启动子或mnc启动子。其启动子序列是本领域技术人员已知的或可公开获得的,例如在文献中或在数据库中,例如genbank、pubmed等。
[0097]
在另一实施例中,启动子是诱导型启动子。诱导型启动子可选自已知的启动子,包括雷帕霉素(rapamycin)/雷帕霉素类似物启动子、蜕皮激素启动子、雌激素反应性启动子和四环素反应性启动子,或异二聚体阻遏物开关。参见sochor等人,用于基因治疗眼部应用的自体调节表达系统(an autogenously regulated expression system for gene therapeutic ocular applications.scientific reports),《科学报告(scientific reports)》,2015年11月24日;5:17105和daber r、lewis m.,一种新型分子开关(a novel molecular switch),《分子生物学杂志(j mol biol)》,2009年8月28;391(4):661-70,2009年1月21日出版,其均以全文引用方式并入本文。
[0098]
合适的polya序列的实例包括例如合成的多聚a或来自牛生长激素(bgh)、人生长激素(hgh)、sv40、兔β-珠蛋白(rgb)或修饰的rgb(mrgb)。
[0099]
合适的增强子的实例包括例如cmv增强子、rsv增强子、甲胎蛋白增强子、ttr最小启动子/增强子、lsp(th结合球蛋白启动子/α-微球蛋白/比库蛋白增强子)、apb增强子、abps增强子、αmic/bik增强子、ttr增强子、en34、apoe等。
[0100]
如本文所述的方法中使用的,“施用”意指向受试者递送疗法以治疗眼部疾病。在一个实施例中,该方法包括通过视网膜下注射向rpe、光感受器细胞或其它眼部细胞施用。在一个实施例中,该方法包括通过视网膜下注射向rpe施用。在另一实施例中,采用玻璃体内注射到眼部细胞。在又一种方法中,可以采用通过睑静脉注射到眼部细胞。在又一实施例中,可以采用脉络膜上注射到眼部细胞。根据本公开内容,本领域技术人员可以选择其它施用方法。“施用”或“施用途径”是在有或没有药用载体或赋形剂的情况下向受试者递送本文所述的疗法(例如,包含编码best1的核酸序列的raav)。如果需要,可以组合施用途径。在一些实施例中,周期性地重复施用。直接递送至眼睛(任选地通过眼部递送、视网膜下注射、视网膜内注射、玻璃体内、局部),或通过全身途径递送,例如动脉内、眼内、静脉内、肌肉内、皮下、皮内和其它胃肠外施用途径。在某些实施例中,本文提供的方法包括在单一组合物或多种组合物中施用本文所述的核酸分子和/或载体。任选地,可以递送两种或更多种不同的aav,或多种病毒[参见,例如,wo20 2011/126808和wo 2013/049493]。在另一实施例中,多种病毒可以单独或与蛋白质组合含有不同的复制缺陷型病毒(例如,aav和腺病毒)。
[0101]
如本文所用,术语“眼部细胞”是指在眼睛中或与眼睛的功能相关的任何细胞。该术语可以指任何一种感光细胞,包括视杆、视锥和感光神经节细胞或视网膜色素上皮(rpe)细胞。在一个实施例中,眼部细胞是光感受器细胞。在另一实施例中,眼部细胞是rpe。
[0102]
本文还提供了药物组合物。本文所述的药物组合物被设计用于通过任何合适的途径或不同途径的组合递送至有需要的受试者。设计这些递送方式以避免含有本文所述的aav组合物的悬浮液的直接全身递送。合适地,与全身给药相比,这可能具有减少剂量、减少毒性和/或减少对aav和/或转基因产物的不良免疫反应的益处。
[0103]
在其它方面,这些核酸序列、载体、表达盒和raav病毒载体可用于药物组合物,该药物组合物还包含药学上可接受的载体、赋形剂、缓冲剂、稀释剂、表面活性剂、防腐剂和/或佐剂等。此类药物组合物用于通过此类重组工程aav或人工aav的递送在宿主细胞中表达best1。
[0104]
为了制备这些含有核酸序列,载体,表达盒和raav病毒载体的药物组合物,优选通过常规方法评价序列或载体或病毒载体的污染,然后将其配制成适合施用于眼睛的药物组合物。此类制剂包括使用药学上和/或生理学上可接受的媒介物或载体,特别是适合施用于眼睛的媒介物或载体。
[0105]
在另一实施例中,组合物包括载体、稀释剂、赋形剂和/或佐剂。考虑到于转移病毒所针对的适应症,本领域技术人员可以容易地选择合适的载体。例如,一种合适的载体包括盐水,其可以用多种缓冲溶液(例如磷酸盐缓冲盐水)配制。
[0106]
根据本发明的组合物可以包含药学上可接受的载体,如上文所定义。合适地,本文所述的组合物包含有效量的一种或多种aav,其悬浮于药学上合适的载体中和/或与合适的赋形剂混合,其被设计用于通过注射、渗透泵、鞘内导管递送至受试者,或用于通过另一装置或途径递送。在一个实例中,组合物被配制用于玻璃体内递送。在一个实例中,组合物被配制用于视网膜下递送。在另一实例中,组合物被配制用于脉络膜上递送。
[0107]
在aav病毒载体的情况下,基因组拷贝(“gc”)、载体基因组(“vg”)或病毒颗粒的定量可用作制剂或悬浮液中所含剂量的量度。本领域已知的任何方法可用于确定本发明的复制缺陷型病毒组合物的基因组拷贝(gc)数。进行aav gc数滴定的一种方法如下:首先用dnase治疗纯化的aav载体样品以从生产过程中除去未包封的aav基因组dna或污染的质粒dna。然后对dnase抗性颗粒进行热治疗以从衣壳释放基因组。然后使用靶向病毒基因组特定区域(通常是转基因或多聚a信号)的引物/探针组通过实时pcr对释放的基因组进行定量。在另一种方法中,携带编码best1的核酸序列的重组腺相关病毒的有效剂量如s.k.mclaughlin等人,1988年,《病毒学杂志》,62:1963中所述的进行测量,以全文引用的方式并入。
[0108]
如本文所用,术语“剂量”可指在治疗过程中递送至受试者的总剂量,或以单个单位(或多个单位或分次剂量)施用递送的量。可以将病毒药物组合物配制成剂量单位,以含有携带编码本文所述的best1的核酸序列的复制缺陷型病毒,该复制缺陷型病毒的量在约1.0
×
109vg(载体基因组)/ml至约1.0
×
10
15
vg/ml的范围内,包括该范围内的所有整数或分数量。在一个实施例中,将组合物配制成含有至少1
×
109、2
×
109、3
×
109、4
×
109、5
×
109、6
×
109、7
×
109、8
×
109或9
×
109vg/ml,包括该范围内的所有整数或分数量。在另一实施例中,将组合物配制成含有至少1
×
10
10
、2
×
10
10
、3
×
10
10
、4
×
10
10
、5
×
10
10
、6
×
10
10
、7
×
10
10
、8
×
10
10
或9
×
10
10
vg/ml,包括该范围内的所有整数或分数量。在另一实施例中,将组合物配制成含有至少1
×
10
11
、2
×
10
11
、3
×
10
11
、4
×
10
11
、5
×
10
11
、6
×
10
11
、7
×
10
11
、8
×
10
11
或9
×
10
11
vg/ml,包括该范围内的所有整数或分数量。在另一实施例中,将组合物配制成含有至少1
×
10
12
、2
×
10
12
、3
×
10
12
、4
×
10
12
、5
×
10
12
、6
×
10
12
、7
×
10
12
、8
×
10
12
或9
×
10
12
vg/ml,包括该范围内的所有整数或分数量。在另一实施例中,将组合物配制成含有至少1
×
10
13
、2
×
10
13
、3
×
10
13
、4
×
10
13
、5
×
10
13
、6
×
10
13
、7
×
10
13
、8
×
10
13
或9
×
10
13
vg/ml,包括该范围内的所有整数或分数量。在另一实施例中,将组合物配制成含有至少1
×
10
14
、2
×
10
14
、3
×
10
14
、4
×
10
14
、5
×
10
14
、6
×
10
14
、7
×
10
14
、8
×
10
14
或9
×
10
14
vg/ml,包括该范围内的所有整数或分数量。在另一实施例中,将组合物配制成含有至少1
×
10
15
、2
×
10
15
、3
×
10
15
、4
×
10
15
、5
×
10
15
、6
×
10
15
、7
×
10
15
、8
×
10
15
或9
×
10
15
vg/ml,包括该范围内的所有整数或分数量。在一个实施例中,对于人应用,剂量范围可以从1
×
10
10
至约1
×
10
12
vg/ml,包括该范围内的所有整数或分数量。所有剂量可以通过任何已知的方法测量,包括通过oqpcr或数字液滴pcr(ddpcr)测量,如例如m.lock等人,《人基因治疗方法(hum gene ther methods)》,2014年4月;25(2):115-25.doi:10.1089/hgtb.2013.131中所描述的,其通过引用并入本文。
[0109]
在一个实施例中,提供了一种适于向患有或怀疑患有bestrophin病的患者施用的水性混悬剂。所述悬浮液包含水性悬浮液和约1
×
109gc或病毒颗粒至约1
×
10
12
gc或病毒颗粒/眼睛的本文所述的重组腺相关病毒(raav),其可用作bestroph病的治疗剂。在一个实施例中,每只眼睛施用约1.5
×
10
10
gc或病毒颗粒。
[0110]
也可能需要施用本发明药物组合物的多个“加强”剂量。例如,根据眼部靶细胞内转基因的持续时间,可以以6个月的间隔或在第一次给施用每年递送加强剂量。通过施用raav载体不生成aav中和抗体的事实应该允许额外的加强施用。
[0111]
此类加强剂量及其需要可以由主治医师使用例如在以下实例中描述的视网膜和视觉功能测试和视觉行为测试来监测。其它类似的测试可用于确定治疗受试者随时间变化的状态。主治医师可以选择适当的测试。或者,本发明的方法还可包括在单次或多次感染中注射更大体积的含病毒溶液,以使视觉功能水平接近野生型视网膜中发现的水平。
[0112]
在另一实施例中,本文所述的携带编码best1的核酸序列的载体、病毒和复制缺陷型病毒的量在约1.0
×
107vg/眼睛至约1.0
×
10
15
vg/眼睛的范围内,包括该范围内的所有整数或分数量。在一个实施例中,其量为至少1
×
107、2
×
107、3
×
107、4
×
107、5
×
107、6
×
107、7
×
107、8
×
107或9
×
107vg/眼睛,包括该范围内的所有整数或分数量。在一个实施例中,其量为至少1
×
108、2
×
108、3
×
108、4
×
108、5
×
108、6
×
108、7
×
108、8
×
108或9
×
108vg/眼睛,包括该范围内的所有整数或分数量。在一个实施例中,其量为至少1
×
109、2
×
109、3
×
109、4
×
109、5
×
109、6
×
109、7
×
109、8
×
109或9
×
109vg/眼睛,包括该范围内的所有整数或分数量。在一个实施例中,其量为至少1
×
10
10
、2
×
10
10
、3
×
10
10
、4
×
10
10
、5
×
10
10
、6
×
10
10
、7
×
10
10
、8
×
10
10
或9
×
10
10
vg/眼睛,包括该范围内的所有整数或分数量。在一个实施例中,其量为至少1
×
10
11
、2
×
10
11
、3
×
10
11
、4
×
10
11
、5
×
10
11
、6
×
10
11
、7
×
10
11
、8
×
10
11
或9
×
10
11
vg/眼睛,包括该范围内的所有整数或分数量。在一个实施例中,其量为至少1
×
10
12
、2
×
10
12
、3
×
10
12
、4
×
10
12
、5
×
10
12
、6
×
10
12
、7
×
10
12
、8
×
10
12
或9
×
10
12
vg/眼睛,包括该范围内的所有整数或分数量。在一个实施例中,其量为至少1
×
10
13
、2
×
10
13
、3
×
10
13
、4
×
10
13
、5
×
10
13
、6
×
10
13
、7
×
10
13
、8
×
10
13
或9
×
10
13
vg/眼睛,包括该范围内的所有整数或分数量。在一个实施例
中,其量为至少1
×
10
14
、2
×
10
14
、3
×
10
14
、4
×
10
14
、5
×
10
14
、6
×
10
14
、7
×
10
14
、8
×
10
14
或9
×
10
14
vg/眼睛,包括该范围内的所有整数或分数量。在一个实施例中,其量为至少1
×
10
15
、2
×
10
15
、3
×
10
15
、4
×
10
15
、5
×
10
15
、6
×
10
15
、7
×
10
15
、8
×
10
15
或9
×
10
15
vg/眼睛,包括该范围内的所有整数或分数量。在一个实施例中,该方法包含在1
×
109至约1
×
10
13
vg/眼睛/剂量的剂量范围,包括该范围内的所有整数或分数量。在另一实施例中,该方法包含在水性悬浮液中递送载体。在另一实施例中,该方法包含以大约或至少150微升体积中1
×
109至1
×
10
13
vg的剂量施用本文所述的raav,从而恢复所述受试者的视觉功能。
[0113]
这些上述剂量可以以各种体积的载体、赋形剂或缓冲剂制剂给药,范围从大约25至大约1000微升,包括该范围内的所有数字,这取决于待治疗区域的大小、使用的病毒滴度、给药途径,以及该方法的预期效果。在一个实施例中,载体、赋形剂或缓冲液的体积为至少约25μl。在一个实施例中,体积为约50μl。在另一实施例中,体积为约75μl。在另一实施例中,体积为约100μl。在另一实施例中,体积为约125μl。在另一实施例中,体积为约150μl。在另一实施例中,体积为约175μl。在又一实施例中,体积为约200μl。在另一实施例中,体积为约225μl。在又一实施例中,体积为约250μl。在又一实施例中,体积为约275μl。在又一实施例中,体积为约300μl。在又一实施例中,体积为约325μl。在另一实施例中,体积为约350μl。在另一实施例中,体积为约375μl。在另一实施例中,体积为约400μl。在另一实施例中,体积为约450μl。在另一实施例中,体积为约500μl。在另一实施例中,体积为约550μl。在另一实施例中,体积为约600μl。在另一实施例中,体积为约650μl。在另一实施例中,体积为约700μl。在另一实施例中,体积为约800μl。在另一实施例中,体积在约150和800μl之间。在另一实施例中,体积在约700和1000μl之间。在另一实施例中,体积在约250和500μl之间。
[0114]
在一个实施例中,对于小动物受试者,例如小鼠,病毒构建体可以以约1μl至约3μl的体积以至少1
×
109至约至少1
×
10
11
gc的剂量递送。对于具有与人眼大小相同的眼睛的较大的兽医受试者,上述较大的人体剂量和体积是有用的。参见例如diehl等人,《应用毒理学杂志(j.applied toxicology)》,21:15-23(2001)讨论了向各种兽医动物施用物质的良好实践。该文献通过引用并入本文。
[0115]
理想的是使用最低有效浓度的病毒或其它递送媒介物以降低不良反应的风险,例如毒性、视网膜发育不良和脱离。在这些范围内的其它剂量可由主治医师考虑所治疗的受试者(优选人)的身体状态、受试者的年龄、bestrophin病和病症(如果是进行性的)发展的程度来选择。
[0116]
在某些实施例中,通过鉴定相对于对照样品中的测量值的至少2%、至少5%、至少10%、至少15%、至少20%、至少25%、至少30%、至少35%、至少40%、至少45%、至少50%、至少55%、至少60%、至少65%、至少70%、至少75%、至少80%、至少85%、至少90%、至少95%或至少100%的改善或变化来确定治疗效果。对照样品可以是正常健康对照、突变疾病对照、治疗前对照、较早的时间点对照、未治疗的对侧眼睛或治疗疱外的视网膜区域。在某些实施例中,突变疾病对照是来自具有两个突变best1等位基因的受试者的样品。在其它实施例中,突变疾病控制来自具有一个突变best1等位基因和野生型best1等位基因的受试者。
[0117]
在某些实施例中,本文提供了用于评估对受试者中的best1-相关黄斑病的治疗的方法。因此,受试者携带至少一个突变best1基因。在某些实施例中,受试者对于best1突变
是杂合的(例如,一个突变的best1等位基因和一个野生型、功能性best1等位基因或突变best1等位基因的载体)。在某些实施例中,在施用治疗后,通过进行体内视网膜成像以评估以下中的一种或多种:纵向反射率曲线(lrp)、光适应和/或暗适应眼睛中is/os至视网膜色素上皮(rpe)的距离和光增强的视网膜下微脱离的形成来确定治疗的有效性(例如,如guziewicz等人,《美国国家科学院院刊》中所述,2018年3月20日;115(12):e2839-e2848,其通过引用并入本文)。这些参数可以用本领域已知的用于评估视觉功能和眼部疾病严重程度的另外的方法补充。在基于例如疾病的严重性、待测量的参数、或受试者的年龄或物种,或疗法的性质等因素选择的时间点施用疗法后评估疗法的有效性。因此,在某些时间点,在施用治疗后的一个或多个间隔评估治疗的有效性。在某些实施例中,在施用疗法后24小时、36小时、48小时或72小时内评估治疗效果。在更进一步的实施例中,在施用疗法的1周、2周、1个月、2个月、3个月、4个月、5个月或6个月内一次或多次评估治疗效果。在某些实施例中,疗法是用病毒载体进行的治疗,如本文所述。
[0118]
犬bestrophin病表现为视网膜色素上皮(rpe)和中央区中的神经视网膜之间的局灶性脱落,并且可限于犬类凹样区域或发展成黄斑外卫星病变,其表现与患者中的bvmd和arb表型平行。典型的cbest呈现双侧,具有早期发作(约12周龄),并且如bvmd中描述的明确临床阶段后缓慢进展:i期,前卵黄样,在犬凹样区域内在rpe和神经视网膜之间具有离散破坏;ii期,卵黄样,以圆形、卵黄样中央损害为特征;iii期,假性前房积脓,iv期,卵黄破裂期,以及最后v期,萎缩性-bvmd患者和cbest狗之间均具有高度可比性。
[0119]
因此,在某些实施例中,本文提供的方法包括包括对患有bestrophin病的犬动物模型进行治疗,其中该犬携带重现人疾病的临床、分子和/或组织学特征的best1突变。合适的突变包括先前鉴定的自发突变,例如c.73c》t/p.r25
*
、-c.482g》a/p.g161d和c,1388delc/p463fs.cbest1-c73t/r25
*-含有过早终止密码子,导致无效表型;cbest1-g482a/g161d,其含有错义改变,影响蛋白质折叠和运输;和cbest1-c1388del/p463fs,其含有移码突变,其截短了bestrophin-1蛋白的c-末端。在某些实施例中,犬科动物具有野生型best1等位基因和突变的best1等位基因。突变的best1等位基因可以具有一个或多个突变。本领域普通技术人员可以鉴定另外的best1突变以生成用于本文所述方法的动物模型。
[0120]
如本文所述,在cbest杂合子突变体中首次识别出先前未检测到的疾病表型。本文的数据验证了cbest杂合(cbest-het)突变狗模型。cbest-hets展示了与先前描述的cbest-纯合突变模型共享重叠的疾病方面和发病机理的表型,但是处于微妙的亚临床水平。然而,在cbest-hets中观察到的和本文所述的亚临床表现先前未被鉴定或描述,并且仅可通过用超高分辨率仪器(如本文所述的那些)测试来鉴定。cbest-het和cbest-纯合模型展示了rpe-光感受器界面的全视网膜病理学。例如,图7a和7b,在峰c处观察,可以看出cbest-het模型的rpe-pr界面展示了由于与增加的elm-rpe距离相关的ros和cos两者的延长而导致的异常微体系结构,在rpe顶端表面处存在l/ms-和rds(prph2)-阳性碎片,指示cbest-het中异常的pos-rpe并置和相互作用。此外,与野生型视网膜相比,cbest-hets展示了ros变薄、伸长和弯曲(图7d),以及碎片形成增加。此外,cbest-het模型展示了脂质稳态的调节异常,类似于cbest纯合模型。期望治疗性治疗改善这些表型变化中的一种或多种。在一个实施例中,治疗减少了cos伸长、变薄和/或弯曲。在另一实施例中,治疗减少了ros伸长、变薄和/或弯曲。在另一实施例中,治疗减少了神经胶质活化。在另一实施例中,治疗减少了elm-rpe距
离,在另一实施例中,治疗减少了视网膜碎片的累积。在另一实施例中,治疗减少了rpe-pr界面的异常pos-rpe并置和微体系结构。在另一实施例中,治疗减少了rpe顶端表面处或视网膜下间隙内的视网膜下碎片。在另一实施例中,治疗减少了受损的ipm和有缺陷的elm。在另一实施例中,治疗减少了与反应性神经胶质增生和细胞迁移相关的onl厚度波动。在另一实施例中,治疗减少了内/外视网膜中的片状改变。在另一实施例中,治疗减少了视网膜下和视网膜内疤痕的形成。在另一实施例中,治疗减少了rpe单层肥大。在另一实施例中,治疗减少了与onl和inl厚度波动相关的个体rpe细胞的偶然严重变形。在另一实施例中,治疗减少了穿透onl层的缪勒氏神经胶质神经干/突起。
[0121]
在本发明的某些实施例中,需要进行非侵入性视网膜成像和功能研究以鉴定待靶向治疗的视杆和视锥光感受器的区。在某些实施例中,采用临床诊断测试来确定一个或多个视网膜下注射的精确位置。这些测试可以包括视网膜电描记法(erg)、视野测量、通过共聚焦扫描激光检眼镜检查法(cslo)和光学相干层析成像(oct)的视网膜层的地形图和其层的厚度的测量、通过自适应光学(ao)的视锥密度的地形图、功能性眼睛检查等,这取决于被治疗的受试者的种类,其身体状态以及健康和治疗。
[0122]
在某些实施例中,该方法包括使用光学相干层析成像(oct)系统生成纵向反射率分布(lrp)。在某些实施例中,使用超高分辨率oct(uhr-oct)系统进行视网膜的成像,例如徕卡/bioptigen envisu oct系统或能够进行类似高分辨率成像的系统。参见例如图7a,其展示了使用uhr-oct系统生成的lrp。在某些实施例中,超高分辨率oct对于生成用于评估视网膜表型的lrp是必不可少的。因此,为了本文所述的某些方法的目的,标准成像系统(例如spectralis hra oct)不足以揭示视网膜表型。在某些实施例中,进一步评估lrp以评价指示治疗有效性的参数。例如,可以基于检查rpe和pr之间的rpe-光感受器(pr)界面并置处的细胞结构来评估治疗的有效性。在某些实施例中,体内成像用于评估视网膜范围的rpe-pr宏观或微观脱离的程度以确定治疗的有效性。
[0123]
如本文所述,并且如以下实例中所讨论的,uhr-oct lrp和所产生的lrp显示出视锥外节的长度(如图7a中峰a所示的is/os至视锥外节尖端(cost))和视杆外节的长度(如图7a中峰b所示的is/os至视杆外节尖端(rost))与体内和体外组织学分析相关。参见例如图7a。进一步地,cbest-hets显示视锥外段和视杆外段的伸长。进一步地,如图7a和7b所展示的,cbest模型展示了rpe-pr界面的异常微体系结构。这些描述的变化在cbest模型和受试受试者中都是可测量的。这些测量可用于帮助确定治疗效果,以及识别需要对best疾病进行医疗干预的受试者。
[0124]
在某些实施例中,评估cos和/或ros以确定是否存在延长。在一个实施例中,大于约12μm至约17μm的cos测量值指示best疾病。在一些实施例中,大于约10、11、12、13、14、15、16、17、18、19或20μm的cos测量值指示best疾病。
[0125]
在一个实施例中,大于约20μm至约27μm的ros测量值指示best疾病。在一些实施例中,大于约20、21、22、23、24、25、26、27、28、29或30μm的ros测量值指示best疾病。
[0126]
如本文所展示的,在常染色体显性和常染色体隐性疾病中,神经胶质改变是best疾病的标志。神经胶质改变是对视网膜的持续损伤和炎症的结果,并且尤其被观察作为穿透onl层的缪勒氏神经胶质(mg)神经干或突起。例如,在图8a和8b中可以看出,mg过程在cbest-het模型中到达rpe。
[0127]
在一个实施例中,指示best-1疾病的视网膜变化包括以下中的一种或多种:异常的pos-rpe并置和rpe-pr界面的微体系结构(图7b);与增加的elm-rpe距离相关的ros和cos的延长(图7b至图7d、图9);rpe顶端表面(图9)处或视网膜下空间(图7b至图7d)的视网膜下碎片的累积;受损的ipm和有缺陷的elm;与反应性神经胶质增生和细胞迁移相关的onl厚度波动;视网膜内/外的片状变化;视网膜下和视网膜内疤痕的形成;rpe单层肥大,与onl和inl厚度波动相关的个别rpe细胞的偶尔严重变形;穿透onl层的mg神经干/突起,其中星形胶质增生作为慢性视网膜应力的指标(图8b)。
[0128]
在某些实施例中,本文提供了用于检测常染色体显性best1突变或诊断受试者患有常染色体显性bestrophin病的方法。在某些实施例中,该方法包括使用超高分辨率oct进行视网膜成像以生成纵向反射率分布(lrp),其中异常的rpe-pr交错区导致改变的lrp分布,指示受试者携带常染色体显性best1突变。
[0129]
在某些实施例中,本文提供的方法包括从经治疗的受试者获得样品用于离体检查。因此,通过用结合样品中的眼部细胞和/或标记的试剂进行标记来检测眼部组织样品,以评估表型。例如可以使用荧光显微镜或免疫组织化学来分析样品。在某些实施例中,评估样品中的视网膜病变在rpe细胞或视网膜下空间中的自荧光物质的累积。在其它实施例中,评估样品以确定细胞骨架挽救和rpe顶端微绒毛结构的恢复、rpe细胞和光感受器(pr)外节之间适当并置的重建(rpe-pr界面的细胞体系结构),和/或不溶性视锥特异性光感受器间基质(ipm)的恢复以确定治疗效果(例如,如guziewicz等人,《美国公共科学图书馆-综合》,2013年10月15日;8(10):e75666和guziewicz等人,《美国国家科学院院刊》,2018年3月20日;15(12):e2839-e2848,其各自通过引用并入本文)。在某些实施例中,用结合best1、rpe65、ezrin、pezrin、mct1、cralbp、f-肌动蛋白、hcar、l-视紫红质、m-视紫红质、s-视紫红质和rho中的一种或多种的试剂标记样品。
[0130]
提供以下实例仅仅是为了说明的目的,本发明不应该被解释为局限于这些实例,而是应该被解释为涵盖由于本文提供的教导而变得明显的任何和所有变化。
[0131]
本文描述了犬cbest疾病模型中的亚临床表型,其与rpe-pr界面的异常微体系结构和导致慢性视网膜应激、反应性缪勒氏细胞神经胶质增生和星形胶质增生的暴露视网膜途径相关,这两者都导致单等位基因best1疾病中的神经元功能障碍。我们的发现支持这些亚临床异常并适用于aav介导的best1基因扩增疗法,扩大了best患者的治疗范围。
[0132]
cbest-het突变模型展示了本领域技术人员可观察到的各种疾病特征,其包括:异常pos-rpe并置和rpe-pr界面的微体系结构;与增加的elm-rpe距离相关的ros和cos的延长;rpe顶端表面处或视网膜下空间的视网膜下碎片的累积;受损的ipm和有缺陷的elm,类似于人best疾病中的uhr发现;与反应性神经胶质增生和细胞迁移相关的onl厚度波动;视网膜内/外的片状变化;视网膜下和视网膜内疤痕的形成;rpe单层肥大,与onl和inl厚度波动相关的个别rpe细胞的偶尔严重变形;穿透onl层的mg神经干/突起,其中星形胶质增生作为慢性视网膜应力的指标。
[0133]
实例
[0134]
实例1:方法
[0135]
cbest狗
[0136]
所有cbest-突变和对照狗均在美国宾夕法尼亚州肯尼特广场的视网膜疾病研究
机构(rdsf)饲养和维护。这些研究严格按照国家卫生研究院(nih)的实验动物护理和使用指南中的建议进行,并符合视觉和眼科研究协会(arvo)在眼科和视觉研究中使用动物的声明。该协议由宾夕法尼亚大学的机构动物护理和使用委员会批准(iacuc#s804956,803422)。尽一切努力提高动物福利并减少不适。
[0137]
基因分型
[0138]
cbest狗的基因型是使用先前开发的基于pcr的测定法和犬best1(cbest1)(gb#nm_001097545.1)基因特异性引物测定(guziewicz等人,2007;zangerl等人,2010)。为了证实cbest1杂合突变(c.73c》t or c.482g》a或c,1388delc),纯化pcr扩增子(exosap-it、赛默飞世尔科技、waltham、ma,usa),并将其提交用于直接sanger测序(宾夕法尼亚大学napcore机构,美国宾夕法尼亚州费城儿童医院),并使用sequencher v.5.2.4软件包(基因编码,美国密歇根州安阿伯)进行分析。
[0139]
眼科检查和体内视网膜成像
[0140]
定期进行眼科检查,包括生物显微镜检查、间接眼底镜检查和眼底照相,从5周龄开始,然后在cslo/oct基线评估前每两周进行一次,此后每4周进行一次。
[0141]
在瞳孔扩张后,在全身麻醉下对cbest突变和对照狗进行非侵入性视网膜成像并且根据与先前描述的类似的方法进行(cideciyan等人,2005;bordran等人,2012;guziewicz等人,2018)。用30
°
和55
°
直径的透镜(spectralis hra oct,德国海德堡)获得具有近红外照明(820nm)的反射率的重叠的正面图像,以描绘眼底特征,例如视神经、视网膜血管、视网膜下注射后的视网膜切开术或其它局部变化。自定义程序(matlab 7.5;the mathworks,美国马萨诸塞州纳蒂克)用于将单张照片数字拼接成视网膜全景图。
[0142]
使用
[0143]
envisu r2210 uhr(超高分辨率)sd-oct系统(bioptigen,徕卡显微系统(leica microsystems),美国北卡罗来纳州莫里斯维尔)获取cbest和对照眼睛的超高分辨率oct系统(徕卡/bioptigen)视网膜横截面图像成像,方法与先前描述的方法类似(aleman等人,2011;huang等人,2012;boye等人,2014)。使用
‘
兔’透镜,并且通过匹配用spectralis以及bioptigen/envisu系统扫描的同一犬眼睛上的可见特征来调整角放大率。在快速眼底模式下,找到了以犬凹样区域为中心的感兴趣的视网膜位置。在该位置获得高分辨率扫描(对1000lrp进行100次平行光栅扫描,每次重复三次)。每个lrp具有1024个样本,代表沿z轴1654μm的视网膜深度(1.615μm/样本)。使用自定义程序执行oct数据的采集后处理(matlab 7.5;the mathworks,美国马萨诸塞州纳蒂克)。oct图像的lrp通过手动拉直布鲁赫膜(brm)和脉络膜血管层(chc)反射来对准。在限定opl和外部限制膜(olm)的信号峰之间测量外部核层(onl)的厚度。在is/os峰和rpe/tapetum(rpe/t)峰之间鉴定超散射峰的数量,并定量峰之间的距离。
[0144]
体外评价
[0145]
使用类似于先前描述的评价方法,与野生型对照相比,研究了cbest-het眼睛的视网膜微体系结构(beltran等人,2006;guziewicz等人,2017;guziewicz等人,2018)。
[0146]
组织学和免疫组织化学评估
[0147]
如先前所述采集用于离体分析的r眼部组织(beltran等人,2006;bordran等人,2014)。将眼睛固定在4%多聚甲醛中或冷冻,嵌入在最佳切割温度(oct)介质中并如先前报
道的那样进行处理(beltran等人,2006;guziewicz等人,2017)。使用苏木精/伊红(h&e)染色的组织学评价和免疫组织化学(ihc)实验在10μm厚的冷冻切片上按照确立的方案进行(beltran等人,2006;guziewicz等人,2013;guziewicz等人,2017)。简言之,用lxpbs/0.25%tx-100透化视网膜冷冻切片,在室温下封闭1小时,并用第一抗体孵育过夜。一组rpe-和光感受器-特异性标记(包括best1、rpe65、ezrin、pezrin、mct1、cralbp、f-肌动蛋白、hcar、l/m&s视蛋白和rho)用于测定cbest-het和对照视网膜中的rpe-光感受器交叉区。为了同时评价不溶性光感受器间基质(ipm),应用多色标记并将第一抗体与wga-af594或pna-af647(l32460;分子探针,美国俄勒冈州尤金)组合,然后与对应的第二抗体(alexa赛默飞世尔科技公司(thermofisher scientific))温育1小时。通过落射荧光或透射光学显微镜(axioplan;卡尔蔡司(carl zeiss meditec),德国奥伯科亨市)检查载玻片,并用spot4.0照相机(诊断仪器,美国密歇根州斯特林高地)采集数字图像。
[0148]
共聚焦显微镜和图像分析
[0149]
显微图像在徕卡tcs-sp5共聚焦显微镜系统或具有dic(微分干涉对比)光学器件和dmc-2900彩色照相机(徕卡显微镜系统,德国曼海姆)的徕卡dm6000b立式显微镜上获得。为了获得高分辨率共聚焦显微照片,以0.25μm的z步进采集数字分辨率为2048
×
2048的图像叠层,然后用huygens deconvolution software v.17.04(scientific volume imaging inc.,荷兰希尔弗瑟姆)去卷积。所有去卷积的图像在徕卡las
×
3d渲染模块中进行渲染,并从最大投影图像中评价与视锥相关的rpe顶端微绒毛。使用prism软件v.7(prism;graphpad,美国加利福尼亚州圣地亚哥)分析和定量数据。
[0150]
实例2:cbest杂合狗的视网膜表型的评价
[0151]
本研究的目的是确定cbest杂合突变狗(cbest-het)是否呈现较温和的疾病表型,这将支持使用cbest-het模型对常染色体显性形式的疾病进行aav2-best1基因扩增疗法的临床前评价。因此,使用超高分辨率oct系统(徕卡/bioptigen)进行视网膜成像,以确定低于标准临床系统(spectralis hra oct)分辨率的rpe/pr界面是否存在结构异常。cbest狗(n=9;两性)携带cbest1-cmrl:c.73c》t/p.r25*或cmr2:-c.482g》a/p.g161d或cmr3:-c.1388delc/p.p463fs突变在杂合状态进行评估。
[0152]
cbest杂合突变狗在宾夕法尼亚大学rdsf饲养,并被安置在强光(450lux)循环条件下。在基线(12周龄)监测视网膜表型,并在6周基础上通过检眼镜检查和cslo/sd-oct使用已建立的递增光暴露方案进行跟踪。使用超高分辨率oct系统(bioptigen)进行成像,以确定是否存在低于标准临床系统(spectralis)分辨率的结构异常。在24周龄(grpl n=3)或36周龄(grp2 n=3)评价视网膜病理学。基于在24或36周龄鉴定的cbest-het狗中的中间表型,保留剩余的cbest-het组(grp3 n=3)以测试通过基因疗法的校正(实例3)。cbest-het模型的体外研究结果指示,与rpe顶端方面和rpe/pr界面相关的细胞骨架部分发育不良,并指示单倍体不足是cbest-het亚临床表现的潜在原因。
[0153]
使用靶向光暴露的系列体内成像用于确定较温和的cbest-het表型与其对光的敏感性之间的关联(基于is/os-rpe/t距离测量定量的视网膜下微脱离的光增强形成)。组织学/ihc表明在cbest-het视网膜中的rpe-pr交叉区鉴定出视网膜形态和分子缺陷。还检查了参与best1途径的ca-依赖性分子的表达、脂褐质的累积和rpe顶端方面的细胞结构(视锥-mv定量)。cbest-het突变表型的表征产生了对best1单倍不足机制的洞察,并因此为感
染常染色体显性遗传bestrophin病患者的基因扩增疗法奠定了基础。
[0154]
简言之,cmr1突变导致cbest1基因第一个编码外显子中的过早终止密码子,并且未检测到基因产物(bestrophin-1蛋白);cmr2改变是外显子5中的点突变(又名错义),导致氨基酸取代(甘氨酸残基
‘
g’变成极性带负电的天冬氨酸
‘
d’),导致蛋白质错折叠/er保持/错乱;cmr3微缺失(c1388del)启动pro463fs移码,导致氨基酸490处的终止密码子和蛋白质截短。所有三种cbest1突变都是自然发生的,并导致高度一致的体内表型。
[0155]
cbest-het突变模型展示了本领域技术人员可观察到的各种疾病特征,其包括:异常pos-rpe并置和rpe-pr界面的微体系结构(图7b);与增加的elm-rpe距离相关的ros和cos的延长(图7b至图7d、图9);rpe顶端表面(图9)处或视网膜下空间(图7b至图7d)的视网膜下碎片的累积;支持人最佳疾病中uhr发现的受损的ipm和有缺陷的elm;与反应性神经胶质增生和细胞迁移相关的onl厚度波动;视网膜内/外的片状变化;视网膜下和视网膜内疤痕的形成;rpe单层肥大,与onl和inl厚度波动相关的个别rpe细胞的偶尔严重变形;穿透onl层的mg神经干/突起,其中星形胶质增生作为慢性视网膜应力的指标(图8b)。
[0156]
实例3:aav介导的best1基因扩增
[0157]
具有确定的疾病表型(grp3,如实例2中所述)的cbest-het狗(n=6)被单侧注射(n=6只眼睛;年龄:36周),使用研究级aav-hbest1治疗载体(3.0e 11vg/ml),靶向先前暴露于递增光强度的视网膜区。治疗疱外的对侧眼睛和视网膜区域用作对照。在注射后(p.i.)6周、12周和24周在体内监测治疗反应(眼睛检查、cslo、biptigen oct),并评价注射后体外24周。中间cbest-het突变表型的逆转为确定与受常染色体显性形式的bestrophin病影响的大部分患者相关的校正效果提供了基线。
[0158]
实例4:aav-best1载体的临床前评价
[0159]
本研究的目的是评价结果测量,如在野生型狗中施用aav-best1载体导致best1蛋白过度表达的视网膜保护、载体嗜性和转基因表达。
[0160]
给药前:身体和眼睛检查(n=12只狗);4个剂量组;3只狗/剂量组。在12只野生型(wt)狗的一只眼中使用3种载体剂量(高剂量:3
×
10
12
vg/ml,中剂量:3
×
10
11
vg/ml,或低剂量:3
×
10
10
vg/ml)或媒介物中的一种进行视网膜下注射(medone试剂盒25g/38g插管)(150ul)。给药后10周终止。
[0161]
体内结果的安全性测量:
[0162]-给药前第1周进行体检,然后第10周终止。
[0163]-给药前、注射后(p.i.)第1天和第2天进行眼部检查,然后每周检查一次,直到第10周终止。
[0164]-在给药前、注射后第1周和第6周,然后终止(第10周),采集血清进行aav2中和抗体滴定。
[0165]-注射后10周的cslo/sd-oct检查(第10周最终评估)和定性分析。
[0166]
体外结果测量:视网膜保存、载体向性和转基因表达的评价:以注射后10周注射的眼睛的治疗区与非治疗区中的视网膜组织学(h&e)/ihc(best1转基因表达、磷酸化埃兹蛋白(pezrin)定性分析)
[0167]
实例5:glp样剂量范围发现/非临床毒理学研究
[0168]
目的:确定在glp样条件下研究级aav2-hvmd2-hbest1载体的有效剂量范围并评估
其安全性。
[0169]
受试者:cbest纯合狗。
[0170]
研究持续时间:生命期:12周(在约12周龄时注射,在约24周龄时终止)。
[0171]
方法:4个剂量组。用3个载体剂量(高剂量:3
×
10
12
vg/ml,中剂量:3
×
10
11
vg/ml,或低剂量:3
×
10
10
vg/ml)或媒介物之一在约12周龄的cbest纯合突变狗的一只眼睛中进行视网膜下注射(150ul)。给药后12周终止。
[0172]
效果的结果测量:
[0173]-在给药前和终止前(给药后约12周)通过cslo-oct评价视网膜结构。
[0174]-在同侧和对侧眼睛的治疗区与未治疗区中best1转基因表达和视锥mv结构的视网膜组织学(h&e)和ihc。
[0175]
安全性的结果测量:
[0176]-在给药前第1周进行身体检查(包括体重),然后每周进行一次直到终止(第12周)。
[0177]-在给药前、第1周进行眼部检查,然后每月检查一次,直到在第12周终止。
[0178]-在给药前进行临床病理学(cbc、化学组、凝血曲线),然后每月一次,直到第12周终止。
[0179]-在给药前、第1周采集全血(供申办者协调生物分布研究),然后每月采集一次,直至第12周终止。
[0180]-在给药前、第1周采集血清(供申办者协调aav2 nab测试),然后每月一次直到在第12周终止。
[0181]-全面尸检、组织病理学分析、用于生物分布研究的组织采集。
[0182]
眼睛检查:在给药前阶段,和第3天,注射后第1周、第2天、第4周、第8周和第12周。cslo/sd
‑‑
oct检查:在给药前和注射后12周。治疗区与未治疗区的视网膜组织学(h&e)/ihc(best1转基因表达;视锥-mv结构)。结果:本研究将确定有效和安全剂量范围,以指导首次人体临床试验的设计。
[0183]
实例6:bvmd:aav-best1临床试验结果测量的自然史和发展
[0184]
目的:确定常染色体显性best卵黄样黄斑营养不良(bvmd)患者中结构和功能缺陷的全视网膜分布。人显性疾病表型与犬隐性和显性疾病表型阶段的比较。针对bvmd局灶性基因疗法的人临床试验的结果测量的开发。
[0185]
受试者:bvmd患者(n=15)。
[0186]
研究持续时间:18个月。
[0187]
方法:结合回顾性和前瞻性数据进行分析。具体方法将包括使用标准和超高分辨率oct的横截面成像,使用近红外反射和自发荧光以及短波长自发荧光正面成像。功能方法将包括适应光和暗的双色计算机化视野测量以及暗适应测量。
[0188]
结果:视网膜上视杆和视锥介导的敏感性丧失的分布。选定视网膜位置的视觉循环动力学。外层和内层视网膜,以及rpe相关的结构异常,及其与光暴露史的关系。在患者亚组中,有长期自然病史。
[0189]
实例7:光刺激后晚期cbest疾病中光诱导的cbest表型加速和aav-best1疗法目的:利用cbest表型的光调制加速度来评价晚期疾病中的aav-hbest1基因疗法。
[0190]
受试者:6只cbest纯合感染的狗(n=2/突变)。
[0191]
研究持续时间:生命期:48周(n=6)。
[0192]
方法:cbest纯合狗将被安置在标准(120luxn=3)或强光(450lux;n=3)循环条件。两个受cbest纯合影响的组将在4周间隔(12周龄时的基线)应用已建立的靶向光刺激方案进行cslo/sd-oct成像。
[0193]
将在3周基础上进行眼科检查,并通过眼底镜检查记录视网膜表型。
[0194]
疾病进展率和严重程度将与已经采集的未受到目标光照方案挑战的狗的自然cbest历史数据进行比较,并与为两组设置的光照预治疗范例相关联。
[0195]
如果这些狗在光照后达到更晚期的疾病阶段,则将在24周龄的cbest纯合狗双侧注射研究级aav-hbest1前导治疗载体(3.0e 11vg/ml)。视网膜下注射将针对患有晚期疾病的视网膜区,而治疗疱外的视网膜区域将用作内部对照。将在接下来的注射后24周对治疗反应进行最终评估(注射后6周、12周和24周),并通过组织学和ihc评价所有3个不同的cbest纯合模型的表型挽救情况(注射后24周)。
[0196]
结果:对光诱导的cbest表型加速及其逆转的评价将为疾病度量和临床试验结果测量的发展提供关键的见解。
[0197]
实例8:arb:aav-best1临床试验的自然史和结果测量的发展
[0198]
目的:确定常染色体隐性bestrophin病(arb)患者全视网膜结构和功能缺陷的分布。人表型阶段与犬表型阶段的比较。
[0199]
针对arb局灶性基因治疗的人临床试验的结果测量的开发。
[0200]
受试者:arb患者(n=5)。
[0201]
研究持续时间:12个月。
[0202]
方法:结合回顾性和前瞻性数据进行分析。具体方法将包括使用标准和超高分辨率oct的横截面成像,使用近红外反射和自发荧光以及短波长自发荧光正面成像。功能方法将包括适应光和暗的双色计算机化视野测量以及暗适应测量。
[0203]
结果:视网膜上视杆和视锥介导的敏感性丧失的分布。选定视网膜位置的视觉循环动力学。外层和内层视网膜,以及rpe相关的结构异常,及其与光暴露史的关系。
[0204]
实例9:cbest中aav-best1治疗的长期稳定性分析
[0205]
目的:纵向跟踪评价cbest眼睛中人best1转基因表达的长期效果。
[0206]
受试者:cbest狗(n=10;两性)携带r25*/r25*或p463fs/p463fs或r25*/p463fs cbest1突变,注射aav2-hbest1(滴度范围:0.5至5.0e 11vg/ml),然后在注射后(p.i.)39至147周进行cslo/sd-oct成像。
[0207]
方法:现有纵向体内成像数据和视网膜组织学分析的综合分析。
[0208]
cbest眼睛(n=20)的评价将涉及:onl厚度的地形图的生成、is/os-rpe/t距离的定量、与患者相关的临床阶段的比较分析,基于正面和横截面记录的表型挽救(宏观和微脱离的逆转)的评价;将在冷冻切片(h&e,具有rpe-和视神经网膜-特异性标记的ihc)中测定视网膜保存,并通过共聚焦显微镜检查。与未经aav治疗的对照视网膜对比,定性和定量地评价rpe-pr界面结构的恢复(视锥-mv数/mm2)。
[0209]
结果:对体内数据的分析将有助于确定对best1基因扩增疗法敏感的患者的疾病阶段。组织学/ihc将确定与矫正rpe-pr界面结构改变相关的剂量反应关系。
[0210]
范围:cslo/sd-oct:地形图is/os-rpe/t距离和onl厚度;h&e/ihc/cbest-ar眼睛n=l 1aav-hbest1-注射与ctrls对比
[0211]
图11示出了本研究中登记的注射cbest-ar raav2-hbest1的眼睛的总结。所有接受1.15
×
10
11
或更高剂量的眼睛都显示有好转。图12示出了对注射后经长达74周cbest-ar治疗的受试者的评价。图13示出了与公开的cbest受试者相比的cbest眼睛给药。
[0212]
实例10:经治疗的cbest突变狗的评价
[0213]
如先前所述治疗cbest突变狗。guziewicz等人,best1基因疗法纠正由光照调节的弥漫性视网膜范围微脱离(best1 gene therapy corrects a diffuse retina-wide microdetachment modulated by light exposure),《美国国家科学院院刊(proc natl acad sci usa)》,2018年3月20日;115(12):e2839-e2848。2018年3月5日在线公布,其通过引用并入本文。考虑到在本文所述的cbest-hets中新观察到的表型变化,评估治疗的眼睛以确定在cbest模型中是否可观察到神经胶质的变化。评估视网膜的转基因表达,并使用gfap评估神经胶质增生和星形胶质增生。如前所述,在治疗的疱区的rpe中观察到best1表达,但在疱外没有观察到。在经治疗的眼睛的未治疗区域(在疱半影外)中观察到增加的mg神经胶质增生和星形胶质增生(图10),但在aav2-best1治疗区中没有观察到。
[0214]
进一步的说明性实施例:
[0215]
1.一种治疗受试者的bestrophin病的方法,其包含
[0216]
向所述受试者的眼睛施用一定剂量的包含编码人best1蛋白的核酸序列的重组腺相关病毒(raav)载体,
[0217]
其中所述受试者具有至少一个突变的best1等位基因,并且
[0218]
其中所述raav载体的所述剂量为:
[0219]
a)以约1.0
×
10
10
载体基因组(vg)/ml至约1.0
×
10
13
vg/ml的浓度施用;或
[0220]
b)约5.0
×
108vg/眼睛至约5.0
×
10
12
vg/眼睛。
[0221]
2.根据实施例1所述的方法,其中所述受试者是犬、小鼠、大鼠、非人灵长类动物或人。
[0222]
3.根据实施例2所述的方法,其中所述受试者是人。
[0223]
4.根据实施例1至3中任一项所述的方法,其中所述bestrophin病是best卵黄样黄斑营养不良(bvmd)、常染色体显性玻璃体视网膜脉络膜病变(advirc)或成年型卵黄样黄斑营养不良(avmd)、色素性视网膜炎(rp)、或小角膜、视杆视锥营养不良、或白内障。
[0224]
5.根据实施例1至4中任一项所述的方法,其中将所述raav载体施用于所述受试者的视网膜。
[0225]
6.根据实施例1至4中任一项所述的方法,其中所述raav载体通过视网膜下或玻璃体内或脉络膜上腔注射施用。
[0226]
7.根据实施例6所述的方法,其中所述raav载体通过视网膜下注射施用。
[0227]
8.根据实施例1至7中任一项所述的方法,其中所述核酸序列在所述眼睛的视网膜色素上皮(rpe)中表达所述人best1蛋白。
[0228]
9.根据实施例1至8中任一项所述的方法,其中编码所述best1蛋白的所述核酸序列的表达在人vmd2启动子的控制下(hvmd2)。
[0229]
10.根据实施例1至9中任一项所述的方法,其中所述raav载体的所述剂量以约1.0
×
10
10
vg/ml至约3.0
×
10
12
vg/ml的浓度施用。
[0230]
11.根据实施例10所述的方法,其中所述raav载体的剂量以约1.5
×
10
10
vg/ml的浓度施用。
[0231]
12.根据实施例1至9中任一项所述的方法,其中所述raav载体的剂量以约1.0
×
10
11
vg/ml至约7.5
×
10
11
vg/ml的浓度施用。
[0232]
13.根据实施例12所述的方法,其中所述raav载体的剂量以约3.0
×
10
11
vg/ml的浓度施用。
[0233]
14.根据实施例12所述的方法,其中所述raav载体的剂量以约6.0
×
10
11
vg/ml的浓度施用。
[0234]
15.根据实施例1至9中任一项所述的方法,其中raav载体的所述剂量以约7.5
×
10
11
vg/ml至约1.0
×
10
13
vg/ml的浓度施用。
[0235]
16.根据实施例15所述的方法,其中所述raav载体的剂量以约3.5
×
10
12
vg/ml的浓度施用。
[0236]
17.根据实施例1至16中任一项所述的方法,其中所述raav载体的剂量以约50ul至约500ul的体积施用。
[0237]
18.根据实施例17所述的方法,其中所述raav载体的剂量以约150ul的体积施用。
[0238]
19.根据实施例17所述的方法,其中所述raav载体的剂量以约300ul的体积施用。
[0239]
20.根据实施例17所述的方法,其中所述raav载体的剂量以约500ul的体积施用。
[0240]
21.根据实施例1至20中任一项所述的方法,其中所述施用的raav载体的剂量为约5.0
×
108vg/眼睛至约1.5
×
10
10
vg/眼睛。
[0241]
22.根据实施例21所述的方法,其中所述施用的raav载体的剂量为约7.5
×
108vg/眼睛。
[0242]
23.根据实施例1至20中任一项所述的方法,其中所述施用的raav载体的剂量为约1.0
×
10
10
vg/眼睛至约1.0
×
10
11
vg/眼睛。
[0243]
24.根据实施例23所述的方法,其中所述施用的raav载体的剂量为约4.5
×
10
10
vg/眼睛。
[0244]
25.根据实施例1至20中任一项所述的方法,其中所述施用的raav载体的剂量为约1.0
×
10
11
vg/眼睛至约5.0
×
10
12
vg/眼睛。
[0245]
26.根据实施例25所述的方法,其中所述施用的raav载体的剂量为约1.0
×
10
12
vg/眼睛。
[0246]
27.根据实施例1至26中任一项所述的方法,其中所述raav载体包含aav2、aav3、aav4、aav5、aav6、aav7、aav8、aav9、aav10、aav11、aav12、lk01、lk02、lk03、aav4-1、aav-2i8、rh10和/或rh74衣壳,或其杂交体、嵌合体或组合。
[0247]
28.根据实施例27所述的方法,其中所述raav载体包含aav2衣壳,或其杂交体、嵌合体或组合。
[0248]
29.根据实施例28所述的方法,其中所述raav载体包含aav2衣壳。
[0249]
30.根据实施例29所述的方法,其中所述raav载体是aav2-hvmd2-hbest1载体。
[0250]
31.根据实施例1至30中任一项所述的方法,其中将所述剂量的raav施用于所述受试者的每只眼睛。
[0251]
32.根据实施例1至30中任一项所述的方法,其中将所述剂量的raav施用于所述受试者的一只眼睛。
[0252]
33.根据实施例1至32所述的方法,其中所述方法不进一步包含施用抑制至少一种突变的best1等位基因的所述表达或活性的核酸组合物。
[0253]
34.根据实施例1至33中任一项所述的方法,其中对所述bestrophin病的治疗进行评估,其包含:
[0254]
进行体内视网膜成像以评估以下中的一种或多种:纵向反射率分布(lrp)、光适应和/或暗适应眼睛中的is/os至视网膜色素上皮(rpe)距离、电生理学、暗适应动力学视野测量和形成光增强视网膜下微脱落,
[0255]
其中治疗效果通过以下中的一种或多种来指示:通过恢复rpe顶端微绒毛结构来挽救视网膜微体系结构、和重建rpe细胞与光感受器(pr)外节(rpe-pr界面的细胞体系结构)之间的适当并置。
[0256]
35.根据实施例34所述的方法,其中进行体内视网膜成像包含眼底检查、cslo/sd-oct、测量视杆外节、视锥外节、onl厚度和elm-rpe距离中的一种或多种。
[0257]
36.根据实施例34的方法,其中所述进行体内视网膜成像包含评估反应性神经胶质增生或细胞迁移。
[0258]
37.根据实施例34所述的方法,其进一步包含评估穿透具有星形胶质增生的onl层的缪勒氏神经胶质干/突起。
[0259]
38.根据实施例34至37所述的方法,其中使用超高分辨率光学相干层析成像(oct)执行所述视网膜成像以生成所述lrp。
[0260]
39.根据实施例34至38中任一项所述的方法,其进一步包含将所选参数的测量值与正常对照、突变疾病对照、预治疗对照、早期时间点对照、未治疗的对侧眼睛或治疗疱外的视网膜区域中的测量值进行比较。
[0261]
40.根据实施例34至39中任一项所述的方法,其进一步包含从经治疗的受试者获得视网膜样品,并且
[0262]
a)用至少一种rpe-和/或光感受器-特异性标记物标记所述样品;
[0263]
b)获得具有rpe-pr交叉区的差分干涉对比(dic)选项图像的高分辨率共聚焦或宽视场荧光显微镜;和
[0264]
c)评价rpe顶端微绒毛长度、顶端微绒毛结构、onl厚度和ipm的结构完整性中的一个或多个。
[0265]
41.根据实施例40所述的方法,其中所述标记物选自best1、rpe65、ezrin、pezrin、mct1、cralbp、f-肌动蛋白、hcar、l-视蛋白、m-视蛋白、s-视蛋白、pna、gfap、iba1、rds/prph2和rho。
[0266]
42.一种鉴定需要治疗bestrophin病的受试者的方法,所述方法包含:
[0267]
对所述受试者进行体内视网膜成像以评估以下中的一种或多种:纵向反射率分布(lrp)、光适应和/或暗适应眼睛中的is/os至视网膜色素上皮(rpe)距离、拓扑图和形成光增强视网膜下微脱离;
[0268]
鉴定指示best-1疾病的视网膜变化,所述best-1疾病选自以下中的一种或多种:异常pos-rpe并置和rpe-pr界面的微体系结构、与增加的elm-rpe距离增加相关的ros和cos
history of cone disease in the murine model of leber congenital amaurosis due to cep290 mutation:determining the timing and expectation of therapy),《美国公共科学图书馆
·
综合》,2014;9(3):e92928。
[0283]
cideciyan av、jacobson sg、aleman ts、gu d、pearce-kelling se等人,人视网膜色素变性视紫红质突变体狗模型中视网膜损伤和修复的体内动力学,《美国国家科学院院刊》2005;102:5233-5238。
[0284]
davidson ae、millar id、urquhart je、burgess-mullan r等人,视网膜色素上皮蛋白bestrophin-1的错义突变导致色素性视网膜炎(missense mutations in a retinal pigment epithelium protein,bestrophin-1,cause retinitis pigmentosa),《美国人遗传学杂志》,2009;85:581-592。
[0285]
guziewicz ke、zangerl b、lindauer sj、mullins rf等人,bestrophin基因突变导致犬多灶性视网膜病变:best疾病的新动物模型,《眼科研究与视力学》2007;48:1959-1967。
[0286]
guziewicz ke、zangerl b、komaromy am、iwabe s等人,重组aav介导的best1向视网膜色素上皮细胞的转移:血清型依赖性视网膜效应分析(recombinant aav-mediated best1 transfer to the retinal pigment epithelium:analysis of serotype-dependent retinal effects),《美国公共科学图书馆
·
综合》,2013;8:e75666.
[0287]
guziewicz ke、sinha d、gomez nm、zorych k等人,bestrophin病:一种rpe光感受器界面疾病(bestrophinopathy:an rpe-photoreceptor interface disease),《视网膜和眼科研究进展(prog retin eye res)》,2017;58:70-88。
[0288]
guziewicz ke、cideciyan av、beltran wa、komaromy am等人,best1基因疗法纠正由光照调节的弥漫性视网膜范围微脱落(best1 gene therapy corrects a diffuse retina-wide microdetachment modulated by light exposure),《美国国家科学院院刊》2018;115(12):e2839-e2848。
[0289]
huang wc、wright af、roman aj、cideciyan av、manson fd等人,人x连锁rp和鼠模型中rpgr相关视网膜变性(rpgr-associated retinal degeneration in human x-linked rp and a murine model),《调查性眼科与视觉科学(invest ophthalmol vis sci)》,2012;53:5594-608。
[0290]
zangerl b、wickstrom k、slavik j、lindauer sj、ahonen w、schelling c、lohi h、guziewicz ke、aguirre gd,犬best1变异评价识别新突变并建立独立的bestrophin模型(cmr3)(assessment of canine best1 variations identifies new mutations and establishes an independent bestrophinopathy model(cmr3)),《分子视觉(mol vis)》,2010;16:2791-2804。
[0291]
本说明书中引用的所有出版物均通过引用并入本文。
[0292]
虽然已经参考特定实施例描述了本发明,但是应当理解,可以在不脱离本发明的精神的情况下进行修改。此类修改旨在落入所附权利要求的范围内。
再多了解一些
本文用于创业者技术爱好者查询,仅供学习研究,如用于商业用途,请联系技术所有人。