2.本发明涉及用于将活性药物制剂递送到眼睛的可植入的可生物蚀解的插入剂。本发明还涉及使用这种插入剂治疗需要治疗缓解的患者的方法,以及制造这种插入剂的方法。
背景技术:
4.可植入药物递送插入剂与常规药物递送方法(如口服给药或静脉注射)相比具有一定的优势。例如,在常规给药方法中,药物(活性药物成分)的浓度可能会发生很大变化,在给药后不久达到最大浓度(c
max
),随后急剧下降。为了维持治疗水平,可能需要以高剂量给药,这可能会导致暂时性潜在毒性的高药物浓度。随着药物被身体代谢或清除,药物浓度可能降低到安全和治疗水平。当药物水平下降到亚治疗水平时,必须给予另一剂量,并因此重复该周期。因此,常规给药的问题是,对于某些类型的药物,患者可能从治疗所需的重复给药周期中,长期暴露于不期望的高水平药物。此外,可能需要频繁给药,降低患者依从性。
5.可植入药物递送插入剂可降低频繁给药的需求,并避免药物的高全身浓度(high systemic concentrations)。然而,在可接受的持续时间内实现恒定的给药速率(所谓的零级释放(zero-order release))具有挑战性。
6.此外,许多可植入药物递送插入剂含有不可生物降解的材料,即使在所有药物均已给药后,这些材料仍永久留在患者体内。这可能会成为问题,特别是对于将药物递送到具有小体积的解剖位置。由于可植入药物递送装置的不可生物降解部分的不良累积,通过植入进行的重复治疗性处理可能受到限制。
7.此外,提供一种可植入的药物递送装置,其尺寸小到足以在患者体内植入,且不适感最小,但又大到足以容纳足够的药物以提供治疗水平的药物的持续释放,这是极具挑战性的。
8.考虑到这些因素,本领域仍需要改进制备可植入药物递送装置的设计和方法,该装置可向患者提供药物的控制和持续释放,以获得所需的局部或全身生理或药理效应。
9.需要改善药物递送的一种眼科疾病是年龄相关性黄斑变性(“amd”)。amd是在全世界导致失明的主要原因,世界卫生组织估计约有1400万人因amd而失明或严重受损。amd导致中心视力的进行性丧失,归因于黄斑(视网膜中央的一个特殊区域)变性和新生血管的改变。一般来说,黄斑变性可导致缓慢或突然的视力丧失。
10.amd存在两种形式:干性amd和湿性amd。通常,amd以干性amd开始,其特征是在视网膜色素上皮和下方脉络膜之间的黄斑形成玻璃膜疣、黄色斑块样沉积物。大约15%的干性amd患者发展为湿性amd,其特征是脉络膜中形成新血管(脉络膜新生血管)和视力丧失。
11.干性黄斑变性比湿性amd更常见,约90%的amd患者被诊断为干性amd。干型的amd可能由黄斑组织老化和变薄、黄斑色素沉积或这两种过程的结合引起。这种疾病的湿型通常会导致更严重的视力丧失。对于湿性amd,新血管在视网膜下方生长并渗漏血液和液体。这种渗漏导致视网膜细胞死亡,并在中央视觉中形成盲点。
12.虽然目前没有治愈amd的方法,但仍有一些治疗湿性amd的治疗方法存在,但其中许多方法不方便或有明显的不良反应。
技术实现要素:
13.根据本发明的各种实施例,经过广泛的实验,发明人发明了一种新型可生物蚀解的药物递送插入剂,其包含活性药物成分(api)和可生物蚀解的聚合物。这种插入剂对于将有效量的api局部递送到眼睛特别有用。此外,插入剂提供了api的持续释放。在一些方面,插入剂提供了一段时间的持续释放,所述时间几乎与所述插入剂在眼睛中完全侵蚀所需的时间同步。
14.这些插入剂可通过眼内(例如通过玻璃体内、脉络膜上腔和前房内)或结膜下给药。例如,插入剂可通过针或套管放置,例如玻璃体内注射。因此,在一些方面,本发明涉及一种药物递送插入剂,其可以递送有效眼内浓度的api,同时递送低全身浓度的api,例如,以降低毒性或其他不良副作用的风险。
15.在一些方面,本发明涉及通过局部(例如眼内)给药api或其药学上可接受的盐来治疗或预防眼部疾病的方法。
16.在一个实施例中,本发明涉及一种包含固体基质芯的眼部药物递送插入剂,所述固体基质芯包含基质聚合物和伏罗尼布(vorolanib)或其药学上可接受的盐,其中所述插入剂中伏罗尼布或其药学可接受的盐的量为约10%w/w至约98%w/w,其中所述插入剂的药物释放速率至少14天为约0.01μg/天至约100μg/天,并且其中所述插入剂能够在95天内有至少20%的侵蚀。在另一个实施例中,插入剂中伏罗尼布或其药学上可接受的盐的量为约60%w/w至约98%w/w。
17.在另一个实施例中,插入剂还包括基本上围绕芯的包衣。在一些实施例中,包衣的量为插入剂的约5%w/w至约20%w/w。在另外的实施例中,插入剂还包括递送端口。
18.在另一个实施例中,插入剂的尺寸和形状适于通过20g至27g的针或套管,并且插入剂具有约1mm至约10mm的长度。在另一个实施例中,插入剂的尺寸和形状适于通过小于25g的针或套管。在另一个实施例中,插入剂具有约1mm至约6mm的长度。
19.在一些实施例中,基质聚合物包含pva。在一些实施例中,基质聚合物由pva组成。在一些实施例中,包衣包含pva。在一些实施例中,包衣由pva组成。
20.在一些方面,包衣包含与基质聚合物不同等级的pva。在一些实施例中,包衣包括超过一层包含pva的包衣,并且至少一层包衣中pva的dh不同于基质聚合物pva的dh。在一些实施例中,包衣中pva的mw不同于基质聚合物pva的mw。在另一个实施例中,所述包衣包括至少两层包含pva的包衣,并且所述包衣中的至少一层包含与至少一层其他包衣不同等级的pva。在其他方面,至少两层包含pva的包衣中的pva的dh不同。在插入剂的一些实施例中,至少两层包含pva的包衣中的pva的mw不同。
21.在另一个实施例中,插入剂能够在440天内有至少90%的侵蚀。
22.在插入剂的一个方面,药物释放速率为约0.1μg/天至约20μg/天。在插入剂的另一个方面,药物释放速率为约0.1μg/天至约10μg/天。在插入剂的另一个方面,药物释放速率为约0.1μg/天至约2μg/天。
23.在一个实施例中,芯包含约200μg至约2000μg的伏罗尼布或其药学上可接受的盐。
24.在另一个实施例中,伏罗尼布的释放持续时间为至少约90天。在另一个实施例中,伏罗尼布的释放持续时间为约60天至约270天。
25.在本发明的一个方面,芯包含约1%w/w至约15%w/w的pva。
26.在本发明的另一个方面,将插入剂在约130℃至约150℃下固化约30分钟至约4小时。
27.在本发明的另一方面,插入剂具有近似零级释放速率动力学。
28.在一个实施例中,插入剂为圆柱形。在另一个实施例中,插入剂的至少一端形成递送端口。
29.在另一个实施例中,通过将pva溶解在水溶液中以形成pva溶液,将pva溶液与伏罗尼布或其药学上可接受的盐混合以形成基质混合物,将混合物通过分配尖端挤出以形成细长形状的基质,将细长形状的基质在约140℃至约160℃的温度下固化约30分钟至约2小时,并将细长形状的基质分割而制成插入剂。
30.在其他实施例中,通过将pva溶解在水溶液中以形成pva溶液,将pva溶液与伏罗尼布或其药学上可接受的盐混合以形成基质混合物,将混合物通过分配尖端挤出以形成细长形状的基质,将细长形状的基质用pva溶液进行包衣,将细长形状的基质在约140℃至约160℃的温度下固化约30分钟至约2小时,并将细长形状基质分割而制成插入剂。
31.本发明还涉及一种在有需要的受试者中治疗或预防眼部疾病的方法,包括将一个或多个插入剂注射到受试者眼睛的玻璃体中。
32.此外,本发明涉及一种在有需要的受试者中治疗黄斑变性的方法,包括将一个或多个插入剂注射到受试者眼睛的玻璃体中。在一些实施例中,所治疗的黄斑变性是年龄相关性黄斑变性。
33.在另一个方面,本发明提供了一种制备眼部药物递送插入剂的方法,包括将pva溶解在水溶液中以形成pva溶液,将pva溶液与伏罗尼布或其药学上可接受的盐混合以形成基质混合物,将混合物通过分配尖端挤出以形成细长形状的基质,将细长形状的基质在约140℃至约160℃的温度下固化约30分钟至约6小时,并将所述细长形状的基质进行分割。
34.在另一个方面,在固化基质之前,用包含pva的包衣覆盖所述细长形状的基质。
35.此外,本发明涉及一种在有需要的受试者中治疗疾病的方法,其中所述疾病选自由以下各项组成的组:黄斑变性、视网膜静脉阻塞和糖尿病视网膜病变,所述方法包括直接向受试者眼睛给药约0.01μg/天至约100μg/天的伏罗尼布。
36.在一个实施例中,通过将一个或多个包含伏罗尼布或其药学上可接受的盐的眼部药物递送插入剂注射到眼睛中来递送伏罗尼布或其药学可接受的盐。
37.在另一个实施例中,插入剂通过玻璃体内注射给药。
38.在一些实施例中,插入剂通过小于25g的针或套管注射。在一些实施例中,注射不需要切口。
39.在一些方面,注射1-6个插入剂。
40.在一些方面,每个插入剂包含约200μg至约2000μg。
41.在一些方面,所有注射的插入剂中伏罗尼布的总量为约600μg至约6000μg。
42.在一些实施例中,一个或多个眼部药物递送插入剂中的每一个至少60天具有约0.1μg/天至约100μg/天的药物释放速率。
43.在一些实施例中,一个或多个眼部药物递送插入剂至少30天递送约1μg/天至约50μg/天的伏罗尼布总平均日剂量。
44.在其他实施例中,一个或多个眼部药物递送插入剂至少30天递送约1μg/天至约20μg/天的伏罗尼布总平均日剂量。
45.本发明还提供了一种眼部药物递送插入剂,其由包含api和至少两种不同等级的pva的固体基质芯组成,其中所述插入剂的药物释放速率至少30天为约0.0001μg/天至约200μg/天,其中所述插入剂能够在95天内有至少20%的侵蚀,并且其中所述插入剂的尺寸和形状适于通过20g至27g针或套管。在该插入剂的一些实施例中,所述两种不同等级的pva是选自以下列表中的混合物,包括:mw 78000,88%水解和mw 78000,98%水解的混合物;mw 78000,88%水解和mw 78000,99 %水解的混合物;mw 6000,80%水解和mw 78000,98%水解的混合物;mw 6000,80%水解和mw 78000,99 %水解的混合物;mw 78000,88%水解和mw 125000,88%水解的混合物;以及mw 6000,80%水解和mw 125000,88%水解的混合物。
46.此外,本发明提供了一种眼部药物递送插入剂,其包括(a)包含pva和api的固体基质芯,以及(b)基本上围绕所述芯的包含pva的包衣;其中所述插入剂包含至少两种不同等级的pva,其中所述插入剂能够在95天内有至少20%的侵蚀,并且其中所述插入剂的尺寸和形状适于通过20g至27g针或套管。
47.在插入剂的一些实施例中,包衣包含与芯pva不同等级的pva。在一些实施例中,包衣中pva的dh不同于芯pva的dh。在其他实施例中,包衣中pva的mw不同于芯pva的mw。在其他实施例中,包衣包括至少两层包含pva的包衣,并且至少一层包衣包含与至少一层其他包衣不同等级的pva。在进一步的实施例中,至少两层包衣中的pva的dh不同。在一些实施例中,至少两层包衣中的pva的mw不同。
48.在插入剂的其他方面,插入剂中api的量为约60%w/w至约98%w/w。在其它方面,芯包含约20%w/w至约60%w/w的pva。在进一步的实施例中,包衣的量为插入剂的约5%w/w至约20%w/w。在其他实施例中,插入剂能够在440天内有至少90%的侵蚀。
49.在一些实施例中,插入剂具有近似零级释放速率动力学,并且所述插入剂的药物释放速率至少30天为约0.0001μg/天至约200μg/天。在其他实施例中,药物释放速率至少30天为约0.001μg/天至约100μg/天。在其它实施例中,api的释放持续时间为至少约90天。在另外的实施例中,api的释放持续时间为约60天至约270天。
50.在插入剂的一些方面,插入剂在约130℃至约150℃下固化约30分钟至约4小时。
51.在其他方面,插入剂为圆柱形。在另一个实施例中,插入剂的至少一端形成递送端口。在另一个实施例中,插入剂具有约1mm至约10mm的长度,或者其尺寸和形状适于通过小于25g的针或套管。
52.本发明还提供了一种眼部药物递送插入剂,包括:(a)包含pva和api的固体基质芯,所述pva选自由以下各项组成的组:mw6000,80%水解、mw 9000-10000,80%水解、mw 25000,88%水解、mw 25000,98%水解、mw 30000-70000,87-90%水解、mw 78000,88%水解、mw 78000,98%水解、mw 78000,99 %水解、mw 89000-98000,99 %水解、mw 85000-124000,87-89%水解、mw 108000,99
%水解、mw 125000,88%水解、mw 133000,99%水解、mw 146000-186000,99 %水解及其混合物;以及(b)基本上围绕所述芯的包含pva的至少一层包衣,其中所述包衣中的pva选自由
以下各项组成的组的pva:mw 6000,80%水解、mw 9000-10000,80%水解、mw 25000,88%水解、mw 25000,98%水解、mw 30000-70000,87-90%水解、mh78000,88%水解、mw 78000,98%水解、mw 78000,99 %水解、mw 89000-98000,99 %水解、mw 85000-124000,87-89%水解、mw 108000,99
%水解、mw 125000,88%水解、mw 133000,99%水解、mw 146000-186000,99 %水解及其混合物;其中所述芯中的pva和所述至少一层包衣中的pva是不同等级的pva。
53.在一些实施例中,插入剂包括至少2层pva,并且最外层的pva的dh低于任何其他每一层的pva的dh。
54.在本发明所述插入剂的其他实施例中,api具有1000 amu或更小的分子量和在25℃下小于约200μg/ml的水溶性。在其他实施例中,api是vegf抑制剂。在其他实施例中,api是tki抑制剂。在其他实施例中,api是伏罗尼布或其药学上可接受的盐。在进一步的实施例中,api是阿西替尼(axitinib)或其药学上可接受的盐。在其他实施例中,api是tie-2激活剂。在一些实施例中,api是雷罗他非(razuprotafib)或其药学上可接受的盐或两性离子。
55.在本发明所述方法的一些方面,受试者患有地图样萎缩(geographicatrophy)、受试者有发生地图样萎缩的风险、受试者患有视力丧失、受试者有发生视力丧失的风险、受试者患有缺血型视网膜静脉阻塞、或受试者患有非缺血型视网膜静脉阻塞。
56.本发明还提供了一种在有需要的受试者中抑制眼部血管生成的方法,包括在受试者眼睛的玻璃体中植入一个或多个眼部药物递送插入剂,其中在给药过程中给药的插入剂的数量为1至6个,并且其中所述一个或多个插入剂中的每一个至少30天具有约0.01μg/天至约100μg/天的伏罗尼布药物释放速率。
57.它还提供了一种在有需要的受试者的眼睛中抑制vegfr和pdgfr的方法,包括在受试者的眼睛的玻璃体中植入一个或多个眼部药物递送插入剂,其中在给药过程中给药的插入剂的数量为1至6个,并且其中所述一个或多个插入剂中的每一个至少30天具有约0.01μg/天至约100μg/天的伏罗尼布药物释放速率。
58.此外,本发明提供了一种在有需要的受试者中治疗黄斑变性的方法,包括在受试者眼睛的玻璃体中植入一个或多个眼部药物递送插入剂,其中在给药过程中给药的插入剂的数量为1至6个,并且其中所述一个或多个插入剂中的每一个至少30天具有约0.01μg/天至约100μg/天的伏罗尼布药物释放速率。在一些实施例中,所治疗的黄斑变性是年龄相关性黄斑变性。
59.在一些实施例中,治疗或给药的方法还包括向受试者给药包含治疗有效量的tie-2激活剂的药物组合物。在另一个实施例中,tie-2激活剂是雷罗他非或其药学上可接受的盐或两性离子。在其他实施例中,治疗方法还包括向受试者给药包含治疗有效量的甾体抗炎剂(steroidal anti-inflammatory agent)的药物组合物。
60.此外,本发明还提供了一种在有需要的受试者眼睛中抑制ve-ptp的方法,包括将一个或多个插入剂注射到受试者眼睛的玻璃体中。在其他方面,本发明提供了一种在有需要的受试者中治疗青光眼的方法,包括将一个或多个插入剂注射到受试者眼睛的玻璃体中。在另一些实施例中,本发明提供了一种在有需要的受试者中治疗iop升高的方法,包括将一个或多个插入剂注射到受试者眼睛的玻璃体中。在另一个实施例中,本发明提供了一种在有需要的受试者中降低iop的方法,包括将一个或多个插入剂注射到受试者眼睛的玻
璃体中。在一些实施例中,所述方法进一步包括给药vegf抑制剂。
61.在一些方面,本发明提供了一种用于在有需要的受试者中治疗或预防眼睛疾病的插入剂。
62.在其他方面,本发明提供了一种用于在有需要的受试者的眼睛中抑制血管生成的插入剂。
63.在其他方面,本发明提供了一种用于在有需要的受试者的眼睛中抑制vegfr和pdgfr的插入剂。
64.在一些方面,本发明提供了一种用于在有需要的受试者中治疗年龄相关性黄斑变性的插入剂。
65.在一些方面,本发明提供了一种用于在有需要的受试者的眼睛中治疗视网膜静脉阻塞的插入剂。
66.在一些方面,本发明提供了一种用于在有需要的受试者的眼睛中治疗糖尿病视网膜病变的插入剂。
67.在一些实施例中,本发明提供了一种用于在需要的受试者的眼睛中抑制ve-ptp的插入剂。
68.在一些实施例中,本发明提供了一种用于在有需要的受试者的眼睛中治疗青光眼的插入剂。
69.在其他实施例中,本发明提供了一种用于在有需要的受试者的眼睛中治疗iop升高的插入剂。
70.在其他实施例中,本发明提供了一种用于在有需要的受试者的眼睛中降低iop的插入剂。
71.在其他实施例中,本发明提供了一种用于在有需要的受试者的眼睛中治疗葡萄膜炎的插入剂。
72.在进一步的实施例中,本发明提供了一种用于在有需要的受试者的眼睛中治疗影响眼后段的慢性非感染性葡萄膜炎的插入剂。
73.在一些实施例中,插入剂通过小于25g的针或套管注射。在一些实施例中,注射不需要切口。
附图说明
74.图1描述了本发明的示例性眼部药物递送插入剂。
75.图2:图2描述了不同等级pva膜在pbs中浸泡24小时后的平均重量变化。
76.图3描述了显示所评估的膜的相对膜强度的等级。
77.图4a描述了体外药物释放曲线,示出了从制剂a植入剂释放的药物的累积百分比,该植入剂是在140℃下固化4小时的包衣制剂。
78.图4b描述了体外药物释放曲线,示出了从制剂a植入剂释放的药物累积量(μg)。
79.图5示出了在溶解介质中浸泡314天和447天后拍摄的侵蚀制剂a植入剂的照片,447天植入剂的照片包括用于比较的完整的植入剂。
80.图6描述了未包衣的制剂a植入剂的体外药物释放曲线,其与制剂a相同,但没有包衣。
81.图7示出了在溶解介质中浸泡287天和352天后拍摄的侵蚀未包衣制剂a植入剂的照片,352天植入剂的照片包括用于比较的完整的植入剂。
82.图8a描述了体外药物释放曲线,示出了从制剂b植入剂释放的药物的累积百分比,该植入剂是在140℃下固化30分钟的包衣制剂。
83.图8b描述了体外药物释放曲线,示出了从制剂b植入剂释放的药物累积量(μg)。
84.图9示出了在溶解介质中浸泡59、88和155天后拍摄的侵蚀制剂b植入剂的照片。
85.图10描述了制剂c(未固化的包衣制剂)的体外药物释放曲线。
86.图11示出了在37℃下在溶解介质中浸泡98天,然后在室温下浸泡113天的侵蚀制剂c植入剂两个样品的照片。
87.图12描述了制剂a、b和c的体外药物释放曲线的比较。
88.图13a描述了体内研究中插入剂中药物残留的平均量与时间的关系,其中植入兔眼的插入剂在不同时间点被植入,并进行分析以确定插入剂中残留的伏罗尼布的量(μg)。一条曲线示出了植入3个插入剂的眼睛的插入剂水平,另一条曲线则示出了植入6个插入剂的眼睛的插入剂的水平。
89.图13b描述了同一体内研究中植入的插入剂的药物释放累积百分比与时间的关系。一条曲线示出了植入3个插入剂的眼睛的插入剂水平,另一条曲线则示出了植入6个插入剂的眼睛的插入剂的水平。
具体实施方式
1.活性药物成分(api)
90.本发明的插入剂包含活性药物成分(api)。api有时在本文中被称为“药物”。
91.在某些实施例中,用于本发明插入剂和方法的api是分子量为1000amu或更小,并且在25℃时水溶性小于约200μg/ml。在其他实施例中,api的水溶性在25℃时小于约100μg/ml,在25℃时小于约75μg/ml,在25℃时小于约50μg/ml,在25℃时小于约10μg/ml,或在25℃时小于约5μg/ml。在一些实施例中,在25℃下api的水溶性为约0.1μg/ml至约200μg/ml、约0.1μg/ml至约150μg/ml、约0.1μg/ml至约100μg/ml、约0.1μg/ml至约75μg/ml、约0.1μg/ml至约50μg/ml、约0.1μg/ml至约20μg/ml、约0.1μg/ml至约10μg/ml或约0.5μg/ml至约50μg/ml。
92.本发明的眼部插入剂可用于递送各种类型的api。此类api和特定api的示例包括:
93.在一些实施例中,api是血管内皮生长因子(vegf)抑制剂(有时也称为抗vegf)、激酶抑制剂(如酪氨酸激酶(tki)抑制剂、血管内皮蛋白酪氨酸磷酸酶(ve-ptp)抑制剂、ang-1抑制剂、ang-2抑制剂)、tie-2激活剂、tie-2激动剂或mtor抑制剂。api具有以下活性物的一种或多种,包括阿替尼(altiratinib)、瑞巴替尼(rebastinib)、阿法替尼(afatinib)、阿列替尼(alectinib)、阿帕替尼(apatinib)、asp-3026、阿西替尼(axitinib)、巴非替尼(bafetinib)、巴利替尼(baricitinib)、比尼替尼(binimetinib)、博苏替尼(bosutinib)、布里加替尼(brigatinib)、卡博扎尼(cabozantinib)、卡奈替尼(canertinib)、塞地拉尼(cediranib)、cep-11981、cep-37440、西瑞替尼(ceritinib)、科比替尼(cobimetinib)、科帕利西(copanlisib)、克洛替尼(crenolanib)、克里佐替尼(crizotinib)、cyt387、达布拉非尼(dabrafenib)、达那康塔尔(damnacanthal)、达沙替尼(dasatinib)、多拉马匹莫德
(doramapimod)、恩替尼(enterctinib)、厄洛替尼(erlotinib)、依维莫司(everolimus)、非戈替尼(filgotinib)、福瑞替尼(foretinib)、福司他尼(fostamatinib)、吉非替尼(gefitinib)、葛兰地宁(grandinin)、伊布替尼(ibrutinib)、伊科替尼(icotinib)、艾代拉里斯(idelalisib)、伊马替尼(imatinib)、ipi-145、jsi-124、拉帕替尼(lapatinib)、乐伐替尼(lenvatinib)、列斯他替尼(lestaurtinib)、利尼法尼(linifanib)、马西替尼(masitinib)、莫替尼(motesanib)、穆布列替尼(mubritinib)、奈拉替尼(neratinib)、尼洛替尼(nilotinib)、尼达尼布(nintedanib)、帕立尼(pacritinib)、帕波西利(palbociclib)、帕唑帕尼(pazopanib)、培他尼(pegaptanib)、培福辛(perifosine)、培美替尼(pexmetinib)、pf-06463922、波那替尼(ponatinib)、px-866、奎扎替尼(quizartinib)、拉多替尼(radotinib)、雷罗他非(razuprotafib)(akb-9778)、雷戈拉非尼(regorafenib)、鲁索替尼(ruxolitinib)、塞卢米替尼(selumetinib)、塞马沙尼(semaxanib)、西罗莫司(sirolimus)、索拉非尼(sorafenib)、索拉非尼对甲苯磺酸酯(sorafenib tosylate)、星形孢菌素(staurosporine)、舒尼替尼(sunitinib)、苹果酸舒尼替尼(sunitinib malate)、su6656、替莫西莫司(temsirolimus)、tg101348、替沃扎尼(tivozanib)、托卡雷尼(toceranib)、托法替尼(tofacitinib)、曲美替尼(trametinib)、tsr-011、万达替尼(vandetanib)、伐他尼(vatalanib)、维穆拉非尼(vemurafenib)、伏罗尼布(vorolanib)和x-396。
94.在一些实施例中,api可以是甾体抗炎剂,例如甾体或皮质类固醇,其非限制性示例为醋酸氟轻松(fluocinolone acetonide)、氢化可的松(hydrocortisone)、醋酸氢化可的松酮(hydrocortisone acetate)、曲安奈德(triamcinolone acetonide)、甲基强的松龙(methylprednisolone)、地塞米松(dexamethasone)、美地松(medrysone)、甲基强的松(methylprednisolone)、泼尼松龙21-磷酸盐(prednisolone 21-phosphate)、醋酸泼尼松(prednisolone acetate)、氟甲酮(fluoromethalone)和倍他米松(betamethasone)。
95.在其他实施例中,api是前列腺素或前列腺素类似物或激动剂,如比马前列素、拉坦前列素、拉坦前列素硝酸酯、他氟前列素或曲伏前列素。
96.在其他实施例中,api是α-2肾上腺素能受体激动剂,如溴莫尼定(brimonidine)、酒石酸溴莫尼定或双羟萘酸溴莫尼定。
97.在某些方面,api是β受体阻滞剂,如噻吗洛尔。
98.在其他方面,api是碳酸酐酶抑制剂(cai),如乙酰唑胺、布林唑胺、多唑胺或醋甲唑胺。
99.在其他方面,api是rho-khinase抑制剂,如奈他地尔。
100.还考虑使用非甾体抗炎药(nsaid)。非甾体抗炎药包括双氯芬酸(diclofenac)、依托洛酮(etoldolac)、非诺洛芬(fenoprofen)、氟西他明(floctafenine)、氟比洛芬(flurbiprofen)、布洛芬(ibuprofen)、吲哚洛芬(ndoprofen)、酮洛芬(ketoprofen)、酮咯酸(ketorolac)、洛莫昔康(lomoxicam)、莫拉宗(morazone)、萘普生(naproxen)、哌唑沙尔(perisoxal)、吡洛芬(pirprofen)、普洛芬(pranoprofen)、舒波芬(suprofen)、苏昔布松(suxibuzone)、托洛芬(tropesin)、西莫洛芬(ximoprofen)、扎洛洛芬(zaltoprofen)、齐乐通(zileuton)和佐美拉(zomepirac)。还考虑了cox-2抑制剂,如伐地考昔(valdecoxib)、罗非昔布(rofecoxib)和塞来昔布(celecoxib)。
101.在一些实施例中,api是神经保护剂,如尼莫地平;抗生素,如四环素、金霉素、棒菌肽、新霉素、多粘菌素、短棒菌肽、土霉素、氯霉素、庆大霉素或红霉素;或抗菌剂,如磺胺、磺胺酰胺、磺胺甲噻二唑、磺胺异恶唑、呋喃西林或丙酸钠。
102.在另一个实施例中,api是互补抑制剂,例如c3抑制剂,例如apl-2(pegcetacoplan)或c5抑制剂。
103.还考虑了麻醉剂和镇痛剂,如利多卡因和相关化合物。
104.在一些实施例中,插入剂包含多种api。
105.此外,本发明还考虑了api的类似物、衍生物、药学上可接受的盐、酯、前药、辅药(codrug)及其保护形式。
106.给定化合物的术语“药学上可接受的盐”是指保留给定化合物的生物有效性和性质的盐,并且在生物学上或其他方面适用。
107.药学上可接受的盐包括与无机酸或有机酸的盐,以及与无机碱或有机碱的盐。本领域技术人员将认识到可用于制备无毒药学上可接受的盐的各种合成方法。
108.盐可衍生自无机酸,包括盐酸、氢溴酸、硫酸、硝酸、磷酸等。盐可衍生自有机酸,包括乙酸、丙酸、乙醇酸、葡萄糖酸、帕莫酸、丙酮酸、草酸、马来酸、丙二酸、琥珀酸、富马酸、酒石酸、柠檬酸、乳酸、苯甲酸、肉桂酸、扁桃酸、甲磺酸、乙磺酸、对甲苯磺酸、水杨酸等。
109.在一些实施例中,所述盐是丙酮化合物盐。
110.药学上可接受的碱加成盐可由无机碱和有机碱制备。衍生自无机碱的盐包括钠、钾、锂、铵、钙和镁盐。衍生自有机碱的盐包括但不限于伯胺、仲胺和叔胺的盐。
111.此外,药学上可接受的盐包括有机盐,如胆碱、氨基葡萄糖、三羟甲基氨基甲烷(tris)、葡甲胺、赖氨酸、精氨酸、三丁胺和苄星青霉素盐。
112.在一些实施例中,api为无定形、晶形、多晶型、水合物或溶剂化物。
113.除非另有规定,本技术中描述的剂量(如100μg)指的是药理学活性部分的重量,而不是给定的api盐或api酯的重量。因此,例如,当插入剂含有api的药学上可接受的盐或酯(例如,雷罗他非钠)时,必须调整重量以提供与本文所述api的量相等的api盐的量。例如,本文中提及的含有100μg雷罗他非钠的插入剂意味着该插入剂含有相当于100μg雷罗他非分子的盐量。在另一个示例中,100μg/天的药物释放率意味着插入剂释放100μg/天的药理学活性部分(例如,伏罗尼布)。
114.在本发明的一些实施例中,api是伏罗尼布或其药学上可接受的盐。
115.伏罗尼布的化学名称为(s,z)-n-(1-(二甲基氨基甲酰基)吡咯烷-3-基)-5-(5-氟-2-氧代吲哚-3-亚基)甲基)-2,4-二甲基-1h-吡咯-3-甲酰胺。同义词包括术语“x-82”。分子式为c
23h26
fn5o3。伏罗尼布在水中的溶解度小于0.1μg/ml。伏罗尼布具有以下结构:
116.如本文所用,“伏罗尼布或其药学可接受的盐”包括伏罗尼布或其药学上可接受的盐的无定形和晶形、多晶型、水合物和溶剂化物。
117.伏罗尼布是一种口服活性多激酶抑制剂,可抑制血管内皮生长因子受体(vegfr)
和血小板衍生生长因子受体(pdgfr)的激活。
118.例如,在美国专利7,683,057、8,524,709、8,039,470和美国公开申请2019/0233403中描述了制造伏罗尼布的方法;其每一个通过引用整体并入。
119.在一些实施例中,api是雷罗他非(akb-9778)或其药学上可接受的盐或两性离子,例如,雷罗他非钠、雷罗他非胆碱、雷罗他非葡糖胺、雷罗他非三羟甲基氨基甲烷(razuprotafib tris)、雷罗他非葡甲胺、雷罗他非赖氨酸、雷罗他非精氨酸、雷罗他非三丁胺、雷罗他非苄星青霉素。雷罗他非是ve-ptp(血管内皮蛋白酪氨酸磷酸酶)催化活性的有效和选择性抑制剂。雷罗他非促进tie2活化,增强ang1诱导的tie2活化,并刺激tie2通路中信号分子的磷酸化,包括蛋白激酶(akt)、一氧化氮合酶(enos)和细胞外调节蛋白激酶(erk)。
120.雷罗他非的化学名称为[4-[(2s)-2-[[(2s)-2-(甲氧基羰基氨基)-3-苯基丙基]氨基]-2-(2-噻吩-2-基-1,3-噻唑-4-基)乙基]苯基]氨基磺酸。分子式为c
26h26
n4o6s3。其cas注册号为1008510-37-9。化学结构为:
[0121]
雷罗他非的制造方法如美国专利7,622,593中所述,其全部内容通过引用并入本文。
[0122]
在本发明的一些实施例中,api是阿西替尼或其药学上可接受的盐或酯。
[0123]
阿西替尼的化学名称为n-甲基-2-[3-((e)-2-吡啶-2-基-乙烯基)-1h-吲唑-6-基磺酰基]-苯甲酰胺。分子式为c
22h18
n4os,分子量为386.47道尔顿。化学结构为:阿西替尼的pka为4.8。在ph 1.1至ph 7.8范围内,阿西替尼在水性介质中的溶解度超过0.2μg/ml。例如,在美国专利6,891,044和8,791,140中描述了制备阿西替尼的方法,其每一个都通过引用整体并入。
[0124]
在制备插入剂之前,可对api进行研磨以产生细颗粒尺寸。在一些实施例中,用于制造插入剂的api的d
90
小于200μm、小于100μm、小于50μm、小于40μm、小于30μm、小于20μm或小于15μm。在一些实施例中,d
90
为约0.01μm至约100μm、约0.01μm至约80μm、约0.1μm至约50μm、约0.1μm至约20、约0.1μm至约15μm、约0.1μm至12μm、约1μm至约50μm、约1μm至约30μm、约1
μm至约25μm、约1μm至约20μm、约1μm至约15μm、约1μm至约12μm、约5μm至约10、约7μm、约8μm、约9μm、约10μm、约11μm或约12μm。2.眼部药物递送插入剂
[0125]“眼部药物递送插入剂”是一种可植入眼睛的装置,其含有药物,并可在植入后在眼睛内释放药物。“眼部药物递送插入剂”包括本文所述的所有插入剂。
[0126]
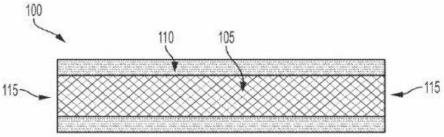
眼部药物递送插入剂包括芯,所述芯包含分散在固体基质中的api。在一些实施例中,所述芯至少部分地被包衣覆盖。插入剂是可生物蚀解的。
[0127]
在其他实施例中,插入剂仅由芯组成。它没有被围绕芯的包衣或任何类型的屏障所围绕。
[0128]
在一些实施例中,插入剂包括芯和包衣。包衣是部分或完全围绕芯的层。包衣是外层,其可以在围绕芯放置之前预成型为所需形状(例如,它可以是管),或者包衣可以通过例如芯与包衣的共挤出、将包衣喷到芯上或将芯浸渍到包衣材料中一次或多次(例如,1-10层)来形成。如果对芯进行包衣,则包衣可以完全围绕芯,或者可以仅部分围绕芯。
[0129]
插入剂可以是各种不同的形状,例如圆柱体、棒、球体或圆盘。在一些实施例中,插入剂为圆柱形形状,并且包衣覆盖除棒或圆柱体的端部之外的圆柱体的整个表面。棒的端部可以用作递送端口。在一些实施例中,圆柱体的一端被包衣覆盖,而另一端不被包衣覆盖。在一些实施例中,其中一端被不透药物的帽(例如硅胶帽)覆盖。棒是具有平行边的立体几何图形,其中一边的长度大于横截面形状的直径或最长边。横截面形状可以是圆形、椭圆形、正方形、矩形、三角形或多边形(例如六边形)。本领域技术人员将认识到,由于制造工艺,插入剂形状可能不精确,例如,外部可能不平滑且完全均匀。例如,圆柱体或棒的边可能不是完全直的或完全平行的。圆柱体的横截面可能不是完美的圆形或椭圆形。其他形状的横截面可能不完全符合这些形状的限定。例如,正方形横截面可能不具有完全直的边,并且角的角度可能不精确为90度。球体或小球可能不是完美的球形。a.基质
[0130]
在一些实施例中,芯是固体基质,包括基质聚合物和api,api可以固体形式存在,例如分散在整个基质中的粉末、微粒或颗粒。基质成分和api形成均匀混合物,api分散在其中。基质在室温下为固体,并且是可生物蚀解的。该基质控制api的释放速率,从而与未制剂api相比改变api释放速率。在一些实施例中,基质减缓药物释放速率,并提供药物的延长递送和较不频繁的给药。
[0131]
在一些实施例中,基质还包括其他药学上可接受的成分。在其他实施例中,用于形成基质的唯一材料是一种或多种基质聚合物。
[0132]
用于形成基质的聚合物(“基质聚合物”)可包括以下一种或多种:聚乙烯醇(pva)、聚(己内酯)(pcl)、聚乙二醇(peg)、聚(dl-丙交酯-共-乙交酯)(plga)、聚乙烯醇(pva)、聚(乳酸)(pla)、聚(乙醇酸)(pga)、聚烷基氰基丙烯酸酯、或其共聚物。
[0133]
在一些实施例中,基质聚合物包括pva。在一些实施例中,基质中唯一的非活性药物成分是pva。
[0134]
可使用不同等级的pva。pva的水解度(dh)可为约70%至约99
%,并且分子量(mw)可为约6000-200000,即,基质聚合物为约70摩尔%至约99
摩尔%水解的pva,其分子量为约6000-200000。例如,dh可为约80%至约90%、约80%、约81%、约82%、约83%、约84%、约
85%、约86%、约87%、约88%、约89%、约90%、约88%至约90%、约90%至约99
%、约91%、约92%、约93%、约94%、约95%、约96%、约97%、约98%、约99
%或约98至约99
%;并且mw可以是约5000、约6000、约7000、约8000、约9000、约10000、约15000、约18000、约20000、约25000、约30000、约40000、约50000、约60000、约70000、约75000、约78000、约80000、约85000、约90000、约100000、约108000、约110000、约120000、约125000、约130000、约133000、约140000、约146000、约150000、约160000、约170000、约180000、约186000、约190000或约200000。在一些实施例中,mw可以是约5000-10000、约6000-10000、约9000-10000、约10000-25000、约25000-50000、约30000-70000、约60000-80000、约70000-80000、约75000-80000、约75000-100000、约89000-98000、约85000-124000或约146000-186000。在一些实施例中,pva为mw 6000,80%水解、mw 9000-10000,80%水解、mw 25000,88%水解、mw 25000,98%水解,mw 30000-70000,87-90%水解、mw 78000,88%水解、mw 78000,98%水解、mw 78000,99 水解、mw 89000-98000,99 %水解、mw 85000-124000,87-89%水解、mw 108000,99
%水解、mw 125000,88%水解、mw133000,99%水解,或mw 146000-186000,99 %水解。
[0135]
在其他实施例中,基质聚合物包括两种、三种或四种不同等级的pva的混合物。在一些实施例中,pva是两种不同等级的pva的混合物。在一些实施例中,混合物中两种等级的比例为1:1至1:15。在一些实施例中,侵蚀较慢的pva比侵蚀较快的pva的两种等级之比为1:6、1:7、1:8、1:9、1:10、1:11或1:12。pva侵蚀速率可以如示例1中所述进行测量。例如,在一些实施例中,pva混合物的6000 mw,80%dh比125000 mw,88%dh的比例为1:9。在其他实施例中,侵蚀较快的pva比侵蚀较慢的pva的混合物中两种等级的比例为1:1至1:15,例如,1:6、1:7、1:8、1:9、1:10、1:11或1:12。
[0136]
pva混合物的示例包括mw 6000,80%水解和mw 78000,98%水解的混合物;mw 6000,80%水解和mw 78000,99
%水解的混合物;mw 78000,98%水解和mw 78000,99
%水解的混合物;以及mw 6000,80%水解与mw 125000,88%水解的混合物。
[0137]
对mw和dh进行选择,以提供特定药物所需的药物释放速率、对所使用的眼部药物递送插入剂的指示、所需药物释放持续时间和所需侵蚀速率。
[0138]
用于形成基质的聚合物溶液可在溶剂(如水或乙醇)中含有约1%w/w至约20%w/w、约1%w/w至约15%w/w、约2%w/w至约15%w/w、约2%w/w至约12%w/w、约2%w/w至约10%w/w、约3%w/w至约10%w/w、约3%w/w至约8%w/w、约3%w/w至约6%w/w、约2%w/w、约2.5%w/w、约3%w/w、约3.5%w/w、约4%w/w、约4.5%w/w、约5%w/w、约5.5%w/w、约6%w/w、约6.5%w/w、约7%w/w、约7.5%w/w、约8%w/w、约8.5%w/w、约9%w/w、约9.5%w/w、约10%w/w、约10.5%w/w、约11%w/w、约11.5%w/w、约12%w/w、约13%w/w、约14%w/w或约15%w/w聚合物(如pva)。
[0139]
聚合物溶液和api可以例如约0.5:1、约1:1、约1:1.2、约1:1.5、约1:1.7或约1:2 w/w的api:聚合物溶液的比例组合。
[0140]
在一些实施例中,芯包括伏罗尼布或其药学上可接受的盐和pva。在一些实施例中,芯由伏罗尼布或其药学上可接受的盐和pva组成。
[0141]
在一些实施例中,芯包括阿西替尼或其药学上可接受的盐和pva。在一些实施例中,芯由阿西替尼或其药学上可接受的盐和pva组成。
[0142]
在进一步的实施例中,pva溶液和api以约1:1 w/w的api:pva溶液的比例组合。
[0143]
在一些实施例中,pva溶液和api以约1:2 w/w的api:pva溶液的比例组合。
[0144]
在某些实施例中,芯含有约0.1%w/w至约90%w/w、约0.1%w/w至约80%w/w、约0.1%w/w至约70%w/w、约0.1%w/w至约60%w/w、约0.1%w/w至约50%w/w、约0.1%w/w至约40%w/w、约0.1%w/w至约30%w/w、约0.1%w/w至约25%w/w、约0.1%w/w至约20%w/w、约0.1%w/w至约15%w/w、约0.1%w/w至约10%w/w、约3%w/w至约90%w/w、约3%w/w至约75%w/w、约4%w/w至约60%w/w、约4%w/w至约50%w/w、约4%w/w至约40%w/w、约4%w/w至约25%w/w、约1%w/w至约10%w/w、约1%w/w至约9%w/w、约1%w/w至约8%w/w、约1%w/w至约7%w/w、约1%w/w至约6%w/w、约2%w/w至约8%w/w、约2%w/w至约6%w/w或约3%w/w至约5%w/w的非活性(非api)成分,如基质聚合物。这些重量百分比是基于芯的干重(即加工中的任何干燥步骤后)。
[0145]
在一些实施例中,芯中基质聚合物的量为约0.1%至约90%w/w、约0.1%w/w至约80%w/w、约0.1%w/w至约70%w/w、约0.1%w/w至约60%w/w、约0.1%w/w至约50%w/w、约0.1%w/w至约40%w/w、约0.1%w/w至约30%w/w、约0.1%w/w至约25%w/w、约0.1%w/w至约20%w/w、约0.1%w/w至约15%w/w、约0.1%w/w至约10%w/w、约3%w/w至约90%w/w、约3%w/w至约75%w/w、约4%w/w至约60%w/w、约4%w/w至约50%w/w、约4%w/w至约40%w/w、约4%w/w至约25%w/w、约1%w/w至约10%w/w、约1%w/w至约9%w/w、约1%w/w至约8%w/w、约1%w/w至约7%w/w、约1%w/w至约6%w/w、约2%w/w至约8%w/w、约2%w/w至约6%w/w、或约3%w/w至约5%w/w;或约1%w/w、1.5%w/w、2%w/w、2.5%w/w、3%w/w、3.5%w/w、4%w/w、4.5%w/w、5%w/w、5.5%w/w、6%w/w、6.5%w/w、7%w/w、7.5%w/w、8%w/w、8.5%w/w、9%w/w、9.5%w/w、10%w/w、10.5%w/w、11%w/w、11.5%w/w、12%w/w、15%w/w、18%w/w、20%w/w、25%w/w、30%w/w、35%w/w、40%w/w、50%w/w、55%w/w、60%w/w、65%w/w或70%w/w。这些重量百分比是基于芯的干重(即加工中的任何干燥步骤后)。
[0146]
术语“插入剂由包含固体基质和api的芯组成”,表示整个插入剂为固体基质和api的形式。基质还可以包括额外的成分,但所述插入剂不具有壳、包衣、帽、覆盖物或管或其他外层,使得当浸入流体环境(例如眼睛的玻璃体或体外药物释放介质)中时,芯的外部与该流体直接接触。b.包衣
[0147]
在本发明的一些实施例中,插入剂包括(a)包含api和固体基质的芯和(b)包衣或由其组成。在其他实施例中,插入剂不包括包衣。
[0148]
在一些实施例中,包衣对api的通过是可渗透的,并充当活性药物成分的扩散膜。扩散膜可以改变基质的api释放速率。扩散膜可以通过例如改变流进基质的流体和/或限制api流出基质外来起作用。在其他实施例中,与未包衣的芯相比,包衣增加了插入剂的耐久性,例如在加工、包装和/或递送药剂期间。在一些实施例中,包衣既改变了api释放速率,又增加了插入剂的耐久性。
[0149]
包衣可以完全围绕芯,或仅部分围绕芯。在一些实施例中,包衣基本上覆盖芯,这意味着它覆盖芯的表面积的至少70%。在一些实施例中,包衣覆盖芯的表面积的至少75%、至少80%、至少85%、至少90%、至少95%、约70%至约100%、约70%至约95%、约80%至约95%、约80%至约96%、约80%至约99%、约90%至约99%或约90%至约98%。在其他实施
例中,包衣围绕芯的表面积的约40%至约98%、约50%至约98%、约60%至约98%、约70%至约98%或约80%至约98%。对于圆柱形插入剂,用a=2πrl 2πr2计算表面积a,其中r为插入剂的半径,l为插入剂的长度。在一些实施例中,芯的一个面被包衣覆盖以形成递送端口。在一些实施例中,超过一个面未被覆盖以形成超过一个递送端口。
[0150]
递送端口对api是可渗透的。
[0151]
在一些实施例中,插入剂为棒状,例如圆柱形,并且只有棒/圆柱体的两端未包衣。
[0152]
为了说明本发明的眼部药物递送插入剂的一实施例,图1示出了根据本发明一个实施例的眼部药物递送插入剂100的纵向截面图。插入剂100包括固体基质芯105。插入剂100还包括基本上围绕芯105的包衣110。插入剂100还具有两个位于插入剂100的相对端部的递送端口115。在该特定的实施例中,至少其中一个递送端口115包括对包含在芯105中的api可渗透的膜,以允许api从递送端口115释放。
[0153]
在一些实施例中,与基质一样,包衣是可生物蚀解的。
[0154]
包衣可包含聚合物和/或非聚合物成分。在一些实施例中,包衣包括一种或多种聚合物,例如聚乙烯醇(pva)、聚(己内酯)(pcl)、聚乙二醇(peg)、聚(dl-丙交酯-共-乙交酯)(plga)、聚乙烯醇(pva)、聚(乳酸)(pla)、聚乙醇酸(pga)、聚烷基氰基丙烯酸酯、或其共聚物。
[0155]
在对芯进行包衣的实施例中,包衣可由1-10层聚合物形成。例如,芯可以有1层、2层、3层、4层、5层、6层、7层、8层、9层或10层包衣。在某些实施例中,每层包衣包括与其他包衣相同的聚合物。在特定实施例中,每层包衣由与其他包衣相同的聚合物组成。在其它实施例中,其中包衣由超过一层包衣形成,至少两层包衣包括不同的聚合物。
[0156]
在某些实施例中,包衣包括pva。在其他实施例中,包衣由pva组成。在一些实施例中,包衣中唯一的非活性药物成分是pva。在其他实施例中,基质聚合物包括pva且包衣包括pva。
[0157]
可使用不同等级的pva。pva的水解度(dh)可为约70%至约99
%,并且分子量(mw)可为约6000-200000,即,基质聚合物为约70摩尔%至约99 摩尔%水解的pva,其分子量为约6000-200000。例如,dh可为约80%至约90%、约80%、约81%、约82%、约83%、约84%、约85%、约86%、约87%、约88%、约89%、约90%、约88%至约90%、约90%至约99
%、约91%、约92%、约93%、约94%、约95%、约96%、约97%、约98%、约99
%或约98%至约99
%,;并且mw可以是约5000、约6000、约7000、约8000、约9000、约10000、约15000、约18000、约20000、约25000、约30000、约40000、约50000、约60000、约70000、约75000、约78000、约80000、约85000、约90000、约100000、约108000、约110000、约120000、约125000、约130000、约133000、约140000、约146000、约150000、约160000、约170000、约180000、约186000、约190000或约200000。在一些实施例中,mw可以是约5000-10000、约6000-10000、约9000-10000、约10000-25000、约25000-50000、约30000-70000、约60000-80000、约70000-80000、约75000-80000、约75000-100000、约89000-98000、约85000-124000或约146000-186000。在一些实施例中,pva为mw 6000,80%水解、mw 9000-10000,80%水解、mw 25000,88%水解、mw 25000,98%水解,mw 30000-70000,87-90%水解、mw 78000,88%水解、mw 78000,98%水解、mw 78000,99 %水解、mw 89000-98000,99 %水解、mw 85000-124000,87-89%水解、mw 108000,99
%水解、mw 125000,88%水解、mw133000,99%水解,或mw 146000-186000,
99 %水解。
[0158]
在其他实施例中,pva是两种、三种或四种不同等级的pva的混合物。在一些实施例中,pva是两种不同等级的pva的混合物。在一些实施例中,混合物中两种等级的比例为1:1至1:15。在一些实施例中,侵蚀较慢的pva比侵蚀较快的pva的两种等级之比为1:6、1:7、1:8、1:9、1:10、1:11或1:12。pva侵蚀速率可以如实施例1中所述进行测量。例如,在一些实施例中,pva混合物的6000 mw,80%dh比125000 mw,88%dh比例为1:9。在其他实施例中,侵蚀较快的pva比侵蚀较慢的pva的混合物中两种等级的比例为1:1至1:15,例如,1:6、1:7、1:8、1:9、1:10、1:11或1:12。
[0159]
pva混合物的示例包括mw 6000,80%水解和mw 78000,98%水解的混合物;mw 6000,80%水解和mw 78000,88%水解的混合物;mw 6000,80%水解和mw 78000,99
%水解的混合物;mw 78000,88%水解和mw 78000,98%水解的混合物;mw 78000,98%水解和mw 78000,99
%水解的混合物;以及mw 6000,80%水解与mw 125000,88%水解的混合物。
[0160]
在某些实施例中,芯包括两种不同等级的pva的混合物。在一些实施例中,包衣包括两种不同等级的pva的混合物。在其他实施例中,芯和包衣都包括两种不同等级的pva的混合物。当包衣包括超过一层pva时,一层或多层包衣可以包括两种不同等级的pva的混合物。
[0161]
在芯和包衣均包含pva的实施例中,芯pva和包衣pva可以是相同或不同等级的pva。本文中所使用的术语“不同等级的pva”是指pva的分子量(mw)、水解度(dh)或mw和dh两者不同。此外,如本文所用,如果与混合物进行比较的pva不是完全相同pva等级的混合物(例如,6000,80%水解的pva与mw 78000,98%水解的pva的混合物),则pva等级混合物为“不同等级的pva”将被视为与仅含有mw 78000,98%的水解pva的pva组合物,或含有mw 6000,80%水解pva与mw 125000,88%水解pva的混合物有不同等级的pva。
[0162]
因此,芯pva和包衣pva可以具有相同的mw和dh,或者可以在mw或dh上不同,或者可以同时在mw和dh上不同。在一些实施例中,芯包括pva,并且插入剂包括包含pva的包衣,其中包衣pva的mw与芯pva的mw相同,且包衣pva的dh低于芯pva的dh。在一些实施例中,包衣pva的mw和dh均低于芯pva的mw和dh。
[0163]
在一些实施例中,包衣由超过一层形成。当插入剂包衣包括超过一层pva的包衣时,具有相同mw和dh的pva可用于芯和至少其中一层。在其他实施例中,芯包括与至少一层中的pva在mw和/或dh上不同的pva。在一些实施例中,芯包括与至少一层中的pva在mw和dh上不同的pva。在其他实施例中,芯中的pva和至少一层包衣中的pva具有相同的mw,但在dh上不同。在一些实施例中,至少一层包衣中的pva的dh低于芯中的pva的dh。在其他实施例中,芯中的pva和至少一层包衣中的pvb在mw上不同,但具有相同的dh。在一些实施例中,至少一层包衣中的pva的mw低于芯中的pva的mw。
[0164]
在一些实施例中,插入剂包衣包括包含pva的单包衣。在其他实施例中,插入剂包衣包括超过一层包含pva的包衣,并且每层包衣中的pva具有相同的mw和dh。在一些实施例中,至少一层包衣包括与至少一层其他包衣中的pva在mw和/或dh上不同的pva。在一些实施例中,至少一层包衣包括与至少一层其他包衣中的pva在mw和dh上不同的pva。在一些实施例中,没有两层包衣包含相同等级的pva,即,每层包衣中的pva的在mw和/或dh上不同于每层其他包衣。
[0165]
在插入剂包衣包含超过一层包含pva的包衣的实施例中,最外层包衣中的pva比任何其他层包衣中的pva更易溶(在pbs中)。在一些实施例中,至少其中一层包衣中的pva比芯pva更易溶。
[0166]
在某些实施例中,插入剂包括(a)包含pva和api的固体基质芯,以及(b)基本上围绕芯的包含pva的包衣;并且包衣中的pva的dh低于芯中的pva的dh。在该插入剂的一个实施例中,插入剂包括2层包含pva的包衣。在其他实施例中,插入剂包括3层包含pva的包衣。在其他实施例中,插入剂包括4层包含pva的包衣。在进一步的实施例中,插入剂包括5层包含pva的包衣。在其他实施例中,插入剂包括6层包含pva的包衣。
[0167]
在具有超过一层包衣的实施例中,应用于芯的第一层包衣是最内层包衣,而应用的最后一层包衣则是最外层包衣。在具有pva的超过一层包衣的这些插入剂的一些实施例中,最内层包衣的pva的dh高于最外层包衣的pva的dh。在具有pva的超过一层包衣的这些插入剂的其他实施例中,最内层包衣中的pva的mw高于最外层包衣中的pva的mw。在一些实施例中,最外层包衣中的pva的dh低于其他每一层包衣中的pva的dh。在其它实施例中,最外层包衣中的pva的mw和dh低于任何其它层包衣中的pva的mw与dh。
[0168]
在一些方面,插入剂包括(a)包含pva和api的固体基质芯,所述pva选自由以下各项组成的组:mw 6000,80%水解、mw 9000-10000,80%水解、mw25000,88%水解、mw 25000,98%水解、mw 30000-70000,87-90%水解、mw 78000,88%水解、mw 78000,98%水解、mw 78000,99 %水解、mw 89000-98000,99 %水解、mw 85000-124000,87-89%水解、mw 108000,99
%水解、mw 125000,88%水解、mw 133000,99%水解、mw 146000-186000,99 %水解及其混合物;以及;(b)基本上围绕所述芯的包含pva的至少一层包衣,其中所述包衣中的pva选自由以下各项组成的组的pva:mw 6000,80%水解、mw 9000-10000,80%水解、mw25000,88%水解、mw 25000,98%水解、mw 30000-70000,87-90%水解、mh 78000,88%水解、mw 78000,98%水解、mw 78000,99 %水解、mw 89000-98000,99 %水解、mw 85000-124000,87-89%水解、mw 108000,99
%水解、mw 125000,88%水解、mw 133000,99%水解、mw 146000-186000,99 %水解及其混合物;以及其中所述芯中的pva和所述至少一层包衣中的pva是不同等级的pva。在其它方面,如果这种惰性,则插入剂包括至少2层pva,并且最外层的pva的dh低于其他每层的任何pva的dh。
[0169]
本发明提供了定制用于制造眼部插入剂的pva等级的能力。对芯和包衣pva的mw和dh进行选择,以提供特定药物所需的药物释放速率、对所使用的眼部药物递送插入剂的指示、所需药物释放持续时间和所需侵蚀速率。对于不同的眼部病或疾病,可能需要不同的药物释放持续时间。例如,对于糖尿病视网膜病变的治疗,药物释放的12个月持续时间(如制剂a所提供的)可能是理想的,而对于用于抑制由损伤或手术引起的眼部炎症的插入剂,少于一个月的持续时间可能是理想的。
[0170]
用于形成包衣的聚合物溶液可在溶剂(如水或乙醇)中含有约1%w/w至约20%w/w、约1%w/w至约15%w/w、约2%w/w至约15%w/w、约2%w/w至约12%w/w、约2%w/w至约10%w/w、约3%w/w至约10%w/w、约3%w/w至约8%w/w、约3%w/w至约6%w/w、约2%w/w、约2.5%w/w、约3%w/w、约3.5%w/w、约4%w/w、约4.5%w/w、约5%w/w、约5.5%w/w、约6%w/w、约6.5%w/w、约7%w/w、约7.5%w/w、约8%w/w、约8.5%w/w、约9%w/w、约9.5%w/w、约10%w/w、约10.5%w/w、约11%w/w、约11.5%w/w、约12%w/w、约13%w/w、约14%w/w或约
15%w/w聚合物(如pva)。
[0171]
对于包含pva包衣的插入剂,可以用1-10层pva溶液覆盖,即插入剂可以包含1-10层pva包衣。例如,插入剂可以包括1层、2层、3层、4层、5层、6层、7层、8层、9层或10层pva。
[0172]
在一些实施例中,插入剂包衣的重量为插入剂的约0.1%w/w至约60%w/w、约0.1%w/w至约40%w/w、约0.1%w/w至约20%w/w、约1%w/w至约40%w/w、约1%w/w至约30%w/w、约1%w/w至约20%w/w、约1%w/w至约10%w/w、约5%w/w至约30%w/w、约5%w/w至约25%w/w、约5%w/w至约20%w/w、约5%w/w至约15%w/w、约10%w/w至约25%w/w、约10%w/w至约20%w/w、约10%w/w至约18%w/w或约12%w/w至约18%w/w。这些重量百分比基于插入剂的干重(即,在加工中的任何干燥步骤之后)。
[0173]
在一些实施例中,插入剂中非活性成分的总量为约1%w/w至约70%w/w、约1%w/w至约50%w/w、约3%w/w至约90%w/w、约3%w/w至约75%w/w、约4%w/w至约60%w/w、约4%w/w至约50%w/w、约4%w/w至约40%w/w、约4%w/w至约25%w/w、约5%w/w至约40%w/w、约5%w/w至约30%w/w、约5%w/w至约25%w/w、约5%w/w至约20%w/w、约5%w/w至约15%w/w、约10%w/w至约25%w/w、约10%w/w至约22%w/w、约15%w/w至约25%w/w、约15%w/w至约22%w/w或约18%w/w至约22%w/w。这些重量百分比基于插入剂的干重(即,在加工中的任何干燥步骤之后)。
[0174]
在一些实施例中,插入剂中pva的量为约1%w/w至80%w/w、约为1%w/w至75%w/w、约为3%w/w至80%w/w、约为3%w/w至70%w/w、约为4%w/w至60%w/w、约为4%w/w至50%w/w、约为4%w/w至40%w/w、约为4%w/w至25%w/w、约为5%w/w至40%w/w、约为5%w/w至30%w/w、约为5%w/w至25%w/w、约为5%w/w至20%w/w、约为5%w/w至15%w/w、约10%w/w至约25%w/w、约10%w/w至约22%w/w、约15%w/w至约25%w/w、约15%w/w至约22%w/w或约18%w/w至约22%w/w。这些重量百分比基于插入剂的干重(即,在加工中的任何干燥步骤之后)。
[0175]
在一些实施例中,本发明提供了一种相对于插入剂中的非活性成分具有非常高的药物含量的插入剂,考虑到插入剂在较长时间内提供药物释放的能力,这是令人惊讶的。在一些实施例中,插入剂中api的量为约5%w/w至约98%、约10%w/w至约98%、约15%w/w至约98%、约20%w/w至约98%、约30%w/w至约98%、约40%w/w至约98%、约50%w/w至约98%、约60%w/w至约98%w/w、约65%w/w至约98%w/w、约70%w/w至约98%w/w、约75%w/w至约98%w/w、约65%w/w至约90%w/w、约70%w/w至约90%w/w、约75%w/w至约90%w/w或约80%w/w至约90%w/w。这些重量百分比基于插入剂的干重(即,在加工中的任何干燥步骤之后)。
[0176]
在一些实施例中,插入剂中唯一的非活性成分是聚合物,如pva。
[0177]
芯周围的包衣厚度可能为约20μm至400μm、约为20μm至300μm、约20μm至约200μm、约20μm至约100μm、约5μm至约75μm、约5μm至约50μm或约5μm至约25μm。c.插入剂形状和尺寸
[0178]
在一些实施例中,当准备将插入剂用于在眼睛的玻璃体内植入时,插入剂在任何方向上都不超过约15mm,或者优选不超过约10mm,以便插入剂可以通过15mm或更小的切口插入。
[0179]
在一些实施例中,插入剂的形状和尺寸可用于注射。在一些实施例中,插入剂的尺
寸和形状适于通过20g或更小的套管或针。这意味着插入剂可以通过具有所述规格(gauge)的套管或针进行注射,而不需要异常的力。在本文中,“或更小”一词意味着具有更小的外径。较小的外径将对应于较大的规格尺寸编号,例如,25g针的外径小于22g针。
[0180]
在一些实施例中,插入剂的尺寸和形状适于通过20至27g针或套管、21至27g针或套管、22至27g针或套管、23至27g针或套管、24至27g针或套管、25至27g针或套管、或25.5至27g针或套管。
[0181]
在其他实施例中,插入剂的尺寸和形状适于通过20g或更小、22g或更小、23g或更小的、24g或更小、25g或更小、25.5g或更小、26g或更小、或26.5g或更小的套管或针。优选地,插入剂的尺寸和形状适于穿通小于25g、小于26g或小于27g的套管或针。在一些实施例中,插入剂的尺寸和形状适于通过约29g至约25.5g的套管或针,例如从约28g至约25.5g、或从约28g至约26g。在一些实施例中,针或套管为约22、22s、23、24或25g,但优选为约25.5、26、26.5、26s、27、27.5、28、28.5、29、29.5、30或30.5g。
[0182]
在一些实施例中,插入剂为棒状、圆柱形或球形,并且长度可小于约12mm,直径可小于约1mm。
[0183]
在一些实施例中,插入剂可以是棒状或圆柱形,并且长度不超过8mm,直径不超过3mm。
[0184]
在一些实施例中,插入剂的长度为约1mm至10mm、2mm至10mm、1mm至4mm、4mm至8mm、6mm至10mm、8mm至10mm、1mm至12mm、2mm至12mm或4mm至12mm;约1mm、约1.5mm、约2mm、约2.5mm、约3mm、约3.5mm、约4mm、约4.5mm、约5mm、约5.5mm、约6mm、约6.5mm、约7mm、约7.5mm、约8mm、约8.5mm、约9mm、约9.5mm、约10mm、约10.5mm、约11mm、约11.5mm、约12mm、约12.5mm、约13mm、约13.5mm、约14mm、约14.5mm或约15mm。
[0185]
在一些实施例中,插入剂的直径为约0.1mm至约2mm、约0.1mm至约1mm、约0.1mm至约0.8mm、约0.1mm至约0.6mm、约0.1mm至约0.5mm、约0.3mm至约0.5mm、约0.3mm至约0.4mm、约0.2mm至0.4mm、约0.1mm至0.2mm、或约0.4mm至约0.6mm;约0.57mm、约0.50mm、约0.41mm、约0.42mm、约0.37mm、约0.34mm、约0.31mm、约0.26mm或约0.15mm。d.插入剂制造
[0186]
插入剂可通过将api与基质聚合物混合来制造。在一些实施例中,基质聚合物是聚合物在溶剂(例如水或乙醇)中的溶液。将api、基质聚合物溶液和任何其他基质成分混合以形成适于通过分配尖端挤出的糊剂。糊剂可通过18-25g套管或分配尖端挤出。在一些实施例中,使用21-23g套管或分配尖端。例如,套管或分配尖端的规格可以是20、21、22或23。挤出的糊剂在本文中称为挤出物、细长形状的基质或棒。棒的长度可以为约4-5英寸(约10-13cm)。挤出物在室温下为固体。挤出物可以有一个或多个附加层进行包衣。在一些实施例中,挤出物在包衣之前在室温下干燥至少24小时。
[0187]
在挤出过程中,可以控制挤出参数,如流体压力、流速和被挤出材料的温度。可选择适当的挤出机,使其能够以足够的压力和流速递送共挤出材料,以形成一定尺寸的模头和出口端口或分配尖端的产品,从而生产出可按照本文所述通过针或套管进行注射的产品。
[0188]
如果使用聚合物溶液,并且要将挤出物进行包衣,则在包衣之前,允许挤出的api-聚合物混合物进行干燥。例如,在包衣之前,挤出物可在室温下干燥约30分钟至约48小时。
[0189]
挤出物可以包衣一层或多层,尽管在一些实施例中没有施加包衣。优选地,在分割成所需插入长度之前施加包衣。可通过将挤出物浸入液体包衣材料中并使其干燥或硬化来施加包衣。可以重复该过程以添加额外的包衣层。或者,可以将包衣喷到挤出物上。
[0190]
在其他实施例中,包衣/外层可以预先形成例如管状,并且api-聚合物糊剂可以挤出到管中。
[0191]
根据用于基质的聚合物,挤出的棒可以固化。固化可以例如通过在烘箱中加热、微波加热或化学处理来进行。
[0192]
在一些实施例中,基质棒未固化或在低于80℃的温度下加热固化。在其它实施例中,基质棒在约80℃至约160℃的温度下固化约15分钟至约4小时。在一些实施例中,基质棒在约120℃至约160℃的温度下固化约15分钟至约4小时。在其它实施例中,基质棒在约130℃至约150℃下(例如约130℃至约140℃或约140℃至约150℃)固化约10分钟至约4小时。在其它实施例中,基质棒在约130℃至约150℃下固化约30分钟至约4小时。例如,固化时间可以是约15分钟、约30分钟、约45分钟、约60分钟、约75分钟、约90分钟、约105分钟或约120分钟,并且固化温度可以是约120℃、约125℃、约130℃、约135℃、约140℃、约145℃、约150℃、约155℃或约160℃。固化后,在执行其他制造步骤之前,可允许棒冷却至室温。如果要对插入剂进行包衣,则可以在固化之前或之后施加包衣。
[0193]
评估了未包衣和pva包衣的pva基质插入剂的药物释放速率。发明人发现,通常,固化温度越高且固化时间越长,药物释放速率越慢,但侵蚀也越慢。
[0194]
当所有固化、冷却和/或包衣和干燥步骤完成时,将棒分割成约1mm至约15mm长的插入剂,例如约1mm至约10mm或约2mm至约6mm的插入剂。例如,可以将棒分割成约1mm、约1.5mm、约2mm、约2.5mm、约3mm、约3.5mm、约4mm、约4.5mm、约5mm、约5.5mm、约6mm、约6.5mm、约7mm、约7.5mm、约8mm、约8.5mm、、约9mm、约9.5mm、约10mm、约10.5mm、约11mm、约11.5mm、约12mm、约12.5mm、约13mm、约13.5mm、约14mm、约14.5mm或约15mm的插入剂。
[0195]
可通过任何合适的分割棒的技术将棒分割或切割成一系列较短的产品,该技术可根据产品是否固化、未固化或部分固化而变化。例如,分割站可以采用钳子、剪刀、切片刀片或任何其他技术。应用的技术可以根据产品的每个切割部分所需的配置而变化。例如,当需要开口端时,剪切作用可能是合适的。然而,如果需要在切割时密封每个端部,可以使用钳子。
[0196]
在一些实施例中,将挤出物在pva水溶液中进行浸渍包衣,其中pva浓度为约1%w/w至约15%w/w、约1%w/w至约10%w/w、约2%w/w至约10%w/w、约2%w/w至约8%w/w、约2%w/w至约6%w/w、约3%w/w至约6%w/w、约2%w/w、约2.5%w/w、约3%w/w、约3.5%w/w、约4%w/w、约4.5%w/w、约5%w/w、约5.5%w/w、约6%w/w、约6.5%w/w、约7%w/w、约7.5%w/w、约8%w/w、约8.5%w/w、约9%w/w、约9.5%w/w或约10%w/w。
[0197]
然后,可对包衣的挤出物进行风干。浸渍包衣过程可重复1-10次,优选1-6次或1-5次,并在各包衣过程之间进行风干。然后可以如上所述固化包衣的挤出物。冷却后,然后将挤出物分割成插入剂。e.插入剂特性
[0198]
一些眼部疾病,包括上述疾病,可能需要在患者的余生中进行治疗。目前可用的治疗需要重复治疗处理。然而,通过将药物递送装置植入眼睛中的重复治疗,对于含有不可生
物降解材料的装置是有限的,因为装置的不可生物降解的残余物会积聚在眼睛中。因此,提供一种可植入的药物递送装置,该装置在下一个装置需要植入时或之后不久会完全侵蚀,这对患者非常有益。
[0199]
然而,设计一种在相当长的一段时间内提供药物治疗水平的控制释放的药物释放装置是极具挑战性的,该装置还能够在例如几个月或约一年内完全侵蚀。许多在相当长的时间内有效控制药物释放的材料是不可生物蚀解的或侵蚀太慢。
[0200]
此外,提供一种足够小的药物递送装置,以最小的不适感植入患者的眼睛中,但它能够包含足够的药物负载以提供药物的持续释放,这大大增加了上述挑战。处理和加工此类装置而不发生重大损坏的难度也增加了挑战。
[0201]
发明人已经克服了这些挑战,提供了一种足够小的药物递送装置,能够以最小的不适感植入眼睛中,能够提供持续数月的药物持续释放,同时在该装置的药物递送期结束后的某个时间完全侵蚀。此外,发明人已经发现了一种提供具有不同药物递送周期/持续时间和递送速率的装置的方法。此外,这些装置在药物递送的初期爆发之后提供药物的基本线性释放。此外,相对于插入剂中的非活性成分,插入剂具有非常高的药物含量,考虑到插入剂在较长时间内提供药物释放的能力,这是令人惊讶的。i.插入剂侵蚀:
[0202]
在一些实施例中,插入剂能够在365天内完全侵蚀。可使用以下侵蚀评估方案对插入剂在给定时间段内的侵蚀能力进行评估。将样品插入剂放置在装有5ml磷酸盐缓冲盐溶液(pbs)的10 ml玻璃小瓶中,在37℃下孵育,在感兴趣的时间段(例如,365天、200天、110天)的每一天,每24小时更换一次瓶中的pbs。在此时间段结束时,从小瓶中取出插入剂,使其干燥,然后目视检查并称重。与原始重量相比,重量减少量计算如下:
[0203]
例如,如果根据侵蚀评估方案(erosion evaluation protocol),原始重量为500μg,在pbs中孵育200天后重量为200μg的插入剂,该插入剂的重量为其原始重量的40%,重量已减少60%。它在200天内经历了60%的侵蚀。当插入剂剩余原始重量的少于10%时,插入剂被视为完全侵蚀。在一些实施例中,插入剂能够在95天内至少有20%侵蚀、在95天内至少有25%侵蚀、在95天内至少有30%侵蚀、在110天内至少有30%侵蚀、在110天内至少有40%侵蚀、在180天内至少有30%侵蚀、在180天内至少有40%侵蚀、在180天内至少有50%侵蚀、在180天内至少有60%侵蚀、在220天内至少有40%的侵蚀、在220天内至少有50%的侵蚀、在220天内至少有60%的侵蚀、在220天内至少有70%的侵蚀、在280天之内至少有60%的侵蚀、在280天内至少有70%的侵蚀、在280天内至少有80%的侵蚀、在365天内至少有60%的侵蚀、在365天内至少有70%的侵蚀、在365天内至少有80%的侵蚀、在365天内至少有90%的侵蚀、在400天内至少有70%的侵蚀、在400天内至少有80%的侵蚀、在400天内至少有90%的侵蚀、在440天内至少有70%的侵蚀、在440天内至少有80%的侵蚀或在440天内至少有90%的侵蚀,其使用侵蚀评估方案进行测量。ii.药物释放速率
[0204]
发明人发现,固化温度、固化持续时间和插入剂表面积都会影响释放速率。直径随着长度的增加保持恒定,释放速率增加。当直径保持恒定时,增加长度可增加释放速率。
[0205]
在一些实施例中,插入剂的药物释放速率为约0.01μg/天至约100μg/天、约0.01μg/天至约90μg/天、约0.01μg/天至约80μg/天、约0.01μg/天至约70μg/天、约0.01μg/天至约50μg/天、约0.01μg/天至约20μg/天、约0.01μg/天至约10μg/天、约0.1μg/天至约60μg/天、约0.1μg/天至约50μg/天、约0.1μg/天至约40μg/天、约0.1μg/天至约30μg/天、约0.1μg/天至约20μg/天、约0.1μg/天至约10μg/天、约0.1μg/天至约5μg/天、约0.1μg/天至约2μg/天、约0.1μg/天至约1μg/天、约1μg/天至约40μg/天、约1μg/天至约30μg/天、约1μg/天至约20μg/天或约1μg/天至约10μg/天。在一些实施例中,这是达到稳态(steady-state)释放后的释放速率。在一些实施例中,这是药物释放的2天、3天、5天、8天、10天、15天、20天、25天、30天、40天、50天、60天、70天、80天、90天、100天、105天或110天之后的释放速率。
[0206]
在一些实施例中,通过体外药物释放方法(drug release method)测量,插入剂具有至少14天、至少30天、至少60天、至少90天、至少100天、至少120天、至少180天、至少200天、至少240天、至少270天、至少300天或至少365天的释放速率。
[0207]
以下体外药物释放方法用于评估药物释放量:将插入剂置于10ml玻璃管中,并向管中加入5ml pbs。将试管在37℃的水浴中进行孵育。在所述期间的每天采集培养基样品,并用新鲜pbs替换释放培养基。如示例2b所述,可通过hplc定量测量释放的api量。
[0208]
在插入剂释放api期间的持续时间(总时间长度)可以介于在约90天至约365天、约90天至约260天、约90天至约200天之间,或者至少约8周、至少约10周、至少约12周、至少约18周、至少约22周、至少约28周、至少约30周、至少约36周、至少约40周、至少约44周或至少约52周。上述体外药物释放试验可用于确定插入剂在该持续时间内是否释放药物。
[0209]
在一些实施例中,本发明的插入剂在达到稳态速率之前的一段时间内提供体内药物的初始快速释放或爆发。在本发明的优选实施例中,快速释放的初始时期远小于api释放的总持续时间(例如,小于10%)。在一些实施例中,该初始时期为例如1至120天、20至120天、80至120天、1至20天、2至50天、3至40天、5至60天、1天、2天、3天、4天、5天、8天、10天、12天、15天、20天、25天、30天、40天、50天、60天、70天、80天、90天、100天、105天、110天。在对兔眼进行的体外研究中,发明人发现药物释放的初始爆发出乎意料地高,这意味着来自插入剂的api初始释放比预期快,然后才趋于稳态。这种爆发可能是有益的,因为它允许快速实现c
max
和平衡,从而快速向眼睛局部提供治疗有效量。在该爆发之后,api释放速率趋于稳定,以每天提供治疗有效量的api。
[0210]
在优选实施例中,本发明的插入剂在植入后的预定持续时间内,例如14天、28天、42天、56天、168天、180天、224天、300天或365天,以基本恒定的速率(即零级药物释放动力学,r2为0.7-1)释放api。
[0211]
从插入剂基本恒定的释放api的持续时间可以在约1至约48个月、约2至约36个月、约2至约24个月、约2至约12个月或约3至约9个月的时间内。在一些实施例中,该持续时间为至少约12周、至少约18周、至少约22周、至少约24周、至少30周、至少32周、至少36周、至少40周、至少44周、至少48周或至少52周。3.治疗方法a.给药眼部药物递送插入剂
[0212]
眼部药物递送插入剂是一种可植入装置。“眼部药物递送插入剂”包括本文所述的所有插入剂。
[0213]
眼部药物递送插入剂可在有需要的受试者的眼部中给药,以预防或治疗眼部疾病或病。在一些实施例中,给药眼部药物递送插入剂以治疗前眼部疾病。在其他实施例中,其可给药以治疗后眼部疾病。在一些实施例中,给药眼部药物递送插入剂以预防前眼部疾病。在其他实施例中,其可给药以预防后眼部疾病。
[0214]“前眼部疾病”是指影响或涉及前眼部(即眼睛前部,也称为眼前段)区域或结构(如眼周肌或眼睑,或位于晶状体囊后壁前方的液体或睫状肌)的病、小病或疾病。因此,前眼部疾病可影响或涉及结膜、角膜、前房、虹膜、后房(位于虹膜和晶状体之间)、晶状体或晶状体囊以及血管化或神经化前眼部区域或部位的血管和神经。
[0215]
前眼部疾病可包括病、小病或疾病,例如但不限于青光眼。
[0216]“后眼部疾病”是一种主要影响或涉及后眼部(即眼球后部,也称为眼后段)区域或结构的病、小病或疾病,如脉络膜或巩膜(位于通过晶状体囊后壁平面的后部)、玻璃体、玻璃体室、视网膜、视神经或视盘,以及血管化或神经化后眼部区域或部位的血管和神经。
[0217]
后眼部疾病可包括以下病、小病或疾病,例如,包括但不限于:急性黄斑神经视网膜病变;白塞氏病;地图样萎缩;脉络膜新生血管;糖尿病性葡萄膜炎;组织胞浆菌病;感染,如真菌、细菌或病毒引起的感染;黄斑变性,如新生血管性黄斑变性、急性黄斑变性、非渗出年龄相关性黄斑变性和渗出年龄相关性黄斑变性;水肿,如黄斑水肿、黄斑囊样水肿和糖尿病性黄斑水肿;多灶性脉络膜炎;累及后眼部位或位置的眼外伤;眼部肿瘤;视网膜疾病,如视网膜静脉阻塞、视网膜中央静脉阻塞、糖尿病性视网膜病变(包括增殖性糖尿病性视网膜病变)、增殖性玻璃体视网膜病变(pvr)、高血压性视网膜病变、视网膜动脉闭塞性疾病,如视网膜中央动脉阻塞(crao)和视网膜分支动脉阻塞(brao)、视网膜脱离、葡萄膜炎性视网膜疾病;交感性眼炎;色素膜-脑膜炎(vogt-koyanagi-harada)(vkh)综合征;葡萄膜扩散;由眼部激光治疗引起或受其影响的后眼部疾病;或由光动力疗法、光凝、放射性视网膜疗法、视网膜前膜疾病、视网膜分支静脉阻塞、前部缺血性视神经病变、非视网膜病变糖尿病视网膜功能障碍和视网膜色素变性引起或受其影响的后眼部疾病。青光眼也可被认为是一种后眼部疾病,因为治疗目标是防止由于视网膜细胞或视神经细胞损伤或丧失(例如,通过神经保护)导致的视力丧失或减少视力丧失的发生。
[0218]
因此,本发明提供了通过在需要的受试者的眼睛中给药眼部药物递送插入剂,来预防或治疗各种眼部疾病的方法。
[0219]
根据对特定眼部疾病的api适用性,选择对特定眼部疾病或病给药的插入剂中的api。因此,例如,给药用于降低眼内压的插入剂将包含有效降低眼内压力的api。
[0220]
在一些实施例中,在有需要的受试者中给药插入剂用于预防或治疗黄斑变性,例如年龄相关性黄斑变性(“amd”),如干性amd和湿性amd。可以给药插入剂以防止视网膜色素上皮细胞的死亡。可以给药插入剂以抑制血管生成。在一些实施例中,在受试者中给药插入剂以防止或治疗视力丧失,例如与黄斑变性相关的视力丧失。此外,可以给药插入剂以防止或延迟干性amd向湿性amd的进展。在一些实施例中,在需要的受试者中给药插入剂以预防或治疗视网膜静脉阻塞,例如,视网膜中央静脉阻塞(“crvo”)或视网膜分支静脉阻塞(“brvo”)。在其他实施例中,可给药插入剂以预防或治疗非缺血型视网膜静脉阻塞或缺血型视网膜静脉闭塞。在其他实施例中,在有需要的受试者的眼睛中给药插入剂以治疗糖尿病视网膜病变。在这些方法的一些实施例中,插入剂包括vegf抑制剂、激酶抑制剂(如tki抑
制剂)、ve-ptp抑制剂、ang-1抑制剂、ang-2抑制剂和/或tie-2激活剂。在一些实施例中,插入剂包括伏罗尼布或其药学上可接受的盐。在其他实施例中,插入剂包括阿西替尼或其药学上可接受的盐。在另一些实施例中,所述插入剂包括雷罗他非或其药学上可接受的盐或两性离子。
[0221]
在一些方面,在有需要的受试者眼睛中给药插入剂以抑制vegfr和/或pdgfr。在一些实施例中,给药用于抑制vegfr和/或pdgfr的插入剂包括伏罗尼布或其药学上可接受的盐。在其他实施例中,插入剂包括阿西替尼。
[0222]
在其他实施例中,给药插入剂以激活tie-2。在该方法的一些实施例中,插入剂包括tie-2激活剂。在另一个实施例中,tie-2激活剂是雷罗他非或其药学上可接受的盐或两性离子。
[0223]
本发明还提供了一种在有需要的受试者中治疗青光眼的方法,包括给药药物递送插入剂。在一些实施例中,在有需要其的受试者的眼睛中给药插入剂以治疗升高的眼压(iop)。在其他实施例中,在有需要其的受试者的眼睛中给药插入剂以降低眼压。在另一实施例中,受试者具有升高的眼压。在另一个实施例中,受试者患有高眼压。在另一实施例中,受试者患有青光眼。可通过确定植入插入剂后60天受试者的iop(单位为毫米汞柱(mmhg))相对于治疗前基线受试者iop的差异来评估iop的降低。在这些方法的一些实施例中,插入剂包括tie-2激活剂。在另一个实施例中,tie-2激活剂是雷罗他非或其药学上可接受的盐或两性离子。在这些方法的其他实施例中,插入剂包括α2-肾上腺素能受体。在另一个实施例中,α2-肾上腺素能受体是溴莫尼定或其药学上可接受的盐。
[0224]
在其他实施例中,给药插入剂以治疗葡萄膜炎。在另一个实施例中,给药插入剂以治疗影响眼后段的慢性非传染性葡萄膜炎。在一些实施例中,给药插入剂以治疗眼睛的术后炎症。在这些方法的一些实施例中,插入剂包括甾体抗炎剂。
[0225]
在一些实施例中,本发明提供了一种治疗方法,包括给药包含vegf抑制剂的本发明眼部药物递送插入剂。在这些方法的一些实施例中,vegf抑制剂是伏罗尼布或其药学上可接受的盐。本发明还包括组合治疗,例如用vegf抑制剂和tie-2激活剂治疗受试者或用vegf抑制物和甾体抗炎剂治疗受试者。
[0226]
因此,在给药vegf抑制剂的方法的一些实施例中,该方法还包括给药tie-2激活剂,例如雷罗他非或其药学上可接受的盐或两性离子。在该方法的一些实施例中,在本发明的眼部药物递送插入剂中给药tie-2激活剂。
[0227]
在给药vegf抑制剂的方法的其他实施例中,该方法还包括给药甾体抗炎剂,如醋酸氟轻松。在该方法的一些实施例中,在本发明的眼部药物递送插入剂中给药甾体抗炎剂。
[0228]
在其他实施例中,本发明提供了治疗的方法,包括给药包含tie-2激活剂的本发明眼部药物递送插入剂。在该方法的其他实施例中,该方法还包括给药vegf抑制剂。在该方法的一些实施例中,tie-2激活剂是雷罗他非或其药学上可接受的盐或两性离子。在该方法的其他实施例中,vegf抑制剂是伏罗尼布或其药学上可接受的盐。在进一步的实施例中,vegf抑制剂是阿柏西普(aflibercept)、贝伐珠单抗或雷罗他非。
[0229]
在本发明的组合治疗中,即在向被治疗的受试者给药超过一种api的方法中,所给药的不同api可以在同一眼部药物递送插入剂中、在单独的插入剂中给药,或者一种api可以在本发明眼部药物递送插入剂中递送,而其他api可以在另一种药物制剂中给药,该制剂
可以是不同类型的剂型。例如,该剂型可以是不同种类的眼部植入物、滴眼液、注射用溶液或注射用悬浮液。此外,所给药的不同api可以在同一注射中同时给药,或在同一程序期间单独注射给药,或在不同时间给药。当在不同时间给药不同的api时,可以设想,当给药含有其他api的剂型或插入剂时,用于递送第一api的剂形或插入剂仍在释放/递送第一api。
[0230]
本发明的各种实施例通常用于局部(例如,向受试者的眼睛)递送治疗有效浓度的api。在一些实施例中,用于治疗眼部疾病的方法包括将插入剂放置在眼睛表面上或眼睛内,例如放置在眼睛的玻璃体或房水上。在一些实施例中,本发明的插入剂可以被递送到眼睛内或眼睛上的任何部位,例如,前部或后部。
[0231]
给药插入剂可包括将插入剂插入受试者的眼睛,例如将插入剂插入房水,或优选地插入眼睛的玻璃体。给药插入剂可包括将插入剂外科植入眼睛内或眼睛上,例如巩膜植入物、结膜下植入物、脉络膜上植入物、巩膜上植入物或玻璃体内植入物。插入剂可以通过外科手术植入受试者的眼睛,例如,植入眼睛的玻璃体、视网膜下或巩膜上。在一些实施例中,插入剂可以通过针或套管注射来放置。插入剂可以逐渐将api释放到眼睛中,从而避免频繁给药的痛苦。
[0232]
在一些实施例中,将插入剂注射到受试者的眼睛中,优选不需要切口。在一些方面,将插入剂注射到眼睛的玻璃体中。在优选实施例中,给药插入剂包括玻璃体内注射。
[0233]
在一些实施例中,使用具有20-27g的规格尺寸的针或套管用于注射。在其他实施例中,使用具有25至27g的规格尺寸的针或套管。在优选实施例中,使用小于25g的针用于注射,例如,具有25.5、26、26.5或27g的规格的针。
[0234]
在本发明给药方法的一些实施例中,在注射插入剂之前,可在注射部位给药局部和/或结膜下麻醉。此外,可将广谱杀菌剂给药到下穹窿。插入剂可以放置在视盘下方和眼睛赤道后方。结膜可能移位,使得在拔出针之后,结膜和巩膜针进入部位将不对齐。用于注射插入剂的针可穿过结膜和巩膜插入,直至给药器的前挡块,并压下柱塞以将插入剂递送到眼睛后部。b.受试者
[0235]
受试者可选自啮齿类动物、兔形目动物、绵羊、猪、犬、猫、马、牛和灵长类动物。在优选实施例中,受试者是人。在本文提供的治疗方法的一些实施例中,受试者需要所述治疗,因为受试者具有正在治疗的疾病。在本文提供的预防方法的一些实施例中,受试者需要预防所述疾病,因为受试者处于该疾病的风险中。c.剂量
[0236]
在一些实施例中,递送的api总剂量为约0.0001μg/天至约200μg/天、约0.0001μg/天至约150μg/天、约0.0001μg/天至约100μg/天、约0.0001μg/天至约80μg/天、约0.0001μg/天至约50μg/天、约0.0001μg/天至约30μg/天、约0.0001μg/天至约10μg/天、约0.0001μg/天至约5μg/天、约0.0001μg/天至约1μg/天、约0.001μg/天至约200μg/天、约0.001μg/天至约150μg/天、约0.001μg/天至约100μg/天、约0.001μg/天至约80μg/天、约0.001μg/天至约60μg/天、约0.001μg/天至约40μg/天、约0.001μg/天至约30μg/天、约1μg/天至约25μg/天、约0.001μg/天至约20μg/天、约0.001μg/天至约15μg/天、约0.001μg/天至约10μg/天、约0.001μg/天至约8μg/天、约0.0005μg/天至约15μg/天、或约0.005μg/天至约10μg/天。在一些实施例中,这是达到稳态后递送的剂量。
[0237]
在一些实施例中,api为伏罗尼布,且递送的伏罗尼布的总剂量为约0.1μg/天至约100μg/天、约0.5μg/天至约80μg/天、约1μg/天至约50μg/天、约1μg/天至约40μg/天、约1μg/天至约30μg/天、约1μg/天至约25μg/天、约1μg/天至约20μg/天、约1μg/天至约15μg/天、约1μg/天至约10μg/天、约1μg/天至约8μg/天、约4μg/天至约15μg/天或约5μg/天至约10μg/天。在一些实施例中,这是达到稳态后递送的剂量。
[0238]
在一些实施例中,api为阿西替尼,递送的阿西替尼总剂量为约0.0001μg/天至约100μg/天、约0.0001μg/天至约80μg/天、约0.0001μg/天至约50μg/天、约0.0001μg/天至约40μg/天、约0.0001μg/天至约30μg/天、约0.001μg/天至约25μg/天、约0.0001μg/天至约20μg/天、约0.0001μg/天至约15μg/天、约0.001μg/天至约10μg/天、约0.001μg/天至约8μg/天、约0.001μg/天至约15μg/天或约0.005μg/天至约10μg/天。在一些实施例中,这是达到稳态后递送的剂量。
[0239]
该剂量(例如1-6个插入剂)可通过一次给药(即在一只眼睛中的一次治疗)来实现。因此,一种治疗可能需要在受试者的每只眼睛一次给药1个插入剂、2个插入剂、3个插入剂、4个插入剂、5个插入剂或6个插入剂。在一些实施例中,受试者可以接受仅一只眼睛或双眼的治疗。如果为一次治疗要注射超过一个插入剂中,则可以在单独注射中单独注射插入剂,或者可以在一次注射中注射几个插入剂。例如,可以在一次注射中注射1、2或3个插入剂。如果一次治疗需要注射多个插入剂,可将其分为几次注射。例如,如果为一次治疗要注射4-6个插入剂,则可将其分为2次或3次注射,每次注射2-3个插入剂。
[0240]
每个插入剂可能包含约1μg至约3000μg、约10μg至约2000μg、约10μg至约1000μg、约100μg至约500μg、约10μg至约800μg、约50μg至约600μg、约200μg至约2000μg、约600μg至约2000μg、约800μg至约2000μg、约800μg至约1500μg、约100μg至约500μg、约100μg至约300μg或约300μg至约550μg的伏罗尼布。例如,每个插入剂可能包含约400μg、约420μg、约440μg、约480μg、约500μg、约520μg、约540μg、约560μg、约580μg、约600μg、约620μg、约640μg、约660μg、约680μg、约700μg、约720μg、约740μg、约780μg、约800μg、约820μg、约840μg、约860μg、约880μg、约900μg、约920μg、约940μg、约960μg、约980μg、约1000μg、约1020μg、约1040μg、约1045μg、约1060μg、约1080μg或约2000μg的api,例如伏罗尼布。
[0241]
所有插入剂中api(例如,伏罗尼布)的总量(总有效负载)为约200μg至约6000μg、约600μg至约6000μg、约800μg至约6000μg、约600μg至约5040μg、约600μg至约4500μg、约1000μg至约5400μg、约1000μg至约3000μg或约2000μg至约4000μg。例如,所有插入剂的api总量为约1400μg、约为1420μg、约1500μg、约1600μg、约1800μg、约1900μg、约1980μg、约2000μg、约2040μg、约2080μg、约3000μg、约3120μg、约3180μg、约3240μg、约3400μg、约3600μg、约3800μg、约4000μg、约4140μg、约4160μg、约4180μg、约4200μg、约4400μg、约4600μg、约5000μg或约5040μg。4.定义
[0242]
在说明书和权利要求书中使用的下列词语和短语通常具有如下所述的含义,除非其使用的上下文另有说明。
[0243]
除非上下文另有明确规定,否则单数形式“一(a)”、“一(an)”和“所述(the)”包括复数引用。例如,“基质聚合物”指一种或多种基质聚合物。
[0244]
本文使用的术语“生物侵蚀(bioerode)”、“生物侵蚀(bioerosion)”、“生物降解
(biodegrade)”和“生物降解(biodegradation)”是指插入剂在生物系统中一段时间内的逐渐崩解、溶解或分解,例如通过一个或多个物理或化学降解过程,例如酶作用、水解、离子交换或溶解(通过增溶作用、乳液形成或胶束形成)。
[0245]
术语“预防”,当与疾病相关时,是指给药以减少受试者相对于未接受药物的受试者的医学疾病症状的频率或延迟其出现。因此,黄斑变性的预防包括,例如,与未接受治疗的对照人群相比,在接受治疗的人群中减少黄斑变性的诊断数量,和/或与未接受治疗的对照人群相比,在接受治疗的人群中延迟黄斑变性的症状出现。干性黄斑变性的预防包括,例如,与未接受治疗的对照人群相比,在接受预防性治疗的受试者人群中减少可检测到的玻璃膜疣的数量,和/或与未接受治疗的对照人群相比,在接受治疗的人群中延迟可检测到的玻璃膜疣的出现,例如,通过具有统计学和/或临床意义的量。视力丧失的预防包括,例如,与未接受治疗的对照人群相比,在接受治疗的人群中降低或延迟受试者经历视力丧失的程度。
[0246]
术语“治疗”是指减少、改善或稳定现有的不良病症。
[0247]
术语“室温”指22℃。“室温下的固体”是指在温度为22℃下的固体。
[0248]
当术语“约”与数值或范围结合使用时,它通过在规定数值的上下延伸边界来修改该数值或范围。一般而言,术语“约”在本文中用于通过数值的10%的方差,向上或向下(更高或更低),即
±
10%,修改高于或低于规定值的数值,除非指示不同的方差(variance)(例如
±
30%、
±
20%、
±
5%、
±
1%、
±
0.5%等)。
[0249]
术语“和/或”是指并包括单独列出的每个项目,以及一个或多个列出项目的任何和所有可能的组合。
[0250]
根据专利法,术语“包括(comprising)”、“由
……
组成(consisting of)”和“基本上由
……
组成(consisting essentially of)”具有其通常接受的含义。当在说明书或权利要求中使用术语“包含(includes)”或“包含(including)”时,其意图以类似于术语“包括(comprising)”的方式包含,因为该术语在权利要求中用作过渡词时被解释为包含。
[0251]
术语“可选的”和“可选地”意味着随后描述的情况可能发生或可能不发生,因此描述包括情况发生的实例和不发生的实例。
[0252]
如果本公开或权利要求的特征或方面是按照markush组来描述的,则所描述的组包括markush组的任何单个成员以及成员的子组。
[0253]
如本领域技术人员所理解的,所有语言(如“多达”、“至少”、“大于”、“小于”)包括所述数字,并指可随后细分为子范围的范围。最后,如本领域技术人员将理解的,范围包括每个单独的成员,并且包括范围的端点。例如,具有1-3个成员的组是指具有1、2或3个成员。类似地,具有1-5个成员的组是指具有1、2、3、4或5个成员的组,等等。
[0254]
本文中使用的术语“基本上全部”是指总量的大部分,例如,总量的至少80%、至少85%、至少90%、至少95%或至少99%。
[0255]
术语“%w/w”是指混合物中特定物质的比例,以重量或质量衡量。因此,例如,对于芯包含至少约8%w/w非活性成分的插入剂,芯中非活性成分的总重量为芯总重量的至少约8%。例如,如果芯总重量为100mg,则该芯中的非活性成分的重量为至少8mg。
[0256]
术语“%w/v”是指溶液总体积中成分(如溶质)的重量百分比。2%w/v pva溶液意味着在100ml溶液中有2克pva。2%w/w pva溶液意味着100mg溶液有2克pva。
[0257]
所有引用的专利、已公开的申请、科学出版物和书籍全部通过引用并入本文。
[0258]
虽然本文公开了各种方面和实施例,但其他方面和实施例对于本领域技术人员来说是显而易见的。示例示例1
[0259]
将下表中列出的pva等级制成膜,然后对其侵蚀速率和强度进行评估。
[0260]
为了形成膜,将4.5%的pva水溶液倒入托盘中,并在室温下进行风干。在膜干燥时,将膜分割成1x1正方形样品。然后将每种膜的六个样品在100℃下固化3小时,在140℃下固化30分钟或在140℃固化4小时,如下表所述。在样品膜正方形固化后,对其称重并进行成像。然后将每个样品在室温下浸入pbs中24小时。然后从pbs中将样品取出,并将每种等级的pva中的4个在50℃下干燥2小时,并将每种等级的pva的2个在室温下在纸巾上进行风干,如下表所述。然后再次对样品称重并进行成像。
[0261]
计算出在pbs中浸泡24小时后的重均重量变化,并图2的图表中示出。pva水解度(dh)和分子量(mw)决定了膜的溶解度。在所有测试的固化条件下,6000/80%、25000/88%、125000/88%和6000/80%-125000/88%的混合pva膜均在第1天结束时溶解。78000/98%的膜持续时间最长。测试薄膜的相对薄膜强度如图3所示。示例2a
[0262]
根据下表中的参数制作插入剂:
[0263]
通过将伏罗尼布与78000/98%pva的水溶液以上表中规定的w/w伏罗尼布∶pva溶液比例混合来制造插入剂。然后将混合物从20、21或23g的分配尖端挤出并在室温下干燥。
[0264]
至于包衣的插入剂,然后将挤出物浸渍在78000/98%pva溶液中并风干。重复浸涂工艺,以达到上表中规定的包衣数量。包衣工艺包括将挤出物浸渍在pva溶液中,在第一层之间有5分钟的室温干燥,然后在浸渍形成最后一层/包衣之前有至少10分钟的干燥时间。然后按表中对包衣的挤出物进行固化。冷却至环境温度后,将挤出物切割成2mm、3.5mm、5mm或6mm或8mm长的插入剂。示例2b
[0265]
在体外对插入剂的药物释放率进行测试。将每个插入剂样品置于10ml玻璃管中,
并向该管中加入5ml pbs。将试管在37℃的水浴中孵育。以12至24小时的间隔采集释放培养基的样品,并用新鲜pbs代替释放培养基。根据示例2b中所述的方法,通过hplc定量测量释放的伏罗尼布的量。测试体外释放速率,并根据累积释放时间确定平均释放速率。示例2c
[0266]
对插入剂样品进行api含量分析。将测试内容物的插入剂切割成4块,并将所有4块放置在标记的闪烁小瓶中。用移液管将3.0ml甲醇移到小瓶中,并将小瓶置于柜下。对所有样品重复该步骤。将样品小瓶置于超声仪中,加入适量的水,并将样品超声处理30分钟。再重复5次超声处理,每次超声处理之间冷却超声仪。根据需要进行额外的超声处理,以确保api完全溶解。使用以下参数进行hplc:柱:zorbax eclipse xdb-c18;4.6x150mm;5微米;流动相a:水 0.1%磷酸;流动相b:乙腈 0.1%磷酸;梯度法;停止时间30分钟;uv:214 nm。示例2d
[0267]
对样品插入剂的侵蚀进行评估。将样品插入剂放置在含有5ml磷酸盐缓冲盐溶液(pbs)的10ml玻璃小瓶中,并在37℃下孵育该小瓶,不搅拌。在感兴趣时间段的每一天,每24小时更换一次小瓶中的pbs。在所述时间段结束时,将样品从小瓶中取出,称重并拍照。
[0268]
在140℃下固化4小时的4.5%pva包衣制剂(称为制剂a)的药物释放速率曲线如图4a(累积药物释放百分比)和图4b(累积药物释放(μg))所示。无包衣制剂a植入剂的药物释放速率曲线如图6所示。图5所示为在溶解介质中浸泡314天和447天后拍摄的侵蚀的制剂a植入剂的照片。447天的照片中包括完整的植入剂,用于比较。图7所示为在溶解介质中浸泡287天和352天后拍摄的侵蚀的未包衣制剂a植入剂的照片。352天的照片中包括完整的植入剂,用于比较。
[0269]
在140℃下固化30分钟的4.5%pva包衣制剂(称为制剂b)的药物释放速率曲线如图8(累积药物释放百分比)和图8b(累积药物释放(μg))所示。图9所示为在溶解介质中浸泡59、88和155天后拍摄的侵蚀的制剂b植入剂的照片。
[0270]
未固化包衣的4.5%pva制剂(称为制剂c)的药物释放速率曲线如图10所示。图11所示分别为在37℃下在溶解介质中浸泡98天,然后在室温下浸泡113天的侵蚀的制剂c植入剂的不同样品的两张照片。
[0271]
制剂a、b和c的药物释放曲线的比较如图12所示。
[0272]
制剂a比制剂b和c释放药物更慢,侵蚀更慢。制剂c比制剂a和b释放药物更快,侵蚀更快。示例3
[0273]
根据下表中的参数制备包含超过一种pva等级的插入剂:
[0274]
通过将伏罗尼布与pva水溶液以伏罗尼布∶pva溶液w/w比例为1:1混合以形成糊剂来制造插入剂。然后将混合物从21g分配尖端挤出,形成约4-5英寸长的棒,并在室温下干燥。按上表所述固化挤出物棒。
[0275]
将挤出物浸涂在pva水溶液中,并在室温下干燥。对于具有超过一层包衣的插入剂,包衣工艺涉及将挤出物浸渍在pva溶液中,在第一层之间有5分钟的室温干燥,然后在浸渍形成最后一层/包衣之前有至少10分钟的干燥时间。
[0276]
最后一层包衣后,根据上表所述条件固化包衣棒。冷却至环境温度后,使用剃刀刀片将包衣的棒分割成8mm长的插入剂。
[0277]
根据示例2b中所述的方法测量api释放。
[0278]
根据示例2c中所述的方法测量api含量。
[0279]
根据示例2d中所述的方法评估植入剂的侵蚀。
[0280]
根据下表中的参数制备包含超过一种pva等级的插入剂:
[0281]
通过将伏罗尼布与pva水溶液以伏罗尼布∶pva溶液w/w比例为1:1混合以形成糊剂来制造插入剂。然后将混合物从21g分配尖端挤出,形成约4-5英寸长的棒,并在室温下干燥。挤出棒按照上表所述进行固化。
[0282]
将挤出物浸涂在pva水溶液中,并在室温下干燥。对于具有超过一层包衣的插入剂,包衣工艺包括将挤出物浸渍在pva溶液中,在第一层之间有5分钟的室温干燥,然后在浸渍形成最后一层/包衣之前有至少10分钟的干燥时间。
[0283]
最后一层包衣后,根据上表所述条件固化包衣棒。冷却至环境温度后,使用剃刀刀片将包衣的棒分割成8mm长的插入剂。
[0284]
根据示例2b中所述的方法测量api释放。
[0285]
根据示例2c中所述的方法测量api含量。
[0286]
根据示例2d中所述的方法评估植入剂的侵蚀。示例4
[0287]
根据下表中的参数制作插入剂:根据下表中的参数制作插入剂:根据下表中的参数制作插入剂:
[0288]
将api与pva水溶液按表中规定的api:pva溶液比例混合,形成糊剂。将糊剂通过具有20-23g规格的分配尖端挤出以形成约4-5英寸长的棒,并在室温下干燥。挤出棒在包衣之前或之后进行固化,如上表所述。
[0289]
将挤出物浸涂在pva水溶液中。包衣工艺包括将挤出物浸渍在pva溶液中,在第一层之间有5分钟的室温干燥,然后在浸渍形成最后一层/包衣之前有至少10分钟的干燥时间。在最后一层包衣后,包衣棒根据上表进行固化或在室温下干燥24小时。
[0290]
使用剃刀刀片将包衣棒切割成2mm、3.5mm、5mm或6mm长的插入剂。
[0291]
根据示例2b中所述的方法测量api释放。
[0292]
根据示例2c中所述的方法测量api含量。
[0293]
根据示例2d中所述的方法评估植入剂的侵蚀。示例5-药代动力学研究
[0294]
在雄性荷兰带兔(belted rabbit)中进行玻璃体内药代动力学研究。本研究的目的是在第1天进行双侧玻璃体内注射后,表征伏罗尼布插入剂的血浆和眼部组织药代动力学。在放置玻璃体内插入剂后至多24个月对动物进行评估。
[0295]
下表描述了分组剂量水平和治疗。
[0296]
麻醉给药后,使用注射器将直径为0.37mm、长度为3.5mm、设计用于在至少6个月释放药物的伏罗尼布插入剂玻璃体内注射到52只雄性荷兰带兔的每只眼睛中。低剂量组(1)每只眼接受3个插入剂,总剂量为每只眼630μg。高剂量组(2)动物中每只眼睛接受6个插入剂,规定2次单独注射(每次注射3个插入剂),总剂量为每只眼睛1260μg。
[0297]
在每个预定的处死点之前,通过耳缘静脉穿刺,从每组目标2只动物中采集一份全血样本。对样品伏罗尼布及其代谢物水平进行测试。在第1天的第6、12、24和48小时、在第7天和14天以及第1、2、4、6、8、16和24个月时,每组两只动物被安乐死。从双眼采集玻璃体和眼部组织以分析眼部组织药物分布,采集插入剂,采集肝和肾样本以对组织分布进行评估。
[0298]
结果:在稳态下,630μg低剂量的伏罗尼布的玻璃体水平为56ng/ml,1260μg高剂量的玻璃体水平为97ng/ml(~剂量比例)。视网膜/脉络膜水平分别为49ng/g和89ng/g。在前90天有一个药物释放的爆发期,随后是稳态。第105天达到稳态。玻璃体和视网膜/脉络膜中观察到的最大浓度似乎接近剂量比例。99天后,血浆水平未发现明显变化。至第180天,630μg剂量的玻璃体c
max
为232ng/ml,t
max
为336h,auc
last
为315.5μg
·
h/ml。至第180天,1260μg剂量的玻璃体c
max
为1697ng/ml,t
max
为720h,auc
last
为1583.2μg
·
h/ml。
[0299]
图13a描述了在不同时间点取出插入剂,插入剂中剩余药物的平均量与的时间的关系,并进行了分析以确定插入剂中剩余的伏罗尼布的量。图13b描述了取出插入剂释放药物的累积百分比与时间的关系。.示例6-毒理学和药代动力学研究
[0300]
还在80只荷兰带兔(40只雄性和40只雌性)中对插入剂进行18个月的玻璃体内毒性研究。在放置玻璃体内插入剂后,对动物进行6个月和18个月的评估。目的是表征双侧玻璃体内注射后的眼部毒性、血浆药代动力学和伏罗尼布插入剂的生物降解。
[0301]
下表描述了分组和剂量水平。对于毒理学组,在6个月和18个月时处死动物。对于血浆药代动力学分析,在第1、3和7天以及第1、2、3、4、5、6、12、14、16和18个月时采集血样。
[0302]
麻醉给药后,使用注射器将直径为0.37mm、长度为3.5mm、设计用于在至少6个月释放药物的伏罗尼布插入剂玻璃体内注射到每只荷兰带兔的每只眼睛中。安慰剂组(1)的动物在每只眼睛中通过注射接受两个安慰剂。低剂量组(2)的动物在每只眼睛接受2个插入剂。中剂量组(3)的动物在每只眼睛中接受3个插入剂,分两次单独注射。高剂量组(4)的动物在每只眼睛中接受4个插入剂,分两次单独注射(2个插入剂/注射)。最高剂量组(5)的动物在每只眼睛中接受6个插入剂,分两次单独注射(3个插入剂/注射)。
[0303]
在每个预定时间点,通过耳缘静脉穿刺采集全血。对样本的临床病理学和血浆药代动力学进行分析。根据上述时间表对动物实施安乐死。对研究期间被处死或发现死亡的所有动物进行全面的总尸检。称重器官并收集组织。收集眼部组织仅进行组织病理学检查。
[0304]
结论:血浆药代动力学和毒理学研究分别提供了18个月和24个月暴露期间玻璃体c
max
和auc的安全性证据。此外,在测试的时间点,玻璃体和视网膜/脉络膜中的伏罗尼布水平仍显著高于vegfr的ic
50
。
[0305]
伏罗尼布没有任何不良发现,最多6个插入剂也没有不良发现。插入剂的未观察到有害作用剂量(noael)确定为6个插入剂/眼睛(1260μg/眼睛)。
[0306]
观察到的最高事件是晶状体的黄色变色,这似乎与剂量和api颜色有关。没有与晶状体变色相关的组织病理学/显微镜发现。观察到的第二高事件是局灶性、点状或线性晶状体浑浊,似乎主要与注射次数有关,并且在较小程度上与插入剂数量有关。
[0307]
最初在所有组中观察到轻度炎症(《2 房水或玻璃体细胞)。3个月后,所有炎性细胞逐渐消退并清除。观察到的最高炎症事件见于安慰剂组(2个插入剂,不含药物)。
[0308]
眼压(iop)与基线相比没有变化,但观察到一些短暂的变化。
[0309]
伏罗尼布的血浆水平处于低pg/ml范围内。示例7-安全性和有效性
[0310]
在激光诱导脉络膜新生血管(cnv)的猪(小型猪)模型中评估伏罗尼布插入剂的安
全性和有效性。本研究的主要目的是评估在猪中使用伏罗尼布插入剂的激光诱导脉络膜新生血管(cnv)模型中血管通透性和新生血管的长期安全性和抑制作用。
[0311]
下表描述了实验设计:下表描述了实验设计:
[0312]
在激光治疗(组1-4)当天,用通过间接检眼镜输送的810nm二极管激光对动物进行治疗。在视网膜静脉之间放置约6个单个激光点。根据上表中的时间表,双眼都接受了激光治疗。
[0313]
在玻璃体内注射当天,麻醉动物并对眼睛进行无菌准备。用结膜钳(colibriforcep)轻轻抓取结膜,并在上方角膜缘后2-3mm处(经睫状体平坦部)进行注射(25g注射针),针直接稍微向后,以避免与晶状体接触。允许动物从手术中正常恢复。4-6小时后,给猪局部滴入抗生素眼液,然后bid再滴用2天,两次给药之间间隔至少6小时。根据上表中的时间表,在激光cnv诱导后即刻的第0天或激光cnv诱发前7天对动物给药。组5-6的动物未进行激光cnv手术,并在第0天植入。
[0314]
在驯化期间和研究期间,评估动物的死亡率和发病率以及一般健康状况,特别注意眼睛。在治疗前和尸检前测量体重,组5和组6的动物每月进行称重。
[0315]
兽医眼科医生在实验设计表所示的时间点,使用裂隙灯生物显微镜和间接检眼镜进行完整的眼部检查(oe)(改良的hackett和mcdonald),以评估眼部表面形态、眼前段和后段炎症、白内障形成和视网膜变化。使用局部1%盐酸托吡卡胺(tropicamide hcl)进行散瞳(mydriasis)的眼部检查。
[0316]
在实验设计表所示的时间点对麻醉动物的双眼进行荧光血管造影(flourescein angiography)。
[0317]
在基线和给药后3个月对动物的双眼进行全视野视网膜电图(full-fieldelectroretinography,erg)(仅第5-6组)。在erg测量当天,暗适应后麻醉动物。使用mini-ganzfeld光刺激器以最大强度输送0.33 hz的短暂闪光诱发erg。对每只动物的20个反应进行放大、过滤并平均。根据iscev标准规定对动物进行标准erg测量,包括暗视(0.01坎德拉)、暗视(3坎德拉)和明视(25坎德拉)测量。
[0318]
在实验设计表所示的时间点,在最终数据收集后,对动物实施安乐死。对组5-6的眼睛进行组织学评估。
[0319]
结果:总的来说,发现了剂量相关的疗效,并且临床没有观察到毒性。所有组(1-4)的荧光素血管造影分析显示,从第7天到第28天,校正的总病变荧光(corrected total lesion fluorescence,ctlf)值降低,阿柏西普治疗的动物ctlf值降幅最大,其次是高剂量,其余组的ctlf数值降幅相似。在接受erg的两组患者中,从基线到第84天,erg b-波振幅降低;然而,这可能归因于erg获取困难。
[0320]
接受组织学检查的眼睛显示出一些炎症,在给药高剂量植入物的动物中,炎症可能更严重。植入手术可能导致高剂量组中观察到的炎症增加。
[0321]
阿柏西普和安慰剂植入物的表现与预期一样,在该模型中,阿柏西普具有正常疗效量,安慰剂植入物耐受性良好。
[0322]
结论:
[0323]
在pk研究中,伏罗尼布的血浆水平处于低pg/ml范围内。发现剂量相关的疗效,并且无临床观察到的毒性。因此,本发明的插入剂能够在持续时间内局部释放安全且治疗有效的稳态水平的伏罗尼布,同时仅产生可忽略的全身水平的伏罗尼布。此外,插入剂是完全可生物蚀解的。
再多了解一些
本文用于创业者技术爱好者查询,仅供学习研究,如用于商业用途,请联系技术所有人。