一种化合物及其制备方法、及其在制备氟吡草酮中间体中的应用
1.本发明是申请日为2022年06月08日,申请号为202210637542.4,发明创造名称为“一种化合物及其制备方法、及其在制备氟吡草酮中间体中的应用”的中国申请的分案申请。
技术领域
2.本发明涉及农药技术领域,尤其涉及一种化合物及其制备方法、及其在制备氟吡草酮中间体中的应用。
背景技术:
3.2015年氟吡草酮首次上市,现已在美国、加拿大、阿根廷、乌拉圭、澳大利亚等多个国家登记和上市。氟吡草酮是一种4-羟基苯丙酮酸双加氧酶(hppd)抑制剂,致使植物中的叶绿素被破坏,可以与甲基磺草酮、异噁唑草酮、苯唑草酮、环磺酮、pyrasulfatole等多种除草剂进行复配。该种选择性的除草剂品种对阔叶杂草和多年生一年生杂草均具有良好的活性,可以用于玉米、小麦、大麦、甘蔗等作物田。氟吡草酮结构如下:
[0004][0005]
氟吡草酮目前典型的工艺(cn 1824662b)报道的方法如下:
[0006][0007]
实验表明第二步反应关环困难,第二步甲基的溴代选择性不好,产率仅有44.7%(见cn 1824662 b),第三步醚化反应易于生成内酯杂质,文献并没有给出产率数据。上述反应路线中,nb s为n-溴代丁二酰亚胺,aibn为偶氮二异丁腈,dmf为n,n-二甲基甲酰胺,dcm
为二氯甲烷,tea为三乙胺,dmap为4-二甲氨基吡啶。
[0008]
文献a convenient and effective method for synthesizingβ-amino-α,β-unsaturated esters and ketones,synthetic communications,2004,34(5),909-916及synthesis of functionalized pyridinium salts bearing a free amino group,arkivoc,2014,2014(3),154-169报道了乙酰乙酸乙酯在甲醇中用氨基甲酸铵以定量的收率得到(z)-3-氨基丁-2-烯酸乙酯,它进一步与烯醚缩合得到2-甲基-6-(三氟甲基)烟酸乙酯(见专利wo2006059103a2),与上面的路线相似。该反应路线如下:
[0009][0010]
专利wo2006059103a2报道了2-甲基-6-(三氟甲基)烟酸乙酯的合成方法,该方法是目前多数厂家广为采用的路线,实验表明反应转化不完全,延长反应时间无效果,主要副产物为两种烯胺。反应路线如下:
[0011][0012]
专利wo2006059103a2报道了4-氯-3-氧代丁酸乙酯和4-乙氧基-1,1,1-三氟丁-3-烯-2-酮在醋酸、醋酸铵条件下一锅法制备2-(氯甲基)-6-(三氟甲基)烟酸乙酯,实验证明该方法产物较乱,产率低且纯化困难,无论升温还是延长时间都有烯胺的中间体剩余,只能柱层析分离,无法应用于生产。该反应路线如下:
[0013][0014]
wo2004078729a1先正达报道了4-氯-3-氧代丁酸乙酯与乙二醇单甲醚通过nah的作用下在四氢呋喃(thf)中对接得到醚化的产物,然后氨化、关环制备2-((2-甲氧基乙氧基)甲基)-6-(三氟甲基)烟酸乙酯,根据记载预计线性收率为36%。该反应路线中,tfa指三氟乙酸。该路线的问题很多,例如第一步反应中用到钠氢,过量的钠氢使用使得4-氯-3-氧代丁酸乙酯之间或与产物之间形成两个或多个分子间大分子的产物,分离提纯十分困难;
需要使用无水四氢呋喃,反应条件要求苛刻;第二步通入氨气,虽然可控,但也属于危险反应。该反应路线如下:
[0015][0016]
第三步反应关环产率低,主要原因是反应物烯胺对烯醚的反应,活性官能团较多,副反应多,随着反应的进行,生成的水使烯胺水解回酮,无法进一步转化为产物,造成原料反应不彻底,该副反应如下:
[0017][0018]
专利wo2016102347a1给出了引入边链的合成方法,该方法中的两种起始原料皆不易获得,成本相对较高,用到了氧化镁、n,n-碳酰二咪唑(cdi)及无水四氢呋喃更增加了成本,该方法原子经济性也较差,纯化成本高,没有工业上的应用价值。同样地,专利wo2005026149的方法也无法应用于生产。反应路线如下:和
[0019]
2015年lonza ltd的专利ep2821399a1报道了另一种合成方法,线性收率有了一定的提高,但起始原料较难合成,步骤长,产生的废弃物较多,例如含磷的废水难以处理,用到贵重的催化剂,三氟乙酰乙酰氯不稳定等,成本也较高。该反应路线如下:
[0020][0021]
综上所述,目前尚没有原料易得,安全可靠,适合工业化放大的工艺路线。
技术实现要素:
[0022]
发明目的
[0023]
为克服上述不足,本发明的目的在于提供一种化合物及其制备方法、及其在制备氟吡草酮中间体中的应用,氟吡草酮中间体包括中间体i(式(ia)和/或式(ib)所示化合物)和中间体ii(式iia、iib、iic所示化合物,属于烟酸片段)。
[0024]
本发明将制备烟酸的两个片段在碱的作用下先对接生成中间体i,然后经过铵盐分子内关环,能显著地提高氟吡草酮中间体(ii)的收率,减少副反应,克服了现有技术(例如wo2006059103a2及wo2004078729a1中报道的方法)直接通过铵盐分子闭环容易导致原料反应不彻底的缺陷。本发明的通过碱的作用生成中间体i再闭环反应生成氟吡草酮中间体(ii)的分步法,不仅可以减少副反应的产生,而且可以使收率提高。
[0025]
解决方案
[0026]
为实现本发明目的,本发明采用的技术方案如下:
[0027]
第一方面,本发明提供了一种化合物(命名为中间体i),其结构式为式(ia)或式(ib)所示化合物,或其药学上可接受的盐、其溶剂化物和其互变异构体;
[0028][0029]
其中,x为-o-r
1-o-r2、-h或、-cl或-br;当x为-o-r
1-o-r2时,r1选自c1~c4的亚烷基,r2选自c1~c4的烷基。
[0030]
进一步地,当x为氢时;其结构式为式(ia-1)或式(ib-1)所示的化合物,
[0031][0032]
或者,x为-cl或-br;可选地,当x为cl时,其结构式为式(ia-2)或式(ib-2)所示的化合物,
[0033][0034]
或者,x为-o-r
1-o-r2,r1选自c1~c4的亚烷基,r2选自c1~c2的烷基,可选地,r1选自c1~c3的亚烷基,r2选自c1~c2的烷基;可选地,r1选自c2~c3的亚烷基,r2选自c1~c2的烷基;优选地x为-o(ch2)2och3时,其为结构式如式(ib-3)所示的化合物或其药学上可接受的盐,
[0035][0036]
第二方面,本发明提供一种第一方面所述的化合物的制备方法,该方法包括如下步骤:
[0037]
在碱的存在下,使式iii所示的化合物和/或其烯醇互变异构体与式iv所示的化合物进行取代反应,得式ia和/或ib所示的化合物,
[0038][0039]
其中,x为-o-r
1-o-r2、-h、-cl或-br;当x为-o-r
1-o-r2时,r1选自c1~c4的亚烷基,r2选自c1~c4的烷基;式ia、式ib、式ii和式iii中,x相同。
[0040]
第三方面,本发明提供一种氟吡草酮中间体的制备方法,在铵盐和/或氨的存在下,使第二方面制得的式ia和/或ib所示的化合物进行关环反应,得到式ii所示的化合物;其中,式ia、式ib、式ii和式iii中,x相同;
[0041][0042]
所述第二方面或第三方面的制备方法中,取代反应中,所述碱选自有机碱、无机碱、钠氢或金属钠中的一种或几种,可选地,有机碱包括醇钠和醇钾中的一种或几种;可选
地,有机碱包括甲醇钠、乙醇钠、叔丁醇钾、甲醇钾、乙醇钾、六甲基二硅氮钠、六甲基硅氮锂中的一种或几种;可选地,无机碱包括氢氧化钠、氢氧化钾、碳酸钠、碳酸钾、磷酸钠、磷酸钾和氨基钠中的一种或几种;可选地,所述碱选自乙醇钠、氢氧化钠、碳酸钠中的一种或几种。
[0043]
所述第二方面或第三方面的制备方法中,取代反应在有机溶剂中进行,可选地,有机溶剂包括有机醇、甲苯、四氢呋喃、二甲基亚砜(dmso)、n,n-二甲基甲酰胺(dmf)、1,4-二氧六环中的一种或几种,可选地,有机溶剂包括甲醇、乙醇和甲苯中的一种或几种;可选地,有机溶剂包括甲苯和/或乙醇。
[0044]
所述第二方面或第三方面的制备方法中,取代反应中,式iv所示的化合物、式iii所示的化合物和/或其烯醇互变异构体、碱的摩尔比为1:0.8~1.5:0.05~1.5,可选地为1:0.8~1.2:0.5~1.3,可选地为1:0.9~1.1:1~1.3,可选地为1:1:1~1.3,优选1:1:1~1.2。
[0045]
所述第二方面或第三方面的制备方法中,取代反应中,反应温度为-15℃~30℃,可选地为0~25℃,优选0~10℃。
[0046]
进一步地,碱的加入方式为缓慢加入,碱为溶液时则是滴加。
[0047]
本发明的中间体i(即第一方面所述的化合物)的反应路线可以为:
[0048][0049]
当x为不同的取代基时,中间体i中的互变异构体(ia)、(ib)的比例也会有所不同,分别为烯醇式化合物ia和酮式化合物ib;
[0050]
例如,当x为氢时,生成的反应产物包括式(ia-1)和(ib-1)所示的互变异构体,其摩尔比约为5:2;命名为路线a-1,以乙醇钠为碱的反应路线a-1如下:
[0051][0052]
反应路线a-1中,通过分步法得到中间体i(结构式为(ia-1)和(ib-1)),然后合成中间体iia,可以显著减少副反应的产生,提高了反应的选择性,实现温和条件下的关环反应,产率能由67%提高到77.4%(参见实施例1)。
[0053]
作为一种替代方案,当x为-cl时,生成的反应产物包括式(ia-2)和式(ib-2)所示的互变异构体,摩尔比约为1:5;生成的特异性杂质包括杂质a、杂质b、杂质c、杂质d中的至少一种;其中包括2~15%杂质b和1~5%杂质c;命名为路线b-1,以乙醇钠为碱的反应路线b-1如下:
[0054][0055]
反应路线b-1中,通过分步法得到中间体i(结构式为(ia-2)和(ib-2))的过程中,在碱的作用下,4-氯乙酰乙酸乙酯中有多个敏感基团,反应非常复杂,除了得到主产物i(为一对互变异构体,即结构式为(ia-2)和(ib-2)的化合物)以外还有四个主要的副产物杂质a、b、c和d。中间体i进一步关环得到ⅱ总收率约为58%(参见实施例2),也优于wo2006059103a2报道的方法。
[0056]
可选地,当以式iii所示化合物和碱为底物滴加iv时,取代反应的反应产物的杂质至少包括化合物a、化合物b、化合物c和化合物d;
[0057]
可选地,当以iii和iv为底物时,碱的加入方式为缓慢加入,控制碱的滴加速度时所述取代反应的产物至少包括杂质化合物b、化合物c、化合物d;当碱为碱溶液时,加入方式为滴加,且滴加速度为1~3小时内均匀滴完,优选1.5~2小时内滴完。
[0058]
作为一种替代方案,当x为-o-r
1-o-r2时,r1选自c1~c4的亚烷基,r2选自c1~c2的烷基,可选地,r1选自c1~c3的亚烷基,r2选自c1~c2的烷基;可选地,r1选自c2~c3的亚烷基,r2选自c1~c2的烷基;优选地x为-o(ch2)2och3,生成的反应产物主要为结构式为式(ib-3)所示的化合物;生成的特异性杂质包括杂质c、杂质d、杂质e中的至少一种。命名为路线c-1,以乙醇钠或碳酸钠为碱的反应路线c-1如下:
[0059][0060][0061]
对于中间体i(ia和/或ib)来说,x分别为-h、-cl、-o(ch2)2och3时,随着取代基的增大,烯醇式的中间体i含量依次减少,而酮式则依次增高,顺式依次增高,反式依次减少。
[0062]
一般地,中间体i(ia和/或ib)在较低温度下有利于动力学产物的形成,而当温度较高时,则有利于形成热力学产物。本发明的发明人研究发现,中间体i为顺式结构(酮式ib)有利于后续的中间体ii关环反应,而反式(烯醇式ia)的关环困难,需要更高的温度。比
如路线c-1中若中间体i为反式结构时,由于边链的位阻作用及关环需的双键反转的活化能较高,在较低的温度范围条件下无法实现顺利关环。
[0063][0064]
反应路线c-1中,与反应路线a-1、b-1不同的是,通过分步法得到的中间体i一般只有结构式(ib-3)的酮式顺式产物,但在温度或在部分工艺变化时,可能也会生成少量的烯醇式反式产物ia-3。由于路线c-1中产生的烯醇式反式产物ia-3更少甚至没有,酮式顺式产物(ib-3)更有利于提高反应收率,故路线c-1的方法优于a-1及b-1的方法。
[0065][0066]
上述反应路线a-1、b-1、c-1,通过先制备中间体i(ia-1与ib-1、或ia-2与ib-2、或ib-3)制备中间体ii,对于减少副产物的产生及实现规模化生产,降低生产成本具有重要意义,可以高转化率、高产率地获得中间体ii。其中,路线c线性产率高、副产物少,更适合工业上大规模化的生产。
[0067]
在以上a-1、b-1、c-1三种方案中,方案c-1由于副反应少,比如避免了路线a-1中的甲基卤代选择性差的缺点及路线b-1中4-氯乙酰乙酸乙酯副反应多的缺点,因此路线c-1是优选路线。
[0068]
所述第三方面的制备方法中,所述关环反应的条件包括:温度为0℃~80℃,优选为45℃~60℃。
[0069]
所述第三方面的制备方法中,所述关环反应中,所述铵盐包括氯化铵、碳酸铵、碳酸氢铵、硝酸铵、硫酸铵、磷酸铵、醋酸铵中的一种或几种,优选为醋酸铵;所述氨以氨气和/或氨水的形式存在。
[0070]
所述第三方面的制备方法中,所述关环反应中,式ia和/或式ib所示的化合物与铵盐和/或氨的摩尔比为1:1~5,可选为1:1~2.5,优选为1:1.2~1.5。
[0071]
第四方面,本发明提供一种组合物,包括第一方面所述的化合物或第二或第三方面所述的制备方法制备的产品。
[0072]
作为一种可能的实施例,当x为h时,组合物包括结构式为式(ia-1)和式(ib-1)所示的化合物;室温条件下摩尔比约为5:2(式ia-1和式ib-1所示的化合物为一对互变异构
体,在反应体系中存在化学平衡,其摩尔比与温度有关)。
[0073]
作为一种可能的实施例,当x为cl时,组合物包括结构式为式(ia-2)和式(ib-2)所示的化合物;室温条件下摩尔比约为1:5(式ia-2和式ib-2所示的化合物为一对互变异构体,是一对反应产物,在反应体系中存在化学平衡,其摩尔比与温度有关)。可选地,组合物还包括杂质a、杂质b、杂质c、杂质d中的至少一种;可选地,组合物还包括2~15%杂质b和1~5%杂质c。
[0074]
作为一种可能的实施例,当x为-o(ch2)2och3时,组合物包括结构式为式(ib-3)所示的化合物;可选地,组合物还包括杂质c、杂质d和杂质e中的至少一种。
[0075]
第五方面,本发明提供一种第一方面所述的化合物、或第二或第三方面所述的制备方法制备的产品、或第四方面所述的组合物的应用,其用于制备氟吡草酮。
[0076]
所述第二或第三方面所述的制备方法中,取代反应的产物可直接用于后续反应,也可以进行纯化处理(例如减压蒸馏等)后进行后续反应。
[0077]
本发明优选提供一种一锅法(即反应产物直接用于后续反应)的氟吡草酮中间体iic的制备方法,该方法包括以下步骤:
[0078]
(1)将含有乙二醇单甲醚盐的物料与4-氯乙酰乙酸乙酯反应,得到含有式iii-a和/或iii-b的反应物料;
[0079][0080]
(2)在碱的作用下,将步骤(1)的反应物料与式iv所示的化合物进行取代反应,得到含有ib-3所示的化合物的反应物料;
[0081][0082]
(3)在步骤(2)的反应物料中加入铵盐和/或氨,使制得的式ib-3所示的化合物进行关环反应,得到式iic所示的化合物;
[0083][0084]
其中,式iii-a和式iii-b化合物也为经反应获得的一对互变异构体,其摩尔比是异构体间达到平衡的结果。
[0085]
该步的反应路线即一锅法的c-1反应路线(碱以醇钠或碳酸钠为例):
[0086][0087]
根据本发明的一种具体实施方式,步骤(1)中,4-氯乙酰乙酸乙酯与乙二醇单甲醚盐的摩尔比为1:1.8~2.5,本发明的发明人研究发现,在比例低的情况下,原料反应不完全,比例高则有副反应导致产率降低,因此,最佳摩尔比为1:2~2.3。由此倒推,乙二醇单甲醚盐的制备中,碱加入量与式iv化合物的摩尔比为1~3:1,可选地为2~2.5:1,优选为2~2.3:1。
[0088]
进一步地,步骤(1)中,含有乙二醇单甲醚盐的物料为乙二醇单甲醚在碱的作用下反应获得的反应物料。
[0089]
进一步地,乙二醇单甲醚与碱的反应温度为40-180℃或80~150℃或80~130℃。
[0090]
进一步地,碱的加入方式为缓慢加入,碱为溶液时为滴加。
[0091]
进一步地,所述碱选自有机碱、无机碱、钠氢或金属钠中的一种或几种;所述有机碱包括醇钠和醇钾中的一种或几种,优选包括甲醇钠、乙醇钠、叔丁醇钾、甲醇钾、乙醇钾中的一种或几种,所述无机碱包括氢氧化钠、氢氧化钾和氨基钠中的一种或几种;优选地,所述碱选自乙醇钠、甲醇钠、甲醇钾、乙醇钾中的一种或几种,选择合适的碱可以使反应路线具有更好的选择性,从而提高产物收率。
[0092]
进一步地,所述步骤(2)中,反应温度在-15℃-30℃,优选为0℃-10℃。
[0093]
进一步地,所述步骤(3)中,反应温度为0℃~80℃,可选地为30℃-80℃,优选为45℃~60℃。
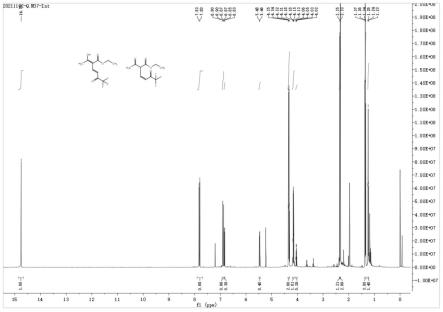
[0094]
进一步地,所述步骤(3)中,所述铵盐包括氯化铵、碳酸铵、碳酸氢铵、硝酸铵、硫酸铵、磷酸铵、醋酸铵中的一种或几种,优选为醋酸铵;所述氨以氨气和/或氨水的形式存在。
[0095]
进一步地,所述步骤(3)中,式ib-3所示的化合物与铵盐和/或氨的摩尔比为1:1~5,可选为1:1~2.5,优选为1:1.2~1.5。
[0096]
进一步地于,所述步骤(2)中反应物料还包括杂质化合物c、化合物d和化合物e中的至少一种,
[0097][0098]
在反应路线c-1的一锅法实施例中,所述步骤(1)的反应物料直接用于步骤(2)的反应。
[0099]
在反应路线c-1的一锅法实施例中,所述步骤(2)的反应物料直
[0100]
接用于步骤(3)的反应。
[0101]
一般地,中间体i在较低温度下有利于动力学产物的形成,而当温度较高时,则有利于形成热力学产物。实验表明中间体i为顺式结构(酮式)有利于后续的中间体ii关环反应,而反式(烯醇式)的关环困难,需要更高的温度。比如当ic为反式结构时,由于边链的位
阻作用及关环需的双键反转的活化能较高,在较低的温度范围条件下无法实现顺利关环。
[0102]
上述反应路线a-1、b-1、c-1用来制备中间体ii时的完整反应路线如下:
[0103]
路线a-1:
[0104][0105]
路线b-1:
[0106][0107]
路线c-1:
[0108][0109]
在上述制备iic的路线c-1中,在制备中间体ib-3时,可以通过分步法,即每一步中间体可以通过减压蒸馏的方法提纯再进行下一步反应;也可以采用一锅法,即每一步中间体反应后的反应液直接或简单处理后套用到下一步反应中,无需进行纯化,制备乙二醇单甲醚盐所用的碱对终产物的收率也具有较大的影响。
[0110]
在上述制备iic的路线c-1中制备乙二醇单甲醚钠盐时,有4种方法。第一种是甲苯中加入60wt%的氢化钠,与乙二醇单甲醚反应,氢化钠往往大量过量,因为矿物油包夹的原因,体系中往往残存大量未反应的氢化钠,淬灭反应会剧烈放出大量的氢气,这种方法不适宜于工业化生产;第二种是氢氧化钠加入到过量的乙二醇单甲醚中通过与甲苯的共沸将反应中的水脱除,这种方法的优点是原料便宜、反应安全且可以大量生产,但缺点是水很难脱除干净,产品乙二醇单甲醚钠盐颜色深,本发明的发明人研究发现,微量的水也会影响后续的反应;第三种是金属钠法,通过金属钠与乙二醇单甲醚反应制备钠盐,该法原料便宜,生产上可控,适合连续化生产,由于释放出大量的氢气,有安全上的隐患;第四种是醇钠交换法,即通过甲醇钠或乙醇钠与乙二醇单甲醚反应,将低沸点的醇蒸出,该法可以放大,但缺点是醇钠用量较大成本较高。在以上的四种乙二醇单甲醚的钠盐制备过程中优选醇钠作为
碱,尤其是甲醇钠和乙醇钠。
[0111]
一锅法与分步法相比,处理简单可以连续进行,一方面可以减少分离环节带来的损失,另一方面产物的相应产率较高,但产品含量偏低,分步法的好处是每步反应产生的副产物能够通过蒸馏的方法除去,产率略低,但产品含量高,有利于后续反应产物的析晶。
[0112]
但需要指出的是中间体ib-3的稳定性较差,比如储存稳定性较差,在酸或者温度较高时,容易异构化等的原因,因此,一锅法与分步法相比,在操作上可以有效地避免中间体ib-3的异构化,从工艺的可靠性考虑,一锅法要优于分步法,因此路线c-1的工艺又以一锅法为优选方案。
[0113]
需要说明的是,本发明对于上述取代反应或关环反应过程中的后处理方式没有特别的限制,可以参照本领域常规的方式进行,例如通过萃取、柱层析、高压制备、结晶等方式。
[0114]
有益效果
[0115]
(1)本发明将制备烟酸片段的两个化合物在碱的作用下先对接生成中间体i,然后经过铵盐分子内关环,能显著地提高氟吡草酮中间体(ii)的收率,减少副反应,克服了现有技术(例如wo2006059103及wo2004078729a1报道的方法)直接通过铵盐分子闭环容易导致原料反应不彻底的缺陷。本发明的通过碱解生成中间体i再闭环反应生成氟吡草酮中间体(ii)的分步法,不仅可以减少副反应的产生,而且可以使收率提高。
[0116]
(2)本发明根据原料可以选择三种反应路线a-1、b-1、c-1,通过先制备中间体i(ia-1与ib-1、或ia-2与ib-2、或ib-3)制备中间体ii,对于减少副产物的产生及实现规模化生产,降低生产成本具有重要意义,可以高转化、高收率地获得中间体ii。其中,路线c-1线性产率高、副产物少,更适合工业上大规模化的生产。路线c-1由于副反应少,比如避免了路线a-1中的甲基卤代选择性差的缺点及路线b-1中4-氯乙酰乙酸乙酯副反应多的缺点,因此路线c-1是优选路线。在路线c-1的两种方案中,一锅法可以避免分步法中由于分离/提纯可能带来顺式中间体ib-3转化为反式的风险,因此c-1路线中一锅法为优选方案。
附图说明
[0117]
一个或多个实施例通过与之对应的附图中的图片进行示例性说明,这些示例性说明并不构成对实施例的限定。在这里专用的词“示例性”意为“用作例子、实施例或说明性”。这里作为“示例性”所说明的任何实施例不必解释为优于或好于其它实施例。
[0118]
图1是本发明实施例1步骤一的分析样品的核磁h谱图。
[0119]
图2是本发明实施例1步骤一的分析样品的核磁c谱图。
[0120]
图3是本发明实施例2-3步骤一的步骤2)的分析样品的核磁h谱图。
[0121]
图4是本发明实施例2-3步骤一的步骤2)的分析样品的核磁c谱图。
[0122]
图5是本发明实施例2-3步骤一的步骤3)中杂质a的核磁h谱图。
[0123]
图6是本发明实施例2-3步骤一的步骤3)中杂质a的核磁c谱图。
[0124]
图7是本发明实施例2-3步骤一的步骤3)中杂质b的核磁h谱图。
[0125]
图8是本发明实施例2-3步骤一的步骤3)中杂质b的核磁c谱图。
[0126]
图9是本发明实施例2-3步骤二的中间体iib的核磁h谱图。
[0127]
图10是本发明实施例2-3步骤二的中间体iib的核磁c谱图。
[0128]
图11是本发明实施例3步骤一的中间体iii-a、iii-b的核磁h谱图。
[0129]
图12是本发明实施例3步骤一的中间体iii-a、iii-b的核磁c谱图。
[0130]
图13是本发明实施例3步骤二的中间体ib-3的核磁h谱图。
[0131]
图14是本发明实施例3步骤二的中间体ib-3的核磁c谱图。
[0132]
图15是本发明实施例4-3步骤四的中间体iiic的核磁h谱图。
[0133]
图16是本发明实施例4-3步骤四的中间体iiic的核磁c谱图。
[0134]
图17是本发明实施例13的杂质e的核磁h谱图。
[0135]
图18是本发明实施例13的杂质e的核磁c谱图。
[0136]
图19是本发明实施例14的杂质c的核磁h谱图。
[0137]
图20是本发明实施例14的杂质c的核磁c谱图。
具体实施方式
[0138]
为使本发明实施例的目的、技术方案和优点更加清楚,下面将对本发明实施例中的技术方案进行清楚、完整地描述,显然,所描述的实施例是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有作出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。
[0139]
另外,为了更好的说明本发明,在下文的具体实施方式中给出了众多的具体细节。本领域技术人员应当理解,没有某些具体细节,本发明同样可以实施。在一些实施例中,对于本领域技术人员熟知的原料、方案、方法、手段等未作详细描述,以便于凸显本发明的主旨。
[0140]
除非另有其它明确表示,否则在整个说明书和权利要求书中,术语“包括”或其变换如“包含”或“包括有”等等将被理解为包括所陈述的元件或组成部分,而并未排除其它元件或其它组成部分。
[0141]
以下实施例中的产物含量通过液相或气相色谱仪确认,以方便计算收率。
[0142]
以下实施例中,为了使中间体i与反应路线相对应和区分,分别命名为中间体ia(对应互变异构体ia-1、对应ib-1)、中间体ib(对应互变异构体ia-2、对应ib-2)、中间体ic(对应结构式ib-3)。
[0143]
以下实施例中,gc-ms为气相质谱,lc-ms为液相质谱,gc检测为气相色谱检测,hplc检测是指液相色谱法检测。
[0144]
实施例1
[0145]
2-甲基-6-(三氟甲基)烟酸乙酯(中间体iia)的合成(路线a-1的一个实施例)
[0146][0147]
步骤一:中间体ia(烯醇式ia-1;酮式ib-1)的合成
[0148]
在单口瓶中加入乙酰乙酸乙酯(6g,46.5mmol)和4-乙氧基-1,1,1-三氟-3-丁烯-2-酮(8g,47.6mmol),冰水浴冷却。缓慢加入乙醇钠(56mmol)的乙醇溶液,滴加完毕,0℃搅拌2小时,薄层色谱法(tlc)监测至反应结束。将反应液倒入50ml的稀盐酸中,用乙酸乙酯萃取三次(60ml
×
3),合并有机相,饱和食盐水洗涤,分出有机相,浓缩得到棕色液体11.96g,柱层析纯化得到分析样品,对分析样品进行核磁h、c谱分析,结果如图1、图2。
[0149]
中间体ia(烯醇式ia-1;酮式ib-1)的核磁h、c谱分析(图1、图2)如下:
[0150]
lc-ms:m 1=253,m-1=251
[0151]1h nmr(cdcl3,500mhz),δ(ppm):(enol)14.75(s,1h),7.82(d,1h,j=15.0hz),6.89(d,1h,j=15.0hz),4.33(q,2h,j=5.0hz),2.33(s,3h),1.36(t,3h,j=5.0hz);(ketone)6.85(d,0.4h,j=10.0hz),5.47(d,0.4h,j=10.0hz),4.16(q,1h,j=5.0hz),4.02-4.06(q,0.2h,j=5.0hz),2.35(s,1.2h),1.24(t,1.2h,j=5.0hz)
[0152]
13
c nmr(cdcl3,150mhz),δ(ppm):186.06,179.45(q,j
c-f
=40.5hz),171.29,164.44,162.32,141.77,126.02,121.52,119.26,115.79(q,j
c-f
=346.5hz),112.91,107.47,102.80,100.05,93.62(q,j
c-f
=19.5hz),61.28,59.72,19.74,18.84,13.21,12.92
[0153]
质谱数据显示中间体ia分子量为252,与结构式ia(ia-1、ib-1)的分子量相符。核磁氢谱数据显示式ia-1中δ14.76ppm含有一个活泼氢具有酚羟基的特征且与空间上临近原子形成了氢键,为烯醇式羟基氢,δ7.82ppm及δ6.89ppm耦合常数j=15.0hz,证明这两个氢处于烯键的反式;而式ib-1中δ6.84ppm及δ5.47ppm耦合常数j=10.0hz,证明这两个氢处于烯键的顺式。在碳谱中,δ186.06ppm,δ179.45ppm分裂成四重峰,说明是与cf3相连的为羰基碳,δ171.29ppm,δ164.44ppm,δ162.32ppm,说明总共5个羰基峰,也说明互变异构体中有一个是烯醇式结构,另一个是酮式结构,δ115.79ppm为四重峰,且j
c-f
=346.5hz,为cf3中的碳。
[0154]
步骤二:2-甲基-6-(三氟甲基)烟酸乙酯(中间体iia)的合成
[0155]
取步骤一制备的棕色液体(11.4g),溶于乙酸(20ml)中,室温搅拌,加入乙酸铵(4.28g),搅拌约0.5小时,然后升温至50℃,继续反应1.5小时,体系变为棕红色。70℃减压浓缩回收乙酸,残余物加入二氯甲烷150ml分三次萃取,合并有机相,用少量的饱和碳酸氢钠水溶液洗涤,分出有机相浓缩得到10.8g棕色油状物,含量为74.1%。步骤一、步骤二两步合计产率为77.4%。
[0156]
在本实施例1中,通过分步法先在碱的作用下得到中间体ia(烯醇式ia-1,酮式ib-1),然后再合成中间件体iia,显著减少了副反应的产生,提高了反应的选择性,在温和条件下实现了关环反应,产率能由现有技术的67%提高到77.4%。
[0157]
实施例2
[0158]
2-氯甲基-6-(三氟甲基)烟酸乙酯(中间体iib)的合成
[0159][0160]
实施例2-1
[0161]
中间体ib(烯醇式ia-2;酮式ib-2)的合成
[0162]
在250ml四口烧瓶中加入无水乙醇(20g)、4-氯乙酰乙酸乙酯(3.46g,21mmol),搅拌下加入4-乙氧基-1,1,1-三氟丁-3-烯-2-酮(3.36g,20mmol)。降温至-15℃,缓慢滴加乙醇溶解的乙醇钠(2.04g,30mmol),约1.0小时滴加完成。-15℃下保温2.0小时左右,薄层色谱法(tlc)监测至反应结束。将反应液倒入配好30ml稀盐酸中,旋蒸除掉乙醇,水相用乙酸乙酯萃取三次(10ml
×
3),合并有机相,用无水硫酸镁干燥,旋蒸、浓缩得粗品4.25g,收率54.3%。
[0163]
实施例2-2
[0164]
中间体ib(烯醇式ia-2;酮式ib-2)的合成
[0165]
在250ml四口烧瓶中加入无水乙醇(35g)、4-氯乙酰乙酸乙酯(17.0g,102mmol)、4-乙氧基-1,1,1-三氟丁-3-烯-2-酮(16.8,100mmol)。升温至30℃,缓慢滴加乙醇溶解的乙醇钠(7.0g,102.9mmol),约1.0小时滴加完成。30℃保温2.0小时左右,液相中控反应至原料低于1%后停止反应。将反应液倒入100ml的稀盐酸中,调ph至1~2,水相用乙酸乙酯萃取三次(100ml
×
3),合并有机相,用无水硫酸镁干燥,旋蒸、浓缩得粗品29.0g,收率67.7%。
[0166]
实施例2-3
[0167]
2-氯甲基-6-(三氟甲基)烟酸乙酯(中间体iib)的合成
[0168]
步骤一:中间体ib(烯醇式ia-2;酮式ib-2)的合成
[0169]
1)在四口烧瓶中加入无水乙醇(28g)、4-氯乙酰乙酸乙酯(17.63g,107mmol),搅拌下加入4-乙氧基-1,1,1-三氟丁-3-烯-2-酮(17.7g,105mmol)。降温至0℃,缓慢滴加乙醇溶解的乙醇钠(7.16g),约2.0小时滴加完成。0℃保温2.0小时左右,液相中控反应至原料低于1%,将反应液倒入配好的100ml稀盐酸溶液中,使得ph=2-3,用二氯甲烷(150ml)萃取。水相用二氯甲烷萃取两次(100ml
×
2),合并有机相,饱和食盐水洗涤一次,分出有机相。有机相浓缩的粗品32.62g,为橙黄色液体。
[0170]
2)将1)中的有机相浓缩的粗品进行柱层析纯化,得到淡黄色纯品21.8g,收率72.4%,其中式ia-2与式ib-2的比例约为1:5,对层析纯化的样品进行核磁h、c谱分析,如图3、4。
[0171]
3)对1)中浓缩后的粗品,以乙腈和水为流动相,通过高压制备液相得到杂质a(100mg,纯度97%)和杂质b(1.0g,纯度95%)。
[0172]
中间体i(烯醇式ia-2,酮式ib-2)的核磁h、c谱分析(图3、图4)如下:
[0173]
lc-ms:m 1=287
[0174]1h nmr(cdcl3,500mhz),δ(ppm):(化合物ia-2)14.54(s,1h),7.82(d,1h,j=15.0hz);7.05(d,1h,j=15.0hz),4.44(q,2h,j=5.0hz),4.37(s,2h),1.44(t,3h,j=5.0hz);(化合物ib-2)6.95(d,1.25h,j=10.0hz),5.70(d,1.25h,j=10.0hz),4.93(d,1.25h,j=10.0hz),4.46(d,1.25h,j=10.0hz),4.27-4.31(m,3.75h),2.01(s,2h),1.35(t,3.75h,j=5.0hz)
[0175]
13
c nmr(cdcl3,150mhz),δ(ppm):177.20(d,j
c-f
=40.5hz),170.05,160.20,155.67,138.49,135.76,124.65,119.35(q,j
c-f
=339.0hz),114.76,114.55,109.63,104.12,100.04,92.89(d,j
c-f
=42.0hz),61.12,59.62,46.44,38.15,38.05,12.25,12.03
[0176]
本实施例步骤一合成中间体ib(烯醇式ia-2,酮式ib-2)的过程中由于碱的作用,4-氯乙酰乙酸乙酯中有多个敏感基团,反应非常复杂,除了得到主产物——中间体i(烯醇式ia-2,酮式ib-2)以外还有四个主要的副产物杂质a、杂质b、杂质c和杂质d。
[0177]
杂质a、杂质b、杂质c和杂质d的形成与主产物中间体ib(烯醇式ia-2,酮式ib-2)是竞争关系,与碱的加入方式有关,一般地,当碱加入的较快时,因为浓度较高,4-乙氧基-1,1,1-三氟丁-3-烯-2-酮发生酸式分解生成丙烯酸乙酯负离子,然后对自身加成生成了杂质a;而当缓慢滴加碱时,由于碱的总体浓度较低,几乎检测不到a的生成。杂质b、杂质c的形成与碱的加料方式及碱的种类无关,b含量大约界于6%-12%之间,c一般为3%左右,副产物b、c的产生是不可避免的,也是本实施例的主要杂质。杂质a的可能形成机理如下:
[0178][0179]
杂质a的核磁h、c谱分析见图5、图6:
[0180]
lc-ms:m 1=269
[0181]1h nmr(d6-dmso,500mhz),δ(ppm):7.05(d,1h,j=10.0hz),5.48(d,1h,j=10.0hz),5.03(d,1h,j=10.0hz),4.41(d,1h,j=10.0hz),4.27-4.32(m,2h),3.56-3.66(m,2h),1.35(t,3h,j=10.0hz),1.24(t,3h,j=10.0hz)
[0182]
13
c nmr(d6-dmso,150mhz),δ(ppm):162.11,158.09,126.53,119.00(q,j
c-f
=340.50hz),108.26,96.79(t,j
c-f
=40.5hz),59.50,57.68,13.16,12.26
[0183]
质谱数据显示杂质a分子量为268,与结构式(杂质a)的分子量相符。氢谱数据显示分子结构中含有两个乙氧基、4个烯氢,其中4个烯氢处于不同的烯键上,碳谱化学位移δ162.11ppm为羰基碳,δ119.00ppm分裂为四重峰且j
c-f
=340.50hz说明分子中含有cf3,δ96.79ppm分裂为三重峰且j
c-f
=40.5hz说明该碳与cf3直接相连,其中δ3.56-3.66ppm处的一个ch2分裂为两组,说明该结构存在手性,是一对外消旋异构体。
[0184]
杂质b的形成机理如下:
[0185][0186]
杂质b的核磁h、c谱分析见图7、图8:
[0187]
lc-ms:m 1=251,m-1=249
[0188]1h nmr(d6-dmso,500mhz),δ(ppm):10.56(brs.,2h),7.35(d,1h,j=10.0hz),7.09(d,1h,j=10.0hz),4.41(q,2h,j=5.0hz),1.36(t,3h,j=5.0hz)
[0189]
13
c nmr(d6-dmso,150mhz),δ(ppm):168.97,150.16,145.84,123.85(q,j
c-f
=325.5hz),119.95(q,j
c-f
=34.5hz),119.32,116.63,116.08(d,j
c-f
=6hz),62.40,14.33
[0190]
质谱数据显示分子量为250,与结构式(杂质b)的分子量相符。氢谱数据显示宽的单峰δ10.56ppm含有两个活泼氢具有酚羟基的特征,与空间上酚羟基与临近原子形成了氢键,另一方面δ168.97ppm显示只有一个羰基基团,分子中含有乙氧基,为酯的羰基,说明分子中另外两个“羰基”是以烯醇式存在而不是酮式存在。
[0191][0192]
δ7.35ppm及δ7.09ppm为烯氢,紫外显色说明分子应具有芳香性;碳谱中δ123.85ppm分裂为四重峰且j
c-f
=325.5hz,说明含有cf3基团,δ119.95ppm分裂为四重峰且j
c-f
=34.5hz,说明该碳与cf3基团之间相连,且该碳不是羰基碳。
[0193]
本实施例步骤一的其他可能的副产物也有很多,含量一般为3%以下,约有20种之多,例如:
[0194][0195]
主要原因是4-氯乙酰乙酸乙酯含有多个活性位点,反应的选择性不高,即使温度降至-15℃对反应结果也影响不大。其中杂质c的含量约为3%,反应机理如下:
[0196][0197]
质谱显示杂质c的分子量为256,从碳谱和氢谱数据推测分子结构对称,氢谱中δ12.13ppm为烯醇氢且与邻近基团形成分子内氢键,δ170.29ppm证明只有一种羰基碳,乙氧基的存在,说明结构中只含有酯基没有酮基。
[0198]
在本实施例2的步骤一中,以4-氯乙酰乙酸乙酯和4-乙氧基-1,1,1-三氟丁-3-烯-2-酮为底物,滴加醇钠的过程中,醇钠的作用是形成了4-氯乙酰乙酸乙酯负离子,进一步与4-乙氧基-1,1,1-三氟丁-3-烯-2-酮反应生成了中间体ib(烯醇式ia-2和酮式ib-2),中间体ib发生分子内反应生成了杂质b;4-氯乙酰乙酸乙酯分子间的反应生成了杂质c及其他多聚体;醇钠对于4-乙氧基-1,1,1-三氟丁-3-烯-2-酮的作用则是将其酸解生成了杂质a及杂质d。这就是为什么中控原料完全消失而产物中间体ib产率低的原因。
[0199]
在本实施例的步骤一中形成的中间体ib有顺反两种互变异构体形式,比例约为1:5,其中的反式异构体h为烯醇式结构,因为分子内氢键的形成,烯醇氢向低场移动到δ14.54ppm,而j=15.0hz表明其结构为反式。顺式异构体i实际含有一个手性,顺式共两个烯氢,高场处δ1.34-1.36显示为多重峰而不是简单的三重峰,表明是一对非对映异构体。
[0200]
步骤二:2-氯甲基-6-(三氟甲基)烟酸乙酯(中间体iib)的合成
[0201]
在四口烧瓶中加入乙酸(130.48g)、步骤一2)中的产品(18.17g),搅拌下加入醋酸铵(9.44g),升温至50℃,保温2小时。液相中控反应至原料小于1%,停止反应。减压蒸除溶剂,残余物用饱和碳酸氢钠水溶液洗至不再产生明显气泡,加入二氯甲烷(200ml)萃取。水相用二氯甲烷萃取(100ml
×
2);合并有机相;有机相用饱和食盐水(100ml)洗一次。减压旋除溶剂,得到橙黄色粗品24.71g。柱层析纯化得淡黄色纯品(中间体iib)14.3g,含量95%,收率80.1%。对柱层析纯品进行核磁h、c谱分析,结果如图9、10。
[0202]
中间体iib的核磁h、c谱分析如图9、图10:
[0203]
lc-ms:m 1=268
[0204]1hnmr(cdcl3,500mhz),δ(ppm):8.45(d,1h,j=10.0hz),7.75(d,1h,j=10.0hz);5.13(s,2h),4.48(q,2h,j=5.0hz),1.45(t,3h,j=5.0hz)
[0205]
13
c nmr(cdcl3,150mhz),δ(ppm):162.40(d,j
c-f
=66hz),155.99,147.87(q,j
c-f
=42hz),139.01,126.81,118.89(q,j
c-f
=267hz),116.37(d,j
c-f
=560hz),60.65,43.00,12.18.
[0206]
实施例3
[0207]
2-((2-甲氧基乙氧基)甲基)-6-(三氟甲基)烟酸乙酯(中间体iic)的合成
[0208][0209]
步骤一:4-(2-甲氧基乙氧基)-3-氧代丁酸乙酯(即iii-a)及(z)-3-羟基-4-(2-甲氧基乙氧基)-3-氧代丁酸乙酯(即iii-b)的合成
[0210]
在四口烧瓶中加入四氢呋喃(100ml),氮气保护,搅拌下分批加入nah(60%,10.4g,260mmol)。降温至10℃,缓慢滴加乙二醇单甲醚(21.6g,284mmol),有气泡产生,滴加完成,搅拌30分钟。滴加4-氯乙酰乙酸乙酯(10g,61mmol)和四氢呋喃(50ml)的混合液至上述四口瓶中,滴加完成,室温反应2小时。中控至4-氯乙酰乙酸乙酯剩余小于1%停止反应。减压除去溶剂,残余物加入150ml水,用30%的hcl调ph至2-3。加入二氯甲烷(100ml)萃取,水相用二氯甲烷(100ml
×
2)萃取两次,合并有机相,有机相用饱和的食盐水洗一次,用无水硫酸镁干燥,浓缩后得到橙黄色液体9.15g,含量73%,收率53.6%。其中酮式(即对应结构式iii-a)与醇式(即对应结构式iii-b)的比例约为9:1。
[0211]
化合物iii-a、iii-b的核磁h、c谱分析如图11、图12
[0212]
gc-ms:m=204
[0213]1h nmr(cdcl3,500mhz),δ(ppm)(iii-a):4.10-4.14(m,4h),3.61(t,2h,j=5.0hz),3.50(t,2h,j=5.0hz),3.46(s,2h),3.31(s,3h),1.21(t,3h,j=5.0hz);(iii-b):11.89(s,1h),5.24(s,1h),4.10-4.14(m,2h),4.02(s,2h),3.61(t,2h,j=5.0hz),3.50(t,2h,j=5.0hz),3.32(s,3h),1.21(t,3h,j=5.0hz)
[0214]
13
c nmr(cdcl3,150mhz),(iii-a)δ:200.85,166.04,75.21,70.87,70.04,60.35,57.99,44.85,13.08;(iii-b)δ:172.91,171.64,87.83,70.80,69.65,68.87,59.18,58.07,13.21。
[0215]
步骤二:(z)-6,6,6-三氟-2-(2-(2-甲氧基乙氧基)乙酰基)-5-氧代己-3-烯酸乙酯(中间体ic)的合成
[0216]
在四口烧瓶中加入乙醇(5.6g)、步骤一中粗品3.06g(73%,10.9mmol),搅拌下加入(e)-4-乙氧基-1,1,1-三氟丁-3-烯-2-酮(1.77g,10.5mmol)。降温至0℃,缓慢滴加乙醇溶解的乙醇钠(0.72g,10.6mmol)。滴加完成,保温2.0小时左右,液相中控反应至原料小于1%。将反应液倒入配好的20ml盐酸溶液中,ph约为2-3。用二氯甲烷(20ml)萃取。水相用二氯甲烷萃取两次(10ml
×
2),合并有机相。使用饱和食盐水洗涤一次,分出有机相,用无水硫酸镁干燥浓缩得粗品3.51g,为橙黄色液体,无需纯化直接投入下一步反应。通过制备液相
分离得分析样品,进行核磁h、c谱分析。中间体ic的h、c谱分析如图13、图14。
[0217]
gc-ms:m=326
[0218]1h nmr(cdcl3,500mhz),δ(ppm):8.19(d,1h,j=5.0hz),7.61(d,1h,j=5.0hz),4.94(s,2h),3.35(q,2h,j=5.0hz),3.63(t,2h,j=5.0hz),3.48(t,2h,j=5.0hz),3.29(s,3h),1.34(t,3h,j=5.0hz)
[0219]
13
c nmr(cdcl3,150mhz),δ(ppm):164.43,158.02,148.05(q,j
c-f
=15.0hz),138.41,128.71,120.01(q,j
c-f
=327.0hz),118.20,71.87,70.74,69.55,61.04,57.95,13.10
[0220]
步骤三:2-((2-甲氧基乙氧基)甲基)-6-(三氟甲基)烟酸乙酯(中间体iic)的合成
[0221]
在四口烧瓶中加入乙酸(14.04g)、步骤二中的粗品(3.51g),搅拌下加入醋酸铵(0.94g,12.2mmol),升温至50℃,保温2小时。液相中控反应至原料小于1%,停止反应。减压除去溶剂,用饱和的碳酸氢钠水溶液洗至不再产生明显气泡,加入二氯甲烷(20ml)萃取。水相用二氯甲烷萃取(15ml
×
2),合并有机相,用饱和食盐水(15ml)洗一次。无水硫酸镁干燥,减压除去溶剂,得到粗品3.75g,为橙黄色液体,含量53%。步骤二、步骤三两步总收率59.3%。步骤一、二、三的总收率为31.8%。
[0222]
实施例4
[0223]
实施例4-1:
[0224]
4-(2-甲氧基乙氧基)-3-氧代丁酸乙酯(即iii-a)及(z)-3-羟基-4-(2-甲氧基乙氧基)-3-氧代丁酸乙酯(即iii-b)的合成
[0225]
将乙醇钠(6.8g,100mmol)加入到乙二醇单甲醚(8.0g,105mmol)中,搅拌加热,油浴升温至40℃搅拌2小时,减压蒸馏蒸除乙醇,体系呈棕黄色的固体,降温至室温,加入甲苯(40.2g),搅拌分散,得到乙二醇单甲醚钠盐的甲苯溶液。
[0226]
控温25℃左右,向上述乙二醇单甲醚钠盐的甲苯溶液中滴加4-氯乙酰乙酸乙酯(7.5g,45.5mmol),加毕,升温至40℃保温,搅拌反应6小时,tlc跟踪原料反应完全。降温至30℃以下,将反应液用盐酸溶液调ph值至4,搅拌10分钟,静置分液,分出有机相,水相用甲苯30ml萃取,合并有机相,减压旋蒸除去甲苯,得到中间体化合物iii-a、iii-b粗品,换油泵减压蒸出金黄色产品6.43g,收率69.2%。
[0227]
实施例4-2:
[0228]
4-(2-甲氧基乙氧基)-3-氧代丁酸乙酯(即iii-a)及(z)-3-羟基-4-(2-甲氧基乙氧基)-3-氧代丁酸乙酯(即iii-b)的合成
[0229]
将乙醇钠(6.8g,100mmol)加入到乙二醇单甲醚(11.4g,150mmol)中,搅拌加热,油浴升温至100℃搅拌1小时,继续升温至180℃蒸除多余的乙二醇单甲醚,体系呈棕黑色的固体,降温至室温,加入甲苯(40.2g),搅拌分散,得到乙二醇单甲醚钠盐的甲苯溶液。
[0230]
控温25℃左右,向上述乙二醇单甲醚钠盐的甲苯溶液中滴加4-氯乙酰乙酸乙酯(7.5g,45.5mmol),加毕,升温至40℃保温,搅拌反应6小时,tlc跟踪原料反应完全。降温至室温,将反应液用盐酸溶液调ph值至4,搅拌静置分液,分出有机相,水相用甲苯30ml萃取,合并有机相,减压旋蒸除去甲苯,得到中间体化合物iii-a、iii-b粗品,换油泵减压蒸出金黄色产品7.23g,收率77.8%。
[0231]
实施例4-3:
[0232]
2-((2-甲氧基乙氧基)甲基)-6-(三氟甲基)烟酸乙酯(中间体iic)的合成
[0233]
步骤一:4-(2-甲氧基乙氧基)-3-氧代丁酸乙酯(即iii-a)及(z)-3-羟基-4-(2-甲氧基乙氧基)-3-氧代丁酸乙酯(即iii-b)的合成
[0234]
将乙醇钠(21.6g,317mmol)加入到乙二醇单甲醚(72.6g,954mmol)中,搅拌加热,油浴升温至130℃,减压蒸馏收取馏分67g,降温至100℃以下,加入甲苯(86.6g),搅拌分散,得到乙二醇单甲醚钠盐的甲苯溶液。
[0235]
控温30℃左右,向上述乙二醇单甲醚钠盐的甲苯溶液中滴加4-氯乙酰乙酸乙酯(18.7g,114mmol),加毕,40℃保温,搅拌反应6小时,tlc(pe:ea=6:1)跟踪检测,原料反应完全。降温至30℃以下,将反应液倒入盐酸溶液(112.2g,6.8%)中,搅拌10分钟,静置分液,用甲苯(43.2g)萃取水相两次,静置分液,再用二氯甲烷(21.6g)萃取水相,合并有机相,减压蒸馏(90℃,-0.095mpa)得到中间体化合物iii-a、iii-b粗品,为褐色油状物22.0g。油浴升温至130℃,水泵减压(-0.095mpa)蒸去溶剂,至无馏分流出,换用油泵,油浴升至140℃,蒸出金黄色产品20.42g,收率87.6%,直接用于下一步反应。
[0236]
本实施例4的步骤一通过先制备乙二醇单甲醚钠盐再制备化合物iii-a、iii-b,收率可达87.6%,优于实施例3的步骤一直接反应的收率(53.6%)。
[0237]
步骤二:(z)-6,6,6-三氟-2-(2-(2-甲氧基乙氧基)乙酰基)-5-氧代己-3-烯酸乙酯(中间体ib-3)的合成
[0238]
将以上步骤一得到的产物(20.4g,100mmol)、4-乙氧基-1,1,1-三氟丁-3-烯-2-酮(16.8g,100mmol)加入到无水乙醇(49.0g)中,控温10℃以下,滴加20wt%乙醇钠乙醇溶液(34g,100mmol)。滴毕,0-10℃保温2小时,hplc检测,原料反应完全。将反应液倒入114.3g盐酸溶液(由12.2g的30wt%盐酸配制)和二氯甲烷(81.7g)混合溶液中,搅拌10分钟,静置分液,再用二氯甲烷(40.8g)萃取水相,合并有机相,减压蒸馏(55℃,低于-0.095mpa)得到中间体ic,为褐色油状物36.5g,直接用于下一步反应。
[0239]
步骤三:2-((2-甲氧基乙氧基)甲基)-6-(三氟甲基)烟酸乙酯(中间体iic)的合成
[0240]
将步骤二的中间体ic(36.5g)加入到乙酸(130.5g)中,搅拌下加入乙酸铵(9.4g,122mmol),控温50-60℃搅拌反应2小时,hplc检测,原料反应完全。向反应液中加入水(97.9g)和二氯甲烷(97.9g)混合溶液中,搅拌10分钟,静置分液,再用二氯甲烷(65.2g)萃取水相两次,合并有机相,减压蒸馏(60℃,低于-0.095mpa)得到中间体iic,为褐色油状物35.1g,直接用于下一步反应。
[0241]
步骤四:2-((2-甲氧基乙氧基)甲基)-6-(三氟甲基)烟酸(中间体iiic)的合成
[0242]
将步骤三的中间体iic(35.1g,净含量30.7g)加入到乙醇(30.7g)中,滴加氢氧化钠(42.7g,28%,300mmol)溶液,控温50-60℃搅拌反应1小时,gc检测,原料反应完全。降温至室温,向反应液中加入水(92.2g)和二氯甲烷(61.5g),搅拌10分钟,静置分液,水相加入二氯甲烷(92.2g),用30%的盐酸酸化至ph≈1.5,搅拌分钟,分液,再用二氯甲烷(61.5g)萃取水相,合并有机相,减压蒸馏(60℃,低于-0.095mpa)得到中间体iiic 26.5g,为褐色油状物。向所得粗品中分别加入13.3g乙酸乙酯和16.6g石油醚,搅拌缓慢降至-5℃析晶,抽滤,干燥得浅黄色的固体产品15.2g,步骤二、三、四的三步产率为54.5%。
[0243]
本实施例的总收率为47.8%,本实施例4的步骤二、三的收率较高,明显优于实施例3的总收率(实施例3中iic的反应收率不太高,未进一步进行iiic的制备),本实施例4在
步骤四制备的中间体iiic可用于合成氟吡草酮。
[0244]
中间体iiic的h、c谱分析图如图15、图16所示。
[0245]
lc-ms:m-1=278
[0246]1h nmr(cdcl3,500mhz),δ(ppm):10.464(s,1h),8.395(d,1h,j=8.0hz),7.716(d,1h,j=8.0hz),5.074(s,2h),3.776-3.795(m,2h),3.611-3.629(m,2h),3.377(s,3h);
[0247]
13
c nmr(cdcl3,150mhz),δ(ppm):167.298,157.784,148.538(q,j
c-f
=42.3hz),139.641,128.100,119.921(q,j
c-f
=327.3hz),118.574,71.932,70.582,69.383,57.384.
[0248]
实施例5
[0249]
2-((2-甲氧基乙氧基)甲基)-6-(三氟甲基)烟酸乙酯(中间体iic)的合成(一锅法)
[0250]
向四口瓶中加入乙二醇单甲醚(19.1g,251mmol)和甲苯(82.7g),边搅拌边加入金属钠(5.3g,230mmol),逐渐升温,80℃下反应至无金属钠颗粒为止。降温,控温40℃以下,滴加4-氯乙酰乙酸乙酯(16.5g,101mmol),45℃保温反应约3小时,降温。取样gc检测,转化率94.6%,反应液直接用于下一步反应。
[0251]
将上述的反应液降温至10℃以下,4-乙氧基-1,1,1-三氟丁-3-烯-2-酮(16.8g,100mmol)和甲苯(14.0g)的混合液向体系中滴加,反应2小时后,gc检测原料无剩余。边搅拌边加入稀盐酸酸化,静置分液,取甲苯相检测含量为87.1%。反应液直接用于下一步反应。
[0252]
边搅拌边向上述的甲苯溶液中加入乙酸铵(9.3g,121mmol),升温至50℃反应2小时,hplc中控,约3小时反应结束。加水(50.0g)洗涤、分液,甲苯相称重25.7g,检测含量为87.2%。本实施例的中间体iic三步总收率为72.9%。
[0253]
实施例6
[0254]
2-((2-甲氧基乙氧基)甲基)-6-(三氟甲基)烟酸乙酯(中间体iic)的合成(一锅法)
[0255]
向四口瓶中加入乙二醇单甲醚(19.1g,251mmol)和甲苯(82.7g),边搅拌边加入金属钠(5.1g,222mmol),逐渐升温至80℃反应至无金属钠颗粒为止。降温至40℃,滴加4-氯乙酰乙酸乙酯(16.5g,101mmol),40℃保温反应约6小时,65℃反应2小时,降温。取样gc检测,转化率88.8%,反应液直接用于下一步反应。
[0256]
将体系温度降至10℃以下,4-乙氧基-1,1,1-三氟丁-3-烯-2-酮(16.8g,100mml)和甲苯(14.0g)的混合液,向上述反应液中滴加,反应2小时后,gc检测原料无剩余。边搅拌边加入稀盐酸酸化,静置分液,取甲苯相检测含量为75.3%。反应液直接用于下一步反应。
[0257]
边搅拌边向上述的甲苯溶液中通入氨气15分钟,加入乙酸(15.0g)升温至50℃反应2小时,hplc中控,约3小时反应结束。加水(50.0g)洗涤、分液,甲苯相称重为20.6g,含量为86.2%。本实施例的中间体iic三步产率为57.2%,本实施例的反应收率略低,本发明的发明人推测,可能是在iic制备过程中使用氨气的原因。
[0258]
实施例7
[0259]
2-((2-甲氧基乙氧基)甲基)-6-(三氟甲基)烟酸乙酯(中间体iic)的合成(一锅法)
[0260]
向四口瓶中加入乙二醇单甲醚(114.4g,1.5mol)、氢氧化钠(48.3g,1.21mol)和甲苯(250.3g),高温140-150℃油浴回流,用分水器脱去反应生成的水,至分水器内无明显水
珠,冰水浴降温至30℃左右,滴加4-氯乙酰乙酸乙酯(90.61g,0.55mol),40℃反应过夜,取样gc检测,转化率95.9%,反应液直接用于下一步反应。
[0261]
取出反应液分出一部分,折约含乙二醇单甲醚钠盐(0.1mol),控温<10℃,滴加4-乙氧基-1,1,1-三氟丁-3-烯-2-酮的甲苯溶液(含16.8g的4-乙氧基-1,1,1-三氟丁-3-烯-2-酮和16.89g甲苯),反应2小时后,gc检测原料无剩余,边搅拌边加入稀盐酸酸化,静置分液,取甲苯相检测含量为82.7%,反应液直接用于下一步反应。
[0262]
边搅拌边向上述的甲苯溶液中分批加入乙酸铵(9.25g,0.12mol均分三份,每间隔20分钟加入一批);升温至50℃反应2小时,hplc中控,反应结束,加水(80g)洗涤、分液,甲苯相称重为17.4g,检测含量为75.7%。本实施例的中间体iic三步收率为42.9%,本实施例的反应收率略低,本发明的发明人推测,可能是在乙二醇单甲醚盐制备过程中残留的微量水的影响。
[0263]
实施例8
[0264]
2-((2-甲氧基乙氧基)甲基)-6-(三氟甲基)烟酸乙酯(中间体iic)的合成
[0265]
向250ml的四口圆底烧瓶中加入乙醇(50g),4-(2-甲氧基乙氧基)-3-氧代丁酸乙酯及(z)-3-羟基-4-(2-甲氧基乙氧基)-3-氧代丁酸乙酯混合物(该混合物按照实施例4步骤一制得,20.42g,100mmol)。将四口瓶置于冷阱中,设冷阱温度为0℃。开启搅拌,待反应液温度降至5
±
3℃,开始利用恒压滴液漏斗滴加20%乙醇钠的乙醇溶液(34.04g,100mmol),约30分钟滴加完毕。滴加完毕后,保温反应0.5小时。然后滴加4-乙氧基-1,1,1-三氟丁-3-烯-2-酮(18.28g,109mmol)的甲苯(90ml)溶液,约20分钟滴加完毕。滴加完毕后,保温反应1小时。取30%的盐酸溶液(12.40g),加入去离子水(100g),混合均匀。将反应液直接倒入酸水中,加入二氯甲烷(80g)萃取,分出有机相,水相加入二氯甲烷(20g)萃取,合并有机相,减压回收二氯甲烷,55℃残余物减压蒸馏得到中间体ic(32.63g)。
[0266]
向250ml的四口圆底烧瓶中加入乙酸(130g)、乙酸铵(9.37g,122mmol)、上述得到的中间体ic(32.63g),油浴加热至50℃,保温反应2小时。升温至65℃,减压蒸馏,压力为2mmhg,至馏分不再馏出为止,向四口瓶中加入去离子水(100g)和二氯甲烷(100g)萃取,分出有机相。水相加入二氯甲烷(30g
×
2)萃取,合并有机相,减压除去溶剂,残余物升温至60℃,压力为≤0.095mpa,减压蒸馏得到黄黑色油状物27.2g,含量89.2%,本实施例的中间体iic两步产率为79.0%。
[0267]
实施例9
[0268]
2-((2-甲氧基乙氧基)甲基)-6-(三氟甲基)烟酸乙酯(中间体iic)的合成
[0269]
向250ml的四口圆底烧瓶中加入甲苯(51.05g),4-(2-甲氧基乙氧基)-3-氧代丁酸乙酯及(z)-3-羟基-4-(2-甲氧基乙氧基)-3-氧代丁酸乙酯混合物(该混合物按照实施例4步骤一制得,10.21g,50mmol)保持25℃搅拌,加入固体乙醇钠(4.08g,60mmol),反应0.5小时。冷却使反应液降温至5℃
±
3℃,滴加4-乙氧基-1,1,1-三氟丁-3-烯-2-酮(9.14g,54mmol)和甲苯(10.21g)的混合溶液,约20分钟滴加完毕。滴加完毕后,保温反应1小时。tlc点板检测反应情况,原料反应完全后,停止反应。取30%的盐酸溶液(7.9g),加入去离子水(51.05g),将酸水直接倒入反应液中并搅拌10分钟。分液得到ic的甲苯溶液。
[0270]
将上述的中间体ic甲苯溶液转移至250ml的四口圆底烧瓶中,加入乙酸(3.00g)、乙酸铵(4.68g,61mmol)。将四口瓶置于油浴锅中,升温至50℃,保温反应2h。tlc点板检测反
应情况,原料反应完全后,停止反应。将反应液转移至分液漏斗中,静置分液。取上层有机相,水泵减压蒸馏,至馏分不再馏出后,停止蒸馏。得到关环产物14.2g,含量88.6%,本实施例的中间体iic的产率为81.9%。
[0271]
实施例10
[0272]
2-((2-甲氧基乙氧基)甲基)-6-(三氟甲基)烟酸乙酯(中间体iic)的合成
[0273]
向250ml的四口圆底烧瓶中加入甲苯(51.05g),4-(2-甲氧基乙氧基)-3-氧代丁酸乙酯及(z)-3-羟基-4-(2-甲氧基乙氧基)-3-氧代丁酸乙酯混合物(该混合物按照实施例4步骤一制得,10.21g,50mmol)保持25℃搅拌,加入碳酸钠(6.36g,60mmol),反应0.5小时。冷却使反应液降温至5℃
±
3℃,滴加4-乙氧基-1,1,1-三氟丁-3-烯-2-酮(9.14g,54mmol)和甲苯(10.21g)的混合溶液,约20分钟滴加完毕。滴加完毕后,保温反应1小时。tlc点板检测反应情况,原料反应完全后,停止反应。取30%的盐酸溶液(7.9g),加入去离子水(51.05g),将酸水直接倒入反应液中并搅拌10分钟。分液得到ic的甲苯溶液。
[0274]
将上述的ic甲苯溶液转移至250ml的四口圆底烧瓶中,加入乙酸(3.00g)、乙酸铵(4.68g,61mmol)。将四口瓶置于油浴锅中,升温至50℃,保温反应2h。tlc点板检测反应情况,原料反应完全后,停止反应。将反应液转移至分液漏斗中,静置分液。取上层有机相,水泵减压蒸馏,至馏分不再馏出后,停止蒸馏。得到关环产物13.9g,含量90.7%,本实施例的中间体iic的产率为82.1%。
[0275]
实施例11(一锅法)
[0276]
2-((2-甲氧基乙氧基)甲基)-6-(三氟甲基)烟酸乙酯(中间体iic)的合成
[0277]
将乙醇钠(8.46g,124.3mmol)加入到乙二醇单甲醚(28.4g,373.2mmol)中,搅拌加热,油浴升温至130℃,减压蒸馏收取馏分12g,降温至100℃以下,加入甲苯(51.1g),搅拌分散,得到乙二醇单甲醚钠盐的甲苯溶液。
[0278]
控温30℃左右,向上述乙二醇单甲醚钠盐的甲苯溶液中滴加4-氯乙酰乙酸乙酯(8.89g,54mmol),加毕,40℃保温,搅拌反应6小时,tlc(pe:ea=6:1)跟踪检测,原料反应完全。
[0279]
体系冷却使反应液降温至5℃
±
3℃,滴加4-乙氧基-1,1,1-三氟丁-3-烯-2-酮(9.14g,54mmol)和甲苯(10.21g)的混合溶液,约20分钟滴加完毕。滴加完毕后,保温反应1小时。tlc点板检测反应情况,原料反应完全后,加入乙酸(4.20g)、乙酸铵(4.68g,61mmol)。将四口瓶置于油浴锅中,升温至50℃,保温反应2h。tlc点板检测反应情况,原料反应完全后,停止反应。将反应液转移至分液漏斗中,静置分液。取上层有机相,水泵减压蒸馏,至馏分不再馏出后,停止蒸馏。得到关环产物15.1g,含量88.7%,本实施例的中间体iic的产率为80.7%。
[0280]
实施例12(一锅法)
[0281]
2-((2-甲氧基乙氧基)甲基)-6-(三氟甲基)烟酸乙酯(中间体iic)的合成
[0282]
将甲醇钠(6.71g,124.3mmol)加入到乙二醇单甲醚(28.4g,373.2mmol)中,搅拌加热,油浴升温至130℃,减压蒸馏收取馏分6.6g,降温至100℃以下,加入甲苯(51.1g),搅拌分散,得到乙二醇单甲醚钠盐的甲苯溶液。
[0283]
控温30℃左右,向上述乙二醇单甲醚钠盐的甲苯溶液中滴加4-氯乙酰乙酸乙酯(8.89g,54mmol),加毕,40℃保温,搅拌反应6小时,tlc(pe:ea=6:1)跟踪检测,原料反应完
全。
[0284]
体系冷却使反应液降温至5℃
±
3℃,滴加4-乙氧基-1,1,1-三氟丁-3-烯-2-酮(9.14g,54mmol)和甲苯(10.21g)的混合溶液,约20分钟滴加完毕。滴加完毕后,保温反应1小时。tlc点板检测反应情况,原料反应完全后,加入乙酸(4.20g)、乙酸铵(4.68g,61mmol)。将四口瓶置于油浴锅中,升温至50℃,保温反应2h。tlc点板检测反应情况,原料反应完全后,停止反应。将反应液转移至分液漏斗中,静置分液。取上层有机相,水泵减压蒸馏,至馏分不再馏出后,停止蒸馏。得到关环产物14.8g,含量92.5%,本实施例的中间体iic的产率为82.5%。
[0285]
实施例13
[0286]
4-乙氧基-3-氧代丁酸乙酯和(z)-4-乙氧基-3-羟基丁-2-烯酸乙酯的合成(杂质e,为一对酮式和烯醇式异构体)
[0287][0288]
在一只250ml的四口烧瓶中加入乙醇(33.6g)、4-氯乙酰乙酸乙酯(16.8g,100mmol),搅拌下加入20%乙醇钠乙醇溶液(68.01g,200mmol)。升温至50℃,保温2h,gc检测,原料≤1%停止反应。将反应液倒入配好的稀盐酸(150ml)溶液中,ph=2-3。用二氯甲烷(150ml)萃取,水相用二氯甲烷萃取两次(100ml
×
2),合并有机相。有机相用饱和食盐水洗涤一次。分出有机相,用无水硫酸镁干燥浓缩得粗品,为淡黄色液体。柱层析纯化得到分析样品,gc检测含量≥97%。通过gc-ms及核磁标准结构正确。核磁证明酮式结构与醇式结构比例为10:1。杂质e的制备是为了表征本发明反应路线中的杂质e。
[0289]
杂质e的核磁h、c谱分析如图17、图18。
[0290]
gc-ms:m=174
[0291]1h nmr(cdcl3,500mhz),δ(ppm):(ketone)4.20(q,2h,j=5.0hz),4.11(s,2h),3.57(q,2h,j=5.0hz),3.52(s,2h),3.63(t,2h,j=5.0hz),1.28(t,3h,j=5.0hz),1.24(t,3h,j=5.0hz)
[0292]
13
c nmr(cdcl3,150mhz),δ(ppm):(ketone)202.19,167.06,75.52,67.28,61.34,45.95,14.95,14.07;(enol)174.35,172.67,88.59,69.29,66.95,60.16,15.06,14.21
[0293]
实施例14
[0294]
2,5-二羟基环己-1,4-二烯-1,4-二羧酸乙酯的合成(杂质c)
[0295][0296]
在250ml四口瓶中加入四氢呋喃(40.0g),控温低于15℃,搅拌分批加入氢化钠(2.4g,60%,60mmol),搅拌10分钟,然后降温至5-10℃,缓慢滴加4-氯乙酰乙酸乙酯(10g溶于30ml四氢呋喃,61mmol)溶液,冰水浴降温,有气泡不断产生。滴加完成,反应液为浅棕黄色。逐渐升温至25-30℃,反应液逐渐至棕黄色澄清。减压旋除溶剂,加入水(150ml),搅拌下
加入二氯甲烷(150ml),调节ph至2-3。萃取分液,水相用二氯甲烷萃取两次(100ml
×
2),合并有机相。有机相用饱和食盐水洗涤一次。分出有机相,用无水硫酸镁干燥,浓缩得粗品。柱层析得2.72g,收率35.4%。产品重结晶纯化得到分析样品,为淡黄色晶体。
[0297]
杂质c的核磁h、c谱分析如图19、图20。
[0298]
lc-ms:m-1=255,m 1=257
[0299]1h nmr(cdcl3,500mhz),δ(ppm):12.13(s,2h),4.18(t,4h,j=5.0hz),3.11(s,4h),1.25(t,6h,j=5.0hz)
[0300]
13
c nmr(cdcl3,150mhz),δ(ppm):170.29,167.43,92.23,59.71,27.51,13.21.
[0301]
最后应说明的是:以上实施例仅用以说明本发明的技术方案,而非对其限制;尽管参照前述实施例对本发明进行了详细的说明,本领域的普通技术人员应当理解:其依然可以对前述各实施例所记载的技术方案进行修改,或者对其中部分技术特征进行等同替换;而这些修改或者替换,并不使相应技术方案的本质脱离本发明各实施例技术方案的精神和范围。
再多了解一些
本文用于创业者技术爱好者查询,仅供学习研究,如用于商业用途,请联系技术所有人。
