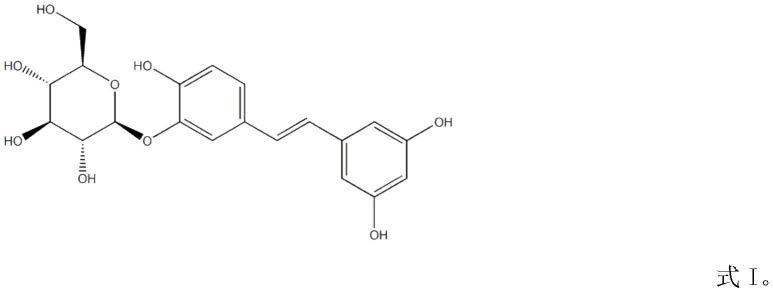
reblastatin在制备治疗慢性惊厥的药物中的用途
技术领域
1.本发明属于生物技术领域,具体涉及reblastatin在制备治疗慢性惊厥的药物中的用途。
背景技术:
2.慢性惊厥是神经元同步化异常放电所导致的一种慢性疾病,目前世界各地大约有5000万人患有慢性惊厥。我国的慢性惊厥发病率为7
‰
,约600万人,每年新增患者40万人。目前慢性惊厥已成为神经科常见病之一,以伤残调整生命年(disability-adjusted life year,daly)统计排名第五。颞叶慢性惊厥是一种最常见的药物难治性慢性惊厥,患者在正确服用足量的抗慢性惊厥药物后仍不能起到满意的治疗效果,往往只能通过手术切除致癫灶的方法控制慢性惊厥发作。药物难治性慢性惊厥给社会和家庭带来的医疗、经济负担远远高于一般的慢性惊厥综合征。因此,阐明颞叶慢性惊厥等难治性慢性惊厥患者的发病机制、开发新型有效的抗慢性惊厥药物靶点和治疗方法,将为患者提供非手术治疗选择,填补难治性慢性惊厥的治疗缺口。
技术实现要素:
3.本发明的目的是提供一种新的预防或治疗慢性惊厥的方法,为实现该目的,本发明采用了如下技术方案:
4.本发明一方面提供了一种天然产物在制备预防或治疗慢性惊厥的药物中的应用,所述的天然产物为reblastatin。
5.本发明中所述的“预防”表示防止有患病风险的对象中的疾病的出现或者已消失的疾病的复发。
6.术语“治疗”是指在显著程度上改善本文提及的疾病或病症或伴随其的症状。
7.作为一种实施方式,所述的reblastatin能够提高细胞中glt-1的表达水平。
8.术语“表达的水平”或“表达水平”通常可互换使用,且一般指生物学样品中多核苷酸、mrna或氨基酸产物或蛋白质的量。“表达”一般指基因所编码的信息转换成细胞中存在的和运行的结构的过程。因此,依照本发明,基因的“表达”可以指转录成多核苷酸、翻译成蛋白质、或甚至蛋白质的翻译后修饰。转录得到的多核苷酸的、翻译得到的蛋白质的、或翻译后修饰得到的蛋白质的片段也应视为表达的,无论它们是源自通过可变剪接生成的转录物或经过降解的转录物,或者是源自蛋白质的翻译后加工(例如通过蛋白水解)。
9.作为一种更为优选的实施方式,所述的细胞为原代星形胶质细胞。
10.作为一种实施方式,所述的reblastatin能够缓解脑组织星形胶质细胞异常增生。
11.作为一种实施方式,所述的药物的剂型包括片剂、胶囊、滴丸、气雾剂、丸剂、粉剂、溶液剂、混悬剂、乳剂、颗粒剂、脂质体、透皮剂、口含片、栓剂、冻干粉针剂。
12.本发明另一方面提供了一种用于预防或治疗慢性惊厥的药物组合物,所述的药物组合物包含reblastatin。
13.作为一种实施方式,所述的药物组合物还包含药学上可接受的缓冲液、载体或赋形剂。
14.作为一种实施方式,所述的缓冲液包括trizma、bicine、tricine、mops、mopso、mobs、tris、hepes、hepbs、mes、磷酸盐、碳酸盐、乙酸盐、柠檬酸盐、乙醇酸盐(glycolate)、乳酸盐、硼酸盐、aces、ada、酒石酸盐、amp、ampd、ampso、bes、cabs、卡可酸盐(cacodylate)、ches、dipso、epps、乙醇胺、甘氨酸、heppso、咪唑、咪唑乳酸、pipes、ssc、sspe、popso、taps、tabs、tapso和tes
15.作为一种实施方式,所述的载体包括抗微生物剂、等渗试剂、抗氧化剂、局部麻醉剂、悬浮剂、分散剂、乳化剂、螯合剂、增稠剂或增溶剂。
16.作为一种实施方式,所述的赋形剂包括碳水化合物、聚合物、脂质或矿物。
17.本发明的药物组合物包括适用于经口、经鼻、局部(包括口腔和舌下)、经直肠、经阴道和/或胃肠外给予的药物组合物。组合物可以方便地以单位剂量形式存在,并且可以通过制药领域熟知的任何方法制备。可与载体材料组合产生单一剂型的活性成分的量将根据被治疗的宿主以及特定的给予方式而变化。可与载体材料组合产生单一剂型的活性成分的量通常为产生治疗效果的reblastatin的量。通常,在100%中,该量的范围将为约1%至约90%的活性成分,优选约5%至约70%,最优选约10%至约30%。制备这些组合物的方法包括将reblastatin与载体和任选的一种或多种辅助成分结合的步骤。通常,药物组合物可通过将reblastatin与液体载体或细分固体载体或两者均匀紧密结合,然后在必要时成型产品而制备。适合于口服给予的药物组合物可以是胶囊剂、扁囊剂、香囊剂、丸剂、片剂、锭剂(使用矫味基料,通常为蔗糖和阿拉伯胶或黄蓍胶)、散剂、颗粒剂、或水性或非水性液体中的溶液剂或混悬剂、或水包油或油包水液体乳剂、或酏剂或糖浆剂、或含片剂(使用惰性基质,例如明胶和甘油、或蔗糖和阿拉伯胶)和/或漱口等形式,每种形式均含有预定量的reblastatin作为活性成分。reblastatin也可以以蜜丸剂、冲剂或糊剂的形式给予。
18.药物组合物会以药学有效剂量对患者施用。“药学有效剂量”意指就其施用所针对的状况而言足以产生期望的效果的剂量。精确的剂量取决于化合物的活性、施用方式、病症的性质和严重性、患者的年龄和体重,可能需要不同剂量。可以通过以个别剂量单位(否则,几个更小的剂量单位)形式的单次施用和还通过特定时间间隔的细分剂量的多次施用来实施剂量施用。
19.本发明还提供了一种非治疗目的提高细胞的谷氨酸盐摄取能力的方法,所述的方法包括向细胞施用reblastatin。
20.作为一种实施方式,所述的细胞为原代星形胶质细胞。
21.相对于现有技术,本发明具有的优点和有益效果:
22.本发明首次发现reblastatin对慢性惊厥具有显著的治疗效果,本发明通过体内实验验证了reblastatin处理后,小鼠慢性惊厥模型海马星形胶质细胞异常增生得到有效缓解。本发明为慢性惊厥的临床治疗提供了新方法,具有很好的应用前景。
附图说明
23.图1为蛋白免疫印迹检测hsp90、hsp70、glt-1、actin水平的实验结果;
24.图2为hsp90蛋白标记实验加样顺序示意图;
25.图3为微量热泳动实验检测reblastatin(z-r)与hsp90亲和力的实验结果;
26.图4为微量热泳动实验检测geldanamycin(ga)与hsp90亲和力的实验结果;
27.图5为微量热泳动实验检测17aag与hsp90亲和力的实验结果;
28.图6为经不同药物处理后原代星形胶质细胞摄取谷氨酸能力的检测结果;
29.图7为293t细胞毒性实验结果;
30.图8为hepg2细胞毒性实验结果;
31.图9为c57小鼠腹腔注射z-r取海马组织提取蛋白western blot检测glt-1水平的实验结果;
32.图10为c57小鼠腹腔注射z-r取海马组织提取蛋白western blot检测glt-1水平的统计图;
33.图11为c57小鼠慢性惊厥模型腹腔注射z-r取海马组织提取蛋白western blot检测glt-1水平的实验结果;
34.图12为c57小鼠慢性惊厥模型腹腔注射z-r取海马组织提取蛋白western blot检测glt-1水平的统计图;
35.图13为c57小鼠慢性惊厥模型脑电结果图;
36.图14为z-r组与dmso组腹腔注射给药前后慢性惊厥发作频率变化结果;
37.图15为各小鼠慢性惊厥模型给药后慢性惊厥发作频率相对于给药前比值;
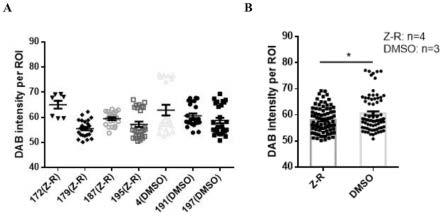
38.图16为z-r处理后c57小鼠慢性惊厥模型海马星形胶质细胞异常增生情况结果图,其中,图a为免疫荧光标记c57小鼠慢性惊厥模型脑组织星形胶质细胞特异性表达蛋白marker gfap,随机框选海马所在区域检测其荧光强度,对比各c57小鼠慢性惊厥模型海马区域星形胶质细胞形态及数量的结果,图b为集中同一处理组所有框选海马区域荧光强度,对z-r组与dmso组整体荧光强度进行统计分析,对比不同处理对c57小鼠慢性惊厥模型海马区域星形胶质细胞形态及数量影响的结果;
39.图17为z-r处理后c57小鼠慢性惊厥模型海马星形胶质细胞异常增生情况结果图,其中,图a为免疫组织化学标记c57小鼠慢性惊厥模型脑组织星形胶质细胞特异性表达蛋白marker gfap,随机框选海马所在区域检测其荧光强度,对比各c57小鼠慢性惊厥模型海马区域星形胶质细胞形态及数量的结果,图b为集中同一处理组所有框选海马区域荧光强度,对z-r组与dmso组整体荧光强度进行统计分析,对比不同处理对c57小鼠慢性惊厥模型海马区域星形胶质细胞形态及数量影响。
具体实施方式
40.下面结合附图和实施例对本发明作进一步详细的说明。以下实施例仅用于说明本发明而不用于限制本发明的范围。实施例中未注明具体条件的实验方法,通常按照常规条件,或按照制造厂商所建议的条件。
41.实施例1低浓度reblastatin(z-r)/geldanamycin(ga)/tanespimycin(17-aag)处理24h提高原代星形胶质细胞glt-1水平
42.1、实验材料
43.c57乳鼠(中国,斯贝福,1日龄)、cellytic cell lysis reagent裂解液(美国,sigma-aldrich,c2978-250ml)、100x cocktail(中国,bimake,b14001)、β-巯基乙醇(美国,
sigma-aldrich,m3148-25ml)、5x蛋白loading buffer、恒温金属浴(美国,thermo fisher scientific,gp10)、甘油(vwr life science,0854-1l)、tris(中国,生工,a501492-0005)、hcl(中国,国药集团化学试剂有限公司,10011008)、sds(美国,sigma-aldrich,74255-250g)、溴酚蓝(美国,sigma-aldrich,114391-5g)、电泳仪(中国,tanon,eps 300)、微型垂直电泳槽(中国,tanon,ve180)、转移电泳槽(中国,tanon,ve186)、体视显微镜(德国,zeiss,37081)、恒温二氧化碳培养箱(美国,thermo fisher scientific,150i)、精细镊、眼科剪、10cm培养皿、12孔板、50ml离心管、15ml离心管、移液管、注射器、dmem(中国,中科迈晨,cm15019)、penicillin-streptomycin(中国,中科迈晨,cc004)、pbs(中国,中科迈晨,cc008)、fbs(美国,sigma-aldrich,f8687-500ml)、poly-d-lysine hydrobromide(美国,sigma-aldrich,p6407-5mg)、dmso(美国,sigma-aldrich,d2650-100ml)、胰酶trypsin-edta 0.25%(中国,中科迈晨,cc012)、geldanamycin(中国,selleck,s2713)、tanespimycin(中国,selleck,s1141)、reblastatin(中国,药物所合成)、蛋白质常规分子量标记(美国,proteintech,pl00001)、硝酸纤维素膜(美国,pall corporation,66485)、glt-1(美国,santa cruz,sc-365634)、hsp90(美国,proteintech,13171-1-ap)、actin(美国,cst,4970s)、hsp70(美国,proteintech,10995-1-ap)、goat anti-mouse igg(h l)secondary antibody(美国,invitrogen,31430)、hrp-conjugated affinipure goat anti-rabbit igg(h l)(美国,proteintech,sa00001-2)、ecl化学发光底物(中国,tanon,180-5001)、g-30定影浓缩液(中国,乐凯,ctgg30332)、g-30显影浓缩液(中国,乐凯,ctgg30313)、医用x射线胶片(中国,锐珂医疗器材有限公司,6535876);
44.5ml 5x蛋白loading buffer配方:
45.表1 5x蛋白loading buffer配方
[0046][0047]
1m tris-hcl(ph 6.8)将12.11g tris-base溶于60ml ddh2o中,完全溶解后用浓盐酸调至ph=6.8,后加入ddh2o定容至100ml;
[0048]
1.5m tris-hcl(ph 8.8)将18.125g tris-base溶于60ml ddh2o中,完全溶解后用浓盐酸调至ph=8.8,后加入ddh2o定容至100ml;
[0049]
10
×
runningbuffer基础液(1000ml体系)称取144g甘氨酸(glycine)和30g tris-base溶于800ml ddh2o中,完全溶解后定溶至1000ml;
[0050]1×
running buffer(电泳液):在895ml ddh2o中加入100ml 10
×
running buffer
(基础液)及5ml 20%sds,配成1000ml电泳液;
[0051]1×
转膜液:在750ml ddh2o中加入100ml 10
×
running buffer(基础液)及150ml甲醇,配成1000ml转膜液;
[0052]
10
×
tbs(1000ml体系)称取12.1g tris-base和87.6g nacl溶于800ml ddh2o中,完全溶解后将ph调至7.6,而后定容至1000ml;
[0053]1×
tbst 900ml ddh2o中加入100ml 10
×
tbs,1ml tween-20,混匀后使用。
[0054]
2、实验方法
[0055]
分离培养原代星形胶质细胞
[0056]
实验前45min细胞间准备工作:dmem完全培养皿、移液管、15ml离心管、注射器、双蒸水(以上照紫外消毒)、pbs、dmem完全培养基(以上37℃温育)、penicillin-streptomycin、pdl
[0057]
实验前15min时刻细胞间准备工作:用h2o 1:50稀释pdl(原瓶溶解好)包被培养皿(首次使用37℃15min即可,第二次使用可延长至30min),待培养皿包被好用双蒸水洗3次后吸干,取15ml离心管加入10ml pbs及200ul双抗配制含2%双抗pbs溶液,带出细胞间用于盛放剥好的脑组织。
[0058]
整理试验台、备冰、三支50ml离心管编号123,其中1加75%乙醇、2和3装pbs、10ml培养皿、体视显微镜、酒精喷洗擦拭工具,其中解剖工具需要酒精灯消毒;
[0059]
酒精离心管浸泡乳鼠消毒,管2pbs浸没处死小鼠,管3pbs清洗一次,转入含有pbs培养皿中;
[0060]
从颈部剪断乳鼠头,沿中间骨缝将头骨剪开,拨开头取出大脑;
[0061]
体视显微镜下,将脑组织分成左右两个半球,掐去嗅球,从此处剥离血膜,翻转后血膜连接处即为海马,剥离海马等脑干组织仅剩余大脑皮层,将其转至混合双抗pbs离心管中,可以剥好多个脑组织一起处理;
[0062]
进入细胞间,pdl包被各皿用培养基润洗,将原pbs倒去多半,剩余pbs用于悬起大脑皮层并倒入培养皿中,吸去多余pbs后,再加入新pbs清洗3次,最后一次尽量将pbs吸干净;
[0063]
加入2ml培养基,用枪头反复吹吸50次左右使脑组织碎裂至无明显块状结构,然后换用注射器,反复吹吸20次左右至溶液颜色均一;
[0064]
将细胞悬液转移至15ml离心管中,800rpm离心5min使细胞沉降至管底;
[0065]
弃去上清培养基,重新加入2ml培养基,将细胞吹吸均匀,各皿加入10ml含20%fbs的dmem,按3个脑组织/皿将细胞分置pdl包被各皿;
[0066]“十”字或者“8”字摇晃使细胞均匀分布于培养皿中,放入培养箱中,再次摇匀细胞即可;
[0067]
第1d后观察细胞生长状况,pbs清洗3次,换液;
[0068]
第3d后吹去表面死亡神经元,pbs清洗3次,换液;
[0069]
培养至细胞长满12孔板;
[0070]
化合物处理星形胶质细胞
[0071]
取长满10cm皿原代星形胶质细胞,弃培养基后pbs洗3次;
[0072]
取1ml胰酶消化细胞,37℃消化3min,每隔1min摇匀一次;
[0073]
弃胰酶,加入2ml完全培养基吹下细胞;
[0074]
800rpm离心3min;
[0075]
弃上清,取3ml培养基重悬细胞,将细胞按照1:3接种于12孔板中;
[0076]
培养至细胞长满12孔板,以终浓度2、4、8、16、32、50、200、1000、5000、20000nmol/l的geldanamycin(ga)、17aag、reblastatin(z-r)处理细胞24h;
[0077]
裂解细胞提蛋白进行western blot
[0078]
pbs洗各孔星形胶质细胞3次;
[0079]
各孔加入120ul含cocktail细胞裂解液,冰浴摇晃至充分裂解细胞;
[0080]
4℃12000rpm离心细胞裂解液10min;
[0081]
离心后各样品取80ul上清,加入20ul 5x蛋白loading buffer;
[0082]
95℃加热变性5min;
[0083]
配制10%分离胶,5%浓缩胶;
[0084]
各孔加入10ul充分混匀蛋白样品,设置160v恒定电压电泳60min;
[0085]
设定156v恒定电压持续电泳60min;
[0086]
设定300ma恒定电流转膜100min;
[0087]
转膜结束后取硝酸纤维素膜根据目的蛋白条带裁剪;
[0088]
tbst中加入奶粉配制5%封闭液孵育60min;
[0089]
用封闭液配制一抗,置于4℃冰箱过夜孵育一抗配制如下:
[0090]
表2一抗配制
[0091][0092]
取出硝酸纤维膜,tbst洗3
×
5min;
[0093]
根据一抗来源,以封闭液配二抗(1:5000),孵育60min;
[0094]
tbst洗3
×
5min,吸干膜上tbst,留待显色;
[0095]
配制发光液;
[0096]
发光液孵育1min;
[0097]
感光胶片感光显影。
[0098]
3、实验结果
[0099]
如图1所示,分离培养乳鼠星形胶质细胞,2、4、8、16、32、50、200、1000、5000、20000nmol/l geldanamycin、17aag、reblastatin处理星形胶质细胞24h,裂解细胞提取蛋白,蛋白免疫印迹检测hsp90、hsp70、glt-1、actin水平。较大范围浓度geldanamycin、17aag、ipi-504、reblastatin可提高原代星形胶质细胞glt-1水平。
[0100]
实施例2 z-r与hsp90亲和力显著大于ga/17-aag
[0101]
1、实验材料
[0102]
his-tag hsp90(美国,abcam,ab48801)、monolith capillaries(德国,nanotemper,mo-k022)、his-tag labeling kit red-tris-nta 2nd generation(德国,nanotemper,mo-l018)、pcr tube strips(美国,merk,axypcr0208c)、monolith(德国,nanotemper,monolithnt.115)、tycho nt.6(德国,nanotemper,ty-002)、dmso(美国,sigma-aldrich,d2650-100ml)、pbs-t(自行准备)、ddh2o、1.5ml ep管、geldanamycin(中国,selleck,s2713)、tanespimycin(中国,selleck,s1141)、reblastatin(中国,药物所合成);
[0103]
2、实验方法
[0104]
hsp90蛋白标记实验
[0105]
在5x pbs-t小瓶中加入8.0ml ddh2o稀释为1x pbs-t;
[0106]
加入25μl pbs-t将染料稀释为5μm;
[0107]
取2μl染料(5μm)与198μl pbs-t混匀,得到200μl染料(50nm);
[0108]
准备30μl his-tagged蛋白(4μm,用pbs-t稀释);
[0109]
向2-16号pcr管中分别加入10μl pbs-t;
[0110]
向1号pcr管中加入20μl his-tagged蛋白(4μm);
[0111]
从1号管中取10μl ligand(his-tagged蛋白)加入2号管中,用移液器反复吹打混匀后,取10μl加入3号管中混匀,之后按照同样的方法完成4-16号管的稀释。最后从16号管中弃去多余的10μl ligand;加样顺序如图2所示。
[0112]
向1-16号管中各加入10μl染料(50nm)并用移液器充分混匀;
[0113]
室温孵育30分钟;
[0114]
用毛细管吸取样品后上机检测,仪器设置为40%led/excitation power及medium mst power(nt.control软件中设置为40%mst power);
[0115]
使用mo.control或mo.affinity analysis软件,通过kd拟合模式计算kd。
[0116]
hsp90与z-r/ga/17-aag互作检测
[0117]
准备pbst:在5x pbs-t小瓶中加入8ml ddh2o稀释为1x pbst;
[0118]
根据实验需要配制含2%dmso的pbst;
[0119]
加入25ul pbst将染料稀释为5um,根据实验需要将5um red蛋白染料母液稀释为100nm red蛋白染料;
[0120]
根据实验需要将11.49um hsp90蛋白母液稀释为200nm hsp90蛋白:
[0121]
将配制好100nm red蛋白染料与200nm hsp90蛋白等体积混匀,并室温孵育30min;
[0122]
将样品于4℃14 000g离心15min,取上清至新的ep管中;
[0123]
根据实验需要对z-r/ga/17-aag进行稀释;
[0124]
准备20ul pbst dmso(2%)buffer稀释的z-r/ga/17-aag分别加入对应的1号pcr管;
[0125]
每组实验中,向其他15个pcr管中各加入10ul pbst dmso(2%)buffer,依次完成梯度稀释,最后一管弃去10ul;
[0126]
准备1800ul pbst稀释的hsp90-red(20nm);
[0127]
每组实验中,向16个pcr管中各加入10ul hsp90-red并混匀;
[0128]
使用毛细管吸取样品并上机检测。
[0129]
3、实验结果
[0130]
如图3-5所示,微量热泳动结果显示reblastatin(z-r)与hsp90亲和力远高于geldanamycin(ga)以及17aag。
[0131]
经微量热泳动实验检测,在pbst 2%dmso环境体系中,reblastatin与hsp90之间kd值为2.3*10-9mol/l,geldanamycin与hsp90之间kd值为2.4*10-7mol/l,17aag与hsp90之间kd值为2.0*10-4mol/l。
[0132]
实施例3 z-r提升原代星形胶质细胞谷氨酸盐摄取能力显著优于ga/17-aag
[0133]
1、实验材料
[0134]
c57乳鼠(中国,斯贝福,1日龄)、谷氨酸检测试剂盒(美国,cell biolabs inc,sta-674)、costar assay plate(美国,corning,3925)、电热恒温培养箱(中国,上海一恒科学仪器有限公司,dhp)、体视显微镜(德国,zeiss,37081)、恒温二氧化碳培养箱(美国,thermo fisher scientific,150i)、精细镊、眼科剪、10cm培养皿、12孔板、50ml离心管、15ml离心管、移液管、注射器、dmem(中国,中科迈晨,cm15019)、penicillin-streptomycin(中国,中科迈晨,cc004)、fbs(美国,sigma-aldrich,f8687-500ml)、poly-d-lysine hydrobromide(美国,sigma-aldrich,p6407-5mg)、无谷氨酸盐dmem(中国,中科迈晨,cm15018)、胰酶trypsin-edta0.25%(中国,中科迈晨,cc012)、10cm皿、多功能酶标仪flexstation3(美国,molecular devices,86783)、l-glutamic acid(美国,sigma-aldrich,g8415-100g)、geldanamycin(中国,selleck,s2713)、tanespimycin(中国,selleck,s1141)、reblastatin(中国,药物所合成)、dmso(美国,sigma-aldrich,d2650-100ml);
[0135]
2、实验方法
[0136]
分离培养原代星形胶质细胞,方法同实验一;
[0137]
待原代星形胶质细胞长满12孔板各孔,按照100nm的终浓度加入z-r/ga/17-aag处理36h;
[0138]
将培养基换为无谷氨酸盐的dmem,处理12h以降低细胞内谷氨酸盐水平;
[0139]
称取l谷氨酸,溶于ddh2o配制母液;
[0140]
换新的无谷氨酸盐dmem,按终浓度20um加入谷氨酸混匀;
[0141]
于20min、40min、80min时刻取细胞培养上清;
[0142]
4℃10 000rpm离心5min,去除不溶性颗粒,取上清稀释100倍留待使用;
[0143]
准备检测试剂:
[0144]
1x assay buffer:去离子水稀释10x缓冲液溶液,搅拌或涡旋至均匀;
[0145]
表3 reaction mix配制
[0146]
[0147][0148]
加50ul样品及空白对照到costar assay plate;
[0149]
加50ul reaction mix到各孔,完全混匀各孔,37℃避光孵育30min;
[0150]
读板,激发光550nm,发射光590nm;
[0151]
根据标曲计算各样品谷氨酸盐浓度。
[0152]
3、实验结果
[0153]
如图6所示,100nmol/l z-r处理显著提升原代星形胶质细胞摄取谷氨酸能力。
[0154]
dmso、100nmol/l 17aag、100nmol/l reblastatin分别处理星形胶质细胞36h,无谷氨酸盐培养基培养12h培养,再将星胶培养置于20um谷氨酸盐处理液中,20、40、80min时刻取细胞培养上清检测谷氨酸盐浓度。
[0155]
实施例4 z-r处理293t/hepg2细胞毒性作用弱于/ga/17-aag
[0156]
1、实验材料
[0157]
恒温二氧化碳培养箱(美国,thermo fisher scientific,150i)、胰酶trypsin-edta0.25%(中国,中科迈晨,cc012)、penicillin-streptomycin(中国,中科迈晨,cc004)、fbs(美国,sigma-aldrich,f8687-500ml)、pbs(中国,中科迈晨,cc008)、dmso(美国,sigma-aldrich,d2650-100ml)、geldanamycin(中国,selleck,s2713)、tanespimycin(中国,selleck,s1141)、reblastatin(中国,药物所合成)、293t、hepg2、96孔板、多通道可调移液器(中国,大龙兴创,ye203am0135463)、cell counting kit-8(美国,mce,hy-k0301)、多功能微孔板酶标仪synergyh1(美国,biotek,86780);
[0158]
2、实验方法
[0159]
293t及hepg2培养及铺板
[0160]
培养293t及hepg2,取对数生长期细胞,pbs洗3次;
[0161]
0.25%胰酶消化细胞,10%fbs dmem培养基终止消化;
[0162]
800rpm离心3min沉淀细胞,10%fbs dmem培养基重悬细胞并调整细胞浓度至3*104个/ml;
[0163]
按每孔100ul细胞悬液将细胞接种于96孔培养板内,37℃5%co2培养;
[0164]
z-r/ga/17-aag处理293t及hepg2检测细胞活性
[0165]
培养293t及hepg224h;
[0166]
dmso配制浓度为20000um、8000um、4000um、2000um、400um、200um、40um、20um、4um、
2um化合物母液;
[0167]
将母液稀释400倍溶于10%fbs dmem完全培养基中,配成含50000nm、20000nm、10000nm、5000nm、1000nm、500nm、100nm、50nm、10num、5nm化合物工作液培养基及仅含dmso溶剂的培养基;
[0168]
将接种293t及hepg296孔板培养基弃去,每孔加入100ul化合物工作液培养基,设置3个复孔;
[0169]
37℃5%co2培养24h、48h及72h;
[0170]
cck-8检测z-r/ga/17-aag处理各细胞活性
[0171]
对z-r/ga/17-aag处理293t及hepg2达24h、48h及72h分别检测;
[0172]
按每100ul培养基加入10ul cck-8比例配制cck-8检测溶液;
[0173]
弃去培养293t及hepg224h 96孔板中培养基,向每孔加入100μl含cck-8检测溶液;
[0174]
37℃培养箱内孵育2h;
[0175]
多功能微孔板酶标仪synergyh1设定450nm激发光测定各细胞培养孔吸光度;
[0176]
统计个组数据,利用prism计算各化合物处理组ic
50
数值;
[0177]
3、实验结果
[0178]
hepg2细胞毒性实验
[0179]
如图7所示,293t细胞毒性实验初步验证,相同条件下处理293t细胞,处理时间24h,z-r细胞毒性弱于17aag、ga;处理时间48h,z-r细胞毒性弱于ga;处理时间72h,z-r细胞毒性弱于ga。
[0180]
如图8所示,hepg2细胞毒性实验初步验证,相同条件下处理hepg2细胞,处理24h,z-r毒性弱于17aag;处理48h,z-r毒性弱于17aag、ga;处理72h,z-r毒性弱于17aag、ga。
[0181]
实施例5z-r处理提升正常c57小鼠海马组织glt-1水平
[0182]
1、实验材料
[0183]
c57小鼠(中国,斯贝福,8周龄)、注射器、reblastatin(中国,药物所合成)、超声波细胞粉碎机(中国,宁波新芝生物科技股份有限公司,jy92-iin)、杜氏匀浆器(美国,sigma-aldrich,p1110-1ea)、β-巯基乙醇(美国,sigma-aldrich,m3148-25ml)、5x蛋白loading buffer、恒温金属浴(美国,thermo fisher scientific,gp10)、甘油(vwr life science,0854-1l)、tris(中国,生工,a501492-0005)、hcl(中国,国药集团化学试剂有限公司,10011008)、sds(美国,sigma-aldrich,74255-250g)、溴酚蓝(美国,sigma-aldrich,114391-5g)、电泳仪(中国,tanon,)、微型垂直电泳槽(中国,tanon,ve180)、转移电泳槽(中国,tanon,ve186)、glt-1(美国,proteintech,22515-1-ap)、actin(美国,proteintech,60008-1-ig)、dmso(美国,sigma-aldrich,d2650-100ml);
[0184]
2、实验方法
[0185]
c57小鼠腹腔注射z-r
[0186]
c57小鼠适应一周;
[0187]
各小鼠称重,按体重、给药剂量计算各小鼠化合物用量,给药剂量设计为2、10、20mg/kg;
[0188]
将z-r溶于dmso配制各小鼠注射用药,给药总体积为50ul,连续3次,每次间隔1天腹腔注射给药,第6天取海马组织;
[0189]
c57小鼠海马组织提取蛋白
[0190]
给药结束后取小鼠海马组织,4%sds裂解液配制;
[0191]
表4 4%sds裂解液配制
[0192][0193]
准备1.5ml ep管,每管预先准备350ul 4%sds裂解液;
[0194]
取小鼠脑组织;
[0195]
准备杜氏匀浆器,取废余脑组织进行预研磨;
[0196]
取海马组织加入匀浆器,加350ul pbs,轻轻研磨以减少泡沫产生;
[0197]
将研磨匀浆取出置于预先准备ep管中,
[0198]
超声波细胞粉碎机进行超声,超声功率7%,超声5s,暂停2s,重复超声2次,冰浴降温;
[0199]
室温下13000rpm离心10min;
[0200]
将离心后上清转置新ep管中;
[0201]
取出使用量组织裂解液,加入5x蛋白loadingbuffer,配制方法同实验一;
[0202]
95℃加热变性5min;
[0203]
western blot检测各小鼠海马组织glt-1水平
[0204]
western blot同实验一;
[0205]
表5抗体配制
[0206][0207]
3、实验结果
[0208]
如图9-10所示,c57小鼠腹腔注射z-r取海马组织提取蛋白western blot检测glt-1水平。
[0209]
western blot结果显示2、10mg/kg剂量z-r可显著提高c57小鼠海马组织glt-1水平,25mg/kg剂量则降低c57小鼠海马组织glt-1水平。
[0210]
实施例6 z-r处理提升c57小鼠慢性惊厥模型海马组织glt-1水平
[0211]
1、实验材料
[0212]
c57小鼠(中国,斯贝福,8周龄)、kainic acid(美国,sigma-aldrich,420318-10mg)、脑立体定位仪(中国,瑞沃德生命科技,e03275-003)、水合氯醛(中国,生工,
a600288-0250)、pbs(中国,中科迈晨,cc008)、reblastatin(中国,药物所合成)、注射器、reblastatin(中国,药物所合成)、超声波细胞粉碎机(中国,宁波新芝生物科技股份有限公司,jy92-iin)、杜氏匀浆器(美国,sigma-aldrich,p1110-1ea)、β-巯基乙醇(sigma-aldrich,m3148-25ml)、5x蛋白loading buffer、恒温金属浴(美国,thermo fisher scientific,gp10)、甘油(vwr life science,0854-1l)、tris(中国,生工,a501492-0005)、hcl(中国,国药集团化学试剂有限公司,10011008)、sds(美国,sigma-aldrich,74255-250g)、溴酚蓝(美国,sigma-aldrich,114391-5g)电泳仪(中国,tanon,)、微型垂直电泳槽(中国,tanon,ve180)、转移电泳槽(中国,tanon,ve186)、glt-1(美国,proteintech,22515-1-ap)、actin(美国,proteintech,60008-1-ig)dmso(美国,sigma-aldrich,d2650-100ml);
[0213]
2、实验方法
[0214]
海马注射kainic acid致c57小鼠慢性惊厥模型制备
[0215]
c57小鼠适应一周;
[0216]
pbs配制5%水合氯醛,按照1g体重0.5ug水合氯醛进行腹腔注射,将小鼠麻醉;
[0217]
加入pbs,按1ug/ul配制kainic acid;
[0218]
待小鼠完全麻醉后,将其固定于脑立体定位仪,备皮,每只小鼠右侧海马注射230nl kainic acid,以小鼠前囟门为原点,注射坐标为(x-0.2cm,y-0.2cm,z-0.18cm);
[0219]
缝合后将小鼠置于37℃复温,待其恢复清醒后收起,饲养4周建成慢性惊厥小鼠模型;
[0220]
c57慢性惊厥小鼠腹腔注射z-r
[0221]
各慢性惊厥小鼠称重,按体重、给药剂量计算各小鼠化合物用量,给药剂量设计为0.5、1、2、5、10mg/kg;
[0222]
将z-r溶于dmso配制各小鼠注射用药,给药总体积为50ul,连续3次,每次间隔1天腹腔注射给药,第6天取海马组织;
[0223]
c57慢性惊厥小鼠海马组织提取蛋白
[0224]
实验方法同实施例5
[0225]
western blot检测各慢性惊厥小鼠海马组织glt-1水平
[0226]
实验方法同实施例5
[0227]
3、实验结果
[0228]
如图11-12所示,c57小鼠慢性惊厥模型腹腔注射z-r取海马组织提取蛋白western blot检测glt-1水平。
[0229]
western blot结果显示1、2、5mg/kg z-r可显著提高c57小鼠海马组织glt-1水平,10mg/kg z-r对c57小鼠慢性惊厥模型海马组织glt-1水平无显著影响。
[0230]
实施例7 c57慢性惊厥小鼠模型腹腔注射z-r显著抑制慢性惊厥发作
[0231]
1、实验材料
[0232]
c57小鼠(中国,斯贝福,8周龄)、kainic acid(美国,sigma-aldrich,420318-10mg)、脑立体定位仪(中国,瑞沃德生命科技,e03275-003)、水合氯醛(中国,生工,a600288-0250)、pbs(中国,中科迈晨,cc008)、reblastatin(中国,药物所合成)、注射器、reblastatin(中国,药物所合成)、dmso(美国,sigma-aldrich,d2650-100ml)、脑电放大器(中国,广州安迪电子科技有限公司,ja-201e)、义齿基托树脂(中国,上海新世纪齿科材料
有限公司,ii型i类)、造牙树脂(中国,上海新世纪齿科材料有限公司,ii型自凝型粉剂)、医用一次性针电极绞线(中国,西安富德医疗电子有限公司,ne-t-2500/13/0.4);
[0233]
2、实验方法
[0234]
海马注射kainic acid致c57小鼠慢性惊厥模型制备
[0235]
c57小鼠慢性惊厥模型制备同实验六;
[0236]
c57小鼠慢性惊厥模型安装电极帽
[0237]
5%水合氯醛麻醉小鼠慢性惊厥模型;
[0238]
将麻醉后小鼠慢性惊厥模型固定于脑立体定位仪,备皮,于颅顶剪开头部皮肤,剪开直径约为0.6cm的圆形区域,并清除颅顶骨相应区域皮肤及相应皮下组织,充分暴露颅顶骨;
[0239]
以小鼠慢性惊厥模型前囟门为原点,坐标为(x-0.2cm,y-0.2cm)、(x 0.2cm,y 0.2cm)钻孔并安装电极;
[0240]
骨水泥固定电极;
[0241]
37℃复温至小鼠慢性惊厥模型恢复清醒,将其收回饲养2周后检测脑电;
[0242]
c57小鼠慢性惊厥模型检测脑电
[0243]
通过医用一次性针电极绞线,将c57小鼠慢性惊厥模型脑电极与脑电放大器设备连接;
[0244]
设置导联,连续记录小鼠脑电信号;
[0245]
连续记录2周,统计小鼠慢性惊厥发作情况,取慢性惊厥发作频率不低于0.5次/天的小鼠慢性惊厥模型,随机分为2组,第一组腹腔注射z-r,第二组腹腔注射溶剂dmso作为对照;
[0246]
根据前期实验结果,按4mg/kg给药剂量配制z-r,将z-r溶于dmso配制各小鼠注射用药,给药总体积为50ul,每隔1天腹腔注射1次,连续给药21天;
[0247]
统计给药前后各组小鼠慢性惊厥发作频率变化。
[0248]
3、实验结果
[0249]
图13为c57小鼠慢性惊厥模型脑电。
[0250]
其中,上图:正常状态下c57小鼠慢性惊厥模型脑电,可见较为稀疏的尖波、棘波;
[0251]
下图:慢性惊厥发作状态下c57小鼠慢性惊厥模型脑电,大量尖波、棘波密集出现,且发作结束脑电活动受到明显抑制。
[0252]
如图14-15所示,脑电结果显示腹腔注射4mg/kg剂量z-r可显著降低小鼠慢性惊厥发作频率。
[0253]
图14:z-r组与dmso组腹腔注射给药前后慢性惊厥发作频率变化,z-r组腹腔注射后慢性惊厥发作频率降低至基线水平52.4%,dmso组腹腔注射后慢性惊厥发作频率升高至基线水平153%;
[0254]
图15:各小鼠慢性惊厥模型给药后慢性惊厥发作频率相对于给药前比值,z-r组大部分比值低于1,dmso组大部分比值高于1,z-r组小鼠慢性惊厥模型给药后慢性惊厥发作频率较dmso组显著降低。
[0255]
实施例8 c57小鼠慢性惊厥模型腹腔注射z-r缓解脑组织星形胶质细胞异常增生
[0256]
1、实验材料
[0257]
石蜡切片机(德国,莱卡纤维系统有限公司,rm2235 cweu)、模块化组织包埋系统的冷台(德国,上海莱卡仪器有限公司,eg1150c)、烘片仪(德国,上海莱卡仪器有限公司,hi1220)、水浴装置(德国,上海莱卡仪器有限公司,hi1210)、粘附载玻片(中国、世泰、188105)、显微镜盖玻片(中国,世泰,10212450c)、环保透明脱蜡液(中国、中杉金桥,zli-9315)、无水乙醇(中国,天津市致远化学试剂有限公司)、gfap(美国,cell signaling technology,3670s)、高压锅(中国,浙江苏珀尔股份有限公司,as20-4.0-90)、多功能电磁炉(中国,美的,ef197)、湿盒、柠檬酸(中国,国药集团化学试剂有限公司,10007118)、柠檬酸钠(美国,sigma-aldrich,s1804-500g)、super pap pen(中国,中杉金桥,zli-9305)、bovine serum albumin(美国,sigma-aldrich,a1933-100g)、triton x-100、通用二步法试剂盒(小鼠/兔增强聚合物法检测系统)(中国,中杉金桥,pv-9000)、gfap(美国,cell signaling technology,3670s,)、donkey anti-mouse igg(h l)highly cross-adsorbed secondary antibody,alexa fluor
tm 488(美国,invitrogen,a-21202)、dapi(美国,sigma-aldrich,d9542-1mg)、leica dm6 b upright microscope(德国,leica,dm6 b)、抗荧光衰减封片剂(中国,索莱宝,s2100)、dab显色试剂盒(中国,中杉金桥,zli-9019)、一抗稀释液(中国,solarbio,a1810);
[0258]
2、实验方法
[0259]
c57小鼠慢性惊厥模型脑组织切片
[0260]
5%水合氯醛将给药后连续记录达21天c57小鼠慢性惊厥模型麻醉;
[0261]
小鼠固定于手术台,打开小鼠胸腔,剪开右心耳;
[0262]
从左心室灌入约20ml pbs,将小鼠体循环内血液清除;
[0263]
从左心室灌入约20ml 4%pfa,初步将小鼠全身组织器官固定;
[0264]
解剖小鼠颅脑,取出完整脑组织,切去小脑及嗅球,将其余脑组织置于4%pfa溶液,置于旋转摇床固定48h;
[0265]
将小鼠脑组织转移至15%蔗糖溶液,置于旋转摇床脱水24h;
[0266]
将小鼠脑组织转移至30%蔗糖溶液,置于旋转摇床脱水24h;
[0267]
石蜡包埋小鼠脑组织;
[0268]
包埋好小鼠脑组织片,切出经典海马组织后按5ul厚度进行连续切片,切片干燥后收起常温保存;
[0269]
c57小鼠慢性惊厥模型脑组织切片免疫荧光染色
[0270]
取c57小鼠慢性惊厥模型脑组织组织石蜡切片,60℃加热10min溶解组织切片石蜡;
[0271]
脱蜡液完全浸没组织切片,慢速摇晃脱蜡10min;
[0272]
组织切片重复脱蜡一次;
[0273]
100%乙醇完全浸没组织切片,慢速摇晃复水10min;
[0274]
100%乙醇复水重复一次;
[0275]
75%乙醇完全浸没组织切片,慢速摇晃复水5min;
[0276]
50%乙醇完全浸没组织切片,慢速摇晃复水5min;
[0277]
单蒸水完全浸没组织切片,慢速摇晃复水5min;
[0278]
pbs完全浸没组织切片,慢速摇晃5min;
[0279]
抗原修复,称量0.38g柠檬酸和2.4g柠檬酸钠溶于1l单蒸水,置于高压锅内,电磁炉大火加热至冒气后,小火再加热3min,放气然后等其冷却至室温;
[0280]
将片子转移至pbs中浸泡5min;
[0281]
pbs溶解bsa配制5%及1%bsa溶液,加入0.1%triton x-100;
[0282]
擦干脑组织所在载玻片周围区域,组化笔画圈;
[0283]
封闭、打孔,含0.1%triton x-100的5%bsa封闭30min;
[0284]
一抗稀释液配制gfap抗体,过夜孵育;
[0285]
取出片子,甩干一抗,pbst洗3x5min;
[0286]
1%bsa配制荧光二抗,常温孵育60min;
[0287]
1%bsa稀释dapi,染核5min;
[0288]
pbst洗3x5min,抗荧光衰减封片剂封片,leica dm6 b正置荧光显微镜拍片统计;
[0289]
统计方法:应用leica application suite x软件自带图像定量功能,对拍摄组织切片海马区域随机框选多个部位进行定量,对定量结果进行统计学分析。
[0290]
c57小鼠慢性惊厥模型脑组织切片免疫组织化学染色
[0291]
取c57小鼠慢性惊厥模型脑组织组织石蜡切片,60℃加热10min溶解组织切片石蜡;
[0292]
脱蜡液完全浸没组织切片,慢速摇晃脱蜡10min;
[0293]
组织切片重复脱蜡一次;
[0294]
100%乙醇完全浸没组织切片,慢速摇晃复水10min;
[0295]
100%乙醇复水重复一次;
[0296]
75%乙醇完全浸没组织切片,慢速摇晃复水5min;
[0297]
50%乙醇完全浸没组织切片,慢速摇晃复水5min;
[0298]
单蒸水完全浸没组织切片,慢速摇晃复水5min;
[0299]
pbs完全浸没组织切片,慢速摇晃5min;
[0300]
抗原修复,称量0.38g柠檬酸和2.4g柠檬酸钠溶于1l单蒸水,置于高压锅内,电磁炉大火加热至冒气后,小火再加热3min,放气然后等其冷却至室温;
[0301]
将片子转移至pbs中浸泡5min;
[0302]
擦干脑组织所在载玻片周围区域,组化笔画圈;
[0303]
内源性过氧化物酶阻断剂抗原修复30min,pbst洗5min;
[0304]
封闭、打孔,含0.1%triton x-100的5%bsa封闭30min;
[0305]
一抗稀释液1:2000配制gfap抗体,过夜孵育;
[0306]
取出片子,甩干一抗,pbst洗3x5min;
[0307]
反应增强液室温孵育20min;
[0308]
pbst洗3x5min;
[0309]
增强酶标山羊抗小鼠/兔igg聚合物室温孵育20min;
[0310]
pbst洗3x5min;
[0311]
dab显色2min20s;
[0312]
pbst洗3x5min,抗荧光衰减封片剂封片,leica dm6 b正置荧光显微镜拍片统计;
[0313]
统计方法:应用leica application suite x软件自带图像定量功能,对拍摄组织
切片海马区域随机框选多个部位进行定量,对定量结果进行统计学分析。
[0314]
3、实验结果
[0315]
如图16所示,免疫荧光标记gfap结果显示z-r处理后c57小鼠慢性惊厥模型海马星形胶质细胞异常增生得到有效缓解。
[0316]
图16a:免疫荧光标记c57小鼠慢性惊厥模型脑组织星形胶质细胞特异性表达蛋白marker gfap,随机框选海马所在区域检测其荧光强度,对比各c57小鼠慢性惊厥模型海马区域星形胶质细胞形态及数量。
[0317]
图16b:集中同一处理组所有框选海马区域荧光强度,对z-r组与dmso组整体荧光强度进行统计分析,对比不同处理对c57小鼠慢性惊厥模型海马区域星形胶质细胞形态及数量影响。
[0318]
如图17所示,免疫组织化学标记gfap结果显示z-r处理后c57小鼠慢性惊厥模型海马星形胶质细胞异常增生得到有效缓解。
[0319]
图17a:免疫组织化学标记c57小鼠慢性惊厥模型脑组织星形胶质细胞特异性表达蛋白marker gfap,随机框选海马所在区域检测其荧光强度,对比各c57小鼠慢性惊厥模型海马区域星形胶质细胞形态及数量。
[0320]
图17b:集中同一处理组所有框选海马区域荧光强度,对z-r组与dmso组整体荧光强度进行统计分析,对比不同处理对c57小鼠慢性惊厥模型海马区域星形胶质细胞形态及数量影响。
[0321]
上述实施例的说明只是用于理解本发明的方法及其核心思想。应当指出,对于本领域的普通技术人员来说,在不脱离本发明原理的前提下,还可以对本发明进行若干改进和修饰,这些改进和修饰也将落入本发明权利要求的保护范围内。
再多了解一些
本文用于创业者技术爱好者查询,仅供学习研究,如用于商业用途,请联系技术所有人。