1.本发明涉及医疗技术领域,特别涉及一种血清细胞外囊泡中上皮性卵巢癌肿瘤标志物的检测方法。
背景技术:
2.目前,盆腹腔检查、影像学检查以及血清肿瘤标志物血清糖类抗原125是临床上最常用的卵巢癌诊断方法,但是这些诊断措施中,盆腹腔检查和影像学检查高度依赖于医师的专业水平和检查人员的经验技能,此外,早期或非典型表现的患者由于缺乏典型的症状和体征,肿瘤部位隐匿等原因极易被漏诊,ca125是临床广泛使用的卵巢癌血清肿瘤标志物,用于卵巢癌的诊断和预后监测等,然而,ca125对早期卵巢癌的敏感性差,且在其他非肿瘤的情况下也有升高,作为卵巢癌的诊断指标其特异性不能令人满意,因此,找到新的敏感度和特异度高的卵巢癌肿瘤标志物是非常有必要的。
技术实现要素:
3.本技术的目的在于提供一种血清细胞外囊泡中上皮性卵巢癌肿瘤标志物的检测方法,以解决上述背景技术中提出的ca125是临床广泛使用的卵巢癌血清肿瘤标志物,用于卵巢癌的诊断和预后监测等,然而,ca125对早期卵巢癌的敏感性差,且在其他非肿瘤的情况下也有升高,作为卵巢癌的诊断指标其特异性不能令人满意的问题。
4.为实现上述目的,本技术提供如下技术方案:一种血清细胞外囊泡中上皮性卵巢癌肿瘤标志物的检测方法,包括以下步骤:
5.步骤一:选择一组健康对照者、一组卵巢囊腺瘤患者和一组上皮性卵巢癌患者;
6.步骤二:对患者和健康对照者提取血清样品,从患者血清中分离提取细胞外囊泡后利用tem、nta、wb和生物信息学分析对其进行鉴定;
7.步骤三:通过lc-ms/ms分析,鉴定出所有的可定量蛋白质,并筛选出组间的差异表达蛋白,并通过prm验证,roc分析得出可作为卵巢癌诊断标志物的蛋白标记物;
8.步骤四:进行单因素和多因素logistic回归分析,对蛋白标记物建立诊断模型,回归方程为logitp=2.481*fgg 8.970*muc16
–
1.709*apoa4-0.184,并判断是否具有诊断效能。
9.优选的,所述卵巢肿瘤患者为进行过卵巢肿瘤手术且有术后病理结果的患者,所述卵巢肿瘤患者在血液采集前未接受其他治疗,所述卵巢肿瘤患者没有其他器官或部位肿瘤病变,所述卵巢肿瘤患者没有其他血液疾病、感染性疾病、内分泌疾病、免疫或代谢性疾病。
10.优选的,所述血清样品均于患者入院后在空腹状态下采集,首先采集血液样本于bdvacutainer血清管中,室温下,血液静置凝固1到2小时,然后4℃冰箱过夜使血块固缩,血清析出,随后将析出的血清4℃,3000g离心10分钟,离心后的上清转移至新的eppendorf离心管中,分装保存于-80℃冰箱。
11.优选的,所述细胞外囊泡提取时,血清样品从-80℃冰箱取出,冰上融化,在4℃,12000g离心10-15分钟,离心后将上清液转移至新的离心管,0.22μm微孔滤膜过滤后用细胞外囊泡提取试剂盒qevoriginalsizeexclusioncolumn去分离提取细胞外囊泡,具体步骤如下,首先将分离柱放置在支架上,使其垂直,盖好底部的luer-slipcap,然后取下盖子,打破真空密封,取下luer-slipcap,用至少10mlpbs洗脱缓冲液冲洗柱子,盖上luer-slipcap,用移液器移去顶部的缓冲液,用移液器向分离柱中加入500μl血清样品,取下luer-slipcap,开始收集分离过滤后的样本,最开始的3ml是空隙体积,继续向分离柱中添加pbs以洗脱囊泡,最后收集空隙体积后的0.5ml液体为高纯度细胞外囊泡。
12.优选的,所述nta分析中,细胞外囊泡用pbs重悬,使用nanosightns300对重悬液体中纳米颗粒的布朗运动进行实时动态跟踪,观察并获得相应的粒径分布及浓度信息,所述tem分析中,使用透射电子显微镜,首先用pbs重悬试剂盒提取的细胞外囊泡,吸取5-10μl重悬的待观察细胞外囊泡样本滴加于电镜的专用的铜网上,室温下放置进行沉淀1-2分钟,并用滤纸吸去浮液,先用pbs进行漂洗,然后吸取磷钨酸(pta)5-10μl滴加于铜网上,沉淀并进行负染色1-2分钟,用滤纸吸去浮液,常温下干燥2分钟,上机成像,电镜下观察并记录细胞外囊泡的形态特征。
13.优选的,所述wb分析中,首先提取细胞外囊泡蛋白质,细胞外囊泡提取后放置于-80℃冰箱保存,使用时从冰箱取出,冰上溶解,避免反复冻融,向细胞外囊泡溶液中加入已配制好的ripa蛋白裂解液,冰上裂解10-15分钟,使细胞外囊泡蛋白质裂解;
14.然后测定蛋白浓度,配制bca的工作液:按照50:1的比例将bca蛋白浓度检测试剂盒中的a液和b液混合后配制成bca工作液,室温放置备用,按照每个反应孔200μl工作液准备,取一个96孔板,根据实验需求设置好标准蛋白孔和待测样品孔,将bca工作液加入到96孔板中,每孔200μl,bca蛋白浓度测定试剂盒提供的标准的蛋白液浓度为2mg/ml,用ddh2o稀释试剂盒中的标准蛋白液,配制成梯度蛋白,浓度分别为2000μg/ml,1000μg/ml,500μg/ml,250μg/ml,125μg/ml,0μg/ml,待测蛋白样品用ddh2o稀释10倍,向每孔中加入20μl的梯度蛋白液和稀释后的待测蛋白样品,混匀,37℃避光孵育30分钟,测定562nm波长下的吸光度,用标准蛋白品的浓度和吸光度od562值绘制标准曲线,计算浓度公式,根据公式计算出待测蛋白样品的浓度;
15.蛋白变性,将测好浓度的蛋白用ddh2o进行稀释,根据wb每孔50μg/20μl的上样量,计算所要加入的ddh2o和4
×
蛋白上样缓冲液,进而配制wb的上样体系,然后将配制好的wb上样体系混匀后放入100℃金属浴,加热变性10分钟,取出后立即将蛋白样品置于冰上或者于-20℃冰箱冻存备用;
16.sds-page凝胶电泳,选择玻璃板,流水冲洗,洗涤剂洗刷,洗净玻璃板表面的污渍和颗粒物,室温晾干或烤箱烘干,将玻璃板安装在制胶架上,注意使玻璃板底部平齐并密切接触制胶架上的胶条避免发生渗漏,根据待测蛋白样品的分子量大小选择合适的浓度,常用浓度分离胶具体配制方式见表2-6,中等分子量选择10%sds-page,小分子量选择12%sds-page,大分子量选择8%sds-page,分离胶配制完成后,混匀,加入玻璃板中至距离顶端2cm处,检查有无渗漏,若无渗漏加入异丙醇压平,室温静置30分钟,分离胶静置30分钟无漏胶且凝固后,弃去玻璃板间异丙醇,按配方配制浓缩胶,混匀后加在分离胶的上面,然后选择梳子,向浓缩胶内垂直插入,注意梳齿之间不能产生气泡,室温静置20分钟,待浓缩胶完
全凝固后,制胶完成,取出备用,蛋白上样:将配制好的电泳胶放置于电泳槽中,预先配制好10x电泳缓冲液,电泳时用ddh2o稀释成1x电泳缓冲液,向槽中加入1x电泳缓冲液,在缓冲液中垂直向上拔去梳子,然后用加样枪按照一定顺序向各孔中加入蛋白样品和预染的蛋白marker,电泳:打开电源,先用80v电压恒压电泳30分钟,当蛋白marker到达分离胶且条带分离清可辨时,调整电压为120v继续恒压电泳直至目的蛋白电泳到合适位置,关闭电源,结束电泳;
17.恒流湿转,材料准备:0.45μm的pvdf转印膜切成和蛋白胶块相当的大小(约6.5cmx8cm),同时裁剪相应大小的滤纸,pvdf膜浸泡于甲醇中激活,膜从不透明变为透明即说明已激活,取10x转膜缓冲液100ml,加入200ml甲醇,700mlddh2o,混匀配制成1x转膜缓冲液,预冷备用,取出电泳后的玻璃板,撬开,沿着分离胶边界切去上层胶,取出分离胶,放在预先配制好的1x转膜缓冲液中,将转膜用的塑料夹打开,海绵垫和滤纸依次叠放在夹子上,黑色面夹子滤纸上放电泳胶,白色面夹子上放活化后的pvdf膜,按照三明治顺序叠放,随后赶走pvdf膜与分离胶之间的气泡,将夹紧后的塑料夹放到转膜槽中,槽内加入预冷的1x转膜缓冲液,同时放入冷冻的冰板,将转膜槽整体放入冰盒中并加满冰,接好电源,300ma恒流转膜,根据分子量大小选择合适的转膜时间,分子量蛋白质选择2小时,小分子量蛋白质可选择1小时;
18.蛋白免疫印迹,封闭:转膜结束后,取出pvdf膜,标注好正反面及上样顺序,然后将pvdf膜放在5%bsa或5%脱脂牛奶的封闭液中,室温于摇床上低速封,一抗:封闭完成后,根据预染蛋白marker的位置将pvdf膜按照目的蛋白的大小剪出所需条带,将其放入稀释好的一抗中,4℃置摇床上孵育过夜,二抗:一抗孵育结束后,回收一抗,用tbst摇床上洗膜3遍,每次10分钟,将洗好的膜放入相对应的二抗,室温摇床上低速孵育2小时,曝光:二抗孵育结束后,用tbst摇床上洗膜3遍,每次10分钟,将ecl发光试剂盒中的a液和b液按1:1配制成发光液,将发光液均匀滴加在膜上,放入凝胶成像仪中成像闭1小时。
19.优选的,所述生物信息学分析包括go分析、kegg分析、go功能富集分析、kegg通路富集分析、蛋白质互作网络分析、数据分析。
20.优选的,所述lc-ms/ms分析中,细胞外囊泡蛋白质提取:由qev细胞外囊泡提取试剂盒从血清中提取分离的细胞外囊泡中加入蛋白酶抑制剂以及1%浓度的聚乙二醇辛基苯基醚对其蛋白质进行裂解,裂解完后bca法检测蛋白浓度;蛋白质胰酶酶解:向裂解后的蛋白质溶液中加入dtt和iam,后室温下避光孵育15分钟,随后加入胰蛋白酶进行酶解;肽段标记及高效液相色谱分级:对胰蛋白酶酶解后的蛋白样品进行标记,将tmt试剂盒中的标记试剂与蛋白样品混合并进行孵育,并对肽段进行高效液相色谱分级;lc-ms/ms分析:将经上述步骤处理标记以后的肽段上机检测(质谱平台),进行液相色谱-质谱联用(lc-ms.ms)分析;质谱数据处理及分析:对质谱平台检测得到的质谱图进行处理,并将得到的实验数据在相应的数据库中(maxquant)进行检索及分析。
21.优选的,所述蛋白质互作网络分析用于对恶性组和健康组之间的deps与恶性组和良性组之间的deps的交叉重复部分进行了蛋白质互作网络分析。
22.优选的,所述prm的实验方法为蛋白提取及浓度检测,胰酶酶解:各待测样品蛋白取等量进行酶解,加入标准蛋白,用裂解液将体积调整至一致,再加入dtt和iam,室温避光孵育15分钟。将烷基化好的样本转移至超滤管,室温12000g离心20分钟,用8m尿素置换3次,
再用置换缓冲液置换尿素3次,以1:50的比例加入胰蛋白酶,酶解过夜。室温12000g离心10分钟回收肽段,再用ddh2o回收肽段一次,合并两次肽段溶液;质谱分析:肽段溶液上机检测,数据采集模式使用数据非依赖型扫描程序,hcd碰撞池的碎裂能量设置为27。一级质谱自动增益控制设置为3e6,最大离子注入时间设置为50ms;二级质谱自动增益控制设置为1e5,最大离子注入时间设置为120ms,隔离窗口设置为1.6m/z,数据分析处理:根据实验目的设置肽段参数,分析处理数据。
23.综上,本发明的技术效果和优点:
24.本研究中关于卵巢癌血清细胞外囊泡的蛋白组学研究,提出了血清细胞外囊泡中的蛋白质分子fga,fgb,fgg,fgl1,apol1,apoa4,itih3,muc16可作为卵巢癌诊断的分子标志物,并通过prm进行了验证,此外,研究中基于血清细胞外囊泡蛋白组学结果建立的卵巢癌诊断模型在全部以及早期的卵巢癌病人中都表现出较好的诊断效能,可对临床上现有的卵巢癌诊断措施进行补充,提供一个新的卵巢癌诊断思路和策略,能够帮助实现卵巢癌的早期诊断,从而改善患者生存和预后。
附图说明
25.为了更清楚地说明本技术实施例或现有技术中的技术方案,下面将对实施例或现有技术描述中所需要使用的附图作简单地介绍,显而易见地,下面描述中的附图仅是本技术的一些实施例,对于本领域技术人员来讲,在不付出创造性劳动的前提下,还可以根据这些附图获得其他的附图。
26.图1为实验流程图;
27.图2为蛋白质谱检测流程图;
28.图3为lc-ms/ms检测过程中肽段的长度分布图;
29.图4为蛋白分子量与覆盖度的关系图;
30.图5为质谱数据的质量精度分布图;
31.图6为血清细胞外囊泡的nta鉴定图;
32.图7为血清细胞外囊泡的tem鉴定图;
33.图8为细胞外囊泡的标志性蛋白质cd63,tsg101和flotillin 1的wb检测结果图;
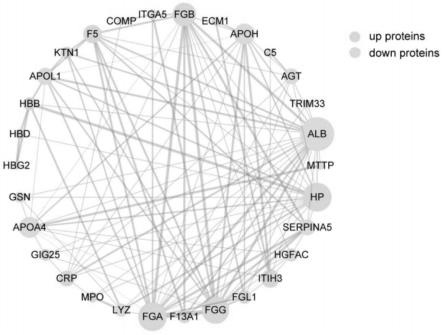
34.图9为卵巢癌血清细胞外囊泡相关deps的蛋白质互作网络图;
35.图10为prm靶向定量验证蛋白列表;
36.图11为prm靶向定量蛋白组学验证结果的蛋白表达量热图;
37.图12为prm靶向定量蛋白组学验证结果的pca模型图;
38.图13为候选肿瘤标志物到卵巢癌诊断模型构建的多级细分步骤图;
39.图14为具有卵巢癌诊断潜能的蛋白标志物的功能图;
40.图15为表达上调蛋白在不同组别血清细胞外囊泡中的表达丰度图;
41.图16为表达下调蛋白在不同组别血清细胞外囊泡中的表达丰度图;
42.图17为单因素回归分析图;
43.图18为卵巢癌的包含3个蛋白分子的诊断模型图;
44.图19为验证队列中诊断模型的roc曲线分析结果图;
45.图20为诊断模型在全部以及早期卵巢癌病人中的诊断效能图。
具体实施方式
46.下面将结合本发明实施例中的附图,对本发明实施例中的技术方案进行清楚、完整地描述,显然,所描述的实施例仅仅是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有做出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。
47.实施例:如图1所示的一种血清细胞外囊泡中上皮性卵巢癌肿瘤标志物的检测方法,包括以下步骤:
48.步骤一:纳入66例卵巢肿瘤患者,其中包括16例卵巢囊腺瘤患者和50例上皮性卵巢癌患,29名健康对照者,健康对照者均为无任何病史的健康女性;
49.步骤二:对患者和健康对照者提取血清样品,从患者血清中分离提取细胞外囊泡后利用tem、nta、wb和生物信息学分析对其进行鉴定;
50.步骤三:通过lc-ms/ms分析,鉴定到998个可定量蛋白质,并筛选出组间的差异表达蛋白,并通过prm验证,roc分析得出fga,fgb,fgg,fgl1,apol1,apoa4,itih3,muc16可作为卵巢癌诊断标志物;
51.步骤四:进行单因素和多因素logistic回归分析,建立了包含3个蛋白标记物fgg,muc16,apoa4的诊断模型,回归方程为logitp=2.481*fgg 8.970*muc16
–
1.709*apoa4-0.184,该诊断模型的在验证队列的全部卵巢癌病人中的auc为0.936(95%ci,0.888-0.984),敏感性为92.0%,特异性为82.9%,同时在早期卵巢癌病人中,该诊断模型的auc为0.820(95%ci,0.699-0.941),敏感性为71.4%,特异性为82.9%,均具有较高的诊断效能。
52.卵巢肿瘤患者为进行过卵巢肿瘤手术且有术后病理结果的患者,卵巢肿瘤患者在血液采集前未接受其他治疗,卵巢肿瘤患者没有其他器官或部位肿瘤病变,卵巢肿瘤患者没有其他血液疾病、感染性疾病、内分泌疾病、免疫或代谢性疾病。
53.血清样品均于患者入院后在空腹状态下采集,首先采集血液样本于bdvacutainer血清管中,室温下,血液静置凝固1到2小时,然后4℃冰箱过夜使血块固缩,血清析出,随后将析出的血清4℃,3000g离心10分钟,离心后的上清转移至新的eppendorf离心管中,分装保存于-80℃冰箱。
54.细胞外囊泡提取时,血清样品从-80℃冰箱取出,冰上融化,在4℃,12000g离心10-15分钟,离心后将上清液转移至新的离心管,0.22μm微孔滤膜过滤后用细胞外囊泡提取试剂盒qevoriginalsizeexclusioncolumn去分离提取细胞外囊泡,具体步骤如下,首先将分离柱放置在支架上,使其垂直,盖好底部的luer-slipcap,然后取下盖子,打破真空密封,取下luer-slipcap,用至少10mlpbs洗脱缓冲液冲洗柱子,盖上luer-slipcap,用移液器移去顶部的缓冲液,用移液器向分离柱中加入500μl血清样品,取下luer-slipcap,开始收集分离过滤后的样本,最开始的3ml是空隙体积,继续向分离柱中添加pbs以洗脱囊泡,最后收集空隙体积后的0.5ml液体为高纯度细胞外囊泡。
55.nta分析中,细胞外囊泡用pbs重悬,使用nanosightns300对重悬液体中纳米颗粒的布朗运动进行实时动态跟踪,观察并获得相应的粒径分布及浓度信息,tem分析中,使用透射电子显微镜,首先用pbs重悬试剂盒提取的细胞外囊泡,吸取5-10μl重悬的待观察细胞外囊泡样本滴加于电镜的专用的铜网上,室温下放置进行沉淀1-2分钟,并用滤纸吸去浮液,先用pbs进行漂洗,然后吸取磷钨酸(pta)5-10μl滴加于铜网上,沉淀并进行负染色1-2
分钟,用滤纸吸去浮液,常温下干燥2分钟,上机成像,电镜下观察并记录细胞外囊泡的形态特征。
56.wb分析中,首先提取细胞外囊泡蛋白质,细胞外囊泡提取后放置于-80℃冰箱保存,使用时从冰箱取出,冰上溶解,避免反复冻融,向细胞外囊泡溶液中加入已配制好的ripa蛋白裂解液,冰上裂解10-15分钟,使细胞外囊泡蛋白质裂解;
57.然后测定蛋白浓度,配制bca的工作液:按照50:1的比例将bca蛋白浓度检测试剂盒中的a液和b液混合后配制成bca工作液,室温放置备用,按照每个反应孔200μl工作液准备,取一个96孔板,根据实验需求设置好标准蛋白孔和待测样品孔,将bca工作液加入到96孔板中,每孔200μl,bca蛋白浓度测定试剂盒提供的标准的蛋白液浓度为2mg/ml,用ddh2o稀释试剂盒中的标准蛋白液,配制成梯度蛋白,浓度分别为2000μg/ml,1000μg/ml,500μg/ml,250μg/ml,125μg/ml,0μg/ml,待测蛋白样品用ddh2o稀释10倍,向每孔中加入20μl的梯度蛋白液和稀释后的待测蛋白样品,混匀,37℃避光孵育30分钟,测定562nm波长下的吸光度,用标准蛋白品的浓度和吸光度od562值绘制标准曲线,计算浓度公式,根据公式计算出待测蛋白样品的浓度;
58.蛋白变性,将测好浓度的蛋白用ddh2o进行稀释,根据wb每孔50μg/20μl的上样量,计算所要加入的ddh2o和4
×
蛋白上样缓冲液,进而配制wb的上样体系,然后将配制好的wb上样体系混匀后放入100℃金属浴,加热变性10分钟,取出后立即将蛋白样品置于冰上或者于-20℃冰箱冻存备用;
59.sds-page凝胶电泳,选择玻璃板,流水冲洗,洗涤剂洗刷,洗净玻璃板表面的污渍和颗粒物,室温晾干或烤箱烘干,将玻璃板安装在制胶架上,注意使玻璃板底部平齐并密切接触制胶架上的胶条避免发生渗漏,根据待测蛋白样品的分子量大小选择合适的浓度,常用浓度分离胶具体配制方式见表2-6,中等分子量选择10%sds-page,小分子量选择12%sds-page,大分子量选择8%sds-page,分离胶配制完成后,混匀,加入玻璃板中至距离顶端2cm处,检查有无渗漏,若无渗漏加入异丙醇压平,室温静置30分钟,分离胶静置30分钟无漏胶且凝固后,弃去玻璃板间异丙醇,按配方配制浓缩胶,混匀后加在分离胶的上面,然后选择梳子,向浓缩胶内垂直插入,注意梳齿之间不能产生气泡,室温静置20分钟,待浓缩胶完全凝固后,制胶完成,取出备用,蛋白上样:将配制好的电泳胶放置于电泳槽中,预先配制好10x电泳缓冲液,电泳时用ddh2o稀释成1x电泳缓冲液,向槽中加入1x电泳缓冲液,在缓冲液中垂直向上拔去梳子,然后用加样枪按照一定顺序向各孔中加入蛋白样品和预染的蛋白marker,电泳:打开电源,先用80v电压恒压电泳30分钟,当蛋白marker到达分离胶且条带分离清可辨时,调整电压为120v继续恒压电泳直至目的蛋白电泳到合适位置,关闭电源,结束电泳;
60.恒流湿转,材料准备:0.45μm的pvdf转印膜切成和蛋白胶块相当的大小(约6.5cmx8cm),同时裁剪相应大小的滤纸,pvdf膜浸泡于甲醇中激活,膜从不透明变为透明即说明已激活,取10x转膜缓冲液100ml,加入200ml甲醇,700mlddh2o,混匀配制成1x转膜缓冲液,预冷备用,取出电泳后的玻璃板,撬开,沿着分离胶边界切去上层胶,取出分离胶,放在预先配制好的1x转膜缓冲液中,将转膜用的塑料夹打开,海绵垫和滤纸依次叠放在夹子上,黑色面夹子滤纸上放电泳胶,白色面夹子上放活化后的pvdf膜,按照三明治顺序叠放,随后赶走pvdf膜与分离胶之间的气泡,将夹紧后的塑料夹放到转膜槽中,槽内加入预冷的1x转
膜缓冲液,同时放入冷冻的冰板,将转膜槽整体放入冰盒中并加满冰,接好电源,300ma恒流转膜,根据分子量大小选择合适的转膜时间,分子量蛋白质选择2小时,小分子量蛋白质可选择1小时;
61.蛋白免疫印迹,封闭:转膜结束后,取出pvdf膜,标注好正反面及上样顺序,然后将pvdf膜放在5%bsa或5%脱脂牛奶的封闭液中,室温于摇床上低速封,一抗:封闭完成后,根据预染蛋白marker的位置将pvdf膜按照目的蛋白的大小剪出所需条带,将其放入稀释好的一抗中,4℃置摇床上孵育过夜,二抗:一抗孵育结束后,回收一抗,用tbst摇床上洗膜3遍,每次10分钟,将洗好的膜放入相对应的二抗,室温摇床上低速孵育2小时,曝光:二抗孵育结束后,用tbst摇床上洗膜3遍,每次10分钟,将ecl发光试剂盒中的a液和b液按1:1配制成发光液,将发光液均匀滴加在膜上,放入凝胶成像仪中成像闭1小时。
62.生物信息学分析包括go分析、kegg分析、go功能富集分析、kegg通路富集分析、蛋白质互作网络分析、数据分析。
63.lc-ms/ms分析中,细胞外囊泡蛋白质提取:由qev细胞外囊泡提取试剂盒从血清中提取分离的细胞外囊泡中加入蛋白酶抑制剂以及1%浓度的聚乙二醇辛基苯基醚对其蛋白质进行裂解,裂解完后bca法检测蛋白浓度;蛋白质胰酶酶解:向裂解后的蛋白质溶液中加入dtt和iam,后室温下避光孵育15分钟,随后加入胰蛋白酶进行酶解;肽段标记及高效液相色谱分级:对胰蛋白酶酶解后的蛋白样品进行标记,将tmt试剂盒中的标记试剂与蛋白样品混合并进行孵育,并对肽段进行高效液相色谱分级;lc-ms/ms分析:将经上述步骤处理标记以后的肽段上机检测(质谱平台),进行液相色谱-质谱联用(lc-ms.ms)分析;质谱数据处理及分析:对质谱平台检测得到的质谱图进行处理,并将得到的实验数据在相应的数据库中(maxquant)进行检索及分析。
64.蛋白质互作网络分析用于对恶性组和健康组之间的deps与恶性组和良性组之间的deps的交叉重复部分进行了蛋白质互作网络分析。
65.prm的实验方法为蛋白提取及浓度检测,胰酶酶解:各待测样品蛋白取等量进行酶解,加入标准蛋白,用裂解液将体积调整至一致,再加入dtt和iam,室温避光孵育15分钟。将烷基化好的样本转移至超滤管,室温12000g离心20分钟,用8m尿素置换3次,再用置换缓冲液置换尿素3次,以1:50的比例加入胰蛋白酶,酶解过夜。室温12000g离心10分钟回收肽段,再用ddh2o回收肽段一次,合并两次肽段溶液;质谱分析:肽段溶液上机检测,数据采集模式使用数据非依赖型扫描程序,hcd碰撞池的碎裂能量设置为27。一级质谱自动增益控制设置为3e6,最大离子注入时间设置为50ms;二级质谱自动增益控制设置为1e5,最大离子注入时间设置为120ms,隔离窗口设置为1.6m/z,数据分析处理:根据实验目的设置肽段参数,分析处理数据。
66.在整个蛋白质谱检测过程中,通过不同的方式对其进行了质控,首先是关于肽段长度的质控,如图3所示,本项研究进行上机检测鉴定的肽段的长度大都在5-20个氨基酸的范围内,这一结果符合胰蛋白酶酶解的规律,上机检测的肽段长度符合实验要求,其次如图4所示,蛋白质的分子量大小和蛋白质的覆盖度之间的关系符合要求,大分子量的蛋白质进行胰蛋白酶酶解可以产生更多数目的肽段,即为了达到同样的蛋白质覆盖度,实验过程中需要检测更多肽段,最后,图5的结果表明实验得到的蛋白谱图的质量误差在可接受的范围内,符合实验要求的高精度,说明蛋白质谱仪器的质量精度是正常且符合质控要求的;
67.为了证明提取分离到了质量以及纯度合格的细胞外囊泡,首先我们对提取到的血清细胞外囊泡进行了nta和tem检测,如图6所示,nta结果表明血清中提取到的细胞外囊泡粒径主峰为113nm,平均粒径为142.3nm,符合文献中已经证实的细胞外囊泡40-160nm的直径范围,如图7所示,tem结果表明血清中提取到的细胞外囊泡为盘状囊泡样结构,同样符合已经证实的细胞外囊泡结构特点;
68.在对提取到的血清细胞外囊泡进行标志性蛋白质的wb检测时,结果如图8所示。通过wb可检测到细胞外囊泡标志性蛋白质cd63,tsg101和flotillin1的表达,结果表明,与全细胞裂解液相比,这些标志性蛋白质在细胞外囊泡中的表达明显升高,而内参gapdh在细胞裂解液中表达量较高,在细胞外囊泡中表达量极低;
69.基于血清细胞外囊泡广靶定量蛋白组学结果,为了进一步验证初步筛选出的细胞外囊泡蛋白质在不同组别间的表达量的确存在差异,我们在另一组包括更大样本量的验证队列中通过prm方法对其进行了靶向定量蛋白组学验证,该验证队列由20名健康对照者和15名良性卵巢肿瘤患者和50名卵巢癌患者组成。为此,我们需要缩小候选目标蛋白标志物的范围,将更多的注意力放在表达差异显著且功能特异的蛋白质分子上。首先,我们选择了恶性组和健康组之间的deps与恶性组和良性组之间的deps的交叉重复部分,结果显示在两组之间均有明显差异表达的蛋白共42个,包括20个表达上调蛋白和22个表达下调蛋白,然后从这42个蛋白质中进一步筛选,选择具有稳定ms信号和可靠定量信息以及不同组别之间相比表达差异倍数较大的deps进行下一步验证,最终一共有23个deps被选择,如图10所示;
70.prm结果表明本次研究中最终一共检测到了22个候选蛋白中的39个含有独特序列的肽段,并对其进行了定量分析。我们依据验证队中的prm靶向定量蛋白组学检测结果绘制了热图,如图11所示,结果可观察到部分蛋白质具有显著的组间差异,包括表达上调蛋白:fga,fgb,fgg,fgl1,itih3,muc16;表达下调蛋白:apol1,apoa4。随后,基于这22个蛋白标志物的prm靶向定量蛋白组学结果,我们进行了pca模型分析,结果显示健康对照、良性卵巢肿瘤组和卵巢癌组可明显区分开来,如图12所示;
71.验证队列的整体靶向定量验证蛋白组学结果表明我们可从prm靶向定量验证的蛋白标志物中进一步寻找用于卵巢癌诊断的特异性肿瘤标志物,这些蛋白标志物包括fga,gb,fgg,fgl1,itih3,muc16,apol1,apoa4等;
72.为了建立卵巢癌的诊断模型,我们需要基于prm靶向定量蛋白组学的结果进一步筛选敏感度和特异度高的肿瘤标志物。我们采用了一个多级细分的流程来筛选可能进入模型的肿瘤标志物,如图13所示。首先,我们根据验证队列中蛋白质组间差异表达变化的趋势(即prm结果)是否与广靶蛋白组学研究结果的蛋白质组间差异表达变化的趋势(即tmt-lc-ms/ms分析结果)一致来选择蛋白质标志物。结果发现14个蛋白标志物(包括11个上调蛋白和3个下调蛋白)符合要求,在两次研究中有相同的组间差异表达变化趋势。然后在验证队列中分别对这14个蛋白标志物绘制roc曲线,以曲线下面积(auc)来评估其区分卵巢癌患者与良性和健康对照者的诊断效能。在这一步分析中,结果表明8个蛋白分子具有潜在的卵巢癌诊断肿瘤标志物的潜能(auc》0.7),其中包括6个上调蛋白(fga,fgb,fgg,fgl1,muc16,itih3)和2个下调蛋白(apol1,apoa4)。这些候选的蛋白标志物与凝血系统(fga,fgb,fgg,fgl1),脂质转运和代谢(apol1,apoa4)以及蛋白结合(muc16,itih3)等功能有关,其具体的功能如图14。同时,6个表达上调蛋白在不同组别血清细胞外囊泡中的表达丰度见图15,2个
表达下调蛋白在不同组别血清细胞外囊泡中的表达丰度见图16。随后,我们在验证队列中对这8个蛋白质分子进行了单因素和多因素logistics回归分析,单因素logistic回归分析结果证明筛选出的6个表达上调蛋白是上皮性卵巢癌的危险因素,2个表达下调蛋白是上皮性卵巢癌的保护因素,如图17所示,为了建立最简化的卵巢癌数学诊断模型,同时又要没有显著变量信息的损失,我们采用多因素logistics回归分析,逐步法(lr,p《0.05时变量进入,p》0.10时变量剔除)构建了卵巢癌诊断模型。最后,该诊断模型由3个蛋白标记物(fgg,apoa4,muc16)组成,如图18所示。回归方程为:logitp=2.481*fgg 8.970*muc16
–
1.709*apoa4-0.184;
73.为了验证该卵巢癌诊断模型的诊断效能,我们对该诊断模型绘制了roc曲线。结果显示在验证队列的全部卵巢癌病人中该模型的auc为0.936(95%ci,0.888-0.984),敏感性为92.0%,特异性为82.9%,cut-off值为0.40。同时在早期卵巢癌病人中(figoi或ii期),该诊断模型也表现出较好的诊断效能,auc为0.820(95%ci,0.699-0.941),敏感性为71.4%,特异性为82.9%,如图19和图20所示。
74.最后应说明的是:以上仅为本发明的优选实施例而已,并不用于限制本发明,尽管参照前述实施例对本发明进行了详细的说明,对于本领域的技术人员来说,其依然可以对前述各实施例所记载的技术方案进行修改,或者对其中部分技术特征进行等同替换,凡在本发明的精神和原则之内,所做的任何修改、等同替换、改进等,均应包含在本发明的保护范围之内。
再多了解一些
本文用于创业者技术爱好者查询,仅供学习研究,如用于商业用途,请联系技术所有人。