在青光眼滤过手术和白内障摘除术联合手术之后实现健康眼内压的方法、系统和组合物
1.相关申请的交叉引用
2.本技术要求于2019年12月6日提交的美国临时申请62/944,952的权益,其内容通过引用的方式并入本技术。
技术领域
3.本发明涉及在青光眼和白内障联合手术之后实现健康眼内压的方法、系统和组合物。例如,本发明的特征在于用β射线治疗与青光眼治疗相关的引流泡和/或孔(例如与异物或其他青光眼外科手术相关的引流泡和/或孔)以维持功能性泡和/或孔的方法和系统。
背景技术:
4.青光眼
5.青光眼是不可逆性失明的主要原因,并且代表具有特征性视神经病变的一系列疾病。这类疾病的治疗主要集中在降低眼内液体(房水)的眼内压(iop),从而避免对视神经的持续损害。
6.通过尝试降低眼内压(iop)来治疗青光眼。在美国、欧洲和其他一些工业化国家,一线疗法通常是通过滴眼剂。这类药物包括β阻滞剂、前列腺素、α-肾上腺素能激动剂和碳酸酐酶抑制剂。对于药物治疗失败的患者以及对日常药物治疗以及频繁的随访的经济性和分布障碍的世界其他地区,治疗方案主要是外科手术干预。
7.一种防止青光眼视力丧失的方法是通过引流术降低眼内压,该引流术通过在微创青光眼手术(migs)中植入流量控制引流装置,或通过使用诸如微创微巩膜造口术(mims)的其他外科手术或装置,以此通过小梁切除术过程中创建的通道将液体从眼睛中分流出来。这些系统和手术允许房水从眼内引流到结膜下的储库(称为“泡”)中,房水随后从那里被重吸收。
8.采用当前的青光眼治疗(例如,mims、migs、小梁切除术等),瘢痕组织经常损害泡或其他周围的结构(例如,与mims相关的引流通道),最终阻碍或阻塞多余流体的流动。尽管与非手术治疗相比具有令人注目的治疗优势,但引流手术和引流装置在临床上仍受术后瘢痕形成的限制。
9.解决该问题的尝试包括应用抗代谢物,例如丝裂霉素c(mmc)和5-氟尿嘧啶(5fu)。这些抗代谢物以液体形式使用,并且通过注射来递送或通过将浸泡在药物中的显微外科手术海绵直接放置到结膜下的手术部位来递送。与抗代谢物(例如,mmc和5fu)相关的问题之一是它们不能很好地保留泡。据报道,三年内的失败率接近50%。
10.青光眼治疗的另一个问题是白内障的频繁共生和恶化。白内障摘除术,例如超声乳化术,可以与青光眼治疗联合进行。然而,青光眼群体的共识是,联合任何形式的外部青光眼引流手术与白内障摘除术都会导致较差的结果。例如,将preserflo
tm microshunt(santen,以前的innfocus)与白内障手术联合使用是一种联合白内障手术和
引流手术的便捷方法。然而,如果不能充分控制伤口愈合反应,眼内压降低可能不是最理想的。
11.作为另一个例子,联合使用xen gel stent(allergan)与白内障手术可能是一种联合白内障手术与引流手术的便捷方法。然而,如果不能充分控制伤口愈合反应,眼内压降低可能不是最理想的。
12.人们已经出人意料地发现使用β射线来维持功能性引流泡并帮助降低iop可以减少与青光眼手术(例如,migs植入物或异物的植入)相关的结膜炎症,以至于即使包括白内障手术,β射线仍然有效。
13.在一项使用β射线或5氟尿嘧啶(5fu)作为联合超声小梁切除术的辅助手段的随机对照试验中,患者通过带有sr-90/y-90或5fu的8mm椎间盘施加器在泡下作为浸湿的药棉拭子或通过注射接受1000cgyβ射线(dhalla等人,2016,plos one 11(9):e0161674)。术后随访患者12个月。手术的成功由三个标准来判断:iop≤16mmhg(并且未接受眼睛降压治疗)、≤21mmhg以及iop降低30%或更多。per dhalla等人,“如果将治疗成功被定义为iop降低30%或更多且iop≤21mmhg,然后在一年内,5fu和β射线组的典型成功结果的比例分别为82.6%和82.7%,(p=0.99)”。不希望将本发明限制于任何理论或机制,鉴于dhalla的发现,即当用作联合超声小梁切除术的辅助手段时,并未证明β射线的使用比5fu更有效,相信本领域的普通技术人员不会期望β射线在用作白内障手术和涉及将异物引入眼睛的青光眼手术的辅助手段时会产生更积极的结果。
14.在不希望将本发明限制于任何理论或机制的情况下,我们认为即使使用例如丝裂霉素-c等抗代谢物,在联合青光眼滤过手术和白内障摘除术后,仍不可能达到10mmhg左右的眼内压。
技术实现要素:
15.本发明的特征在于结合青光眼和白内障联合手术将射线施加到治疗区域(例如泡的靶区域)的方法和系统。本文的方法和系统可用于将β射线施加到眼睛中的靶区域以帮助维持由青光眼引流步骤或手术产生的功能性泡和/或引流孔,以帮助避免瘢痕形成或伤口复原,以抑制或减少泡或周围区域的纤维化和/或炎症等。本发明不限于本文所公开的应用。
16.如本文所用,术语“治疗区域”或“靶区域”可以指期望或预期用β射线治疗的组织。治疗区域或靶区域可以被定义为在暴露于β射线的组织区域内具有特定尺寸和特定深度的特定平面。
17.所述方法的特征在于在白内障和青光眼联合手术(如植入引流装置,如migs植入)时或前后(如青光眼手术前、青光眼手术后、白内障手术前、白内障手术后等)向靶位点(如引流位点或其他适当位点)施加治疗剂量的β射线。
18.本文中的方法和系统有助于提供跨靶区域或治疗区域的优化的剂量分布。在不希望将本发明限制于任何理论或机制的情况下,如本文所用,术语“优化的剂量分布”可以指跨靶区域或治疗区域之上或之内的特定深度处特定尺寸的特定平面的剂量,这是基本均匀的和治疗性的剂量。例如,跨靶上或靶内的特定平面的剂量变化可能不超过最大剂量的某个百分比。
19.图2说明了靶区域的平面的非限制性示例。靶和靶平面的大小和尺寸(和深度)可能会不同。在一些实施方案中,靶区域的直径为6mm。在一些实施方案中,靶区域的直径为7mm。在一些实施方案中,靶区域的直径为8mm。在一些实施方案中,靶区域的直径为9mm。在一些实施方案中,靶区域的直径为10mm。在一些实施方案中,靶区域的直径为11mm。在一些实施方案中,靶区域的深度,例如靶区域的平面的深度,为0mm(例如,与近距离放射治疗递送系统例如放射性核素近距离放射治疗系统接触)。在一些实施方案中,靶区域的深度,例如靶区域的平面的深度,为0.1mm。在一些实施方案中,靶区域的深度,例如靶区域的平面的深度,为0.2mm。在一些实施方案中,靶区域的深度,例如靶区域的平面的深度,为0.3mm。在一些实施方案中,靶区域的深度,例如靶区域的平面的深度,为0.4mm。在一些实施方案中,靶区域的深度,例如靶区域的平面的深度,为0.5mm。在一些实施方案中,靶区域的深度,例如靶区域的平面的深度,为0.6mm。在一些实施方案中,靶区域的深度为0至0.4mm。
20.可选地,“优化的剂量分布”也可以意味着剂量分布在整个病变中以特定的模式变化,目的是最好地影响治疗结果。在一个示例中,治疗深度处的剂量变化跨直径/平面,使得泡的边缘区域相对于中心接收更高的剂量。在一个示例中,治疗深度处跨直径/平面的剂量分布发生变化,使得migs装置流出孔处的区域相比其他区域接收增加的剂量。在一个示例中,治疗深度处跨直径/平面的剂量发生变化,使得泡的边缘和migs装置流出孔处的区域都接收增加的剂量。在一个示例中,剂量在特定区域上减弱。在一个示例中,剂量在角膜上减弱。
21.β射线随深度迅速衰减。在一些实施方案中,术语“优化的剂量分布”包括穿过靶组织深度的适当剂量。临床剂量深度可以由结膜和相关的功能性泡的特农氏囊的厚度来确定。作为非限制性示例,对于migs手术,焦点区域可以在上角膜缘上方大约3mm。howlet等人使用光学相干断层成像术(oct)在青光眼患者中发现结膜和特农氏囊层的平均厚度为393
±
67微米,范围为194至573微米(howlet j等人,当代青光眼实践杂志2014,8(s):63-66)。在早期的研究中,zhang等人使用oct分析发现健康个体的结膜厚度为238
±
51微米,并得出结论oct能以高分辨率准确测量结膜组织的横截面结构(zhang等人,眼科研究&视力学2011,52(10):7787-7791)。基于howlet的研究,靶组织厚度的范围可以为150至700微米,或10至700微米等等。在一个示例中,从表面通过靶组织深度的剂量分布允许组织内的治疗剂量达到快速衰减β射线的极限。
22.本发明的特征在于发射β射线的放射性同位素,用于治疗青光眼和白内障的方法中。
23.在一些实施方案中,所述方法包括对患者的眼睛进行青光眼引流手术,所述手术在结膜下间隙或结膜和特农氏囊之间形成泡,并且所述青光眼引流手术允许房水排入所述泡中(例如,migs、mims、小梁切除术等);进行白内障手术;以及将来自放射性同位素的治疗剂量的β射线施加到眼睛的靶区域,其中,靶区域与泡、青光眼引流植入物或引流通道或其组合等相关。在一些实施方案中,所述青光眼手术是微创青光眼手术(migs)。在一些实施方案中,所述青光眼手术是微创微巩膜造口术(mims)。在一些实施方案中,所述青光眼手术是小梁切除术。
24.在一些实施方案中,所述方法包括在患者的眼睛上进行青光眼引流手术,其中,植入物(例如,migs植入物)经巩膜植入以在结膜下间隙或所述结膜与特农氏囊之间形成泡,
所述青光眼引流手术允许房水排入泡中;进行白内障手术;以及将来自放射性同位素的治疗剂量的β射线施加到眼睛的靶区域,其中,所述靶区域与所述泡、所述植入物、或所述泡和所述植入物相关。
25.本发明的特征还在于发射β射线的放射性同位素,其用于预防或减少正在或已经接受青光眼引流手术(例如,migs、mims、小梁切除术等)和白内障手术的治疗的眼睛中的引流泡或引流通道中的瘢痕形成,其特征在于将所述放射性同位素施加到所述眼睛,使得来自所述放射性同位素的治疗剂量的β射线施加到所述眼睛的靶区域。所述靶区域可与所述引流泡、引流通道,或青光眼引流植入物或其组合相关。在一些实施方案中,所述青光眼手术是微创青光眼手术(migs)。在一些实施方案中,所述青光眼手术是微创微巩膜造口术(mims)。在一些实施方案中,所述青光眼手术是小梁切除术。
26.本发明的特征还在于发射β射线的放射性同位素,其用于预防或减少正在接受或已经接受以下手术治疗的人眼中的引流泡中的瘢痕形成:(i)青光眼引流手术,其中,将植入物(例如,migs植入物)经巩膜植入以在结膜下间隙或结膜与特农氏囊之间形成泡,并且房水可排入到所述引流泡中,以及(ii)白内障手术,其特征在于,将所述放射性同位素施加到眼睛,以使来自所述放射性同位素的治疗剂量的β射线施加到眼睛的靶区域,所述靶区域可与所述引流泡、所述植入物、或所述引流泡和所述植入物相关。
27.本发明的特征还在于发射β射线的放射性同位素,其用于降低正在接受或已经接受青光眼手术(例如,migs、mims、小梁切除术等)和白内障手术治疗的人眼中的眼内压(iop)的方法,其特征在于,将放射性同位素施加到眼睛,以使来自放射性同位素的治疗剂量的β射线施加到眼睛的靶区域。所述靶区域可与引流泡、引流通道或青光眼引流植入物或其组合相关。在一些实施方案中,青光眼手术是微创青光眼手术(migs)。在一些实施方案中,青光眼手术是微创微巩膜造口术(mims)。在一些实施方案中,青光眼手术是小梁切除术。
28.本发明的特征还在于发射β射线的放射性同位素,其用于降低正在接受或已经接受以下手术治疗的人眼中的眼内压(iop)的方法:(i)青光眼引流手术,其中,将植入物(例如,migs植入物)经巩膜植入以在结膜下间隙或结膜与特农氏囊之间形成泡,并且房水可排入引流泡,以及(ii)白内障手术,其特征在于,将放射性同位素施加到眼睛,以使来自放射性同位素的治疗剂量的β射线施加到眼睛的靶区域。所述靶区域可与所述引流泡、所述植入物、或所述引流泡和所述植入物相关。
29.本发明的特征还在于包含β射线源的组合物,其用于在正在或已经接受青光眼(例如,migs、mims、小梁切除术)和白内障治疗的人眼中实现健康眼内压(iop)的方法,其特征在于,将所述组合物施加到眼睛,以使来自β射线源的β射线施加到眼睛的靶区域。靶区域可与引流泡、引流通道或青光眼引流植入物或其组合相关。在一些实施方案中,放射性同位素包括锶-90(sr-90)、磷-32(p-32)、钌106(ru-106)、钇90(y-90)或其组合。在一些实施方案中,治疗剂量为500-1000cgy。在一些实施方案中,青光眼手术是微创青光眼手术(migs)。在一些实施方案中,青光眼手术是微创微巩膜造口术(mims)。在一些实施方案中,青光眼手术是小梁切除术。
30.本发明的特征还在于包含β射线源的组合物,其用于在正在或已经接受以下手术治疗的人眼中的实现健康眼内压(iop)的方法:(i)青光眼引流手术(例如,migs),其中,将
植入物(例如,migs植入物)经巩膜植入以在结膜下间隙或结膜和特农氏囊之间形成泡,并且房水可以排入引流泡,以及(ii)白内障手术,其特征在于,将所述组合物施加到眼睛,以使来自β射线源的β射线施加到眼睛的靶区域。所述靶区域可与所述引流泡、所述植入物、或所述引流泡和所述植入物相关。
31.本发明的特征还在于降低正在或已经接受青光眼引流手术(例如,migs、mims、小梁切除术等)和白内障手术治疗的人眼中的眼内压(iop)的方法,其中,青光眼手术允许房水排入结膜下间隙或结膜和特农氏囊之间的空间中的泡。在一些实施方案中,所述方法包括将来自放射性同位素的治疗量的β射线施加到眼睛的靶区域,其中,靶区域与泡、青光眼引流植入物或引流通道或其组合相关;其中,治疗量的β射线有助于维持功能性引流泡。在一些实施方案中,青光眼手术是微创青光眼手术(migs)。在一些实施方案中,青光眼手术是微创微巩膜造口术(mims)。在一些实施方案中,青光眼手术是小梁切除术。
32.本发明的特征还在于降低正在接受治疗或已经接受以下手术治疗的人眼中的眼内压(iop)的方法:(i)青光眼引流手术(例如migs),其中,将植入物(例如migs植入物)经巩膜植入以在结膜下间隙或所述结膜与特农氏囊之间形成泡,并且房水可以排入到所述引流泡中,以及(ii)白内障手术,所述方法包括将来自放射性同位素的治疗量的β射线施加到眼睛的靶区域,其中,所述靶区域与所述引流泡、所述植入物、或所述引流泡和所述植入物相关;其中,治疗量的β射线有助于维持功能性引流泡。
33.本发明的特征还在于减少正在或已经接受青光眼引流手术(例如,migs、mims、小梁切除术等)和白内障手术治疗的人眼中结膜炎的方法,其中,青光眼手术允许房水排入结膜下间隙或结膜和特农氏囊之间的引流泡中。在一些实施方案中,所述方法包括将来自放射性同位素的治疗量的β射线施加到眼睛的靶区域,其中,靶区域与泡、青光眼引流植入物或引流通道或其组合相关;其中,所述β射线导致特农氏囊上成纤维细胞的细胞周期停滞,从而抑制或减少纤维化过程和结膜炎。在一些实施方案中,青光眼手术是微创青光眼手术(migs)。在一些实施方案中,青光眼手术是微创微巩膜造口术(mims)。在一些实施方案中,青光眼手术是小梁切除术。
34.本发明的特征还在于减少正在或已经接受以下手术治疗的人眼中的结膜炎的方法:(i)青光眼引流手术(例如migs),其中,将植入物(例如migs植入物)经巩膜植入以在结膜下间隙或结膜和特农氏囊之间形成泡,并且房水可以排入引流泡,以及(ii)白内障手术,所述方法包括将来自所述放射性同位素的治疗剂量的所述β射线施加到所述眼睛的靶区域,其中,所述靶区域与所述泡、所述植入物、或所述泡和所述植入物相关;其中,β射线导致特农氏囊上成纤维细胞的细胞周期停滞从而抑制或减少纤维化过程和结膜炎。
35.本发明的特征还在于实现正在或已经接受青光眼引流手术(例如,migs、mims、小梁切除术)和白内障手术治疗的人眼中的健康眼内压(iop)的方法,其中,青光眼手术允许房水排入结膜下间隙或结膜和特农氏囊之间的泡中。在一些实施方案中,所述方法包括将来自放射性同位素的治疗量的β射线施加到眼睛的靶区域,其中,靶区域与泡、青光眼引流植入物或引流通道或其组合相关;其中,治疗量的β射线有助于维持功能性引流泡,从而实现健康的眼内压。在一些实施方案中,青光眼手术是微创青光眼手术(migs)。在一些实施方案中,青光眼手术是微创微巩膜造口术(mims)。在一些实施方案中,青光眼手术是小梁切除术。
36.本发明的特征还在于实现正在或已经接受以下手术治疗的人眼中的健康眼内压(iop)的方法:(i)青光眼引流手术(例如migs),其中,将植入物(例如migs植入物)经巩膜植入以在结膜下间隙或结膜和特农氏囊之间形成泡,并且房水可以排入引流泡中,以及(ii)白内障手术,所述方法包括将来自放射性同位素的治疗量的β射线施加到眼睛的靶区域,其中,所述靶区域与所述引流泡、所述植入物、或所述引流泡和所述植入物相关;其中,治疗量的β射线有助于维持功能性引流泡,从而实现健康的眼内压。
37.本发明的特征还在于治疗青光眼和白内障的方法。在一些实施方案中,所述方法包括进行青光眼引流手术(例如,migs、mims、小梁切除术等),其中,所述青光眼引流手术允许房水排入结膜下间隙或结膜与特农氏囊之间中的泡中;进行白内障手术;以及将来自放射性同位素的治疗剂量的β射线施加到眼睛的靶区域,其中,靶区域与泡、青光眼引流植入物或引流通道或其组合相关。所述方法可有效地降低眼内压(iop)。所述方法可有效地实现健康的眼内压(iop)。在一些实施方案中,青光眼手术是微创青光眼手术(migs)。在一些实施方案中,青光眼手术是微创微巩膜造口术(mims)。在一些实施方案中,青光眼手术是小梁切除术。
38.本发明的特征还在于治疗青光眼和白内障的方法,所述方法包括:在眼睛中进行青光眼引流手术(例如,migs),其中,将植入物(例如,migs植入物)经巩膜植入以在结膜下间隙或所述结膜与特农氏囊之间形成泡,并且房水可以排入到所述引流泡中;对眼睛进行白内障手术;以及将来自放射性同位素的治疗剂量的β射线施加到眼睛的靶区域,其中,所述靶区域与所述引流泡、所述植入物、或所述引流泡和所述植入物相关。所述方法可有效地降低眼内压(iop)。所述方法可有效地实现健康的眼内压(iop)。
39.本文的方法可有效地降低眼内压(iop)。在一些实施方案中,所述方法可有效地维持功能性引流泡。在一些实施方案中,所述方法有效地抑制或减少泡中、引流植入物周围或引流通道周围的纤维化和炎症。在一些实施方案中,所述方法有效地减少结膜炎。
40.参考本文中的任何实施方案,放射性同位素可包括锶-90(sr-90)、磷-32(p-32)、钌106(ru-106)、钇90(y-90),或其组合。在一些实施方案中,治疗剂量为500-1000cgy。在一些实施方案中,治疗剂量为450-1050cgy。
41.参考本文中的任何实施方案,在一些实施方案中,所述方法还包括将药物施加到靶区域。在一些实施方案中,所述药物是丝裂霉素c或5氟尿嘧啶。在一些实施方案中,所述药物是抗vegf组合物。
42.参考本文中的任何实施方案,在一些实施方案中,在进行青光眼引流手术之后将β射线施加到靶。在一些实施方案中,在进行青光眼引流手术之前将β射线施加到靶。在一些实施方案中,在进行青光眼引流手术时将β射线施加到靶。在一些实施方案中,在进行青光眼引流手术之前和之后将β射线施加到靶。
43.参考本文中的任何实施方案,在一些实施方案中,iop降低至12mmhg或更低。在一些实施方案中,iop降低至10mmhg或更低。在一些实施方案中,iop降低至5至10mmhg。在一些实施方案中,iop降低至5至12mmhg。在一些实施方案中,iop降低至8至10mmhg。在一些实施方案中,iop降低至8至12mmhg。
44.参考本文中的任何实施方案,所述方法可以在治疗后有效地降低iop一定量并持续一段时间。在一些实施方案中,所述方法在治疗后6个月有效地降低iop 20%或更多。在
一些实施方案中,所述方法在治疗后6个月有效地降低iop 30%或更多。在一些实施方案中,所述方法在治疗后6个月有效地降低iop 40%或更多。在一些实施方案中,所述方法在治疗后6个月有效地降低iop 50%或更多。在一些实施方案中,所述方法在治疗后12个月有效地降低iop 20%或更多。在一些实施方案中,所述方法在治疗后12个月有效地降低iop 30%或更多。在一些实施方案中,所述方法在治疗后12个月有效地降低iop 40%或更多。在一些实施方案中,所述方法在治疗后12个月有效地降低iop 50%或更多。在一些实施方案中,所述方法在治疗后24个月有效地降低iop 20%或更多。在一些实施方案中,所述方法在治疗后24个月有效地降低iop 30%或更多。在一些实施方案中,所述方法在治疗后24个月有效地降低iop 40%或更多。在一些实施方案中,所述方法在治疗后24个月有效地降低iop 50%或更多。在一些实施方案中,所述方法在治疗后36个月有效地降低iop 20%或更多。在一些实施方案中,所述方法在治疗后36个月有效地降低iop 30%或更多。在一些实施方案中,所述方法在治疗后36个月有效地降低iop 40%或更多。在一些实施方案中,所述方法在治疗后36个月有效地降低iop 50%或更多。
45.参考本文中的任何实施方案,在一些实施方案中,所述方法有效地降低iop以及随后稳定所述iop,例如,iop稳定一段时间。在一些实施方案中,iop的稳定为iop在治疗后3个月增加不超过10%。在一些实施方案中,iop的稳定为iop在治疗后6个月增加不超过10%。在一些实施方案中,iop的稳定为iop在治疗后12个月增加不超过10%。在一些实施方案中,iop的稳定为iop在治疗后24个月增加不超过10%。在一些实施方案中,iop的稳定为iop在治疗后36个月增加不超过10%。在一些实施方案中,iop的稳定为iop在治疗后3个月增加不超过20%。在一些实施方案中,iop的稳定为iop在治疗后6个月增加不超过20%。在一些实施方案中,iop的稳定为iop在治疗后12个月增加不超过20%。在一些实施方案中,iop的稳定为iop在治疗后24个月增加不超过20%。在一些实施方案中,iop的稳定为iop在治疗后36个月增加不超过20%。在一些实施方案中,iop的稳定为iop在治疗后24个月增加不超过25%。在一些实施方案中,iop的稳定为iop在治疗后36个月增加不超过25%。
46.在一些实施方案中,青光眼手术是微创青光眼手术(migs)。在一些实施方案中,青光眼手术是微创微巩膜造口术(mims)。在一些实施方案中,青光眼手术是小梁切除术。
47.在一些实施方案中,抑制或减少所述泡内的纤维化和炎症根据预定的泡分级量表来测量。所述预定的泡分级量表为摩菲(moorfields)泡分级量表(mbgs)和/或indiana泡外观分级量表(ibags)。
48.在一些实施方案中,使用施加器将β射线施加到靶。
49.在一些实施方案中,靶为泡的至少一部分。在一些实施方案中,靶包括整个泡。在一些实施方案中,靶区域包围微创青光眼手术(migs)植入物的末端。在一些实施方案中,靶包括引流通道上方的泡的至少一部分。在一些实施方案中,靶还包括引流通道上方的泡的至少一部分和泡的周边的至少一部分。在一些实施方案中,靶还包括引流通道上方的泡的至少一部分、泡的周边的至少一部分,以及所述周边和引流通道之上的部分之间的泡的至少一部分。在一些实施方案中,靶包括泡的一部分。在一些实施方案中,靶区域包括微创青光眼手术(migs)植入物的末端。
50.参考本文中的任何实施方案,在一些实施方案中,所述方法有效地在一定的时间内防止视力进一步丧失。视力丧失可以用本领域普通技术人员熟知的技术、测量方法和尺
度来确定。在一些实施方案中,所述方法在治疗后至少2个月内防止视力进一步丧失。在一些实施方案中,所述方法在治疗后至少3个月内防止视力进一步丧失。在一些实施方案中,所述方法在治疗后至少4个月内防止视力进一步丧失。在一些实施方案中,所述方法在治疗后至少5个月内防止视力进一步丧失。在一些实施方案中,所述方法在治疗后至少6个月内防止视力进一步丧失。在一些实施方案中,所述方法在治疗后至少7个月内防止视力进一步丧失。在一些实施方案中,所述方法在治疗后至少8个月内防止视力进一步丧失。在一些实施方案中,所述方法在治疗后至少9个月内防止视力进一步丧失。在一些实施方案中,所述方法在治疗后至少12个月内防止视力进一步丧失。在一些实施方案中,所述方法在治疗后至少18个月内防止视力进一步丧失。在一些实施方案中,所述方法在治疗后至少24个月内防止视力进一步丧失。
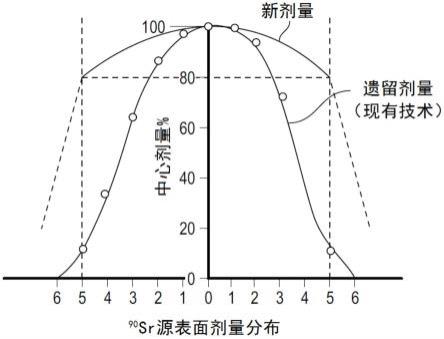
51.如前所述,本发明提供治疗剂量的β射线。如图1所示,本发明提供跨大部分靶区域相对稳定的剂量。
52.本发明的特征还在于发射β射线的放射性核素近距离放射治疗源(rbs)系统,其用于治疗青光眼和白内障的方法中(例如,用于帮助降低iop)。在一些实施方案中,所述方法包括对患者的眼睛进行青光眼引流手术,以在结膜下间隙或结膜和特农氏囊之间形成泡,并且允许房水排入泡中;进行白内障手术;以及将治疗剂量的β射线从rbs系统施加到与泡、引流通道、引流植入物或其组合相关的靶区域。在一些实施方案中,青光眼引流手术是migs、mims或小梁切除术。
53.本发明的特征还在于降低正在或已接受以下手术治疗的人眼中的眼内压(iop)的方法:(i)青光眼引流手术,以在结膜下间隙或结膜和特农氏囊之间形成泡,并且允许房水排入引流泡,以及(ii)白内障手术。在一些实施方案中,所述方法包括将来自放射性核素近距离放射治疗(rbs)系统的治疗量的β射线施加到与泡、引流通道、引流植入物或其组合相关的靶区域。在一些实施方案中,青光眼引流手术是migs、mims或小梁切除术。
54.在一些实施方案中,所述方法有效地降低眼内压(iop)。在一些实施方案中,治疗量的β射线有助于维持功能性引流泡。在一些实施方案中,治疗量的β射线有助于减少结膜炎症。
55.附图简要说明
56.本专利申请包含至少一幅彩色附图。专利局将根据请求和必要费用的支付提供本专利或专利申请公开文本的彩色附图副本。本发明的特征和优点将通过考虑以下与附图相结合的详细描述而变得明显,其中:
57.图1示出了传统装置(现有技术)的剂量分布与本发明的系统的剂量分布的对照。
58.图2示出了相对于放射性核素近距离放射治疗系统(rbs)系统的靶区域内的靶平面的示例。
59.术语
60.除非另有说明,否则本文中使用的所有技术和科学术语具有与所公开的发明所属领域的普通技术人员通常所理解的相同含义。除非上下文另外明确指出,否则单数术语“一(a)”,“一个(an)”和“该(the)”包括复数对象。类似地,除非上下文另外明确指出,否则单词“或”旨在包括“和”。术语“包括(comprising)”是指除了所给出的定义的要素之外还可以存在其他要素。“包括(comprising)”的使用表示包含而不是限制。换句话说,术语“包括
(comprising)”是指“主要包括,但不是唯一地包括”。此外,单词“包含(comprising)”的变型,例如“包括(comprise)”和“包括(comprises)”,具有相应的相同含义。一方面,本文所述的技术涉及对本发明必不可少的本文所述的组合物、方法及其各自的组成部分,还可包含未指明的必要或非必要的元素(“包括”)。
61.除非上下文另外明确指出,否则本文公开的所有实施方案可以与其他实施方案组合。
62.用于实践和/或测试本公开的实施方案的合适的方法和材料说明如下。这种方法和材料仅是说明性的并不意在限制。与本文描述的那些方法和材料相似或等同的其他方法和材料也可以被使用。例如,在各种综合的和更具体的参考文献中被描述的在本公开所属的领域中公知的常规方法。
63.剂量测定技术包括薄膜剂量测定法。在一个示例中,rbs被应用于射线照相胶片,例如gafchromic
tm
胶片。也可以通过在rbs和胶片之间放置已知厚度的中间材料(例如plasticwater
tm
)来测量不同深度的剂量。传输密度计结合胶片的光密度与剂量的关系图,可以测量胶片的不透明度,然后将其转换为输送的剂量。其他方法包括热致发光方法(tld芯片)。tld芯片是具有毫米尺寸的小塑料芯片,具有吸收电离辐射的晶格。
64.剂量变化被描述为假设中心点最大剂量时在整个直径上的变化。但是,实际上已经证明最大剂量可能偏离中心。因此,在整个直径上的剂量变化的描述也可以包括在整个区域上以及在深度上的剂量变化。
65.在眼科学领域中通常使用的术语“结膜”可以指结膜与特农氏囊(tenon’s capsule)的结合。另外,在眼科学界通常使用的术语“结膜”可能仅指结膜,不包括特农氏囊(tenon’s capsule)。本文对“结膜”的引用可包括和/或两种含义。
66.出于所有目的通过全部引用并入本文提及的所有出版物、专利申请、专利和其他参考文献。在发生冲突的情况下,以本说明书(包括术语解释)为准。
67.尽管与本文描述的那些方法和材料相似或等同的方法和材料可以被用于实践或测试所述公开的技术,合适的方法和材料描述如下。但该材料、方法和示例仅是说明性的并不意在限制。
68.为了便于对本公开的各种实施方案进行评述,提供了对特定术语的以下解释:
69.光束修正:通过在光束路径中插入任何材料来对辐射的空间分布(例如,在患者体内)进行期望的修改。光束修正增加一致性,从而允许将更高的剂量输送到靶,同时保留更多的正常组织。光束修正有四种主要类型:(1)防护:消除对光束所指向区域的一些特殊部分的辐射剂量。通常使用的是制造低熔点合金(lipowitz金属或cerroblend)防护体,这些防护体是为个别患者定制的并用于屏蔽正常组织和关键器官。例如,在全身照射(tbi)期间,将定制的防护体放置在肺部的前面以减少辐射剂量。(2)补偿:当光束倾斜穿过身体或存在不同类型的组织时,允许将正态的剂量分布数据应用于治疗区域。(3)楔形过滤:在等剂量曲线上获得有特殊倾斜的地方。(4)平坦化:通过减小相对于外围的中心照射强度来改变自然光束的空间分布。通常使用的是光束平坦化滤镜,它相对于光束边缘附近的照射强度降低中心照射强度。此技术用于线性加速器。滤镜被设计成使最厚的部分位于中间。这些通常由铜或黄铜制成。
70.诸如立体定向放射治疗、强度调制放射治疗和适形放射治疗的创新也被应用于保
留正常组织和关键器官的靶。例如,在许多情况下,使用多叶准直器(multileafcollimators)设计的线性加速器已经取代了防护体。
71.近距离放射疗法(另请参阅放射性核素近距离放射治疗源(rbs)):根据美国医学物理学会(aapm),近距离放射疗法是“在距靶体积很短距离的情况下,对小型封装的放射源的临床使用,用于辐射恶性肿瘤或非恶性病变”。通常,在医学实践中,近距离放射疗法可以分类为局部或斑块近距离放射疗法、腔内和间隙。
72.近距离放射疗法的一些实现方式采用永久植入的放射性核素近距离放射治疗源(rbss)。例如,在用于前列腺癌的低剂量率(ldr)近距离放射疗法中,作为一种护理标准,放射性碘125rbs直接放置在前列腺中并无限期保留。在另一个实现方式中,将高剂量率(hdr)近距离放射疗法theraspheres注入喂养肝脏肿瘤的动脉中。随后,这些微球栓塞,置入肝脏的毛细血管中,并在高水平的90钇辐射下浸润恶性肿瘤。在这两种实现方式中,总剂量通过消耗整个放射性同位素来确定。近距离放射疗法的一些其他实现方式采用rbs的瞬时放置。例如,在后加载高剂量率(hdr)近距离放射疗法中,将非常小的塑料导管放入前列腺中,并通过这些导管进行一系列放射治疗。计算机控制的机器将一个高放射性铱192rbs逐一地按规定的停留时间在整个被辐射提及的位置推入导管。然后可以轻松地拔出导管,并且在前列腺上没有放射性物质。rbs瞬时放置的另一个示例包括在支架植入后对冠状动脉再狭窄的预防性治疗。这是一种非恶性疾病,已通过将导管放入冠状动脉中,然后将hdr放射源插入导管中并在其中保持预定的时间来成功治疗,以便向血管壁输送足够的剂量。
73.引流装置或引流系统:用于引流房水的通用方法和特定方法中的任何方法或组合,诸如本文所述的治疗剂和装置,例如微创青光眼手术(migs)装置和手术、微创微巩膜造口术(mims)装置和手术、小梁切除术、巩膜造口术等,可通过有或无装置的外科手术干预降低眼内压(iop)。
74.流量受控支架(另请参阅微创青光眼手术(migs)):一些与migs相关的装置控制房水的流量。例如,凝胶支架(allergan)是明胶和戊二醛管,预装在一次性注射器中,并使用内路(abinterno)方法植入。例如,外科医生将注射器穿过透明的角膜切口插入,并在schlemm管处或前面通过巩膜穿过隧道,以在结膜下间隙内展开支架的远端部分。这为水从前房流到结膜下间隙创建了通路,从而形成泡。另一种流量受控的支架是innfocus(innfocus,santen)。外科医生通过外路(ab externo)法将该装置插入前房,在结膜下间隙中形成泡。
75.功能性引流泡:有效地从眼睛引出房水以将眼睛的眼内压(iop)降低至适当水平的泡。
76.早期的泡分级系统包括由kronfeld(1969)、migdal和hitchings(1983)以及picht和grehn(1998)提出的系统。随后的泡分级系统确定并合并了对各种泡参数的分级评估,这些参数例如血管、高度、宽度、微囊变、包囊和弥散/标定区域。
77.最近有两种描述的用于外科手术滤过泡进行临床分级的分级系统:摩菲(moorfields)泡分级系统(mbgs)和indiana泡外观分级量表(ibags)。mbgs建立在用于远程医学研究的系统上,并将其扩展到包括评估远离泡中心的血管性以及代表混合形态泡的方法。在该方案中,评估了中心区域(1-5)、最大区域(1-5)、泡高度(1-4)和结膜下血液(0-1)。此外,针对泡的三个区域分别对血管的等级进行了分级,包括泡中央结膜、外周结膜和非泡
结膜。每个区域的血管评分为1到5。一项研究发现,ibags和mbgs在观察者之间具有良好的一致性和临床可重复性(wells ap,ashraffnn,hallrc等人,两种临床泡分级系统的比较,眼科学(ophthalmology)2006;113:77-83)。
78.由于意识到了泡外观对结果的重要性,因此开发了摩菲(moorfields)泡分级系统。形成较薄的无血管区的泡发生渗漏、迟发性低渗以及与视力相关的泡相关感染的风险增加。
79.indiana泡外观分级量表是用于对滤过泡的形态裂隙灯外观进行分类的系统。indiana泡外观评分级量表包含一组摄影标准,这些标准说明了一系列滤过性泡形态,这些形态选自印第安纳大学眼科青光眼服务中心的幻灯片库。这些标准包括裂隙灯图像,用于通过seidel测试对泡高度、程度、血管性和渗漏进行分级。为了分级,相对于标准图像,针对4个参数评估滤过泡的形态,并相应地评分。
80.作为参考,已失败的或失败的泡可能具有“受限的后向流动,具有所谓的
‘
钢环
’”
,例如,瘢痕组织或纤维化的环在泡的外周将结膜粘附到巩膜上(参见dhingras,khawpt,摩菲安全手术系统(the moorfields safer surgery system),中东非洲眼科杂志(middle east african journal of ophthalmology),2009;16(3):112-115)。已失败或失败的泡的其他属性可能包括囊性外观和/或血管化和/或瘢痕组织的改变和/或覆帽泡的结膜变薄和/或张紧的泡和/或可能包括在indiana泡外观分级量表或摩菲(moorfields)泡分级系统中的其他可观察或可测量的改变。已失败或失败的泡或青光眼手术的其他功能决定因素可能包括iop增加或iop尚未充分降低。
81.微创性青光眼手术(migs):migs是青光眼的外科治疗中的最新创新,其被开发以最小化来自管和小梁切除术的并发症。migs是一个术语,指的是范围更广的植入物、装置和技术,他们的目的是降低眼内压,而其手术风险要比更悠久的手术低。在大多数情况下,结膜相关装置需要结膜下泡才能容纳液体并允许其眼外吸收。流量受控的结膜相关装置通常会尝试通过应用泊肃叶(poiseuille)层流定律来创建足够长且狭窄以限制和控制流出的管,以试图控制流量并将iop降低至正常压力,并使肌张力降低(眼内压力过低)最小化。一些migs装置包括流量受控支架、与shlemm管的微分流、脉络膜上装置以及小梁切开术装置。与shlemm管的微分流的示例包括与shlemm管的微分流的示例包括和hydrus
tm
(ivantis)。脉络膜上装置的示例包括(alcon)、金分流器(solx)和(glaukos)。小梁切开术装置的示例包括(neomedix)电灼装置。
82.计划治疗体积或计划靶体积(ptv):包括所有要辐射的组织的体积。ptv包括临床靶体积或临床治疗体积(ctv)。
83.放射性同位素(radioactive isotope),放射性核素(radionuclide),放射性同位素(radioisotope):具有不稳定的原子核并在其衰变成稳定形式时发射辐射的元素。从放射性核到稳定核的衰变可能有几个步骤。放射性衰变有四种类型:α、β负、β正和电子捕获。子核在衰变过程之后的去激励中可以发射γ射线。这些发射被认为是电离辐射,因为它们足够强大,可以从另一个原子中释放出电子。
84.治疗性放射性核素可以天然存在或可以人工产生,例如通过核反应堆或粒子加速器。在自然衰变之后,使用放射性核素发生器将子级同位素与父同位素分离。
85.本文给出在四个衰变过程之一之后的放射性同位素的非限制性示例:(1)α衰变:镭226,镅241;(2)β负:铱192,铯137,磷32(p-32),锶90(sr-90),钇90(y-90),钌106,铑106;(3)β正:氟18;(4)电子捕获:碘125,钯106。γ辐射的示例包括铱192和铯137。
86.半衰期定义为放射性物质的一半原子分解所需的时间。各种放射性同位素的半衰期可在几微秒到数十亿年的范围内。
87.放射性衰变过程中的术语活性(activity)是指每秒的崩解数。给定源中活性的度量单位是居里(ci)和贝克勒尔(bq)。一(1)贝克勒尔(bq)是每秒崩解一次。
88.较旧的单位是居里(ci),其中一(1)ci为3.7x10
10
bq。
89.术语β射线源(beta radiation source或source of beta radiation)可以指术语“放射性同位素(radioisotope)”。在本文的任何方法或组合物中,放射性同位素或β射线源可以包括锶-90(sr-90)、磷-32(p-32)、钌106(ru-106)、钇90(y-90)),或其组合。
90.放射性核素近距离放射源(rbs)(另请参阅近距离放射疗法):根据美国联邦法规,放射性核素近距离放射源(rbs)是“一种由放射性核素组成的装置,可以将其封装在由金、钛、不锈钢或铂金制成的密封容器中,并用于医疗目的以放置在体表或体腔或组织中作为治疗用的核辐射源。”在实践中还使用了其他形式的近距离放射源。例如,市售的保形源是由化学方法键合到磷-32(p-32)上的聚合物制成的柔性薄膜。另一产品是玻璃微球(therasphere),这是一种用于肝细胞癌(hcc)的放射疗法,其由数百万个含钇-90的微小的放射性玻璃微球(直径20
–
30微米)组成。其他形式的近距离放射疗法使用x辐射发生器代替放射同位素作为放射源。
91.巩膜造口术:通常在开角型青光眼患者中使用。它被分类为青光眼滤过手术的一种。微创微巩膜造口术(mims,sanoculis)是一种结合了传统小梁切除术机理和简单针刺技术的最新创新技术。在手术过程中,形成了巩膜角膜引流通道。mims手术通过创建巩膜角膜通道以将房水从前房排至结膜下腔来执行腹部外伸入法。使用mims创建的通道被设计成获得受控的流体流量。激光巩膜造口术以比标准的过滤手术创伤小的方式执行。其他研究也探索了使用具有不同波长、特性和组织相互作用的激光能量来来创建热巩膜造口术。有几种方法可以通过镜面隐形眼镜将激光能量传递到滤过角的内表面,也可以通过光纤线缆进行腹部内或腹部外的巩膜造口术。
92.小梁切除术:其中,在巩膜上开小孔并被薄的活板门(trap-door)覆盖的方法。房水通过活板门流到泡。例如,在一些小梁切除术手术中,在结膜和特农氏囊(tenon's capsule)下会形成最初的口袋,并在角膜巩膜交界处使用“基于穹隆的”结膜切口用丝裂霉素c浸湿的海绵处理伤口床。在对皮瓣区域进行烧灼后,创建了部分厚度的巩膜瓣,其底部位于角膜巩膜交界处。此外,在皮瓣下用凯利打孔器或卡夫后弹力膜(descemet)打孔器开窗以去除巩膜、schlemm管和小梁网的一部分,以进入前房。在很多情况下,进行虹膜切除术是为了防止将来巩膜造口术的阻塞。然后用几根缝合线将巩膜瓣松散地缝合到位。结膜在手术结束时以水密方式闭合。
93.经巩膜引流装置:将房水从前房分流至结膜下储库的装置。例如,青光眼滤过装置将房水通过安全内腔引导至半厚度巩膜瓣,形成结膜下滤过泡。该装置的内腔为房水流动提供了标准化的开口,同时还提供了一定的阻力,这似乎在手术期间和术后早期为前房增加了稳定性。
94.治疗(treat)、治疗(treatment)、治疗(treating):这些术语既指治疗性治疗,例如消除疾病、病症或病状,也指预防或预防性措施,例如预防或减慢疾病或病状的发展,降低疾病、病状或病症的至少一种不良作用或症状等。如本文所定义的,如果一种或多种症状或临床标志物得到减轻,则治疗可能是“有效的”。或者,如果疾病的进展被减少或停止,则治疗可能是“有效的”。即,“治疗”不仅包括疾病症状的改善或标志物的减少,而且还包括在不进行治疗的情况下被预期的症状的进展或恶化的中止或减慢。有益或期望的临床效果包括但不限于无论是可检测的还是不可检测的一种或多种症状的缓解、疾病程度的减轻、疾病状态的稳定(例如,不恶化),疾病进展的延迟或减慢,疾病状态改善或减轻和缓解(无论是局部的还是全部的)。与未接受治疗的预期生存期相比,“治疗”还可能意味着延长生存期。需要治疗的治疗包括已经被诊断出患有特定疾病、病症或病状的治疗,以及由于遗传敏感性或其他因素而可能发展成特定疾病,病症或病状的治疗。
95.阀:可用于青光眼治疗的装置,其中该装置不使用天然泡,而是使用合成的储库(或平板),其被植入结膜下以允许房水的流动。阀装置包括植入物(pharmaciaco.),青光眼阀(newworldmedical),用于椎间盘植入物的krupin-denver眼阀(e.bensonhoodlaboratories)以及和引流装置(ophthalmic ltd.)。
具体实施方式
96.本发明提供了用于在青光眼和白内障联合手术后实现健康眼内压的方法和系统。例如,本文与青光眼手术有关的方法和系统可以帮助有效地维持引流泡和/或引流通道的功能(例如,帮助避免瘢痕形成或伤口复原;抑制或减少泡或孔中的纤维化和/或炎症等)。
97.所述方法的特征在于在白内障手术和青光眼联合手术(例如植入引流装置,例如植入migs)时或前后将治疗剂量的β辐射施加到靶位点(例如,引流位点或其他合适的位点),例如,在青光眼手术之前、青光眼手术之后、白内障手术之前、白内障手术之后等。本文所述方法的特征还在于将药物施加到眼睛,例如,施加到靶,施加到靶附近的区域等。药物的非限制性示例包括丝裂霉素c、5氟尿嘧啶、抗vegf组合物和其他合适的组合物。
98.所述方法允许实现健康的眼内压(iop)。在一些实施方案中,本文的方法允许实现10mmhg或更低的iop。在一些实施方案中,本文的方法允许实现10mmhg的iop。在一些实施方案中,本文的方法允许实现11mmhg的iop。在一些实施方案中,本文的方法允许实现12mmhg的iop。在一些实施方案中,本文的方法允许实现13mmhg的iop。在一些实施方案中,本文的方法允许实现14mmhg的iop。在一些实施方案中,本文的方法允许实现15mmhg的iop。在一些实施方案中,本文的方法允许实现10至12mmhg的iop。在一些实施方案中,本文的方法允许实现10至13mmhg的iop。在一些实施方案中,本文的方法允许实现10至14mmhg的iop。在一些实施方案中,本文的方法允许实现10至15mmhg的iop。在一些实施方案中,本文的方法允许实现9-12mmhg的iop。在一些实施方案中,本文的方法允许实现9至15mmhg的iop。
99.如本文所用,术语“引流装置”是指用于引流房水的一般和特定方法的任何一种或组合,例如本文所述的治疗方法和装置,包括但不限于微创青光眼手术(migs)设备和手术,用于通过使用设备进行手术干预来降低眼内压。
100.本文描述了各种青光眼引流手术和装置,包括小梁切除术、引流管道和用于微创
青光眼手术(migs)的装置。出于本发明的目的,除了上述那些之外的其他外科创新和/或装置可以包括在本发明的范围内并且被描述和称为migs。例如,可替代地描述为微创性青光眼手术或扩大切口手术的技术和装置也包括在本发明中。
101.同位素和放射性
102.美国核管理委员会(usnrc)将放射性定义为“由材料释放的电离辐射量。无论它发出来的是α粒子还是β粒子、γ射线、x射线或中子,放射性材料的数量都以其放射性(或简单地以其活性)来表示,该放射性代表材料在给定时间段内衰减了多少个原子。放射性的度量单位是居里(ci)和贝克勒尔(bq)。”放射性衰变过程中的活性定义为给定样品中每秒的崩解数或每秒衰变的不稳定原子核数。活性在国际单位制中用贝克勒尔(缩写为bq)表示,精确等于每秒一次崩解。可以使用的另一个单位是居里,其中一个居里的活性大约是1克镭的活性,等于(精确地)3.7x10
10
贝克勒尔。在选择放射性核素生产治疗性药物时,放射性核素的比活性至关重要。
103.通过usnrc的定义,吸收剂量定义为吸收的辐射量,例如,放射源在其所通过的材料中沉积的能量的量,或由于暴露于电离辐射而沉积在组织中的能量的浓度。吸收剂量等于辐射束的辐射暴露量(离子或ci/kg)乘以要电离的介质的电离能。通常,吸收剂量的单位是辐射吸收剂量(rad)和戈(gy)。gy是电离辐射剂量的单位,定义为每千克物质吸收一焦耳的辐射能。rad通常已被si衍生单位中的gy取代。1gy等于100rad。
104.放射性核素发生器是从长寿命的放射性核素(称为“父”)的放射性转化中产生有用的短寿命医学放射性核素(称为“子”产品)的装置。通过在设施上提供现有的父,子就可以在现场连续产生。发生器可以使子放射性核素与父立即分离。锝99发生器是使用最广泛的发生器装置之一(通常称为“牛”)。它允许从衰变的99号钼中提取锝的亚稳态同位素99mtc。99mo的半衰期为66小时,可以很容易地长距离运输到医院,在那里提取其衰变产物锝99m(半衰期仅为6小时,不方便运输)并用于各种短半衰期非常有用的核能医学手术。
105.发生器也可以被构造用于供应其他子放射性同位素。钌106(ru-106)是可商购的放射性同位素,半衰期为668-373天,使其成为牛或发生器中父同位素的理想候选物。ru-106衰变为铑106(rh-106)仅产生对治疗没有用的39kev的低能β。但是,rh-106具有可用于近距离放射疗法的高能β衰变:rh-106的半衰期为30秒,通过β射线衰变为钯106(pd-106),最大衰变能量为3.541mev,平均能量96.9kev。例如,在一些实施方案中,本发明的特征在于从钌106牛装载的装置具有提供全规定剂量的铑106的活性。可以将装置应用于靶体积以交付其内容的全部活性。例如,可以将装置放置在靶病变上方10个半衰期(300秒),从而释放其所有放射性能量并消耗铑106,从而将其耗尽为钯。
106.在一些实施方案中,本发明的特征在于ru-106在与rh-106的长期平衡中的用途。ru-106通过β射线衰减到rh-106。这两种同位素处于长期平衡状态,其合并源的衰变速率受ru-106父控制,但治疗性β射线由子rh-106发出。
107.钇-90可从锶-90牛商业获得。作为另一个示例,在一些实施方案中,本发明的特征在于使用具有半衰期为64小时的钇-90。y-90沿三种不同的途径通过β射线衰减为稳定同位素锆90(zr-90),其中99.985%的y-90衰减时间为最大β粒子能量为2.2801mev,平均β粒子能量为0.9337mev,或大约或1.5x10-13焦耳。其他次要衰减路径会产生其他低能γ辐射和电子。与主要路径相比,这些路径的辐射剂量在临床上可以忽略不计。
108.当前,锶90也可商购获得。作为另一个示例,在一些实施方案中,本发明的特征在于锶90(sr-90)在与钇90(y-90)的长期平衡中的用途。锶90(sr-90)通过β射线衰减到钇90(y-90)。父sr-90同位素的半衰期为28.79年。子y-90同位素的半衰期为64.0小时。这两种同位素的长期平衡处于由sr-90父控制的组合源的衰减率,但从子y-90发出的治疗性β射线,其最大能量为2.28mev,平均能量为934kev。
109.计划靶体积(ptv)或计划治疗体积(ptv)是为放射治疗计划引入的几何概念。ptv用于确保将规定的剂量实际输送到靶组织的所有部分。在不将本发明限制于任何特定外科手术实践的情况下,医学杂志上的文章详细介绍了泡的外科手术创建,其中“外科医生用westcott剪刀向后解剖,以向后形成约10至15mm的口袋,并足够宽以容纳抗代谢物海绵”。在此示例中,外科医生打开了结膜和特农氏囊下方的潜在间隙,形成了直径约10至15mm的泡。例如,可以将靶体积定义为直径为15mm深度为0.3mm的圆盘,其中包含结膜和特农氏囊的组织。
110.例如,在整个靶体积中,10戈(1000cgy)的近距离放射治疗的处方剂量为10j/kg吸收剂量。测量表明,活性为1.48gbq的sr-90/y-90rbs模型产生的表面剂量率约为每秒0.20gy。要将10gy的剂量输送到靶体积,将需要50秒的辐射时间。在这50秒的治疗过程中,衰变的核数为1.48x109bq(每秒崩解)x50秒=7.4x10
10
。眼睛的靶
111.如前所述,本发明提供了用于将β射线施加到眼睛的治疗区域或靶的方法和系统。在一些实施方案中,靶是正在用migs植入物或migs手术治疗青光眼的眼睛中泡的位点。在一些实施方案中,靶是用小梁切除术治疗的眼睛中泡的位点。在一些实施方案中,靶是用微创微巩膜造口术(mims)治疗的眼睛中泡的位点。在一些实施方案中,靶是用mims治疗的眼睛中的孔的位点。在一些实施方案中,靶是植入物的位点,所述植入物通过手术植入眼睛以治疗青光眼。在一些实施方案中,靶是与翼状胬肉相关的眼睛的位点。
112.在一些实施方案中,靶包括整个泡。在一些实施方案中,靶包括泡的一部分。在一些实施方案中,靶区域包围migs植入物的末端。在一些实施方案中,靶包括引流通道上方的泡的至少一部分。在一些实施方案中,靶还包括引流通道上方的泡的至少一部分和泡的周边的至少一部分。在一些实施方案中,靶还包括引流通道上方的泡的至少一部分、泡的周边的至少一部分、以及周边和引流通道之上的部分之间的泡的至少一部分。
113.在一些实施方案中,靶区域是整个泡,例如泡的周边、泡的中心以及周边和中心之间的泡部分。在一些实施方案中,靶区域是泡的周边,例如,环形靶区域。在一些实施方案中,靶是泡的周边和靠近周边的泡的一部分,例如,靶可以是环形的。在一些实施方案中,靶是在中心和周边之间的泡的一部分。在一些实施方案中,靶是泡的中心的至少一部分。本发明不限于靶区域的上述描述。例如,在一些实施方案中,靶是(或包括)围绕引流通道边缘的组织。
114.在一些实施方案中,靶是除与migs/mims/小梁切除术相关的靶以外的靶。在一些实施方案中,眼科靶是除与青光眼引流手术相关的那些靶以外的其他靶。在一些实施方案中,靶是眼睛的炎症、自身免疫介导的病变或血管病症。在一些实施方案中,靶包括巨噬细胞。在一些实施方案中,靶包括成纤维细胞。在一些实施方案中,靶包括内皮细胞。在一些实施方案中,靶与感染(例如,单纯疱疹性角膜炎或结核性硬角膜炎)、角膜溃疡(例如,蚕食性角膜溃疡(moorens))、过敏性疾病(例如,春季(vernal))、良性或恶性肿瘤(例如,鳞状细胞
癌)或良性生长(例如乳头状瘤)、变性(例如翼状胬肉)、结节病(例如类天疱疮)、炎症(例如睑板腺)、史蒂文斯—约翰逊(stevens-johnson)综合征的眼部表现、药物诱发的结疤性结膜炎、木样结膜炎、角膜血管化、翼状胬肉、春季卡他性结膜炎(vernalcatarrh)、眼睑小乳头状瘤、角膜缘癌、眼部恶性黑色素瘤、结膜色素痣、血管瘤、睑板腺囊肿。在一些实施方案中,靶在眼睛的眼眶中。本发明包括其他眼科适应症,并且不限于上述靶。
115.本发明的系统将射线的一定剂量递送到靶区域或治疗区域。靶区域或治疗区域可以是在暴露于β射线的组织内在特定深度(例如,距施加器外表面的距离、距眼睛表面的距离、距顶部的距离、rbs的距离等)处的具有特定尺寸(例如,直径)的平面。
116.在一些实施方案中,靶平面具有约2mm的直径。在一些实施方案中,靶平面具有约3mm的直径。在一些实施方案中,靶平面具有约4mm的直径。在一些实施方案中,靶平面具有约5mm的直径。在一些实施方案中,靶平面具有约6mm的直径。在一些实施方案中,靶平面具有约7mm的直径。在一些实施方案中,靶平面具有约8mm的直径。
117.在一些实施方案中,靶平面具有约9mm的直径。在一些实施方案中,靶平面具有约10mm的直径。在一些实施方案中,靶平面具有约11mm的直径。在一些实施方案中,靶平面具有约12mm的直径。在一些实施方案中,靶平面具有从10到14mm的直径。在一些实施方案中,靶平面具有从6到10mm的直径。在一些实施方案中,靶平面具有从5到12mm的直径。在一些实施方案中,靶平面具有从6到12mm的直径。在一些实施方案中,靶平面具有从8到10mm的直径。在一些实施方案中,靶平面具有从8到12mm的直径。在一些实施方案中,靶平面具有6至8mm的直径。在一些实施方案中,靶平面具有7至10mm的直径。在一些实施方案中,靶平面具有从8到11mm的直径。在一些实施方案中,靶平面具有从9到11mm的直径。在一些实施方案中,靶平面具有从9到12mm的直径。本发明不限于上述靶表面的尺寸。
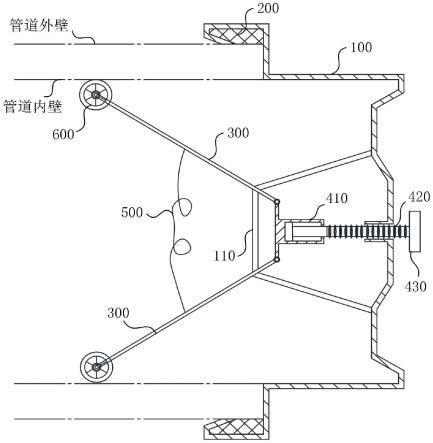
118.在一些实施方案中,靶平面是从0到700微米的距离,例如,距施加器的外表面(例如,施加器与眼组织接触的部分)、距眼睛表面、距气泡的顶部和距rbs等。在一些实施方案中,靶平面是从0到100微米的距离,例如,距施加器的外表面(例如,施加器与眼组织接触的部分)、距眼睛表面、距气泡的顶部和距rbs等。在一些实施方案中,靶平面是从100到200微米的距离,例如,距施加器的外表面(例如,施加器与眼组织接触的部分)、距眼睛表面、距气泡的顶部和距rbs等。在一些实施方案中,靶平面是从200到400微米的距离,例如,距施加器的外表面(例如,施加器与眼组织接触的部分)、距眼睛表面、距气泡的顶部和距rbs等。在一些实施方案中,靶平面是从200到600微米的距离,例如,距施加器的外表面(例如,施加器与眼组织接触的部分)、距眼睛表面、距气泡的顶部和距rbs等。在一些实施方案中,靶平面是从400到600微米的距离,例如,距施加器的外表面(例如,施加器与眼组织接触的部分)、距眼睛表面、距气泡的顶部和距rbs等。
119.在一些实施方案中,跨靶上或靶内的特定靶平面上的剂量变化不超过最大剂量的10%。在一些实施方案中,跨靶上或靶内的特定靶平面上的剂量变化不超过最大剂量的15%。在一些实施方案中,跨靶上或靶内的特定靶平面上的剂量变化不超过最大剂量的20%。在一些实施方案中,跨靶上或靶内的特定靶平面上的剂量变化不超过最大剂量的30%。在一些实施方案中,治疗区域靶平面上任何点的剂量在治疗区域靶平面上任何其他点的剂量的10%以内。在一些实施方案中,治疗区域靶平面上任何点的剂量在治疗区域靶平面上任何其他点的剂量的20%以内。在一些实施方案中,治疗区域的靶平面上的任何点
的剂量在治疗区域的靶平面上的任何其他点的剂量的30%以内。在一些实施方案中,治疗区域靶平面上任何点的剂量在治疗区域靶平面上任何其他点的剂量的40%以内。在一些实施方案中,治疗区域靶平面上任何点的剂量在治疗区域靶平面上任何其他点的剂量的50%以内。
120.在一些实施方案中,将射线剂量递送到靶平面上的多个点,其中,靶平面上的一个点接收的剂量在靶平面上的任何其他点接收的剂量的50%以内。在一些实施方案中,将射线剂量递送到靶平面上的多个点,其中,靶平面上的一个点接收的剂量在靶平面上的任何其他点接收的剂量的40%以内。在一些实施方案中,将射线剂量递送到靶平面上的多个点,其中,靶平面上的一个点接收的剂量在靶平面上的任何其他点接收的剂量的30%以内。在一些实施方案中,将射线剂量递送到靶平面上的多个点,其中,靶平面上的一个点接收的剂量在靶平面上的任何其他点接收的剂量的20%以内。在一些实施方案中,将射线剂量递送到靶平面上的多个点,其中,靶平面上的一个点接收的剂量在靶平面上的任何其他点接收的剂量的15%以内。在一些实施方案中,将射线剂量递送到靶平面上的多个点,其中,靶平面上的一个点接收的剂量在靶平面上的任何其他点接收的剂量的10%以内。β射线的应用
121.本发明的方法和系统将特定射线剂量递送至靶,例如,递送至靶内的平面(例如,代表治疗区域的一部分的在特定深度处的特定尺寸的平面(例如,ptv))。
122.在一些实施方案中,所述方法和系统向靶递送1000cgy(10gy)的射线剂量。在一些实施方案中,该方法和系统向靶递送900cgy的射线剂量。在一些实施方案中,所述方法和系统向靶递送800cgy的射线剂量。在一些实施方案中,所述方法和系统向靶递送750cgy的射线剂量。在一些实施方案中,所述方法和系统向靶递送600cgy的射线剂量。在一些实施方案中,所述方法和系统向靶递送500cgy的射线剂量。在一些实施方案中,所述方法和系统向靶递送400cgy的射线剂量。在一些实施方案中,所述方法和系统向靶递送300cgy的射线剂量。在一些实施方案中,所述方法和系统向靶递送200cgy的射线剂量。在一些实施方案中,所述方法和系统向靶递送100cgy的射线剂量。在一些实施方案中,所述方法和系统向靶递送50cgy的射线剂量。在一些实施方案中,所述方法和系统向靶递送1100cgy的射线剂量。在一些实施方案中,所述方法和系统向靶递送1200cgy的射线剂量。在一些实施方案中,所述方法和系统向靶递送1300cgy的射线剂量。在一些实施方案中,所述方法和系统向靶递送1500cgy的射线剂量。在一些实施方案中,所述方法和系统向靶递送600cgy到1500cgy的射线剂量。在一些实施方案中,所述方法和系统递送50cgy到100cgy的射线剂量。在一些实施方案中,所述方法和系统递送100cgy到150cgy的射线剂量。在一些实施方案中,所述方法和系统递送150cgy到200cgy的射线剂量。在一些实施方案中,所述方法和系统递送200cgy到250cgy的射线剂量。在一些实施方案中,所述方法和系统递送250cgy到300cgy的射线剂量。在一些实施方案中,所述方法和系统递送300cgy到350cgy的射线剂量。在一些实施方案中,所述方法和系统递送350cgy到400cgy的射线剂量。在一些实施方案中,所述方法和系统递送400cgy到450cgy的射线剂量。在一些实施方案中,所述方法和系统递送450cgy到500cgy的射线剂量。在一些实施方案中,所述方法和系统递送500cgy到550cgy的射线剂量。在一些实施方案中,所述方法和系统递送550cgy到600cgy的射线剂量。在一些实施方案中,所述方法和系统递送600cgy到650cgy的射线剂量。在一些实施方案中,所述方法和系统递送650cgy到700cgy的射线剂量。在一些实施方案中,所述方法和系统递送700cgy到750cgy的
射线剂量。在一些实施方案中,所述方法和系统递送750cgy到800cgy的射线剂量。在一些实施方案中,所述方法和系统递送800cgy到850cgy的射线剂量。在一些实施方案中,所述方法和系统递送850cgy到900cgy的射线剂量。在一些实施方案中,所述方法和系统递送900cgy到950cgy的射线剂量。在一些实施方案中,所述方法和系统递送950cgy到1000cgy的射线剂量。在一些实施方案中,所述方法和系统递送1000cgy到1050cgy的射线剂量。在一些实施方案中,所述方法和系统递送1050cgy到1100cgy的射线剂量。在一些实施方案中,所述方法和系统递送1100cgy到1150cgy的射线剂量。在一些实施方案中,所述方法和系统递送1150cgy到1200cgy的射线剂量。在一些实施方案中,所述方法和系统递送1200cgy到1250cgy的射线剂量。在一些实施方案中,所述方法和系统递送1250cgy到1300cgy的射线剂量。在一些实施方案中,所述方法和系统递送1300cgy到1350cgy的射线剂量。在一些实施方案中,所述方法和系统递送1350cgy到1400cgy的射线剂量。在一些实施方案中,所述方法和系统递送1400cgy到1450cgy的射线剂量。在一些实施方案中,所述方法和系统递送1450cgy到1500cgy的射线剂量。在一些实施方案中,所述方法和系统递送1500cgy到1550cgy的射线剂量。在一些实施方案中,所述方法和系统递送1550cgy到1600cgy的射线剂量。在一些实施方案中,所述方法和系统递送1600cgy到1800cgy的射线剂量。在一些实施方案中,所述方法和系统递送1800cgy到2000cgy的射线剂量。在一些实施方案中,所述方法和系统向靶递送600、650、700、750、800、850、900、950、1000、1050、1100、1150、1200、1250、1300、1350、1400、1450或1500cgy的射线剂量。在一些实施方案中,所述方法和系统递送1500cgy到3200cgy的射线剂量。在一些实施方案中,所述方法和系统递送3200cgy到8000cgy的射线剂量。在一些实施方案中,所述方法和系统递送8000cgy到10000cgy的射线剂量。在一些实施方案中,所述方法和系统递送大于10000cgy的射线剂量。
123.本文引用的剂量可指距装置表面特定深度处的剂量,例如0.05mm、0.1mm、0.15mm、0.2mm、0.25mm、0.3mm、0.35mm、0.4mm、0.45mm、0.5mm、0.55mm、0.6mm、0.65mm、0.7mm、0.75mm、0.8mm的深度等。
124.在一些实施方案中,所述方法和系统向靶(例如,治疗区域内的特定尺寸/直径的平面)提供一定剂量的β射线,其中,靶上任何点的剂量(例如,治疗区域内特定大小/直径的平面)在靶上任何其他点的剂量的10%以内。在一些实施方案中,所述方法和系统向靶(例如,治疗区域内的特定尺寸/直径的平面)提供一定剂量的β射线,其中,靶上任何点的剂量(例如,治疗区域内特定大小/直径的平面)在靶上任何其他点的剂量的15%以内。在一些实施方案中,该方法和系统向靶(例如,治疗区域内的特定尺寸/直径的平面)提供一定剂量的β射线,其中,靶上任何点的剂量(例如,治疗区域内特定大小/直径的平面)在靶上任何其他点的剂量的20%以内。在一些实施方案中,所述方法和系统向靶(例如,治疗区域内的特定尺寸/直径的平面)提供一定剂量的β射线,其中,靶上任何点的剂量(例如,治疗区域内特定大小/直径的平面)在靶上任何其他点的剂量的25%以内。在一些实施方案中,所述方法和系统向靶(例如,治疗区域内的特定尺寸/直径的平面)提供一定剂量的β射线,其中,靶上任何点的剂量(例如,治疗区域内特定大小/直径的平面)在靶上任何其他点的剂量的30%以内。在一些实施方案中,所述方法和系统向靶(例如,治疗区域内的特定尺寸/直径的平面)提供一定剂量的β射线,其中,靶上任何点的剂量(例如,治疗区域内特定大小/直径的平面)在靶上任何其他点的剂量的35%以内。在一些实施方案中,所述方法和系统向靶(例如,治
疗区域内的特定尺寸/直径的平面)提供一定剂量的β射线,其中,靶上任何点的剂量(例如,治疗区域内特定大小/直径的平面)在靶上任何其他点的剂量的40%以内。在一些实施方案中,所述方法和系统向靶(例如,治疗区域内的特定尺寸/直径的平面)提供一定剂量的β射线,其中,靶上任何点的剂量(例如,治疗区域内特定大小/直径的平面)在靶上任何其他点的剂量的45%以内。在一些实施方案中,所述方法和系统向靶(例如,治疗区域内的特定尺寸/直径的平面)提供一定剂量的β射线,其中,靶上任何点的剂量(例如,治疗区域内特定大小/直径的平面)在靶上任何其他点的剂量的50%以内。
125.在一些实施方案中,所述方法和系统在10秒到20分钟的时间内递送规定剂量。在一些实施方案中,所述方法和系统在20秒到10分钟的时间内递送规定剂量。在一些实施方案中,所述方法和系统在20秒到60秒的时间内递送规定剂量。在一些实施方案中,所述方法和系统在30秒到90秒的时间内递送规定剂量。在一些实施方案中,所述方法和系统在60秒到90秒的时间内递送规定剂量。在一些实施方案中,所述方法和系统在90秒到2分钟的时间内递送规定剂量。在一些实施方案中,所述方法和系统在2分钟到3分钟的时间内递送规定剂量。
126.在一些实施方案中,所述方法和系统在3分钟到4分钟的时间内递送规定剂量。在一些实施方案中,所述方法和系统在3分钟到5分钟的时间内递送规定剂量。在一些实施方案中,所述方法和系统在3分钟到6分钟的时间内递送规定剂量。在一些实施方案中,所述方法和系统在4分钟到5分钟的时间内递送规定剂量。在一些实施方案中,所述方法和系统在4分钟到6分钟的时间内递送规定剂量。在一些实施方案中,所述方法和系统在5分钟到6分钟的时间内递送规定剂量。在一些实施方案中,所述方法和系统在6分钟到7分钟的时间内递送规定剂量。在一些实施方案中,所述方法和系统在7分钟到8分钟的时间内递送规定剂量。在一些实施方案中,所述方法和系统在8分钟到9分钟的时间内递送规定剂量。在一些实施方案中,所述方法和系统在9分钟到10分钟的时间内递送规定剂量。在一些实施方案中,所述方法和系统在10分钟到12分钟的时间内递送规定剂量。在一些实施方案中,所述方法和系统在12分钟到15分钟的时间内递送规定剂量。在一些实施方案中,所述方法和系统在15分钟到20分钟的时间内递送规定剂量。
127.在一些实施方案中,所述方法和系统在5秒内递送规定剂量。在一些实施方案中,所述方法和系统在10秒内递送规定剂量。在一些实施方案中,所述方法和系统在15秒内递送规定剂量。在一些实施方案中,所述方法和系统在20秒内递送规定剂量。在一些实施方案中,所述方法和系统在25秒内递送规定剂量。在一些实施方案中,所述方法和系统在45秒内递送规定剂量。在一些实施方案中,所述方法和系统在60秒内递送规定剂量。在一些实施方案中,所述方法和系统在90秒内递送规定剂量。在一些实施方案中,所述方法和系统在2分钟内递送规定剂量。在一些实施方案中,所述方法和系统在3分钟内递送规定剂量。在一些实施方案中,所述方法和系统在4分钟内递送规定剂量。在一些实施方案中,所述方法和系统在5分钟内递送规定剂量。在一些实施方案中,所述方法和系统在6分钟内递送规定剂量。在一些实施方案中,所述方法和系统在7分钟内递送规定剂量。在一些实施方案中,所述方法和系统在8分钟内递送规定剂量。在一些实施方案中,所述方法和系统在9分钟内递送规定剂量。在一些实施方案中,所述方法和系统在10分钟内递送规定剂量。在一些实施方案中,所述方法和系统在11分钟内递送规定剂量。在一些实施方案中,所述方法和系统在12分
钟内递送规定剂量。在一些实施方案中,所述方法和系统在13分钟内递送规定剂量。在一些实施方案中,所述方法和系统在14分钟内递送规定剂量。在一些实施方案中,所述方法和系统在15分钟内递送规定剂量。在一些实施方案中,所述方法和系统在16分钟内递送规定剂量。在一些实施方案中,所述方法和系统在17分钟内递送规定剂量。在一些实施方案中,所述方法和系统在18分钟内递送规定剂量。在一些实施方案中,所述方法和系统在19分钟内递送规定剂量。在一些实施方案中,所述方法和系统在20分钟内递送规定剂量。在一些实施方案中,所述方法和系统在大于20分钟的时间范围内递送规定剂量。
128.在一些实施方案中,可以在单次施加中递送剂量(例如,规定剂量)。在其他实施方案中,可以将剂量(例如,规定剂量)分次并以多次应用方式施加。例如,在一些实施方案中,可以在2次施加的过程中施加辐射(例如,规定剂量)。在一些实施方案中,可以在3次施加的过程中施加辐射(例如,规定剂量)。在一些实施方案中,可以在4次施加的过程中施加辐射(例如,规定剂量)。在一些实施方案中,可以在5次施加的过程中施加辐射(例如,规定剂量)。在一些实施方案中,可以在超过5次施加的过程中施加辐射(例如,规定剂量)。在一些实施方案中,可以在20次施加的过程中施加辐射(例如,规定剂量)。在一些实施方案中,可以在超过20次施加的过程中施加辐射(例如,规定剂量)。
129.每个施加可以递送相等的子剂量。在一些实施方案中,一个或多个子剂量是不同的。例如,一个或多个子剂量可以是不同的,以便随着每次的附加施加而增加或减少。根据一个实施方案,可以在治疗手术例如植入装置例如migs装置的手术或其他适当的青光眼手术之前施加一定剂量的辐射。例如,在一些实施方案中,可以在手术(例如,插入装置)前一天或多天施加一定剂量的辐射。在一些实施方案中,可以在手术(例如,插入装置)之前的24h内施加一定剂量的辐射。在一些实施方案中,可以在手术(例如,插入装置)之前,例如在手术前1h、手术前30min、手术前15min、手术前5min、手术前1min等等施加一定剂量的辐射。在一些实施方案中,可以在例如用于植入装置的手术过程中施加一定剂量的辐射。在一些实施方案中,可以在植入装置(例如,migs装置)后或在形成孔之后的例如1min、2min、3min、5min、10min等之内立即施加一定剂量的辐射。在一些实施方案中,可以在结膜上切开切口之前施加一定剂量的辐射。在一些实施方案中,可以在结膜上切开切口之后施加一定剂量的辐射。在其他实施方案中,可以在手术(例如,插入装置)之后施加一定剂量的辐射。在一些实施方案中,可以在手术(例如,插入装置)后的24h内施加一定剂量的辐射。在一些实施方案中,可以在手术(例如,插入装置)后的一到两天内施加一定剂量的辐射。在一些实施方案中,可以在手术(例如,插入装置)后的两天或更多天内施加一定剂量的辐射。在一些实施方案中,可以在青光眼手术后的任何时间施加剂量。在一些实施方案中,在青光眼手术后数月或数年施加剂量。例如,可以给在手术期间没有接受剂量但在将来有瘢痕或针刺手术以破坏瘢痕组织的患者给予剂量。方法
130.本发明的特征在于将治疗量的β射线施加到治疗区域的方法和系统,例如用于排出房水的泡的靶区域,例如但不限于与微创青光眼手术(migs)植入物或插入到眼睛前房和眼睛结膜下间隙之间或眼睛前房和结膜与特农氏囊的间隙之间的异物相关的泡结合青光眼和白内障手术。本文的方法和系统可用于将β射线施加到眼睛中的靶区域以帮助维持由青光眼引流外科手术或手术产生的功能性气泡和/或引流孔、帮助避免瘢痕形成或伤口复原、抑制或减少泡或周围区域的纤维化和/或炎症、治疗青光眼、降低眼内压(iop)、实现和/
或维持健康的眼内压,使特农氏囊上成纤维细胞的细胞周期停滞、增强引流装置的功能(例如migs植入物等)。本发明不限于本文所公开的应用。
131.所述方法的特征可在于使用施加器系统将治疗量β的射线从放射性同位素施加到眼睛的靶区域。
132.在一些实施方案中,所述方法包括进行青光眼手术,其形成用于排出房水的泡。例如,所述方法可以包括在眼中植入微创青光眼手术(migs)植入物,其中,所述植入物导致气泡形成(例如,在眼睛的结膜下间隙中、在结膜和特农氏囊之间的间隙中);泡的作用是排出房水。在一些实施方案中,植入物经巩膜插入到眼睛的前房和眼睛的结膜下间隙之间、眼睛前房和结膜与特农氏囊的间隙之间等。
133.在一些实施方案中,所述方法包括进行白内障手术。
134.所述方法的特征在于在白内障和青光眼联合手术(如植入引流装置,如migs植入)时或前后(如青光眼手术前、青光眼手术后、白内障手术前、白内障手术后等)对靶位点(如引流位点或其他适当位点)施加治疗剂量的β射线。例如,所述方法可以包括在插入migs植入物之前、在切开结膜之前、在创建与mims相关的孔之前等施加β辐射。在一些实施方案中,所述方法包括在插入migs植入物之后、在切开结膜之前、在创建与mims相关的孔之前等施加β射线。
135.本文方法的特征还可在于将药物施加到眼睛,例如靶、靶附近的区域、引流装置或植入物的位点、泡的侧面、眼睛的不同的部分等。药物的非限制性示例包括丝裂霉素c、5氟尿嘧啶、抗vegf组合物和其他合适的组合物。在一些实施方案中,药物在外科手术之前、之间和/或之后施加。
136.如前所述,β射线可以通过放射性核素近距离放射治疗源(rbs)施加。rbs可以通过施加器施加到靶上。如前所述,在一些实施方案中,β射线是锶-90(sr-90)、磷-32(p-32)、钌106(ru-106)、钇90(y-90)或其组合。
137.本发明的示例包括但不限于发射β射线的放射性同位素,其用在治疗青光眼和白内障的方法中、发射β射线的放射性同位素,其用于预防或减少引流泡或引流通道中的瘢痕形成,所述引流泡为正在或已经接受青光眼引流手术和白内障手术的治疗的人眼中的引流泡、发射β射线的放射性同位素,其用于降低正在接受或已经接受青光眼手术和白内障手术治疗的人眼中的眼内压(iop)的方法、包含β射线源的组合物,其用于在正在或已经接受青光眼和白内障治疗的人眼中实现健康眼内压(iop)的方法等。放射性同位素或组合物可施加到眼睛,以使来自β辐射源的β辐射施加到眼睛的靶区域,其中靶区域与引流泡、引流通道或青光眼引流植入物相关。
138.本发明的方法的示例包括但不限于治疗青光眼和白内障的方法、预防或减少正在或已经接受青光眼手术和白内障手术治疗的人眼中的引流泡或引流通道内瘢痕形成的方法、用于降低正在或已接受青光眼手术和白内障手术治疗的人眼中的眼内压(iop)的方法、用于正在或已接受青光眼手术和白内障手术治疗的人眼中实现健康眼内压(iop)的方法等。
139.青光眼手术允许房水排入结膜下间隙或结膜和特农氏囊间的间隙中的泡中。在一些实施方案中,青光眼手术是微创青光眼手术(migs)。
140.在一些实施方案中,本文的方法对以下一种或组合有效:维持功能性引流泡;抑制
或减少泡中、引流植入物周围或引流通道周围的纤维化和炎症;以及减少结膜炎。在一些实施方案中,本文的方法有效地实现健康的iop。在一些实施方案中,本文的方法有效地维持健康的iop。在一些实施方案中,本文的方法有效地降低iop和维持iop。
141.抑制或减少泡中的纤维化和炎症可根据预定的泡分级量表来测量。在一些实施方案中,预定的泡分级量表是摩菲(moorfields)泡分级量表(mbgs)。在一些实施方案中,预定的泡分级量表是indiana泡外观分级量表(ibags)。
142.在一些实施方案中,本文的方法包括在眼睛中进行青光眼引流手术和对眼睛进行白内障手术。在一些实施方案中,本文的方法在已经进行的青光眼引流手术和/或白内障手术之后进行。
143.本文的方法的特征在于将来自放射性同位素或组合物或源的治疗剂量的β射线施加到眼睛的靶区域。靶区域可与泡相关。在一些实施方案中,靶区域与青光眼引流植入物相关。在一些实施方案中,靶区域与引流通道相关。
144.在一些实施方案中,在进行青光眼引流手术之后将β射线施加到靶。在一些实施方案中,在进行青光眼引流手术之前将β射线施加到靶。在一些实施方案中,在进行青光眼引流手术时将β射线施加到靶。在一些实施方案中,在进行青光眼引流手术之前和之后将β射线施加到靶。
145.在一些实施方案中,本文的方法进一步包括将药物施加到靶区域。药物的非限制性示例包括丝裂霉素c、5氟尿嘧啶、抗vegf组合物等。
146.在一些实施方案中,眼内压(iop)降低至12mmhg或更低。在一些实施方案中,iop降低至10mmhg或更低。在一些实施方案中,iop降低至5至10mmhg。在一些实施方案中,iop降低至5至12mmhg。在一些实施方案中,iop降低至8至10mmhg。在一些实施方案中,iop降低至8至12mmhg。
147.在一些实施方案中,所述方法在治疗后6个月有效地降低iop 10%或更多。在一些实施方案中,所述方法在治疗后6个月有效地降低iop 20%或更多。在一些实施方案中,所述方法在治疗后6个月有效地降低iop 30%或更多。在一些实施方案中,所述方法在治疗后6个月有效地降低iop 40%或更多。在一些实施方案中,所述方法在治疗后6个月有效地降低iop 50%或更多。
148.在一些实施方案中,所述方法在治疗后12个月有效地降低iop 10%或更多。在一些实施方案中,所述方法在治疗后12个月有效地降低iop 20%或更多。在一些实施方案中,所述方法在治疗后12个月有效地降低iop 30%或更多。在一些实施方案中,所述方法在治疗后12个月有效地降低iop 40%或更多。在一些实施方案中,所述方法在治疗后12个月有效地降低iop 50%或更多。
149.在一些实施方案中,所述方法在治疗后24个月有效地降低iop 10%或更多。在一些实施方案中,所述方法在治疗后24个月有效地降低iop 20%或更多。在一些实施方案中,所述方法在治疗后24个月有效地降低iop 30%或更多。在一些实施方案中,所述方法在治疗后24个月有效地降低iop 40%或更多。在一些实施方案中,所述方法在治疗后24个月有效地降低iop 50%或更多。
150.在一些实施方案中,所述方法在治疗后36个月有效地降低iop 10%或更多。在一些实施方案中,所述方法在治疗后36个月有效地降低iop 20%或更多。在一些实施方案中,
所述方法在治疗后36个月有效地降低iop 30%或更多。在一些实施方案中,所述方法在治疗后36个月有效地降低iop 40%或更多。在一些实施方案中,所述方法在治疗后36个月有效地降低iop 50%或更多。
151.在一些实施方案中,所述方法有效地降低iop以及随后稳定iop。在一些实施方案中,iop的稳定是iop在治疗后3个月增加不超过10%。在一些实施方案中,iop的稳定是iop在治疗后6个月增加不超过10%。在一些实施方案中,iop的稳定是iop在治疗后12个月增加不超过10%。在一些实施方案中,iop的稳定是iop在治疗后24个月增加不超过10%。在一些实施方案中,iop的稳定是iop在治疗后36个月增加不超过10%。
152.在一些实施方案中,iop的稳定化是iop在治疗后3个月增加不超过20%。在一些实施方案中,iop的稳定是iop在治疗后6个月增加不超过20%。在一些实施方案中,iop的稳定是iop在治疗后12个月增加不超过20%。在一些实施方案中,iop的稳定是iop在治疗后24个月增加不超过20%。在一些实施方案中,iop的稳定是iop在治疗后36个月增加不超过20%。
153.在一些实施方案中,iop的稳定是iop在治疗后24个月时增加不超过25%。在一些实施方案中,iop的稳定是iop在治疗后36个月增加不超过25%。
154.在一些实施方案中,本文的方法、系统和装置可用于针刺手术,例如,对泡和/或孔进行的以释放或去除围绕该泡和/或孔和/或手术部位的瘢痕组织和/或囊性结构的手术,该瘢痕组织和/或囊性结构可能由伤口愈合或瘢痕或炎症反应而引起。针刺手术可能会影响手术部位的形态,恢复手术功能和/或降低iop。实施例1:施加β射线的外科手术本发明提供了将β射线施加到眼睛的过程的示例。本发明绝不限于本文所述的具体步骤、方法、装置、系统和组合物。准备和组装
155.在有机玻璃β防护罩(例如,universal medicalinc.的大双角β射线防护罩)之后执行装置的组装程序。医学技术人员或医学物理师打开放射性同位素近距离放射源(rbs)的储存容器。使用适当的处理技术(例如,长镊子)将rbs从其容器中移出。将rbs放置在干净的场所。
156.近距离放射治疗施加器可以是一次性使用的无菌包装装置。可以通过检查无菌屏障的损坏或破坏来检查其包装。如果没有找到损坏或破坏,则打开近距离放射治疗施加器包装,并将施加器组件放置在无菌场所中。
157.近距离放射治疗施加器包括手柄和rbs帽。使用无菌技术和远程处理技术,将rbs加载到近距离放射治疗施加器中,例如,rbs可以插入帽中,然后把手柄连接到帽上,固定rbs。注意避免污染。
158.确认辐射输出符合放射疗法中的质量保证标准(例如,参见:palmer,antonyl.,andrewnisbet和davidbradley。“通过ebt3全色薄膜质量控制验证高剂量率近距离放射疗法剂量分布”,医学与生物学物理58.3(2013):497。在一种质量保证方法中,将施加器以无菌的外包装施加辐射照相胶片上一段指定的停留时间(例如,胶片,ashland inc.)。外包装被去除。医学物理学家会检查施加区域是否有胶卷曝光的证据。
159.将装置放置在无菌的有机玻璃β运输箱中(例如,ibiβ-gard丙烯酸存储容器-大,universal medicalinc.),并将该箱放置在可操作的mayo支架上。
160.先前已经计算出rbs的衰变活性以确定每单位时间的现代剂量(例如,cgy/s)。衰变计算方法是医学物理学领域的技术人员所熟知的,并且还在nrc信息公告96-66:美国核
监管委员会,核材料安全和保障办公室,华盛顿特区20555,1996年12月13日中进行了描述。然后计算出总处方剂量的停留时间。例如,处方剂量为距结膜表面0.19mm深度中心点的剂量为1,000cgy。例如,在水当量深度为0.19mm时,rbs的衰减活性为30cgy/s。在此示例中,停留时间经计算为约33s,提供了990cgy剂量。手术应用
161.在完成青光眼手术后进行β射线疗法。(注意,本发明不限于在青光眼手术后应用β射线。)通过使用靠在巩膜上以提供牵引力的探针(例如,靠在眼睛上vera钩的远端),将眼睛旋转到向下凝视位置。这样可以更好地通过视觉和手术接近结膜。
162.眼科医生例如从运输箱中获得近距离放射治疗施加器装置。施加器的尖端(例如,远端、活动端)放在结膜上,位置正好在角膜缘上方。施加器的直径包括靶(例如泡)的适当表面积。近距离放射治疗施加器被压在眼睛表面。在一些实施方案中,近距离放射治疗施加器被压到眼睛的表面,以使所有或基本上所有的水肿液都被推开。施加器在指定的停留时间内保持在原位。在一些实施方案中,停留时间已经被编程为倒数计时器。在指定的停留时间之后,将近距离放射治疗施加器从手术区域中移出。
163.在手术结束时,将抗生素软膏施加到眼睛并对眼睛进行修补。
164.在一些实施方案中,在手术之后,将手动近距离放射治疗施加器在丙烯酸β防护罩的后面进行拆卸。放射性同位素近距离放射疗法源返回到其储存容器。装置的一次性部分以与生物垃圾(例如“红色袋子”垃圾)的适当处置相一致的方式被丢弃。实施例2:超声乳化和小梁切除术的外科手术
165.本发明提供了用于摘除白内障然后进行小梁切除术的手术的示例。本发明绝不限于本文所述的具体步骤、方法、装置、系统和组合物。
166.从眼睛中去除天然晶状体:在眼睛的透明前窗(角膜)中创建开口。在包含眼睛天然晶状体的口袋(囊)的前部形成一个圆形开口。使用超声波将天然晶状体从囊内取出以将其分解(超声乳化)和抽出。
167.人工晶状体的引入:将透明的人工晶状体折叠并通过相同的角膜开口引入囊中。它在囊中展开。
168.在巩膜中创建活板门(trapdoor)。覆盖眼睛前部白色面(巩膜)的薄层(结膜)通过切割其前部的附着物而反射回来。在前面(通过角膜)铰接的巩膜中创建了一个活板门。
169.在活板门的基部/铰链处进入眼睛房室的开口:经巩膜进入眼睛前房的孔(小梁切除术),还在虹膜中制造孔以阻止虹膜浮起而堵住巩膜孔。活板门用特殊缝线闭合,如果需要,可以在手术后将缝线拆下以将活板门打开。
170.活板门上方的结膜闭合:将结膜重新附着在角膜的边缘以覆盖活板门及其开口。红线显示流体(房水)从眼睛前房流出,通过活板门流向结膜下间隙,形成一个泡。
171.本文所述的任何特征或特征的组合都包括在本发明的范围内,只要任何此类组合中包括的特征不相互矛盾,这将从上下文、本说明书和本领域普通技术人员的知识中显而易见。本发明的其他优点和方面在以下详细描述和权利要求中是显而易见的。
172.除了本文描述的那些之外,根据前述描述,本发明的各种修改对于本领域技术人员将是显而易见的。这些修改也意图落入所附权利要求的范围内。本技术中引用的每个参考文献通过引用整体并入本文。
173.尽管已经示出并描述了本发明的优选实施方案,但是对于本领域技术人员而言显
而易见的是,可以对其做出不超出所附权利要求的范围的修改。因此,本发明的范围仅由所附权利要求书限制。权利要求书中引用的数字是示例性的且仅为了便于专利局审查,并且不以任何方式进行限制。在一些实施方式中,在本专利申请中提出的附图是按比例绘制的,包括角度、尺寸比例等。在一些实施方案中,附图仅是代表性的,并且权利要求不受附图尺寸的限制。在一些实施方案中,本文中使用短语“包括”所描述的发明的说明书包括可以被描述为“由...组成”的实施方案,因此,符合使用短语“由...构成”要求保护本发明的一个或多个实施方案的书面描述的要求。
174.本文中引用的任何参考数字,包括下面的权利要求,仅是为了便于审查本专利申请,是示例性的,并且不旨在以任何方式将权利要求的范围限制在具有相应附图标记的特定特征上。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。