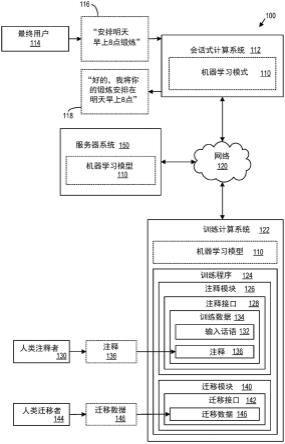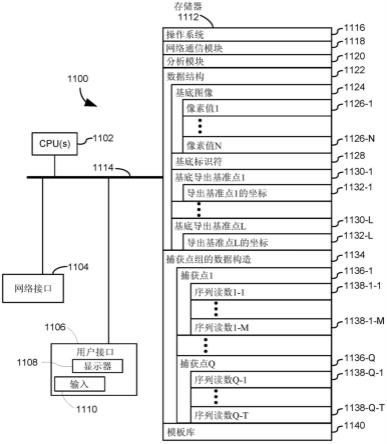
使用基准对齐对分析物进行空间分析的系统和方法
1.相关申请的交叉引用
2.本技术要求于2019年11月22日提交的题为《使用基准对齐进行空间分析的系统和方法(systems and methods for spatial analysis using fiducial alignment)》的美国临时专利申请第62/938,967号的优先权,其通过引用整体并入本文。
技术领域
3.本说明书描述了涉及处理大型复杂的数据集中的观察到的分析物数据(如空间排列的下一代测序数据)的技术。
背景技术:
4.复杂组织中分析物的空间分辨率提供了对生物功能和形态学的基础过程的新见解,如细胞命运和发育、疾病进展和检测,以及细胞和组织水平的调节网络。参见,satija等人,2015,《单细胞基因表达数据的空间重建(spatial reconstruction of single-cell gene expression data)》,《自然生物技术(nature biotechnology.)》33,495-502,doi:10.1038.nbt.3192和achim等人,2015,《单细胞rna序列数据到起源组织的高通量空间映射(high-throughput spatial mapping of single-cell rna-seq data to tissue of origin)》,《自然生物技术》33:503-509,doi:10.1038/nbt.3209,其各自通过引用整体并入本文。
5.对分析物之间的空间模式或其它形式的关系的理解可以提供关于差异细胞行为的信息。这反过来有助于阐明复杂的病症,如复杂的疾病。例如,分析物(例如,基因)的丰度与特定组织类(例如,疾病组织、健康组织、疾病组织和健康组织的边界等)的组织亚群相关联的确定提供了分析物与如复杂疾病等病症相关联的推理证据。同样,分析物的丰度与复杂2维或3维组织(例如,哺乳动物脑、肝、肾、心脏、肿瘤或模型生物体的发育胚胎)中的异质细胞群体的特定亚群相关联的确定提供了分析物在特定亚群中的关联的推理证据。
6.因此,分析物的空间分析可以通过标识复杂组织中的风险区域并通过(例如,基因表达、蛋白质表达、dna甲基化和/或单核苷酸多态性等的)空间重建表征这些区域中存在的分析物图谱来为疾病的早期检测提供信息。分析物到其在区域或子区域内的特定位置的高分辨率空间映射揭示了分析物的空间表达模式,提供了相关数据,并进一步暗示了与疾病或其它感兴趣的形态或表型有关的分析物网络相互作用,从而导致对细胞在其形态背景下的整体理解。参见,10x,2019,《空间解析的转录组学(spatially-resolved transcriptomics)》,10x,2019,《内部visium空间技术(inside visium spatial technology)》和10x,2019,《visium空间基因表达解决方案(visium spatial gene expression solution)》,其各自通过引用整体并入本文。
7.分析物的空间分析可以通过捕获分析物和/或分析物捕获剂或分析物结合域并使用指示对应于已知位置的感兴趣的组织或区域的参考图像将其映射到已知位置(例如,使用附着于基底的条形码捕获探针)来进行。例如,在空间分析的一些实施方式中,制备样品
(例如,将新鲜冷冻的组织切片、置于载片上、固定和/或染色以进行成像)。样品的成像提供了用于空间分析的参考图像。然后使用例如经由条形码捕获探针的分析物或分析物配体捕获、文库构建和/或测序进行分析物检测。所得条形码分析物数据和参考图像可以在数据可视化期间组合以进行空间分析。参见,10x,2019,《内部visium空间技术》,其通过引用并入本文。
8.这种分析的一个困难是确保样品或样品的图像(例如,组织切片或组织切片的图像)与条形码捕获探针正确对齐(例如,使用基准对齐)。在用于组织样品制备和切片的传统湿实验室方法中,频繁出现样品质量的缺陷进一步复杂化了本领域的技术限制。这些问题是由于组织样品本身的性质(尤其包括间隙区域、液泡和/或在成像后通常难以解释的一般粒度)或由于不适当的处理或样品降解而引起的,不适当的处理或样品降解导致样品中的间隙或孔(例如,撕裂样品或仅获得部分样品,如从活组织检查中获得)。另外,用于成像的湿实验室方法会导致其它缺陷,包括但不限于气泡、碎片、沉积在基底或组织上的结晶染色颗粒、不一致或较差的对比度染色,和/或产生图像模糊、曝光过度或曝光不足,和/或分辨率差的显微镜限制。参见,uchida,2013,《生物图像的图像处理和识别(image processing and recognition for biological images)》,《发展、生长和分化(develop.growth differ.)》55,523-549,doi:10.1111/dgd.12054,其通过引用整体并入本文。这种缺陷使得对齐更加困难。
9.因此,在本领域中需要提供改进的对齐的系统和方法。此类系统和方法将允许图像中组织样品的可再现的标识和对齐,而不需要大量的培训和劳动力成本,并且将通过消除由于主观对齐引起的人为误差来进一步提高标识的准确性。此类系统和方法将进一步为从业者提供成本有效的、用户友好的工具,以可靠地执行组织切片中的分析物的空间重建,而不需要在提供图像之外的空间映射步骤期间的附加用户输入。
技术实现要素:
10.在本公开中提供了用于解决上述空间对齐问题的技术方案(例如,计算系统、方法和非暂时性计算机可读存储介质)。
11.以下呈现本公开的概述以便提供对本公开的一些方面的基本理解。该发明内容不是本公开的广泛综述。其不旨在标识本公开的关键/重要元素或描绘本公开的范围。其唯一目的是以简化形式呈现本发明的一些概念,作为稍后呈现的更详细描述的序言。
12.公开了用于分析物的空间分析的系统和方法,其中以电子形式获得数据结构,其包含(i)基底上的样品(例如,切片的组织样品)的图像和(ii)对于基底(例如,芯片)唯一的基底标识符。基底包括多个基准标记和一组捕获点。在一些实施例中,该组捕获点包含至少1000、2000、5000、10,000、15,000、20,000、25,000、30,000、35,000、40,000、45,000、50,000、55,000、60,000、65,000、70,000、75,000、80,000、85,000、90,000、95,000或100,000个捕获点。图像包含像素值阵列。在一些实施例中,像素值阵列包含至少100、10,000、100,000、1x106、2x106、3x106、5x106、8x106、10x106或15x106个像素值。在一些实施例中,使用荧光显微镜或透射光学显微镜获取图像。在一些实施例中,基准标记不直接或间接地与分析物结合。相反,基准标记用于为基底提供参考框架。在一些实施例中,存在多于5、10、15、20、25、30、35、40、45、50、55、60、65、70、75、80、85、90、95、100、200、500或1000个基准标记。在一
些实施例中,存在少于1000个基准标记。
13.分析像素值阵列以标识图像的多个导出基准点。
14.数据结构的基底标识符用于选择多个模板中的第一模板。多个模板中的每个模板包含对应的多个参考基准点的基准位置和对应的坐标系。使用对齐算法将图像的多个导出基准点与第一模板的对应的多个参考基准点进行对齐,以获得图像的多个导出基准点与第一模板的对应的多个参考基准点之间的变换。
15.变换和第一模板的坐标系用于将图像配准到该组捕获点。然后,结合与每个捕获点相关联的空间分析物数据来分析图像,从而执行分析物的空间分析。
16.在一些这样的实施例中,通过首先标识多个候选导出基准点来确定图像的多个导出基准点。通过将像素值阵列阈值化为多个阈值图像并在多个阈值图像内标识具有白色值的像素组来确定候选导出基准点。基于点大小对多个候选导出基准点进行聚类,从而将多个候选导出基准点分布到多个候选导出基准点子集中,其中多个候选导出基准点子集中的每个相应候选导出基准点子集具有特征大小。然后,选择多个候选导出基准点子集中具有最大特征大小的候选导出基准点子集作为图像的多个导出基准点。在一些这样的实施例中,在聚类之前在彼此的阈值距离内的各个候选导出基准点对。在一些这样的实施例中,在聚类之前过滤掉不能满足最大或最小大小标准的相应候选导出基准点。在一些这样的实施例中,过滤掉不能满足圆度标准的相应候选导出基准点,其中各个导出基准点的圆度由下式定义:
[0017][0018]
其中“面积”是各个导出基准点的面积,“周长”是各个导出基准点的周长。在一些实施例中,过滤掉不能满足凸度标准或惯性比标准的相应候选导出基准点。
[0019]
在一些实施例中,该变换是相似性变换,其包含图像的多个导出基准点的旋转、平移和各向同性缩放,以最小化多个导出基准点和对应的多个参考基准点之间的残差。
[0020]
在一些实施例中,该变换是非刚性变换(例如,仿射变换),其包含图像的多个导出基准点的各向异性缩放和偏斜,以最小化多个导出基准点和对应的多个参考基准点之间的残差。
[0021]
在一些实施例中,对齐算法是相干点漂移算法或迭代最近点算法。在一些实施例中,对齐算法是鲁棒点匹配算法或薄板样条鲁棒点匹配算法。
[0022]
在一些实施例中,第一模板的对应的多个参考基准点由100个和1000个之间的点组成。
[0023]
在一些实施例中,该样品是切片的组织样品,并且该组捕获点中的每个相应捕获点(i)位于二维阵列中的不同位置处,并且(ii)与来自该切片的组织样品的一种或多种分析物相关联,并且该组捕获点中的每个相应捕获点由多个空间条形码中的至少一个唯一空间条形码来表征。
[0024]
在一些实施例中,基底可以具有两个或多个具有相同空间条形码的捕获点。也就是说,在两个捕获点之间,没有唯一空间条形码。在一些这样的实施例中,具有重复的空间条形码的这些捕获点被认为是单个捕获点。在其它实施例中,不具有唯一空间条形码的捕
获点不被认为是用于定位相应序列读数以捕获特定捕获点组的点的捕获点组的一部分。
[0025]
在一些实施例中,基底上至少1%、至少5%、至少10%、至少20%、至少30%或至少40%的捕获点在基底上的捕获点上可能不具有唯一空间条形码。也就是说,对于每个这样的捕获点的每个相应空间条形码,在基底上存在至少一个具有相应空间条形码的其它捕获点。在一些这样的实施例中,没有唯一空间条形码的这些捕获点不被认为是用于定位相应序列读数以捕获特定捕获点组的点的捕获点组的一部分。
[0026]
在一些实施例中,基底上至少十个、至少100个、至少1000个、至少10,000个、至少100,000个,或至少1,000,000个捕获点在基底上的捕获点上可能不具有唯一空间条形码。也就是说,对于每个这样的捕获点的每个相应空间条形码,在基底上存在至少一个具有相应空间条形码的其它捕获点。在一些这样的实施例中,没有唯一空间条形码的这些捕获点不被认为是用于定位相应序列读数以捕获特定捕获点组的点的捕获点组的一部分。
[0027]
在一些实施例中,该组捕获点中的捕获点包含捕获域。在一些实施例中,该组捕获点中的捕获点包含切割域。在一些实施例中,该组捕获点中的每个捕获点直接或间接地附着于基底。在一些实施例中,一种或多种分析物包含五种或更多种分析物、十种或更多种分析物、五十种或更多种分析物、一百种或更多种分析物、五百种或更多种分析物、1000种或更多种分析物、2000种或更多种分析物,或2000种至10,000种分析物。
[0028]
在一些实施例中,唯一空间条形码对从集合{1,
…
,1024}、{1,
…
,4096}、{1,
…
,16384}、{1,
…
,65536}、{1,
…
,262144}、{1,
…
,1048576}、{1,
…
,4194304}、{1,
…
,16777216}、{1,
…
,67108864}或{1,
…
,1x10
12
}中选择的唯一预定值进行编码。
[0029]
在一些实施例中,该组捕获点中的每个相应捕获点包括1000个或更多个捕获探针、2000个或更多个捕获探针、10,000个或更多个捕获探针、100,000个或更多个捕获探针、1x106个或更多个捕获探针、2x106个或更多个捕获探针,或5x106个或更多个捕获探针。在一些实施例中,相应捕获点中的每个捕获探针包括聚-a序列或聚-t序列和表征相应捕获点的唯一空间条形码。在一些实施例中,相应捕获点中的每个捕获探针包括与多个空间条形码相同的空间条形码。在一些实施例中,相应捕获点中的每个捕获探针包括与多个空间条形码不同的空间条形码。
[0030]
在一些实施例中,样品是深度为100微米或更小的切片组织样品。
[0031]
在一些实施例中,一种或多种分析物是多种分析物,并且该组捕获点中的相应捕获点包括多个捕获探针。在一些这样的实施例中,多个捕获探针中的每个捕获探针包括由多种捕获域类型中的一种捕获域类型表征的捕获域,并且多种捕获域类型中的每种相应捕获域类型被配置成结合多种分析物中的不同分析物。
[0032]
在一些实施例中,多种捕获域类型包含5种至15,000种捕获域类型,并且对于多种捕获域类型中的每种捕获域类型,相应捕获点包括至少5个、至少10个、至少100个或至少1000个捕获探针。
[0033]
在一些实施例中,一种或多种分析物是多种分析物,并且该组捕获点中的相应捕获点包括多个捕获探针。此外,多个捕获探针中的每个捕获探针包括由被配置成以无偏方式结合多种分析物中的每种分析物的单一捕获域类型表征的捕获域。
[0034]
在一些实施例中,该组捕获点中的每个相应捕获点包含在基底上的100微米
×
100微米的正方形内。在一些实施例中,该组捕获点中的每个相应捕获点包含在基底上的50微
米
×
50微米的正方形内。在一些实施例中,该组捕获点中的每个相应捕获点包含在基底上的10微米
×
10微米的正方形内。在一些实施例中,该组捕获点中的每个相应捕获点包含在基底上的1微米
×
1微米的正方形内。在一些实施例中,该组捕获点中的每个相应捕获点包含在基底上的0.5微米
×
0.5微米的正方形内。在一些实施例中,该组捕获点中的每个相应捕获点包含在基底上的0.3微米
×
0.3微米的正方形内。在一些实施例中,该组捕获点中的每个相应捕获点包含在基底上的0.2微米
×
0.2微米的正方形内。
[0035]
在一些实施例中,基底上的该组捕获点中的每个相应点的中心到相邻捕获点之间的距离在300纳米至300微米之间。在一些实施例中,基底上的该组捕获点中的每个相应点的中心到相邻捕获点之间的距离在700纳米至10微米之间。在一些实施例中,基底上的该组捕获点中的每个相应点的中心到相邻捕获点之间的距离在800纳米至3微米之间。
[0036]
在一些实施例中,基底上的该组捕获点中的每个捕获点的形状是闭合形状。在一些实施例中,闭合形状为圆形、椭圆形或n边形,其中n为1至20之间的值。在一些实施例中,闭合形态为六边形。在一些实施例中,闭合形状是圆形的,并且该组捕获点中的每个捕获点具有80微米或更小的直径。在一些实施例中,闭合形状是圆形的,并且该组捕获点中的每个捕获点具有0.3微米至65微米之间的直径。
[0037]
在一些实施例中,基底上的该组捕获点中的每个相应捕获点的中心到相邻捕获点之间的距离在0.5微米至2微米之间。在一些实施例中,基底上的该组捕获点中的每个相应捕获点的中心到相邻捕获点之间的距离在2微米至7微米之间。在一些实施例中,基底上的该组捕获点中的每个相应捕获点的中心到相邻捕获点之间的距离在5微米至50微米之间。
[0038]
在一些实施例中,响应于将基底标识符发送到远程计算机系统,从远程计算机系统获得多个模板中的第一模板。
[0039]
本公开的另一方面提供了一种包含一个或多个处理器、存储器和一个或多个程序的计算机系统。一个或多个程序被存储在存储器中并且被配置成由一个或多个处理器执行。一个或多个程序用于分析物的空间分析。一个或多个程序包括用于获得电子形式的数据结构的指令,该数据结构包含(i)基底上的样品(例如,切片的组织样品)的图像(例如,来自受试者),以及(ii)对基底唯一的基底标识符。
[0040]
基底包括多个基准标记和一组捕获点。
[0041]
在一些实施例中,该组捕获点包含至少1000、2000、5000、10,000、15,000、20,000、25,000、30,000、35,000、40,000、45,000、50,000、55,000、60,000、65,000、70,000、75,000、80,000、85,000、90,000、95,000或100,000个捕获点。
[0042]
基准标记不直接或间接地与分析物结合。相反,基准标记用于为基底提供参考框架。在一些实施例中,多个基准标记包含5、10、15、20、25、30、35、40、45、50、55、60、65、70、75、80、85、90、95、100、200、500或1000个基准标记。在一些实施例中,在多个基准标记中存在少于1000个基准标记。
[0043]
图像包含像素值阵列。在一些实施例中,像素值阵列包含至少100、10,000、100,000、1x106、2x106、3x106、5x106、8x106、10x106或15x106个像素值。
[0044]
分析像素值阵列以标识图像的多个导出基准点。数据结构的基底标识符用于选择多个模板中的第一模板,其中多个模板中的每个模板包含对应的多个参考基准点的参考位置和对应的坐标系。使用对齐算法将图像的多个导出基准点与第一模板的对应的多个参考
基准点进行对齐,以获得图像的多个导出基准点与第一模板的对应的多个参考基准点之间的变换。变换和第一模板的坐标系用于将图像配准到该组捕获点。然后,结合与每个捕获点相关联的空间分析数据来分析图像,从而执行分析物的分析。
[0045]
本公开的又一方面提供了一种存储一个或多个程序的计算机可读存储介质。一个或多个程序包含指令,其在由具有一个或多个处理器和存储器的电子装置执行时使得电子装置执行分析物的空间分析。分析物的空间分析包含获得电子形式的数据结构,其包含(i)基底上的生物组织样品(例如,切片的组织样品)的图像(例如,来自受试者),以及(ii)对基底唯一的基底标识符。
[0046]
基底包括多个基准标记和一组捕获点。
[0047]
在一些实施例中,该组捕获点包含至少1000、2000、5000、10,000、15,000、20,000、25,000、30,000、35,000、40,000、45,000、50,000、55,000、60,000、65,000、70,000、75,000、80,000、85,000、90,000、95,000或100,000个捕获点。
[0048]
基准标记不直接或间接地与分析物结合。相反,基准标记用于为基底提供参考框架。在一些实施例中,多个基准标记包含5、10、15、20、25、30、35、40、45、50、55、60、65、70、75、80、85、90、95、100、200、500或1000个基准标记。在一些实施例中,在多个基准标记中存在少于1000个基准标记。
[0049]
图像包含像素值阵列。在一些实施例中,像素值阵列包含至少100、10,000、100,000、1x106、2x106、3x106、5x106、8x106、10x106或15x106个像素值。
[0050]
分析像素值阵列以标识图像的多个导出基准点。数据结构的基底标识符用于选择多个模板中的第一模板。多个模板中的每个模板包含对应的多个参考基准点的基准位置和对应的坐标系。使用对齐算法将图像的多个导出基准点与第一模板的对应的多个参考基准点进行对齐,以获得图像的多个导出基准点与第一模板的对应的多个参考基准点之间的变换。变换和第一模板的坐标系用于将图像配准到该组捕获点。然后结合与每个捕获点相关联的空间分析物数据来分析图像,从而执行分析物的空间分析。
[0051]
本公开的另一方面提供了一种计算系统,其包括一个或多个处理器和存储用于空间核酸分析的一个或多个程序的存储器。应当理解,该存储器可以在单个计算机、计算机网络、一个或多个虚拟机上,或者在云计算体系结构中。一个或多个程序被配置成由一个或多个处理器执行。一个或多个程序包括用于执行本文公开的任何方法的指令。
[0052]
本公开的又一方面提供了一种存储要由电子装置执行的一个或多个程序的计算机可读存储介质。一个或多个程序包括用于电子装置的指令,以通过本文公开的任何方法执行分析物的空间分析。应当理解,计算机可读存储介质可以作为单个计算机可读存储介质或物理上彼此分离的任何数目的组件计算机可读存储介质存在。
[0053]
其它实施例涉及与本文所述的方法相关联的系统、便携式消费装置和计算机可读介质。
[0054]
如本文所公开的,在适用时,本文所公开的任何实施例可以应用于任何方面。
[0055]
在所附权利要求书的范围内的系统、方法和装置的各种实施例各自具有若干方面,其中没有单个方面单独负责本文所描述的所需属性。在不限制所附权利要求的范围的情况下,本文描述了一些突出特征。在考虑本讨论之后,特别是在阅读标题为“具体实施方式”的部分之后,将理解如何使用各种实施例的特征。
[0056]
通过引用并入
[0057]
在因特网上可获得的并且在本说明书中提及的所有出版物、专利、专利申请和信息通过引用并入本文,其程度如同每个单独的出版物、专利、专利申请或信息项被具体地和单独地指明通过引用并入。在以引用方式并入的因特网上可获得的出版物、专利、专利申请或信息项与说明书中所包含的公开内容相矛盾的程度上,说明书旨在取代和/或优先于任何此类矛盾材料。
附图说明
[0058]
以下附图绘示了本公开的特征和优点的某些实施例。这些实施例并不旨在以任何方式限制所附权利要求的范围。附图中相同的附图标记表示相同的元件。
[0059]
图1示出了根据本公开的实施例的示例性空间分析工作流程。
[0060]
图2示出了根据本公开的实施例的示例性空间分析工作流程,其中可选的步骤由虚线框表示。
[0061]
图3a和3b示出了根据本公开的实施例的示例性空间分析工作流程,其中在图3a中,可选的步骤由虚线框表示。
[0062]
图4示出了根据本公开的实施例的示例性空间分析工作流程,其中可选的步骤由虚线框表示。
[0063]
图5示出了根据本公开的实施例的示例性空间分析工作流程,其中可选的步骤由虚线框表示。
[0064]
图6是示出了根据本公开的实施例的如本文所述的条形码捕获探针的实例的示意图。
[0065]
图7是绘示了根据本公开的实施例的可切割的捕获探针的示意图。
[0066]
图8是根据本公开的实施例的示例性多路复用的空间标记的捕获点的示意图。
[0067]
图9示出了根据本公开的实施例的示例性空间分析工作流程,其中可选的步骤由虚线框表示。
[0068]
图10a、10b、10c、10d和10e绘示了根据本公开的一些实施例的用于分析物的空间分析的非限制性方法,其中可选的步骤由虚线框示出。
[0069]
图11是绘示了根据本公开的一些实施例的计算装置的示例框图。
[0070]
图12是示出了根据本公开的一些实施例的阵列内的条形码捕获点的排列的示意图。
[0071]
图13是绘示了根据本公开的一些实施例的抗扩散介质(例如,盖)的侧视图的示意图。
[0072]
图14绘示了根据本公开的实施例的在基底上具有样品(例如,组织样品)的图像的基底。
[0073]
图15绘示了根据本公开的实施例的具有多个捕获区和基底标识符的基底。
[0074]
图16绘示了根据本公开的实施例的具有多个基准标记和一组捕获点的基底。
[0075]
图17绘示了根据本公开的实施例的基底上的样品(例如,组织样品)的图像,其中样品定位在多个基准标记内。
[0076]
图18绘示了根据本公开的实施例的包含对应的多个参考基准点的参考位置和对
应的坐标系的模板。
[0077]
图19绘示了根据本公开的实施例的模板如何使用对应的坐标系来指定基底的该组捕获点相对于基底的参考基准点的位置。
[0078]
图20绘示了根据本公开的实施例的图像的基底设计,包括多个基准标记和一组捕获点,该图像包括对应的导出基准点。
[0079]
图21绘示了根据本公开的实施例的使用变换和模板的坐标系将图像与基底配准以将图像配准到基底的该组捕获点。
[0080]
图22绘示了根据本公开的实施例的在图像与基底配准之后,使用变换和模板的坐标系来将图像配准到基底的该组捕获点,从而标识基底上的已被组织覆盖的捕获点的图像的分析。
[0081]
图23绘示了根据本公开的实施例的已经被组织覆盖的基底上的捕获点。
[0082]
图24绘示了根据本公开的实施例的从与基底缔合的核酸测序数据中的每个序列读数中提取条形码和umi。
[0083]
图25绘示了根据本公开的实施例的序列读数与参考基因组的对齐。
[0084]
图26绘示了根据本公开的实施例的由于在工作流程步骤期间发生的随机片段,即使序列读数共享条形码和umi,序列读数也不全部映射到完全相同的位置。
[0085]
图27绘示了根据本公开的实施例如何针对实际条形码的白名单(例如,在一些实施例中,该白名单对应于具有约360万个不同条形码的铬单细胞3'v3化学凝胶珠粒,并且因此白名单具有360万个条形码)来验证每个序列读数的条形码。
[0086]
图28绘示了根据本公开的一些实施例的如果与较高计数的umi具有1个错配的序列读数的唯一分子标识符(umi)共享细胞条形码和基因,则它们如何被校正为该umi。
[0087]
图29绘示了根据本公开的一些实施例的如何仅使用具有有效条形码和umi的可信映射读数来形成原始特征条形码矩阵的umi计数。
[0088]
图30绘示了根据本公开的实施例的如何对被称为细胞的条形码(过滤的特征条形码矩阵)进行二次分析,其中对归一化的过滤的基因-细胞矩阵的主要组分分析用于将g基因减少到前10个元基因,t-sne在pca空间中运行以生成二维投影,基于图形(louvain)和k-均值聚类(k=2
…
10)在pca空间中执行以标识细胞簇,并且sseq(负二项检验)算法用于找到最唯一地定义每个簇的基因。
[0089]
图31绘示了用于结合与多个捕获点中的每个捕获点缔合的核酸测序数据来分析图像(例如,组织图像)的流水线,从而根据本公开执行空间核酸分析。
[0090]
图32绘示了根据本公开的结合核酸测序数据对组织图像的分析如何可用于在图像的环境中观察捕获点簇。
[0091]
图33绘示了根据本公开的一些实施例的结合核酸测序数据对组织图像的分析如何可以包括在该图像的环境中放大到捕获点簇的覆盖图以便看到更多细节。
[0092]
图34绘示了根据本公开的一些实施例的结合核酸测序数据对组织图像的分析如何可以用于创建用于差异表达分析的定制类和簇。
[0093]
图35绘示了根据本公开的一些实施例的结合核酸测序数据对组织图像的分析如何可以用于查看在组织图像的环境中表达的基因。
[0094]
图36绘示了根据本公开的一些实施例的用于制备用于空间分析的序列读数的反
应方案。
[0095]
图37是根据本公开的一些实施例的示例性分析物捕获剂的示意图。
[0096]
图38a是描绘根据本公开的一些实施例的特征固定的捕获探针和分析物捕获剂之间的示例性相互作用的示意图。
[0097]
图38b是示出了包含寡核苷酸的分析物结合部分的示例性示意图,寡核苷酸具有与阻断域(由聚(t)序列表示)杂交的捕获结合域(由聚(a)序列表示)。
[0098]
图38c是示出了包括寡核苷酸的分析物结合部分的示例性示意图,寡核苷酸包含设置在阻断域(由聚(u)序列表示)和捕获结合域(由聚(a)序列表示)之间的发夹序列。如图所示,阻断域与捕获结合域杂交。
[0099]
图38d是示出了rnase h释放的阻断域的示例性示意图。
[0100]
图38e是示出了包括寡核苷酸的分析物结合部分的示例性示意图,寡核苷酸包含使用笼状核苷酸(由五边形表示)阻断的捕获结合域。
[0101]
图39是绘示了根据本公开的一些实施例的空间标记的分析物捕获剂的示例性示意图,其中分析物捕获序列通过阻断探针阻断,并且其中阻断探针可以例如用rnase处理去除。
具体实施方式
[0102]
i.引言
[0103]
本公开描述了用于样品的空间分析的设备、系统、方法和组合物。本节特别描述了在本公开的后面章节中提及的某些通用术语、分析物、样品类型和制备步骤。
[0104]
(a)空间分析
[0105]
组织和细胞可以从任何来源获得。例如,组织和/或细胞可以从单细胞或多细胞生物体(例如,哺乳动物)获得。从哺乳动物(例如,人类)获得的组织和细胞通常具有可能导致细胞形态和/或功能差异的不同分析物水平(例如,基因和/或蛋白质表达)。细胞或细胞子集(例如,相邻细胞和/或非相邻细胞)在组织内的位置可能影响例如细胞命运、行为、形态、信号传导和与组织中其它细胞的串扰。关于哺乳动物组织中不同细胞内的分析物水平(例如,基因和/或蛋白质表达)的差异的信息还可以帮助医师选择或施用有效的治疗,并且可以允许研究者基于组织中不同细胞内的分析物水平的检测差异来鉴定和阐明单细胞或多细胞生物体(例如,哺乳动物)中细胞形态和/或细胞功能的差异。哺乳动物组织中不同细胞内分析物水平的差异也可以提供关于组织(例如,健康和患病组织)如何起作用和/或发展的信息。哺乳动物组织中不同细胞内分析物水平的差异也可以提供关于组织中疾病发病机理的不同机制和组织内治疗性处理的作用机制的信息。哺乳动物组织中不同细胞内分析物水平的差异也可以提供关于哺乳动物组织中药物抗性机制及其发展的信息。多细胞生物(例如,哺乳动物)组织中不同细胞内存在或不存在分析物的差异可以提供关于多细胞生物组织中药物抗性机制及其发展的信息。
[0106]
本文的空间分析方法用于检测哺乳动物组织中的不同细胞内或来自哺乳动物的单个细胞内的分析物水平(例如,基因和/或蛋白质表达)的差异。例如,空间分析方法可用于检测组织学载片样品中不同细胞内的分析物水平(例如,基因和/或蛋白质表达)的差异,从中可以重新组合数据以生成从哺乳动物获得的样品(例如,组织样品)的分析物水平(例
如,基因和/或蛋白质表达)的三维图谱,其具有一定程度的空间分辨率,如单细胞分辨率。
[0107]
通常使用rna杂交、免疫组织化学、荧光报道分子或预定义亚群的纯化或诱导以及随后的基因组图谱(例如,rna-seq)来研究发育系统中的空间异质性。然而,这种方法依赖于一组相对小的预定义标记,因此引入限制发现的选择偏差。这些现有方法还依赖于先验知识。空间rna分析传统上依赖于有限数量的rna种类的染色。相比之下,单细胞rna测序允许细胞基因表达(包括非编码rna)的深度分析,但已建立的方法将细胞与其天然空间环境分开。
[0108]
本文所述的空间分析方法以高空间分辨率提供样品内各种多种分析物的分析物水平和/或表达数据的大量数据,例如,同时保留天然空间环境。空间分析方法包括例如使用包括空间条形码(例如,核酸序列)和捕获域的捕获探针,空间条形码提供关于捕获探针在细胞或组织样品(例如,哺乳动物细胞或哺乳动物组织样品)内的位置的信息,捕获域能够结合由细胞产生和/或存在于细胞中的分析物(例如,蛋白质和/或核酸)。如本文所述,空间条形码可以是具有唯一序列、唯一荧光团、荧光团的唯一组合、唯一氨基酸序列、唯一重金属或重金属的唯一组合或任何其它唯一可检测试剂的核酸。捕获域可以是能够结合由细胞产生和/或存在于细胞中的分析物(例如,能够与来自细胞的核酸(例如,mrna、基因组dna、线粒体dna或mirna)杂交的核酸、包括分析物的基底、分析物的结合配偶体或特异性结合分析物的抗体)的任何试剂。捕获探针也可以包括与通用正向和/或通用反向引物的序列互补的核酸序列。捕获探针也可以包括切割位点(例如,限制性核酸内切酶的切割识别位点),或光不稳定或热敏性键。
[0109]
可以使用多种不同方法检测分析物与捕获探针的结合,例如核酸测序、荧光团检测、核酸扩增、核酸连接检测和/或核酸切割产物检测。在一些实例中,该检测用于将特定的空间条形码与由细胞(例如,哺乳动物细胞)产生的和/或存在于细胞中的特定分析物缔合。
[0110]
捕获探针可以例如附着于表面,例如固体阵列、珠或盖玻片。在一些实例中,捕获探针不附着于表面。在一些实例中,捕获探针封装在可渗透组合物(例如,本文所述的任何基底)内、包埋其中或层叠在其表面上。例如,捕获探针捕获探针封装或设置在可渗透的珠(例如,凝胶珠)内。在一些实例中,捕获探针封装在基底(例如,本文所述的任何示例性基底,如水凝胶或多孔膜)内、包埋其中或层叠在其表面上。
[0111]
在一些实例中,使细胞或包括细胞的组织样品与附着于基底(例如,基底的表面)的捕获探针接触,并且使细胞或组织样品透化以允许分析物从细胞释放并结合到附着于基底的捕获探针。在一些实例中,可以使用多种方法(例如,电泳、化学梯度、压力梯度、流体流动或磁场)将从细胞释放的分析物主动导向附着于基底的捕获探针。
[0112]
在其它实例中,使用多种方法引导捕获探针与细胞或组织样品相互作用,例如在捕获探针中包括脂质锚定剂、在捕获探针中包括与膜蛋白特异性结合或形成共价键的试剂、流体流动、压力梯度、化学梯度或磁场。
[0113]
空间分析方法的非限制性方面描述于wo 2011/127099、wo 2014/210233、wo 2014/210225、wo 2016/162309、wo 2018/091676、wo 2012/140224、wo 2014/060483、美国专利第10,002,316号、美国专利第9,727,810号、美国专利申请公开第2017/0016053号、rodriques等人,《科学(science)》363(6434):1463-1467,2019;wo 2018/045186,lee等人,《自然实验手册(nat.protoc.)》10(3):442-458,2015;wo 2016/007839、wo 2018/045181、
wo 2014/163886,trejo等人,《公共科学图书馆期刊(plos one)》14(2):e0212031,2019,美国专利申请公开第2018/0245142号,chen等人,《科学》348(6233):aaa6090,2015,gao等人,《bmc生物学(bmc biol.)》15:50,2017,wo 2017/144338、wo 2018/107054、wo 2017/222453、wo 2019/068880、wo 2011/094669、美国专利第7,709,198号、美国专利第8,604,182号、美国专利第8,951,726号、美国专利第9,783,841号、美国专利第10,041,949号、wo 2016/057552、wo 2017/147483、wo 2018/022809、wo 2016/166128、wo 2017/027367、wo 2017/027368、wo 2018/136856、wo 2019/075091、美国专利第10,059,990号、wo 2018/057999、wo 2015/161173、gupta等人,《自然生物技术(nature biotechnol.)》36:1197-1202,2018,以及于2020年8月13日提交的题为《用于使用单元型的空间分布来确定生物学状况的系统和方法(systems and methods for using spatial distribution of haplotypes to determine a biological condition)》的美国专利申请第16/992,569号,并且可以在本文中以任何组合使用。本文描述了空间分析方法的其它非限制性方面。
[0114]
(b)通用术语
[0115]
贯穿本公开使用特定术语来解释所描述的设备、系统、方法和组合物的各个方面。这一小节包括对在本公开的后面章节中出现的某些术语的解释。就本节中的描述与本公开的其它节中的用法明显冲突而言,将以本节中的定义为准。
[0116]
(i)受试者
[0117]“受试者”是动物,如哺乳动物(例如,人类或非人类猿),或禽类(例如,鸟),或其它生物体,如植物。受试者的实例包括但不限于哺乳动物,如啮齿动物、小鼠、大鼠、兔、豚鼠、有蹄类动物、马、绵羊、猪、山羊、牛、猫、狗、灵长类动物(例如,人类或非人类灵长类动物);植物,如拟南芥(arabidopsis thaliana)、玉米、高粱、燕麦、小麦、水稻、油菜或大豆;藻类,如莱茵衣藻(chlamydomonas reinhardtii);线虫,如秀丽隐杆线虫(caenorhabditis elegans);昆虫,如黑腹果蝇(drosophila melanogaster)、蚊子、果蝇、蜜蜂或蜘蛛;鱼类,如斑马鱼;爬行动物;两栖动物,如蛙或爪蟾(xenopus laevis);盘基网柄菌(dictyostelium discoideum);真菌,如卡氏肺孢子虫(pneumocystis carinii)、红鳍东方鲀(takifugu rubripes)、酵母、酿酒酵母(saccharamoyces cerevisiae)或粟酒裂殖酵母(schizosaccharomyces pombe);或恶性疟原虫(plasmodium falciparum)。
[0118]
(ii)核酸和核苷酸
[0119]
术语“核酸”和“核苷酸”旨在与它们在本领域中的用途一致,并且包括天然存在的物种或其功能类似物。特别有用的核酸的功能类似物能够以序列特异性方式与核酸杂交(例如,能够与两个核酸杂交,使得在两个杂交的核酸之间可以发生连接)或能够用作特定核苷酸序列复制的模板。天然存在的核酸通常具有包含磷酸二酯键的主链。类似物结构可以具有交替的主链连接,包括本领域已知的任何种类的主链连接。天然存在的核酸通常具有脱氧核糖(例如,存在于脱氧核糖核酸(dna)中)或核糖(例如,存在于核糖核酸(rna)中)。
[0120]
核酸可以包含具有本领域已知的这些糖部分的多种类似物中的任一种的核苷酸。核酸可以包括天然或非天然核苷酸。在这方面,天然脱氧核糖核酸可以具有一个或多个选自由腺嘌呤(a)、胸腺嘧啶(t)、胞嘧啶(c)或鸟嘌呤(g)组成的组的碱基,核糖核酸可以具有一个或多个选自由尿嘧啶(u)、腺嘌呤(a)、胞嘧啶(c)或鸟嘌呤(g)组成的组的碱基。可以包括在核酸或核苷酸中的有用的非天然碱基是本领域已知的。
[0121]
(iii)探针和靶
[0122]
当用于指核酸或核酸序列时,“探针”或“靶”在方法或组合物的上下文中旨在作为核酸或序列的语义标识符,并且不将核酸或序列的结构或功能限制在明确指出的范围之外。
[0123]
(iv)条形码
[0124]“条形码”是传达或能够传达信息(例如,关于样品、珠和/或捕获探针中的分析物的信息)的标签或标识符。条形码可以是分析物的一部分,或独立于分析物。条形码可以附着于分析物。特定条形码相对于其它条形码可以是唯一的。
[0125]
条形码可以具有多种不同的格式。例如,条形码可以包括非随机、半随机和/或随机的核酸和/或氨基酸序列,以及合成的核酸和/或氨基酸序列。
[0126]
条形码可以具有多种不同的格式。例如,条形码可以包括多核苷酸条形码、随机核酸和/或氨基酸序列,以及合成的核酸和/或氨基酸序列。条形码可以以可逆或不可逆的方式附着于分析物或另一部分或结构。条形码可以在样品测序之前或期间添加到例如脱氧核糖核酸(dna)或核糖核酸(rna)样品的片段中。条形码可以允许对单个测序读数进行标识和/或定量(例如,条形码可以是或可以包括唯一的分子标识符或“umi”)。
[0127]
条形码可以例如以单细胞分辨率空间解析在样品中发现的分子组分(例如,条形码可以是或可以包括“空间条形码”)。在一些实施例中,条形码包括umi和空间条形码。在一些实施例中,条形码包括一起用作单个条形码的两个或更多个子条形码。在一些实施例中,条形码包括umi和空间条形码。在一些实施例中,条形码包括一起用作单个条形码(例如,多核苷酸条形码)的两个或更多个子条形码。例如,多核苷酸条形码可以包括被一个或多个非条形码序列分开的两个或更多个多核苷酸序列(例如,子条形码)。
[0128]
(v)捕获点
[0129]“捕获点”(替代地,“特征”或“捕获探针群”)在本文中用于描述充当样品分析中使用的各种分子实体的支持物或库的实体。捕获点的实例包括但不限于珠、任何二维或三维几何形状的点(例如,喷墨点、掩蔽点、网格上的正方形)、孔和水凝胶垫。在一些实施例中,捕获点是用空间条形码标记的捕获探针在其上聚类的基底上的区域。以下在本公开中进一步描述捕获点和基底的具体非限制性实施方案。
[0130]
在2020年8月13日提交的题为《用于使用单元型的空间分布来确定生物学状况的系统和方法(systems and methods for using the spatial distribution of haplotypes to determine a biological condition)》的美国专利申请第16/992,569号中可以找到通常与分析物的空间分析相关的其它定义,本文通过引用将其并入本文。
[0131]
(vi)基底
[0132]
如本文所用,“基底”是捕获探针可附着于其上的任何表面(例如,芯片、固体阵列、珠、载片、基底、盖玻片等)。
[0133]
(vii)抗体
[0134]“抗体”是识别并结合互补靶抗原的多肽分子。抗体通常具有类似y形的分子结构形状,或其聚合物。天然存在的抗体,称为免疫球蛋白,属于免疫球蛋白类igg、igm、iga、igd和ige之一。抗体也可以合成产生。例如,重组抗体,其是单克隆抗体,可以使用合成基因通过从来源细胞中回收抗体基因、扩增到合适的载体中,并将载体导入宿主中以使宿主表达
rrna或23s rrna)。
[0144]
分析物的其它实例包括mrna和细胞表面特征(例如,使用本文所述的标记剂)、mrna和细胞内蛋白质(例如,转录因子)、mrna和细胞甲基化状态、mrna和可及染色质(例如,atac-seq、dnase-seq和/或mnase-seq)、mrna和代谢物(例如,使用本文所述的标记剂)、条形码标记剂(例如,本文所述的寡核苷酸标记的抗体)和免疫细胞受体(例如,t细胞受体)的v(d)j序列、mrna和干扰剂(例如,如本文所述的crispr crrna/sgrna、talen、锌指核酸酶,和/或反义寡核苷酸)。在一些实施例中,干扰剂是小分子、抗体、药物、适配体、mirna、物理环境(例如,温度变化)或任何其它已知的干扰剂。
[0145]
分析物可以包括具有编码免疫细胞受体(例如,tcr或bcr)的v(d)j序列的至少一部分的核酸序列的核酸分子。在一些实施例中,核酸分子是使用含聚(t)的引物从对应mrna的逆转录首先生成的cdna。然后可以使用捕获探针对生成的cdna进行条形码化,捕获探针的特征在于与生成的cdna的至少一部分杂交的条形码序列(和任选地,umi序列)。在一些实施例中,模板转换寡核苷酸通过逆转录酶与添加到cdna的3'端的聚(c)尾杂交。然后可以从cdna变性原始mrna模板和模板转换寡核苷酸,然后条形码捕获探针可以与cdna和生成的cdna的互补物杂交。适用于条形码化由mrna转录物生成的cdna的其它方法和组合物(包括编码免疫细胞受体的v(d)j区的那些)和/或条形码化方法和组合物(包括模板转换寡核苷酸)描述于2017年10月18日提交的pct专利申请pct/us2017/057269和2017年11月29日提交的美国专利申请第15/825,740号中,这均以全文引用的方式并入本文。v(d)j分析也可以通过使用一种或多种与免疫细胞的特定表面特征结合并与条形码序列缔合的标记剂来完成。一种或多种标记剂可以包括mhc或mhc多聚体。
[0146]
如上所述,分析物可以包括能够用作基因编辑反应的组分的核酸,例如基于聚类的规则间隔的短回文重复(crispr)的基因编辑。因此,捕获探针可以包括与分析物互补的核酸序列(例如,可以与crispr rna(crrna)、单引导rna(sgrna)或工程化到crrna或sgrna中的衔接子序列杂交的序列)。
[0147]
在某些实施例中,从活细胞中提取分析物。可以调节处理条件以确保样品在分析期间保持活性,并且从样品的活细胞中提取(或释放)分析物。活细胞来源的分析物可以仅从样品中获得一次,或者可以每隔一段时间从继续保持存活状态的样品中获得。
[0148]
通常,系统、设备、方法和组合物可用于分析任何数量的分析物。例如,被分析的分析物的数量可以是至少约2、至少约3、至少约4、至少约5、至少约6、至少约7、至少约8、至少约9、至少约10、至少约11、至少约12、至少约13、至少约14、至少约15、至少约20、至少约25、至少约30、至少约40、至少约50、至少约100个、至少约1,000、至少约10,000、至少约100,000种或更多种不同的分析物,其存在于样品的区域中或基底的单个捕获点内。用于进行多重测定以分析两种或更多种不同分析物的方法将在本公开的后续部分中讨论。
[0149]
(d)样品
[0150]
(i)样品类型
[0151]
本公开允许分析生物和非生物样品。“生物样品”从受试者获得用于使用多种技术中的任一种进行分析,技术包括但不限于活检、手术和激光捕获显微术(lcm),并且通常包括来自受试者的细胞和/或其它生物材料。除了上述受试者之外,生物样品还可以从非哺乳动物生物体(例如,植物、昆虫、蜱螨类、线虫、河豚、两栖动物和鱼)获得生物样品也可以从
原核生物获得,如细菌,例如大肠杆菌(escherichia coli)、葡萄球菌(staphylococci)或肺炎支原体(mycoplasma pneumoniae);古细菌;病毒,如丙型肝炎病毒或人类免疫缺陷病毒;或类病毒。生物样品也可以从真核生物获得,如患者来源的类器官(pdo)或患者来源的异种移植物(pdx)。生物样品可以包括类器官,即在体外以三维形式产生的器官的小型化和简化形式,其显示真实的显微解剖结构。类器官可以由来自组织的一种或多种细胞、胚胎干细胞和/或诱导多能干细胞生成,由于它们的自我更新和分化能力,它们可以在三维培养中自我组织。在一些实施例中,类器官是脑类器官、肠类器官、胃类器官、舌类器官、甲状腺类器官、胸腺类器官、睾丸类器官、肝类器官、胰腺类器官、上皮类器官、肺类器官、肾类器官、类原肠胚、心脏类器官或视网膜类器官。可以从其获得生物样品的受试者可以是健康或无症状的个体、患有或疑似患有疾病(例如,癌症)或易患疾病的个体,和/或需要治疗或疑似需要治疗的个体。
[0152]
生物样品可以包括任何数量的大分子,例如细胞大分子和细胞器(例如,线粒体和细胞核)。生物样品可以是核酸样品和/或蛋白质样品。生物样品可以是核酸样品和/或蛋白质样品。生物样品可以是碳水化合物样品或脂质样品。生物样品可以作为组织样品获得,如组织切片、活检、芯活检、针吸出物或细针吸出物。样品可以是流体样品,如血液样品、尿液样品或唾液样品。样品可以是皮肤样品、结肠样品、颊拭子、组织学样品、组织病理学样品、血浆或血清样品、肿瘤样品、活细胞、培养的细胞、临床样品(例如全血或血液衍生的产物)、血细胞,或培养的组织或细胞,包括细胞悬浮液。
[0153]
无细胞生物样品可以包括细胞外多核苷酸。细胞外多核苷酸可以分离自身体样品,例如血液、血浆、血清、尿液、唾液、粘膜分泌物、痰、粪便和泪液。
[0154]
生物样品可以来源于本文提及的受试者或生物体的均质培养物或群体,或者可替代地来源于几种不同生物体的集合,例如在群落或生态系统中。
[0155]
生物样品可以包括一种或多种患病细胞。患病细胞可以具有改变的代谢特性、基因表达、蛋白质表达和/或形态学特征。疾病的实例包括炎性病症、代谢病症、神经系统病症和癌症。癌细胞可以来源于实体瘤、血液恶性肿瘤、细胞系或作为循环肿瘤细胞获得。
[0156]
生物样品还可以包括胎儿细胞。例如,可以进行如羊膜穿刺术的手术以从母体循环获得胎儿细胞样品。胎儿细胞的测序可用于鉴定多种遗传病症中的任一种,包括例如非整倍性,如唐氏综合征、爱德华综合征和帕陶综合征。此外,胎儿细胞的细胞表面特征可用于鉴定多种病症或疾病中的任一种。
[0157]
生物样品还可以包括免疫细胞。这些细胞的免疫系统全部(包括基因组、蛋白质组和细胞表面特征)的序列分析可以提供大量的信息,有助于理解免疫系统的状态和功能。例如,在自体干细胞移植后确定多发性骨髓瘤(mm)患者中微小残留疾病(mrd)的状态(例如,阴性或阳性)被认为是mm患者中mrd的预测因子(参见,例如,美国专利公开第2018/0156784号,其全部内容通过引用并入本文)。
[0158]
生物样品中的免疫细胞的实例包括但不限于b细胞、t细胞(例如,细胞毒性t细胞、天然杀伤t细胞、调节性t细胞和t辅助细胞)、天然杀伤细胞、细胞因子诱导的杀伤(cik)细胞、骨髓细胞(如粒细胞(嗜碱性粒细胞、嗜酸性粒细胞、中性粒细胞/多分叶核中性粒细胞)、单核细胞/巨噬细胞、肥大细胞、血小板/巨核细胞和树突细胞。
[0159]
如上所述,生物样品可以包括单个感兴趣的分析物,或多于一个感兴趣的分析物。
用于进行多重测定以分析单个生物样品中的两种或更多种不同分析物的方法将在本公开的后续部分中讨论。
[0160]
(ii)样品制备
[0161]
可以进行各种步骤以制备用于分析的样品。除非另有说明,下文所述的制备步骤通常可以以任何方式组合以适当地制备用于分析的特定样品。
[0162]
(1)组织切片
[0163]
样品可以从受试者收获(例如,通过手术活检、整个受试者切片)或作为细胞群体在生长基底或培养皿上体外生长,或作为组织切片(tissue slice)或组织切片(tissue section)准备用于分析。生长的样品可以足够薄以进行分析而无需进一步的处理步骤。替代地,生长样品和通过活检或切片获得的样品可以使用机械切割设备(如振动切片机)制备成薄组织切片。作为另一个替代方案,在一些实施例中,可以通过将样品的触摸印记施加到合适的基底材料上来制备薄组织切片。
[0164]
组织切片的厚度可以是细胞的最大横截面尺寸的分数(例如,小于0.9、0.8、0.7、0.6、0.5、0.4、0.3、0.2或0.1)。然而,也可以使用厚度大于最大横截面细胞尺寸的组织切片。例如,可以使用冷冻切片,其可以是例如10至20微米厚。
[0165]
更一般地,组织切片的厚度通常取决于用于制备切片的方法和组织的物理特性,因此可以制备和使用具有各种不同厚度的切片。例如,组织切片的厚度可以为至少0.1、0.2、0.3、0.4、0.5、0.7、1.0、1.5、2、3、4、5、6、7、8、9、10、11、12、13、14、15、20、30、40或50微米。如果需要或方便,也可以使用更厚的切片,例如至少70、80、90或100微米或更厚。通常,组织切片的厚度在1至100微米、1至50微米、1至30微米、1至25微米、1至20微米、1至15微米、1至10微米、2至8微米、3至7微米或4至6微米之间,但是如上所述,也可以分析厚度大于或小于这些范围的切片。
[0166]
也可以从单个样品获得多个切片。例如,通过使用切片刀片对活检样品进行连续切片,可以从外科活检样品获得多个组织切片。可以以这种方式保存连续切片中的空间信息,并且可以连续分析切片以获得关于样品的三维信息。
[0167]
(2)冷冻
[0168]
在一些实施例中,样品(例如,如上所述的组织切片)可以通过在适于维持或保存组织结构的完整性(例如,物理特性)的温度下深度冷冻来制备。这样的温度可以是,例如,低于-20℃,或低于-25℃、-30℃、-40℃、-50℃、-60℃、-70℃、-80℃、-90℃、-100℃、-110℃、-120℃、-130℃、-140℃、-150℃、-160℃、-170℃、-180℃、-190℃,或-200℃。可以使用许多合适的方法将冷冻组织样品切片(例如,切成薄片)到基底表面上。例如,可以使用设定在适于保持组织样品的结构完整性和样品中核酸的化学性质的温度下的冷冻切片机(例如,低温恒温器)制备组织样品。这样的温度可以是例如低于-15℃、低于-20℃或低于-25℃。样品可以在异戊烷和液氮中快速冷冻。冷冻样品可以在包埋之前储存在密封容器中。
[0169]
(3)福尔马林固定和石蜡包埋
[0170]
在一些实施例中,可以使用福尔马林固定和石蜡包埋(ffpe)制备样品,其是既定的方法。在一些实施例中,可以使用福尔马林固定和石蜡包埋制备细胞悬浮液和其它非组织样品。在固定样品并包埋在石蜡或树脂块中之后,可以如上所述对样品进行切片。在分析之前,可以通过在合适的溶剂(例如,二甲苯)中孵育组织切片,然后冲洗(例如,99.5%乙醇
2分钟,96%乙醇2分钟和70%乙醇2分钟),从组织切片中去除石蜡包埋材料(例如,脱蜡)。
[0171]
(4)固定
[0172]
作为上述福尔马林固定的替代方案,可以将样品固定在多种其它固定剂中的任一种中,以在分析之前保存样品的生物结构。例如,可以通过浸入乙醇、甲醇、丙酮、甲醛(例如,2%甲醛)、多聚甲醛-triton、戊二醛或其组合来固定样品。
[0173]
在一些实施例中,丙酮固定与新鲜冷冻样品一起使用,新鲜冷冻样品可以包括但不限于皮质组织、小鼠嗅球、人脑肿瘤、人尸检脑和乳腺癌样品。在一些实施例中,基于期望的工作流程选择和/或优化兼容的固定方法。例如,甲醛固定可以选择为与使用ihc/if方案进行蛋白质可视化的工作流程兼容。作为另一个实例,可以选择甲醇固定用于强调rna/dna文库质量的工作流程。在一些应用中可以选择丙酮固定以透化组织。当进行丙酮固定时,可以不进行预透化步骤(如下所述)。替代地,丙酮固定可以与透化步骤联合进行。
[0174]
(5)包埋
[0175]
作为上述石蜡包埋的替代方案,可以将样品包埋在多种其它包埋材料中的任一种中以在切片和其它处理步骤之前向样品提供结构基底。通常,在分析从样品获得的组织切片之前去除包埋材料。合适的包埋材料包括但不限于蜡、树脂(例如,甲基丙烯酸树脂)、环氧树脂和琼脂。
[0176]
(6)染色
[0177]
为了便于可视化,可以使用多种染色剂和染色技术对样品进行染色。在一些实施例中,例如,可以使用任何数量的染色剂对样品进行染色,包括但不限于吖啶橙、俾斯麦棕、胭脂红、考马斯蓝、甲酚紫、dapi、曙红、溴化乙锭、酸性品红、苏木精、赫斯特染色剂、碘、甲基绿、亚甲蓝、中性红、尼罗蓝、尼罗红、四氧化锇、碘化丙啶、罗丹明或番红。
[0178]
样品可用已知的染色技术染色,包括坎-格伦瓦德(can-grunwald)、吉姆莎(giemsa)、苏木精和曙红(h&e)、哲纳尔氏(jenner's)、雷氏曼(leishman)、马松三色(masson's trichrome)、巴氏(papauicolaou)、瑞氏(romanowsky)、银、苏丹、瑞特(wright's)和/或高碘酸希夫(pas)染色技术。pas染色通常在福尔马林或丙酮固定后进行。
[0179]
在一些实施例中,使用如本文别处所述的可检测标记(例如,放射性同位素、荧光团、化学发光化合物、生物发光化合物和染料)对样品进行染色。在一些实施例中,仅使用一种类型的染色剂或一种技术对样品进行染色。在一些实施例中,染色包括生物染色技术,如h&e染色。在一些实施例中,染色包括使用荧光缀合的抗体鉴定分析物。在一些实施例中,使用两种或更多种不同类型的染色剂或两种或更多种不同的染色技术对样品进行染色。例如,可以通过使用一种技术(例如,h&e染色和明场成像)进行染色和成像,然后使用另一种技术(例如,ihc/if染色和荧光显微术)对同一样品进行染色和成像来制备样品。
[0180]
在一些实施例中,样品可以脱色。使样品脱色或褪色的方法是本领域已知的,并且通常取决于应用于样品上的染色剂的性质。例如,h&e染色可以通过在hcl或任何其它低ph值酸(例如,硒酸、硫酸、氢碘酸、苯甲酸、碳酸、苹果酸、磷酸、草酸、琥珀酸、水杨酸、酒石酸、亚硫酸、三氯乙酸、氢溴酸、盐酸、硝酸、正磷酸、砷酸、亚硒酸、铬酸、柠檬酸、氢氟酸、亚硝酸、异氰酸、甲酸、硒化氢、钼酸、乳酸、乙酸、碳酸、硫化氢或其组合)中洗涤样品来脱色。在一些实施例中,脱色可以包括在低ph值酸(例如,hcl)中洗涤1、2、3、4、5或更多次。在一些实施例中,脱色可以包括向下游溶液(例如,透化溶液)中添加hcl。在一些实施例中,脱色可以
包括将所公开的方法中使用的酶(例如,胃蛋白酶)溶解在低ph值酸(例如,hcl)溶液中。在一些实施例中,在用低ph值酸脱色苏木精之后,可以向脱色溶液中添加其它试剂以提高用于其它应用的ph值。例如,与单独的低ph值酸性脱色溶液相比,可以将sds添加到低ph值酸性脱色溶液中以提高ph值。作为另一个实例,在一些实施例中,通过抗体偶联将一种或多种免疫荧光染色剂应用于样品。可以使用如通过用还原剂和去污剂洗涤处理、离液盐处理、用抗原修复溶液处理和用酸性甘氨酸缓冲液处理而裂解二硫键的技术来去除这些染色剂。多重染色和脱色的方法描述于例如bolognesi等人,2017,《组织化学和细胞化学杂志(j.histochem.cytochem.)》65(8):431-444,lin等人,2015,《自然通讯(nat commun.)》6:8390,pirici等人,2009,《组织化学和细胞化学杂志》57:567-75,和glass等人,2009《组织化学和细胞化学杂志》57:899
–
905,其各自的全部内容通过引用并入本文。
[0181]
(7)水凝胶包埋
[0182]
在一些实施例中,水凝胶形成发生在样品内。在一些实施例中,将样品(例如,组织切片)包埋在水凝胶中。在一些实施例中,将水凝胶亚单位输注到样品中,并通过外部或内部刺激引发水凝胶的聚合。本文所述的“水凝胶”可以包括亲水性聚合物链的交联3d网络。“水凝胶亚单位”可以是亲水性单体、分子前体或可以聚合(例如,交联)以形成三维(3d)水凝胶网络的聚合物。
[0183]
水凝胶可以在水的存在下溶胀。在一些实施例中,水凝胶包含天然材料。在一些实施例中,水凝胶包括合成材料。在一些实施例中,水凝胶包括混合材料,例如,水凝胶材料包含合成和天然聚合物的成分。可以使用本文所述的用于水凝胶或包含基于多肽的材料的水凝胶中的任何材料。以这种方式包埋样品通常包括使样品与水凝胶接触,使得样品被水凝胶包围。例如,可以通过使样品与合适的聚合物材料接触并活化聚合物材料以形成水凝胶来包埋样品。在一些实施例中,形成水凝胶使得水凝胶在样品内内化。
[0184]
在一些实施例中,通过形成水凝胶的聚合物材料的交联将样品固定在水凝胶中。交联可以通过化学和/或光化学方式进行,或者替代地通过本领域已知的任何其它水凝胶形成方法进行。例如,可以通过聚丙烯酰胺交联将样品固定在水凝胶中。此外,样品的分析物可以通过交联(例如,聚丙烯酰胺交联)固定在水凝胶中。
[0185]
水凝胶基质的组成和在样品中的应用通常取决于样品的性质和制备(例如,切片、非切片、新鲜冷冻、固定类型)。水凝胶可以是任何合适的水凝胶,其中当在样品上形成水凝胶时,样品被锚定在水凝胶上或包埋在水凝胶中。水凝胶的非限制性实例在本文中描述或者是本领域已知的。作为一个实例,当样品是组织切片时,水凝胶可以包括单体溶液和过硫酸铵(aps)引发剂/四甲基乙二胺(temed)促进剂溶液。作为另一个实例,当样品由细胞(例如,培养的细胞或从组织样品分离的细胞)组成时,可以将细胞与单体溶液和aps/temed溶液一起孵育。对于细胞,在区室中形成水凝胶,区室包括但不限于用于培养、维持或转运细胞的装置。例如,水凝胶可以通过将单体溶液加aps/temed添加到区室中形成,深度范围为约0.1μm至约2mm。
[0186]
样品的水凝胶包埋的其它方法和方面描述于例如chen等人,2015,《科学》347(6221):543-548和题为《利用空间条形码寡核苷酸阵列对生物分析物进行分析(profiling of biological analytes with spatially barcoded oligonucleotide arrays)》的pct公开202020176788a1,其各自的全部内容通过引用并入本文。
[0187]
(8)样品转移
[0188]
在一些实施例中,使用水凝胶将固定在基底上的样品(例如,使用甲醇固定或福尔马林固定和石蜡包埋(ffpe)制备的生物样品)转移到空间阵列。在一些实施例中,在基底(例如,载玻片)上的样品顶部形成水凝胶。例如,水凝胶形成可以以足以将样品锚定(例如,包埋)到水凝胶的方式发生。在水凝胶形成后,将样品锚定到(例如,包埋在)水凝胶上,其中将水凝胶与基底分离导致样品与水凝胶一起与基底分离。然后样品可以与空间阵列接触,从而允许对样品进行空间分析。在一些实施例中,在使样品与空间阵列接触后去除水凝胶。例如,本文所述的方法可以包括事件依赖性(例如,光或化学)解聚水凝胶,其中在施加事件(例如,外部刺激)时,水凝胶解聚。在一个实例中,样品可以锚定到dtt敏感的水凝胶上,其中dtt的添加可以引起水凝胶解聚并释放锚定的样品。水凝胶可以是任何合适的水凝胶,其中当在样品上形成水凝胶时,样品被锚定在水凝胶上或包埋在水凝胶中。水凝胶的非限制性实例在本文中描述或者是本领域已知的。在一些实施例中,水凝胶包括允许将样品锚定到水凝胶的接头。在一些实施例中,水凝胶包括允许将分析物锚定到水凝胶的接头。在这种情况下,接头可以在水凝胶形成之前、同时或之后添加到水凝胶中。将核酸锚定到水凝胶上的接头的非限制性实例可以包括6-((丙烯酰基)氨基)己酸(丙烯酰基-x se)(可购自马萨诸塞州沃尔瑟姆的赛默飞世尔公司(thermofisher,waltham,ma))、label-it胺(可购自威斯康星州麦迪逊的mirusbio公司(mirusbio,madison,wi))和label x(chen等人,《自然方法(nat.方法)》13:679-684,2016)。任何种类的特征可以确定给定样品所需的转移条件。可能影响转移条件的特征的非限制性实例包括样品(例如,厚度、固定和交联)和/或感兴趣的分析物(保存和/或转移不同分析物(例如,dna、rna和蛋白质)的不同条件)。在一些实施例中,水凝胶形成可以以足以将样品中的分析物锚定(例如,包埋)到水凝胶的方式发生。在一些实施例中,水凝胶可以与存在于样品中的锚定分析物(例如,包埋在水凝胶中)一起内爆(例如,收缩)。在一些实施例中,水凝胶可以用存在于样品中的锚定分析物(例如,包埋在水凝胶中)膨胀(例如,等体积膨胀)。在一些实施例中,水凝胶可以被内爆(例如,收缩)并随后用存在于样品中的锚定分析物(例如,包埋在水凝胶中)膨胀。
[0189]
(9)等体积膨胀
[0190]
在一些实施例中,包埋在水凝胶中的样品可以是等体积膨胀的。可以使用的等体积膨胀方法包括水合作用,这是膨胀显微镜中的一个制备步骤,如chen等人,2015,《科学》347(6221)543-548,asano等人,2018,《实验室指南(current protocols)》80:1,doi:10.1002/cpcb.56;gao等人,2017,《bmc生物学》15:50,doi:10.1186/s12915-017-0393-3,和wassie等人,2018,《膨胀显微镜:生物学研究中的原理和应用(expansion microscopy:principles and uses in biological research)》,《自然方法》16(1):33-41中描述的,其各自通过引用整体并入本文。
[0191]
通常,用于执行样品的等体积膨胀的步骤可以取决于样品的特性(例如,组织切片的厚度、固定、交联)和/或感兴趣的分析物(例如,将rna、dna和蛋白质锚定到凝胶的不同条件)。
[0192]
可以通过将样品的一种或多种组分锚定到凝胶上,随后凝胶形成、蛋白水解和溶胀来进行等体积膨胀。样品的等体积膨胀可以发生在样品固定在基底上之前,或者在样品固定在基底上之后。在一些实施例中,在使膨胀的样品与空间条码化阵列(例如,基底上的
空间条码化捕获探针)接触之前,可以从基底中去除等体积膨胀的样品。
[0193]
在一些实施例中,样品中的蛋白质被锚定到可溶胀的凝胶上,如聚电解质凝胶上。抗体可以在锚定于可溶胀的凝胶之前、之后或同时导向到蛋白质。样品中的dna和/或rna也可以通过合适的接头锚定到可溶胀的凝胶上。此类接头的实例包括但不限于6-((丙烯酰基)氨基)己酸(丙烯酰基-x se)(可购自马萨诸塞州沃尔瑟姆的赛默飞世尔公司)、label-it胺(可购自威斯康星州麦迪逊的mirusbio公司)和label x(例如描述于chen等人,《自然方法)》13:679-684,2016,其全部内容通过引用并入本文)。
[0194]
样品的等体积膨胀可以增加样品的后续分析的空间分辨率。例如,样品的等体积膨胀可能导致空间分布(例如,单细胞分布)的分辨率增加。空间分布的分辨率增加可以通过将等体积膨胀的样品与未等体积膨胀的样品进行比较来确定。
[0195]
等体积膨胀可以实现样品的后续分析的三维空间分辨率。在一些实施例中,样品的等体积膨胀可以在空间分析试剂(例如,分析物捕获剂或捕获探针)的存在下发生。例如,可溶胀的凝胶可以包括通过合适的接头锚定到可溶胀的凝胶的分析物捕获剂或捕获探针。在一些实施例中,可以将空间分析试剂递送到等体积膨胀样品中的特定位置。
[0196]
在一些实施例中,将样品等体积膨胀至其未膨胀体积的至少2x、2.1x、2.2x、2.3x、2.4x、2.5x、2.6x、2.7x、2.8x、2.9x、3x、3.1x、3.2x、3.3x、3.4x、3.5x、3.6x、3.7x、3.8x、3.9x、4x、4.1x、4.2x、4.3x、4.4x、4.5x、4.6x、4.7x、4.8x或4.9x的体积。在一些实施例中,将样品等体积膨胀至其未膨胀体积的至少2x且小于20x。
[0197]
在一些实施例中,将包埋在水凝胶中的样品等体积膨胀至其未膨胀体积的至少2x、2.1x、2.2x、2.3x、2.4x、2.5x、2.6x、2.7x、2.8x、2.9x、3x、3.1x、3.2x、3.3x、3.4x、3.5x、3.6x、3.7x、3.8x、3.9x、4x、4.1x、4.2x、4.3x、4.4x、4.5x、4.6x、4.7x、4.8x或4.9x的体积。在一些实施例中,将包埋在水凝胶中的样品等体积膨胀至其未膨胀体积的至少2x且小于20x。
[0198]
(10)基底附着
[0199]
在一些实施例中,样品可以附着于基底(例如,芯片)。下面详细描述适用于此目的的基底的实例。样品的附着可以是不可逆的或可逆的,这取决于样品的性质和分析方法中的后续步骤。
[0200]
在某些实施例中,通过将合适的聚合物涂层施加到基底上,并使样品与聚合物涂层接触,可以将样品可逆地附着于基底。然后可以使用至少部分溶解聚合物涂层的有机溶剂将样品从基底上分离。水凝胶是适用于此目的的聚合物的实例。
[0201]
更一般地,在一些实施例中,可以用一种或多种物质涂覆或官能化基底以促进样品与基底的附着。可用于涂覆或官能化基底的合适物质包括但不限于凝集素、聚赖氨酸、抗体和多糖。
[0202]
(11)细胞解聚
[0203]
在一些实施例中,样品对应于细胞(例如,来源于细胞培养物或组织样品)。在具有多个细胞的细胞样品中,单个细胞可以是天然未聚集的。例如,细胞可以来源于细胞悬浮液和/或来自组织或组织切片的解离或解聚的细胞。
[0204]
替代地,样品中的细胞可以聚集,并且可以使用例如酶促或机械技术解聚成单个细胞。用于酶促解聚的酶的实例包括但不限于分散酶、胶原酶、胰蛋白酶及其组合。可以例如使用组织匀浆器进行机械解聚。
[0205]
在未聚集的细胞或解聚的细胞的一些实施例中,细胞分布在基底上,使得至少一个细胞占据基底上不同的空间特征。细胞可以固定在基底上(例如,以防止细胞的横向扩散)。在一些实施例中,细胞固定剂可用于在捕获分析物之前将未聚集或解聚的样品固定在空间条形码阵列上。“细胞固定剂”可以指附着于基底的抗体,其可以结合至细胞表面标记。在一些实施例中,基底上的多个细胞的分布遵循泊松统计。
[0206]
在一些实施例中,将来自多个细胞的细胞固定在基底上。在一些实施例中,细胞被固定以防止横向扩散,例如通过添加水凝胶和/或通过施加电场。
[0207]
(12)悬浮和粘附细胞
[0208]
在一些实施例中,样品可以来源于体外生长的细胞培养物。来源于细胞培养物的样品可以包括一种或多种悬浮细胞,其在细胞培养物中是不依赖于贴壁的。此类细胞的实例包括但不限于来源于造血细胞的细胞系和来源于以下细胞系:colo205、ccrf-cem、hl-60、k562、molt-4、rpmi-8226、sr、hop-92、nci-h322m和malme-3m。
[0209]
来源于细胞培养物的样品可以包括在包含培养基的容器的表面上生长的一种或多种粘附细胞。悬浮细胞和粘附细胞的其它非限制性实例可见于2020年8月13日提交的题为《用于使用单元型上的空间分布来确定生物学状况的系统和方法(systems and methods for using the spatial distributions on haplotypes to determine a biological condition)》的美国专利申请第16/992,569号和题为《利用空间条形码寡核苷酸阵列对生物分析物进行分析》的pct公布第202020176788a1号中,其各自的全部内容通过引用并入本文。
[0210]
在一些实施例中,样品可以被透化以促进分析物从样品中转移出来,和/或促进物种(如捕获探针)转移到样品中。如果样品不能充分透化,从样品捕获的分析物的量可能太低而不能进行充分的分析。相反,如果组织样品的渗透性太强,则组织样品内分析物的相对空间关系可能会丧失。因此,期望在透化组织样品足以获得良好的信号强度的同时仍保持样品中分析物分布的空间分辨率之间的平衡。
[0211]
常,样品可以通过将样品暴露于一种或多种透化剂而被透化。用于此目的的合适试剂包括但不限于有机溶剂(例如,丙酮、乙醇和甲醇)、交联剂(例如,多聚甲醛)、去污剂(例如,皂苷、triton x-100
tm
、tween-20
tm
或十二烷基硫酸钠(sds))和酶(例如,胰蛋白酶、蛋白酶(例如,蛋白酶k)。在一些实施例中,去污剂是阴离子去污剂(例如,sds或n-月桂酰肌氨酸钠盐溶液)。在一些实施例中,在酶处理(例如,用本文所述的任何酶处理,例如,胰蛋白酶、蛋白酶(例如,胃蛋白酶和/或蛋白酶k))之前或之后,可以使用本文所述的任何方法(例如,使用本文所述的任何去污剂,例如,sds和/或n-月桂酰肌氨酸钠盐溶液)透化样品。
[0212]
在一些实施例中,样品可以通过将样品暴露于大于约1.0w/v%(例如,大于约2.0w/v%、大于约3.0w/v%、大于约4.0w/v%、大于约5.0w/v%、大于约6.0w/v%、大于约7.0w/v%、大于约8.0w/v%、大于约9.0w/v%、大于约10.0w/v%、大于约11.0w/v%、大于约12.0w/v%,或大于约13.0w/v%)的十二烷基硫酸钠(sds)和/或n-月桂酰肌氨酸或n-月桂酰肌氨酸钠盐而被透化。在一些实施例中,样品可以通过将样品暴露(例如,约5分钟至约1小时、约5分钟至约40分钟、约5分钟至约30分钟、约5分钟至约20分钟,或约5分钟至约10分钟)于约1.0w/v%至约14.0w/v%(例如,约2.0w/v%至约14.0w/v%、约2.0w/v%至约12.0w/v%、约2.0w/v%至约10.0w/v%、约4.0w/v%至约14.0w/v%、约4.0w/v%至约
12.0w/v%、约4.0w/v%至约10.0w/v%、约6.0w/v%至约14.0w/v%、约6.0w/v%至约12.0w/v%、约6.0w/v%至约10.0w/v%、约8.0w/v%至约14.0w/v%、约8.0w/v%至约12.0w/v%、约8.0w/v%至约10.0w/v%、约10.0%w/v%至约14.0w/v%、约10.0w/v%至约12.0w/v%,或约12.0w/v%至约14.0w/v%)的sds和/或n-月桂酰肌氨酸盐溶液和/或蛋白酶k(例如,在约4%至约35℃、约4℃至约25℃、约4℃至约20℃、约4℃至约10℃、约10℃至约25℃、约10℃至约20℃、约10℃至约15℃、约35℃至约50℃、约35℃至约45℃、约35℃至约40℃、约40℃至约50℃、约40℃至约45℃,或约45℃至约50℃的温度下)而被透化。
[0213]
在一些实施例中,样品可以与透化剂一起孵育以促进样品的透化。用于样品透化的其它方法描述于例如jamur等人,2010,《分子生物学(method mol.biol.)》588:63-66,2010,其全部内容通过引用并入本文。
[0214]
裂解试剂
[0215]
在一些实施方案中,样品可以通过向样品中添加一种或多种裂解试剂来透化。合适的裂解剂的实例包括但不限于生物活性试剂,如用于裂解不同细胞类型(例如,革兰氏阳性或阴性细菌、植物、酵母、哺乳动物)的裂解酶,如溶菌酶、无色肽酶、溶葡萄球菌素、labiase、细胞裂解酶、溶细胞酶和多种其它市售裂解酶。
[0216]
可以额外地或替代地将其它裂解剂添加到样品中以促进透化。例如,基于表面活性剂的裂解溶液可用于裂解样品细胞。裂解溶液可以包括离子型表面活性剂,例如十二烷基肌氨酸钠和十二烷基硫酸钠(sds)。更一般地,化学裂解剂可包括但不限于有机溶剂、螯合剂、去污剂、表面活性剂和离液剂。
[0217]
在一些实施例中,可以通过非化学透化方法透化样品。非化学透化方法是本领域已知的。例如,可以使用的非化学透化方法包括但不限于物理裂解技术(如电穿孔)、机械透化方法(例如,使用匀浆器和研磨球的珠打浆以机械地破坏样品组织结构)、声学透化(例如,超声处理)和热裂解技术(如加热)以诱导样品的热透化。
[0218]
蛋白酶
[0219]
在一些实施例中,培养基、溶液或透化溶液可以包含一种或多种蛋白酶。在一些实施例中,用能够降解组蛋白的蛋白酶处理的样品可能导致生成片段化的基因组dna。可以使用用于捕获mrna的相同捕获域(例如,具有聚(t)序列的捕获域)来捕获片段化的基因组dna。在一些实施例中,在空间分析之前用能够降解组蛋白蛋白质的蛋白酶和rna保护剂处理样品以促进基因组dna和mrna的捕获。
[0220]
在一些实施例中,生物样品通过将样品暴露于能够降解组蛋白蛋白质的蛋白酶而被透化。如本文所用,术语“组蛋白”通常是指接头组蛋白(例如,h1)和/或核心组蛋白(例如,h2a、h2b、h3和h4)。在一些实施例中,蛋白酶降解接头组蛋白、核心组蛋白,或接头组蛋白和核心组蛋白。可以使用能够降解样品中组蛋白的任何合适的蛋白酶。能够降解组蛋白的蛋白酶的非限制性实例包括被亮抑蛋白酶肽和tlck(甲苯磺酰基-l-赖氨酰-氯甲烷盐酸盐)抑制的蛋白酶、由来自沙眼衣原体血清变型a(chlamydia trachomatis serovar a)的euo基因编码的蛋白酶、粒酶a、丝氨酸蛋白酶(例如,胰蛋白酶或胰蛋白酶样蛋白酶、中性丝氨酸蛋白酶、弹性蛋白酶、组织蛋白酶g)、天冬氨酰蛋白酶(例如,组织蛋白酶d)、肽酶家族c1酶(例如,组织蛋白酶l)、胃蛋白酶、蛋白酶k、被重氮甲烷抑制剂z-phe-phe-chn(2)或环氧化物抑制剂e-64抑制的蛋白酶、溶酶体蛋白酶或嗜天青酶(例如,组织蛋白酶g、弹性
蛋白酶、蛋白酶3、中性丝氨酸蛋白酶)。在一些实施例中,丝氨酸蛋白酶是胰蛋白酶、胰蛋白酶样酶或其功能变体或衍生物(例如,p00761;c0hk48;q8iyp2;q8bw11;q6ie06;p35035;p00760;p06871;q90627;p16049;p07477;p00762;p35031;p19799;p35036;q29463;p06872;q90628;p07478;p07146;p00763;p35032;p70059;p29786;p35037;q90629;p35030;p08426;p35033;p35038;p12788;p29787;p35039;p35040;q8nhm4;p35041;p35043;p35044;p54624;p04814;p35045;p32821;p54625;p35004;p35046;p32822;p35047;c0hka5;c0hka2;p54627;p35005;c0hka6;c0hka3;p52905;p83348;p00765;p35042;p81071;p35049;p51588;p35050;p35034;p35051;p24664;p35048;p00764;p00775;p54628;p42278;p54629;p42279;q91041;p54630;p42280;c0hka4)或其组合。在一些实施例中,胰蛋白酶是p00761、p00760、q29463或其组合。在一些实施例中,能够降解一种或多种组蛋白的蛋白酶包含与p00761、p00760或q29463具有至少80%序列同一性的氨基酸序列。在一些实施例中,能够降解一种或多种组蛋白的蛋白酶包含与p00761、p00760或q29463具有至少85%、90%、91%、92%、93%、94%、95%、96%、97%、98%或99%同一性的氨基酸序列。如果蛋白酶相对于在对酶最佳的条件下的蛋白酶的活性具有至少50%,例如至少60%、70%、80%、90%、95%、96%、97%、98%、99%或100%的活性,则其可被认为是功能变体。在一些实施例中,用胃蛋白酶或胃蛋白酶样酶的酶处理可以包括:p03954/pepa1_macfu;p28712/pepa1_rabit;p27677/pepa2_macfu;p27821/pepa2_rabit;p0djd8/pepa3_human;p27822/pepa3_rabit;p0djd7/pepa4_human;p27678/pepa4_macfu;p28713/pepa4_rabit;p0djd9/pepa5_human;q9d106/pepa5_mouse;p27823/pepaf_rabit;p00792/pepa_bovin;q9n2d4/pepa_calja;q9gmy6/pepa_canlf;p00793/pepa_chick;p11489/pepa_macmu;p00791/pepa_pig;q9gmy7/pepa_rhife;q9gmy8/pepa_sorun;p81497/pepa_sunmu;p13636/pepa_ursth及其功能变体和衍生物,或其组合。在一些实施例中,胃蛋白酶可以包括:p00791/pepa_pig;p00792/pepa_bovin,其功能变体、衍生物或组合。
[0221]
另外,蛋白酶可以包含在反应混合物(溶液)中,其还包括其它组分(例如,缓冲液、盐、螯合剂(例如,edta)和/或去污剂(例如,sds、n-月桂酰肌氨酸钠盐溶液))。反应混合物可以被缓冲,具有约6.5至8.5,例如约7.0至8.0的ph。另外,反应混合物可以在任何合适的温度下使用,如约10至50℃,例如约10至44℃、11至43℃、12至42℃、13至41℃、14至40℃、15至39℃、16至38℃、17至37℃,例如约10℃、12℃、15℃、18℃、20℃、22℃、25℃、28℃、30℃、33℃、35℃或37℃,优选地约35至45℃,例如,约37℃。
[0222]
其它试剂
[0223]
在一些实施例中,透化溶液可以包含额外的试剂,或者样品可以用额外的试剂处理以优化生物样品的透化。在一些实施例中,额外的试剂是rna保护剂。如本文所用,术语“rna保护剂”通常是指保护rna免受rna核酸酶(例如,rnase)影响的试剂。可以使用保护rna免于降解的任何合适的rna保护剂。rna保护剂的非限制性实例包括有机溶剂(例如,至少60%、65%、70%、75%、80%、85%、90%或95%v/v的有机溶剂),其包括但不限于乙醇、甲醇、丙-2-醇、丙酮、三氯乙酸、丙醇、聚乙二醇、乙酸或其组合。在一些实施例中,rna保护剂包括乙醇、甲醇和/或丙-2-醇,或其组合。在一些实施例中,rna保护剂包括rnalater ice(赛默飞世尔科技公司(thermofisher scientific))。在一些实施例中,rna保护剂包含至少约60%的乙醇。在一些实施例中,rna保护剂包含约60至95%的乙醇、约0至35%的甲醇
和约0至35%的丙-2-醇,其中培养基中有机溶剂的总量不超过约95%。在一些实施例中,rna保护剂包含约60至95%的乙醇、约5至20%的甲醇和约5至20%的丙-2-醇,其中培养基中有机溶剂的总量不超过约95%。
[0224]
在一些实施例中,rna保护剂包括盐。盐可以包括硫酸铵、硫酸氢铵、氯化铵、乙酸铵、硫酸铯、硫酸镉、硫酸铁(ii)铯、硫酸铬(iii)、硫酸钴(ii)、硫酸铜(ii)、氯化锂、乙酸锂、硫酸锂、硫酸镁、氯化镁、硫酸锰、氯化锰、氯化钾、硫酸钾、氯化钠、乙酸钠、硫酸钠、氯化锌、乙酸锌和硫酸锌。在一些实施例中,盐是硫酸盐,例如硫酸铵、硫酸氢铵、硫酸铯、硫酸镉、硫酸铁(ii)铯、硫酸铬(iii)、硫酸钴(ii)、硫酸铜(ii)、硫酸锂、硫酸镁、硫酸锰、硫酸钾、硫酸钠或硫酸锌。在一些实施例中,盐是硫酸铵。盐可以以约20g/100ml培养基或更低的浓度存在,如约15g/100ml、10g/100ml、9g/100ml、8g/100ml、7g/100ml、6g/100ml、5g/100ml或更低,例如约4g、3g、2g或1g/100ml。
[0225]
另外,rna保护剂可以包含在进一步包括螯合剂(例如,edta)、缓冲液(例如,柠檬酸钠、乙酸钠、柠檬酸钾或乙酸钾,优选地乙酸钠)和/或缓冲至约4至8(例如,约5)的ph的培养基中。
[0226]
在一些实施例中,在透化之前、同时或之后用一种或多种rna保护剂处理样品。例如,在用一种或多种透化试剂(例如,一种或多种蛋白酶)处理之前,用一种或多种rna保护剂处理样品。在另一个实例中,用包括一种或多种rna保护剂和一种或多种透化试剂(例如,一种或多种蛋白酶)的溶液处理样品。在又一个实例中,在用一种或多种透化试剂(例如,一种或多种蛋白酶)处理样品之后,用一种或多种rna保护剂处理样品。在一些实施例中,在固定前用一种或多种rna保护剂处理样品。
[0227]
在一些实施例中,鉴定样品中捕获的分析物的位置包括核酸延伸反应。在一些实施例中,当捕获探针捕获片段化的基因组dna分子时,核酸延伸反应包括dna聚合酶。例如,核酸延伸反应包括使用dna聚合酶延伸捕获探针,该捕获探针使用捕获的分析物(例如,片段化的基因组dna)作为模板与捕获的分析物(例如,片段化的基因组dna)杂交。延伸反应的产物包括空间条形码分析物(例如,空间条形码片段化的基因组dna)。空间条形码分析物(例如,空间条形码片段化的基因组dna)可用于标识样品中分析物的空间位置。能够使用捕获的分析物作为模板延伸捕获探针的任何dna聚合酶可用于本文所述的方法。dna聚合酶的非限制性实例包括t7 dna聚合酶;bsu dna聚合酶;和大肠杆菌dna聚合酶pol i。
[0228]
抗扩散介质
[0229]
在一些实施例中,通常用于限制分析物扩散的抗扩散介质可以包括至少一种透化试剂。例如,抗扩散介质(例如,水凝胶)可以包括包含透化缓冲液或试剂的孔(例如,微米孔、纳米孔或皮孔或孔隙)。在一些实施例中,在使水凝胶与样品接触之前,将抗扩散介质(例如,水凝胶)浸泡在透化缓冲液中。在一些实施例中,水凝胶或其它抗扩散介质可以包含干燥的试剂或单体,以在将抗扩散介质施加到样品时递送透化试剂。在一些实施例中,抗扩散介质(例如,水凝胶)共价附着于固体基底(例如,丙烯酸酯化载玻片)。
[0230]
在一些实施例中,可以修饰水凝胶以递送透化试剂和包含捕获探针。例如,可以修饰水凝胶薄膜以包括空间条形码捕获探针。然后在使空间条形码水凝胶薄膜与样品接触之前,将空间条形码水凝胶薄膜浸泡在透化缓冲液中。在另一个实例中,可以修饰水凝胶以包括空间条形码捕获探针,并且被设计为当暴露于透化缓冲液或任何其它样品制备试剂时用
作多孔膜(例如,可渗透水凝胶)。透化试剂扩散通过空间条形码的可渗透水凝胶并透化水凝胶另一侧的样品。然后,在暴露于透化试剂后,分析物扩散到空间条形码水凝胶中。在此类情况下,空间条形码水凝胶(例如,多孔膜)促进样品中的分析物扩散到水凝胶中。在一些实施例中,分析物在暴露于透化试剂之前扩散到水凝胶中(例如,当分泌的分析物存在于样品之外时,或在样品在添加透化试剂之前通过其它方式裂解或透化的情况下)。在一些实施例中,透化试剂以可变流速(例如,促进透化试剂扩散穿过空间条形码水凝胶的任何流速)流过水凝胶。在一些实施例中,透化试剂流过空间条形码水凝胶上方的微流体室或通道。在一些实施例中,在使用流动将透化试剂引入样品之后,样品制备试剂可以在水凝胶上流动以进一步促进分析物扩散到空间条形码水凝胶中。因此,空间条形码水凝胶薄膜将透化试剂递送到与空间条形码水凝胶接触的样品表面,从而增强分析物迁移和捕获。在一些实施例中,将空间条形码水凝胶施用于样品并置于透化本体溶液中。在一些实施例中,浸泡在透化试剂中的水凝胶薄膜夹在样品和空间条形码阵列之间。在一些实施例中,靶分析物能够扩散通过透化试剂浸泡的水凝胶并杂交或结合水凝胶另一侧的捕获探针。在一些实施例中,水凝胶的厚度与分辨率损失成比例。在一些实施例中,孔(例如,微米孔、纳米孔或皮孔)可以包含空间条形码捕获探针和透化试剂和/或缓冲液。在一些实施例中,空间条形码捕获探针和透化试剂保持在间隔之间。在一些实施例中,将样品冲压、切割或转移到孔中,其中靶分析物通过透化试剂/缓冲液扩散到空间条形码捕获探针。在一些实施例中,分辨率损失可以与间隙厚度(例如,样品和捕获探针之间的透化缓冲液的量)成比例。在一些实施例中,抗扩散介质(例如,水凝胶)为大约50至500微米厚,包括500、450、400、350、300、250、200、150、100或50微米厚,或50至500微米内的任何厚度。
[0231]
在一些实施例中,将样品暴露于多孔膜(例如,可渗透水凝胶)以帮助透化并限制扩散分析物损失,同时允许透化试剂到达样品。可以控制膜化学和孔隙体积以使分析物损失最小化。在一些实施例中,多孔膜可以由玻璃、硅、纸、水凝胶、聚合物整料或其它材料制成。在一些实施例中,材料可以是天然多孔的。在一些实施例中,材料可以具有蚀刻到固体材料中的孔隙或孔。在一些实施例中,透化试剂流过多孔膜上方的微流体室或通道。在一些实施例中,流动控制样品接近透化试剂。在一些实施例中,多孔膜是可渗透水凝胶。例如,当透化试剂和/或样品制备试剂可以使用扩散穿过水凝胶时,水凝胶是可渗透的。本文所述的任何合适的透化试剂和/或样品制备试剂可以在足以从样品释放分析物(例如,核酸、蛋白质、代谢物、脂质等)的条件下使用。在一些实施例中,将水凝胶一侧暴露于样品,另一侧暴露于透化试剂。透化试剂扩散通过可渗透水凝胶并使水凝胶另一侧的样品透化。在一些实施例中,透化试剂以可变流速(例如,促进透化试剂扩散穿过水凝胶的任何流速)流过水凝胶。在一些实施例中,透化试剂流过水凝胶上方的微流体室或通道。使透化试剂流过水凝胶能够控制试剂的浓度。在一些实施例中,可以调节水凝胶化学和孔隙体积以增强渗透性并限制扩散分析物损失。
[0232]
在一些实施例中,多孔膜夹在空间条形码阵列和样品之间,其中透化溶液施加在多孔膜上。透化试剂通过膜的孔隙扩散并进入样品。在一些实施例中,可以将样品置于基底(例如,载玻片)上。然后生物分析物扩散通过多孔膜并进入包含捕获探针的空间。在一些实施例中,多孔膜被修饰以包括捕获探针。例如,可以使用本文所述的任何方法将捕获探针附着于多孔膜的表面。在另一个实例中,捕获探针可以在允许与生物分析物相互作用的任何
深度包埋多孔膜中。在一些实施例中,将多孔膜以允许多孔膜上的捕获探针与来自样品的生物分析物相互作用的构型置于样品上。例如,捕获探针位于多孔膜靠近样品的一侧。在此类情况下,多孔膜另一侧上的透化试剂通过多孔膜扩散到包含样品和捕获探针的位置中,以便促进样品的透化(例如,还促进捕获探针对生物分析物的捕获)。在一些实施例中,多孔膜位于样品和捕获探针之间。在一些实施例中,透化试剂流过多孔膜上方的微流体室或通道。
[0233]
选择性透化/选择性裂解
[0234]
在一些实施例中,可以根据已建立的方法处理样品以选择性地从细胞的亚细胞区域释放分析物。在一些实施例中,本文提供的方法可以包括检测样品中细胞的亚细胞区域中存在的至少一种分析物。如本文所用,“亚细胞区域”可以指任何亚细胞区域。例如,亚细胞区域可以指细胞溶质、线粒体、细胞核、核仁、内质网、溶酶体、小泡、高尔基体、质体、液泡、核糖体、细胞骨架或其组合。在一些实施例中,亚细胞区域包含细胞溶质、细胞核、线粒体和微粒体中的至少一种。在一些实施例中,亚细胞区域是细胞溶质。在一些实施例中,亚细胞区域是细胞核。在一些实施例中,亚细胞区域是线粒体。在一些实施例中,亚细胞区域是微粒体。
[0235]
例如,生物分析物可以通过选择性透化或选择性裂解从细胞的亚细胞区域选择性释放。在一些实施例中,“选择性透化”可以指可以透化亚细胞区域的膜,同时使不同的亚细胞区域基本上完整(例如,由于所应用的透化方法,生物分析物不会从亚细胞区域释放)的透化方法。选择性透化方法的非限制性实例包括使用电泳和/或施加透化试剂。在一些实施例中,“选择性裂解”可以指裂解亚细胞区域的膜同时使不同的亚细胞区域基本上完整(例如,由于所应用的裂解方法,生物分析物不从亚细胞区域释放)的裂解方法。选择性透化或裂解的几种方法是本领域技术人员已知的,包括lu等人《实验室芯片(lab chip.)》2005年1月;5(1):23-9;niklas等人,2011,《分析生物化学(anal biochem)》416(2):218-27;cox和emili,2006,《自然实验手册》1(4):1872-8;chiang等人,2000,《生物化学与生物物理方法杂志(j biochem.biophys.methods.)》20;46(1-2):53-68;以及yamauchi和herr等人,2017,《微系统与纳米工程(microsyst.nanoeng.)》3.pii:16079描述的方法;其各自通过全文引用并入本文。
[0236]
在一些实施例中,“选择性透化”或“选择性裂解”是指特定细胞类型的选择性透化或选择性裂解。例如,“选择性透化”或“选择性裂解”可以指裂解一种细胞类型同时使不同细胞类型基本上完整(例如,由于所应用的透化或裂解方法,生物分析物不会从细胞释放)。与另一细胞“不同细胞类型”的细胞可以指来自不同分类界的细胞、原核细胞与真核细胞、来自不同组织类型的细胞等。本领域技术人员已知许多用于选择性透化或裂解不同细胞类型的方法。非限制性实例包括应用透化试剂、电穿孔和/或超声处理。参见,例如,国际申请号wo2012/168003;han等人,2019,《微系统与纳米工程》5:30;gould等人,2018,《肿瘤标靶(oncotarget.)》20;9(21):15606-15615;oren和shai,1997,《生物化学(biochemistry)》36(7),1826-35;algayer等人,2019,《分子(molecules.)》24(11).pii:e2079;hipp等人2017,《白血病(leukemia)》10,2278;国际申请号wo 2012/168003;和美国专利第7,785,869号;所有这些文献通过引用整体并入本文。
[0237]
在一些实施例中,应用选择性透化或裂解试剂包含使样品与包含透化或裂解试剂
的水凝胶接触。
[0238]
在一些实施例中,使样品与两个或更多个阵列(例如,柔性阵列,如本文所述)接触。例如,在亚细胞区域被透化并且来自亚细胞区域的生物分析物被捕获在第一阵列上之后,可以去除第一阵列,并且来自不同亚细胞区域的生物分析物可以被捕获在第二阵列上。
[0239]
(13)rna种类的选择性富集
[0240]
在一些实施例中,在rna是分析物的情况下,可以选择性地富集一种或多种感兴趣的rna分析物种类(例如,adiconis等人,2013,《用于降解和低输入样品的rna测序方法的比较分析(comparative analysis of rna sequencing methods for degraded and low-input samples)》,《自然(nature)》10,623-632,其通过引用整体并入本文)。例如,可以通过向样品中添加一种或多种寡核苷酸来选择一种或多种感兴趣的rna。在一些实施例中,额外的寡核苷酸是用于通过聚合酶引发反应的序列。例如,与一种或多种感兴趣的rna具有序列互补性的一种或多种引物序列可用于扩增一种或多种感兴趣的rna,从而选择性地富集这些rna。在一些实施例中,与捕获的rna(例如,cdna)的互补链具有序列互补性的寡核苷酸可以结合到cdna。例如,具有与一个或多个感兴趣的cdna互补的序列的生物素化寡核苷酸结合到cdna,并且可以使用本领域已知的多种方法中的任一种使用生物素化-链霉抗生物素蛋白亲和力进行选择(例如,链霉抗生物素蛋白珠)。
[0241]
替代地,可以使用多种方法中的任一种来向下选择(例如,去除、耗尽)一种或多种rna(例如,核糖体和/或线粒体rna)。核糖体rna缺失的杂交和捕获方法的非限制性实例包括ribominus
tm
、ribocop
tm
和ribo-zero
tm
。另一种非限制性的rna缺失方法涉及互补dna寡核苷酸与不需要的rna的杂交,随后使用rnase h降解rna/dna杂合体。杂交和降解方法的非限制性实例包括rrna耗尽、nugen anydeplete或ribozero plus。另一种非限制性的核糖体rna缺失方法包括zapr
tm
消化,例如smarter。在smarter方法中,随机核酸衔接子与rna杂交进行第一链合成,并通过逆转录酶加尾,随后通过逆转录酶进行模板转换和延伸。另外,第一轮pcr扩增添加全长illumina测序衔接子(例如,illumina索引)。核糖体rna被zapr v2和r探针v2切割。进行第二轮pcr,扩增非rrna分子(例如,cdna)。这些核糖体耗尽方案/试剂盒的部分或步骤可以进一步与本文所述的方法组合以优化特定样品的方案。
[0242]
在耗尽方案中,可以将探针施用于样品,探针选择性地与核糖体rna(rrna)杂交,从而减少样品中rrna的汇集和浓度。可以将探针施用于样品,探针选择性地与线粒体rna(mtrna)杂交,从而减少样品中mtrna的汇集和浓度。在一些实施例中,与线粒体rna互补的探针可以在cdna合成期间添加,或与核糖体和线粒体rna两者互补的探针可以在cdna合成期间添加。由于样品中存在的非特异性rna(例如向下选择的rna)的减少,随后将捕获探针应用于样品可能导致其它类型rna的捕获的改善。附加地和替代地,双链体特异性核酸酶(dsn)处理可以去除rrna(参见,例如,archer等人,2014,《在cdna阶段选择性和灵活地从rna-seq文库中去除有问题的序列(selective and flexible depletion of problematic sequences from rna-seq libraries at the cdna stage)》,《bmc基因组学(bmc genomics)》15 401,其全部内容通过引用并入本文)。此外,羟基磷灰石层析可以去除丰富的物种(例如,rrna)(参见,例如,vandernoot,2012,《通过羟基磷灰石色谱对cdna进行归一化以丰富rna-seq应用中的转录组多样性(cdna normalization by hydroxyapatite chromatography to enrich transcriptome diversity in rna-seq applications)》,
《生物技术(biotechniques)》,53(6)373-80,其全部内容通过引用并入本文)。
[0243]
(14)其它试剂
[0244]
可以向样品中添加额外的试剂以在分析样品之前执行各种功能。在一些实施例中,可以将核酸酶抑制剂(如dnase和rnase灭活剂)或蛋白酶抑制剂(如蛋白酶k),和/或螯合剂(如edta)添加到样品中。在其它实施例中,可以将核酸酶(如dnase或rnase),或蛋白酶(如胃蛋白酶或蛋白酶k)添加到样品中。在一些实施例中,额外的试剂可以溶解在溶液中或作为介质施加到样品上。在一些实施例中,在施加到样品之前,可以将额外的试剂(例如,胃蛋白酶)溶解在hcl中。例如,来自h&e染色的苏木精可以任选地在进一步处理之前通过在稀hcl(0.001m至0.1m)中洗涤而从样品中去除。在一些实施例中,在进一步处理之前,可以将胃蛋白酶溶解在稀hcl(0.001m至0.1m)中。在一些实施例中,在用蛋白酶(例如,胃蛋白酶)孵育之前,但在蛋白酶k处理之后,样品可以在稀hcl中洗涤额外的次数(例如,2、3、4、5或更多次)。
[0245]
在一些实施例中,可以用一种或多种酶处理样品。例如,可以添加一种或多种用于片段化dna的核酸内切酶、dna聚合酶和用于扩增核酸的dntp。也可以添加到样品的其它酶包括但不限于聚合酶、转座酶、连接酶、dnase和rnase。
[0246]
在一些实施例中,可以向样品中添加逆转录酶,包括具有末端转移酶活性的酶、引物和模板转换寡核苷酸(tso)。模板转换可用于增加cdna的长度,例如通过将预定的核酸序列附加到cdna上。这种逆转录步骤如图37所示。在一些实施例中,附加的核酸序列包含一个或多个核糖核苷酸。
[0247]
在一些实施例中,可以添加额外的试剂以提高一种或多种靶分子(例如,cdna分子、mrna转录物)的回收率。例如,向rna样品工作流程过程中添加载体rna可以增加从样品中提取的rna/dna杂合体的产量。在一些实施例中,当输入或靶分子的浓度与剩余分子相比较低时,载体分子是有用的。通常,单个靶分子不能形成沉淀,并且载体分子的添加可有助于形成沉淀。一些靶分子回收方案使用载体rna来防止样品中存在的少量靶核酸被不可恢复地结合。在一些实施例中,可以在第二链合成步骤之前立即添加载体rna。在一些实施例中,可以在从阵列释放的寡核苷酸上的第二链cdna合成之前立即添加载体rna。在一些实施例中,可以在体外转录后清除步骤之前立即添加载体rna。在一些实施例中,可以在扩增的rna纯化和定量之前添加载体rna。在一些实施例中,可以在rna定量之前添加载体rna。在一些实施例中,可以在第二链cdna合成和体外转录后清除步骤之前立即添加载体rna。
[0248]
(15)用于捕获探针相互作用的预处理
[0249]
在一些实施例中,样品中的分析物可以在与捕获探针相互作用之前进行预处理。例如,在与捕获探针相互作用之前,在样品中进行聚合酶(例如,dna聚合酶或逆转录酶)催化的聚合反应。在一些实施例中,用于聚合反应的引物包括增强与捕获探针杂交的官能团。捕获探针可以包括合适的捕获域以捕获感兴趣的生物分析物(例如,捕获聚(a)mrna的聚-dt序列)。
[0250]
在一些实施例中,通过下一代测序对生物分析物进行预处理以生成文库。例如,可以通过添加修饰(例如,允许与捕获探针相互作用的序列的连接)来预处理分析物。在一些实施例中,使用片段化技术(例如,使用转座酶和/或片段化缓冲液)对分析物(例如,dna或rna)进行片段化。
[0251]
片段化之后可以修饰分析物。例如,修饰可以是通过连接允许与捕获探针杂交的衔接子序列而添加。在一些实施例中,当感兴趣的分析物是rna时,进行聚(a)加尾。将聚(a)尾添加到不含聚(a)尾的rna中可以促进与捕获探针的杂交,捕获探针包括具有功能量的聚(dt)序列的捕获域。
[0252]
在一些实施例中,在与捕获探针相互作用之前,在样品中进行连接酶催化的连接反应。在一些实施例中,可以通过化学连接进行连接。在一些实施例中,可以使用如下文进一步描述的点击化学进行连接。在一些实施例中,捕获域包括与rna分子具有互补性的dna序列,其中rna分子与第二dna序列具有互补性,并且其中rna-dna序列互补性用于将第二dna序列与捕获域中的dna序列连接。在这些实施例中,rna分子的直接检测是可能的。
[0253]
在一些实施例中,在与捕获探针相互作用之前,在样品中进行靶特异性反应。靶特异性反应的实例包括但不限于靶特异性连接子、探针和/或其它寡核苷酸的连接,使用对一种或多种分析物特异性的引物的靶特异性扩增,以及使用原位杂交、dna显微术和/或抗体检测的靶特异性检测。在一些实施例中,捕获探针包括靶向靶特异性产物(例如,扩增或连接)的捕获域。
[0254]
基于空间阵列的通用分析方法
[0255]
本公开的这一节描述了用于样品的基于空间阵列的分析的方法、设备、系统和组合物。
[0256]
(a)空间分析方法
[0257]
基于阵列的空间分析方法涉及将一种或多种分析物从样品转移到基底上的捕获点阵列,每个捕获点与阵列上的唯一空间位置缔合。对转移的分析物的后续分析包括确定分析物的同一性和样品中每种分析物的空间位置。样品中每种分析物的空间位置是基于阵列中每种分析物结合的捕获点和阵列中捕获点的相对空间位置确定的。
[0258]
存在至少两种将空间条形码与一个或多个相邻细胞缔合的通用方法,使得空间条形码将一个或多个细胞和/或一个或多个细胞的内容标识为与特定空间位置缔合。一种通用的方法是促使分析物从细胞中出来并朝向空间条形码阵列。图1描述了这种通用方法的示例性实施例。在图1中,用捕获探针填充的空间条形码阵列(如本文进一步描述的)与样品接触101,并且样品被透化102,从而允许靶分析物离开样品并朝向阵列迁移102。靶分析物与空间条形码阵列上的捕获探针相互作用。一旦靶分析物与捕获探针杂交/结合,任选地从阵列中取出样品并分析捕获探针以获得空间解析的分析物信息103。
[0259]
另一种通用方法是从阵列中切割空间条形码捕获探针,并将空间条形码捕获探针推向和/或推进到样品中或样品上。图2描绘了这种通用方法的示例性实施例,用捕获探针填充的空间条形码阵列(如本文进一步描述的)可以与样品接触201。空间条形码捕获探针被切割,然后与提供的样品中的细胞相互作用202。相互作用可以是共价或非共价细胞-表面相互作用。相互作用可以是由递送系统或细胞穿透肽促进的细胞内相互作用。一旦空间条形码化捕获探针与特定的细胞缔合,就可以任选地取出样品进行分析。样品可以任选地在分析之前解离。一旦标记的细胞与空间条形码捕获探针缔合,就可以分析捕获探针以获得关于标记的细胞的空间解析信息203。
[0260]
图3a和3b示出了包括在空间条形码阵列上准备样品301的示例性工作流程。样品制备可以包括将样品放置在基底(例如,芯片、载片等)上、固定样品,和/或将样品染色用于
成像。然后使用明场(以对样品成像,例如使用苏木精和曙红染色)或荧光(以对捕获点成像)(如图3b的上图302所示)和/或发射成像模态(如图3b的下图304所示)在阵列上对样品(染色或未染色)成像302。
[0261]
明场图像是透射显微镜图像,其中将广谱白光置于安装在芯片上的样品的一侧,将照相机物镜置于另一侧,并且样品本身过滤光以生成颜色或灰度强度图像1124,类似于在明亮的日子从内部观察的染色玻璃窗。
[0262]
在一些实施例中,除了明场成像之外或代替明场成像,使用发射成像,如荧光成像。在发射成像方法中,将芯片上的样品暴露于光的特定窄带(第一波长带)的光,然后测量以稍微不同的波长(第二波长带)从样品重新发射的光。这种吸收和再发射是由于荧光团的存在,荧光团对所使用的激发敏感并且可以是样品的天然性质或样品在成像准备中已经暴露于的试剂。作为一个实例,在免疫荧光实验中,将与某一蛋白质或某类蛋白质结合且用某一荧光团标记的抗体添加到样品中。当这样做时,样品上包括该蛋白质或该类蛋白质的位置将发射第二波长段。事实上,具有多个荧光团的多种抗体可用于标记样品中的多种蛋白质。每个这样的荧光团需要用不同波长的光激发并进一步发射不同的独特波长的光。为了在空间上解析每个不同发射波长的光,使样品经受不同波长的光,这些不同波长的光将在连续基础上激发多个荧光团,并且将这些曝光的每一个的图像保存为图像,从而生成多个图像。例如,使图像经受激发第一荧光团以第二波长发射的第一波长,并在样品暴露于第一波长时拍摄样品的第一图像。然后停止将样品暴露于第一波长,并将样品暴露于第三波长(不同于第一波长),第三波长在第四波长(不同于第二波长)激发第二荧光团,并在将样品暴露于第三波长时拍摄样品的第二图像。对于多个荧光团(例如,两个或更多个荧光团、三个或更多个荧光团、四个或更多个荧光团、五个或更多个荧光团)中的每个不同荧光团重复这样的过程。以这种方式,获得了组织的一系列图像,每个图像描绘了如特定蛋白质或蛋白质类的一些不同参数的空间排列。在一些实施例中,多于一个荧光团同时成像。在这种方法中,使用激发波长的组合,每个激发波长用于多于一个荧光团中的一个,并且收集单个图像。
[0263]
在一些实施例中,通过发射成像收集的每个图像是灰度的。为了区分这种灰度图像,在一些实施例中,为每个图像分配颜色(红色阴影、蓝色阴影等),并将其组合成一个复合彩色图像以供观看。这种荧光成像允许对样品中的蛋白质丰度进行空间分析(例如,空间蛋白质组学)。在一些实施例中,单独分析这种空间丰度。在其它实施例中,这种空间丰度与转录组学一起分析。
[0264]
在一些实施例中,在用转录组学连同明场和/或发射成像(例如,荧光成像)分析样品的情况下,从样品释放靶分析物并且形成空间条形码阵列的捕获探针杂交或结合所释放的靶分析物303。可以任选地从阵列中取出样品304,并可以任选地从阵列中切割捕获探针305。然后任选地以两种模式对样品和阵列进行第二次成像305b,同时将分析物逆转录成cdna,制备扩增子文库306并测序307。然后,将两组图像进行空间覆盖,以便使空间标识的样品信息相关308。当样品和阵列没有第二次成像时,305b,代替地提供点坐标文件。点坐标文件代替第二成像步骤305b。此外,可以用独特的pcr衔接子进行扩增子文库制备306并测序307。
[0265]
图4示出了利用基底(例如,芯片)上的空间标记阵列的另一示例性工作流程,其中
空间条形码捕获探针在称为捕获点的区域处聚类。空间标记的捕获探针可以包括切割域、一个或多个功能序列、空间条形码、唯一的分子标识符和捕获域。空间标记的捕获探针还可以包括用于可逆附着于基底的5'端修饰。使空间条形码阵列与样品接触401,并通过应用透化试剂使样品透化402。透化试剂可以通过将阵列/样品组件置于本体溶液中来施用。替代地,可以通过抗扩散介质和/或物理屏障(如盖)将透化试剂施用于样品,其中样品夹在抗扩散介质和/或屏障与含阵列的基底之间。使用本文公开的任何数量的技术,分析物向空间条形码捕获阵列迁移。例如,可以使用抗扩散介质盖和被动迁移来进行分析物迁移。作为另一个实例,分析物迁移可以是例如使用电泳转移系统的主动迁移。一旦分析物接近空间条形码捕获探针,捕获探针就可以杂交或以其它方式结合靶分析物403。可以任选地从阵列中取出样品404。
[0266]
捕获探针可以任选地从阵列切割405,并且捕获的分析物可以通过进行逆转录酶第一链cdna反应进行空间条形码化。第一链cdna反应可以任选地使用模板转换寡核苷酸进行。例如,模板转换寡核苷酸可以通过逆转录酶与添加到cdna的3'端的聚(c)尾杂交。然后可以从cdna变性原始mrna模板和模板转换寡核苷酸,然后空间条形码捕获探针可以与cdna杂交,并且可以生成cdna的互补物。然后可以纯化第一链cdna并收集用于下游扩增步骤。可以任选地使用pcr扩增第一链cdna 406,其中正向和反向引物侧接感兴趣的空间条形码和靶分析物区域,从而生成与特定空间条形码相关的文库407。在一些实施例中,cdna包含合成测序(sbs)引物序列。在一些实施例中,可以对文库制备进行定量和/或进行质量控制以验证文库制备步骤408的成功。对文库扩增子进行测序并分析以解码空间信息407,具有额外的文库质量控制(qc)步骤408。
[0267]
使用本文所述的方法、组合物、系统、试剂盒和装置,生物样品(例如,组织样品)中存在的rna转录物可用于空间转录组分析。具体地,在一些情况下,条形码化寡核苷酸可以被配置成引发、复制,并且因此从rna模板或其衍生物产生条形码化延伸产物。例如,在一些情况下,条形码化寡核苷酸可以包括mrna特异性引发序列,例如允许在逆转录反应中引发和复制mrna的聚-t引物区段或其它靶向引发序列。替代地或附加地,可以使用条形码化寡核苷酸的随机n-mer引物区段进行随机rna引发。逆转录酶(rt)可以使用rna模板和与rna模板的3'端互补的引物来指导第一链互补dna(cdna)的合成。许多rt可用于该逆转录反应,包括例如禽成髓细胞瘤病毒(amv)逆转录酶、莫洛尼鼠白血病病毒(m-mulv或mmlv)及其其它变体。某些重组m-mulv逆转录酶,例如ii逆转录酶,与其野生型对应物相比可能具有降低的rnase h活性和增加的热稳定性,并提供更高的特异性、更高的cdna产率和长度高达12千碱基(kb)的更全长cdna产物。在一些实施例中,逆转录酶是突变型逆转录酶,例如但不限于突变型mmlv逆转录酶。在另一个实施例中,逆转录酶是突变体mmlv逆转录酶,例如但不限于在美国专利公开第20180312822和于2019年12月11日提交的美国临时专利申请第62/946,885号中描述的一种或多种变体,这两篇文献通过引用整体并入本文。
[0268]
图5描述了示例性工作流程,其中从空间条形码阵列中取出样品,并从阵列中取出空间条形码捕获探针,用于条形码化分析物扩增和文库制备。另一个实施方案包括使用模板转换寡核苷酸在空间条形码阵列上进行第一链合成而不切割捕获探针。在该实施例中,样品制备501和透化502如本文别处所述进行。一旦捕获探针捕获靶分析物,通过模板转换和逆转录酶产生的第一链cdna 503随后变性,第二链随后延伸504。然后将第二链cdna从第
一链cdna变性,中和,并转移到管505。可以使用本文讨论的标准技术进行cdna定量和扩增。然后可以对cdna进行文库制备506和索引507,包括片段化、端修复、a-加尾和索引pcr步骤。还可以任选地测试文库的质量控制(qc)508。
[0269]
在上述工作流程的非限制性实例中,样品(例如组织切片)可以用甲醇固定、用苏木精和曙红染色并成像。任选地,样品可以在透化之前脱色。图像可用于将空间分析物丰度(例如,基因表达)模式映射回样品。透化酶可用于直接透化载片上的样品。从样品的上覆细胞释放的分析物(例如,聚腺苷酸化mrna)可以被基底上的捕获区内的捕获探针捕获。可以将逆转录(rt)试剂添加到透化的样品中。用rt试剂孵育可以从捕获的分析物(例如,聚腺苷酸化mrna)产生空间条形码化的全长cdna。可以将第二链试剂(例如,第二链引物、酶)添加到载片上的样品中以启动第二链合成。所得cdna可以从捕获探针模板变性并转移(例如,转移到干净的管中)用于扩增和/或文库构建。空间条形码化的全长cdna可以在文库构建之前通过pcr扩增。然后可以将cdna酶片段化并选择大小以优化cdna扩增子大小。p5、p7、i7和i5可以用作样品索引,并且可以通过端修复、a-加尾、连接子连接和pcr添加truseq读数2。然后使用truseq读数1和truseq读数2作为测序引物位点,使用配对端测序对cdna片段进行测序。参见,依诺米那(illumina),《索引测序概述指南(indexed sequencing overview guides)》,2018年2月,文件15057455v04;和依诺米那衔接子序列,2019年5月,文献#1000000002694v11,其各自通过引用并入本文,以获得关于p5、p7、i7、i5、truseq读数2、索引测序和本文所述的其它试剂的信息。
[0270]
在一些实施例中,对由该工作流程和本文所述的其它工作流程产生的数据进行相关分析可以产生跨越两个捕获区表达的基因的超过95%的相关性(例如95%或更高、96%或更高、97%或更高、98%或更高,或99%或更高)。当使用细胞核的单细胞rna测序执行所描述的工作流程时,在一些实施例中,数据的相关分析可以产生跨越两个捕获区表达的基因的超过90%(例如,超过90%、91%、92%、93%、94%、95%、96%、97%、98%或99%)的相关性。
[0271]
在一些实施例中,在生成cdna(例如,通过逆转录)后,可以直接在基底表面上扩增cdna。通过在基底表面上直接扩增生成cdna的多个拷贝(例如,从捕获的分析物合成的cdna)可以提高最终测序文库的复杂性。因此,在一些实施例中,cdna可以通过等温核酸扩增直接在基底表面上扩增。在一些实施例中,等温核酸扩增可以扩增rna或dna。
[0272]
在一些实施例中,等温扩增可以比标准pcr反应更快。在一些实施例中,等温扩增可以是线性扩增(例如,用单个引物不对称)或指数扩增(例如,用两个引物)。在一些实施例中,等温核酸扩增可以通过模板转换寡核苷酸引物进行。在一些实施例中,模板转换寡核苷酸将共同序列添加到被逆转录的rna的5'端。例如,在捕获探针与分析物(例如,mrna)相互作用并进行逆转录之后,将额外的核苷酸添加到cdna的端部,产生如本文所述的3'突出端。在一些实施例中,模板转换寡核苷酸与通过逆转录酶添加的未模板化的聚(c)核苷酸杂交以继续复制到模板转换寡核苷酸的5'端,从而生成准备用于进一步扩增的全长cdna。在一些实施例中,模板转换寡核苷酸向用于cdna扩增的全长cdna添加共同的5'序列(例如,模板转换寡核苷酸的反向互补物)。
[0273]
在一些实施例中,一旦生成全长cdna分子,模板转换寡核苷酸可以用作cdna扩增反应(例如,用dna聚合酶)中的引物。在一些实施例中,双链cdna(例如,第一链cdna和第二
链反向互补cdna)可以通过用解旋酶或重组酶等温扩增,然后用链置换dna聚合酶扩增。链置换dna聚合酶可以生成置换的第二链,从而产生扩增产物。
[0274]
在本文所述的任何等温扩增方法中,条形码交换(例如,空间条形码)可以在第一扩增循环之后发生,其中在基底表面上存在未使用的捕获探针。在一些实施例中,未使用的捕获探针的游离3'oh端可以通过任何合适的3'oh阻断方法进行阻断。在一些实施例中,3'oh可以通过发夹连接阻断。
[0275]
除了标准pcr反应(例如,需要加热至约95℃以使双链dna变性的pcr反应)之外,或替代标准pcr反应,可以使用等温核酸扩增。等温核酸扩增通常不需要使用热循环仪,然而在一些实施例中,等温扩增可以在热循环仪中进行。在一些实施例中,等温扩增可以在约35℃至约75℃进行。在一些实施例中,等温扩增可以在约40℃、约45℃、约50℃、约55℃、约60℃、约65℃或约70℃或其间的任何温度进行,这取决于所用的聚合酶和辅助酶。
[0276]
等温核酸扩增技术是本领域已知的,并且可以单独使用或与本文所述的任何空间方法组合使用。例如,合适的等温核酸扩增技术的非限制性实例包括转录介导的扩增、基于核酸序列的扩增、rna技术的信号介导的扩增、链置换扩增、滚环扩增、dna的环介导等温扩增(lamp)、等温多重置换扩增、重组酶聚合酶扩增、解旋酶依赖性扩增、单引物等温扩增和环状解旋酶依赖性扩增(参见,例如,gill和ghaemi,《核酸等温扩增技术:综述(nucleic acid isothermal amplification technologies:a review)》,《核苷、核苷酸和核酸(nucleosides,nucleotides,&nucleic acids)》,27(3),224-43,doi:10.1080/15257770701845204(2008),其通过引用整体并入本文)。
[0277]
在一些实施例中,等温核酸扩增是解旋酶依赖性核酸扩增。解旋酶依赖性等温核酸扩增描述于vincent等人,2004,《解旋酶依赖性等温dna扩增(helicase-dependent isothermal dna amplification)》,《embo报告(embo rep.)》,795-800和美国专利第7,282,328号,其均通过引用整体并入本文。此外,在基底(例如,芯片)上的解旋酶依赖性核酸扩增描述于andresen等人,2009,《解旋酶依赖性扩增:用于芯片扩增和潜在的护理点诊断(helicase-dependent amplification:use in onchip amplification and potential for point-of-care diagnostics)》,《分子诊断专家评审(expert rev mol diagn.)》9,645-650,doi:10.1586/erm.09.46,其全部内容通过引用并入本文。在一些实施例中,等温核酸扩增是重组酶聚合酶核酸扩增。重组酶聚合酶核酸扩增描述于piepenburg等人,2006《利用重组蛋白进行dna检测(dna detection using recombinant proteins)》,《公共科学图书馆生物学(plos biol.)》4,7e204和li等人,2019,《综述:重组酶聚合酶扩增的十年发展的综合概述(review:a comprehensive summary of adecade development of the recombinase polymerase amplification)》,《分析员(analyst)》144,31-67,doi:10.1039/c8an01621f(2019),其均通过引用整体并入本文。
[0278]
通常,等温扩增技术使用本领域已知的标准pcr试剂(例如,缓冲液、dntp等)。一些等温扩增技术可能需要额外的试剂。例如,解旋酶依赖性核酸扩增使用单链结合蛋白和辅助蛋白。在另一个实例中,重组酶聚合酶核酸扩增使用重组酶(例如,t4 uvsx)、重组酶加载因子(例如,tf uvsy)、单链结合蛋白(例如,t4 gp32)、拥挤剂(例如,peg-35k)和atp。
[0279]
在通过本文任何方法描述的全长cdna的等温核酸扩增之后,可以从基底回收等温扩增的cdna(例如,单链或双链),并且任选地随后在微量离心管中用典型的cdna pcr进行
扩增。然后可以将样品用于本文所述的任何空间方法。
[0280]
免疫组织化学和免疫荧光
[0281]
在一些实施例中,免疫荧光或免疫组织化学方案(直接和间接染色技术)作为本文呈现的示例性空间工作流程的一部分或除本文呈现的示例性空间工作流程之外被执行。例如,可以根据本文所述的方法固定组织切片。可以将生物样品转移到阵列(例如,捕获探针阵列),其中使用免疫荧光方案探测分析物(例如,蛋白质)。例如,可以将样品再水合、阻断和透化(3xssc,2%bsa,0.1%triton x,1u/μl rnase抑制剂,在4℃下10分钟),然后用荧光一级抗体(在3xssc,2%bsa,0.1%triton x,1u/μl rnase抑制剂中以1:100的比例,在4℃下30分钟)染色。可以根据本文所述的分析物捕获或空间工作流程对生物样品进行洗涤、盖玻片(在甘油 1u/μl rnase抑制剂中)、成像(例如,使用共焦显微镜或其它能够机芯荧光检测的设备)、洗涤和处理。
[0282]
如本文所用,“抗原修复缓冲液”可以改善if/ihc方案中的抗体捕获。抗原修复的示例性方案可以是预热抗原修复缓冲液(例如,至95℃),将生物样品浸入加热的抗原修复缓冲液中预定时间,然后从抗原修复缓冲液中取出生物样品并洗涤生物样品。
[0283]
在一些实施例中,优化透化可用于鉴定细胞内分析物。透化优化可以包括选择透化剂、透化剂的浓度和透化持续时间。本文别处讨论了组织透化。
[0284]
在一些实施例中,在标记生物样品的制备中阻断阵列和/或生物样品降低了抗体与阵列和/或生物样品的非特异性结合(降低了背景)。一些实施例提供了可在施加标签之前和/或期间施加的阻断缓冲液/阻断溶液,其中阻断缓冲液可以包括阻断剂和任选地表面活性剂和/或盐溶液。在一些实施例中,阻断剂可以是牛血清白蛋白(bsa)、血清、明胶(例如,鱼明胶)、奶(例如,脱脂奶粉)、酪蛋白、聚乙二醇(peg)、聚乙烯醇(pva)或聚乙烯吡咯烷酮(pvp)、生物素阻断试剂、过氧化物酶阻断试剂、左旋咪唑、卡诺依氏溶液、甘氨酸、赖氨酸、硼氢化钠、滂胺天蓝、苏丹黑、台盼蓝、fitc阻断剂和/或乙酸。阻断缓冲液/阻断溶液可以在标记(例如,应用荧光团缀合的抗体)至生物样品之前和/或期间应用于阵列和/或生物样品。
[0285]
在一些实施例中,在结合空间阵列执行if/ihc协议时可以包括额外的步骤或优化。在执行本文讨论的空间标记的分析物捕获剂工作流程时,可以包括额外的步骤或优化。
[0286]
在一些实施例中,本文提供了用于从生物样品(例如,存在于生物样品(如组织切片)中的分析物)空间检测分析物(例如,检测分析物(例如,生物分析物)的位置)的方法,其包括:(a)在基底上提供生物样品;(b)对基底上的生物样品进行染色,对染色的生物样品进行成像,并选择生物样品或生物样品的一部分(例如,感兴趣区域)以进行分析;(c)在基底上提供包含一种或多种捕获探针的阵列;(d)使生物样品与阵列接触,从而允许一种或多种捕获探针中的捕获探针捕获感兴趣的分析物;以及(e)分析所捕获的分析物,从而在空间上检测感兴趣的分析物。可以根据本文所述的方法使用本文所述或本领域已知的任何种类的染色和成像技术。在一些实施例中,染色包括本文所述的光学标记,包括但不限于荧光、放射性、化学发光、量热或比色可检测标记。在一些实施例中,染色包括针对生物样品中的靶分析物(例如,细胞表面或细胞内蛋白质)的荧光抗体。在一些实施例中,染色包括针对生物样品中的靶分析物(例如,细胞表面或细胞内蛋白质)的免疫组织化学染色。在一些实施例中,染色包括化学染色,如苏木精和曙红(h&e)或高碘酸-希夫(pas)。在一些实施例中,在
对生物样品进行染色和/或成像与进行分析之间可能会经过相当长的时间(例如,几天、几个月或几年)。在一些实施例中,在阵列接触生物样品之前、同时或之后,将用于进行分析的试剂添加到生物样品中。在一些实施例中,步骤(d)包括将阵列置于生物样品上。在一些实施例中,该阵列是柔性阵列,其中多个空间条形码化特征(例如,具有捕获探针的基底、具有捕获探针的珠)附着于柔性基底。在一些实施例中,在阵列与生物样品接触之前,采取措施以减缓反应(例如,冷却生物样品的温度或使用在比其最佳功能温度更低或更高的温度下优先执行其主要功能的酶)。在一些实施例中,在不使生物样品与阵列脱离接触的情况下执行步骤(e)。在一些实施例中,在生物样品不再与阵列接触之后执行步骤(e)。在一些实施例中,在生物样品的染色和/或成像之前、同时或之后,用分析物捕获剂标记生物样品。在这种情况下,在染色和/或成像与进行分析之间可能会经过相当长的时间(例如,几天、几个月或几年)。在一些实施例中,阵列适于促进生物分析物从染色和/或成像的生物样品迁移到阵列上(例如,使用本文所述的任何材料或方法)。在一些实施例中,生物样品在与阵列接触之前被透化。在一些实施例中,在使生物样品与阵列接触之前减慢透化速率(例如,以限制分析物扩散离开其在生物样品中的原始位置)。在一些实施例中,调节透化速率(例如,调节透化试剂的活性)可以通过调节生物样品暴露于的条件(例如,调节温度、ph和/或光)来进行。在一些实施例中,调节透化速率包括使用外部刺激(例如,小分子、酶和/或活化试剂)来调节透化速率。例如,可以在与阵列接触之前向生物样品提供透化试剂,该透化试剂是无活性的,直到条件(例如,温度、ph和/或光)改变或提供外部刺激(例如,小分子、酶和/或活化试剂)。
[0287]
在一些实施例中,本文提供了用于从生物样品(例如,存在于如组织切片的生物样品中)空间检测分析物(例如,检测分析物(例如,生物分析物)的位置)的方法,其包括:(a)在基底上提供生物样品;(b)对基底上的生物样品进行染色,对染色的生物样品进行成像,并选择生物样品或生物样品的一部分(例如,感兴趣区域)以进行空间转录组分析;(c)在基底上提供包含一种或多种捕获探针的阵列;(d)使生物样品与阵列接触,从而允许一种或多种捕获探针中的捕获探针捕获感兴趣的生物分析物;以及(e)分析所捕获的生物分析物,从而在空间上检测感兴趣的生物分析物。
[0288]
(b)捕获探针
[0289]“捕获探针”在本文中也可以互换地称为“探针”,是指能够捕获(直接或间接)和/或标记样品中的分析物(例如,感兴趣的分析物)的任何分子。在一些实施例中,捕获探针是核酸或多肽。在一些实施例中,捕获探针是缀合物(例如,寡核苷酸-抗体缀合物)。在一些实施例中,捕获探针包括条形码(例如,空间条形码和/或唯一的分子标识符(umi))和捕获域。
[0290]
图6是示出了如本文所述的捕获探针的实例的示意图。如图所示,捕获探针602任选地通过切割域603(如二硫化物接头)与捕获点601偶联。
[0291]
捕获探针602可以包括用于后续处理的功能序列,如功能序列604,其可以包括测序仪特异性流动细胞附着序列,例如p5序列,以及功能序列606,其可以包括测序引物序列,例如r1引物结合位点、r2引物结合位点。在一些实施例中,序列604是p7序列,序列606是r2引物结合位点。
[0292]
空间条形码605可以包括在捕获探针内,用于条形码化靶分析物。可以选择与各种
不同测序系统相容的功能序列,例如454测序、离子激流质子或pgm、依诺米那测序仪器、pacbio、牛津纳米孔等及其要求。在一些实施例中,可以选择与未商业化的测序系统兼容的功能序列。可以使用合适的功能序列的这种测序系统和技术的实例包括(但不限于)离子激流质子或pgm测序、依诺米那测序、pacbio smrt测序和牛津纳米孔测序。此外,在一些实施例中,可以选择与其它测序系统(包括非商业化的测序系统)兼容的功能序列。
[0293]
在一些实施例中,空间条形码605、功能序列604(例如,流动细胞附着序列)和606(例如,测序引物序列)可以是附着于给定捕获点的所有探针所共有的。空间条形码还可以包括捕获域607,以便于捕获靶分析物。
[0294]
(i)捕获域
[0295]
如上所述,每个捕获探针包括至少一个捕获域607。“捕获域”是特异性结合所需分析物的寡核苷酸、多肽、小分子或其任何组合。在一些实施例中,捕获域可用于捕获或检测所需分析物。
[0296]
在一些实施例中,捕获域是被配置成与一种或多种分析物,如一种或多种不同类型的核酸(例如,rna分子和dna分子)相互作用的功能性核酸序列。在一些实施例中,功能性核酸序列可以包括n-mer序列(例如,随机n-mer序列),其被配置成与多个dna分子相互作用。在一些实施例中,功能序列可以包括聚(t)序列,该聚(t)序列被配置成通过mrna转录物的聚(a)尾与信使rna(mrna)分子相互作用。在一些实施例中,功能性核酸序列是蛋白质(例如,转录因子、dna结合蛋白或rna结合蛋白)的结合靶标,其中感兴趣的分析物是蛋白质。
[0297]
捕获探针可以包括核糖核苷酸和/或脱氧核糖核苷酸以及能够参与瓦特生-克里克型或类似碱基对相互作用的合成核苷酸残基。在一些实施例中,捕获域能够引发逆转录反应以生成与捕获的rna分子互补的cdna。在一些实施例中,捕获探针的捕获域可以引发dna延伸(聚合酶)反应以生成与捕获的dna分子互补的dna。在一些实施例中,捕获域可以模板化捕获的dna分子和直接或间接固定在基底上的表面探针之间的连接反应。在一些实施例中,捕获域可以与捕获的dna分子的一条链连接。例如,可以使用splintr连接酶连同rna或dna序列(例如,简并rna)将单链dna或rna连接到捕获域。在一些实施例中,具有rna模板连接酶活性的连接酶,例如splintr连接酶、t4 rna连接酶2或kod连接酶,可用于将单链dna或rna连接到捕获域。在一些实施例中,捕获域包括夹板寡核苷酸。在一些实施例中,捕获域捕获夹板寡核苷酸。
[0298]
在一些实施例中,捕获域位于捕获探针的3'端并且包括可以例如通过模板依赖性聚合延伸以形成如本文所述的延伸的捕获探针的游离3'端。在一些实施例中,捕获域包括能够与存在于与阵列接触的组织样品的细胞中的核酸(例如,rna或其它分析物)杂交的核苷酸序列。在一些实施例中,可以选择或设计捕获域以选择性或特异性结合靶核酸。例如,可以选择或设计捕获域以通过与mrna聚(a)尾杂交的方式捕获mrna。因此,在一些实施例中,捕获域包括聚(t)dna寡核苷酸,例如通过磷酸二酯键连接的一系列连续脱氧胸苷残基,其能够与mrna的聚(a)尾杂交。在一些实施例中,捕获域可以包括功能上或结构上类似于聚(t)尾的核苷酸。例如,聚-u寡核苷酸或包括脱氧胸苷类似物的寡核苷酸。在一些实施例中,捕获域包括至少10、11、12、13、14、15、16、17、18、19或20个核苷酸。在一些实施例中,捕获域包括至少25、30或35个核苷酸。
[0299]
在一些实施例中,捕获探针包括具有能够结合mrna和/或基因组dna的序列的捕获
域。例如,捕获探针可以包括捕获域,该捕获域包括能够结合mrna的聚(a)尾和/或存在于基因组dna中的聚(a)均聚序列的核酸序列(例如,聚(t)序列)。在一些实施例中,使用末端转移酶将均聚序列添加到mrna分子或基因组dna分子以产生具有聚(a)或聚(t)序列的分析物。例如,可以将聚(a)序列添加到分析物(例如,基因组dna的片段),从而使得分析物能够被聚(t)捕获域捕获。
[0300]
在一些实施例中,随机序列,例如随机六聚体或类似序列,可用于形成捕获域的全部或部分。例如,随机序列可以与聚(t)(或聚(t)类似物)序列结合使用。因此,当捕获域包括聚(t)(或“聚(t)样”)寡核苷酸时,它也可以包括随机寡核苷酸序列(例如,“聚(t)-随机序列”探针)。这可以例如位于聚(t)序列的5'或3',例如在捕获域的3'端。聚(t)-随机序列探针可以促进mrna聚(a)尾的捕获。在一些实施例中,捕获域可以是完全随机的序列。在一些实施例中,可以使用简并捕获域。
[0301]
在一些实施例中,两种或多种捕获探针的集合形成混合物,其中一种或多种捕获探针的捕获域包括聚(t)序列,一种或多种捕获探针的捕获域包括随机序列。在一些实施例中,两种或多种捕获探针的集合形成混合物,其中一种或多种捕获探针的捕获域包括聚(t)样序列,一种或多种捕获探针的捕获域包括随机序列。在一些实施例中,两种或多种捕获探针的集合形成混合物,其中一种或多种捕获探针的捕获域包括聚(t)-随机序列,一种或多种捕获探针的捕获域包括随机序列。在一些实施例中,具有简并捕获域的探针可以添加到本文列出的任何前述组合中。在一些实施例中,具有简并捕获域的探针可以取代本文所述的每一对中的探针之一。
[0302]
捕获域可以基于特定设计用于捕获的特定基因序列或特定基序序列或共同/保守序列(即序列特异性捕获域)。因此,在一些实施例中,捕获域能够选择性地结合所需的核酸亚型或亚组,例如特定类型的rna,如mrna、rrna、trna、srp rna、tmrna、snrna、snorna、smy rna、scarna、grna、rnase p、rnase mrp、terc、sl rna、arna、cis-nat、crrna、lncrna、mirna、pirna、sirna、shrna、tasirna、rasirna、7sk、erna、ncrna或其它类型的rna。在非限制性实例中,捕获域能够选择性地结合所需的核糖核酸亚组,例如,微生物组rna,如16s rrna。
[0303]
在一些实施例中,捕获域包括“锚”或“锚定序列”,其为经设计以确保捕获域与预期生物分析物杂交的核苷酸序列。在一些实施例中,锚定序列包括核苷酸序列,包括1-mer、2-mer、3-mer或更长的序列。在一些实施例中,短序列是随机的。例如,可以设计包括聚(t)序列的捕获域以捕获mrna。在这样的实施例中,锚定序列可以包括随机3-mer(例如,ggg),其有助于确保聚(t)捕获域与mrna杂交。在一些实施例中,锚定序列可以是vn、n或nn。替代地,可以使用特定的核苷酸序列设计序列。在一些实施例中,锚定序列在捕获域的3'端。在一些实施例中,锚定序列在捕获域的5'端。
[0304]
在一些实施例中,捕获探针的捕获域在使样品与阵列接触之前被阻断,并且当样品中的核酸在其捕获在阵列上之前被修饰时使用阻断探针。在一些实施例中,阻断探针用于阻断或修饰捕获域的游离3'端。在一些实施例中,阻断探针可以与捕获探针杂交以掩蔽捕获域的游离3'端,例如发夹探针、部分双链探针或互补序列。在一些实施例中,捕获域的游离3'端可以通过化学修饰阻断,例如添加叠氮甲基作为化学可逆的封端部分,使得捕获探针不包括游离3'端。在使样品与阵列接触之前,阻断或修饰捕获探针,特别是在捕获域的
游离3'端,防止捕获探针的修饰,例如,防止聚(a)尾添加到捕获探针的游离3'端。
[0305]
3'修饰的非限制性实例包括双脱氧c-3'(3'-ddc)、3'反向dt、3'c3间隔、3'氨基和3'磷酸化。在一些实施例中,可以修饰样品中的核酸,使得其可以被捕获域捕获。例如,可以将连接子序列(包括能够结合捕获探针的捕获域的结合域)添加到核酸(例如,片段化的基因组dna)的端部。在一些实施例中,这通过连接连接子序列或延伸核酸来实现。在一些实施例中,酶用于在核酸序列的端部掺入额外的核苷酸,例如,聚(a)尾。在一些实施例中,捕获探针可以被可逆地掩蔽或修饰,使得捕获探针的捕获域不包括游离3'端。在一些实施例中,3'端被去除、修饰或变得不可接近,使得捕获域对用于修饰样品的核酸的过程(例如,连接或延伸)不敏感。
[0306]
在一些实施例中,修饰捕获探针的捕获域以允许去除在修饰样品的核酸分子期间发生的捕获探针的任何修饰。在一些实施例中,捕获探针可以包括捕获域下游的额外序列,即捕获域的3',即阻断域。
[0307]
在一些实施例中,捕获探针的捕获域可以是非核酸域。不完全基于核酸的合适捕获域的实例包括但不限于蛋白质、肽、适配体、抗原、抗体和模拟本文所述的任何捕获域的功能性的分子类似物。
[0308]
(ii)切割域
[0309]
每个捕获探针可以任选地包括至少一个切割域。切割域代表用于可逆地将探针连接到阵列捕获点的探针部分,这将在下面进一步描述。此外,捕获探针的一个或多个区段或区域可以任选地通过切割域的切割从阵列捕获点释放。作为实例,空间条形码和/或通用分子标识符(umi)可以通过切割域的切割来释放。
[0310]
图7是绘示了可切割的捕获探针的示意图,其中切割的捕获探针可以进入非透化细胞并结合样品中的靶分析物。捕获探针602包含切割域603、细胞穿透肽703、报道分子704和二硫键(-s-s-)。705代表捕获探针的所有其它部分,例如空间条形码和捕获域。捕获探针1801包含切割域702、细胞穿透肽703、报道分子704和二硫键(-s-s-)。705代表捕获探针的所有其它部分,例如空间条形码和捕获域。
[0311]
在一些实施例中,将捕获探针连接到捕获点的切割域603是能够被酶切割的共价键。可以添加酶来切割切割域603,导致捕获探针从捕获点释放。作为另一个实例,加热也可以导致切割域的降解和附着的捕获探针从阵列捕获点的释放。在一些实施例中,激光辐射用于加热和降解在特定位置的捕获探针的切割域。在一些实施例中,切割域是光敏化学键(例如,当暴露于如紫外光的光时解离的化学键)。在一些实施例中,切割域可以是超声切割域。例如,超声切割可能取决于核苷酸序列、长度、ph、离子强度、温度和超声频率(例如,22khz、44khz)(grokhovsky,2006,《超声切割dna的特异性(specificity of dna cleavage by ultrasound)》,《分子生物学(molecular biology)》,40(2),276-283)。
[0312]
切割域603的其它实例包括不稳定的化学键,例如但不限于酯键(例如,可通过酸、碱或羟胺切割)、连位二醇键(例如,可通过高碘酸钠切割)、狄尔斯-阿尔德键(例如,可通过热切割)、砜键(例如,可通过碱切割)、甲硅烷基醚键(例如,可通过酸切割)、糖苷键(例如,可通过淀粉酶切割)、肽键(例如,可通过蛋白酶切割)或磷酸二酯键(例如,可通过核酸酶(例如,dnaase)切割)。
[0313]
在一些实施例中,切割域包括被一种或多种酶识别的序列,该酶能够切割核酸分
子,例如能够断裂两个或更多个核苷酸之间的磷酸二酯键。键可以通过如限制性酶(例如,限制性核酸内切酶)等其它核酸分子靶向酶切割。例如,切割域可以包括限制性核酸内切酶(限制性酶)识别序列。限制性酶在称为限制性位点的特异性识别核苷酸序列处切割双链或单链dna。在一些实施例中,稀有切割限制性酶,即具有长识别位点(长度至少8个碱基对)的酶,用于降低在捕获探针中其它地方切割的可能性。
[0314]
具有光敏化学键(例如,光可切割接头)的寡核苷酸具有各种优点。它们可以被有效且快速地裂解(例如,在纳秒和毫秒内)。在一些情况下,可以使用光掩模以使得仅阵列的特定区域暴露于可切割的刺激(例如,暴露于uv光、暴露于光、暴露于由激光诱导的热)。当使用光可切割接头时,可切割反应由光触发,并且对接头可以是高度选择性的,因此是双正交的。通常,光可切割接头的波长吸收位于光谱的近uv范围内。在一些实施例中,光可切割接头的λmax为约300nm至约400nm,或约310nm至约365nm。在一些实施例中,光可切割接头的λmax为约300nm、约312nm、约325nm、约330nm、约340nm、约345nm、约355nm、约365nm或约400nm。可用于切割域的光敏化学键的非限制性实例公开于题为《利用空间条形码寡核苷酸阵列对生物分析物进行分析》的pct公开202020176788a1中,其全部内容通过引用并入本文。
[0315]
在一些实施例中,切割域包括可以被尿嘧啶dna糖基化酶(udg)和dna糖基化酶-裂解酶核酸内切酶viii(商业上称为user
tm
酶)的混合物切割的聚-u序列。一旦释放,可释放的捕获探针可用于反应。因此,例如,可以通过从捕获点释放捕获探针来激活可激活的捕获探针。
[0316]
在一些实施例中,当捕获探针例如通过表面探针间接附着于基底时,切割域包括一个或多个错配核苷酸,使得表面探针和捕获探针的互补部分不是100%互补的(例如,错配碱基对的数目可以是一个、两个或三个碱基对)。这种错配被例如muty和t7核酸内切酶i识别,其导致核酸分子在错配位置的切割。如本文所述,“表面探针”可以是存在于基底表面上的能够附着于试剂(例如,捕获探针)的任何部分。在一些实施例中,表面探针是寡核苷酸。在一些实施例中,表面探针是捕获探针的一部分。
[0317]
在一些实施例中,当捕获探针例如通过表面探针间接(例如,固定)附着于捕获位点时,切割域包括切口酶识别位点或序列。切口酶是仅切割dna双链体的单链的核酸内切酶。因此,切割域可以包括靠近表面探针的5'端(和/或捕获探针的5'端)的切口酶识别位点,使得表面探针或捕获探针的切割使表面探针和捕获探针之间的双链体不稳定,从而从捕获点释放捕获探针。
[0318]
切口酶也可用于其中捕获探针直接附着(例如,固定)于捕获点的一些实施例中。例如,基底可以与核酸分子接触,该核酸分子与捕获探针的切割域杂交以提供或重建切口酶识别位点,例如切割辅助探针。因此,与切口酶接触将导致切割域的切割,从而从捕获点释放捕获探针。这种切割辅助探针也可用于为其它切割酶(例如,限制性酶)提供或重建切割识别位点。
[0319]
一些切口酶通过结合并识别特定的核苷酸识别序列,仅在dna分子的特定位点引入单链切口。已经发现了许多天然存在的切口酶,目前已经确定了其中至少四种的序列识别特性。在美国专利第6,867,028号中描述了切口酶,其通过引用整体并入本文。通常,任何合适的切口酶可用于结合切割域的互补切口酶识别位点。在使用后,可以将切口酶从测定
中去除或在释放捕获探针后使其灭活以防止捕获探针的不必要的切割。
[0320]
在一些实施例中,捕获探针不存在切割域。例如在macosko等人,2015《细胞(cell)》161,1202-1214中描述了具有缺乏切割域的附着的捕获探针的基底的实例,其全部内容通过引用并入本文。
[0321]
不完全基于核酸的合适捕获域的实例包括但不限于蛋白质、肽、适配体、抗原、抗体和模拟本文所述的任何捕获域的功能性的分子类似物。
[0322]
在一些实施例中,对应于切割域的捕获探针区域可用于一些其它功能。例如,可以包括用于核酸延伸或扩增的额外区域,其中切割域通常位于该区域。在这样的实施例中,该区域可以补充功能域或者甚至作为额外的功能域存在。在一些实施例中,存在切割域,但其用途是任选的。
[0323]
(iii)功能域
[0324]
每个捕获探针可以任选地包括至少一个功能域。每个功能域通常包括用于整个分析过程中的下游分析步骤的功能性核苷酸序列。
[0325]
可以与本公开结合使用的功能域的更多细节描述于2020年8月13日提交的题为《用于使用单元型的空间分布来确定生物学状况的系统和方法》的美国专利申请第16/992,569号,以及题为《利用空间条形码寡核苷酸阵列对生物分析物进行分析(profiling of biological analyes with spatially barcoded oligonucleotide arrays)》的pct公开202020176788a1,其各自通过引用并入本文。
[0326]
(iv)空间条形码
[0327]
如上所述,捕获探针可以包括一个或多个空间条形码(例如,两个或更多个、三个或更多个、四个或更多个、五个或更多个)。“空间条形码”是用作传递或能够传递空间信息的标记或标识符的连续核酸区段或两个或更多个非连续核酸区段。在一些实施例中,捕获探针包括具有空间特征的空间条形码,其中条形码与阵列内的特定位置或基底上的特定位置缔合。
[0328]
空间条形码可以是分析物的一部分,或独立于分析物(例如,捕获探针的一部分)。除了分析物的内源特征(例如,分析物的大小或端序列)之外,空间条形码可以是附着于分析物(例如,核酸分子)的标签或标签的组合。空间条形码可以是唯一的。在一些实施例中,在空间条形码是唯一的情况下,空间条形码既作为空间条形码又作为与一种特定捕获探针缔合的唯一分子标识符(umi)。
[0329]
空间条形码可以具有多种不同的格式。例如,空间条形码可以包括多核苷酸空间条形码;随机核酸和/或氨基酸序列;以及合成的核酸和/或氨基酸序列。在一些实施例中,空间条形码以可逆或不可逆的方式附着于分析物。在一些实施例中,在样品测序之前、期间和/或之后,将空间条形码添加到例如dna或rna样品的片段中。在一些实施例中,空间条形码允许对单个测序读数进行标识和/或定量。在一些实施例中,空间条形码用作荧光条形码,荧光标记的寡核苷酸探针与空间条形码杂交。
[0330]
在一些实施例中,空间条形码是基本上不与样品中的分析物核酸分子杂交的核酸序列。在一些实施例中,空间条形码在样品中核酸分子的大部分(例如,80%或更多)上与核酸序列具有小于80%的序列同一性(例如,小于70%、60%、50%或小于40%的序列同一性)。
[0331]
空间条形码序列可以在捕获探针的序列内包括约6至约20个或更多个核苷酸。在一些实施例中,空间条形码序列的长度可以是约6、7、8、9、10、11、12、13、14、15、16、17、18、19、20个核苷酸或更长。在一些实施例中,空间条形码序列的长度可以是至少约6、7、8、9、10、11、12、13、14、15、16、17、18、19、20个核苷酸或更长。在一些实施方案中,空间条形码序列的长度为至多约6、7、8、9、10、11、12、13、14、15、16、17、18、19、20个核苷酸或更短。
[0332]
这些核苷酸可以是完全连续的,即在一段相邻的核苷酸中,或者它们可以被分成由1个或多个核苷酸分开的两个或多个分开的子序列。分离的空间条形码子序列长度可以为约4至约16个核苷酸。在一些实施例中,空间条形码子序列可以是约4、5、6、7、8、9、10、11、12、13、14、15、16个核苷酸或更长。在一些实施例中,空间条形码子序列可以是至少约4、5、6、7、8、9、10、11、12、13、14、15、16个核苷酸或更长。在一些实施例中,空间条形码子序列可以是至多约4、5、6、7、8、9、10、11、12、13、14、15、16个核苷酸或更短。
[0333]
对于附着于共同阵列捕获点的多个捕获探针,多个捕获探针的一个或多个空间条形码序列可以包括对于偶联于捕获点的所有捕获探针相同的序列,和/或对于偶联于捕获点的所有捕获探针不同的序列。
[0334]
图8是示例性多路复用的空间标记的捕获点的示意图。在图8中,捕获点601可以偶联到空间条形码捕获探针,其中特定捕获点的空间条形码探针可以具有相同的空间条形码,但是具有不同的捕获域,其被设计为将捕获点的空间条形码与多于一种靶分析物缔合。例如,捕获点可以偶联到四种不同类型的空间条形码捕获探针,每种类型的空间条形码捕获探针具有空间条形码605。与捕获点缔合的一种类型的捕获探针包括与聚(t)捕获域803结合的空间条形码605,其被设计用于捕获mrna靶分析物。与捕获点缔合的第二种类型的捕获探针包括与用于gdna分析的随机n-mer捕获域804结合的空间条形码605。与捕获点缔合的第三种类型的捕获探针包括与分析物捕获剂805上的捕获域互补的捕获域结合的空间条形码605。与捕获点缔合的第四种类型的捕获探针包括与捕获探针结合的空间条形码605,该捕获探针可特异性结合可以在crispr测定(例如,crispr/cas9)中起作用的核酸分子806。虽然在图8中仅示出了四种不同的捕获探针条形码构造,但是捕获探针条形码构造可以被定制用于分析与核酸缔合并且能够与这种构造结合的任何给定分析物。例如,图8所示的方案也可用于本文公开的其它分析物的并行分析,包括但不限于:(a)mrna、谱系示踪构造、细胞表面或细胞内蛋白质和代谢物,以及gdna;(b)mrna、可及染色质(例如,atac-seq、dnase-seq和/或mnase-seq)细胞表面或细胞内蛋白质和代谢物,以及干扰剂(例如,crispr crrna/sgrna、talen、锌指核酸酶和/或如本文所述的反义寡核苷酸);(c)mrna、细胞表面或细胞内蛋白质和/或代谢物、条形码标记剂(例如,本文所述的mhc多聚体)和免疫细胞受体(例如,t细胞受体)的v(d)j序列。在一些实施例中,干扰剂可以是小分子、抗体、药物、适配体、mirna、物理环境(例如,温度变化)或任何其它已知的干扰剂。
[0335]
附着于单个阵列捕获点的捕获探针可以包括相同(或共同)的空间条形码序列、不同的空间条形码序列或两者的组合。附着于捕获点的捕获探针可以包括多组捕获探针。给定组的捕获探针可以包括相同的空间条形码序列。相同的空间条形码序列可以不同于另一组捕获探针的空间条形码序列。
[0336]
多个捕获探针可以包括与空间阵列上的特定位置缔合的空间条形码序列(例如,核酸条形码序列)。例如,基于第一区域内捕获探针共有的空间条形码序列,第一多个捕获
探针可以与第一区域相关联,并且基于第二区域内捕获探针共有的空间条形码序列,第二多个捕获探针可以与第二区域相关联。第二区域可以与第一区域相关联,也可以不与第一区域相关联。额外的多个捕获探针可以与其它区域内捕获探针共有的空间条形码序列缔合。在一些实施例中,空间条形码序列在多个捕获探针分子上可以是相同的。
[0337]
在一些实施例中,多个不同的空间条形码被结合到单个阵列捕获探针中。例如,混合但已知的一组空间条形码序列可以通过提供位置身份的重复或独立确认来提供空间条形码对给定点或位置的更强的地址或归属。在一些实施例中,多个空间条形码表示特定阵列点位置的增加的特异性。
[0338]
(v)唯一分子标识符
[0339]
捕获探针可以包括一个或多个(例如,两个或更多个、三个或更多个、四个或更多个、五个或更多个)唯一分子标识符(umi)。唯一分子标识符是连续的核酸区段或两个或更多个非连续的核酸区段,其用作特定分析物或结合特定分析物(例如,通过捕获域)的捕获探针的标记或标识符。
[0340]
可以与本公开的系统和方法一起使用的umi的进一步细节描述于2020年8月13日提交的题为《用于使用单元型的空间分布来确定生物学状况的系统和方法》的美国专利申请第16/992,569号和题为《利用空间条形码寡核苷酸阵列对生物分析物进行分析》的pct公开202020176788a1,其各自通过引用并入本文。
[0341]
(vi)捕获探针的其它方面。
[0342]
对于附着于阵列捕获点的捕获探针,单个阵列捕获点可以包括一个或多个捕获探针。在一些实施例中,单个阵列捕获点包括数百或数千个捕获探针。在一些实施例中,捕获探针与特定的单个捕获点缔合,其中单个捕获点包含捕获探针,该捕获探针包括对阵列上的限定区域或位置唯一空间条形码。
[0343]
在一些实施例中,特定捕获点包含包括多于一个空间条形码的捕获探针(例如,在特定捕获点处的一个捕获探针可以包括与在同一特定捕获点处的另一捕获探针中包括的空间条形码不同的空间条形码,而两个捕获探针都包括第二共同的空间条形码),其中每个空间条形码对应于阵列上特定的限定区域或位置。例如,与阵列上的一个特定捕获点缔合的多个空间条形码序列可以通过提供位置的重复或独立确认来提供给定位置的更强的地址或属性。在一些实施例中,多个空间条形码表示特定阵列点位置的增加的特异性。在一个非限制性实例中,可以用两个不同的空间条形码对特定的阵列点进行编码,其中每个空间条形码标识该阵列内特定的限定区域,并且具有这两个空间条形码的阵列点标识其中两个限定区域重叠的子区域,例如维恩图的重叠部分。
[0344]
在另一个非限制性实例中,可以用三种不同的空间条形码对特定的阵列点进行编码,其中第一空间条形码标识该阵列内的第一区域,第二空间条形码标识第二区域,其中第二区域是完全在第一区域内的子区域,并且第三空间条形码标识第三区域,其中第三区域是完全在第一子区域和第二子区域内的子区域。
[0345]
在一些实施例中,附着于阵列捕获点的捕获探针从阵列捕获点释放以进行测序。替代地,在一些实施例中,捕获探针保持附着于阵列捕获点,并且探针在保持附着于阵列捕获点的同时被测序(例如,通过原位测序)。捕获探针测序的其它方面在本公开的后续章节中描述。
[0346]
在一些实施例中,阵列捕获点可以包括附着于捕获点的不同类型的捕获探针。例如,阵列捕获点可以包括第一种类型的捕获探针和第二种类型的捕获探针,第一种类型的捕获探针具有设计成结合一种类型的分析物的捕获域,第二种类型的捕获探针具有设计成结合第二种类型的分析物的捕获域。通常,阵列捕获点可以包括附着于单个阵列捕获点的一种或多种(例如,两种或更多种、三种或更多种、四种或更多种、五种或更多种、六种或更多种、八种或更多种、十种或更多种、12种或更多种、15种或更多种、20种或更多种、30种或更多种、50种或更多种)不同类型的捕获探针。
[0347]
在一些实施例中,捕获探针是核酸。在一些实施例中,捕获探针通过其5'端附着于阵列捕获点。在一些实施例中,捕获探针从5'至3'端包括:一个或多个条形码(例如,空间条形码和/或umi)和一个或多个捕获域。在一些实施例中,捕获探针从5'至3'端包括:一个条形码(例如,空间条形码或umi)和一个捕获域。在一些实施例中,捕获探针从5'至3'端包括:切割域、功能域、一个或多个条形码(例如,空间条形码和/或umi),以及捕获域。在一些实施例中,捕获探针从5'至3'端包括:切割域、功能域、一个或多个条形码(例如,空间条形码和/或umi)、第二功能域和捕获域。在一些实施例中,捕获探针从5'至3'端包括:切割域、功能域、空间条形码、umi和捕获域。在一些实施例中,捕获探针不包括空间条形码。在一些实施例中,捕获探针不包括umi。在一些实施例中,捕获探针包括用于引发测序反应的序列。
[0348]
在一些实施例中,捕获探针通过其3'端固定在捕获点上。在一些实施例中,捕获探针从3'至5'端包括:一个或多个条形码(例如,空间条形码和/或umi)和一个或多个捕获域。在一些实施例中,捕获探针从3'至5'端包括:一个条形码(例如,空间条形码或umi)和一个捕获域。在一些实施例中,捕获探针从3'至5'端包括:切割域、功能域、一个或多个条形码(例如,空间条形码和/或umi),以及捕获域。在一些实施例中,捕获探针从3'至5'端包括:切割域、功能域、空间条形码、umi和捕获域。
[0349]
在一些实施例中,捕获探针包括原位合成的寡核苷酸。原位合成的寡核苷酸可以附着于基底,或附着于基底上的特征。在一些实施例中,原位合成的寡核苷酸包括一个或多个恒定序列,其中一个或多个用作引发序列(例如,用于扩增靶核酸的引物)。原位合成的寡核苷酸可以例如在3'端包括恒定序列,该恒定序列附着于基底或附着于基底上的特征。附加地或替代地,原位合成的寡核苷酸可以在游离5'端包括恒定序列。在一些实施例中,一个或多个恒定序列可以是可切割的序列。在一些实施例中,原位合成的寡核苷酸包括条形码序列,例如可变条形码序列。条形码可以是本文所述的任何条形码。条形码的长度可以是大约8至16个核苷酸(例如,8、9、10、11、12、13、14、15或16个核苷酸)。原位合成的寡核苷酸的长度可以小于100个核苷酸(例如,小于90、80、75、70、60、50、45、40、35、30、25或20个核苷酸)。在一些情况下,原位合成的寡核苷酸的长度为约20至约40个核苷酸。示例性的原位合成的寡核苷酸由美国昂飞公司(affymetrix)生产。在一些实施例中,原位合成的寡核苷酸附着于阵列的捕获点。
[0350]
额外的寡核苷酸可以与原位合成的寡核苷酸连接以生成捕获探针。例如,与原位合成的寡核苷酸的一部分(例如,寡核苷酸中的恒定序列)互补的引物可用于杂交额外的寡核苷酸并延伸(使用原位合成的寡核苷酸作为模板,例如,引物延伸反应)以形成双链寡核苷酸并进一步产生3'突出端。在一些实施例中,3'突出端可以通过模板非依赖性连接酶(例如,末端脱氧核苷酸转移酶(tdt)或聚(a)聚合酶)产生。可以使用合适的酶(例如,连接酶)
和夹板寡核苷酸将包含一个或多个捕获域的额外的寡核苷酸连接到3'突出端,以生成捕获探针。因此,在一些实施例中,捕获探针是连接在一起的两个或更多个寡核苷酸序列(例如,原位合成的寡核苷酸和额外的寡核苷酸)的产物。在一些实施例中,寡核苷酸序列之一是原位合成的寡核苷酸。
[0351]
在一些实施例中,捕获探针包括夹板寡核苷酸。可以使用夹板寡核苷酸和本领域已知或本文描述的任何种类的连接酶(例如,splintr连接酶)将两种或更多种寡核苷酸连接在一起。
[0352]
在一些实施例中,寡核苷酸之一包括:恒定序列(例如,与夹板寡核苷酸的一部分互补的序列)、简并序列和捕获域(例如,如本文所述)。在一些实施例中,通过使酶在寡核苷酸序列的端部添加多核苷酸来生成捕获探针。捕获探针可以包括简并序列,其可用作唯一分子标识符。
[0353]
捕获探针可以包括简并序列,其是核苷酸序列的一些位置包含许多可能碱基的序列。简并序列可以是包括约或至少5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、25、30、35、40、45或50个核苷酸的简并核苷酸序列。在一些实施例中,核苷酸序列在核苷酸序列内包含1、2、3、4、5、6、7、8、9、0、10、15、20、25或更多个简并位置。在一些实施例中,简并序列用作umi。
[0354]
在一些实施例中,捕获探针包括限制性核酸内切酶识别序列或可通过特异性酶活性切割的核苷酸序列。例如,可以使用尿嘧啶dna糖基化酶(udg)或尿嘧啶特异性切除试剂(user)从核苷酸序列酶促切割尿嘧啶序列。作为另一个实例,其它修饰的碱基(例如,通过甲基化修饰的)可以被特异性核酸内切酶识别和切割。可以对捕获探针进行酶促切割,其去除阻断域和在修饰过程期间添加到捕获探针3'端的任何额外核苷酸。阻断域的去除揭示和/或恢复捕获探针的捕获域的游离3'端。在一些实施例中,可以去除额外的核苷酸以揭示和/或恢复捕获探针的捕获域的3'端。
[0355]
在一些实施例中,阻断域可以在其合成时或合成后掺入到捕获探针中。捕获域的末端核苷酸是可逆终止子核苷酸(例如,3'-o-阻断的可逆终止子和3'-未阻断的可逆终止子),并且可以在探针合成期间或之后包括在捕获探针中。
[0356]
(vii)延伸捕获探针
[0357]“延伸捕获探针”是具有扩大的核酸序列的捕获探针。例如,在捕获探针包括核酸的情况下,“延伸的3'端”表示将额外的核苷酸添加到捕获探针的最3'核苷酸以延伸捕获探针的长度,例如,通过用于延伸核酸分子的标准聚合反应,包括由聚合酶(例如,dna聚合酶或逆转录酶)催化的模板聚合。
[0358]
在一些实施例中,延伸捕获探针包括从捕获的(杂交的)rna生成cdna。该方法包括杂交核酸的互补链的合成,例如基于捕获的rna模板(与捕获探针的捕获域杂交的rna)生成cdna。因此,在延伸捕获探针的初始步骤,例如cdna生成中,捕获的(杂交的)核酸,例如rna,作为延伸(例如,逆转录)步骤的模板。
[0359]
在一些实施例中,使用逆转录延伸捕获探针。例如,逆转录包括使用逆转录酶从rna(例如,信使rna)合成cdna(互补或拷贝dna)。在一些实施例中,当组织仍在原位时进行逆转录,生成分析物文库,其中分析物文库包括来自相邻捕获探针的空间条形码。在一些实施例中,使用一种或多种dna聚合酶延伸捕获探针。
[0360]
在一些实施例中,捕获探针的捕获域包括用于产生与捕获探针杂交的核酸的互补链的引物,例如用于dna聚合酶和/或逆转录的引物。通过延伸反应生成的核酸(例如,dna和/或cdna分子)掺入捕获探针的序列。捕获探针的延伸,例如dna聚合酶和/或逆转录反应,可以使用多种合适的酶和方案进行。
[0361]
在一些实施例中,生成全长dna,例如cdna分子。在一些实施例中,“全长”dna分子指整个捕获的核酸分子。然而,如果核酸(例如,rna)在组织样品中被部分降解,则捕获的核酸分子将与组织样品中的初始rna长度不同。在一些实施例中,修饰延伸探针的3'端,例如第一链cdna分子。例如,可以将接头或连接子连接到延伸探针的3'端。这可以使用单链连接酶(如t4 rna连接酶或circligase
tm
(购自威斯康星州米德尔顿的lucigen公司(lucigen,middleton,wi)))来实现。在一些实施例中,模板转换寡核苷酸用于延伸cdna以生成全长cdna(或尽可能接近全长cdna)。在一些实施例中,可以使用双链连接酶(如t4 dna连接酶)将第二链合成辅助探针(能够与延伸捕获探针的3'端杂交的部分双链dna分子)连接到延伸探针的3'端,例如第一链cdna分子。适合于连接步骤的其它酶是本领域已知的,包括例如tth dna连接酶、taq dna连接酶、嗜热古菌(thermococcus sp.)(菌株9
°
n)dna连接酶(9
°ntm dna连接酶,新英格兰生物实验室(new england biolabs))、ampligase
tm
(购自威斯康星州米德尔顿的lucigen公司)和splintr(购自马萨诸塞州伊普斯维奇的新英格兰生物实验室(new england biolabs,ipswich,ma))。在一些实施例中,多核苷酸延伸的探针分子的3'端掺入多核苷酸尾,例如聚(a)尾。在一些实施例中,使用末端转移酶活性酶掺入多核苷酸尾。
[0362]
在一些实施例中,在扩增和/或分析,例如序列分析之前,处理双链延伸的捕获探针以去除任何未延伸的捕获探针。这可以通过多种方法实现,例如使用酶降解未延伸的探针,如核酸外切酶,或纯化柱。
[0363]
在一些实施例中,扩增延伸的捕获探针以产生足以用于例如通过dna测序进行分析的量。在一些实施例中,延伸的捕获探针的第一链(例如,dna和/或cdna分子)用作扩增反应(例如,聚合酶链反应)的模板。
[0364]
在一些实施例中,扩增反应使用包括亲和基团的引物将亲和基团掺入延伸捕获探针(例如,rna-cdna杂合体)上。在一些实施例中,引物包括亲和基团,并且延伸捕获探针包括亲和基团。亲和基团可以对应于前述任何亲和基团。
[0365]
在一些实施例中,包括亲和基团的延伸捕获探针可以偶联到亲和基团特异性的阵列特征。在一些实施例中,基底可以包括抗体或抗体片段。在一些实施例中,阵列特征包括抗生物素蛋白或链霉抗生物素蛋白,并且亲和基团包括生物素。在一些实施例中,阵列特征包括麦芽糖并且亲和基团包括麦芽糖结合蛋白。在一些实施例中,阵列特征包括麦芽糖结合蛋白并且亲和基团包括麦芽糖。在一些实施例中,扩增延伸捕获探针可用于从阵列特征释放延伸的探针,只要延伸的探针的拷贝不附着于阵列特征。
[0366]
在一些实施例中,从阵列特征释放延伸的捕获探针或其互补物或扩增子。从阵列特征释放延伸捕获探针或其互补物或扩增子的步骤可以以多种方式实现。在一些实施例中,通过核酸切割和/或变性(例如,通过加热使双链分子变性)从特征释放延伸捕获探针或其互补物。
[0367]
在一些实施例中,通过物理方法从阵列特征释放延伸捕获探针或其互补物或扩增子。例如,用于诱导物理释放的方法包括变性双链核酸分子。用于释放延伸捕获探针的另一
种方法是使用干扰双链分子的氢键的溶液。在一些实施例中,通过施加至少85℃,例如至少90℃、91℃、92℃、93℃、94℃、95℃、96℃、97℃、98℃或99℃的热水(如水或缓冲液)来释放延伸捕获探针。在一些实施例中,添加包括盐、表面活性剂等的溶液以从阵列特征释放延伸捕获探针,该溶液可以进一步使核酸分子之间的相互作用不稳定。在一些实施例中,甲酰胺溶液可用于使核酸分子之间的相互作用不稳定以从阵列特征释放延伸捕获探针。
[0368]
(viii)捕获探针的扩增
[0369]
在一些实施例中,本文提供了用于扩增附着于空间阵列的捕获探针的方法,其中捕获探针的扩增增加了空间阵列上的捕获域和空间条形码的数目。在一些实施例中,在扩增捕获探针的情况下,通过滚环扩增进行扩增。在一些实施例中,待扩增的捕获探针包括能够进行滚环扩增的序列(例如,对接序列、功能序列和/或引物序列)。在一个实例中,捕获探针可以包括能够结合用于扩增的引物的功能序列。在另一实例中,捕获探针可以包括可以与用于滚环扩增的一个或多个寡核苷酸(例如,挂锁探针)杂交的一个或多个对接序列(例如,第一对接序列和第二对接序列)。在一些实施例中,将额外的探针固定到基底,其中额外的探针包括能够进行滚环扩增的序列(例如,对接序列、功能序列和/或引物序列)。在一些实施例中,空间阵列与寡核苷酸(例如,挂锁探针)接触。如本文所用,“挂锁探针”是指在其5'和3'端具有与捕获探针上的相邻或附近靶序列(例如,对接序列)互补的序列的寡核苷酸。在与靶序列(例如,对接序列)杂交后,使挂锁探针的两个端部接触或使端部延伸直到两个端部接触,从而允许通过连接(例如,使用本文所述的任何方法的连接)使挂锁探针环化。在一些实施例中,寡核苷酸环化后,滚环扩增可用于扩增连接产物,其至少包括捕获域和来自捕获探针的空间条形码。在一些实施例中,使用挂锁寡核苷酸和滚环扩增扩增捕获探针增加了空间阵列上的捕获域的数目和空间条形码的数目。
[0370]
在一些实施例中,一种提高空间阵列的捕获效率的方法,包括放大固定到基底的捕获探针的全部或部分。例如,通过增加捕获域和空间条形码的数目,扩增固定到基底的捕获探针的全部或部分可以增加空间阵列的捕获效率。在一些实施例中,一种确定分析物在生物样品中的位置的方法包括使用具有增加的捕获效率的空间阵列(例如,其中捕获探针已经如本文所述被扩增的空间阵列)。例如,可以通过在与生物样品接触之前扩增捕获探针的全部或部分来提高空间阵列的捕获效率。与其中捕获探针在接触生物样品之前未被扩增的空间阵列相比,扩增导致捕获域的数目增加,从而能够捕获更多的分析物。在一些实施例中,一种产生具有增加的捕获效率的空间阵列的方法包括扩增捕获探针的全部或部分。在一些实施例中,在通过扩增捕获探针的全部或部分产生具有增加的捕获效率的空间阵列的情况下,扩增增加了空间阵列上捕获域的数目和空间条形码的数目。在一些实施例中,一种确定捕获探针(例如,特征上的捕获探针)在空间阵列上的位置的方法包括扩增捕获探针的全部或部分。例如,扩增固定到基底的捕获探针可以增加用于直接解码(例如,使用本文所述的任何方法直接解码,包括但不限于原位测序)捕获探针的位置的空间条形码的数目。
[0371]
(ix)分析物捕获剂
[0372]
本公开还提供了使用分析物捕获剂对生物分析物(例如,mrna、基因组dna、可及染色质和细胞表面或细胞内蛋白质和/或代谢物)进行空间分析的方法和材料。如本文所用,“分析物捕获剂”(之前有时也称为“细胞标记”剂)是指与分析物(例如,样品中的分析物)和捕获探针(例如,附着于基底的捕获探针)相互作用以标识分析物的试剂。在一些实施例中,
7、cea(m)、cea(p)、嗜铬粒蛋白a、糜蛋白酶、ck-5、ck-5/6、ck-7、ck-7/ttf-1、ck-14、ck-17、ck-18、ck-19、ck-20、ck-hmw、ck-lmw、cmv-ih、coll-iv、cox-2、d2-40、dba44、肌间线蛋白、dog1、eber-ish、ebv(lmp1)、e-钙粘着蛋白、egfr、ema、er、ercc1、因子viii(vwf)、因子xiiia、肌成束蛋白、fli-1、fhs、半乳糖蛋白-3、胃泌激素、gcdfp-15、gfap、胰高血糖素、血型糖蛋白a、磷脂酰肌醇聚糖-3、粒酶b、生长激素(gh)、gst、ham 56、hmbe-1、hbp、hcag、hcg、血红蛋白a、hep b core(hbcag)、hep b surf(hbsag)、heppar1、her2、herpes i、herpes ii、hhv-8、hla-dr、hmb 45、hpl、hpv-ihc、hpv(6/11)-ish、hpv(16/18)-ish、hpv(31/33)-ish、hpv wss-ish、hpv高-ish、hpv低-ish、hpv高&低-ish、iga、igd、igg、igg4、igm、抑制素、胰岛素、jc病毒-ish、kappa-ish、ker pan、ki-67、λ-ihc、λ-ish、lh、脂肪酶、溶菌酶(mura)、乳腺珠蛋白、mart-1、mbp、m-细胞胰蛋白酶、mel-5、melan-a、melan-a/ki-67、间皮素、mitf、mlh-1、moc-31、mpo、msh-2、msh-6、muc1、muc2、muc4、muc5ac、mum-1、myo d1、肌细胞生成素、肌红蛋白、myoin重链、新天冬氨酸蛋白酶a、nb84a、new-n、nf、nk1-c3、npm、nse、oct-2、oct-3/4、oscar、p16、p21、p27/kip1、p53、p57、p63、p120、p504s、泛黑色素瘤、panc.poly、细小病毒b19、pax-2、pax-5、pax-5/cd43、pax=5/cd5、pax-8、pc、pd1、穿孔素、pgp 9.5、plap、pms-2、pr、催乳素、psa、psap、psma、pten、pth、pts、rb、rcc、s6、s100、血清素、生长抑素、表面活性剂(sp-a)、突触泡蛋白、突触核蛋白、tau、tcl-1、tcrβ、tdt、凝血调节蛋白、甲状腺球蛋白、tia-1、toxo、trap、triview
tm
乳腺、triview
tm
前列腺、胰蛋白酶、ts、tsh、ttf-1、酪氨酸酶、泛应素、uroplakin、vegf、绒毛蛋白、波形蛋白(vim)、vip、vzv、wt1(m)n-末端、wt1(p)c-末端和zap-70。
[0377]
此外,可用作分析物捕获剂4002中的分析物结合部分4004或可用于本文公开的应用中的示例性非限制性抗体包括以下抗体(及其变体)中的任一种:细胞表面蛋白、细胞内蛋白、激酶(例如,agc激酶家族,如akt1、akt2、pdk1、蛋白激酶c、rock1、rock2、sgk3)、camk激酶家族(例如,ampk1、ampk2、camk、chk1、chk2、zip)、ck1激酶家族、tk激酶家族(例如,abl2、axl、cd167、cd246/alk、c-met、csk、c-src、egfr、erbb2(her2/neu)、erbb3、erbb4、fak、fyn、lck、lyn、pkt7、syk、zap70)、ste激酶家族(例如,ask1、mapk、mek1、mek2、mek3、mek4、mek5、pak1、pak2、pak4、pak6)、cmgc激酶家族(例如,cdk2、cdk4、cdk5、cdk6、cdk7、cdk9、erk1、gsk3、jnk/mapk8、jnk2/mapk9、jnk3/mapk10、p38/mapk)和tkl激酶家族(例如,alk1、ilk1、irak1、irak2、irak3、irak4、limk1、limk2、m3k11、raf1、rip1、rip3、vegfr1、vegfr2、vegfr3)、极光激酶a、极光激酶b、ikk、nemo样激酶、pink、plk3、ulk2、wee1、转录因子(例如,foxp3、atf3、bach1、egr、elf3、foxa1、foxa2、fox01、gata)、生长因子受体和肿瘤抑制剂(例如,抗p53、抗blm、抗cdk2、抗chk2、抗brca-1、抗nbs1、抗brca-2、抗wrn、抗pten、抗wt1、抗p38)。
[0378]
在一些实施例中,分析物捕获剂4002能够结合细胞内存在的分析物4006。在一些实施例中,分析物捕获剂能够结合细胞表面分析物,其可以包括但不限于受体、抗原、表面蛋白、跨膜蛋白、分化蛋白簇、蛋白通道、蛋白泵、载体蛋白、磷脂、糖蛋白、糖脂、细胞-细胞相互作用蛋白复合物、抗原呈递复合物、主要组织相容性复合物、工程化t细胞受体、t细胞受体、b细胞受体、嵌合抗原受体、细胞外基质蛋白、细胞表面蛋白的翻译后修饰(例如,磷酸化、糖基化、泛素化、亚硝基化、甲基化、乙酰化或脂化)状态、间隙连接和粘附连接。在一些实施例中,分析物捕获剂4002能够结合翻译后修饰的细胞表面分析物。在此类实施例中,分
析物捕获剂可以基于给定的翻译后修饰状态(例如,磷酸化、糖基化、泛素化、亚硝基化、甲基化、乙酰化或脂化)对细胞表面分析物具有特异性,使得细胞表面分析物图谱可以包括一种或多种分析物的翻译后修饰信息。
[0379]
在一些实施例中,分析物捕获剂4002包括与分析物结合部分缀合或以其它方式附着于分析物结合部分的捕获剂条形码域4008。在一些实施例中,捕获剂条形码域4008与分析物结合部分4004共价连接。在一些实施例中,捕获剂条形码域4008是核酸序列。在一些实施例中,捕获剂条形码域4008包括分析物结合部分条形码和分析物捕获序列4114,或与其共价结合。
[0380]
如本文所用,术语“分析物结合部分条形码”是指与分析物结合部分4004相关联或以其它方式对其进行标识的条形码。在一些实施例中,通过标识分析物结合部分4004及其相关联的分析物结合部分条形码,也可以标识分析物结合部分4004所结合的分析物4006。分析物结合部分条形码可以是给定长度的核酸序列和/或与分析物结合部分4004相关联的序列。分析物结合部分条形码通常可以包括本文所述条形码的多种方面中的任一种。例如,对一种类型的分析物具有特异性的分析物捕获剂4002可以具有与其偶联的第一捕获剂条形码域(例如,其包括第一分析物结合部分条形码),而对不同分析物具有特异性的分析物捕获剂可以具有与其偶联的不同捕获剂条形码域(例如,其包括第二条形码分析物结合部分条形码)。在一些方面,这种捕获剂条形码域可以包括分析物结合部分条形码,其允许标识捕获剂条形码域所偶联的分析物结合部分4004。捕获剂条形码域4008的选择可以允许在序列方面的显著多样性,同时也易于附着于大多数分析物结合部分(例如,抗体或适配体)以及易于检测(例如,使用测序或阵列技术)。
[0381]
在一些实施例中,分析物捕获剂4002的捕获剂条形码域包括分析物捕获序列。如本文所用,术语“分析物捕获序列”是指被配置成与捕获探针的捕获域杂交、结合、偶联或以其它方式相互作用的区域或部分。在一些实施例中,分析物捕获序列包括与捕获探针的捕获域互补或基本上互补的核酸序列,使得分析物捕获序列与捕获探针的捕获域杂交。在一些实施例中,分析物捕获序列包含与包含聚(t)核酸序列的捕获域杂交的聚(a)核酸序列。在一些实施例中,分析物捕获序列包含与包含聚(a)核酸序列的捕获域杂交的聚(t)核酸序列。在一些实施例中,分析物捕获序列包含与捕获域杂交的非均聚核酸序列,该捕获域包含与分析物捕获区的非均聚核酸序列互补(或基本上互补)的非均聚核酸序列。
[0382]
在本文所述的采用分析物捕获剂4002的任何空间分析方法的一些实施例中,捕获剂条形码域可以直接偶联到分析物结合部分4004,或它们可以附着于珠、分子晶格,例如线性、球状、交联或其它聚合物,或附着于或以其它方式关联到分析物结合部分的其它框架,其允许多个捕获剂条形码域附着于单个分析物结合部分。捕获剂条形码域与分析物结合部分4004的附着(偶联)可以通过多种直接或间接、共价或非共价结合或附着中的任一种来实现。例如,在捕获剂条形码域偶联到包括抗体或抗原结合片段的分析物结合部分4004的情况下,此类捕获剂条形码域可以使用化学缀合技术(例如,可购自英诺华生物科学公司(innova biosciences)的抗体标记试剂盒)共价附着于抗体或抗原结合片段的一部分。在一些实施例中,可以使用非共价附着机制将捕获剂条形码域偶联到抗体或抗原结合片段(例如,使用生物素化抗体和寡核苷酸或包括一个或多个生物素化接头的珠,用抗生物素蛋白或链霉抗生物素蛋白接头偶联到寡核苷酸)。可以使用抗体和寡核苷
酸生物素化技术,并且在例如fang等人,2003,《核酸研究(nucleic acids res.)》31(2):708-715中有所描述,其全部内容通过引用并入本文。同样,已开发并可使用蛋白质和肽生物素化技术,并且描述于例如美国专利第6,265,552号中,其全部内容通过引用并入本文。此外,如甲基四嗪-peg5-nhs酯反应、tco-peg4-nhs酯反应等点击反应化学可用于将捕获剂条形码域偶联到分析物结合部分4004。分析物结合部分上的反应性部分还可以包括用于靶向醛的胺、用于靶向马来酰亚胺(例如,游离硫醇)的胺、用于靶向点击化学化合物(例如,炔烃)的叠氮化物、用于靶向链霉抗生物素蛋白的生物素、用于靶向edc的磷酸酯,其进而又靶向活性酯(例如,nh2)。分析物结合部分4004上的反应部分可以是与反应部分结合的化学化合物或基团。将分析物结合部分4004缀合到捕获剂条形码域的示例性策略包括使用商业试剂盒(例如,solulink、thunder link)、铰链区的温和还原和马来酰亚胺标记的缀合、对标记的酰胺(例如,无铜)的染色促进的点击化学反应,以及糖链的高碘酸盐氧化和胺缀合的缀合。在分析物结合部分4004是抗体的情况下,可以在寡核苷酸缀合之前或同时修饰抗体。例如,抗体可以用β-1,4-半乳糖基转移酶的化学基底允许突变体galt(y289l)和带有叠氮化物的尿苷二磷酸-n-乙酰半乳糖胺类似物尿苷二磷酸-galnaz进行糖基化。修饰的抗体可以与具有二苯并环辛炔-peg4-nhs基团的寡核苷酸缀合。在一些实施例中,可以避免某些步骤(例如,cooh活化(如edc)和同型双功能交联剂)以防止分析物结合部分与其自身缀合。在本文所述的任何空间分析方法的一些实施例中,分析物捕获剂(例如,偶联到寡核苷酸的分析物结合部分4004)可以例如通过转染(例如,使用转染胺、阳离子聚合物、磷酸钙或电穿孔)、通过转导(例如,使用噬菌体或重组病毒载体)、通过机械递送(例如,磁珠)、通过脂质(例如,1,2-二油酰基-sn-甘油基-3-磷酸胆碱(dopc))或通过转运蛋白递送到细胞中。
[0383]
可以使用外来体将分析物捕获剂4002递送到细胞中。例如,可以生成释放包含分析物捕获剂的外来体的第一细胞。分析物捕获剂可以附着于外来体膜。分析物捕获剂可以包含在外来体的细胞溶质中。可以收获释放的外来体并提供给第二细胞,从而将分析物捕获剂递送到第二细胞中。分析物捕获剂可以在递送到细胞之前、期间或之后从外来体膜释放。在一些实施例中,细胞被透化以允许分析物捕获剂4002与细胞内成分(例如但不限于细胞内蛋白质、代谢物和核膜蛋白)偶联。在细胞内递送后,分析物捕获剂4002可用于分析本文所述的细胞内成分。
[0384]
在本文所述的任何空间分析方法的一些实施例中,偶联到分析物捕获剂4002的捕获剂条形码域可以包括使其不可由聚合酶延伸的修饰。在一些实施例中,当结合到样品中捕获探针或核酸的捕获域以进行引物延伸反应时,捕获剂条形码域可用作模板,而不是引物。当捕获剂条形码域还包括条形码(例如,分析物结合部分条形码)时,这样的设计可以通过增加捕获剂条形码域与未条形码化的样品核酸之间的亲和力来增加分子条形码化的效率,并且消除连接子伪影的潜在形成。在一些实施例中,捕获试剂条形码域4008可以包括随机的n-mer序列,其被修饰封端,使其不能被聚合酶延伸。在一些情况下,随机n-mer序列的组成可以设计为使与游离的、未条形码化的ssdna分子的结合效率最大化。该设计可以包括具有较高gc含量的随机序列组成、在特定位置具有固定g或c的部分随机序列、使用鸟苷、使用锁定核酸或其任何组合。
[0385]
用于通过聚合酶阻断引物延伸的修饰可以是不同长度的碳间隔基团或双脱氧核苷酸。在一些实施例中,修饰可以是具有脱嘌呤或脱嘧啶结构、碱基类似物或磷酸酯主链的
类似物的脱碱基位点,如通过酰胺键、四氢呋喃或1',2'-二脱氧核糖连接的n-(2-氨基乙基)-甘氨酸主链。修饰还可以是尿嘧啶碱基、2'ome修饰的rna、c3-18间隔(例如,具有3至18个连续碳原子的结构,如c3间隔)、乙二醇多聚体间隔(例如,间隔18(六乙二醇间隔))、生物素、二脱氧核苷三磷酸、乙二醇、胺或磷酸酯)。
[0386]
在本文所述的任何空间分析方法的一些实施例中,与分析物结合部分4004偶联的捕获剂条形码域4008包括可切割域。例如,在分析物捕获剂与分析物(例如,细胞表面分析物)结合后,可以根据本文所述的方法切割和收集捕获剂条形码域用于下游分析。在一些实施例中,捕获剂条形码域的可切割域包括允许物质从珠释放的u-切除元件。在一些实施例中,u-切除元件可以包括包含至少一个尿嘧啶的单链dna(ssdna)序列。该物种可以通过ssdna序列附着于珠。可以通过尿嘧啶-dna糖基化酶(例如,以去除尿嘧啶)和核酸内切酶(例如,以诱导ssdna断裂)的组合来释放物种。如果核酸内切酶从切割产生5'磷酸基团,则在下游处理中可以包括额外的酶处理以消除磷酸基团,例如在连接额外的测序处理元件(例如,依诺米那全p5序列、部分p5序列、全r1序列和/或部分r1序列)之前。
[0387]
在一些实施例中,来自生物样品的多种不同种类的分析物(例如,多肽)可以随后与生物样品的一种或多种物理性质相关联。例如,多种不同种类的分析物可以与生物样品中分析物的位置相关联。此类信息(例如,当分析物结合部分识别多肽时的蛋白质组信息)可以与其它空间信息(例如,来自生物样品的遗传信息,如dna序列信息、转录组信息(例如转录物序列),或两者)结合使用。例如,细胞的细胞表面蛋白可以与细胞的一种或多种物理性质(例如,细胞的形状、大小、活性或类型)相关联。一种或多种物理性质可以通过对细胞成像来表征。细胞可被分析物捕获剂结合,该分析物捕获剂包含结合到细胞表面蛋白的分析物结合部分和标识分析物结合部分的分析物结合部分条形码,并且细胞可以经受空间分析(例如,本文所述的多种空间分析方法中的任一种)。例如,结合到细胞表面蛋白的分析物捕获剂4002可以结合到捕获探针(例如,阵列上的捕获探针),该捕获探针包括与分析物捕获剂902的捕获剂条形码域上存在的分析物捕获序列相互作用的捕获域。捕获剂条形码域的全部或部分(包括分析物结合部分条形码)可以用聚合酶复制,使用捕获域的3'端作为引发位点,生成延伸的捕获探针,其包括对应于捕获探针的全部或部分互补序列(包括存在于捕获探针上的空间条形码)和分析物结合部分条形码的拷贝。在一些实施例中,具有包括与捕获探针的空间条形码互补的序列的延伸的捕获剂条形码域的分析物捕获剂被称为“空间标记的分析物捕获剂”。
[0388]
在一些实施例中,具有空间标记的分析物捕获剂的空间阵列可以与样品接触,其中与空间阵列结合的分析物捕获剂捕获靶分析物。然后可以从空间阵列的捕获探针变性包含延伸的捕获探针的分析物捕获试剂,该延伸的捕获探针包括与捕获探针的空间条形码和分析物结合部分条形码互补的序列。这允许重新使用空间阵列。可以将样品解离成非聚集细胞(例如,单细胞)并通过本文所述的单细胞/液滴方法进行分析。可以对空间标记的分析物捕获剂进行测序以获得捕获探针的空间条形码和分析物捕获剂的分析物结合部分条形码的核酸序列。因此,延伸的捕获探针的核酸序列可以与分析物(例如,细胞表面蛋白)相关联,并进而与细胞的一种或多种物理性质(例如,形状或细胞类型)相关联。在一些实施例中,延伸的捕获探针的核酸序列可以与附近细胞的胞内分析物相关联,其中细胞内分析物使用本文所述的任何细胞透化或分析物迁移技术释放。
[0389]
在本文所述的任何空间分析方法的一些实施例中,然后可以对从分析物捕获剂释放的捕获剂条形码域进行序列分析以标识哪些分析物捕获剂与分析物结合。基于与空间阵列上的捕获点(例如,特定位置处的捕获点)相关联的捕获试剂条形码域和分析物结合部分条形码序列的存在,可以为生物样品创建分析物图谱。可以将单个细胞或细胞群体的图谱与来自其它细胞(例如,“正常”细胞)的图谱进行比较,以鉴定分析物中的变化,其可以提供诊断相关的信息。在一些实施例中,这些图谱可用于诊断由细胞表面受体变化表征的多种疾病,如癌症和其它病症。
[0390]
图38a上图是描绘了特征固定的捕获探针602和分析物捕获剂4002之间的示例性相互作用的示意图(其中术语“特征”和“捕获点”可以互换使用)。如本文别处所述,特征固定的捕获探针602可以包括空间条形码605以及一个或多个功能序列604和606。捕获探针602也可以包括能够结合分析物捕获剂4002的捕获域607。在一些实施例中,分析物捕获剂4002包含功能序列4118、捕获剂条形码域4008和分析物捕获序列4114。在一些实施例中,分析物捕获序列4114能够结合捕获探针602的捕获域607。分析物捕获剂4002也可以包括允许捕获剂条形码域4008(4114/4008/4118)与分析物结合部分4004偶联的接头4120。
[0391]
图38a下图进一步说明了空间标记的分析物捕获剂4002,其中捕获剂条形码域4118/4008/4114的分析物捕获序列4114(聚-a序列)可以用阻断探针(聚-t寡核苷酸)阻断。
[0392]
在一些实施例中,捕获结合域可以包括与捕获探针的捕获域(例如,本文所述的任何示例性捕获域)的序列至少部分互补的序列。图38b示出了附着于用于检测生物样品中蛋白质的分析物结合部分的示例性捕获结合域。如图38b所示,分析物结合部分4004包括寡核苷酸,该寡核苷酸包括引物(例如,读数2)序列4118、分析物结合部分条形码4008、具有第一序列(例如,捕获结合域)4114的捕获结合域(例如,示例性聚a),以及阻断探针或第二序列4120(例如,聚t或聚u),其中阻断序列阻断捕获结合域与捕获探针上的捕获域杂交。在一些情况下,阻断序列4120被称为如本文所公开的阻断探针。在一些情况下,阻断探针是图38b中例示的聚t序列。
[0393]
在一些情况下,如图38a所示,阻断探针序列不在具有捕获结合域的连续序列上。换句话说,在一些情况下,捕获结合域(本文也称为第一序列)和阻断序列是独立的多核苷酸。在一些情况下,对本领域技术人员显而易见的是,术语“捕获结合域”和“第一序列”在本公开中可互换使用。
[0394]
在非限制性实例中,当基底上捕获探针的捕获域序列是聚(t)序列时,第一序列可以是聚(a)序列。在一些实施例中,捕获结合域包括与捕获探针的捕获域基本上互补的捕获结合域。基本上互补是指捕获结合域的第一序列与捕获探针的捕获域中的序列至少70%、至少75%、至少80%、至少85%、至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%、至少99%或100%互补。在另一个实例中,捕获结合域的第一序列可以是随机序列(例如,随机六聚体),其与也是随机序列的捕获探针的捕获域序列至少部分互补。在又一个实例中,当捕获探针的捕获域序列也是包括均聚序列(例如,聚(a)序列)和随机序列的序列时,捕获结合域可以是均聚序列(例如,聚(t)序列)和随机序列(例如,随机六聚体)的混合物。在一些实施例中,捕获结合域包括能够参与瓦特生-克里克型或类似碱基对相互作用的核糖核苷酸、脱氧核糖核苷酸和/或合成核苷酸。在一些实施例中,捕获结合域序列的第一序列包括至少10个核苷酸、至少11个核苷酸、至少12个核苷
酸、至少13个核苷酸、至少14个核苷酸、至少15个核苷酸、至少16个核苷酸、至少17个核苷酸、至少18个核苷酸、至少19个核苷酸、至少20个核苷酸、至少21个核苷酸、至少22个核苷酸、至少23个核苷酸或至少24个核苷酸。在一些实施例中,捕获结合域的第一序列包括至少25个核苷酸、至少30个核苷酸或至少35个核苷酸。
[0395]
在一些实施例中,捕获结合域(例如,第一序列)和捕获结合域的阻断探针(例如,第二序列)位于相同的连续核酸序列上。当捕获结合域和阻断探针位于相同的连续核酸序列上时,第二序列(例如,阻断探针)位于第一序列的3'。当捕获结合域的第一序列和第二序列(例如,阻断探针)位于相同的连续核酸序列上时,第二序列(例如,阻断探针)位于第一序列的5'。如本文所用,术语第二序列和阻断探针可以互换使用。
[0396]
在一些情况下,捕获结合域的第二序列(例如,阻断探针)包括核酸序列。在一些情况下,第二序列也称为阻断探针或阻断域,并且每个术语可以互换使用。在一些情况下,阻断域是dna寡核苷酸。在一些情况下,阻断域是rna寡核苷酸。在一些实施例中,捕获结合域的阻断探针包括与捕获结合域的第一序列互补或基本上互补的序列。在一些实施例中,当存在时,阻断探针阻止捕获结合域的第一序列结合捕获探针的捕获域。在一些实施例中,在捕获结合域的第一序列(例如,存在于连接的探针中)与捕获探针上的捕获域结合之前,去除阻断探针。在一些实施例中,捕获结合域的阻断探针包括聚-尿苷序列、聚-胸苷序列或两者。在一些情况下,阻断探针(或第二序列)是发夹结构的一部分,其特异性结合捕获结合域并防止捕获结合域与捕获探针的捕获域杂交。参见例如,图38c。
[0397]
在一些实施例中,捕获结合域的第二序列(例如,阻断探针)包括被配置成与捕获结合域的第一序列杂交的序列。当阻断探针与第一序列杂交时,阻断第一序列与捕获探针的捕获域杂交。在一些实施例中,阻断探针包括与第一序列互补的序列。在一些实施例中,阻断探针包括与第一序列基本上互补的序列。在一些实施例中,阻断探针包括与捕获结合域的第一序列至少70%、至少75%、至少80%、至少85%、至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%、至少99%或100%互补的序列。
[0398]
在一些实施例中,捕获结合域的阻断探针包括与捕获结合域的第一序列基本上互补的均聚序列。在一些实施例中,阻断探针被配置成与聚(a)、聚(t)或聚-ru序列杂交。在一些实施例中,阻断探针包括聚(a)、聚(t)或聚(u)序列。在一些实施例中,第一序列包括均聚序列。在一些实施例中,第一序列包括聚(a)、聚(u)或聚(t)序列。
[0399]
在一些实施例中,捕获结合域进一步包括发夹序列(如图38c所示)。图38c示出了附着于用于检测生物样品中蛋白质的分析物结合部分的示例性捕获结合域。如图38c所示,分析物结合部分4004包括寡核苷酸,该寡核苷酸包括引物(例如,读数2)序列4118、分析物结合部分条形码4008、具有第一序列4114的捕获结合域(例如,示例性聚a)、阻断探针4120和第三序列4140,其中第二和/或第三序列可以是聚t或聚u或其组合,其中阻断探针产生发夹型结构,并且第三序列阻断第一序列与捕获探针上的捕获域杂交。在一些情况下,第三序列4140被称为阻断序列。此外,4150举例说明了能够消化阻断测序的核酸酶。在该实施例中,4150可以是能够消化尿嘧啶的核酸内切酶或核酸酶混合物,如udg或尿嘧啶特异性切除混合物,如user(neb)。
[0400]
发夹阻断剂方案的另一个实施例在图38d中举例说明。如图38d所示,分析物结合
部分4004包括寡核苷酸,该寡核苷酸包括引物(例如,读数2)序列4118、分析物结合部分条形码4008、具有第一序列(例如,捕获结合域)4114的捕获结合域(例如,示例性聚a)、第二发夹序列4170和第三序列4180,其中第三序列(例如,阻断探针)阻断第一序列与捕获探针上的捕获域杂交。在该实施例中,4190举例说明了能够从dna:rna杂合体中消化尿嘧啶阻断测序的rnase h核酸酶,该杂合体通过用包含尿嘧啶的第三序列阻断第一序列而形成。
[0401]
在一些实施例中,发夹序列4170位于捕获结合域中阻断探针的5'。在一些实施例中,发夹序列4170位于捕获结合域中第一序列的5'。在一些实施例中,捕获结合域从5'至3'包括与捕获探针的捕获域基本上互补的第一序列、发夹序列和与第一序列基本上互补的阻断探针。替代地,捕获结合域从3'至5'包括与捕获探针的捕获域基本上互补的第一序列、发夹序列和与第一序列基本上互补的阻断探针。
[0402]
在一些实施例中,发夹序列4170包括约三个核苷酸、约四个核苷酸、约五个核苷酸、约六个核苷酸、约七个核苷酸、约八个核苷酸、约九个核苷酸或约10个或更多个核苷酸的序列。在一些情况下,发夹为至少约15个核苷酸、至少约20个核苷酸、至少约25个核苷酸、至少约30个核苷酸或更多个核苷酸。
[0403]
在一些实施例中,发夹序列包括dna、rna、dna-rna杂合体,或包括修饰的核苷酸。在一些情况下,发夹是多聚(u)序列。在一些情况下,使用本文公开的方法通过user和/或rnase h消化rna发夹序列。在一些情况下,使用本文公开的方法通过user和/或rnase h消化聚(u)发夹序列。在一些情况下,发夹是聚(t)序列。应当理解,发夹的序列(无论其是包括dna、rna、dna-rna杂合体,还是包括修饰的核苷酸)可以是几乎任何核苷酸序列,只要其形成发夹,并且在一些情况下,只要其被user和/或rnase h消化。
[0404]
在一些实施例中,本文提供的方法要求与捕获结合域的第一序列杂交的捕获结合域的第二序列(例如,阻断探针)从第一序列释放。在一些实施例中,从第一序列释放阻断探针(或第二序列)在阻断探针从第一序列去杂交的条件下进行。
[0405]
在一些实施例中,从第一序列释放阻断探针包括切割发夹序列。在一些实施例中,发夹序列包括可切割接头。例如,可切割接头可以是光可切割接头、uv可切割接头或酶可切割接头。在一些实施例中,切割该酶促可切割域的酶是核酸内切酶。在一些实施例中,发夹序列包括限制性核酸内切酶的靶序列。
[0406]
在一些实施例中,释放与捕获结合域的第一序列杂交的捕获结合域的阻断探针(或第二序列)包括使阻断探针与限制性核酸内切酶接触。在一些实施例中,从第一序列释放阻断探针包括使阻断探针与核糖核酸内切酶接触。在一些实施例中,当阻断探针是rna序列(例如,包含尿嘧啶的序列)时,核糖核酸内切酶是rnase h、rnase a、rnase c或rnase i中的一种或多种。在一些实施例中,其中核糖核酸内切酶是rnase h。在一些实施例中,rnase h包括rnase h1、rnase h2或rnase h1和rnase h2。
[0407]
在一些实施例中,发夹序列包括均聚序列。在一些实施例中,发夹序列4170包括聚(t)或聚(u)序列。例如,发夹序列包括聚(u)序列。在一些实施例中,本文提供了通过使发夹序列与尿嘧啶特异性切除试剂(user)酶接触来释放阻断探针的方法。
[0408]
在一些实施例中,从第一序列释放阻断探针包括在阻断探针从第一序列去杂交的条件下使阻断探针变性。在一些实施例中,变性包含使用化学变性或物理变性。例如,其中使用物理变性(例如,温度)来释放阻断探针。在一些实施例中,变性包括温度调节。例如,第
一序列和阻断探针具有基于已知序列内的组成(a、g、c或t)的预定退火温度。在一些实施例中,将温度调节到高于预定退火温度至多5℃、至多10℃、至多15℃、至多20℃、至多25℃、至多30℃或至多35℃。在一些实施例中,将温度调节为高于预定退火温度1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、24、25、26、27、28、29、30、31、32、33、34或35℃。在一些实施例中,一旦将温度调节到高于预定退火温度的温度,以约0.1℃/秒至约1.0℃/秒(例如,约0.1℃/秒至约0.9℃/秒、约0.1℃/秒至约0.8℃/秒、约0.1℃/秒至约0.7℃/秒、约0.1℃/秒至约0.6℃/秒、约0.1℃/秒至约0.5℃/秒、约0.1℃/秒至约0.4℃/秒、约0.1℃/秒至约0.3℃/秒、约0.1℃/秒至约0.2℃/秒、约0.2℃/秒至约1.0℃/秒、约0.2℃/秒至约0.9℃/秒、约0.2℃/秒至约0.8℃/秒、约0.2℃/秒至约0.7℃/秒、约0.2℃/秒至约0.6℃/秒、约0.2℃/秒至约0.5℃/秒、约0.2℃/秒至约0.4℃/秒、约0.2℃/秒至约0.3℃/秒、约0.3℃/秒至约1.0℃/秒、约0.3℃/秒至约0.9℃/秒、约0.3℃/秒至约0.8℃/秒、约0.3℃/秒至约0.7℃/秒、约0.3℃/秒至约0.6℃/秒、约0.3℃/秒至约0.5℃/秒、约0.3℃/秒至约0.4℃/秒、约0.4℃/秒至约1.0℃/秒、约0.4℃/秒至约0.9℃/秒、约0.4℃/秒至约0.8℃/秒、约0.4℃/秒至约0.7℃/秒、约0.4℃/秒至约0.6℃/秒、约0.4℃/秒至约0.5℃/秒、约0.5℃/秒至约1.0℃/秒、约0.5℃/秒至约0.9℃/秒、约0.5℃/秒至约0.8℃/秒、约0.5℃/秒至约0.7℃/秒、约0.5℃/秒至约0.6℃/秒、约0.6℃/秒至约1.0℃/秒、约0.6℃/秒至约0.9℃/秒、约0.6℃/秒至约0.8℃/秒、约0.6℃/秒至约0.7℃/秒、约0.7℃/秒至约1.0℃/秒、约0.7℃/秒至约0.9℃/秒、约0.7℃/秒至约0.8℃/秒、约0.8℃/秒至约1.0℃/秒、约0.8℃/秒至约0.9℃/秒,或约0.9℃/秒至约1.0℃/秒))的升温速率将温度冷却至预定退火温度。在一些实施例中,变性包括温度循环。在一些实施例中,变性包括在变性条件(例如,变性温度)和非变性条件(例如,退火温度)之间交替。
[0409]
应当理解,尽管在实施例中有任何特定的功能,发夹序列可以是任何序列构型,只要形成发夹。因此,在一些情况下,它可以是例如简并序列、随机序列或其它(包含任何多核苷酸序列)。
[0410]
在一些实施例中,发夹序列4170进一步包括能够结合捕获探针的捕获域的序列。例如,从捕获结合域释放发夹序列可能需要切割发夹序列,其中切割后留下的发夹序列部分包括能够结合捕获探针的捕获域的序列。在一些实施例中,发夹序列的全部或部分基本上与捕获探针的捕获域互补。在一些实施例中,与捕获探针的捕获域基本上互补的序列位于发夹序列切割后的游离5'或游离3'端。在一些实施例中,发夹的切割产生能够结合空间阵列上捕获探针的捕获域的单链序列。虽然发夹序列的释放可能使得能够与捕获探针的捕获域杂交,但预期发夹的释放不会显著影响分析物结合部分或探针寡核苷酸(例如,第二探针寡核苷酸)对靶分析物的捕获。
[0411]
在一些情况下,本文公开的一种或多种阻断方法包括多个笼状核苷酸。在一些实施例中,本文提供了其中捕获结合域包括多个笼状核苷酸的方法。笼状核苷酸防止捕获结合域与捕获探针的捕获域相互作用。笼状核苷酸包括阻断瓦特生-克里克氢键合的笼状部分,从而防止相互作用,直到例如通过释放笼状部分并恢复笼状核苷酸与互补核苷酸进行瓦特生-克里克碱基配对的能力的笼状部分的光解而激活。
[0412]
图38e展示了用笼状核苷酸阻断捕获结合域。如图38e所示,分析物结合部分4004包括寡核苷酸,该寡核苷酸包括引物(例如,读数2)序列4118、分析物结合部分条形码4008
和具有序列4114的捕获结合域(例如,示例性聚a)。笼状核苷酸4130阻断序列4114,从而阻断捕获结合域和捕获探针的捕获域之间的相互作用。在一些实施例中,捕获结合域包括多个笼状核苷酸,其中多个笼状核苷酸的一个笼状核苷酸包括能够防止捕获结合域和捕获探针的捕获域之间相互作用的笼状部分。笼状核苷酸(也称为光敏寡核苷酸)的非限制性实例描述于liu等人,2014,《化学研究述评(acc.chem.res.)》,47(1):45-55(2014),其通过引用整体并入本文。在一些实施例中,笼状核苷酸包括选自由6-硝基胡椒酰氧基甲基(npom)、1-(邻硝基苯基)-乙基(npe)、2-(邻硝基苯基)丙基(npp)、二乙氨基香豆素(deacm)和硝基二苯并呋喃(ndbf)组成的组的笼状部分。
[0413]
在一些实施例中,笼状核苷酸包括选自由6-硝基胡椒酰氧基甲基(npom)-笼状腺苷,6-硝基胡椒酰氧基甲基(npom)-笼状鸟苷、6-硝基胡椒酰氧基甲基(npom)-笼状尿苷和6-硝基胡椒酰氧基甲基(npom)-笼状胸苷组成的组的非天然存在的核苷酸。例如,捕获结合域包括一个或多个笼状核苷酸,其中笼状核苷酸包括一个或多个6-硝基胡椒酰氧基甲基(npom)-笼状鸟苷。在另一个实例中,捕获结合域包括一个或多个笼状核苷酸,其中笼状核苷酸包括一个或多个硝基胡椒酰氧基甲基(npom)-笼状尿苷。在又一个实例中,捕获结合域包括一个或多个笼状核苷酸,其中笼状核苷酸包括一个或多个6-硝基胡椒酰氧基甲基(npom)-笼状胸苷。
[0414]
在一些实施例中,捕获结合域包括至少两个或更多个本文所述的任何笼状核苷酸的组合。例如,捕获结合域可以包括一个或多个6-硝基胡椒酰氧基甲基(npom)-笼状鸟苷和一个或多个硝基胡椒酰氧基甲基(npom)-笼状尿苷。应当理解,捕获结合域可以包括本文所述的任何笼状核苷酸的任何组合。
[0415]
在一些实施例中,捕获结合域包括一个笼状核苷酸、两个笼状核苷酸、三个笼状核苷酸、四个笼状核苷酸、五个笼状核苷酸、六个笼状核苷酸、七个笼状核苷酸、八个笼状核苷酸、九个笼状核苷酸,或十个或更多个笼状核苷酸。
[0416]
在一些实施例中,捕获结合域在3'端包括一个笼状核苷酸。在一些实施例中,捕获结合域在3'端包括两个笼状核苷酸。在一些实施例中,捕获结合域在3'端包括至少三个笼状核苷酸。
[0417]
在一些实施例中,捕获结合域在5'端包括一个笼状核苷酸。在一些实施例中,捕获结合域在5'端包括两个笼状核苷酸。在一些实施例中,捕获结合域在5'端包括至少三个笼状核苷酸。
[0418]
在一些实施例中,捕获结合域在从捕获结合域的3'端开始的每个奇数位置处包括一个笼状核苷酸。在一些实施例中,捕获结合域在从捕获结合域的5'端开始的每个奇数位置处包括一个笼状核苷酸。在一些实施例中,捕获结合域在从捕获结合域的3'端开始的每个偶数位置处包括一个笼状核苷酸。在一些实施例中,捕获结合域在从捕获结合域的5'端开始的每个偶数位置处包括一个笼状核苷酸。
[0419]
在一些实施例中,捕获结合域包括含有至少10%、至少20%或至少30%笼状核苷酸的序列。在一些情况下,捕获结合域中的笼状核苷酸的百分比为约40%、约50%、约60%、约70%、约80%或更高。在一些实施例中,捕获结合域包括其中每个核苷酸是笼状核苷酸的序列。应当理解,笼状核苷酸的限制基于捕获结合域的序列和基于产生彼此邻近的笼状核苷酸的空间限制。因此,在一些情况下,特定核苷酸(例如,鸟嘌呤)被笼状核苷酸替代。在一
些情况下,捕获结合域中的所有鸟嘌呤被笼状核苷酸替代。在一些情况下,捕获结合域中的鸟嘌呤的一部分(例如,约10%、约20%、约30%、约40%、约50%、约60%、约70%、约80%、约90%或约95%)被笼状核苷酸替代。在一些情况下,特定核苷酸(例如,尿苷或胸腺嘧啶)被笼状核苷酸替代。在一些情况下,捕获结合域中的所有尿苷或胸腺嘧啶被笼状核苷酸替代。在一些情况下,捕获结合域中的尿苷或胸腺嘧啶的一部分(例如,约10%、约20%、约30%、约40%、约50%、约60%、约70%、约80%、约90%或约95%)被笼状核苷酸替代。笼状核苷酸公开于govan等人,2013,《核酸研究(nucleic acids research)》41;22,10518-10528,其全部内容通过引用并入本文。
[0420]
在一些实施例中,捕获结合域包括均匀分布在整个捕获结合域中的笼状核苷酸。例如,捕获结合域可以包括包括至少10%笼状核苷酸的序列,其中笼状核苷酸均匀分布在整个捕获结合域中。在一些实施例中,捕获结合域包括至少10%笼状核苷酸的序列,其中10%笼状核苷酸位于捕获结合域的3'。在一些实施例中,捕获结合域包括至少10%笼状核苷酸的序列,其中10%笼状核苷酸位于捕获结合域的5'端。在一些实施例中,笼状核苷酸包括在捕获结合域序列的每第三个、每第四个、每第五个、每第六个核苷酸或其组合。
[0421]
在一些实施例中,本文提供了用于从笼状核苷酸释放笼状部分的方法。在一些实施例中,从笼状核苷酸释放笼状部分包括激活笼状部分。在一些实施例中,从笼状核苷酸释放笼状部分恢复了笼状核苷酸通过瓦特生-克里克氢键合与互补核苷酸杂交的能力。例如,恢复笼状核苷酸与互补核苷酸杂交的能力能够使得/恢复捕获结合域与捕获域相互作用的能力。当从笼状核苷酸释放笼状部分时,笼状核苷酸不再是“笼状的”,因为笼状部分不再与笼状核苷酸连接(例如,共价或非共价)。如本文所用,术语“笼状核苷酸”可以指连接到笼状部分的核苷酸或连接到笼状部分但由于笼状部分的激活而不再连接的核苷酸。
[0422]
在一些实施例中,本文提供了用于激活笼状部分从而从笼状核苷酸释放笼状部分的方法。在一些实施例中,激活笼状部分包括从核苷酸光解出笼状部分。如本文所用,“光解”可以指使用光从笼状核苷酸去除或分离笼状部分的过程。在一些实施例中,激活(例如,光解)笼状部分包括将笼状部分暴露于光脉冲(例如,两个或更多个、三个或更多个、四个或更多个,或五个或更多个光脉冲),这些光脉冲总共足以从笼状核苷酸释放笼状部分。在一些实施例中,激活笼状部分包括将笼状部分暴露于足以从笼状核苷酸释放笼状部分的光脉冲(例如,单一光脉冲)。在一些实施例中,激活笼状部分包括将笼状部分暴露于多个脉冲(例如,一个或两个或更多个光脉冲),其中光的波长为约小于约360nm。在一些实施例中,波长约小于360nm的光源是uv光。uv光可以源自荧光显微镜、uv激光器或uv闪光灯,或本领域已知的任何uv光源。
[0423]
在一些实施例中,一旦笼状部分从捕获结合域释放,包括捕获结合域的寡核苷酸、探针寡核苷酸或连接产物能够与捕获探针的捕获域杂交。最后,为了鉴定分析物的位置或确定两个或多个分析物结合部分之间的相互作用,可以测定寡核苷酸、探针寡核苷酸或连接产物或其互补物的全部或部分序列。
[0424]
关于其中阻断分析物捕获序列的实施例的更多公开内容,参见2020年11月6日提交的题为《增强分析物结合的特异性(enhancingspecificityofanalytebinding)》的国际专利申请第pct/us2020/059472号,其通过引用并入本文。
[0425]
图39绘示了如何将阻断探针添加到空间标记的分析物捕获剂4002中以防止与阵
列上的捕获域的非特异性结合。在一些实施例中,将阻断寡核苷酸和抗体递送到组织,其中在结合到组织靶标后,阻断寡核苷酸可以随后被去除(例如,被rnase消化)。在图39所示的实例中,寡核苷酸和抗体之间的接头的切割允许寡核苷酸迁移到阵列上的捕获域。参见下面的实例3和4。
[0426]
在本文所述的任何空间分析方法的一些实施例中,该方法用于鉴定免疫细胞图谱。免疫细胞表达与免疫功能相关的各种适应性免疫受体,如t细胞受体(tcr)和b细胞受体(bcr)。t细胞受体和b细胞受体通过特异性识别和结合抗原并辅助其破坏而在免疫应答中起作用。在题为《利用空间条形码寡核苷酸阵列对生物分析物进行分析》的pct公开202020176788a1中提供了关于所公开的方法的这种应用的更多信息,其各自的全部内容通过引用并入本文。
[0427]
(c)基底
[0428]
对于本节中描述的基于空间阵列的分析方法,基底(例如,芯片)起到支持捕获探针直接或间接附着于阵列的捕获点的作用。另外,在一些实施例中,使用基底(例如,相同的基底或不同的基底)来为样品,特别是例如薄组织切片提供支持。因此,“基底”是不溶于水性液体并且允许生物样品、分析物、捕获点和/或捕获探针在基底上定位的支持物。
[0429]
多种不同的基底可用于前述目的。通常,基底可以是任何合适的支持材料。示例性基底包括但不限于玻璃、改性和/或官能化玻璃、水凝胶、薄膜、膜、塑料(包括例如丙烯酸树脂、聚苯乙烯、苯乙烯和其它材料的共聚物、聚丙烯、聚乙烯、聚丁烯、聚氨酯、teflon
tm
、环烯烃、聚酰亚胺等)、尼龙、陶瓷、树脂、zeonor、二氧化硅或基于二氧化硅的材料(包括硅和改性硅)、碳、金属、无机玻璃、光纤束和聚合物(如聚苯乙烯、环烯烃共聚物(coc)、环烯烃聚合物(cop)、聚丙烯、聚乙烯和聚碳酸酯)。
[0430]
基底也可以对应于流动细胞。流动细胞可以由任何前述材料形成,并且可以包括允许试剂、溶剂、捕获点和分子通过流动细胞的通道。
[0431]
在以上讨论的基底材料的实例中,聚苯乙烯是适合于结合带负电荷的大分子的疏水材料,因为它通常包含很少的亲水基团。对于固定在载玻片上的核酸,通过增加玻璃表面的疏水性,可以增加核酸的固定。这种增强可以允许相对更密集的堆积形成(例如,提供改进的特异性和分辨率)。
[0432]
在一些实施例中,用表面处理剂(如聚-l-赖氨酸)涂覆基底。附加地或替代地,可以通过硅烷化(例如,用环氧-硅烷,氨基-硅烷和/或用聚丙烯酰胺处理)处理基底。
[0433]
基底通常可以具有任何合适的形式或格式。例如,基底可以是平坦的、弯曲的,例如,朝向样品(例如,组织样品)与基底之间发生相互作用的区域凸起或凹陷地弯曲。在一些实施例中,基底是平坦的(例如,平面的)芯片或载片。基底可以在基底内包含一个或多个图案化表面(例如,通道、孔、突起、脊、凹槽等)。
[0434]
基底可以具有任何期望的形状。例如,基底通常可以是薄而平坦的形状(例如,正方形或矩形)。在一些实施例中,基底结构具有圆角(例如,为了增加安全性或坚固性)。在一些实施例中,基底结构具有一个或多个截角(cut-off corner)(例如,用于载片夹或十字工作台)。在一些实施例中,在基底结构是平坦的情况下,基底结构可以是具有平坦表面的任何适当类型的支撑物(例如,芯片或载片,如显微镜载片)。
[0435]
基底可以任选地包括各种结构,例如但不限于突起、脊和通道。基底可以被微图案
化以限制横向扩散(例如,以防止空间条形码的重叠)。用这种结构修饰的基底可以被修饰以允许分析物、捕获点(例如,珠)或探针在单个位点关联。例如,用各种结构修饰基底的位点可以与其它位点相邻或不相邻。
[0436]
在一些实施例中,可以对基底的表面进行改性,从而形成仅具有或容纳单个捕获点的离散位点。在一些实施例中,可以对基底的表面进行改性,使得捕获点粘附到随机位点。
[0437]
在一些实施例中,使用例如(但不限于)冲压技术、微蚀刻技术和模制技术的技术将基底的表面改性为包含一个或多个孔。在其中基底包括一个或多个孔的实施例中,基底可以是凹载片或凹穴载片。例如,孔可以由基底表面上的一个或多个浅凹陷形成。在一些实施例中,在基底包括一个或多个孔的情况下,可以通过将盒(例如,包含一个或多个室的盒)附着于基底结构的表面来形成孔。
[0438]
在一些实施例中,基底的结构(例如,孔)可以各自带有不同的捕获探针。可以根据基底表面中或表面上的结构的位置来标识附着于每个结构的不同捕获探针。示例性基底包括阵列,其中分离的结构位于基底上,包括例如具有容纳捕获点的孔的那些。
[0439]
在一些实施例中,基底包括在基底表面上的一个或多个标记,例如以提供用于将空间信息与感兴趣的分析物的表征相关联的指导。例如,可以用线的网格标记基底(例如,以允许容易地估计在放大下看到的对象的尺寸和/或提供用于计数对象的参考区域)。在一些实施例中,基准标记可以包括在基底上。这种标记可以使用包括但不限于印刷、喷砂和在表面上沉积的技术制成。
[0440]
在基底被改性以包含一种或多种结构(包括但不限于孔、突起、脊或标记)的一些实施例中,该结构可以包括物理改变的位点。例如,用各种结构改性的基底可以包括物理性质,包括但不限于物理构型、磁力或压缩力、化学官能化位点、化学改变位点和/或静电改变位点。
[0441]
在基底被改性以包含各种结构(包括但不限于孔、突起、脊或标记)的一些实施例中,该结构以图案形式应用。替代地,这些结构可以随机分布。
[0442]
在一些实施例中,处理基底以最小化或减少捕获点内或捕获点之间的非特异性分析物杂交。例如,处理可以包括用水凝胶、薄膜和/或膜涂覆基底,其产生对非特异性杂交的物理屏障。可以使用任何合适的水凝胶。例如,可以使用根据美国专利第6,391,937号、第9,512,422号和第9,889,422号以及美国专利申请公开第2017/0253918号和美国2018/0052081中所述的方法制备的水凝胶基质。上述每篇文献的全部内容通过引用并入本文。
[0443]
处理可以包括添加反应性的或能够被激活的官能团,使得其在接受刺激后变为反应性的(例如,光反应性的)。处理可以包括用具有使非特异性结合最小化的一种或多种物理性质(例如,机械的、电的、磁的和/或热的)的聚合物进行处理(例如,在某些位置激活基底以允许分析物在那些位置杂交)。
[0444]
基底(例如,阵列上的珠或捕获点)可以包括数万至数十万或数百万个单独的寡核苷酸分子(例如,至少约10,000、50,000、100,000、500,000、1,000,000、10,000,000、100,000,000、1,000,000,000或10,000,000,000个寡核苷酸分子)。
[0445]
在一些实施例中,基底的表面涂有细胞允许涂层以允许活细胞粘附。“细胞允许涂层”是允许或帮助细胞在基底上维持细胞活力(例如,保持存活)的涂层。例如,细胞允许涂
层可以增强细胞附着、细胞生长和/或细胞分化,例如,细胞允许涂层可以向活细胞提供营养物。细胞允许涂层可以包括生物材料和/或合成材料。细胞允许涂层的非限制性实例包括以一种或多种细胞外基质(ecm)组分(例如,蛋白聚糖和纤维状蛋白质,如胶原蛋白、弹性蛋白、纤连蛋白和层粘连蛋白)、聚赖氨酸、聚l-鸟氨酸和/或生物相容性硅酮(例如,)为特征的涂层。例如,包括一种或多种细胞外基质组分的细胞允许涂层可以包括i型胶原蛋白、ii型胶原蛋白、iv型胶原蛋白、弹性蛋白、纤连蛋白、层粘连蛋白和/或玻连蛋白。在一些实施例中,细胞允许涂层包括从engelbreth-holm-swarm(ehs)小鼠肉瘤(例如,)中提取的溶解的基膜制品。在一些实施例中,细胞允许涂层包括胶原蛋白。
[0446]
在基底包括凝胶(例如,水凝胶或凝胶基质)的情况下,凝胶内的寡核苷酸可以附着于基底。术语“水凝胶”和“水凝胶基质”在本文中可以互换使用,是指包括网络的大分子聚合物凝胶。在网络内,一些聚合物链可以任选地交联,尽管交联并不总是发生。
[0447]
关于可用于本公开的水凝胶和水凝胶亚单位的更多细节和非限制性实施例描述于2020年8月13日提交的题为《用于使用单元型的空间分布来确定生物学状况的系统和方法》的美国专利申请第16/992,569号中,其通过引用并入本文。
[0448]
在题为《利用空间条形码寡核苷酸阵列对生物分析物进行分析》的pct公开202020176788a1中公开了基底的其它实例,包括例如在这种基底上的基准标记,其通过引用并入本文。
[0449]
(d)阵列
[0450]
在本文公开的许多方法中,捕获点共同位于基底上。“阵列”是不规则或形成规则图案的多个捕获点(也称为“特征”)的特定排列。阵列中的各个捕获点基于它们的相对空间位置而彼此不同。通常,阵列中的多个捕获点中的至少两个包括不同的捕获探针(例如,本文所述的捕获探针的任何实例)。
[0451]
阵列可用于同时测量大量分析物。在一些实施例中,寡核苷酸至少部分用于产生阵列。例如,单一种类的寡核苷酸(例如,捕获探针)的一个或多个拷贝可以对应于或直接或间接地附着于阵列中的给定捕获点。在一些实施例中,阵列中的给定捕获点包括两种或更多种寡核苷酸(例如,捕获探针)。在一些实施例中,直接或间接附着于阵列上给定捕获点的两种或更多种寡核苷酸(例如,捕获探针)包括共同(例如,相同)的空间条形码。
[0452]
如上定义,“捕获点”是充当样品分析中使用的各种分子实体的支持物或库的实体。捕获点的实例包括但不限于珠、任何二维或三维几何形状的点(例如,喷墨点、掩蔽点、网格上的正方形)、孔和水凝胶垫。在一些实施例中,捕获点直接或间接地附着或固定到基底(例如,芯片的基底)。在一些实施例中,捕获点不直接或间接地附着或固定到基底,而是例如设置在封闭或部分封闭的三维空间(例如,孔或凹槽)内。
[0453]
在一些实施例中,捕获点直接或间接地附着或固定到可渗透液体的基底(例如,芯片的基底)。在一些实施例中,捕获点直接或间接地附着或固定到生物相容的基底上。在一些实施例中,捕获点直接或间接地附着或固定到水凝胶基底上。
[0454]
图12描绘了阵列内条形码捕获点的示例性排列。从左到右,图12示出了(l)包括六个空间条形码阵列的载片,(c)六个空间条形码阵列中的一个的放大示意图,示出了与样品相关的条形码捕获点的网格,以及(r)阵列的一部分的放大示意图,示出了阵列内的多个捕
获点的特异性标识(标记为id578、id579、id580等)。
[0455]
如本文所用,术语“珠阵列”是指包括多个珠作为阵列中的捕获点的阵列。在一些实施例中,珠附着于基底(例如,芯片的基底)。例如,珠可以任选地附着于如显微镜载片的基底,并且靠近样品(例如,包括细胞的组织切片)。珠也可以悬浮在溶液中并沉积在表面上(例如,膜、组织切片或基底(例如,显微镜载片))。
[0456]
在基底上或基底内的珠阵列的实例包括位于孔中的珠,如珠芯片阵列(可购自加利福尼亚州圣地亚哥依诺米那公司)、在来自454lifesciences的测序平台中使用的阵列(瑞士巴塞尔罗氏公司(roche,basel,switzerland)的子公司),以及在来自离子激流的测序平台中使用的阵列(加利福尼亚州卡尔斯巴德生命技术公司(life technologies,carlsbad,ca)的子公司)。珠阵列的实例描述于例如美国专利第6,266,459号;第6,355,431号;第6,770,441号;第6,859,570号;第6,210,891号;第6,258,568号;以及第6,274,320号;美国专利申请公开第2009/0026082号;第2009/0127589号;第2010/0137143号;第2010/0282617号;以及pct专利申请公开第wo 00/063437号和第wo 2016/162309号,其各自的全部内容通过引用并入本文。
[0457]
(i)用于分析捕获的阵列
[0458]
在一些实施例中,阵列中的一些或全部捕获点包括捕获探针。在一些实施例中,阵列可以包括直接或间接附着于基底的捕获探针。
[0459]
捕获探针包括捕获域(例如,核苷酸序列),其可以特异性结合(例如,杂交)到样品内的靶分析物(例如,mrna、dna或蛋白质)。在一些实施例中,捕获探针与靶标的结合(例如,杂交)通过检测已并入靶标中的视觉信号(例如,荧光团、重金属(例如,银离子)或化学发光标记)来检测和定量。在一些实施例中,视觉信号的强度与生物样品中每种分析物的相对丰度相关。由于阵列可以包含数千或数百万个(或更多)捕获探针,因此具有捕获探针的捕获点阵列可以并行询问许多分析物。
[0460]
在一些实施例中,基底包括设计用于从一种或多种生物体捕获分析物的一种或多种捕获探针。在非限制性实例中,基底可以包含一种或多种设计用于从一种生物体(例如,人类)捕获mrna的捕获探针和一种或多种设计用于从第二种生物体(例如,细菌)捕获dna的捕获探针。
[0461]
可以使用各种技术将捕获探针附着于基底或捕获点。在一些实施例中,捕获探针直接附着于固定在阵列上的捕获点。在一些实施例中,通过化学固定将捕获探针固定到基底上。例如,化学固定可以发生在基底上的官能团和捕获探针上的相应功能元件之间。捕获探针中的示例性相应功能元件可以是捕获探针的固有化学基团,例如羟基,或者功能元件可以被引入到捕获探针上。基底上的官能团的实例是胺基。在一些实施例中,待固定的捕获探针包括胺官能团或被化学修饰以包括胺官能团。这种化学修饰的手段和方法是本领域公知的。
[0462]
在一些实施例中,捕获探针是核酸。在一些实施例中,捕获探针通过其5'端固定在捕获点或基底上。在一些实施例中,捕获探针通过其5'端固定在捕获点或基底上,并且从5'至3'端包括:一个或多个条形码(例如,空间条形码和/或umi)和一个或多个捕获域。在一些实施例中,捕获探针通过其5'端固定在捕获点上,并且从5'至3'端包括:一个条形码(例如,空间条形码或umi)和一个捕获域。在一些实施例中,捕获探针通过其5'端固定在捕获点或
基底上,并且从5'至3'端包括:切割域、功能域、一个或多个条形码(例如,空间条形码和/或umi),以及捕获域。
[0463]
在一些实施例中,捕获探针通过其5'端固定在捕获点或基底上,并且从5'至3'端包括:切割域、功能域、一个或多个条形码(例如,空间条形码和/或umi)、第二功能域和捕获域。在一些实施例中,捕获探针通过其5'端固定在捕获点或基底上,并且从5'至3'端包括:切割域、功能域、空间条形码、umi和捕获域。在一些实施例中,捕获探针通过其5'端固定在捕获点或基底上,并且不包括空间条形码。在一些实施例中,捕获探针通过其5'端固定在捕获点或基底上,并且不包括umi。在一些实施例中,捕获探针包括用于引发测序反应的序列。
[0464]
在一些实施例中,捕获探针通过其3'端固定在捕获点或基底上。在一些实施例中,捕获探针通过其3'端固定在捕获点或基底上,并且从3'至5'端包括:一个或多个条形码(例如,空间条形码和/或umi)和一个或多个捕获域。在一些实施例中,捕获探针通过其3'端固定在捕获点或基底上,并且从3'至5'端包括:一个条形码(例如,空间条形码或umi)和一个捕获域。在一些实施例中,捕获探针通过其3'端固定在捕获点或基底上,并且从3'至5'端包括:切割域、功能域、一个或多个条形码(例如,空间条形码和/或umi),以及捕获域。在一些实施例中,捕获探针通过其3'端固定在捕获点或基底上,并且从3'至5'端包括:切割域、功能域、空间条形码、umi和捕获域。
[0465]
待固定的捕获探针内的官能团的定位可用于控制和塑造捕获探针的结合行为和/或取向,例如,官能团可置于捕获探针的5'或3'端或捕获探针的序列内。在一些实施例中,捕获探针可以进一步包括支持物(例如,附着于捕获探针的支持物、附着于捕获点的支持物,或附着于基底的支持物)。待固定的捕获探针的典型支持物包括能够结合到这种捕获探针的部分,例如结合到胺官能化的核酸。这种支持物的实例是羧基、醛或环氧支持物。
[0466]
在一些实施例中,其上可固定捕获探针的基底可以被化学激活,例如通过激活基底上可用的官能团。术语“激活基底”涉及其中通过化学改性程序建立或使能相互作用或反应性化学官能团的材料。例如,包括羧基的基底可以在使用前激活。此外,某些基底包含可以与捕获探针中已存在的特定部分反应的官能团。
[0467]
在一些实施例中,使用共价键将捕获探针直接偶联到基底上。在一些实施例中,捕获探针通过将捕获探针的“第一”核苷酸与支持物分离的接头(即化学接头)间接偶联到基底。在一些实施例中,捕获探针不直接与阵列结合,而是间接相互作用,例如通过与本身直接或间接与阵列结合的分子结合。在一些实施例中,捕获探针间接附着于基底(例如,通过包括聚合物的溶液)。
[0468]
在一些实施例中,当捕获探针间接固定在阵列的捕获点上时,例如通过与能够结合捕获探针的表面探针杂交,捕获探针可以进一步包括能够与表面探针的5'端杂交的上游序列(与核酸,例如组织样品的rna杂交的序列的5')。单独地,捕获探针的捕获域可以被视为捕获域寡核苷酸,其可用于其中捕获探针间接固定在阵列上的实施例中的捕获探针的合成。
[0469]
在一些实施例中,基底由惰性材料或基质(例如,载玻片)组成,该惰性材料或基质已经通过例如用包含能够固定捕获探针的反应性基团的材料处理而官能化。参见,例如,wo 2017/019456,其全部内容通过引用并入本文。非限制性实例包括支撑在惰性基底(例如,载玻片;参见wo 2005/065814和美国专利申请第2008/0280773,其全部内容通过引用并入本
文)上的聚丙烯酰胺水凝胶。
[0470]
在一些实施例中,使用共价方法将官能化生物分子(例如,捕获探针)固定在官能化基底上。共价附着的方法包括,例如,胺和激活的羧酸酯(例如,n-羟基琥珀酰亚胺酯)的缩合;胺和醛在还原胺化条件下的缩合;以及环加成反应,如狄尔斯-阿德尔[4 2]反应、1,3-偶极环加成反应和[2 2]环加成反应。共价附着的方法还包括例如点击化学反应,包括[3 2]环加成反应(例如,huisgen 1,3-偶极环加成反应和铜(i)催化的叠氮化物-炔烃环加成(cuaac));硫醇-烯反应;狄尔斯-阿尔德反应和逆电子需求狄尔斯-阿尔德反应;异腈和四嗪的[4 1]环加成;以及小碳环的亲核开环(例如,用氨基寡核苷酸的环氧化物开环)。共价附着的方法还包括例如马来酰亚胺和硫醇;以及对硝基苯酯官能化的寡核苷酸和聚赖氨酸官能化的基底。共价附着的方法还包括例如二硫化物反应;自由基反应(参见,例如,美国专利第5,919,626号,其全部内容通过引用并入本文);以及酰肼官能化的基底(例如,其中酰肼官能团直接或间接附着于基底)和醛官能化的寡核苷酸(参见,例如,yershov等人(1996)《美国国家科学院院刊(proc.natl.acad.sci.usa)》93,4913-4918,其全部内容通过引用并入本文)。
[0471]
在一些实施例中,使用光化学共价方法将官能化生物分子(例如,捕获探针)固定在官能化基底上。光化学共价附着的方法包括,例如,固定蒽醌缀合的寡核苷酸(参见,例如,koch等人,2000,《生物共轭化学(bioconjugate chem.)》11,474-483,其全部内容通过引用并入本文)。
[0472]
在一些实施例中,使用非共价方法将官能化生物分子(例如,捕获探针)固定在官能化基底上。用于非共价附着的方法包括,例如,生物素官能化的寡核苷酸和链霉抗生物素蛋白处理的基底(参见,例如,等人(1993)《分析生物化学(analytical biochemistry)》209,278-283和gilles等人(1999)《自然生物技术(nature biotechnology)》17,365-370,其全部内容通过引用并入本文)。
[0473]
在一些实施例中,可以根据美国专利第6,737,236号、第7,259,258号、第7,375,234号、第7,427,678号、第5,610,287号、第5,807,522号、第5,837,860号和第5,472,881号;美国专利申请公开第2008/0280773号和第2011/0059865号;shalon等人(1996)《基因组研究(genome research)》,639-645;rogers等人(1999)《分析生物化学》266,23-30;stimpson等人(1995)《美国国家科学院院刊(proc.natl.acad.sci.usa)》92,6379-6383;bettie等人(1995)《临床化学(clin.chem.)》45,700-706;lamture等人(1994)《核酸研究》22,2121-2125;beier等人(1999)《核酸研究》27,1970-1977;joos等人(1997)《分析生物化学》247,96-101;nikiforov等人(1995)《分析生物化学》227,201-209;timofeev等人(1996)《核酸研究》24,3142-3148;chrisey等人(1996)《核酸研究》24,3031-3039;guo等人(1994)《核酸研究》22,5456-5465;running和urdea(1990)《生物技术(biotechniques)》8,276-279;fahy等人(1993)《核酸研究》21,1819-1826;zhang等人(1991)19,3929-3933;和rogers等人(1997)《基因治疗(gene therapy)》4,1387-1392中阐述的方法将寡核苷酸(例如,捕获探针)附着于基底或捕获点。上述每篇文献的全部内容通过引用并入本文。
[0474]
在一些实施例中,基底的表面涂有细胞允许涂层以促进活细胞的粘附。“细胞允许涂层”是允许或帮助细胞在基底上维持细胞活力(例如,保持存活)的涂层。例如,细胞允许涂层可以增强细胞附着、细胞生长和/或细胞分化,例如,细胞允许涂层可以向活细胞提供
营养物。细胞允许涂层可以包括生物材料和/或合成材料。细胞允许涂层的非限制性实例包括以一种或多种细胞外基质(ecm)组分(例如,蛋白聚糖和纤维状蛋白质,如胶原蛋白、弹性蛋白、纤连蛋白和层粘连蛋白)、聚赖氨酸、聚l-鸟氨酸和/或生物相容性硅酮(例如,)为特征的涂层。例如,包括一种或多种细胞外基质组分的细胞允许涂层可以包括i型胶原蛋白、ii型胶原蛋白、iv型胶原蛋白、弹性蛋白、纤连蛋白、层粘连蛋白和/或玻连蛋白。在一些实施例中,细胞允许涂层包括从engelbreth-holm-swarm(ehs)小鼠肉瘤(例如,)中提取的溶解的基膜制品。在一些实施例中,细胞允许涂层包括胶原蛋白。
[0475]“有条件地可去除的涂层”是在施加脱模剂时可以从基底表面去除的涂层。在一些实施例中,有条件地可去除的涂层包括水凝胶,如于2020年8月13日提交的题为《用于使用单元型的空间分布来确定生物学状况的系统和方法》的美国专利申请第16/992,569号中进一步详细描述的。
[0476]
(ii)以阵列形式生成捕获探针。
[0477]
可以通过多种方法制备阵列。在一些实施例中,通过在阵列上合成(例如,原位合成)寡核苷酸,或通过喷射印刷或平版印刷制备阵列。例如,可以通过光刻法或固相dna合成实现高密度dna寡核苷酸的光定向合成。为了实施光刻合成,可以将用光化学保护基团改性的合成接头附着于基底,并且可以使用光刻掩模(施加到基底的特定区域)和光来改性光化学保护基团,从而产生具有局部光脱保护的阵列。这些方法中的许多是本领域已知的,并且描述于例如miller等人,2009,《微阵列的基本概念和在临床微生物学中的潜在应用(basic concepts of microarrays and potential applications in clinical microbiology)》,《临床微生物学评述(clinical microbiology reviews)》22.4,611-633;us201314111482a;us9593365b2;us2019203275;和wo2018091676中,其各自通过引用整体并入本文。
[0478]
(1)点样或印刷
[0479]
在一些实施例中,用寡核苷酸“点样”或“印刷”阵列,然后将这些寡核苷酸(例如,捕获探针)附着于基底。可以通过非接触或接触印刷施加寡核苷酸。非接触打印机可以使用与计算机打印机相同的方法(例如,气泡喷射或喷墨)来将探针溶液的小液滴喷射到基底上。专用的喷墨样打印机可以将纳升到皮升体积的寡核苷酸溶液液滴而不是油墨喷射到基底上。在接触印刷中,每个印刷针将寡核苷酸溶液直接施加到表面上的特定位置上。寡核苷酸可以通过dna磷酸主链的负电荷与基底表面的带正电荷的涂层的静电相互作用或通过dna中的胸苷碱基与处理过的基底表面上的胺基之间的uv交联共价键附着于基底表面。在一些实施例中,基底是载玻片。在一些实施例中,寡核苷酸(例如,捕获探针)通过与化学基质(例如,环氧基-硅烷、氨基-硅烷、赖氨酸、聚丙烯酰胺等)的共价键附着于基底。
[0480]
(2)原位合成
[0481]
阵列也可以通过原位合成制备。在一些实施例中,这些阵列可以使用光刻法制备。光刻法通常依赖于基底上的uv掩蔽和光导向的组合化学合成,以选择性地直接在阵列的表面上合成探针,每个点一次一个核苷酸,同时用于多个点。在一些实施例中,基底包含共价接头分子,其在自由端具有可以通过光去除的保护基团。uv光被引导通过光刻掩模,以用羟基去保护和激活所选择的位点,该羟基引发与附着于激活位点的引入的受保护核苷酸的偶
联。以这样的方式设计掩模,使得可以选择暴露位点,并因此指定阵列上每个核苷酸可以附着的坐标。可以重复该过程,施加新的掩模,激活不同组的位点并偶联不同的碱基,从而允许在每个位点构建任意的寡核苷酸。该方法可用于合成数十万种不同的寡核苷酸。在一些实施例中,可以使用无掩模阵列合成器技术。其使用可编程微镜阵列来产生反射所需图案的uv光以使特征脱保护的数字掩模。
[0482]
在一些实施例中,喷墨点样方法也可用于原位寡核苷酸合成。不同的核苷酸前体加上催化剂可以印刷在基底上,然后与偶联和脱保护步骤结合。该方法依赖于在重复的逐碱基印刷循环中在阵列表面上印刷皮升体积的核苷酸,从而延长阵列上寡核苷酸探针的长度。
[0483]
(3)电场
[0484]
也可以通过电场的主动杂交来制备阵列以控制核酸转运。当将正电流施加到阵列上的一个或多个测试位点时,带负电荷的核酸可被转运到特定位点或捕获点。阵列的表面可能包含结合分子,例如链霉抗生物素蛋白,其允许一旦电子寻址的生物素化探针到达其靶向位置就形成键(例如,链霉抗生物素蛋白-生物素键)。然后从活性捕获点去除正电流,并且可以通过正电流的目标应用来激活新的测试位点。重复该过程直到覆盖阵列上的所有位点。
[0485]
可以通过如本文所述的各种方法生成用于空间分析的阵列。在一些实施例中,阵列具有多个包含空间条形码的捕获探针。可以确定这些空间条形码及其与阵列上的位置的关系。在一些情况下,这样的信息是容易获得的,因为寡核苷酸以预定的图案点样、印刷或合成在阵列上。在一些情况下,该空间条形码可以通过本文描述的方法来解码,例如通过原位测序、通过与这些空间条形码相关联的各种标签等。在一些实施例中,阵列可以使用模板来生成子阵列。因此,空间条形码可以以已知的图案转移到子阵列。
[0486]
(4)连接
[0487]
在一些实施例中,包含条形码探针的阵列可以通过多个寡核苷酸的连接生成。在一些情况下,多个寡核苷酸包含条形码的一部分,并且在连接多个寡核苷酸时生成完整的条形码。例如,可以将包含条形码的第一部分的第一寡核苷酸附着于基底(例如,使用本文所述的将寡核苷酸附着于基底的任何方法),并且然后可以将包含条形码的第二部分的第二寡核苷酸连接到第一寡核苷酸上以生成完整的条形码。条形码的第一、第二和任何附加部分的不同组合可用于增加条形码的多样性。在第二寡核苷酸也在连接之前附着于基底的情况下,第一寡核苷酸和/或第二寡核苷酸可以通过包含切割位点的表面接头附着于基底。连接后,连接的寡核苷酸通过在切割位点切割而线性化。
[0488]
为了增加条形码的多样性,可以将包含两个或更多个不同条形码序列的多个第二寡核苷酸连接到包含相同条形码序列的多个第一寡核苷酸上,从而生成两种或更多种不同种类的条形码。为了实现选择性连接,最初可以用保护基团(例如,光可切割的保护基团)保护附着于包含条形码的第一部分的基底的第一寡核苷酸,并且可以在第一寡核苷酸和第二寡核苷酸之间连接之前去除保护基团。在阵列上的条形码探针是通过连接两个或多个寡核苷酸生成的情况下,可以将寡核苷酸的浓度梯度施加到基底上,使得寡核苷酸的不同组合根据其在基底上的位置掺入到条形码探针中。
[0489]
可以通过夹板寡核苷酸将额外的寡核苷酸直接连接到现有的寡核苷酸上来生成
探针。在一些实施例中,现有阵列上的寡核苷酸可以包括可以与夹板寡核苷酸杂交的识别序列。识别序列可以在现有阵列上的寡核苷酸的游离5'端或游离3'端。可用于本公开的方法的识别序列可以不包含限制性酶识别位点或二级结构(例如,发夹),并且可包括高含量的鸟嘌呤和胞嘧啶核苷酸。
[0490]
(5)聚合酶
[0491]
阵列上的条形码探针也可以通过向阵列上的现有寡核苷酸添加单个核苷酸来生成,例如,使用以模板非依赖性方式起作用的聚合酶。可以将单个核苷酸以浓度梯度添加到现有的寡核苷酸中,从而生成具有不同长度的探针,这取决于探针在阵列上的位置。
[0492]
(6)现有捕获探针的修饰
[0493]
也可以通过修饰现有的阵列来制备阵列,例如,通过修饰附着于阵列的寡核苷酸。例如,可以在包含寡核苷酸的阵列上生成探针,该寡核苷酸在3'端附着于阵列并具有游离的5'端。寡核苷酸可以是原位合成的寡核苷酸,并且可以包括条形码。寡核苷酸的长度可以小于50个核苷酸(nts)(例如,小于45、40、35、30、25、20、15或10个nts)。为了使用这些寡核苷酸生成探针,与寡核苷酸的一部分(例如,寡核苷酸共有的恒定序列)互补的引物可用于与寡核苷酸杂交并延伸(使用寡核苷酸作为模板)以形成双链体并产生3'突出端。因此,3'突出端允许将额外的核苷酸或寡核苷酸添加到双链体上。捕获探针可以通过例如将一个或多个寡核苷酸添加到3'突出端的端部(例如,通过夹板寡核苷酸介导的连接)来生成,其中添加的寡核苷酸可以包括捕获域的序列或序列的一部分。
[0494]
在一些实施例中,根据wo 2012/140224、wo 2014/060483、wo 2016/162309、wo 2017/019456、wo 2018/091676和wo 2012/140224以及美国专利申请第2018/0245142号中阐述的方法制备阵列。上述文献的全部内容通过引用并入本文。
[0495]
在一些实施例中,阵列上的捕获点包括珠。在一些实施例中,将两个或更多个珠分散在基底上以产生阵列,其中每个珠是阵列上的捕获点。可以任选地将珠分散到基底上的孔中,例如使得每孔仅容纳单个珠。
[0496]
在美国专利申请第16/992,569号、美国专利公开第20110059865a1号、美国临时专利申请第62/839,346号、美国专利公开第9,012,022号和pct公开第202020176788a1号题为《利用空间条形码寡核苷酸阵列对生物分析物进行分析》中描述了关于珠、珠阵列、珠性质(例如,结构、材料、构造、交联、降解、试剂和/或光学性质),以及用于将珠共价和非共价结合到基底的其它细节和非限制性实施例,其各自通过引用整体并入本文。
[0497]
(i)捕获点大小
[0498]
阵列上的捕获点可以是各种大小。在一些实施例中,阵列的捕获点具有1μm至100μm之间的直径或最大尺寸。在一些实施例中,阵列的捕获点具有1μm至10μm、1μm至20μm、1μm至30μm、1μm至40μm、1μm至50μm、1μm至60μm、1μm至70μm、1μm至80μm、1μm至90μm、90μm至100μm、80μm至100μm、70μm至100μm、60μm至100μm、50μm至100μm、40μm至100μm、30μm至100μm、20μm至100μm,或10μm至100μm之间的直径或最大尺寸。在一些实施例中,捕获点的直径或最大尺寸为30μm至100μm、40μm至90μm、50μm至80μm、60μm至70μm,或所公开的子范围内的任何范围。在一些实施例中,捕获点的直径或最大尺寸不大于95μm、90μm、85μm、80μm、75μm、70μm、65μm、60μm、55μm、50μm、45μm、40μm、35μm、30μm、25μm、20μm、15μm、14μm、13μm、12μm、11μm、10μm、9μm、8μm、7μm、6μm、5μm、4μm、3μm、2μm或1μm。在一些实施例中,捕获点的直径或最大尺寸
为约65μm。
[0499]
在一些实施例中,多个捕获点的平均直径或平均最大尺寸在1μm至100μm之间。例如,在1μm至10μm、1μm至20μm、1μm至30μm、1μm至40μm、1μm至50μm、1μm至60μm、1μm至70μm、1μm至80μm、1μm至90μm、90μm至100μm、80μm至100μm、70μm至100μm、60μm至100μm、50μm至100μm、40μm至100μm、30μm至100μm、20μm至100μm,或10μm至100μm之间。在一些实施例中,多个捕获点的平均直径或平均最大尺寸为30μm至100μm、40μm至90μm、50μm至80μm、60μm至70μm,或所公开的子范围内的任何范围。在一些实施例中,多个捕获点的平均直径或平均最大尺寸不大于95μm、90μm、85μm、80μm、75μm、70μm、65μm、60μm、55μm、50μm、45μm、40μm、35μm、30μm、25μm、20μm、15μm、14μm、13μm、12μm、11μm、10μm、9μm、8μm、7μm、6μm、5μm、4μm、3μm、2μm或1μm。在一些实施例中,多个捕获点具有约65μm的平均直径或平均最大尺寸。
[0500]
在一些实施例中,当捕获点是珠时,珠可以具有不大于100μm的直径或最大尺寸(例如,不大于95μm、90μm、85μm、80μm、75μm、70μm、65μm、60μm、55μm、50μm、45μm、40μm、35μm、30μm、25μm、20μm、15μm、14μm、13μm、12μm、11μm、10μm、9μm、8μm、7μm、6μm、5μm、4μm、3μm、2μm或1μm)。
[0501]
在一些实施例中,多个珠的平均直径不大于100μm。在一些实施例中,多个珠的平均直径或最大尺寸不大于95μm、90μm、85μm、80μm、75μm、70μm、65μm、60μm、55μm、50μm、45μm、40μm、35μm、30μm、25μm、20μm、15μm、14μm、13μm、12μm、11μm、10μm、9μm、8μm、7μm、6μm、5μm、4μm、3μm、2μm或1μm。
[0502]
在一些实施例中,珠的体积可以为至少约1μm3,例如至少1μm3、2μm3、3μm3、4μm3、5μm3、6μm3、7μm3、8μm3、9μm3、10μm3、12μm3、14μm3、16μm3、18μm3、20μm3、25μm3、30μm3、35μm3、40μm3、45μm3、50μm3、55μm3、60μm3、65μm3、70μm3、75μm3、80μm3、85μm3、90μm3、95μm3、100μm3、125μm3、150μm3、175μm3、200μm3、250μm3、300μm3、350μm3、400μm3、450μm3、μm3、500μm3、550μm3、600μm3、650μm3、700μm3、750μm3、800μm3、850μm3、900μm3、950μm3、1000μm3、1200μm3、1400μm3、1600μm3、1800μm3、2000μm3、2200μm3、2400μm3、2600μm3、2800μm3、3000μm3或更大。
[0503]
在一些实施例中,珠的体积可以在约1μm3至100μm3之间,如约1μm3至10μm3之间、约10μm3至50μm3之间,或约50μm3至100μm3之间。在一些实施例中,珠可以包括约100μm3至1000μm3之间,如约100μm3至500μm3之间或约500μm3至1000μm3之间的体积。在一些实施例中,珠可以包括约1000μm3至3000μm3之间,如约1000μm3至2000μm3之间或约2000μm3至3000μm3之间的体积。在一些实施例中,珠可以包括约1μm3至3000μm3之间,如约1μm3至2000μm3之间、约1μm3至1000μm3之间、约1μm3至500μm3之间或约1μm3至250μm3之间的体积。
[0504]
捕获点可以包括一个或多个相同或不同的横截面。在一些实施例中,捕获点可以具有不同于第二横截面的第一横截面。捕获点可以具有至少约0.0001微米、0.001微米、0.01微米、0.1微米或1微米的第一横截面。在一些实施例中,捕获点可以包括至少约1微米(μm)、2μm、3μm、4μm、5μm、6μm、7μm、8μm、9μm、10μm、11μm、12μm、13μm、14μm、15μm、16μm、17μm、18μm、19μm、20μm、25μm、30μm、35μm、40μm、45μm、50μm、55μm、60μm、65μm、70μm、75μm、80μm、85μm、90μm、100μm、120μm、140μm、160μm、180μm、200μm、250μm、300μm、350μm、400μm、450μm、500μm、550μm、600μm、650μm、700μm、750μm、800μm、850μm、900μm、950μm、1毫米(mm)或更大的横截面(例如,第一横截面)。在一些实施例中,捕获点可以包括在约1μm至500μm之间,如在约1μm至100μm之间、在约100μm至200μm之间、在约200μm至300μm之间、在约300μm至400μm之间,
或在约400μm与500μm之间的横截面(例如,第一横截面)。例如,捕获点可以包括在约1μm至100μm之间的横截面(例如,第一横截面)。在一些实施例中,捕获点可以具有至少约1μm的第二横截面。例如,捕获点可以包括至少约1微米(μm)、2μm、3μm、4μm、5μm、6μm、7μm、8μm、9μm、10μm、11μm、12μm、13μm、14μm、15μm、16μm、17μm、18μm、19μm、20μm、25μm、30μm、35μm、40μm、45μm、50μm、55μm、60μm、65μm、70μm、75μm、80μm、85μm、90μm、100μm、120μm、140μm、160μm、180μm、200μm、250μm、300μm、350μm、400μm、450μm、500μm、550μm、600μm、650μm、700μm、750μm、800μm、850μm、900μm、950μm、1毫米(mm)或更大的第二横截面。在一些实施例中,捕获点可以包括在约1μm至500μm之间,如在约1μm至100μm之间、在约100μm至200μm之间、在约200μm至300μm之间、在约300μm至400μm之间,或在约400μm至500μm之间的第二横截面。例如,捕获点可以包括在约1μm至100μm之间的第二横截面。
[0505]
在一些实施例中,捕获点可以是纳米级的(例如,捕获点可以具有约100纳米(nm)至约900纳米(nm)(例如,850nm或更小、800nm或更小、750nm或更小、700nm或更小、650nm或更小、600nm或更小、550nm或更小、500nm或更小、450nm或更小、400nm或更小、350nm或更小、300nm或更小、250nm或更小、200nm或更小、150nm或更小)的直径或最大横截面尺寸。多个捕获点可以具有约100纳米(nm)至约900纳米(nm)(例如,850nm或更小、800nm或更小、750nm或更小、700nm或更小、650nm或更小、600nm或更小、550nm或更小、500nm或更小、450nm或更小、400nm或更小、350nm或更小、300nm或更小、250nm或更小、200nm或更小、150nm或更小)的平均直径或平均最大横截面尺寸。在一些实施例中,捕获点的直径或大小约为单个细胞(例如,待评估的单个细胞)的大小。
[0506]
捕获点可以具有均匀的大小或不均匀的大小。“多分散性”通常是指分子或颗粒大小的不均匀性。多分散性(pdi)可以使用等式pdi=mw/mn计算,其中mw是重均摩尔质量,mn是数均摩尔质量。在某些实施例中,捕获点可以作为具有相对单分散大小分布的群体或多个捕获点提供。在希望提供相对一致量的试剂的情况下,保持相对一致的捕获点特征(如大小)可有助于整体一致性。
[0507]
在一些实施例中,本文提供的珠可以具有其横截面尺寸的变异系数小于50%、小于40%、小于30%、小于20%、小于15%、小于10%、小于5%或更低的尺寸分布。在一些实施例中,本文提供的多个珠具有小于50%、小于45%、小于40%、小于35%、小于30%、小于25%、小于20%、小于15%、小于10%、小于5%或更低的多分散指数。
[0508]
(ii)捕获点密度
[0509]
在一些实施例中,阵列(例如,二维阵列)包含多个捕获点。在一些实施例中,阵列包括4000至10,000个捕获点,或4000至6000个捕获点中的任何范围。例如,阵列包括4,000至4,400个捕获点、4,000至4,800个捕获点、4,000至5,200个捕获点、4,000至5,600个捕获点、5,600至6,000个捕获点、5,200至6,000个捕获点、4,800至6,000个捕获点或4,400至6,000个捕获点。在一些实施例中,阵列包括4,100至5,900个捕获点、4,200至5,800个捕获点、4,300至5,700个捕获点、4,400至5,600个捕获点、4,500至5,500个捕获点、4,600至5,400个捕获点、4,700至5,300个捕获点、4,800至5,200个捕获点、4,900至5,100个捕获点,或所公开的子范围内的任何范围。例如,阵列可以包括约4,000个捕获点、约4,200个捕获点、约4,400个捕获点、约4,800个捕获点、约5,000个捕获点、约5,200个捕获点、约5,400个捕获点、约5,600个捕获点或约6,000个捕获点。在一些实施例中,阵列包含至少4,000个捕获点。在
一些实施例中,阵列包括大约5,000个捕获点。
[0510]
在一些实施例中,阵列的捕获点可以排列成图案。在一些实施例中,阵列的捕获点的中心距离阵列的另一捕获点的中心在1μm和100μm之间。例如,捕获点的中心距离阵列的另一捕获点的中心在20μm至40μm、20μm至60μm、20μm至80μm、80μm至100μm、60μm至100μm或40μm至100μm之间。在一些实施例中,阵列的捕获点的中心距离阵列的另一捕获点的中心在30μm至100μm、40μm至90μm、50μm至80μm、60μm至70μm之间,或在所公开的子范围内的任何范围。在一些实施例中,阵列的捕获点的中心距离阵列的另一捕获点的中心大约65μm。在一些实施例中,阵列的捕获点的中心距离阵列的另一捕获点的中心在80μm至120μm之间。
[0511]
在一些实施例中,阵列的多个捕获点被均匀地定位。在一些实施例中,阵列的多个捕获点不是均匀定位的。在一些实施例中,阵列的多个捕获点的位置是预定的。在一些实施例中,阵列的多个捕获点的位置不是预定的。
[0512]
在一些实施例中,阵列的多个捕获点的大小和/或形状近似一致。在一些实施例中,阵列的多个捕获点的大小和/或形状基本上不一致。
[0513]
在一些实施例中,阵列约为8mm
×
8mm。在一些实施例中,阵列小于8mm
×
8mm。
[0514]
在一些实施例中,阵列可以是高密度阵列。在一些实施例中,高密度阵列可以排列成图案。在一些实施例中,阵列的高密度图案是通过在一个或多个维度上将捕获点压实或压缩在一起而产生的。在一些实施例中,高密度图案可以通过点印刷或本文所述的其它技术产生。在一些实施例中,阵列的捕获点的中心距离阵列的另一捕获点的中心在80μm至120μm之间。在一些实施例中,阵列的捕获点的中心距离阵列的另一捕获点的中心在85μm至115μm、90μm至110μm、95μm至105μm之间,或在所公开的子范围内的任何范围。在一些实施例中,阵列的捕获点的中心距离阵列的另一捕获点的中心大约100μm。
[0515]
(iii)阵列分辨率
[0516]
如本文所用,“低分辨率”阵列(例如,低分辨率空间阵列)是指具有平均直径为约20微米或更大的捕获点的阵列。在一些实施例中,单个捕获点内基本上所有(例如,80%或更多)的捕获探针包括相同的条形码(例如,空间条形码),使得在解卷积时,来自一种或多种分析物的检测的所得测序数据可以与捕获点的空间条形码相关,从而标识阵列上捕获点的位置,并因此确定生物样品中一种或多种分析物的位置。
[0517]“高分辨率”阵列是指具有平均直径为约1微米至约10微米的捕获点的阵列。捕获点的平均直径的该范围对应于单个哺乳动物细胞的近似直径。因此,高分辨率空间阵列能够在哺乳动物单细胞规模或以下检测分析物。
[0518]
在一些实施例中,可以通过构造具有较小捕获点的阵列来提高阵列的分辨率。在一些实施例中,可以通过增加阵列中的捕获点的数量来提高阵列的分辨率。在一些实施例中,可以通过将捕获点更紧密地堆积在一起来提高阵列的分辨率。例如,与包括1,000个捕获点的阵列相比,包括5,000个捕获点的阵列被确定为提供更高的分辨率(数据未示出)。
[0519]
在一些实施例中,阵列的捕获点可以排列成图案,并且在一些情况下,排列成高密度图案。在一些实施例中,阵列的高密度图案是通过在一个或多个维度上将捕获点压实或压缩在一起而产生的。在一些实施例中,高密度图案可以通过点印刷或本文所述的其它技术产生。与包括1,000个捕获点的阵列相比,当使用包括5,000个捕获点的阵列时,每个细胞的中值基因捕获数和每个细胞的中值umi计数更高(数据未示出)。
[0520]
在一些实施例中,阵列包括捕获点,其中捕获点包括一个或多个捕获探针(例如,本文所述的任何捕获探针)。
[0521]
(e)分析物捕获
[0522]
在本节中,描述了用于捕获分析物的系统和方法的一般方面。各个方法步骤和系统特征可以在许多不同实施例中组合存在;本文所述的具体组合不以任何方式限制步骤和特征的其它组合。
[0523]
通常,当样品与例如包含捕获探针的基底(例如,具有包埋、点样、印刷在基底上的捕获探针的基底或具有包含捕获探针的捕获点(例如,珠、孔)的基底)接触时,可以捕获分析物。
[0524]
如本文所用,样品与包含捕获点的基底的“接触(contact)”、“接触(contacted)”和/或“接触(contacting)”是指任何接触(例如,直接或间接),使得捕获探针可以与来自样品的分析物相互作用(例如,捕获)。例如,基底可以靠近或邻近样品而没有直接的物理接触,但是能够从样品捕获分析物。在一些实施例中,样品与基底直接物理接触。在一些实施例中,样品与基底间接物理接触。例如,液体层可以在样品和基底之间。在一些实施例中,分析物扩散通过液体层。在一些实施例中,捕获探针扩散通过液体层。在一些实施例中,试剂可以通过样品和基底之间的液体层递送。在一些实施例中,间接物理接触可以是在样品和包含具有捕获探针的捕获点的第一基底之间存在第二基底(例如,水凝胶、薄膜、多孔膜)。在一些实施例中,通过第二基底将试剂递送至样品。
[0525]
(i)抗扩散介质/盖
[0526]
为了通过促进分析物向空间标记的捕获探针扩散来提高效率,可以使用抗扩散介质。通常,生物分析物的分子扩散发生在所有方向,包括朝向捕获探针(例如朝向空间条形码阵列)和远离捕获探针(例如进入本体溶液)。增加向空间条形码阵列的扩散减少了分析物从空间条形码阵列的扩散,并增加了捕获探针的捕获效率。
[0527]
在一些实施例中,将样品置于空间条形码基底的顶部,并将抗扩散介质置于样品的顶部。例如,可以将抗扩散介质置于已与样品接触的阵列上。在一些实施例中,抗扩散介质和空间标记的阵列是相同的组分。例如,抗扩散介质可以在抗扩散介质(例如,盖玻片、载片、水凝胶或膜)内或其上包含空间标记的捕获探针。在一些实施例中,将样品置于支持物上,并将抗扩散介质置于样品的顶部。另外,空间条形码捕获探针阵列可以放置在抗扩散介质上的附近。例如,抗扩散介质可以夹在空间标记的阵列和支持物上的样品之间。在一些实施例中,抗扩散介质被设置或点样到样品上。在其它实施例中,抗扩散介质放置在样品附近。
[0528]
通常,抗扩散介质可以是已知限制生物分析物扩散的任何材料。例如,抗扩散介质可以是固体盖(例如,盖玻片或载玻片)。在一些实施例中,抗扩散介质可以由玻璃、硅、纸、水凝胶聚合物整料或其它材料制成。在一些实施例中,载玻片可以是丙烯酸酯化的载玻片。在一些实施例中,抗扩散介质是多孔膜。在一些实施例中,材料可以是天然多孔的。在一些实施例中,材料可以具有蚀刻到固体材料中的孔隙或孔。在一些实施例中,可以控制孔径以最小化靶分析物的损失。在一些实施例中,可以控制膜化学以最小化靶分析物的损失。在一些实施例中,抗扩散介质(即水凝胶)共价附着于固体支持物(即载玻片)。在一些实施例中,抗扩散介质可以是已知限制聚a转录物扩散的任何材料。在一些实施例中,抗扩散介质可以
是已知限制蛋白质扩散的任何材料。在一些实施例中,抗扩散介质可以是已知限制大分子成分扩散的任何材料。
[0529]
在一些实施例中,抗扩散介质包括一种或多种抗扩散介质。例如,一种或多种抗扩散介质可以在使介质与样品接触之前以多种方式组合,包括但不限于涂布、分层或点样。作为另一个实例,可以将水凝胶置于样品上,随后将盖(例如,载玻片)置于水凝胶的顶部。
[0530]
在一些实施例中,施加力(例如,流体压力、超声振动、溶质反差、微波辐射、血管循环或其它电力、机械力、磁力、离心力和/或热力)以控制扩散和增强分析物捕获。在一些实施例中,使用一种或多种力和一种或多种抗扩散介质来控制扩散和增强捕获。例如,离心力和载玻片可以同时使用。力和抗扩散介质的多种组合中的任一种可用于控制或减轻扩散并增强分析物捕获。
[0531]
在一些实施例中,抗扩散介质与空间条形码阵列和样品一起浸没在本体溶液中。在一些实施例中,本体溶液包括透化试剂。在一些实施例中,抗扩散介质包括至少一种透化试剂。在一些实施例中,在抗扩散介质与样品接触之前,将抗扩散介质(即水凝胶)浸泡在透化试剂中。在一些实施例中,抗扩散介质可以包括包含透化缓冲液或试剂的孔(例如,微米孔、纳米孔或皮孔)。在一些实施例中,抗扩散介质可以包括透化试剂。在一些实施例中,抗扩散介质可以包含干燥的试剂或单体,以在将抗扩散介质施加到样品时递送透化试剂。在一些实施例中,在将组分浸没在本体溶液中之前,将抗扩散介质添加到空间条形码阵列和样品组分中。在一些实施例中,在样品已经暴露于透化试剂之后,将抗扩散介质添加到空间条形码阵列和样品组分中。在一些实施例中,透化试剂流过抗扩散介质上方的微流体室或通道。在一些实施例中,流动控制样品接近透化试剂。在一些实施例中,靶分析物扩散出样品并朝向本体溶液,并包埋在空间标记的包埋捕获探针的抗扩散介质中。
[0532]
图13是抗扩散介质的示例性用途的图示。抗扩散介质1302可以与样品1303接触。在图13中,载玻片1304填充有空间条形码捕获探针1306,并且样品1303、1305与阵列1304、1306接触。抗扩散介质1302可以施加到样品1303,其中样品1303夹在抗扩散介质1302和涂覆捕获探针的载片1304之间。当将透化溶液1301施加到样品上时,使用抗扩散介质/盖1302通过减少分析物向外扩散到介质中来引导分析物1305向捕获探针1306迁移。替代地,盖可以包含透化试剂。
[0533]
(ii)捕获条件
[0534]
基底上(或基底上的捕获点上)的捕获探针通过捕获域与释放的分析物相互作用,如别处所述,以捕获分析物。在一些实施例中,执行某些步骤以增强阵列的捕获探针对分析物的转移或捕获。这种修饰的实例包括但不限于调节用于使基底与样品接触的条件(例如,时间、温度、取向、ph水平、样品的预处理等)、使用力来转运分析物(例如,电泳、离心、机械等)、进行扩增反应以增加生物分析物的量(例如,pcr扩增、原位扩增、克隆扩增),和/或使用标记的探针来检测扩增子和条形码。
[0535]
在一些实施例中,通过用透化试剂处理样品来促进分析物的捕获。如果样品不能充分透化,则在基底上捕获的分析物的量可能太低而不能进行充分的分析。相反,如果样品的渗透性太强,则分析物可能从其在样品中的来源扩散开,使得样品中分析物的相对空间关系丧失。因此,期望在透化样品足以获得良好的信号强度的同时仍保持样品中分析物分布的空间分辨率之间的平衡。制备样品以促进的方法是本领域已知的,并且可以根据样品
和如何制备样品(例如,新鲜冷冻、ffpe等)进行修改。
[0536]
(iii)被动捕获方法
[0537]
在一些实施例中,分析物从样品迁移到基底。用于促进迁移的方法可以是被动的(例如,扩散)和/或主动的(例如,核酸的电泳迁移)。被动迁移的非限制性实例可以包括由脱水对象的再水合产生的简单扩散和渗透压。
[0538]
通过扩散的被动迁移使用浓度梯度。扩散是不受束缚的对象朝向平衡的运动。因此,当存在高对象浓度的区域和低对象浓度的区域时,对象(捕获探针、分析物等)移动到浓度较低的区域。在一些实施例中,不受束缚的分析物沿浓度梯度向下移动。
[0539]
在一些实施例中,将不同的试剂添加到样品中,使得样品再水合,同时改善分析物的捕获。在一些实施例中,样品用透化试剂再水合。在一些实施例中,样品用染色溶液(例如,苏木精和曙红染色)再水合。
[0540]
(iv)主动捕获方法
[0541]
在本文所述的任何方法的一些实例中,细胞或样品中的分析物可以被转运(例如,被动地或主动地)到捕获探针(例如,固定到固体表面的捕获探针)。
[0542]
例如,可以使用电场(例如,使用电泳)、压力梯度、流体流动、化学浓度梯度、温度梯度和/或磁场将细胞或样品中的分析物转运到捕获探针(例如,固定的捕获探针)。例如,分析物可以通过例如凝胶(例如,水凝胶基质)、流体或透化的细胞转运到捕获探针(例如,固定的捕获探针)。
[0543]
在一些实例中,可以对分析物施加电泳场以促进分析物朝向捕获探针迁移。在一些实例中,样品接触基底和固定在基底上的捕获探针(例如,载片、盖玻片或珠),并且施加电流以促进带电分析物朝向固定在基底上的捕获探针的定向迁移。电泳组件可用于施加电流,其中细胞或样品与阴极和捕获探针(例如,固定在基底上的捕获探针)接触,并且其中捕获探针(例如,固定在基底上的捕获探针)与细胞或样品和阳极接触。
[0544]
可以进行分析物的电泳转移,同时保持样品中分析物的相对空间排列。因此,由捕获探针(例如,固定在基底上的捕获探针)捕获的分析物保留了细胞或样品的空间信息。
[0545]
在一些实例中,空间可寻址微电极阵列用于捕获探针对至少一种感兴趣的带电分析物进行空间约束捕获。微电极阵列可被配置成包括具有小面积的高密度离散位点,用于施加电场以促进感兴趣的带电分析物的迁移。例如,可以使用空间可寻址微电极阵列在感兴趣区域上执行电泳捕获。
[0546]
(v)感兴趣区域
[0547]
样品可以具有显示可指示疾病存在或疾病表型发展的形态学特征的区域。例如,肿瘤活检样品中特定位点的形态学特征可以指示受试者中癌症的侵袭性、治疗抗性、转移潜力、迁移、分期、诊断和/或预后。肿瘤活组织检查样品定位点处的形态学特征的变化通常与特定位点内细胞中分析物的水平或表达的变化相关,这又可用于提供关于受试者中癌症的侵袭性、治疗抗性、转移潜力、迁移、分期、诊断和/或预后的信息。样品内的被选择用于特定分析的区域或面积(例如,样品中具有感兴趣的形态学特征的区域)通常被描述为“感兴趣区域”。
[0548]
样品中的感兴趣区域可用于分析样品内的特定感兴趣区域,从而将实验和数据收集集中到生物样品的特定区域(而不是整个生物样品)。这导致样品分析的时间效率增加。
[0549]
可以使用各种不同的技术在样品中标识感兴趣区域,例如扩展显微术、明场显微术、暗场显微术、相衬显微术、电子显微术、荧光显微术、反射显微术、干涉显微术和共焦显微术及其组合。例如,可以进行样品的染色和成像以标识感兴趣区域。在一些实例中,感兴趣区域可以对应于细胞架构的特定结构。在一些实施例中,可以在可视化之前将样品染色以提供样品的不同区域之间的对比。可以根据样品的类型和待染色的细胞区域选择染色剂的类型。在一些实施例中,一种以上的染色剂可用于显现样品的不同方面,例如样品的不同区域、特定细胞结构(例如,细胞器)或不同的细胞类型。在其它实施例中,样品可以被可视化或成像而无需对样品染色。
[0550]
在一些实施例中,可以使用一个或多个基准标记,即放置在成像系统的视场中的出现在所产生的图像中的对象,来执行成像。基准标记通常用作参考点或测量尺度。基准标记可以包括但不限于可检测标记,如荧光、放射性、化学发光、量热和比色标记。使用基准标记来稳定和定向样品描述于例如carter等人,2007,《应用光学(applied optics)》46:421-427中,其全部内容通过引用并入本文。
[0551]
在一些实施例中,基准标记可以存在于基底上以提供样品的取向。在一些实施例中,微球可以偶联到基底上,以帮助样品的定向。在一些实例中,偶联到基底上的微球可以产生光信号(例如,荧光)。在另一个实例中,微球可以以特定图案或设计(例如,六边形设计)附着于阵列的一部分(例如,角),以帮助样品在基底上的捕获点阵列上的定向。在一些实施例中,基准标记可以是固定的分子,可检测的信号分子可以与其相互作用以生成信号。例如,标记核酸可以连接或偶联到当经受特定波长(或波长范围)的光时能够发荧光的化学部分。这种标记核酸分子可以在组织样品染色之前、同时或之后与阵列接触以使组织切片可视化或成像。尽管不是必需的,但使用可使用用于检测标记的cdna的相同条件(例如,成像条件)检测的标记可能是有利的。
[0552]
在一些实施例中,包括基准标记以便于组织样品或其图像相对于基底上的固定捕获探针的定向。可以使用用于标记阵列的任何数量的方法,使得仅当组织切片被成像时标记才是可检测的。例如,可以将产生信号的分子(例如,荧光分子)直接或间接固定在基底表面上。标记可以以图案(例如,边缘、一行或多行、一列或多列等)提供在基底上。
[0553]
在一些实施例中,基准标记可以随机地放置在视场中。例如,可以将包含荧光团的寡核苷酸随机印刷、压印、合成或附着于基底上的随机位置处的基底(例如,载玻片)。组织切片可以与基底接触,使得包含荧光团的寡核苷酸接触或接近来自组织切片的细胞或细胞组分(例如,mrna或dna分子)。可以获得基底和组织切片的图像,并且可以确定荧光团在组织切片图像内的位置(例如,通过检查覆盖有荧光团检测的组织切片的光学图像)。在一些实施例中,基准标记可以精确地放置在视场中(例如,在基底上的已知位置处)。在这种情况下,可以将基准标记压印、附着或合成在基底上并与样品接触。通常,拍摄样品和基准标记的图像,并且可以通过观察该图像来确认基准标记在基底上的位置。
[0554]
在一些实例中,基准标记可以围绕该阵列。在一些实施例中,基准标记允许例如镜像的检测。在一些实施例中,基准标记可以完全围绕阵列。在一些实施例中,基准标记可以不完全围绕阵列。在一些实施例中,基准标记标识阵列的角。在一些实施例中,一个或多个基准标记标识阵列的中心。在一些实施例中,基准标记包含图案化的点,其中一个或多个图案化的点基准标记的直径约为100微米。基准标记的直径可以是任何可用的直径,包括但不
限于直径为50微米至500微米。基准标记可以布置成使得一个基准标记的中心距离阵列周围的一个或多个其它基准标记的中心在100微米至200微米之间。在一些实施例中,具有周围基准标记的阵列大约为8mm
×
8mm。在一些实施例中,没有周围基准标记的阵列小于8mm
×
8mm。
[0555]
在一些实施例中,在使样品与空间阵列接触之前对样品进行染色和成像,以选择用于空间分析的样品。在一些实施例中,染色包括应用如上所述的基准标记,包括荧光、放射性、化学发光、量热或比色可检测标记。在一些实施例中,样品的染色和成像允许用户标识用户希望评估的特定样品(或感兴趣区域)。
[0556]
在一些实施例中,查找表(lut)可用于将捕获点的一个属性与另一属性相关联。这些性质包括例如位置、条形码(例如,核酸条形码分子)、空间条形码、光学标记、分子标签和其它性质。
[0557]
在一些实施例中,查找表可以将核酸条形码分子与捕获点相关联。在一些实施例中,捕获点的光学标记可以允许将捕获点与生物颗粒(例如,细胞或细胞核)相关联。捕获点与生物颗粒的缔合可以进一步允许将生物颗粒的核酸分子的核酸序列与生物颗粒的一种或多种物理性质(例如,细胞类型或细胞位置)缔合。例如,基于条形码和光学标记之间的关系,光学标记可用于确定捕获点的位置,从而将捕获点的位置与捕获点的条形码序列相关联。随后的分析(例如,测序)可以将条形码序列与来自样品的分析物相关联。因此,基于位置和条形码序列之间的关系,可以确定生物分析物的位置(例如,在特定类型的细胞中或在样品的特定位置处的细胞中)。
[0558]
在一些实施例中,捕获点可以具有多个附着于其上的核酸条形码分子。多个核酸条形码分子可以包括条形码序列。附着于给定捕获点的多个核酸分子可以具有相同的条形码序列,或两个或更多个不同的条形码序列。不同的条形码序列可用于提供改进的空间定位准确度。
[0559]
在一些实施例中,处理基底以最小化或减少捕获点内或捕获点之间的非特异性分析物杂交。例如,处理可以包括用水凝胶、薄膜和/或膜涂覆基底,其产生对非特异性杂交的物理屏障。可以使用任何合适的水凝胶。例如,可以使用根据美国专利第6,391,937号、第9,512,422号和第9,889,422号以及美国专利公开第u.s.2017/0253918号和第u.s.2018/0052081号中所述方法制备的水凝胶基质。上述每篇文献的全部内容通过引用并入本文。
[0560]
处理可以包括添加反应性的或能够被激活的官能团,使得其在接受刺激后变为反应性的(例如,光反应性的)。处理可以包括用具有使非特异性结合最小化的一种或多种物理性质(例如,机械的、电的、磁的和/或热的)的聚合物进行处理(例如,在某些位置激活基底以允许分析物在那些位置杂交)。
[0561]
在一些实例中,阵列(例如,本文所述的任何示例性阵列)可以仅包含样品的一部分(例如,细胞、特征或感兴趣区域)。在一些实例中,样品仅与阵列(例如,本文所述的任何示例性阵列)的一部分接触。在一些实例中,可以使阵列的一部分失活,使得其不与样品中的分析物相互作用(例如,光学失活、化学失活、热失活或阻断阵列中的捕获探针(例如,使用阻断探针))。在一些实例中,可以从样品中去除感兴趣区域,然后可以使感兴趣区域与阵列(例如,本文所述的任何阵列)接触。可以使用显微外科手术、激光捕获显微解剖、分块、薄片切片机、切片、胰蛋白酶消化、标记和/或荧光辅助细胞分选从样品中去除感兴趣区域。
[0562]
(f)分析捕获的分析物
[0563]
在一些实施例中,在使样品与包括捕获探针的基底接触后,可以任选地进行去除步骤以从基底去除全部或部分样品。在一些实施例中,去除步骤包括样品的细胞的酶促和/或化学降解。例如,去除步骤可以包括用酶(例如,蛋白酶,例如,蛋白酶k)处理样品以从基底去除至少一部分样品。在一些实施例中,去除步骤可以包括组织的消融(例如,激光消融)。
[0564]
在一些实施例中,一种用于从样品(例如,存在于生物样品中)空间检测分析物(例如,检测分析物(例如,生物分析物)的位置)的方法,其包含:(a)任选地对基底上的样品进行染色和/或成像;(b)使基底上的样品透化(例如,向其提供包含透化试剂的溶液);(c)使样品与包含多个捕获探针的阵列接触,其中多个捕获探针中的一个捕获探针捕获生物分析物;以及(d)分析所捕获的生物分析物,从而在空间上检测生物分析物;其中样品完全或部分地从基底中去除。
[0565]
在一些实施例中,样品不从基底中去除。例如,在从基底释放捕获探针(例如,与分析物结合的捕获探针)之前,不从基底去除样品。在一些实施例中,这种释放包含捕获探针从基底上的切割(例如,通过切割域)。在一些实施例中,这种释放不包含从基底释放捕获探针(例如,可以制备与分析物结合的捕获探针的拷贝,并且可以例如通过变性从基底释放拷贝)。在一些实施例中,在与捕获探针结合的分析物从基底上释放之后,在分析之前不从基底上去除样品。在一些实施例中,样品在捕获探针从基底上去除和/或分析结合到捕获探针上的分析物的过程中保留在基底上。在一些实施例中,可以在不使样品经受细胞(例如,透化细胞)的酶促和/或化学降解或组织消融(例如,激光消融)的情况下进行与来自基底的捕获探针结合的分析物的分析。
[0566]
在一些实施例中,样品的至少一部分不从基底去除。例如,在从基底释放捕获探针(例如,与分析物结合的捕获探针)和/或分析与从基底释放的捕获探针结合的分析物之前,一部分样品可以保留在基底上。在一些实施例中,在分析与来自支持物的捕获探针结合的分析物之前,样品的至少一部分不经受细胞(例如,透化细胞)的酶促和/或化学降解或组织的消融(例如,激光消融)。
[0567]
在一些实施例中,一种用于从样品(例如,存在于生物样品中)空间检测分析物(例如,检测分析物(例如,生物分析物)的位置)的方法,其包含:(a)任选地对基底上的样品进行染色和/或成像;(b)使基底上的样品透化(例如,向其提供包含透化试剂的溶液);(c)使样品与包含多个捕获探针的阵列接触,其中多个捕获探针中的一个捕获探针捕获生物分析物;以及(d)分析所捕获的生物分析物,从而在空间上检测生物分析物;其中样品不从基底中去除。
[0568]
在一些实施例中,一种用于从生物样品空间地检测感兴趣的生物分析物的方法,其包含:(a)对支持物上的样品进行染色和成像;(b)向支持物上的样品提供包含透化试剂的溶液;(c)使样品与基底上的阵列接触,其中阵列包含一个或多个捕获探针群,从而允许一个或多个捕获探针群捕获感兴趣的生物分析物;以及(d)分析所捕获的生物分析物,从而在空间上检测感兴趣的生物分析物;其中样品不从支持物上去除。
[0569]
在一些实施例中,该方法进一步包括选择样品中的感兴趣区域以进行空间转录组分析。在一些实施例中,一个或多个捕获探针中的一个或多个包括捕获域。在一些实施例
中,一个或多个捕获探针群中的一个或多个包含唯一分子标识符(umi)。在一些实施例中,一个或多个捕获探针群中的一个或多个包含切割域。在一些实施例中,切割域包含被尿嘧啶-dna糖基化酶、脱嘌呤/脱嘧啶(ap)核酸内切酶(ape1)、u尿嘧啶特异性切除试剂(user)和/或核酸内切酶viii识别和切割的序列。在一些实施例中,一种或多种捕获探针不包含切割域并且不从阵列切割。
[0570]
在来自样品的分析物已经与捕获探针、分析物捕获剂或其它条形码寡核苷酸序列杂交或以其它方式结合之后,根据上文结合基于空间细胞的一般分析方法所述的任何方法,通过测序分析杂交/结合产生的条形码构造以鉴定分析物。
[0571]
在一些实施例中,本文所述的方法可用于评估细胞或样品中随时间推移(例如,在用药剂治疗或不同的分化阶段之前或之后)的分析物水平和/或表达。在一些实例中,本文所述的方法可以在不同的时间点(例如,在用药剂治疗之前或之后、不同的分化阶段、不同的疾病进展阶段、不同的受试者年龄,或在对药剂产生抗性之前或之后)对从受试者获得的多种类似的样品或细胞进行。
[0572]
关于从阵列中取出样品、释放和扩增分析物、分析捕获的分析物(例如,通过测序和/或多路复用),以及分析物信息的空间分辨率(例如,使用查找表)的进一步细节和非限制性实施例描述于2019年8月13日提交的题为《用于使用单元型的空间分布来确定生物学状况的系统和方法》的美国专利申请第16/992,569号,其通过引用并入本文。
[0573]
iii.用于使用基准对齐对分析物进行空间分析的系统和方法的具体实施例
[0574]
本公开还提供了用于分析物的空间分析的方法和系统。下面提供本公开的各种实施例的详细描述和解释。这些实施例是非限制性的并且不排除本领域技术人员从本公开的范围可以想到的任何替代、变化、改变和替换。
[0575]
(a)用于分析物的空间分析的系统
[0576]
图11是绘示了根据一些实现方式的用于分析物的空间分析的示例性非限制性系统的框图。在一些实现方式中,系统1100包括一个或多个处理单元cpu 1102(也称为处理器)、一个或多个网络接口1104、用户接口1106、存储器1112和用于互连这些组件的一个或多个通信总线1114。通信总线1114任选地包括互连并控制系统组件之间的通信的电路(有时称为芯片组)。存储器1112通常包括高速随机存取存储器,如dram、sram、ddr ram、rom、eeprom、闪存、cd-rom、数字多功能盘(dvd)或其它光存储、磁带盒、磁带、磁盘存储或其它磁存储装置、其它随机存取固态存储装置,或可用于存储所需信息的任何其它介质;并且任选地包括非易失性存储器,如一个或多个磁盘存储装置、光盘存储装置、闪存装置或其它非易失性固态存储装置。存储器1112任选地包括远离cpu 1102的一个或多个存储装置。存储器1112或替代地存储器1112内的非易失性存储装置包含非暂时性计算机可读存储介质。应当理解,该存储器1112可以分布在一个或多个计算机上。在一些实现方式中,存储器1112或替代地非暂时性计算机可读存储介质存储以下程序、模块和数据结构或其子集:
[0577]
·
任选的操作系统1116,其包括用于处理各种基本系统服务和用于执行硬件相关任务的过程;
[0578]
·
任选的网络通信模块(或指令)1118,用于将装置1100与其它装置或通信网络连接;
[0579]
·
用于分析物的空间分析的分析模块1120;
[0580]
·
数据结构1122,其包含(i)基底图像1124,该基底图像包含多个像素值1126-1,
……
,1126-n,以及(ii)基底标识符1128;
[0581]
·
多个导出基准点1130-1,
……
,1130-l,以及在基底图像1124中标识的对应坐标1132-1,
……
,1132-l;
[0582]
·
用于基底中的一组捕获点的数据构造1134,该数据构造对于每个捕获点1136-1,
……
,1136-q包含测序读数1138-1-1,
……
,1138-1-m,
……
1138-q-1,
……
,1138-q-t数据,其中序列读数1138包括唯一空间条形码1150(例如,1150-1-1-1)和分析物编码部分1152(例如,1152-1-1-1);以及
[0583]
·
模板库1140,包含多个模板1142-1,
……
1142-q,其分别包含对应的坐标系1144-1,
……
,1144-q、参考基准点1146-1-1,
……
,1146-1-k,1146-q-1,
……
,1146-q-p和对应的坐标1148-1-1,
……
,1148-1-k,1148-q-1,
……
,1146-q-p。
[0584]
在一些实现方式中,用户接口1106包括用于用户与系统1100交互的输入装置(例如,键盘、鼠标、触摸板、跟踪板和/或触摸屏)1110和显示器1108。
[0585]
在一些实现方式中,一个或多个上述标识的元件被存储在一个或多个先前提到的存储器装置中,并且对应于用于执行上述功能的一组指令。上述标识的模块或程序(例如,指令集)不需要被实现为单独的软件程序、过程或模块,并且因此这些模块的各种子集可以在各种实现方式中被组合或以其它方式重新排列。在一些实现方式中,存储器1112任选地存储上述标识的模块和数据结构的子集。此外,在一些实施例中,存储器存储上面没有描述的附加模块和数据结构。在一些实施例中,上述标识的元素中的一个或多个存储在除系统1100之外的计算机系统中,该计算机系统可由系统1100寻址,使得系统1100可以在需要时检索这些数据的全部或一部分。
[0586]
尽管图11示出了示例性系统1100,但该图更多地旨在作为可存在于计算机系统中的各种特征的功能描述,而不是作为本文所述实现的结构示意图。在实践中,并且如本领域普通技术人员所认识到的,单独示出的项目可以被组合并且一些项目可以被分离。
[0587]
(b)用于分析物的空间分析的方法。
[0588]
图10是绘示了用于分析物的空间分析的方法1002的流程图1000。在一些实施例中,该方法发生在具有一个或多个处理器1102和存储由一个或多个处理器1102执行的一个或多个程序的存储器1112的计算机系统1100处。应当理解,存储器可以在单个计算机上、分布在多个计算机上、在一个或多个虚拟机中和/或在云计算体系结构中。
[0589]
参考框1004,所公开的方法包含获得电子形式的数据结构1122,该数据结构包含(i)基底上的样品(例如,图12的切片组织样品1204)的图像1124(例如,来自受试者)和(ii)对基底唯一的基底标识符1128。基底包括多个基准标记和一组捕获点1136。
[0590]
图像可以以任何电子图像文件格式获得,包括但不限于jpeg/jfif、tiff、exif、pdf、eps、gif、bmp、png、ppm、pgm、pbm、pnm、webp、hdr光栅格式、heif、bat、bpg、deep、drw、ecw、fits、flif、ico、ilbm、img、pam、pcx、pgf、jpeg xr、分层图像文件格式、plbm、sgi、sid、cd5、cpt、psd、psp、xcf、pdn、cgm、svg、postscript、pct、wmf、emf、swf、xaml和/或raw。
[0591]
在一些实施例中,使用透射光学显微镜获取图像,并且该图像包含像素值1126的阵列。在一些实施例中,像素值阵列包含至少100、10,000、100,000、1x106、2x106、3x106、5x106、8x106、10x106或15x106个像素值。在一些实施例中,在图像获取之前对样品进行免疫
组织化学处理,并使用荧光显微镜来获取图像。在一些这样的实施例中,使用落射照明模式获取图像,其中从样品的一侧执行照明和检测。在一些这样的实施例中,使用共焦显微术、双光子成像、宽场多光子显微术、单平面照明显微术或薄片荧光显微术获取图像。参见,例如,《用于生物成像的自适应光学(adaptive optics for biological imaging)》,2013,kubby编辑,佛罗里达州波卡拉顿的crc出版社(crc press,boca raton,florida);以及《共焦和双光子显微术:基础、应用和进展(confocal and two-photon microscopy:foundations,applications and advances)》,2002,diaspro编辑,纽约州纽约的wiley liss出版社(wiley liss,new york,new york);以及《生物共焦显微镜手册(handbook of biological confocal microscopy)》,2002,pawley编辑,纽约州纽约的施普林格科学 商业媒体公司(springer science business media,llc),其各自通过引用并入本文。
[0592]
作为说明,图14示出了根据一些实施例的基底上的样品的图像1124的实例。在一些实施例中,基底用于为样品,特别是例如薄组织切片提供支持。在一些实施例中,基底是允许在基底上定位样品、分析物、捕获点和/或捕获探针的支持物。
[0593]
在一些实施例中,使用具有明场和荧光能力的nikon eclipse ti2(tritc)或imagexpress纳米自动细胞成像系统获取图像。在一些实施例中,用具有4x(plan apoλ;na 0.20)、10x(plan apoλ;na0.45)或20x(plan apoλ;na 0.75)物镜的显微镜获取图像。
[0594]
在一些实施例中,图像是彩色图像(例如,3x8比特,2424x2424像素分辨率)。在一些实施例中,图像是单色图像(例如,14比特,2424x2424像素分辨率)。
[0595]
在一些实施例中,图像的曝光时间在2至10毫秒之间。在一些实施例中,在图像获取期间,将样品暴露于波长范围为380至680nm的光源(或等同物)。在一些实施例中,最小捕获分辨率为2.18μm/像素。
[0596]
在一些实施例中,以任何电子颜色模式获得图像,包括但不限于灰度、位图、索引、rgb、cmyk、hsv、lab颜色、双色调和/或多通道。在一些实施例中,对图像进行操作(例如,缝合、压缩和/或展平)。在一些实施例中,图像文件大小在1kb和1mb之间、在1mb和0.5gb之间、在0.5gb和5gb之间、在5gb和10gb之间,或大于10gb。
[0597]
在一些实施例中,图像被表示为包含多个像素的阵列(例如,矩阵),使得阵列(例如,矩阵)中的多个像素中的每个相应像素的位置对应于其在图像中的原始位置。在一些实施例中,图像被表示为包含多个像素的向量,使得向量中的多个像素中的每个相应像素包含与其在图像中的原始位置相对应的空间信息。
[0598]
在一些实施例中,基底可以包含任何合适的支撑材料,包括但不限于玻璃、改性的和/或官能化的玻璃、水凝胶、薄膜、膜、塑料(包括例如丙烯酸树脂、聚苯乙烯、苯乙烯和其它材料的共聚物、聚丙烯、聚乙烯、聚丁烯、聚氨酯、teflon
tm
、环烯烃、聚酰亚胺等)、尼龙、陶瓷、树脂、zeonor、二氧化硅或基于二氧化硅的材料(包括硅和改性硅)、碳、金属、无机玻璃、光纤束和聚合物(如聚苯乙烯、环烯烃共聚物(coc)、环烯烃聚合物(cop)、聚丙烯、聚乙烯和聚碳酸酯)。在一些实施例中,基底可以被印刷、图案化或以其它方式修饰,以包含允许在接触样品(例如,组织切片)时与分析物缔合的捕获点。基底特性、结构和/或修饰的进一步详细的实施例在以上具体实施方式(例如,在ii.基于空间阵列的通用分析方法;(c)基底)中描述。
[0599]
参考图12,在一些实施例中,基底包含捕获区1206,其中捕获区包含用于一种或多
种反应和/或测定的多个条形码捕获点1136,并且其中反应包含用于空间分析的一种或多种组织类型。在一些实施例中,基底包含2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、多于20、多于30、多于40或多于50个用于多种反应和/或测定的捕获区1206。例如,在一些实施例中,基底是包含四个捕获区1206的空间基因表达载片(例如,visium),每个捕获区具有6.5mm x6.5mm的尺寸,使得基底包含用于四种反应和最多四种组织类型的能力。在一些这样的实施例中,每个捕获区包含5,000个条形码捕获点1136,其中每个捕获点的直径是55μm并且两个相应捕获点的中心之间的距离是100μm。参见,10x,2019,《visium空间基因表达解决方案》,其通过引用并入本文。捕获点的其它具体实施例在本公开中详述如下。还可参见,于2019年8月13日提交的题为《用于使用单元型的空间分布来确定生物学状况的系统和方法》的美国临时专利申请第62/886,233号,以及于2019年4月26日提交的题为《组织样品中生物分析物的空间转录组学(spatial transcriptomics of biological analytes in tissue samples)》的美国临时专利申请第62/839,346号,其各自通过引用并入本文。
[0600]
再次参考框1004,获得样品(例如,从受试者)。如上文所定义,在一些实施例中,受试者是哺乳动物,如啮齿动物、小鼠、大鼠、兔、豚鼠、有蹄类动物、马、绵羊、猪、山羊、牛、猫、狗、灵长类动物(例如,人类或非人类灵长类动物);植物,如拟南芥、玉米、高粱、燕麦、小麦、水稻、油菜或大豆;藻类,如莱茵衣藻;线虫,如秀丽隐杆线虫;昆虫,如黑腹果蝇、蚊子、果蝇、蜜蜂或蜘蛛;鱼类,如斑马鱼;爬行动物;两栖动物,如蛙或爪蟾;盘基网柄菌;真菌,如卡氏肺孢子虫、红鳍东方鲀、酵母、酿酒酵母或粟酒裂殖酵母;或恶性疟原虫。这些实施例是非限制性的并且不排除本领域技术人员会想到的任何替代主题的替代。
[0601]
在一些实施例中,样品是组织样品,并且该组织样品是从来源于任何受试者(包括但不限于以上列出的那些受试者)的任何组织和/或器官获得的。在一些实施例中,组织样品从例如心脏、肾脏、卵巢、乳房、淋巴结、脂肪、脑、小肠、胃、肝、四头肌、肺、睾丸、甲状腺、眼睛、舌、大肠、脾和/或乳腺、皮肤、肌肉、隔膜、胰腺、膀胱、前列腺等获得。组织样品可以从健康或不健康的组织(例如,发炎的、肿瘤、癌或其它)获得。组织样品的其它实例示在表1中,并分类在例如10x,2019,《visium空间基因表达解决方案》中,其通过引用并入本文。
[0602]
表1:组织样品的实例
[0603]
生物体组织健康/患病人类脑大脑多形性成胶质细胞瘤人类乳房健康人类乳房浸润性导管癌人类乳房浸润性小叶癌人类心脏健康人类肾健康人类肾肾炎人类大肠结直肠癌人类肺乳头状癌人类淋巴结健康人类淋巴结发炎人类卵巢肿瘤
人类脾脏发炎小鼠脑健康小鼠眼睛健康小鼠心脏健康小鼠肾健康小鼠大肠健康小鼠肝脏健康小鼠肺健康小鼠卵巢健康小鼠四头肌健康小鼠小肠健康小鼠脾脏健康小鼠胃健康小鼠睾丸健康小鼠甲状腺健康小鼠舌头健康大鼠脑健康大鼠心脏健康大鼠肾健康小鼠舌头健康大鼠脑健康大鼠心脏健康大鼠肾健康
[0604]
在一些实施例中,切片组织通过组织切片制备,如以上具体实施方式(例如,在i.引言;(d)生物样品;(ii)制备生物样品;(1)组织切片)中所述。简而言之,在一些实施例中,从样品制备组织的薄切片(例如,使用机械切割装置,如振动切片机,或通过将样品的接触印记施加到合适的基底材料)。在一些实施例中,在切片之前将样品冷冻、固定和/或交联,或包裹在基质(例如,树脂或石蜡块)中,以在切片期间保持样品的完整性。在以上具体实施方式(例如,在i.引言;(d)生物样品;(ii)制备生物样品;(2)冷冻,(3)福尔马林固定和石蜡包埋,(4)固定,和(5)包埋)中提供了样品制备的其它实现方式。例如,参考图3,使用组织切片制备生物样品包含用于空间分析的示例性工作流程的第一步骤301。
[0605]
参考框1006,在一些实施例中,样品是深度为100微米或更小的切片组织样品。在一些实施例中,切片组织样品具有80微米或更小、70微米或更小、60微米或更小、50微米或更小、40微米或更小、30微米或更小,或20微米或更小的深度。在一些实施例中,切片组织样品具有10微米至20微米之间的深度。参见,10x,2019,《visium空间基因表达解决方案》。在一些实施例中,切片组织样品具有1至10微米之间的深度。切片组织样品的其它实施例在以上具体实施方式中提供(例如,在i.引言;(d)生物样品;(ii)制备生物样品;(1)组织切片)。在一些实施例中,组织切片的大小和形状与其所在的基底相似。在一些实施例中,组织切片的大小和形状与其所在的基底不同。在一些实施例中,组织切片覆盖基底的全部或一部分。
例如,图9a绘示了尺寸大致与基底相当的组织切片,使得基底的大部分与组织切片接触。
[0606]
在一些实施例中,基底上的组织切片是单个均匀切片。在一些替代实施例中,多个组织切片在一个基底上。在一些这样的实施例中,基底上的单个捕获区1206可以包含多个组织切片,其中每个组织切片从相同的样品和/或受试者或从不同的样品和/或受试者获得。在一些实施例中,组织切片是单个组织切片,其包含一个或多个不存在细胞的区域(例如,组织中的孔、裂缝或间隙)。因此,在如上所述的一些实施例中,基底上的组织切片的图像可以包含存在组织的区域和不存在组织的区域。
[0607]
参考框1008并如图12所示,在一些实施例中,该组捕获点中的每个相应捕获点1136(i)位于二维阵列中的不同位置处,并且(ii)与来自组织的一种或多种分析物缔合。此外,在这样的实施例中,该组捕获点中的每个相应捕获点由多个空间条形码中的至少一个唯一空间条形码来表征。
[0608]
参考框1010,在一些实施例中,一种或多种分析物包括五种或更多种分析物、十种或更多种分析物、五十种或更多种分析物、一百种或更多种分析物、五百种或更多种分析物、1000种或更多种分析物、2000种或更多种分析物、2000种至10,000种分析物、5,000种至20,000种分析物,或10,000种至100,000种分析物。
[0609]
参考框1012,在一些实施例中,唯一空间条形码对从集合{1,
…
,1024}、{1,
…
,4096}、{1,
…
,16384}、{1,
…
,65536}、{1,
…
,262144}、{1,
…
,1048576}、{1,
…
,4194304}、{1,
…
,16777216}、{1,
…
,67108864}或{1,
…
,1x10
12
}中选择的唯一预定值进行编码。
[0610]
参考框1014,在一些实施例中,一种或多种分析物是多种分析物。该组捕获点中的相应捕获点1136包括多个捕获探针。多个捕获探针中的每个捕获探针包括由多种捕获域类型中的一种捕获域类型表征的捕获域。多种捕获域类型中的每种相应捕获域类型被配置成结合多种分析物中的不同分析物。
[0611]
因此,在一些这样的实施例中,每种捕获域类型对应于特定的分析物(例如,特定的寡核苷酸或特定基因的结合部分)。在一些实施例中,多种捕获域类型中的每种捕获域类型被配置成结合相同的分析物(例如,对单个基因的mrna具有特异性结合互补性)或结合不同的分析物(例如,对多个基因的mrna具有特异性结合互补性)。
[0612]
参考框1016,在一些实施例中,多种捕获域类型包含5种至15,000种捕获域类型,并且对于多种捕获域类型中的每种捕获域类型,相应捕获点1136包括至少5个、至少10个、至少100个、至少1000个捕获探针、至少5000个捕获探针或至少10,000个捕获探针。
[0613]
参考框1018,在一些实施例中,一种或多种分析物是多种分析物。该组捕获点中的相应捕获点包括多个捕获探针,多个捕获探针中的每个捕获探针包括由被配置成以无偏方式结合多种分析物中的每种分析物的单一捕获域类型表征的捕获域。因此,在一些这样的实施例中,捕获域包含非特异性捕获部分(例如,寡-dt结合部分)。
[0614]
参考框1020,在一些实施例中,该组捕获点中的每个相应捕获点包含在基底上(例如,基底的基底上)的100微米
×
100微米的正方形内。在一些实施例中,该组捕获点中的每个相应捕获点包含在基底上的50微米
×
50微米的正方形内。在一些实施例中,该组捕获点中的每个相应捕获点包含在基底上的10微米
×
10微米的正方形内。在一些实施例中,该组捕获点中的每个相应捕获点包含在基底上的1微米
×
1微米的正方形内。在一些实施例中,该组捕获点中的每个相应捕获点包含在基底上的0.5微米
×
0.5微米的正方形内。在一些实
施例中,该组捕获点中的每个相应捕获点包含在基底上的0.3微米
×
0.3微米的正方形内。在一些实施例中,该组捕获点中的每个相应捕获点包含在基底上的0.2微米
×
0.2微米的正方形内。
[0615]
参考框1022,在一些实施例中,基底上的该组捕获点中的每个相应捕获点的中心到相邻捕获点之间的距离在300纳米至300微米之间。在一些实施例中,每个相应捕获点的中心到相邻捕获点之间的距离在300纳米至15微米之间、在800纳米至10微米之间,或在2微米至7微米之间。在一些实施例中,每个相应点的中心到相邻捕获点之间的距离在100微米至200微米之间。
[0616]
参考图10b的框1024,在一些实施例中,基底上的该组捕获点中的每个捕获点的形状是闭合形状。在一些实施例中,闭合形状为圆形、椭圆形或n边形,其中n为1至20之间的值。在一些实施例中,闭合形态为六边形。参考框1026,在一些这样的实施例中,闭合形状是圆形的,并且该组捕获点中的每个捕获点具有在25微米至65微米之间的直径。在一些实施例中,闭合形状是圆形或六边形,并且该组捕获点中的每个捕获点具有在30纳米至200微米之间的直径,和/或100微米或更小的直径。在一些实施例中,闭合形状是圆形的,并且该组捕获点中的每个捕获点具有30微米至200微米之间的直径。在一些实施例中,闭合形状是圆形或六边形,并且该组捕获点中的每个捕获点具有0.5微米至60微米之间的直径。参考框1028,在一些实施例中,基底上的该组捕获点中的每个相应捕获点的中心到相邻捕获点之间的距离在40微米至100微米之间。在一些实施例中,基底上的该组捕获点中的每个相应捕获点的中心到相邻捕获点之间的距离在300纳米至300微米之间。在一些实施例中,基底上的该组捕获点中的每个相应点的中心到相邻捕获点之间的距离在700纳米至10微米之间。在一些实施例中,基底上的该组捕获点中的每个相应点的中心到相邻捕获点之间的距离在800纳米至3微米之间。
[0617]
在一些实施例中,阵列的多个捕获点的位置是预定的。在一些实施例中,阵列的多个捕获点的位置不是预定的。在一些实施例中,基底包含基准标记,并且基准标记的位置是预定的,使得它们可以被映射到空间位置。在一些实施例中,基底包含在500至1000之间、在1000至5000之间、在5000和10,000之间、在10,000和15,000之间、在15,000和20,000之间,或在20,000和100,000之间的多个捕获点。在一些实施例中,基底包含1000至5000个捕获点,或4000至100,000个捕获点,其中捕获点以六边形或网格形式排列在基底上。
[0618]
参考框1030,在一些实施例中,该组捕获点中的捕获点1136包含捕获域。参考框1032,在一些实施例中,该组捕获点中的捕获点包含切割域。参考框1034,在一些实施例中,该组点中的每个捕获点直接附着或间接附着于基底。
[0619]
参考框1036,在一些实施例中,每个相应捕获点包括1000个或更多个捕获探针、2000个或更多个捕获探针、10,000个或更多个捕获探针、100,000个或更多个捕获探针、1x106个或更多个捕获探针、2x106个或更多个捕获探针,或5x106个或更多个捕获探针。参考框1038,在一些实施例中,相应捕获点中的每个捕获探针包括聚-a序列或聚-t序列和表征相应捕获点的唯一空间条形码。参考框1040和框1042,在一些实施例中,相应捕获点中的每个捕获探针包括与多个空间条形码相同的空间条形码或不同的空间条形码。
[0620]
捕获域类型、捕获点大小、阵列、探针、空间条形码分析物和/或捕获点的其它特征(包括但不限于尺寸、设计和修改)的许多替代组合也是可能的,并且在上文详细讨论(例
如,在章节(ii)基于空间阵列的通用分析方法);小节(b)捕获探针,(c)基底和(d)阵列)。
[0621]
再次参考框1004,获得作为像素值阵列的图像。例如,参考图3,基底上的组织样品和/或阵列的成像包含用于空间分析的示例性工作流程的第二步骤302。图像可以以任何电子图像文件格式获得,包括但不限于jpeg/jfif、tiff、exif、pdf、eps、gif、bmp、png、ppm、pgm、pbm、pnm、webp、hdr光栅格式、heif、bat、bpg、deep、drw、ecw、fits、flif、ico、ilbm、img、pam、pcx、pgf、jpeg xr、分层图像文件格式、plbm、sgi、sid、cd5、cpt、psd、psp、xcf、pdn、cgm、svg、postscript、pct、wmf、emf、swf、xaml和/或raw。在一些实施例中,像素值阵列包含至少100、10,000、100,000、1x106、2x106、3x106、5x106、8x106、10x106或15x106个像素值。
[0622]
在一些实施例中,以任何电子颜色模式获得图像,包括但不限于灰度、位图、索引、rgb、cmyk、hsv、lab颜色、双色调和/或多通道。在一些实施例中,对图像进行操作(例如,缝合、压缩和/或展平)。在一些实施例中,图像文件大小在1kb和1mb之间、在1mb和0.5gb之间、在0.5gb和5gb之间、在5gb和10gb之间,或大于10gb。
[0623]
在一些实施例中,图像被表示为包含多个像素的阵列(例如,矩阵),使得阵列(例如,矩阵)中的多个像素中的每个相应像素的位置对应于其在图像中的原始位置。在一些实施例中,图像被表示为包含多个像素的向量,使得向量中的多个像素中的每个相应像素包含与其在图像中的原始位置相对应的空间信息。
[0624]
再次参考框1004,被成像的基底包括多个基准标记。在以上具体实施方式(例如,在ii.基于空间阵列的通用分析方法;(c)基底和(e)分析物捕获;(v)感兴趣区域)中更详细地描述了基准标记。简而言之,在一些实施例中,基准标记被包括在基底上作为基底的基底表面上的一个或多个标记。在一些实施例中,基准标记用作将空间信息与感兴趣的分析物的表征相关联的指南。在一些实施例中,使用以下非限制性技术中的任一者在基底上制备基准标记:在玻璃上沉积铬、金纳米颗粒、激光蚀刻、tubewriter-ink、微球、epson 802、hp 65black xl、永久性标记、荧光寡聚物、胺氧化铁纳米颗粒、胺铥掺杂上转换纳米磷光体和/或胺cd基量子点。用于基准标记制备的其它技术包括基底表面的喷砂、印刷、沉积或物理修饰。在一些实施例中,基准标记不直接或间接地与分析物结合。
[0625]
在一些实施例中,基准标记非暂时地附着于基底的外边界(例如,捕获区1206的外边界),并且样品覆盖在基准标记的边界内。在一些实施例中,基准标记暂时地附着于基底的外边界(例如,通过附着连接子、载片支架和/或盖玻片)。在一些实施例中,在样品位于基底上之前或之后,基准标记暂时附着于基底的外边界。在一些实施例中,在样品上之后但在获得图像之前,基准标记暂时或非暂时地附着于基底。
[0626]
图12绘示了根据一些实施例的基底上的组织1204的图像1124,其中该图像包括多个基准标记。基准标记沿着基底的外部边界排列,围绕捕获点阵列和组织覆盖层。在一些这样的实施例中,基准标记包含图案化的点,并且图案化的点指示捕获点阵列的边缘和角。在一些这样的实施例中,在每个角处提供不同图案的基准标记,允许使用任何取向(例如,旋转和/或镜像)将图像与空间信息相关联。
[0627]
在一些实施例中,使用透射光学显微镜获取图像。在一些实施例中,在成像之前使用例如荧光、放射性、化学发光、量热或比色可检测标记对样品进行染色。在一些实施例中,使用活/死染色剂(例如,台盼蓝)对样品进行染色。在一些实施例中,如以上具体实施方式
(例如,在i.引言;(d)生物样品;(ii)制备生物样品;(6)染色)中所指示对样品进行染色。在一些实施例中,使用光学显微镜(例如,明场、暗场、分散染色、相衬、微分干涉对比、干涉反射、荧光、共焦、单平面照明、宽场多光子、解卷积、透射电子显微镜和/或扫描电子显微镜)获取图像。在一些实施例中,在组织切片染色之后但在分析物捕获之前获取图像。在一些实施例中,在图像获取之前对样品进行免疫组织化学处理,并使用荧光显微镜来获取图像。在一些这样的实施例中,使用落射照明模式获取图像,其中从样品的一侧执行照明和检测。在一些这样的实施例中,使用共焦显微术、双光子成像、宽场多光子显微术、单平面照明显微术或薄片荧光显微术获取图像。参见,例如,《用于生物成像的自适应光学(adaptive optics for biological imaging)》,2013,kubby编辑,佛罗里达州波卡拉顿的crc出版社(crc press,boca raton,florida);以及《共焦和双光子显微术:基础、应用和进展(confocal and two-photon microscopy:foundations,applications and advances)》,2002,diaspro编辑,纽约州纽约的wiley liss出版社(wiley liss,new york,new york);以及《生物共焦显微镜手册(handbook of biological confocal microscopy)》,2002,pawley编辑,纽约州纽约的施普林格科学 商业媒体公司(springer science business media,llc),其各自通过引用并入本文。
[0628]
参考图10c的框1044,分析像素值阵列以标识图像的多个导出基准点。参考图10c的框1046,在一些实施例中,这是通过用多个不同的阈值对图像内的像素值阵列进行阈值处理,从而获得多个阈值图像,并在多个阈值图像内标识具有白色值的像素组,从而标识图像内的多个候选导出基准点来执行的。在一个这样的实施例中,对于一个这样的阈值t,如果相应像素
i,j
的强度小于阈值(ii,j《t),则用黑色像素替换图像中的每个相应像素
i,j
,或者如果相应像素
i,j
的强度大于阈值(ii,j》t),则用白色像素替换图像中的每个相应像素
i,j
。在一些实施例中,使用图像自动选择阈值的值。例如参见,sezgin和sankur,2004,《图像阈值技术及量化性能评价综述(survey over image thresholding techniques and quantitative performance evaluation)》,《电子成像杂志(journal of electronic imaging)》13(1),146-165,其公开了用于阈值处理的方法,包括选择合适的阈值处理值,以及阈值处理的类型,包括基于直方图形状的方法。如sezgin和sankur,同上所公开的,合适的阈值处理方法包括但不限于基于直方图形状的阈值处理方法,其中例如分析平滑直方图的峰、谷和曲率。合适的阈值处理方法还包括基于聚类的方法,其中灰度级样品被聚类为背景和前景(对象)两部分,或者替代地被建模为两个高斯的混合。
[0629]
合适的阈值处理方法还包括基于熵的方法,其使用前景和背景区域的熵、原始图像和二值化图像之间的交叉熵等。参见,例如,zhang,2011,《通过人工蜂群方法基于最大tsallis熵的最优多级阈值(optimal multi-level thresholding based on maximum tsallis entropy via an artificial bee colony approach)》,《熵(entropy)13(4):第841至859页,其通过引用并入本文。合适的阈值处理方法还包括基于对象属性的阈值处理方法,该方法搜索灰度级和二值化图像之间的相似性度量,例如模糊形状相似性、边缘重合等。合适的阈值处理方法还包括使用较高阶概率分布和/或像素之间的相关性的空间方法。
[0630]
合适的阈值处理方法还包括使每个像素上的阈值适应局部图像特征的局部方法。在这种局部阈值处理方法中,为图像中的每个像素选择不同的t。
[0631]
因此,如上所述,在一些实施例中,使用几个不同的t值来对图像进行阈值处理,而
在其它实施例中,使用单个t值来对图像进行阈值处理。阈值处理的最终结果是标识多个候选导出基准点。在经典阈值下,这些候选导出基准点是白像素组。然而,本公开不限于此并且本领域技术人员将完全理解,白色和黑色可以颠倒,使得候选导出基准点是黑色像素组。然而,为了便于描述工作流程,候选导出基准点将被认为是由阈值确定的白像素组。
[0632]
图17绘示了包括样品1204和图像周边上的多个候选导出基准点1702的图像1124。在一些实施例中,有5至1000个候选导出基准点1702、5至500个候选导出基准点1702,或5至300个候选导出基准点1702。
[0633]
继续参考图10c的框1046,基于点大小(例如,点大小面积、点大小直径、点大小周长)对多个候选导出基准点进行聚类,从而将多个候选导出基准点分布到多个候选导出基准点子集中。
[0634]
聚类在duda和hart,《模式分类和场景分析(pattern classification and scene analysis)》,1973,纽约约翰威立国际出版公司(john wiley&sons,inc,new york)的第211至256页(下文中称为“duda 1973”)中描述,其通过引用整体并入本文。如duda 1973第6.7节所述,聚类问题是在数据集中发现自然分组之一。为了标识自然分组,解决了两个问题。首先,确定测量两个样品之间的相似性(或不相似性)的方式。该度量(例如,相似性度量)用于确保一个簇中的样品比其它簇中的样品更相似。第二,确定使用相似性度量将数据分区成簇的机制。相似性度量在duda 1973的第6.7节中讨论,其中声明开始聚类研究的一种方式是定义距离函数并计算训练集中所有样品对之间的距离矩阵。如果距离是相似性的良好度量,则同一簇中的参考实体之间的距离将显著小于不同簇中的参考实体之间的距离。然而,如duda 1973的第215页所述,聚类不需要使用距离度量例如,可以使用非度量相似性函数s(x,x')来比较两个向量x和x'。通常,s(x,x')是对称函数,当x和x'以某种方式“相似”时其值较大。在duda 1973的第218页提供了非度量相似性函数s(x,x')的实例。一旦选择了用于测量数据集中的点之间的“相似性”或“不相似性”的方法,则聚类需要测量数据的任何分区的聚类质量的标准函数。使用使标准函数极值化的数据集的分区来对数据进行聚类。参见duda1973第217页。duda 1973第6.8节讨论了标准功能。最近,duda等人,《模式分类(pattern classification)》,第2版,纽约约翰威立国际出版公司,已经出版。第537至563页详细描述了可以根据图10c的框1046使用的聚类。关于合适的聚类技术的更多信息可见于kaufman和rousseeuw,1990,《在数据中查找组:聚类分析简介(finding groups in data:an introduction to cluster analysis)》,纽约州纽约的威立出版社(wiley,new york,n.y.);everitt,1993,《聚类分析(cluster analysis)》(第3版),纽约州纽约的威立出版社;和backer,1995,《聚类分析中的计算机辅助推理(computer-assisted reasoning in cluster analysis)》,新泽西州上鞍河的普伦蒂斯
·
霍尔出版社(prentice hall,upper saddle river,new jersey),其各自通过引用并入本文。可用于本公开的特定示例性聚类技术包括但不限于分级聚类(使用最近邻域算法、最远邻域算法、平均连接算法、质心算法或平方和算法的聚集聚类)、k均值聚类、模糊k均值聚类算法和帕特里克贾维斯(jarvis-patrick)聚类。在一些实施例中,聚类包含无监督聚类,其中不强加当训练集被聚类时应当形成什么簇的预先构想。
[0635]
在一些实施例中,将多个候选导出基准点聚类成两个、三个、四个、五个、六个、七个、八个、九个、十个、十一个、十二个、十三个、十四个、十五个、十六个、十七个、十八个、十
九个或二十个子集。在一些实施例中,将候选导出基准点聚类成两个至100个子集。多个候选导出基准点子集中的候选导出基准点的每个相应子集具有特征大小。例如,在一些实施例中,特征大小是相应子集中每个候选导出基准点中的平均像素数。选择多个候选导出基准点子集中具有最大特征大小的候选导出基准点子集作为图像的多个导出基准点。例如,考虑这样的情况,其中多个候选导出基准点被聚类成两个子集,子集a和子集b,并且子集a中的候选导出基准点的平均大小是49个像素,而子集b中的候选导出基准点的平均大小是58个像素。在这种情况下,子集b中的候选导出基准点将被选作图像的导出基准点,而子集a中的候选导出基准点将作为噪声被丢弃。
[0636]
参考图10d的框1048并进一步参考图17,在一些实施例中,合并在彼此的阈值距离内的各个候选导出基准点对。在一些实施例中,该阈值距离是像素的阈值数量,如一个像素、两个像素、三个像素、四个像素、五个像素、六个像素、七个像素、八个像素、九个像素、十个像素、二十个像素等。在一些实施例中,该阈值距离是点中心之间的阈值距离。例如,在一些实施例中,合并其中心彼此在0.5μm、1μm、2μm、3μm、4μm、5μm、10μm或20μm内的一对相应候选导出基准点。在一些实施例中,得到的合并的候选导出基准点位于合并的原始候选导出基准点对的中间。在图17中,各对候选导出基准点1702-1/1702-2被合并,因为它们未能达到距离阈值。在一些实施例中,将阈值距离滤波器应用于候选导出基准点。在替代实施例中,阈值距离滤波器不应用于候选导出基准点,而是在框1046完成之后应用于导出基准点。
[0637]
参考图10d的框1050,在一些实施例中,过滤掉不能满足最大或最小大小标准的相应候选导出基准点。在一些实施例中,将该大小滤波器应用于候选导出基准点。在替代实施例中,该大小滤波器不应用于候选导出基准点,而是在框1046完成之后应用于导出基准点。在一些实施例中,该大小滤波器的应用使得具有小于50像素、200像素、150像素、100像素、50像素、40像素、35像素、30像素、25像素、20像素、18像素、16像素、14像素、12像素、10像素、9像素、8像素、7像素、6像素、5像素或4像素或更少像素的相应候选导出基准点被丢弃。在一些实施例中,该大小滤波器的应用使得具有多于200像素、150像素、100像素、50像素、40像素、35像素、30像素、25像素、20像素、18像素、16像素、14像素、12像素或10像素的相应候选导出基准点被丢弃。
[0638]
参考图10d的框1052,在一些实施例中,过滤掉不能满足圆度标准的相应候选导出基准点。在一些实施例中,将该圆度滤波器应用于候选导出基准点。在替代实施例中,该圆度不应用于候选导出基准点,而是在框1046完成之后应用于导出基准点。在一些这样的实施例中,各个导出基准点的圆度定义为:
[0639][0640]
其中,“面积”是各个导出基准点的面积,“周长”是各个导出基准点的周长。因此,在这样的实施例中,当该圆度标准落在合适的范围之外时,相应候选导出基准点被认为不是圆形的,并且因此不可能表示基底上的真实基准点,在一些实施例中,真实基准点被印刷为使得它们是圆形的。在一些实施例中,使用用于圆度确定的单轨迹方法来确定每个相应候选导出基准点的圆度。在一些实施例中,使用用于圆度确定的多轨迹方法来确定每个相应候选导出基准点的圆度。
[0641]
在一些实施例中,使用最小二乘参考圆(lsci)方法来确定每个相应候选导出基准点的圆度,其中将参考圆拟合到相应候选导出基准点,使得相应候选导出基准点与该参考圆的偏差的平方和最小。然后用曲线从lsci的最大偏离(即最高峰到最低谷)来表示不圆度。在这样的实施例中,当不圆度超过可接受的阈值时,丢弃相应候选导出基准点。在其它实施例中,使用最小外接圆法、最小区域圆法测量圆度。参见,例如,petrick等人,2009,《测量(measurement)》2009,斯洛伐克斯莫莱尼茨第7届国际会议论文集,第352至355页,其通过引用并入本文。使用所公开的用于计算圆度的任何方法或本领域中已知的用于计算偏心率的任何方法,用于丢弃相应候选导出基准点(或候选导出基准点)的精确阈值是依赖于应用的,并且在许多情况下,针对给定数据集动态地优化。
[0642]
参考图10d的框1054,在一些实施例中,不能满足凸度标准的相应候选导出基准点被丢弃。在一些实施例中,将该凸度滤波器应用于候选导出基准点。在替代实施例中,该凸度滤波器不应用于候选导出基准点,而是在框1046完成之后应用于导出基准点。在一些实施例中,凸度滤波器要求每个相应候选导出基准点落入最小凸度(小于或等于一)和最大凸度之间的范围内。在一些实施例中,各个候选导出基准点的凸度由下式计算:
[0643][0644]
其中,“面积”是各个候选导出基准点的面积,“凸壳面积”是各个导出基准点的凸壳面积。关于凸壳的计算,参见andrew,1979,《二维凸壳的另一种有效算法(another efficient algorithm for convex hulls in two dimensions)》,《信息处理快报(information processing letters)》9(5),第216至219页;和brown,1979,《凸壳的维诺图(voronoi diagrams from convex hulls)》,《信息处理快报》9(5),第223至228页。关于计算凸度的更多信息,请参见《建模和图形中的新兴技术:iem图形处理(emerging technology in modeling and graphics:processing of iem graph)》2018,jyotsna kumar mandal,debika编辑,其通过引用并入本文。在一些实施例中,凸度滤波器要求每个相应候选导出基准点落入0.10、0.15、0.20、0.25、0.30、0.35或0.45的最小凸度与0.95、0.90、0.85、0.80、0.75、0.70、0.65或0.60的最大凸度之间的范围内。
[0645]
参考图10d的框1056,在一些实施例中,不能满足惯性比标准的相应候选导出基准点被丢弃。在一些实施例中,将该惯性比滤波器应用于候选导出基准点。在替代实施例中,该惯性比滤波器不应用于候选导出基准点,而是在框1056完成之后应用于导出基准点。在一些实施例中,惯性比滤波器要求每个相应候选导出基准点落入最小惯性(小于或等于一)和最大惯性之间的范围。关于计算惯性的更多信息,请参见《建模和图形中的新兴技术:iem图形处理》2018,施普林格新加坡,jyotsna kumar mandal,debika编辑,其通过引用并入本文。在一些实施例中,惯性滤波器要求每个相应候选导出基准点落入0.40、0.45、0.50、0.55、0.60、0.65或0.70的最小惯性和1(整圆)的最大惯性之间的范围。
[0646]
参考图10d的框1058,数据结构1122的基底标识符1128用于选择多个模板中的第一模板(例如,响应于将基底标识符发送到远程计算机系统,从远程计算机系统,从多个模板中选择第一模板)。换句话说,当前正被分析的基底的基底标识符用于标识具有匹配基底标识符的模板。例如,参考图11b,在一些实施例中,在模板库1140中找到多个模板。多个模板中的每个模板1142包括至少一个它可以使用的芯片标识符1128,并且包含对应的多个参
考基准点1146的参考位置1148(坐标)和对应的坐标系1144。在一些实施例中,从坐标1148推断坐标系。在一些实施例中,坐标系1144包含芯片基底上的捕获点1136的位置(坐标),其具有与模板1142的基底标识符相匹配的基底标识符1128。
[0647]
在一些实施例中,模板1142由基底打印指令文件(例如,genepix阵列列表(gal)文件)形成,其指定如何在基底上打印阵列捕获点1136。在一些这样的实施例中,分析基底打印指令文件以创建用于每个基底的模板1142,并且当提供匹配的基底标识符1128时提供该模板。关于示例基底打印指令文件的信息,参见zhai,2001,《制作genepix阵列列表(gal)文件(making genepixarray list(gal)files)》,《genepix操作说明书(genepixapplication note)》,美谷分子仪器公司(molecular devices),第1至9页,其通过引用并入本文。图18绘示了从gal文件形成模板1142的实例。
[0648]
参考图10d的框1060,在一些实施例中,第一模板1142的对应的多个参考基准点1146由100个基准点和1000个基准点、200个基准点至800个基准点、300个基准点至700个基准点或500个基准点至600个基准点组成。也就是说,模板1142具有100个基准点至1000个基准点,因为这是对应于模板的基底上的基准点的数量。在一些实施例中,模板1142和对应的基底具有少于100个基准点、少于50个基准点或少于25个基准点。在一些实施例中,模板1142和对应的基底具有多于1000个基准点、多于1500个基准点或多于3000个基准点。图19绘示了在基底周边的基准点的位置。如图19进一步所示,基底还包括捕获点1136,并且模板1142的坐标系1144指定这些捕获点在基底上的位置,并且在一些实施例中,精确地指定在每个捕获点印刷哪些捕获探针。在一些实施例中,每个捕获点印有相同的捕获探针。在其它实施例中,每个捕获点印有一组独立的捕获探针,并且模板1142不仅跟踪每个相应捕获点在基底上的位置,而且跟踪已经印在各个捕获点上的一组独立的捕获探针。在一些实施例中,坐标系1144提供基底上每个捕获点1136的明确位置。在一些实施例中,坐标系1144提供了基底相对于基准点的取向,并且该取向用于参考模板1142外部的数据源中的捕获点位置的列表。本领域技术人员将理解,存在多种方式来实现基于本公开的模板坐标系1144(例如,作为捕获点位置的显式列表,作为从与捕获点位置的外部列表偶联的基准点导出的取向等),并且本公开包括所有这样的方法。
[0649]
参考图10e的框1062,使用对齐算法将图像1124的多个导出基准点1130与第一模板1142的对应的多个参考基准点1146进行对齐,以获得图像1124的多个导出基准点1130与第一模板1142的对应的多个参考基准点1146之间的变换。这是一个点集配准问题,其目的是分配两组点(图像1124的多个导出基准点1130和模板1142的多个参考基准点1146)之间的对应关系和/或恢复将一个点集映射到另一个点集的变换。在一些实施例中,为了确定基底处于八个可能取向中的哪一个(四个90度旋转加上反射),所有八个取向同时运行,并且选择具有最低残差的取向,只要第二最低残差明显更高。
[0650]
参考图10e的框1064,在一些实施例中,图像1124的多个导出基准点1130与模板1142的对应的多个参考基准点1146之间的变换是相似性变换。相似性变换仅允许平移、旋转和各向同性缩放。因此,当使用相似性变换时,图像1124的多个导出基准点1130被旋转、平移和/或各向同性地缩放,以最小化多个导出基准点1130和对应的多个参考基准点1146之间的残差。
[0651]
在一些实施例中,图像1124的多个导出基准点1130和模板1142的对应的多个参考
基准点1146之间的变换是刚性变换。刚性变换仅允许平移和旋转。因此,当使用刚性变换时,图像1124的多个导出基准点1130被旋转和/或平移,以最小化多个导出基准点1130和对应的多个参考基准点1146之间的残差。
[0652]
参考图10e的框1066,在一些实施例中,变换是非刚性变换,其包含图像1124的多个导出基准点1130的各向异性缩放和偏斜,以最小化多个导出基准点1130和对应的多个参考基准点1146之间的残差。参考图10e的框1068,在一些实施例中,非刚性变换是仿射变换。参考图10e的框1070,在一些实施例中,对齐算法是相干点漂移算法。参见,myronenko等人,2007,《刚性点集配准:相干点漂移(non-rigid point set registration:coherent point drift)》,nips,1009-1016;以及myronenko和song,《点集配准:相干点漂移(point set registration:coherent point drift)》,arxiv:0905.2635v1,2009年5月15日,其各自通过引用并入本文,以用于公开相干点漂移算法。在一些实施例中,所使用的相干点漂移算法是python中称为“pycpd”的实现方式。参见,因特网上的github.com/siavashk/pycpd,其通过引用并入本文。
[0653]
参考图10e的框1072,在一些实施例中,对齐算法是迭代最近点算法。参见,例如,chetverikov等人,2002,《修剪迭代最近点算法(the trimmed iterative closest point algorithm)》,用户交互支持的服务机器人目标识别,加拿大魁北克省魁北克市,issn:1051-4651;以及chetverikov等人,2005,《3d点集的鲁棒欧几里德对齐;修剪迭代最近点算法》,《图像与视觉计算(image and vision computing)》23(3),第299至309页,其各自通过引用并入本文。
[0654]
参考图10e的框1074,在一些实施例中,对齐算法是鲁棒点匹配算法(参见,例如,chui和rangarajanb,2003,《一种新的非刚性配准点匹配算法(a new point matching algorithm for non-rigid registration)》,《计算机视觉与图像理解(computer vision and image understanding)》89(2-3),第114至141页,其通过引用并入本文)或薄板样条鲁棒点匹配算法(参见,例如,yang,2011,《薄板样条鲁棒点匹配(tps-rpm)算法:再探讨(the thin plate spline robust point matching(tps-rpm)algorithm:a revisit)》,《模式识别快报(pattern recognition letters)》32(7),第910至918页,其通过引用并入本文。
[0655]
参考图10e的框1076,使用变换和第一模板1142的坐标系1144将图像1124配准到该组捕获点1136。图20和21绘示了。在图20中,对齐引起将图像的基底导出基准点1130映射到模板1142的基准点1148上的变换。在这种映射时,如图21所示,现在可以确定图像1124中每个捕获点1136的位置。
[0656]
参考图10e的框1078,结合如与每个捕获点1136相关联的核酸测序数据(例如,序列读数1138)的空间分析物数据来分析图像1124,从而执行空间核酸分析。在2019年11月21日提交的题为《用于分析物的空间分析的流水线》的62/938,336中公开了用于这种分析的方法,其各自通过引用并入本文。这在图22中示出,在图像上覆盖捕获点之后,可以标识组织的组织样品下的点,并且可以使用例如在本公开中公开的技术以及于2019年8月13日提交的题为《用于使用单元型的空间分布来确定生物学状况的系统和方法》的美国临时专利申请第62/886,233号;于2019年10月1日提交的题为《用于可视化数据集中模式的系统和方法(systems and methods for visualizing a pattern in a dataset)》的62/909,071;于2019年4月26日提交的题为《组织样品中生物分析物的空间转录组学》的62/839,346,以
及于2019年11月21日提交的题为《用于分析物的空间分析的流水线》的62/938,336中详述的技术来分析每个这样的捕获点的核酸测序数据,其各自通过引用并入本文。这种分析在图23中进一步示出,其指定了组织下的捕获点1136用于生成过滤的条形码矩阵,该矩阵用于二次分析,其在图24至35中进一步示出。具体地,图24绘示了如何从已经获得的每个序列读数1136(例如,使用读数1)中提取空间条形码1150和umi,如在2019年4月26日提交的题为《组织样品中生物分析物的空间转录组学》的美国临时申请第62/839,346号中进一步解释的,其通过引用并入本文。图25绘示了序列读数1138如何与参考基因组(例如,使用读数2插入读数)对齐。图26绘示了由于在工作流步骤期间发生的随机片段,序列读数1138如何不全部映射到完全相同的位置,即使它们共享条形码和umi。图27绘示了捕获点中序列读数中的空间条形码是必须如何在已知捕获点空间条形码的列表中的。例如,根据2019年4月26日提交的题为《组织样品中生物分析物的空间转录组学》的美国临时申请第62/839,346号,如果铬单细胞3'v3化学凝胶珠(10x,加利福尼亚州普莱森顿)用于对来自捕获点的分析物进行测序,则每个空间条形码1150必须在铬单细胞3'v3化学凝胶珠中的360万个不同细胞条形码的组中。如图27所示,在一些实施例中,允许条形码中的单个错配。在其它实施例中,不允许空间条形码1150中的错配,并且丢弃具有不在所使用的测序试剂盒(例如,铬单细胞3'v3化学凝胶珠)的空间条形码组的空间条形码1150的序列读数。图28绘示了在一些实施例中,唯一分子标识符(umi)如何用于评估和筛选序列读数1138。因此,参考图29,在一些实施例中,仅使用具有有效空间条形码1150和umi的可靠映射的序列读数1138。在一些实施例中,序列读数的umi被校正为更丰富的umi,它们在序列中是一个错配。在一些实施例中,记录相同rna分子的重复序列读数,并且仅将唯一的umi计数为唯一的rna分子。在这样的实施例中,这些umi计数形成原始特征条形码矩阵。图30进一步绘示了如何结合与每个捕获点1136相关联的核酸测序数据来分析图像1124。在一些实施例中,对原始特征条形码矩阵进行尺寸缩减算法,如主要组分分析,以将g基因缩减到前10个元基因。然后,在pca空间中运行t-sne以生成二维投影。此外,使用pca空间中的基于图形(louvain)和k-均值聚类(k=2
…
10)来标识细胞簇。在一些实施例中,使用sseq(负二项式检验)算法来寻找最唯一地定义每个簇的基因。参见,例如,于2019年10月1日提交的题为《用于可视化数据集中模式的系统和方法》的美国临时申请第62/909,071号,其通过引用并入本文。
[0657]
图31绘示了图像1124的获取如何并行地并结合上述空间测序来运行。图32绘示了根据本公开的一些实施例的这种并行分析的最终结果,其中结合与每个捕获点1136相关联的核酸测序数据来显示图像1124。图33绘示了如何放大核酸测序数据的图像和对应的分析,更多细节参见于2020年9月30日提交的题为《用于标识组织样品中的形态模式的系统和方法(systems and methods for identifying morphological patterns in tissue samples)》的美国申请第17/039,935号,其通过引用并入本文。图34绘示了根据本公开的一些实施例的用于差异表达分析的定制类别和聚类如何可以在结合与每个捕获点1136相关联的核酸测序数据之后作为图像1124的分析的一部分来执行。图35绘示了根据本公开的一些实施例的如何可以结合与每个捕获点1136相关联的核酸测序数据作为图像1124的分析的一部分来执行图像1124的环境中的基因的空间表达。参见,例如,于2019年10月1日提交的题为《用于可视化数据集中模式的系统和方法》的美国临时申请第62/909,071号,其通过引用并入本文。
[0658]
示例性实施例。
[0659]
以下实例提供了制备用于空间分析的序列读数的反应方案。图36还提供了制备用于空间分析的序列读数的反应方案。
[0660]
在本文所述工作流程的一些非限制性实例中,可以将样品浸入100%冷冻的甲醇中并在-20℃下孵育30分钟。20分钟后,可以取出样品并在超纯水中冲洗。冲洗样品后,制备新鲜的曙红溶液,并用异丙醇覆盖样品。将样品在异丙醇中孵育1分钟后,可以通过将载片保持在一定角度来去除试剂,其中载片的底部边缘可以与实验室擦拭物接触并风干。将样品均匀地覆盖在苏木精溶液中并在室温下孵育7分钟。将样品在苏木精中孵育7分钟后,可以通过将载片保持在一定角度来去除试剂,其中载片的底部边缘可以与实验室擦拭物接触。可以将包含样品的载片浸入水中,并且可以去除过量的液体。此后,可以用蓝化缓冲液覆盖样品,并在室温下孵育2分钟。将包含样品的载片再次浸入水中,用曙红溶液均匀覆盖并在室温下孵育1分钟。载片可以风干不超过30分钟,并在37℃下孵育5分钟。可以使用明场成像设置对样品进行成像。
[0661]
此外,样品可以通过以下用于样品透化和cdna生成的示例性步骤进行处理。可以将样品暴露于透化酶并在37℃孵育预定的透化时间(其是组织类型特异性的)。通过添加0.1x ssc缓冲液可以去除透化酶并制备用于分析物捕获的样品。然后可以使样品经受预平衡热循环方案(例如,盖温并在53℃下预平衡,在53℃下逆转录45分钟,然后在4℃下保持),并且可以去除ssc缓冲液。可以将包含无核酸酶的水、逆转录酶试剂、模板转换寡聚物、还原剂和逆转录酶的主混合物添加到样品和基底中,并且可以使具有主混合物的样品经受热循环方案(例如,在53℃下进行逆转录45分钟并在4℃下保持)。可以通过使基底经受热循环方案(例如,在65℃下预平衡,在65℃下进行15分钟的第二链合成,然后在保持4℃下)而在基底上进行第二链合成。可以从样品中去除主混合物试剂,并且可以施加0.8m koh并在室温下孵育5分钟。可以去除koh,并且可以添加洗脱缓冲液并从样品中去除。可以向样品中添加包括第二链试剂、第二链引物和第二链酶的第二链混合物,并且可以密封和孵育样品。在孵育结束时,可以去除试剂,并且可以添加洗脱缓冲液并从样品中去除,并且可以向样品中再次添加0.8m koh,并且可以将样品在室温下孵育10分钟。可以添加tris-hcl并混合试剂。可以将样品转移到新管中,涡旋并置于冰上。
[0662]
此外,可以通过以下用于cdna扩增和质量控制的示例性步骤处理样品。可以制备qpcr混合物,包括无核酸酶的水、qpcr主混合物和cdna引物,并将其移液到qpcr板中的孔中。可以将少量样品添加到平板化的qpcr混合物中,并根据预定的热循环方案进行热循环(例如,步骤1:98℃下持续3分钟,步骤2:98℃下持续5秒,步骤3:63℃下持续30秒,步骤4:记录放大信号,步骤5:重复98℃下持续5秒,63℃下持续30秒,共25个循环)。热循环完成后,可以制备cdna扩增混合物,包括扩增混合物和cdna引物,并与剩余的样品组合并混合。然后可以将样品孵育并热循环(例如,在105℃的盖温度下持续约45至60分钟;步骤1:98℃下持续3分钟,步骤2:98℃下持续15秒,步骤3:63℃下持续20秒,步骤4:72℃下持续一分钟,步骤5:[通过qpcr cq值确定的循环次数],步骤6:72℃下持续1分钟,步骤7:保持在4℃下)。然后可以将样品在4℃下储存至多72小时或在-20℃下储存至多1周,或重悬于0.6x spriselect试剂中并移液以确保适当混合。然后可以将样品在室温下孵育5分钟,并且通过将样品放置在磁体上(例如,磁体处于高位)来清除。可以去除上清液,向沉淀中添加80%乙醇,并孵育30
秒。可以去除乙醇并再次洗涤沉淀。然后可以将样品离心并置于磁体上(例如,磁体处于低位)。可以去除任何残留的乙醇,并且可以将样品风干至多2分钟。可以去除磁体,并且可以将洗脱缓冲液添加到样品中,混合,并且在室温下孵育2分钟。然后可以将样品放置在磁体上(例如,处于低位)直到溶液澄清。可以将样品转移到新的管条中并在4℃下储存至多72小时或在-20℃下储存至多4周。一部分样品可以在安捷伦生物分析仪高灵敏度芯片(agilent bioanalyzer high sensitivity chip)上运行,其中可以选择一个区域并且可以测量cdna浓度以计算总cdna产量。替代地,可以通过安捷伦生物分析仪或安捷伦tapestation测定定量。
[0663]
此外,样品可以通过以下用于空间基因表达文库构建的示例性步骤进行处理。可以在冰上制备包括片段化缓冲液和片段化酶的片段化混合物。可以将洗脱缓冲液和片段化混合物添加到每个样品中,混合并离心。然后可以将样品混合物置于热循环仪中并根据预定方案进行循环(例如,在65℃的盖温度下持续约35分钟,将块预冷至4℃,然后在32℃下进行片段化5分钟,在65℃下端修复并a-加尾30分钟,并保持在4℃下)。可以将0.6x spriselect试剂添加到样品中并在室温下孵育5分钟。可以将样品置于磁体上(例如,处于高位)直到溶液澄清,并且可以将上清液转移至新的管条。可以将0.8x spriselect试剂添加样品中,混合,并在室温下孵育5分钟。可以将样品置于磁体上(例如,处于高位)直到溶液澄清。可以去除上清液,并且可以向沉淀中添加80%乙醇,可以将沉淀孵育30秒,然后去除乙醇。可以重复乙醇洗涤并且将样品置于磁体上(例如,处于低位)直到溶液澄清。可以去除剩余的乙醇,可以将洗脱缓冲液添加到样品中,混合,并在室温下孵育2分钟。可以将样品置于磁体上(例如,处于高位)直到溶液澄清,并且可以将样品的一部分移动到新的管条。可以制备连接子连接混合物,包括连接缓冲液、dna连接酶和连接子寡聚物,并离心。可以将连接子连接混合物添加到样品中,用移液管混合,并短暂离心。然后可以根据预定方案(例如,在30℃的盖温度下持续约15分钟,步骤1:20℃下持续15分钟,步骤2:保持在4℃下)。可以将样品涡旋以再悬浮spriselect试剂,可以将额外的0.8x spriselect试剂添加到样品中并在室温下孵育5分钟,并置于磁体上(例如,处于高位)直到溶液澄清。可以去除上清液,用80%乙醇洗涤沉淀,孵育30秒,并去除乙醇。可以重复乙醇洗涤,并且可以在将样品置于磁体上(例如,处于低位)之前将样品短暂离心。可以去除任何残留的乙醇,并且可以将样品风干最多2分钟。可以去除磁体,并且可以将洗脱缓冲液添加到样品中,并且可以用移液管混合样品,在室温下孵育2分钟,并且置于磁体上(例如,处于低位)直到溶液澄清。可以将一部分样品转移到新的管条中。可以制备扩增混合物并与样品组合。可以将单独的dual indextt set a添加到样品中,用移液管混合并经受预定热循环方案(例如,在105℃的盖温度下持续约25至40分钟,步骤1:98℃下持续45秒,步骤2:98℃下持续20秒,步骤3:54℃下持续30秒;步骤4:72℃下持续20秒,步骤5:返回到第2步,循环预定次数,步骤6:72℃下持续1分钟,并保持在4℃下)。涡旋以再悬浮spriselect试剂,可以将额外的0.6x spriselect试剂添加到每种样品中,混合,并在室温下孵育5分钟。可以将样品置于磁体上(例如,处于高位)直到溶液澄清,并且可以将上清液转移到新的管条。可以将0.8xspriselect试剂添加到每种样品中,用移液管混合,并在室温下孵育5分钟。然后可以将样品置于磁体上(例如,处于高位)直到溶液澄清。可以去除上清液,用80%乙醇洗涤沉淀,孵育30秒,然后去除乙醇。可以重复乙醇洗涤,将样品离心,并置于磁体上(例如,处于低位)以去除任何残留的乙醇。可以从磁体
中取出样品,并且可以将洗脱缓冲液添加到样品中,用移液管混合,并在室温下孵育2分钟。可以将样品置于磁体上(例如,处于低位)直到溶液澄清并且可以将样品的一部分转移到新的管条。样品可以在4℃下储存至多72小时,或在-20℃下长期储存。可以使用生物分析仪迹线或安捷伦tapestation确定平均片段大小。
[0664]
可以使用可用的测序平台对文库进行测序,测序平台包括miseq、nextseq500/550、hiseq 2500、hiseq 3000/4000、novaseq和iseq。
[0665]
在本文所述的任何工作流程的非限制性实例中,产生包括连续核苷酸序列的核酸分子,该连续核苷酸序列包含:(a)第一引物序列(例如,读数1);(b)空间条形码;(c)唯一的分子序列(umi);(d)捕获域;(e)与来自生物样品的核酸中存在的序列互补的序列;(f)与模板转换寡核苷酸(tso)的序列基本上互补的第二引物序列(例如,读数2)。在这些核酸分子的一些实施例中,核酸分子是单链核酸分子。在一些实施例中,这些核酸分子的一些实施例中,核酸分子是双链核酸分子。在这些核酸分子的一些实施例中,(a)至(f)在连续核苷酸序列中以5'至3'方向定位。在任何这些核酸分子的一些实施例中,核酸分子附着于基底(例如,载片)。在任何这些核酸分子的一些实施例中,连续核酸序列的5'端附着于基底(例如,载片)。在任何这些核酸分子的一些实施例中,连续核苷酸序列是嵌合rna和dna序列。在任何这些核酸分子的一些实施例中,连续核苷酸序列是dna序列。
[0666]
在本文所述的任何工作流程的非限制性实例中,产生包括连续核苷酸序列的核酸分子,该连续核苷酸序列包含:(a)与第一引物序列互补的序列(例如,与读数1互补的序列);(b)与空间条形码互补的序列;(c)与唯一的分子序列互补的序列;(d)与捕获域互补的序列;(e)来自样品的核酸中存在的序列;以及(f)模板转换寡核苷酸(tso)的序列。在任何这些核酸分子的一些实施例中,核酸分子是单链的。在任何这些核酸分子的一些实施例中,核酸分子是双链的。在任何这些核酸分子的一些实施例中,连续核苷酸序列是dna序列。在任何这些核酸分子的一些实施例中,(a)至(f)在连续核苷酸序列中以3'至5'方向定位。
[0667]
在本文所述的任何工作流程的非限制性实例中,产生包括连续核苷酸序列的核酸分子,该连续核苷酸序列包含:(a)第一引物序列(例如,读数1);(b)空间条形码;(c)唯一的分子序列(umi);(d)捕获域;(e)与来自样品的核酸中存在的序列互补的序列;以(f)第二引物序列(读数2)。在任何这些核酸分子的一些实施例中,核酸分子是单链核酸分子。在任何这些核酸分子的一些实施例中,核酸分子是双链核酸分子。在任何这些核酸分子的一些实施例中,(a)至(f)在连续核苷酸序列中以5'至3'方向定位。在任何这些核酸分子的一些实施例中,连续核苷酸序列是dna序列。在任何这些核酸分子的一些实施例中,连续核苷酸序列进一步包含3'至(f):(g)与第一连接子序列互补的序列;以及(h)与第三引物序列互补的序列。在任何核酸分子的一些实施例中,第一连接子序列是i7样品索引序列。在任何这些核酸分子的一些实施例中,第三引物序列是p7引物序列。参见,依诺米那(illumina),《索引测序概述指南(indexed sequencing overview guides)》,2018年2月,文件15057455v04;和依诺米那衔接子序列,2019年5月,文献#1000000002694v11,其各自通过引用并入本文,以获得关于p5、p7、i7、i5、truseq读数2、索引测序和本文所述的其它试剂的信息。在任何这些核酸分子的一些实施例中,(h)相对于(g)位于连续核苷酸序列的3'。在任何这些核酸分子的一些实施例中,连续核苷酸序列进一步包含5'至(a):(i)第二连接子序列;以及(ii)第四引物序列。在任何这些核酸分子的一些实施例中,第二连接子序列是i5样品索引序列。在任
何这些核酸分子的一些实施例中,第四引物序列是p5引物序列。在任何这些核酸分子的一些实施例中,(ii)相对于(i)位于连续核苷酸序列的5'。
[0668]
在本文所述的任何工作流程的非限制性实例中,产生包括连续核苷酸序列的核酸分子,该连续核苷酸序列包含:(a)与第一引物序列互补的序列;(b)与空间条形码互补的序列;(c)与唯一的分子序列互补的序列;(d)与捕获域互补的序列;(e)来自样品的核酸中存在的序列;以及(f)与第二引物序列互补的序列。在这些核酸分子的一些实施例中,与第一引物序列互补的序列是与读数1互补的序列。在这些核酸分子的一些实施例中,与第二引物序列互补的序列是与读数2互补的序列。在一些实施例中,任何这些核酸分子的一些实施例中,核酸分子是单链核酸分子。在一些实施例中,任何这些核酸分子的一些实施例中,核酸分子是双链核酸分子。在一些实施例中,任何这些核酸分子的一些实施例中,(a)至(f)在连续核苷酸序列中以3'至5'方向定位。在一些实施例中,任何这些核酸分子的一些实施例中,连续核苷酸序列是dna序列。在一些实施例中,任何这些核酸分子的一些实施例中,连续核苷酸序列进一步包含5'至(f):(g)第一连接子序列;以及(h)第三引物序列。在任何这些核酸分子的一些实施例中,第一连接子序列是i7样品索引序列。在一些实施例中,任何这些核酸分子的一些实施例中,第三引物序列是p7引物序列。在一些实施例中,任何这些核酸分子的一些实施例中,(h)相对于(g)位于连续核苷酸序列的5'。在一些实施例中,任何这些核酸分子的一些实施例中,连续核苷酸序列进一步包含3'至(a):(i)与第二连接子序列互补的序列;以及(ii)与第四引物序列互补的序列。在一些实施例中,任何这些核酸分子的一些实施例中,第二连接子序列是i5样品索引序列。在一些实施例中,任何这些核酸分子的一些实施例中,第四引物序列是p5引物序列。在一些实施例中,任何这些核酸分子的一些实施例中,(ii)相对于(i)位于连续核苷酸序列的3'。
[0669]
引用的参考文献和替代实施例
[0670]
本说明书中提及的可在互联网上获得的所有出版物、专利、专利申请和信息通过引用并入本文,其程度如同每个单独的出版物、专利、专利申请或信息项被具体地和单独地指明通过引用并入。在通过引用并入的出版物、专利、专利申请和信息项与说明书中包含的公开内容相矛盾的程度上,说明书旨在取代和/或优先于任何此类矛盾材料。
[0671]
本发明可以实现为计算机程序产品,其包含嵌入在非暂时性计算机可读存储介质中的计算机程序机制。例如,计算机程序产品可以包含图11a和11b中所示和/或图10a、10b、10c、10d和10e中描述的程序模块。这些程序模块可以存储在cd-rom、dvd、磁盘存储产品、usb密钥或任何其它非暂时性计算机可读数据或程序存储产品上。
[0672]
在不脱离本发明的精神和范围的情况下,可以对本发明进行许多修改和变化,这对于本领域技术人员来说是显而易见的。本文描述的特定实施例仅作为实例提供。选择和描述这些实施例是为了最好地解释本发明的原理及其实际应用,从而使本领域的其它技术人员能够最好地利用本发明和具有适合于预期的特定用途的各种修改的各种实施例。本发明仅由所附权利要求的术语以及这些权利要求所授权的等同物的全部范围来限定。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。