1.本技术涉及医疗数据人工智能技术领域,具体而言,涉及一种预测近红外指示剂的用量方法、装置、设备及存储介质。
背景技术:
2.恶性肿瘤是危害人类健康的第二大杀手,目前,手术仍是治疗恶性肿瘤的首选方案,肿瘤能否完全切除是影响疾病预后的直接因素,术前医生可以借助核磁共振、超声、ct等影像手段进行诊断,从而确定手术方案,但在手术过程中仅能依靠视、触觉经验来判断肿瘤边界,具有较强的主观性,约有40%的患者未完全肿瘤切除导致复发甚至死亡,近红外荧光影像导航手术技术是近年来被认为最有可能实现术中肿瘤精准切除的有效辅助手段之一,也是国内外研究的热点和难点,该技术基于近红外波段(700-1800nm)近红外指示剂结合体内蛋白后产生的增强渗透滞留效应epr(enhanced permeability and retention effect)选择性的在肿瘤部位富集来区别肿瘤,然而,在临床及科研中荧光指示剂如何给药仍处于“盲人摸象”阶段,虽然对于同一癌种存在一个统计学最佳方案,但是仍然存在同一癌种中的不同类型的个体达到肿瘤最佳成像效果时,近红外指示剂的使用剂量/时间差异极大,能否针对不同个体提供精准的近红外指示剂给药方案,是影响近红外荧光影像导航手术技术临床使用效果的关键问题。
3.由于近红外指示剂的使用剂量和肿瘤能区别于周围正常组织的成像效果tbr(tumor to background ratio),二者并不呈简单的线性关系,近红外指示剂剂量过小,在肿瘤部位富集的浓度低(10-8-10-10
m),则近红外荧光强度过低,现有设备和手段难以检测;剂量过大,在适宜的手术等待时间内(12-24h),周围组织代谢不充分,无法与肿瘤荧光信号产生统计学差异;同一种肿瘤不同个体,近红外指示剂代谢能力良莠不齐,成像效果也不同,因此,存在一定的技术缺陷。
4.吲哚菁绿icg(indocyanine green)是目前唯一同时获得美国食品药品监督局fda(food and drug administration)和国家食品药品监督总局cfda(china food and drug administration)批准可用于人体的近红外指示剂,过去由于设备灵敏度的限制,吲哚菁绿仅用于血管造影和肝功能检测,近十年,近红外荧光影像导航手术技术飞速发展,设备检测水平有了极大的提高,国内外很多临床机构开始借助吲哚菁绿近红外指示剂开展肿瘤导航辅助用药方案的研究,肝脏是吲哚菁绿的唯一代谢器官,吲哚菁绿由门静脉入肝脏,被肝脏实质细胞上的膜转运蛋白捕获进入细胞内,也可以经人肝细胞膜蛋白mrp3转运回流入血液,胞内的吲哚菁绿经谷胱甘肽巯基转移酶转运至毛细胆管侧的细胞膜附近,再由人肝细胞膜蛋白mdr3和人肝细胞膜蛋白mrp2介导分泌至毛细胆管中,最后汇入胆管,经胆汁后肠道排泄,原型代谢,无肝肠循环,目前认为,血液中的吲哚菁绿以浓度依赖的方式分别通过增强渗透滞留效应,自由扩散在肿瘤和正常组织中富集,正常组织中的吲哚菁绿借助淋巴回流清除,但肿瘤中的淋巴回流受阻,肿瘤类型一定的情况下,随着时间推移,血液中吲哚菁绿逐渐被肝代谢,肿瘤中富集的多清除的少,才能与周围正常组织产生一个浓度差,这是
近红外指示剂的使用剂量和肿瘤能区别于周围正常组织的成像tbr产生的前提,因此,肝脏对吲哚菁绿的代谢能力直接决定了近红外指示剂用于周围正常组织成像的变化趋势,也就是说,术前检测的各项肝功指标与吲哚菁绿的代谢息息相关,如,总胆红素指标和总胆汁酸指标的摄取和分泌与吲哚菁绿共用同一类膜转运蛋白,存在竞争关系,二者血液中的含量会影响吲哚菁绿的代谢;胆汁淤积会影响吲哚菁绿清除的快慢,而γ-谷氨酰转移酶指标、碱性磷酸酶指标与胆汁淤积有关,因此肝脏的各项功能指标反应吲哚菁绿的代谢情况,在对肿瘤检测时并不需要注射吲哚菁绿,这里我们利用待给药患者的各项肝功能指标与吲哚菁绿剂量/时间生成的最佳肿瘤成像的关系,建立近红外荧光导航系统的多变量公式模型,根据该公式计算肿瘤像素值与周围正常组织背景像素值的肿瘤信号背景比的计算结果,从而针对性的预测出个体患者在最佳时间段内最佳剂量的辅助用药方案,有利于近红外荧光影像导航技术与恶性肿瘤临床需求的紧密结合。
技术实现要素:
5.有鉴于此,本技术实施例提供了一种预测近红外指示剂的用量方法,通过收集个体的肝脏功能指标数据,实现围绕近红外指示剂的使用剂量和肿瘤能区别于周围正常组织的肿瘤成像的研究,进而针对性的预测出个体患者在观察时间段内最佳剂量的辅助用药方案。
6.第一方面,本技术实施例提供了一种预测近红外指示剂的用量方法,包括:
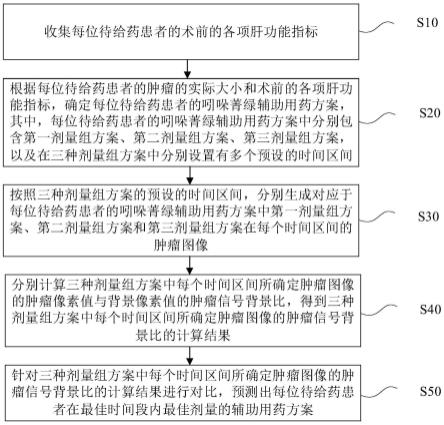
7.收集每位待给药患者的术前的各项肝功能指标;
8.根据所述每位待给药患者的肿瘤的实际大小和术前的所述各项肝功能指标,确定每位待给药患者的吲哚菁绿辅助用药方案,其中,所述每位待给药患者的吲哚菁绿辅助用药方案中分别包含第一剂量组方案、第二剂量组方案、第三剂量组方案,以及在三种剂量组方案中分别设置有多个预设的时间区间;
9.按照所述三种剂量组方案的预设的时间区间,分别生成对应于所述每位待给药患者的吲哚菁绿辅助用药方案中第一剂量组方案、第二剂量组方案和第三剂量组方案在每个时间区间的肿瘤图像,进而针对性的预测出个体患者在观察时间段内最佳剂量的辅助用药方案;
10.分别计算所述三种剂量组方案中每个时间区间所确定肿瘤图像的肿瘤像素值与背景像素值的肿瘤信号背景比,得到所述三种剂量组方案中每个时间区间所确定肿瘤图像的肿瘤信号背景比的计算结果;
11.针对所述三种剂量组方案中每个时间区间所确定肿瘤图像的肿瘤信号背景比的计算结果进行对比,预测出所述每位待给药患者在最佳时间段内最佳剂量的辅助用药方案。
12.结合第一方面,本技术实施例提供了第一方面的第一种可能的实施方式,其中,收集每位待给药患者的术前的各项肝功能指标,包括:
13.从医院历史病历档案中或者患者入院检查病历档案中,收集每位待给药患者的术前的各项肝功能指标,其中,各项肝功能指标包含丙氨酸氨基转移酶指标(alt)、天门冬氨酸氨基转移酶指标(ast)、直接胆红素指标(dbil)、总胆红素指标(tbil)、白蛋白指标(alb)、碱性磷酸酶指标(alp)、γ-谷氨酰转移酶指标(γ-gt)、总胆汁酸指标(tba)。
14.结合第一方面的第一种可能的实施方式,本技术实施例提供了第一方面的第二种可能的实施方式,其中,根据所述每位待给药患者的肿瘤的实际大小和术前的所述各项肝功能指标,确定每位待给药患者的吲哚菁绿辅助用药方案,包括:
15.根据所述每位待给药患者的肿瘤的实际大小和术前的所述各项肝功能指标,预设每位待给药患者用于注射吲哚菁绿的第一剂量组方案、第二剂量组方案及第三剂量组方案;
16.针对每位待给药患者注射吲哚菁绿的第一剂量组方案,按照预设的四个时间分区,确定所述第一剂量组方案的子剂量组,其中,所述预设的时间分区分别为注射吲哚菁绿后的2-6h、6-10h、10-14h及20-24h;
17.针对每位待给药患者注射吲哚菁绿的第二剂量组方案,按照预设的四个时间分区,确定所述第二剂量组方案的子剂量组;
18.针对每位待给药患者注射吲哚菁绿的第三剂量组方案,按照预设的四个时间分区,确定所述第三剂量组方案的子剂量组。
19.结合第一方面的第一种可能的实施方式或第二种可能的实施方式,本技术实施例提供了第一方面的第三种可能的实施方式,其中,按照所述三种剂量组方案的预设的时间区间,分别生成对应于所述每位待给药患者的吲哚菁绿辅助用药方案中第一剂量组方案、第二剂量组方案和第三剂量组方案在每个时间区间的肿瘤图像,包括:
20.将所述每位待给药患者注射吲哚菁绿的第一剂量组方案的子剂量组、第二剂量组方案的子剂量组和第三剂量组方案的子剂量组的剂量数据输入到近红外荧光导航系统中,其中,所述三种剂量方案的子剂量组中分别携带有表示每位待给药患者的给药剂量和注射射吲哚菁绿后观察期的预设的时间区间;
21.基于荧光成像技术分别生成对应于所述第一剂量方案的子剂量组的肿瘤图像、所述第二剂量方案的子剂量组的肿瘤图像及所述第三剂量方案的子剂量组的肿瘤图像。
22.结合第一方面的第一种可能的实施方式或第二种可能的实施方式,本技术实施例提供了第一方面的第四种可能的实施方式,其中,分别计算所述三种剂量组方案中每个时间区间所确定肿瘤图像的肿瘤像素值与背景像素值的肿瘤信号背景比,得到所述三种剂量组方案中每个时间区间所确定肿瘤图像的肿瘤信号背景比的计算结果,包括:
23.在生成的所述第一剂量组方案的子剂量组的肿瘤图像中,从肿瘤中心点位置和距离肿瘤外边界2厘米位置沿周向顺时针选取多个采样点;
24.在生成的所述第二剂量组方案的子剂量组的肿瘤图像中,从肿瘤中心点位置和距离肿瘤外边界2厘米位置沿周向顺时针选取多个采样点;
25.在生成的所述第三剂量组方案的子剂量组的肿瘤图像中,从肿瘤中心点位置和距离肿瘤外边界2厘米位置沿周向顺时针选取多个采样点;
26.分别计算三种剂量组方案中每组采样点集合内肿瘤图像对应的肿瘤像素值与背景像素值的肿瘤信号背景比,得到所述三种剂量组方案中每个时间区间所确定肿瘤图像的肿瘤信号背景比的计算结果。
27.结合第一方面的第一种可能的实施方式或第二种可能的实施方式,本技术实施例提供了第一方面的第五种可能的实施方式,其中,分别计算三种剂量组方案中每组采样点集合内肿瘤图像对应的肿瘤像素值与背景像素值的肿瘤信号背景比,得到所述三种剂量组
方案中每个时间区间所确定肿瘤图像的肿瘤信号背景比的计算结果,包括:
28.利用分析软件针对所述三种剂量组方案中所蕴含的各项肝功能指标、每个子剂量组对应的最佳时间区间与的吲哚菁绿用量进行公式拟合,得到剂量多变量公式和时间多变量公式,其中,所述剂量多变量公式和时间多变量公式分别表示为:
29.dose=f(x1,x2,
…
,x7,x8)=a1x1 a2x2
…
a7x7 a8x8 b;
30.time=f(x1,x2,
…
,x7,x8)=c1x1 c2x2
…
c7x7 c8x8 d;
31.其中,dose代表剂量,单位mg/kg,x1,x2,
…
,x7,x8代表8项各项肝功能指标,a1x1 a2x2
…
a7x7 a8x8代表剂量组的用量参数拟合的8项各项肝功能指标的公式系数,b代表常数,用于拟合剂量预测公式;time代表时间,单位h,x1,x2,
…
,x7,x8代表8项各项肝功能指标,c1x1 c2x2
…
c7x7 c8x8代表最佳时间区间拟合的8项各项肝功能指标,d代表常数,用于拟合时间预测公式;
32.利用剂量多变量公式和时间多变量公式,分别递归计算三种剂量组方案中每组采样点集合内肿瘤图像对应肿瘤图像的肿瘤像素值与背景像素值的肿瘤信号背景比,得到所述三种剂量组方案中每个时间区间所确定肿瘤图像的肿瘤信号背景比的计算结果。
33.结合第一方面的第一种可能的实施方式或第二种可能的实施方式,本技术实施例提供了第一方面的第六种可能的实施方式,其中,针对所述三种剂量组方案中每个时间区间所确定肿瘤图像的肿瘤信号背景比的计算结果进行对比,预测出所述每位待给药患者在最佳时间段内最佳剂量的辅助用药方案,包括:
34.针对所述第一剂量组方案的子剂量组中每个时间区间肿瘤图像的肿瘤信号背景比的计算结果进行筛选处理,得到第一目标方案,其中,所述每个时间分区分别为注射吲哚菁绿后的2-6h、6-10h、10-14h及20-24h;
35.针对所述第二剂量组方案的子剂量组中每个时间区间肿瘤图像的肿瘤信号背景比的计算结果进行筛选处理,得到第二目标方案;
36.针对所述第三剂量组方案的子剂量组中每个时间区间肿瘤图像的肿瘤信号背景比的计算结果进行筛选处理,得到第三目标方案;
37.从所述第一目标方案、第二目标方案及第三目标方案中,预测出所述每位待给药患者在最佳时间段内最佳剂量的辅助用药方案。
38.第二方面,本技术实施例还提供了一种预测近红外指示剂的用量装置,所述装置包括:
39.收集模块,用于收集每位待给药患者的术前的各项肝功能指标;
40.确定模块,用于根据所述每位待给药患者的肿瘤的实际大小和术前的所述各项肝功能指标,确定每位待给药患者的吲哚菁绿辅助用药方案,其中,所述每位待给药患者的吲哚菁绿辅助用药方案中分别包含第一剂量组方案、第二剂量组方案、第三剂量组方案,以及在三种剂量组方案中分别设置有多个预设的时间区间;
41.生成模块,用于按照所述三种剂量组方案的预设的时间区间,分别生成对应于所述每位待给药患者的吲哚菁绿辅助用药方案中第一剂量组方案、第二剂量组方案和第三剂量组方案在每个时间区间的肿瘤图像;
42.计算模块,用于分别计算所述三种剂量组方案中每个时间区间所确定肿瘤图像的肿瘤像素值与背景像素值的肿瘤信号背景比,得到所述三种剂量组方案中每个时间区间所
确定肿瘤图像的肿瘤信号背景比的计算结果;
43.预测模块,用于针对所述三种剂量组方案中每个时间区间所确定肿瘤图像的肿瘤信号背景比的计算结果进行对比,预测出所述每位待给药患者在最佳时间段内最佳剂量的辅助用药方案。
44.第三方面,本技术实施例还提供了一种计算机设备,包括存储器、处理器及存储在所述存储器上并可在所述处理器上运行的计算机程序,所述处理器执行所述计算机程序时实现上述任一项的预测近红外指示剂的用量方法步骤。
45.第四方面,本技术实施例提供了一种计算机可读存储介质,所述计算机可读存储介质上存储有计算机程序,所述计算机程序被处理器运行时执行如预测近红外指示剂的用量方法步骤。
46.本技术实施例提供的一种预测近红外指示剂的用量方法,收集每位待给药患者的术前的各项肝功能指标;根据每位待给药患者的肿瘤的实际大小和术前的各项肝功能指标,确定每位待给药患者的吲哚菁绿辅助用药方案;按照三种剂量组方案的预设的时间区间,分别生成对应于每位待给药患者的吲哚菁绿辅助用药方案中第一剂量组方案、第二剂量组方案和第三剂量组方案在每个时间区间的肿瘤图像;分别计算三种剂量组方案中每个时间区间所确定肿瘤图像的肿瘤像素值与背景像素值的肿瘤信号背景比,得到三种剂量组方案中每个时间区间所确定肿瘤图像的肿瘤信号背景比的计算结果;针对三种剂量组方案中每个时间区间所确定肿瘤图像的肿瘤信号背景比的计算结果进行对比,预测出每位待给药患者在最佳时间段内最佳剂量的辅助用药方案。具体来说,利用待给药患者的各项肝功能指标与吲哚菁绿剂量/时间生成的最佳肿瘤成像的关系,建立近红外荧光导航系统的多变量公式模型,根据该公式计算肿瘤像素值与周围正常组织背景像素值的肿瘤信号背景比的计算结果,从而针对性的预测出个体患者在最佳时间段内最佳剂量的辅助用药方案,综上所述通过医疗大数据管理系统收集个体的肝脏功能指标数据,实现围绕近红外指示剂的使用剂量和肿瘤能区别于周围正常组织的成像的研究,是本领域亟待突破的关键技术瓶颈,有利于开展近红外荧光影像导航技术与恶性肿瘤临床需求的紧密结合,针对性的对不同个体提供近红外指示剂精准辅助用药方案,为肿瘤切除的临床和研究提供数据的技术支撑,解决了目前同一种肿瘤不同个体中,近红外指示剂代谢能力良莠不齐,成像效果不准确的问题,避免了因个体周围组织代谢不充分,从而导致肿瘤荧光信号产生统计学差异的问题,以及在对肿瘤检测时并不需要注射吲哚菁绿。
47.为使本技术的上述目的、特征和优点能更明显易懂,下文特举较佳实施例,并配合所附附图,作详细说明如下。
附图说明
48.为了更清楚地说明本技术实施例的技术方案,下面将对实施例中所需要使用的附图作简单地介绍,应当理解,以下附图仅示出了本技术的某些实施例,因此不应被看作是对范围的限定,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据这些附图获得其他相关的附图。
49.图1示出了本技术实施例所提供的一种预测近红外指示剂的用量方法的流程图。
50.图2示出了本技术实施例所提供的一种预测近红外指示剂的用量方法中收集各项
肝功能指标的流程示意图。
51.图3示出了本技术实施例所提供的一种预测近红外指示剂的用量方法中确定三种剂量组方案的流程示意图。
52.图4示出了本技术实施例所提供的一种预测近红外指示剂的用量方法中生成肿瘤图像的流程示意图。
53.图5示出了本技术实施例所提供的一种预测近红外指示剂的用量方法中计算肿瘤信号背景比的流程示意图。
54.图6示出了本技术实施例所提供的一种预测近红外指示剂的用量方法中预测出每位待给药患者的辅助用药方案的流程示意图。
55.图7示出了本技术实施例所提供的一种预测近红外指示剂的用量装置的结构示意图。
56.图8示出了本技术实施例所提供的一种计算机设备的结构示意图。
具体实施方式
57.为使本技术实施例的目的、技术方案和优点更加清楚,下面将结合本技术实施例中附图,对本技术实施例中的技术方案进行清楚、完整地描述,显然,所描述的实施例仅仅是本技术一部分实施例,而不是全部的实施例。通常在此处附图中描述和示出的本技术实施例的组件可以以各种不同的配置来布置和设计。因此,以下对在附图中提供的本技术的实施例的详细描述并非旨在限制要求保护的本技术的范围,而是仅仅表示本技术的选定实施例。基于本技术的实施例,本领域技术人员在没有做出创造性劳动的前提下所获得的所有其他实施例,都属于本技术保护的范围。
58.考虑到目前确定近红外指示剂的使用剂量时,无法避免与肿瘤荧光信号产生统计学差异,存在技术缺陷;基于此,本技术实施例提供了一种预测近红外指示剂的用量方法,下面通过实施例进行描述。
59.下面结合附图,对本技术的一些实施方式作详细说明。在不冲突的情况下,下述的实施例及实施例中的特征可以相互组合。
60.图1示出了本技术实施例所提供的一种预测近红外指示剂的用量方法流程示意图;如图1所示,具体包括以下步骤:
61.步骤s10,收集每位待给药患者的术前的各项肝功能指标。
62.步骤s10在具体实施时,从医院患者信息管理系统的历史病历档案中收集每位待给药患者的术前的各项肝功能指标,或者从患者入院检查病历档案中收集每位待给药患者的术前的各项肝功能指标,还可以通过社区医疗健康管理系统收集每位待给药患者的各项肝功能指标,其中,各项肝功能指标包含丙氨酸氨基转移酶指标(alt)、天门冬氨酸氨基转移酶指标(ast)、直接胆红素指标(dbil)、总胆红素指标(tbil)、白蛋白指标(alb)、碱性磷酸酶指标(alp)、γ-谷氨酰转移酶指标(γ-gt)、总胆汁酸指标(tba)。
63.步骤s20,根据每位待给药患者的肿瘤的实际大小和术前的各项肝功能指标,确定每位待给药患者的吲哚菁绿辅助用药方案,其中,每位待给药患者的吲哚菁绿辅助用药方案中分别包含第一剂量组方案、第二剂量组方案、第三剂量组方案,以及在三种剂量组方案中分别设置有多个预设的时间区间。
64.步骤s20在具体实施时,根据每位待给药患者的肿瘤的实际大小和每位待给药患者术前的各项肝功能指标,分别确定每位待给药患者注射吲哚菁绿的第一剂量组方案、第二剂量组方案、第三剂量组方案,其中,第一剂量组方案注射吲哚菁绿的剂量较高如1.5mg/kg,第二剂量组方案注射吲哚菁绿的剂量中等如1mg/kg,第三剂量组方案中注射吲哚菁绿的剂量较少如0.5mg/kg,以及分别对第一剂量组方案、第二剂量组方案、第三剂量组方案中设置四个时间区间,在三种剂量组方案中分别设置每位待给药患者注射吲哚菁绿后2-6h为第一时间区间,6-10h为第二时间区间,10-14h为第三时间区间,以及20-24h为第四时间区间,按照上述每个时间区间,确定每位待给药患者注射吲哚菁绿用量和注射射吲哚菁绿后不同观察期三种剂量组方案的子剂量组,这里,每位待给药患者注射吲哚菁绿的用量根据肿瘤的实际大小和每位待给药患者术前的各项肝功能指标确定。
65.步骤s30,按照三种剂量组方案的预设的时间区间,分别生成对应于每位待给药患者的吲哚菁绿辅助用药方案中第一剂量组方案、第二剂量组方案和第三剂量组方案在每个时间区间的肿瘤图像。
66.步骤s30在具体实施时,将每位待给药患者注射吲哚菁绿的三种剂量组方案的用量数据和每位待给药患者注射吲哚菁绿后每个时间分区的观察数据输入到近红外荧光导航系统中,近红外荧光导航系统利用荧光成像技术分别生成对应于每位待给药患者的吲哚菁绿辅助用药方案中第一剂量组方案在每个时间区间的肿瘤图像、生成对应于每位待给药患者的吲哚菁绿辅助用药方案中第二剂量组方案在每个时间区间的肿瘤图像、生成对应于每位待给药患者的吲哚菁绿辅助用药方案中第三剂量组方案在每个时间区间的肿瘤图像。
67.例如:将每位待给药患者注射吲哚菁绿的第一剂量组方案的1.5mg/kg用量数据和每位待给药患者注射吲哚菁绿后2-6h的第一时间区间、注射吲哚菁绿后6-10h的第二时间区间、注射吲哚菁绿后10-14h的第三时间区间、注射吲哚菁绿后20-24h的第四时间区间的时间临界点观察数值输入到近红外荧光导航系统中,近红外荧光导航系统利用荧光成像技术分别生成1.5mg/kg用量数据对应2-6h、6-10h、10-14h、20-24h四个时间区间的肿瘤图像。
68.步骤s40,分别计算三种剂量组方案中每个时间区间所确定肿瘤图像的肿瘤像素值与背景像素值的肿瘤信号背景比,得到三种剂量组方案中每个时间区间所确定肿瘤图像的肿瘤信号背景比的计算结果。
69.步骤s40在具体实施时,在第一剂量组方案的子剂量组所确定肿瘤图像中,从肿瘤中心位置和肿瘤外边界位置沿着周向顺时针选取多个采样点,在第二剂量组方案的子剂量组所确定肿瘤图像中,从肿瘤中心位置和肿瘤外边界位置沿着周向顺时针选取多个采样点,在第三剂量组方案的子剂量组所确定肿瘤图像中,从肿瘤中心位置和肿瘤外边界位置沿着周向顺时针选取多个采样点,分别计算第一剂量组方案的子剂量组、第二剂量组方案的子剂量组和第三剂量组方案的子剂量组所确定肿瘤图像中肿瘤像素值与背景像素值之间的肿瘤信号背景比,得到三种剂量组方案中每个子剂量组所确定肿瘤图像的肿瘤信号背景比的计算结果,每个子剂量组中对应四个时间区间。
70.步骤s50,针对三种剂量组方案中每个时间区间所确定肿瘤图像的肿瘤信号背景比的计算结果进行对比,预测出每位待给药患者在最佳时间段内最佳剂量的辅助用药方案。
71.步骤s50在具体实施时,分别对第一剂量组方案的子剂量组、第二剂量组方案的子
剂量组、第三剂量组方案的子剂量组中每个时间区间所确定肿瘤图像的计算结果进行对比,预测出每位待给药患者在注射吲哚菁绿后观察时间区间内最佳剂量的辅助用药方案,即得到最佳观察时间段内最佳注射剂量辅助用药方案。
72.在一个可行的实现方案中,图2示出了本技术实施例所提供的一种预测近红外指示剂的用量方法中收集各项肝功能指标的流程示意图;上述步骤s10中,收集每位待给药患者的术前的各项肝功能指标,包括:
73.步骤s101,从医院历史病历档案中或者患者入院检查病历档案中,收集每位待给药患者的术前的各项肝功能指标,其中,各项肝功能指标包含丙氨酸氨基转移酶指标(alt)、天门冬氨酸氨基转移酶指标(ast)、直接胆红素指标(dbil)、总胆红素指标(tbil)、白蛋白指标(alb)、碱性磷酸酶指标(alp)、γ-谷氨酰转移酶指标(γ-gt)、总胆汁酸指标(tba)。
74.步骤s101在具体实施时,从医院患者信息管理系统的历史病历档案中收集每位待给药患者的术前的各项肝功能指标,或者从患者入院检查病历档案中收集每位待给药患者的术前的各项肝功能指标,还可以通过社区医疗健康管理系统收集每位待给药患者的各项肝功能指标,其中,各项肝功能指标包含丙氨酸氨基转移酶指标(alt)、天门冬氨酸氨基转移酶指标(ast)、直接胆红素指标(dbil)、总胆红素指标(tbil)、白蛋白指标(alb)、碱性磷酸酶指标(alp)、γ-谷氨酰转移酶指标(γ-gt)、总胆汁酸指标(tba),上述8项肝功能指标分别表示为x1,x2,x3,x4,x5,x6,x7,x8。
75.在一个可行的实现方案中,图3示出了本技术实施例所提供的一种预测近红外指示剂的用量方法中确定三种剂量组方案的流程示意图;上述步骤s20中,根据每位待给药患者的肿瘤的实际大小和术前的各项肝功能指标,确定每位待给药患者的吲哚菁绿辅助用药方案,包括:
76.步骤s201,根据每位待给药患者的肿瘤的实际大小和术前的各项肝功能指标,预设每位待给药患者用于注射吲哚菁绿的第一剂量组方案、第二剂量组方案及第三剂量组方案。
77.步骤s202,针对每位待给药患者注射吲哚菁绿的第一剂量组方案,按照预设的四个时间分区,确定第一剂量组方案的子剂量组,其中,预设的时间分区分别为注射吲哚菁绿后的2-6h、6-10h、10-14h及20-24h。
78.步骤s203,针对每位待给药患者注射吲哚菁绿的第二剂量组方案,按照预设的四个时间分区,确定第二剂量组方案的子剂量组。
79.步骤s204,针对每位待给药患者注射吲哚菁绿的第三剂量组方案,按照预设的四个时间分区,确定第三剂量组方案的子剂量组。
80.步骤s201、s202、s203、s204在具体实施时,根据每位待给药患者的肿瘤的实际大小和每位待给药患者术前的各项肝功能指标,预设每位待给药患者用于注射吲哚菁绿的第一剂量组方案、第二剂量组方案及第三剂量组方案;针对每位待给药患者注射吲哚菁绿1.5mg/kg的第一剂量组方案,分别按照2-6h为第一时间区间,6-10h为第二时间区间,10-14h为第三时间区间,以及20-24h为第四时间区间,确定出第一剂量组方案的子剂量组;针对每位待给药患者注射吲哚菁绿1mg/kg的第二剂量组方案,分别按照2-6h为第一时间区间,6-10h为第二时间区间,10-14h为第三时间区间,以及20-24h为第四时间区间,确定出第
二剂量组方案的子剂量组;针对每位待给药患者注射吲哚菁绿0.5mg/kg的第三剂量组方案,分别按照2-6h为第一时间区间,6-10h为第二时间区间,10-14h为第三时间区间,以及20-24h为第四时间区间,确定出第三剂量组方案的子剂量组。
81.在一个可行的实现方案中,图4示出了本技术实施例所提供的一种预测近红外指示剂的用量方法中生成肿瘤图像的流程示意图;上述步骤s30中,按照三种剂量组方案的预设的时间区间,分别生成对应于每位待给药患者的吲哚菁绿辅助用药方案中第一剂量组方案、第二剂量组方案和第三剂量组方案在每个时间区间的肿瘤图像,包括:
82.步骤s301,将每位待给药患者注射吲哚菁绿的第一剂量组方案的子剂量组、第二剂量组方案的子剂量组和第三剂量组方案的子剂量组的剂量数据输入到近红外荧光导航系统中,其中,三种剂量方案的子剂量组中分别携带有表示每位待给药患者的给药剂量和注射射吲哚菁绿后观察期的预设的时间区间。
83.步骤s302,基于荧光成像技术分别生成对应于第一剂量方案的子剂量组的肿瘤图像、第二剂量方案的子剂量组的肿瘤图像及第三剂量方案的子剂量组的肿瘤图像。
84.步骤s301、s302在具体实施时,根据每位待给药患者注射吲哚菁绿的第一剂量组方案的给药用量和每位待给药患者注射吲哚菁绿后2-6h的第一时间区间、注射吲哚菁绿后6-10h的第二时间区间、注射吲哚菁绿后10-14h的第三时间区间、注射吲哚菁绿后20-24h的第四时间区间,确定第一剂量组方案的子剂量组,上述第一剂量组方案的子剂量组中包含每个时间区间的四个子节点剂量组;根据每位待给药患者注射吲哚菁绿的第二剂量组方案的给药用量和每位待给药患者注射吲哚菁绿后2-6h的第一时间区间、注射吲哚菁绿后6-10h的第二时间区间、注射吲哚菁绿后10-14h的第三时间区间、注射吲哚菁绿后20-24h的第四时间区间,确定第二剂量组方案的子剂量组,上述第二剂量组方案的子剂量组中包含每个时间区间的四个子节点剂量组;根据每位待给药患者注射吲哚菁绿的第二剂量组方案的给药用量数据和每位待给药患者注射吲哚菁绿后2-6h的第一时间区间、注射吲哚菁绿后6-10h的第二时间区间、注射吲哚菁绿后10-14h的第三时间区间、注射吲哚菁绿后20-24h的第四时间区间,确定第三剂量组方案的子剂量组,上述第三剂量组方案的子剂量组中包含每个时间区间的四个子节点剂量组;分别将每位待给药患者注射吲哚菁绿的第一剂量组方案的子剂量组的剂量数据和时间数据、每位待给药患者注射吲哚菁绿的第二剂量组方案的子剂量组的剂量数据和时间数据和每位待给药患者注射吲哚菁绿的第三剂量组方案的子剂量组的剂量数据和时间数据输入到近红外荧光导航系统中,基于近红外荧光导航系统内的荧光成像技术分别生成对应于第一剂量方案的每个时间区间的四个子节点剂量组的肿瘤图像,生成对应于第二剂量方案的每个时间区间的四个子节点剂量组的肿瘤图像,以及生成对应于第三剂量方案的每个时间区间的四个子节点剂量组的肿瘤图像。
85.在一个可行的实现方案中,图5示出了本技术实施例所提供的一种预测近红外指示剂的用量方法中的计算肿瘤信号背景比流程示意图;上述步骤s40中,分别计算三种剂量组方案中每个时间区间所确定肿瘤图像的肿瘤像素值与背景像素值的肿瘤信号背景比,得到三种剂量组方案中每个时间区间所确定肿瘤图像的肿瘤信号背景比的计算结果,包括:
86.步骤s401,在生成的第一剂量组方案的子剂量组的肿瘤图像中,从肿瘤中心点位置和距离肿瘤外边界2厘米位置沿周向顺时针选取多个采样点。
87.步骤s402,在生成的第二剂量组方案的子剂量组的肿瘤图像中,从肿瘤中心点位
置和距离肿瘤外边界2厘米位置沿周向顺时针选取多个采样点。
88.步骤s403,在生成的第三剂量组方案的子剂量组的肿瘤图像中,从肿瘤中心点位置和距离肿瘤外边界2厘米位置沿周向顺时针选取多个采样点。
89.步骤s404,分别计算三种剂量组方案中每组采样点集合内肿瘤图像对应的肿瘤像素值与背景像素值的肿瘤信号背景比,得到三种剂量组方案中每个时间区间所确定肿瘤图像的肿瘤信号背景比的计算结果。
90.步骤s401、s402、s403、s404在具体实施时,在生成的第一剂量组方案的子剂量组的肿瘤图像中,从肿瘤中心点位置及距离肿瘤外边界2厘米外的3点钟方向、6点钟方向、9点钟方向和12点钟方向共选取5个点作为肿瘤像素值的采样点;在生成的第二剂量组方案的子剂量组的肿瘤图像中,从肿瘤中心点位置及距离肿瘤外边界2厘米外的3点钟方向、6点钟方向、9点钟方向和12点钟方向共选取5个点作为肿瘤像素值的采样点,在生成的第三剂量组方案的子剂量组的肿瘤图像中,从肿瘤中心点位置及距离肿瘤外边界2厘米外的3点钟方向、6点钟方向、9点钟方向和12点钟方向共选取5个点作为肿瘤像素值的采样点,由于每个子剂量组中均包含每个时间区间的四个子节点剂量组的肿瘤图像,即分别得到每个剂量组中四个子节点剂量组的肿瘤图像,共12组子节点剂量组肿瘤图像,分别计算第一剂量组方案的子剂量组中每组采样点集合内肿瘤图像对应肿瘤像素值与背景像素值之间的肿瘤信号背景比、计算第二剂量组方案的子剂量组中每组采样点集合内肿瘤图像对应肿瘤图像的肿瘤像素值与背景像素值之间的肿瘤信号背景比和计算第三剂量组方案的子剂量组中每组采样点集合内肿瘤图像对应肿瘤图像的肿瘤像素值与背景像素值之间的肿瘤信号背景比,分别得到第一剂量组方案、第二剂量组方案、第三剂量组方案中每个子剂量组所确定肿瘤图像的肿瘤信号背景比的计算结果;
91.其中,利用分析软件针对三种剂量组方案中所蕴含的各项肝功能指标、每个子剂量组对应的最佳时间区间与的吲哚菁绿用量进行公式拟合,得到剂量多变量公式和时间多变量公式,其中,剂量多变量公式和时间多变量公式分别表示为:
92.dose=f(x1,x2,
…
,x7,x8)=a1x1 a2x2
…
a7x7 a8x8 b;
93.time=f(x1,x2,
…
,x7,x8)=c1x1 c2x2
…
c7x7 c8x8 d;
94.其中,dose代表剂量,单位mg/kg,x1,x2,
…
,x7,x8代表8项各项肝功能指标,a1x1 a2x2
…
a7x7 a8x8代表剂量组的用量参数拟合的8项各项肝功能指标的公式系数,b代表常数,用于拟合剂量预测公式;time代表时间,单位h,x1,x2,
…
,x7,x8代表8项各项肝功能指标,c1x1 c2x2
…
c7x7 c8x8代表最佳时间区间拟合的8项各项肝功能指标,d代表常数,用于拟合时间预测公式;
95.利用剂量多变量公式和时间多变量公式,分别递归计算三种剂量组方案中每组采样点集合内肿瘤图像对应肿瘤图像的肿瘤像素值与背景像素值的肿瘤信号背景比,得到三种剂量组方案中每个时间区间所确定肿瘤图像的肿瘤信号背景比的计算结果,其中,肿瘤信号背景比表征了肿瘤像素值荧光强度和背景像素值荧光强度。
96.在一个可行的实现方案中,图6示出了本技术实施例所提供的一种预测近红外指示剂的用量方法中的预测出每位待给药患者的辅助用药方案流程示意图;上述步骤s50中,针对三种剂量组方案中每个时间区间所确定肿瘤图像的肿瘤信号背景比的计算结果进行对比,预测出每位待给药患者在最佳时间段内最佳剂量的辅助用药方案,包括:
97.步骤s501,针对第一剂量组方案的子剂量组中每个时间区间肿瘤图像的肿瘤信号背景比的计算结果进行筛选处理,得到第一目标方案,其中,每个时间分区分别为注射吲哚菁绿后的2-6h、6-10h、10-14h及20-24h。
98.步骤s502,针对第二剂量组方案的子剂量组中每个时间区间肿瘤图像的肿瘤信号背景比的计算结果进行筛选处理,得到第二目标方案。
99.步骤s503,针对第三剂量组方案的子剂量组中每个时间区间肿瘤图像的肿瘤信号背景比的计算结果进行筛选处理,得到第三目标方案。
100.步骤s504,从第一目标方案、第二目标方案及第三目标方案中,预测出每位待给药患者在最佳时间段内最佳剂量的辅助用药方案。
101.步骤s501、s502、s503、s504在具体实施时,从第一剂量组方案的子剂量组中2-6h、6-10h、10-14h及20-24h四个时间区间肿瘤图像的肿瘤信号背景比的计算结果进行筛选处理,得到第一目标方案,从第二剂量组方案的子剂量组中2-6h、6-10h、10-14h及20-24h四个时间区间肿瘤图像的肿瘤信号背景比的计算结果进行筛选处理,得到第二目标方案,从第三剂量组方案的子剂量组中2-6h、6-10h、10-14h及20-24h四个时间区间肿瘤图像的肿瘤信号背景比的计算结果进行筛选处理,得到第三目标方案,再对得到第一目标方案、第二目标方案和第三目标方案对应的计算结果进行对比,预测出每位待给药患者在注射吲哚菁绿后观察时间区间内最佳剂量的辅助用药方案。
102.图7示出了本技术实施例所提供的一种预测近红外指示剂的用量装置结构示意图,如图7所示,上述装置包括:
103.收集模块601,用于收集每位待给药患者的术前的各项肝功能指标;
104.确定模块602,用于根据每位待给药患者的肿瘤的实际大小和术前的各项肝功能指标,确定每位待给药患者的吲哚菁绿辅助用药方案,其中,每位待给药患者的吲哚菁绿辅助用药方案中分别包含第一剂量组方案、第二剂量组方案、第三剂量组方案,以及在三种剂量组方案中分别设置有多个预设的时间区间;
105.生成模块603,用于按照三种剂量组方案的预设的时间区间,分别生成对应于每位待给药患者的吲哚菁绿辅助用药方案中第一剂量组方案、第二剂量组方案和第三剂量组方案在每个时间区间的肿瘤图像;
106.计算模块604,用于分别计算三种剂量组方案所确定肿瘤图像的肿瘤像素值与背景像素值的肿瘤信号背景比,得到三种剂量组方案中每个时间区间所确定肿瘤图像的肿瘤信号背景比的计算结果;
107.预测模块605,用于针对三种剂量组方案中每个时间区间所确定肿瘤图像的肿瘤信号背景比的计算结果进行对比,预测出每位待给药患者在最佳时间段内最佳剂量的辅助用药方案。
108.对应于图1中的预测近红外指示剂的用量方法,本技术实施例还提供了一种计算机设备70,图8,如图8所示,该设备包括存储器701、处理器802及存储在该存储器701上并可在该处理器702上运行的计算机程序,其中,上述处理器702执行上述计算机程序时实现上述的方法。
109.收集每位待给药患者的术前的各项肝功能指标;
110.根据每位待给药患者的肿瘤的实际大小和术前的各项肝功能指标,确定每位待给
药患者的吲哚菁绿辅助用药方案,其中,每位待给药患者的吲哚菁绿辅助用药方案中分别包含第一剂量组方案、第二剂量组方案、第三剂量组方案,以及在三种剂量组方案中分别设置有多个预设的时间区间;
111.按照三种剂量组方案的预设的时间区间,分别生成对应于每位待给药患者的吲哚菁绿辅助用药方案中第一剂量组方案、第二剂量组方案和第三剂量组方案在每个时间区间的肿瘤图像;
112.分别计算三种剂量组方案中每个时间区间所确定肿瘤图像的肿瘤像素值与背景像素值的肿瘤信号背景比,得到三种剂量组方案中每个时间区间所确定肿瘤图像的肿瘤信号背景比的计算结果;
113.针对三种剂量组方案中每个时间区间所确定肿瘤图像的肿瘤信号背景比的计算结果进行对比,预测出每位待给药患者在最佳时间段内最佳剂量的辅助用药方案。
114.对应于图1中的预测近红外指示剂的用量方法,本技术实施例还提供了一种计算机可读存储介质,该计算机可读存储介质上存储有计算机程序,该计算机程序被处理器运行时执行以下步骤:
115.收集每位待给药患者的术前的各项肝功能指标;
116.根据每位待给药患者的肿瘤的实际大小和术前的各项肝功能指标,确定每位待给药患者的吲哚菁绿辅助用药方案,其中,每位待给药患者的吲哚菁绿辅助用药方案中分别包含第一剂量组方案、第二剂量组方案、第三剂量组方案,以及在三种剂量组方案中分别设置有多个预设的时间区间;
117.按照三种剂量组方案的预设的时间区间,分别生成对应于每位待给药患者的吲哚菁绿辅助用药方案中第一剂量组方案、第二剂量组方案和第三剂量组方案在每个时间区间的肿瘤图像;
118.分别计算三种剂量组方案中每个时间区间所确定肿瘤图像的肿瘤像素值与背景像素值的肿瘤信号背景比,得到三种剂量组方案中每个时间区间所确定肿瘤图像的肿瘤信号背景比的计算结果;
119.针对三种剂量组方案中每个时间区间所确定肿瘤图像的肿瘤信号背景比的计算结果进行对比,预测出每位待给药患者在最佳时间段内最佳剂量的辅助用药方案。
120.基于上述分析可知,与目前同一种肿瘤不同个体中,近红外指示剂代谢能力良莠不齐,成像效果不准确的问题,避免了因个体周围组织代谢不充分,从而导致肿瘤荧光信号产生统计学差异的问题相比,本技术实施例提供的利用待给药患者的各项肝功能指标与吲哚菁绿剂量/时间生成的最佳肿瘤成像的关系,建立近红外荧光导航系统的多变量公式模型,根据该公式计算肿瘤像素值与周围正常组织背景像素值的肿瘤信号背景比的计算结果,从而针对性的预测出个体患者在最佳时间段内最佳剂量的辅助用药方案,有利于开展近红外荧光影像导航技术与恶性肿瘤临床需求的紧密结合,针对性的对不同个体提供近红外指示剂精准辅助用药方案,为肿瘤切除的临床和研究提供数据的技术支撑。
121.本技术实施例所提供的预测近红外指示剂的用量装置可以为设备上的特定硬件或者安装于设备上的软件或固件等。本技术实施例所提供的装置,其实现原理及产生的技术效果和前述方法实施例相同,为简要描述,装置实施例部分未提及之处,可参考前述方法实施例中相应内容。所属领域的技术人员可以清楚地了解到,为描述的方便和简洁,前述描
述的装置和单元的具体工作过程,均可以参考上述方法实施例中的对应过程,在此不再赘述。
122.在本技术所提供的实施例中,应该理解到,所揭露装置和方法,可以通过其它的方式实现。以上所描述的装置实施例仅仅是示意性的,例如,单元的划分,仅仅为一种逻辑功能划分,实际实现时可以有另外的划分方式,又例如,多个单元或组件可以结合或者可以集成到另一个系统,或一些特征可以忽略,或不执行。另一点,所显示或讨论的相互之间的耦合或直接耦合或通信连接可以是通过一些通信接口,装置或单元的间接耦合或通信连接,可以是电性,机械或其它的形式。
123.作为分离部件说明的单元可以是或者也可以不是物理上分开的,作为单元显示的部件可以是或者也可以不是物理单元,即可以位于一个地方,或者也可以分布到多个网络单元上。可以根据实际的需要选择其中的部分或者全部单元来实现本实施例方案的目的。
124.另外,在本技术提供的实施例中的各功能单元可以集成在一个处理单元中,也可以是各个单元单独物理存在,也可以两个或两个以上单元集成在一个单元中。
125.功能如果以软件功能单元的形式实现并作为独立的产品销售或使用时,可以存储在一个计算机可读取存储介质中。基于这样的理解,本技术的技术方案本质上或者说对现有技术做出贡献的部分或者该技术方案的部分可以以软件产品的形式体现出来,该计算机软件产品存储在一个存储介质中,包括若干指令用以使得一台计算机设备(可以是个人计算机,服务器,或者网络设备等)执行本技术各个实施例方法的全部或部分步骤。而前述的存储介质包括:u盘、移动硬盘、只读存储器(rom,read-only memory)、随机存取存储器(ram,random access memory)、磁碟或者光盘等各种可以存储程序代码的介质。
126.应注意到:相似的标号和字母在下面的附图中表示类似项,因此,一旦某一项在一个附图中被定义,则在随后的附图中不需要对其进行进一步定义和解释,此外,术语“第一”、“第二”、“第三”等仅用于区分描述,而不能理解为指示或暗示相对重要性。
127.最后应说明的是:以上所述实施例,仅为本技术的具体实施方式,用以说明本技术的技术方案,而非对其限制,本技术的保护范围并不局限于此,尽管参照前述实施例对本技术进行了详细的说明,本领域的普通技术人员应当理解:任何熟悉本技术领域的技术人员在本技术揭露的技术范围内,其依然可以对前述实施例所记载的技术方案进行修改或可轻易想到变化,或者对其中部分技术特征进行等同替换;而这些修改、变化或者替换,并不使相应技术方案的本质脱离本技术实施例技术方案的精神和范围。都应涵盖在本技术的保护范围之内。因此,本技术的保护范围应以所述权利要求的保护范围为准。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。