1.本发明涉及技术领域,具体地说,是一种用于多形性胶质母细胞瘤的诊疗纳米复合物及其制备方法和应用。
背景技术:
2.多形性胶质母细胞瘤(glioblastoma multiforme,gbm)是最具侵袭性的恶性脑癌,其发病率为3/10万,5年生存率低于10%。放疗是改善gbm临床症状和提高其生存率的不可或缺的方式。然而,放疗依旧存在一定的局限性,不可避免的副作用,放疗抵抗的肿瘤微环境以及免疫抑制细胞的存在,使得放疗并不能取得较好的成效,实现对gbm的完全根治。目前针对胶质瘤的综合治疗方法主要包括手术切除肿瘤联合放疗或替莫唑胺(temozolomide,tmz)化疗,但患者的总生存时间并未得到明显改善,仍少于15个月。因此,亟需找到能够提升基于放疗的抗gbm治疗效果的方法。
3.近年来,免疫疗法的出现为肿瘤的治疗提供了新的思路,其中放疗联合免疫治疗的协同作用引起了广泛的关注。放疗产生的dna损伤可以被抗原提呈细胞(antigen-presenting cells,apcs)所识别,apcs将这些损伤片段提呈给淋巴细胞,促进淋巴细胞的产生与增殖。目前,树突状细胞(dendritic cells,dcs)被认为是最强大且最重要的apcs。成熟dcs表面分子的表达不会受胶质瘤细胞的影响,且活化的dcs与胶质瘤预后呈正相关。此外,dna损伤可以通过环gmp-amp合酶(cyclic gmp-amp synthase,cgas)/干扰素基因刺激剂(stimulator of interferon genes,sting)信号的激活,促进i型干扰素(type-iinterferons,ifn-i)的产生,进一步增强放疗诱导的抗肿瘤免疫。放疗还可以促进细胞因子和趋化因子的释放,从而增强dcs,自然杀伤细胞和cd8
t细胞在肿瘤部位的浸润。因此,放疗与免疫治疗的结合可以进一步增强肿瘤部位的免疫反应,有效改善放疗的抗肿瘤效果。在肿瘤免疫治疗中,免疫佐剂是消除肿瘤的有效方式,胞嘧啶-磷酸-鸟嘌呤寡脱氧核苷酸(cytosine-phosphorothioate-guanine oligodeoxynucleotides,cpg odns)被称为最有效的免疫佐剂,已被开发用于治疗癌症。通过模式识别受体toll样受体9(toll-like receptor 9,tlr9)的激活进行免疫治疗。cpg odns在病原体基因组中相对常见,通常充当被tlr9识别的“危险信号”,从而激活tlr9相关的信号通路。tlr9信号通路随后增加促炎性细胞因子和趋化因子(如肿瘤坏死因子-α,tumor necrosis factor-α,tnf-α)和白介素6(interleukin-6,il-6)的分泌,增强th1免疫反应。在人和小鼠胶质瘤中,tlr9主要表达在肿瘤周围浸润的免疫细胞(b淋巴细胞,浆细胞样dcs,小胶质细胞和星形胶质细胞),但在肿瘤细胞上的表达量非常低。因此,cpg odns在抗胶质瘤中发挥作用主要依赖于肿瘤微环境中的免疫细胞。值得注意的是,与其他tlr(tlr1、tlr2、tlr3、tlr4、tlr7)配体相比,cpg-odn s(tlr9配体)在小鼠脑胶质瘤的局部治疗中能达到80%的治愈率,远远优于其他tlr配体。然而,当cpg odns用于新发胶质母细胞瘤或复发性胶质母细胞瘤患者的局部治疗时,患者的生存率并未得到明显改善。一方面可能是恶性胶质瘤在免疫逃逸过程中,分泌了大量免
疫抑制因子并招募免疫抑制细胞,改造了肿瘤组织的微环境,从而逃避了免疫系统的识别和攻击。另一方面,可能与恶性胶质瘤中的免疫细胞摄取cpg odns后的低内化有关。且cpg odns在体内不够稳定,容易被脱氧核糖核酸酶降解,这会大大降低其治疗效果。因此,开发安全有效的药物传递系统对提高cpg odns的作用尤其重要。
4.近来的研究表明,基于纳米技术的递送cpg odns的载体,如空心硫化铜纳米粒子,钯纳米片,金纳米粒子,超顺磁性氧化铁,水凝胶等,均可有效改善cpg odns的药代动力学和生物分布。其中,水凝胶因为良好的生物相容性,毒性低,易于合成与修饰的优势而凸显出来。此外,基于核酸的水凝胶在药物控释和靶向肿瘤治疗的生物医学应用方面更被证实了有巨大的潜力。
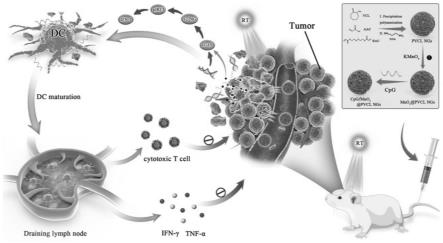
5.mri具有较高的组织分辨率且可实现多方向多参数的成像,对脑肿瘤的研究具有极大的价值,也是脑肿瘤成像的首选。t1造影剂钆由于较快的代谢并可引起肾源性纤维化,二氧化锰纳米粒子成为了其安全且有效的替代。此外,锰离子可以增强肿瘤细胞dna损伤所激活的cgas和sting的表达,进一步促进dc的成熟和细胞毒性t淋巴细胞(cytotoxic t lymphocyte,ctl)的增殖,增强辐射肿瘤细胞后诱导的抗肿瘤免疫反应。因此,我们利用聚(n-乙烯基己内酰胺)水凝胶(poly(n-vinyl caprolactam)nanogels,pvcl ngs)将mno2和cpg odns相结合(pvcl-mno
2-cpg),实现mri引导的、可增强固有免疫的针对gbm的放疗与免疫联合治疗。
6.但是关于本发明一种用于多形性胶质母细胞瘤的诊疗纳米复合物及其制备方法和应用目前还未见报道。
技术实现要素:
7.本发明的目的是针对现有技术的不足,提供一种用于多形性胶质母细胞瘤的诊疗纳米复合物及其制备方法和应用。
8.为实现上述目的,本发明采取的技术方案是:
9.第一方面,本发明提供了一种用于多形性胶质母细胞瘤的诊疗纳米复合物,所述多形性胶质母细胞瘤的诊疗纳米复合物的制备方法包括如下步骤:
10.(1)将含edc和nhs的混合溶液加入到pvcl ngs水溶液中,搅拌以活化羧基;
11.(2)加入eda反应,pvcl ngs表面的羧基通过edc/nhs偶联反应转化为氨基,得到pvcl.nh2 ngs,随后透析以去除杂质;
12.(3)将kmno4水溶液滴加到pvcl ngs分散体中并连续搅拌过夜;
13.(4)去离子水透析,获得pvcl-mno
2 ngs;
14.(5)将cpg odns加入到pvcl-mno
2 ngs水溶液中,磁力搅拌,随后离心以去除未载上的cpg,收集上清液即得。
15.优选地,步骤(1)中edc的浓度为47.925mg/ml,nhs浓度为28.773mg/ml,pvcl ngs的溶液体积为30ml。
16.优选地,步骤(2)中eda溶液体积为200.4μl,透析为水透析。
17.优选地,步骤(3)中pvcl ngs与kmno4的质量比为1:0.5,kmno4的浓度为5mg/ml;pvcl ngs的浓度为7mg/ml。
18.优选地,步骤(5)中pvcl-mno
2 ngs的浓度为5.4mg/ml。ngs与cpg的质量比为1mg:
30μg。
19.第二方面,本发明提供了如上所述的诊疗纳米复合物的制备方法,包括如下步骤:
20.(1)将含edc和nhs的混合溶液加入到pvcl ngs水溶液中,搅拌以活化羧基;
21.(2)加入eda反应,pvcl ngs表面的羧基通过edc/nhs偶联反应转化为氨基,得到pvcl.nh2 ngs,随后透析以去除杂质;
22.(3)将kmno4水溶液滴加到pvcl ngs分散体中并连续搅拌过夜;
23.(4)去离子水透析,获得pvcl-mno
2 ngs;
24.(5)将cpg odns加入到pvcl-mno
2 ngs水溶液中,磁力搅拌,随后离心以去除未载上的cpg,收集上清液即得。
25.第三方面,本发明提供了如上所述的诊疗纳米复合物在制备治疗多形性胶质母细胞瘤的药物中的应用。
26.进一步地,本发明提供了如上所述的诊疗纳米复合物在联合免疫协同治疗多形性胶质母细胞瘤中的应用。
27.进一步地,本发明提供了如上所述的诊疗纳米复合物在制备mri成像的材料中的应用。
28.本发明优点在于:
29.1、本发明以pvcl水凝胶为模板,制备了pvcl-mno
2-cpg纳米颗粒,所得产品具有良好的稳定性。使用pvcl-mno
2-cpg联合放疗,进而实现对原位多形性胶质母细胞瘤的治疗以及体内mri成像。本发明涉及了三个基本原理:(1)mn
2
可以增强cgas-sting通路的激活,产生ifn-i,同时实现t
1-加权mri成像。(2)mn
2
可通过分解肿瘤微环境中的h2o2产生氧气,实现放疗增敏。(3)以pvcl水凝胶为载体,可有效保护免疫佐剂cpg odns不被降解,促进免疫细胞的摄取。
30.本发明的制备过程温和,简单易行。
31.2、本发明方法制备的pvcl-mno
2-cpg纳米颗粒具有良好的稳定性和生物相容性。
32.3、本发明制备得到的pvcl-mno
2-cpg具有良好的抗肿瘤以及mri成像效果,为肿瘤的诊治以及癌症免疫疗法提供了新思路。
具体实施方式
33.下面结合具体实施方式,进一步阐述本发明。应理解,这些实施例仅用于说明本发明而不用于限制本发明的范围。此外应理解,在阅读了本发明记载的内容之后,本领域技术人员可以对本发明作各种改动或修改,这些等价形式同样落于本技术所附权利要求书所限定的范围。
附图说明
34.附图1是mri引导下的多形性胶质母细胞瘤的诊疗一体化流程图。
35.附图2是本发明制备的pvcl-mno
2-cpg的原理图。
36.附图3是本发明制备的pvcl-mno
2 ngs的xps图。
37.附图4是本发明制备的pvcl-mno
2-cpg的dls分布图。
38.附图5是本发明制备的pvcl-mno2和pvcl-mno
2-cpg的zeta电位图。
39.附图6是本发明制备的pvcl-mno
2-cpg的tem图片(a),以及相应的尺寸分布直方图(b)。
40.附图7是本发明制备的pvcl-mno
2-cpg在不同浓度下(0,20,40,60,80,100μg/ml)与bmdcs细胞共培养后的mtt结果。
41.附图8是本发明制备的pvcl-mno
2-cpg与bmdcs细胞共培养8h后,细胞对pvcl-mno
2-cpg的摄取情况。
42.附图9是本发明制备的pvcl-mno
2-cpg联合放疗,与c6细胞共培养48h后的mtt结果。
43.附图10是本发明制备的pvcl-mno
2-cpg与c6细胞共培养6小时,再电离辐射2h后,产生的γ-h2ax的免疫荧光结果。
44.附图11是本发明制备的pvcl-mno
2-cpg联合放疗对c6增殖影响的平板克隆结果。
45.附图12是本发明制备的pvcl-mno
2-cpg联合放疗后cgas-sting通路上游蛋白sting和下游蛋白ifn-β的western blot结果。
46.附图13是本发明制备的pvcl-mno
2-cpg联合放疗干预后的c6细胞与bmdcs共培养,bmdcs的表面marker cd11c,mhc ii,cd80,cd86表达的流式检测结果。
47.附图14是本发明制备的pvcl-mno
2-cpg联合放疗干预后的c6细胞与bmdcs共培养后分泌的tnf-α结果。
48.附图15是本发明制备的pvcl-mno
2-cpg联合放疗干预后的c6细胞与bmdcs共培养后分泌的ifn-γ结果。
49.附图16是本发明制备的pvcl-mno
2-cpg在小鼠多形性胶质母原位瘤模型中的mri成像图(a)以及信噪比(signal-to-noise ratio,snr)(b)。
50.附图17是本发明制备的pvcl-mno
2-cpg联合放疗进行小鼠原位多形性胶质母原位瘤模型治疗的实验设计概要图(a)和治疗期间每3天进行的mri扫描图片(b)。
51.附图18是本发明制备的pvcl-mno
2-cpg联合放疗进行原位小鼠多形性胶质母原位瘤模型治疗的体积(a)和体重变化(b)。
52.附图19是本发明制备的pvcl-mno
2-cpg联合放疗治疗原位小鼠多形性胶质母原位瘤模型后4天进行h&e和tunel染色(a)及肿瘤区域tunel阳性细胞的定量分析(b)。
53.附图20是本发明制备的pvcl-mno
2-cpg联合放疗治疗原位小鼠多形性胶质母原位瘤模型后,流式检测引流淋巴结(a)和脾脏(b)中成熟dcs的表达情况。
54.附图21是本发明制备的pvcl-mno
2-cpg联合放疗治疗小鼠多形性胶质母原位瘤模型后,western blot检测各组肿瘤组织中sting、irf3、pirf3及ifn-β蛋白的表达情况。
55.附图22是本发明制备的pvcl-mno
2-cpg联合放疗治疗小鼠多形性胶质母原位瘤模型后,流式细胞仪评估不同组引流淋巴结、脾脏、肿瘤组织中的cd8
t细胞比例。
56.附图23是本发明制备的pvcl-mno
2-cpg联合放疗治疗小鼠多形性胶质母原位瘤模型后,流式评估不同组引流淋巴结(a)、脾脏(b)和肿瘤组织(c)中cd3
cd8
t细胞的定量分析。
57.附图24是本发明制备的pvcl-mno
2-cpg联合放疗治疗小鼠多形性胶质母原位瘤模型,elisa评估不同组血清中的tnf-α分泌。
58.附图25是本发明制备的pvcl-mno
2-cpg处理健康小鼠7天后解剖的小鼠主要器官
(心、肝、脾、肺、肾和脑)的图片(a)和主要器官(心、肝、脾、肺、肾、脑)的重量(b)。
59.附图26是本发明制备的pvcl-mno
2-cpg处理健康小鼠7天后的h&e染色。
60.附图27是本发明制备的pvcl-mno
2-cpg处理健康小鼠7天后小鼠血液学指标及尿常规分析。
61.附图28是本发明制备的pvcl-mno
2-cpg在原位多形性胶质母细胞瘤的体内生物分布情况。
62.实施例1
63.将含edc(287.55mg)和nhs(172.635mg)的混合溶液加入到30ml pvcl ngs(210mg)水溶液中,搅拌两小时以活化羧基。上述溶液与过量的eda(200.4μl)反应3天,pvcl ngs表面的羧基通过edc/nhs偶联反应转化为氨基,得到pvcl.nh
2 ngs,随后透析3天以去除杂质。使用注射泵以0.1ml/min的速度将kmno4(5mg/ml)水溶液滴加到pvcl ng(7mg/ml),pvcl ngs与kmno4比例为1:0.5分散体中并连续搅拌过夜。上述溶液去离子水透析3天后,获得pvcl-mno
2 ngs。
64.xps结果(附图2)证明了pvcl-mno
2 ngs已经被成功构建。
65.dls测试结果(附图4)说明cpg被成功搭载至pvcl-mno2ngs,形成了pvcl-mno
2-cpg纳米颗粒,表明pvcl-mno
2-cpg具有较好的水溶性。zeta电位测试结果(附图5)说明pvcl-mno
2-cpg的zeta电位为-9.8mv。tem测试结果表明(附图6),pvcl-mno
2-cpg的尺寸为106.2nm,表现出良好的单分散性。
66.实施例2
67.使用含有10%胎牛血清的rpmi-1640培养基培养小鼠原代未成熟树突状细胞bmdcs。按照1
×
104的密度接种于6孔板中,在37℃,含有5%co2的细胞培养箱中培养24h。吸去培养基,然后加入不同浓度的(pvcl水凝胶浓度为0,20,40,60,80,100μg/ml)的pvcl-mno
2-cpg,每组6个复孔,24小时后弃去培养基上清,每孔加入10μl mtt溶液(5mg/ml),继续孵育4h,然后小心吸取孔内上清液,每孔加入100μl dmso,震荡10min后,使用酶标仪测定490nm波长下的吸光度。根据(od
pvcl-mno2-od blank
)/(od
control-od
blank
)
×
100%计算出各组细胞存活率。
68.mtt法测试结果如附图7显示,在pvcl水凝胶浓度为40μg/ml时,bmdcs的活性为60%以上,可使用该浓度用于后续的细胞实验。
69.实施例3
70.按照bmdcs(1
×
106/孔)的密度接种于共聚焦单孔培养皿中,细胞贴壁后分别加入cy5.5标记的游离cpg和pvcl-mno
2-cpg并共同孵育8小时。然后收集bmdcs并用4%多聚甲醛固定。细胞核用dapi染色后,使用激光扫描共聚焦显微镜(confocal laser scanning microscope,clsm)观察bmdcs对游离cpg和pvcl-mno
2-cpg的摄取情况(附图8)。结果表明,与bmdcs共培养8h时,与游离cpg相比,pvcl-mno
2-cpg可以更多的被bmdcs摄取,说明以pvcl纳米水凝胶为载体时,可以增强免疫细胞对cpg odns的摄取。
71.实施例4
72.按照8
×
103细胞/孔的密度将培养好的c6细胞种于96孔板中,培养24h,然后加入40μg/ml的pvcl-cpg、pvcl-mno2、pvcl-mno
2-cpg,每组6个复孔,共培养6小时后,使用6gy的剂量辐射细胞,48小时后弃去培养基上清,每孔加入10μlmtt溶液(5mg/ml),继续孵育4h,然
后小心吸取孔内上清液,每孔加入100μl dmso,震荡10min后,使用酶标仪测定490nm波长下的吸光度。根据(od
pvcl-mno2-od blank
)/(od
control-od
blank
)
×
100%计算出各组细胞存活率。mtt结果表明,pvcl-mno2和pvcl-mno
2-cpg处理过的细胞,经放疗后细胞存活率更低,分别是37%和36%,而用pvcl-cpg处理和未处理组的存活率为73%和72%,说明锰可以增强放疗的抗肿瘤效果。
73.实施例5
74.将2
×
105个c6细胞预先接种在共聚焦培养皿中。细胞贴壁后,分别加入pvcl-cpg、pvcl-mno2、pvcl-mno
2-cpg,6小时后进行x线照射。2小时后终止培养,用4%多聚甲醛固定,然后分别进行破膜和封闭处理,加入200μlγ-h2ax抗体(1:400),4℃下孵育过夜。第二天用pbs洗涤后,加入抗兔igg fab2 alexa488分子探针(1:500),暗盒中孵育1小时。最后用dapi染色并通过clsm进行评估。结果如图9所示,与单独放疗及放疗联合pvcl-cpg组相比,pvcl-mno
2-cpg及pvcl-mno2联合放疗可产生更多的γ-h2ax。说明放疗联合锰可产生更多的dna损伤。
75.实施例6
76.将c6细胞按照每孔1000的密度种植于六孔板中,培养24h,弃掉培养液,换新鲜培养液,并分别加入pvcl-cpg、pvcl-mno2、pvcl-mno
2-cpg,未加入材料组作为对照,继续培养6h后用6gy的剂量辐射,然后细胞箱中培养。每两天进行一次换液,在第8天终止反应。pbs清洗3遍后,用4%多聚甲醛固定30min,再pbs清洗3遍,结晶紫染色15分钟,自来水冲洗后晾干,计数每个孔形成的克隆数,计算细胞存活分数,结果如附图11所示,相比较放疗组,pvcl-mno
2-cpg及pvcl-mno2联合放疗的细胞存活分数为40.8%和36.3%(p<0.05)。说明放疗联合锰可以更好的抑制肿瘤细胞的增殖。
77.实施例7
78.将c6细胞按照每孔1
×
105/ml的密度种植于六孔板中,培养24h,弃掉培养液,换新鲜培养液,进行6gy的剂量辐射,然后分别加入pvcl-cpg、pvcl-mno2、pvcl-mno
2-cpg,共培养48h后,提取细胞蛋白,用western blot检测cgas-sting通路的sting及ifn-β的表达。结果如附图12所示,pvcl-mno
2-cpg及pvcl-mno2联合放疗可以增强上游sting的表达,进而使下游蛋白ifn-β的表达增加。说明锰可以增强放疗激活的cgas-sting通路。
79.实施例8
80.将c6细胞按照每孔3
×
105/ml的密度种植于transwell上室中,bmdcs细胞按照每孔1
×
106/ml的密度种植于transwell下室中。24h后,弃掉上室c6细胞的培养液,换新鲜培养液,并分别加入pvcl-cpg、pvcl-mno2、pvcl-mno
2-cpg,共培养6h后,进行电离辐射,此时立即将铺有c6细胞的上室转移至bmdcs下室的上方,24h后终止反应。收集下室的培养基用于elisa检测tnf-α和ifn-γ的分泌,同时收集下室的bmdcs细胞,pbs清洗2遍后,分别用抗cd11c-pe、抗cd80-bv421、抗cd86-fitc及抗mhc ii-apc流式抗体进行染色,避光冰上敷育15min,pbs清洗2遍后,加入pbs重悬并上机检测。结果如附图13、14、15所示,放疗组cd11c
cd80
cd86
细胞的比例为22.7%,放疗联合pvcl-cpg组为24.6%,放疗联合pvcl-mno2组为24.5%,放疗联合pvcl-mno
2-cpg为28.1%,且放疗联合pvcl-mno
2-cpg组均可分泌较高的抗肿瘤细胞因子tnf-α和ifn-γ,说明cgas-sting通路的激活及免疫佐剂cpg的联合作用可以产生更强的免疫激活作用。
81.实施例9
82.使用icr小鼠建立小鼠多形性胶质母细胞瘤原位动物模型,用于pvcl-mno
2-cpg的mri成像。c6细胞培养于37℃、5%co2的培养箱中,选取对数生长期的细胞,弃去培养液,pbs冲洗3遍,离心获得细胞沉淀,加入适量pbs重悬。小鼠头部剃毛处理,酒精棉球擦拭小鼠头部,沿头的矢状缝切开头皮,约1cm,然后用微型钻孔器在矢状缝右2mm,前囟后2mm处钻孔,微量注射器抽取5μl细胞(1
×
105个细胞),在该钻孔处下3mm处以1μl/min的速度注入细胞,注射结束后留针15min,最后缝合头皮,碘伏消毒,待小鼠醒来后放至小鼠笼。1周后将pvcl-mno
2-cpg(mn:61ug)尾静脉注射至原位多形性胶质母细胞瘤小鼠,分别在注射后的0、2、4、6小时,用3.0t mri系统进行磁共振扫描,并测量不同时间点的信噪比,结果见附图16。附图16a为注射材料后不同时间点的mri图像,附图16b为对应的snr值,可以看出,pvcl-mno
2-cpg在注射后4h达到信号值的高峰,具有最高的snr值,随后出现了下降趋势。以上结果说明,pvcl-mno
2-cpg可克服血脑屏障的障碍,聚集在肿瘤部位,实现t
1-加权mri成像。
83.实施例10
84.小鼠成瘤后,将其分为5组:rt组,rt pvcl-mno2组,rt pvcl-cpg组,rt pvcl-mno
2-cpg组,rt pvcl-mno
2-cpg sting抑制剂c-176组(rt=2gy)。每隔3天进行治疗与mri扫描,监测肿瘤体积变化,每两天进行称重。rt pvcl-mno
2-cpg sting抑制剂c-176组在建模的第一天进行sting抑制剂c-176腹腔注射,最后一次治疗后停止腹腔注射。在第15天时,解剖小鼠,取出肿瘤组织进行tunel和he染色。提取肿瘤组织的蛋白进行western blot检测sting,pirf3,irf3和ifn-β的表达水平。解剖出颈部和腋窝淋巴结及脾脏,制备单细胞悬液,进行抗cd8-fitc、抗cd3-percp-cy 5.5、抗mhc ii-apc、抗cd11c-pe流式抗体染色,并上机检测cd3
cd8
及cd11c
mhc ii
的比例。制备肿瘤组织的单细胞悬液,抗cd8-fitc和抗cd3-percp-cy 5.5流式抗体染色后上机检测。最后elisa检测血清中tnf-α水平。结果如附图17
–
24所示,9天的治疗过程中,单放疗组,体积较治疗前增长了5.5倍,rt pvcl-mno
2-cpg组体积仅增长了1.65倍。此外,除了rt pvcl-mno
2-cpg组,rt组、rt pvcl-cpg组和rt pvcl-mno2组治疗中也出现了不同程度的体重下降。rt pvcl-mno
2-cpg组治疗后,肿瘤细胞的坏死最严重,且凋亡的区域也最大。颈部和腋窝提取的淋巴结及脾脏制备的单细胞悬液,经流式检测后发现,rt pvcl-mno
2-cpg组淋巴结中cd11c
mhc ii
dc的比例为1.27%,脾脏中cd11c
mhc ii
dc的比例为6.1%,均较其他组高,表明rt与pvcl-mno2-cpg的联合作用可以有效增加成熟dcs的比例。根据肿瘤组织中各蛋白的表达量可见,rt pvcl-mno2和rt pvcl-mno
2-cpg组中,sting的表达明显高于rt和rt pvcl-cpg组。当sting被激活后,其下游蛋白pirf3和ifn-β的表达量也明显增加,当用sting抑制剂c-176将cgas-sting通路阻断时,sting的表达降低,pirf3和ifn-β的表达也随之下降。这些结果验证了pvcl-mno
2-cpg联合放疗对免疫细胞的激活,与mn
2
增强的cgas-sting通路密不可分。在引流淋巴结、脾脏和肿瘤组织中,rt pvcl-mno
2-cpg组的cd3
cd8
t细胞群较单放疗组更密集,分别为21.2%,12.1%和1.24%,rt组的为14.8%,5.4%和0.08%。加入sting抑制剂后,cd3
cd8
t细胞群明显变的稀疏,cd3
cd8
t的比例分别为13.5%,5.9%和0.16%,说明pvcl-mno
2-cpg可有效改善放疗后的肿瘤免疫微环境。另外,elisa检测不同组治疗后小鼠血清中的tnf-α,rt pvcl-mno
2-cpg组分泌的tnf-α为32.9pg/ml,明显高于rt组(14.8pg/ml),当cgas-sting通路被抑制时,tnf-α的分泌也有所下降,为12.1pg/ml,以上结果与各组的cd3
cd8
t细胞的分布相一致。
85.实施例11
86.健康icr小鼠尾静脉注射pvcl-mno
2-cpg(mn:61.28μg),注射pbs组为对照组。注射7天后收集所有小鼠尿液进行尿常规分析。处死小鼠,取血进行血液学指标检测。解剖出主要脏器称重,4%多聚甲醛固定后进行h&e染色。结果如附图25-27所示,与对照组相比,pvcl-mno
2-cpg组小鼠主要脏器在外观及重量上未见异常,h&e染色也未见明显的坏死等损伤。此外,对小鼠血液和尿液进行的血液学分析和常规尿液表明,血液中的常规生化参数和尿液参数均在相应的参考范围内。以上结果表明,我们构建的pvcl-mno
2-cpg在发挥其生物学功能的同时不会引起显著的系统毒性。
87.实施例12
88.icr小鼠进行c6原位胶质瘤建模后,尾静脉注射pvcl-mno
2-cpg(mn:61.28μg)。尾静脉注射pvcl-mno
2-cpg后,分别在12h、24h和48h处死小鼠。解剖出主要器官(心、肝、脾、肺、肾和脑),进行icp检测。结果如附图28所示,pvcl-mno
2-cpg主要富集于肝脏和肾脏,说明肝脏和肾脏是代谢的主要部位。
89.以上所述仅是本发明的优选实施方式,应当指出,对于本技术领域的普通技术人员,在不脱离本发明原理的前提下,还可以做出若干改进和补充,这些改进和补充也应视为本发明的保护范围。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。