新型aie分子纳米探针作为神经内分泌肿瘤诊断治疗荧光染色试剂的应用
技术领域
1.本发明属神经内分泌肿瘤诊断治疗荧光染色试剂技术领域,涉及新型aie分子纳米探针作为神经内分泌肿瘤诊断治疗荧光染色试剂的应用。
背景技术:
2.近年来高速发展的光学活体生物成像越来越多的应用于生物医学成像领域,其中光声-荧光双模态成像为定位肿瘤及区域淋巴结提供了灵敏度极高的实时可视化效果,具有非侵入性、无电离辐射、高时空分辨率、快速输出和低成本等突出优点。可以帮助临床医生在术前准确定位深部肿瘤并在术中快速确定淋巴结清扫范围,以精准地进行手术。
3.在光学活体生物成像的过程中,光子的穿透深度主要取决于组织的吸收和散射。同时,组织本身产生的荧光和散射光子会对光子穿透过程造成干扰噪声和背景辐射。因此,荧光成像技术在实际应用中也有局限性,生物体内的一些活性成分(如黑色素、血红蛋白、细胞色素等)在可见光波段(400-700nm)内有较高的光吸收和光散射,这将降低可见光的穿透深度。此外,生物体内富含许多发光的大分子(通常位于可见光区),这些生物大分子在可见光激发下也会产生非特异性的荧光发射,从而干扰成像结果。
4.由于近红外光(near-infrared,nir)在生物组织中的光子吸收、散射和自发荧光比可见光少,因此可以更有效地穿透皮肤等生物组织。目前的nir窗口可以人为地分为nir
‑ⅰ
(700-1000nm)和nir
‑ⅱ
(1000-1700nm)窗口27。nir
‑ⅱ
窗口可进一步分为nir
‑ⅱ
a’(1000-1300nm)、nir
‑ⅱ
a(1300-1400nm)和nir
‑ⅱ
b(1500-1700nm)三个子区域。
5.目前,经美国食品和药物管理局(food and drug administration,fda)批准,nir
‑ⅰ
型荧光染料吲哚菁绿(indocyanine green,icg)和亚甲基蓝(methylene blue,mb)目前已在临床上获得广泛使用。尽管如此,在nir
‑ⅰ
窗口实现毫米级的组织穿透仍然很难满足实际临床应用的多层次和多样化要求。
6.在实践过程中,nir
‑ⅰ
荧光成像在深层组织的成像质量远没有达到足够的分辨率,并且由于组织自发荧光产生的大量背景噪声,以及nir
‑ⅰ
型光子仅能达到的1-2mm的组织穿透深度,导致了其成像灵敏度、对比度和空间分辨率不足。
7.为进一步提高荧光成像技术的分辨率、灵敏度和组织穿透深度,研究人员重新审视了光子和生物组织之间的相互作用,并进行了探索性研究。2009年,斯坦福大学戴宏杰课题组的一项开创性工作揭示了一个新的生物成像窗口,nir
‑ⅱ
窗口。该研究首次报道了一类单壁碳纳米管(single-walled carbon nanotube,swcnts),其荧光发射波长为950-1600nm。
8.进一步的实验表明,这种材料可用于活体小鼠的成像,通过检测swcnts在950-1400nm处的荧光信号,研究人员获得了深层皮肤组织下血管的高分辨率成像。新型nir
‑ⅱ
型荧光材料在生物体内荧光成像中显示出卓越的性能。与nir
‑ⅰ
荧光成像相比,新出现的nir
‑ⅱ
荧光成像技术具有更长的波长,大大降低了组织的自发荧光(当波长>1500nm时,背
景几乎为0)、光子散射和吸收,进而显著降低了成像的背景噪声并增强了组织穿透能力,增强了荧光成像的空间分辨率和成像保真度,在荧光生物传感和生物成像的疾病诊断方面表现出巨大的潜力。此后,越来越多的nir
‑ⅱ
型荧光探针被成功开发并应用于生物医学成像领域。
9.迄今为止,研究人员已经开发了多种nir
‑ⅱ
型探针,按照材料类型,主要分为无机荧光探针(如swcnts40-44)、金属硫化物(如硫化银,硫化铅)量子点、宽带隙半导体量子点(如砷化铟量子点、稀土纳米粒子52-54)和有机荧光探针(如共轭聚合物、小分子有机染料)。
10.在生物检测的应用中,有机荧光探针与无机荧光探针相比具有很大的优势,因为有机荧光探针的物理和光学特性可以通过结构设计精细定制,易于加工,具有很强的调节性。此外,另一个关键因素是有机荧光探针具有良好的生物相容性,在体内应用时较少引起急性或慢性毒性作用,可以更好地用于临床。
11.然而,由于大多数有机荧光探针在结构上倾向于疏水,当它们被封装在两亲性聚合物形成的疏水空腔内部以增加水分散性时,有机荧光分子常会发生聚集,进而引起荧光淬灭,称为聚集诱导淬灭(aggregation induced quenching,acq),导致成像效果不理想。
12.近年来,聚集诱导发光(aggregation induced emission,aie)材料的开发为解决这一瓶颈问题提供了良好的解决方案。aie是指一种独特的发光现象,即荧光分子在单分子状态下不发光或弱发光,但在聚集状态下显示出显著增强的荧光发射。与传统的acq荧光团不同,aie材料(aggregation-induced emission luminogens,aiegens)允许在高浓度下使用,在成像过程中显示出高信噪比和高光稳定性,能够实现目标物的长期靶向和追踪。此外,aie材料还具有大斯托克斯位移、高光漂白阈值和聚集开启机制等特点,在荧光成像方面具有独特的优越性。自2001年唐本忠院士小组首次报告以来,aiegens在生物医学领域引起了广泛关注,已被应用于生物标记、诊断和成像。
13.相比较传统nir
‑ⅱ
型有机荧光探针,nir
‑ⅱ
型aiegens具有高光漂白阈值、高信噪比、高荧光量子产率(0.18%-14.8%)、聚集性荧光开启等优点,并在包括肿瘤诊断、淋巴结定位、血管成像等临床成像应用中实现了微观解剖结构的高清晰可视化。
14.虽然nir
‑ⅱ
荧光成像相比nir-i荧光成像提高了灵敏度,然而受限于光子成像原理,其空间分辨率仍然有限。光声成像作为一种新兴的光学成像方式,由于可以提供厘米级的成像深度,受到了研究人员广泛的关注。光声成像(photoacoustic imaging,pai),也被称为光声断层成像(photoacoustic tomography,pat)或多光谱光声层析成像(multispectral photoacoustic tomography,msot),是一种基于声学检测的混合成像方法。在pa成像过程中,组织中的光吸收剂(成像剂)被短脉冲激光照射后吸收激光束的能量并部分转化为热量,产生局部温度的瞬时升高,随后通过热弹性膨胀产生压力波(声波)。然后,这些声波被组织外的超声换能器收集,并根据其到达时间转化为pa图像。由于声波在生物组织中的散射远小于光子,而且散射的光子也可以促进声波的产生,所以pa成像能够在深层组织中进行高空间分辨率的绘图(6cm),同时保留光学成像的高对比度。迄今为止,pa成像已在临床转化中显示出巨大的潜力,可用于前列腺癌和乳腺癌的早期诊断,肿瘤转移的监测,内窥镜胃肠道成像和治疗监测。
15.随着现今基础研究和临床诊断的要求不断提高,同时结合两种或更多成像模式的
诊断方式由于可以提供更多的诊断信息,具有更广阔的临床应用前景。
16.在这些多模态成像方式中,光声成像与荧光成像联合的成像方式由于可以结合光声成像的高空间分辨率和荧光成像的高灵敏度,优势互补,吸引了研究人员更多的关注。与单一模式的荧光成像相比,光声-荧光双模态成像可以在术前借助光声成像提供高空间分辨率的肿瘤信息,之后通过nir
‑ⅱ
荧光成像辅助临床医生在术中准确定位肿瘤部位的前哨淋巴结并引导手术切除。
17.因此,找到一种兼具nir
‑ⅱ
型荧光探针和光声材料两种特性的,无生无毒性的化合物成为研究热点。
技术实现要素:
18.本发明所要解决的技术问题是提供一种新型aie分子,其荧光发射波长在950-1600nm的nir
‑ⅱ
窗口,并且制备的aie探针(aiegens)可以同时实现光声-荧光双模态成像。
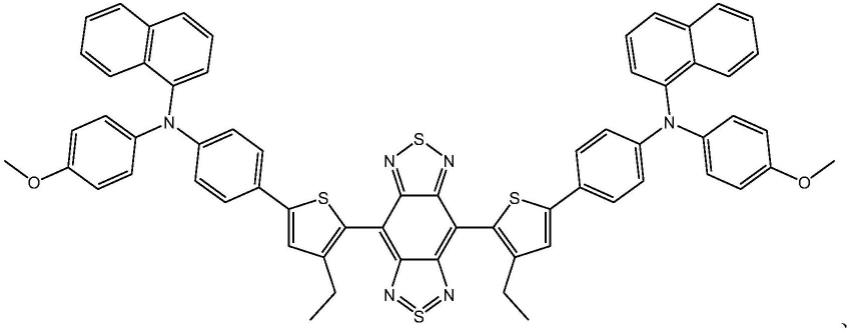
19.本发明公开了新型aie分子纳米探针作为神经内分泌肿瘤诊断治疗荧光染色试剂的应用,所述新型aie分子为如通式(i)所示结构的化合物:
[0020][0021]
或及其衍生物;
[0022]
其中,r选自烷基、烷氧基中至少一种。
[0023]
进一步的,所述衍生物为水合物、盐、配合物、螯合物、酯中至少一种。
[0024]
优选的,所述新型aie分子为
[0025][0026]
中任意一种。
[0027]
进一步地,给药方式为静脉注射、瘤内注射中至少一种。
[0028]
进一步地,给药浓度为100-300μm。
[0029]
优选的,给药浓度为300μm。
[0030]
本发明的有益效果在于:
[0031]
提供了新型aie分子纳米探针作为神经内分泌肿瘤诊断治疗荧光染色试剂,可以同时实现光声-荧光双模态成像。
附图说明
[0032]
图1实施例1中间产物2的核磁氢谱;
[0033]
图2实施例1目标产物aie分子c-ntbd的核磁氢谱;
[0034]
图3实施例1目标产物aie分子c-ntbd的核磁碳谱;
[0035]
图4实施例1目标产物aie分子c-ntbd的高清质谱;
[0036]
图5实施例2中间产物2的核磁氢谱;
[0037]
图6实施例2目标产物aie分子o-ntbd的核磁氢谱;
[0038]
图7实施例2目标产物aie分子o-ntbd的核磁碳谱;
[0039]
图8实施例2目标产物aie分子o-ntbd的高清质谱;
[0040]
图9实施例1-2在thf中的紫外吸收光谱及紫外吸收与浓度梯度之间的的定量关系图;
[0041]
图10实施例1-2的二甲基亚砜-甲苯混合物在1000nm lp滤光片下的相对荧光强度
(i/i0)与fw的关系图;
[0042]
图11实施例3-4制备的纳米探针的dls、tem,以及紫外吸收和荧光发射光谱图;
[0043]
图12实施例3-4制备的纳米探针光物理进行表征图;
[0044]
图13实施例3-4制备的纳米探针在的红外热像图;
[0045]
图14实施例3-4制备的纳米探针光热数据曲线图;
[0046]
图15实施例3-4制备的纳米探针(100μm)冷却周期得到-lnθ的线性时间曲线图;
[0047]
图16实施例3-4制备的纳米探针在不同激发波长(680-900nm)下的(12.5μm)的光声谱图;
[0048]
图17实施例3-4制备的纳米探针在不同浓度下(0-12.5μm)激光激发下的pa图像及函数图;
[0049]
图18应用例1-2分别孵育24小时后的细胞毒性图;
[0050]
图19应用例1-2体内安全性图;
[0051]
图20应用例1指定时间间隔尾静脉注射后肿瘤部位pa图像及肿瘤部位pa强度与注射后时间的关系图;
[0052]
图21应用例1nir-ii血管成像数据图;
[0053]
图22应用例1尾静脉注射24小时后c-ntbd nps在体外组织成像中的生物分布特征图;
[0054]
图23应用例3nir
‑ⅱ
荧光成像引导的前哨淋巴结术前图;
[0055]
图24应用例3nir
‑ⅱ
荧光成像引导的前哨淋巴结术中图;
[0056]
图25应用例3nir
‑ⅱ
荧光成像引导的前哨淋巴结术后图;
[0057]
图26应用例3瘤内注射5小时后c-ntbd nps在体外组织成像中的生物分布特征图。
具体实施方式
[0058]
下面结合实施例对本发明的具体实施方式作进一步描述,以下实施例仅用于更加清楚地说明本发明的技术实施例,而不能以此来限制本发明的保护范围。
[0059]
实施例1
[0060]
r取代基选取乙基,制备出的目标产物记作c-ntbd。
[0061]
新型aie分子的合成方法,包括如下步骤:
[0062]
1)中间产物1的制备
[0063]
称取化合物b1(3-乙基噻吩)(113mg,1.0mmol)加入250ml圆底烧瓶中。在氩气氛围下,加入80ml超干thf。然后在低温反应仪中将反应体系冷却至-78℃,然后在反应体系中缓慢滴加正丁基锂(2.5m己烷溶液,0.4ml,1.0mmol)。之后,反应体系继续维持在-78℃并搅拌2小时。2小时后,在反应体系中加入0.36ml三丁基氯化锡(390mg,1.2mmol),将反应体系缓慢升温至室温,搅拌过夜,即得到中间产物1。反应完成后,待反应降至室温,将反应液旋转蒸发浓缩,获得的粗品无需进一步提纯即可用于下一步反应;
[0064]
2)中间产物2的制备
[0065]
称取中间产物1(401mg,1.0mmol)和化合物b2(404mg,1.0mmol)和四三苯基膦钯(23.1mg,0.02mmol)加入50ml两口圆底烧瓶中。在氩气氛围下,加入无水甲苯(10ml)。利用油浴加热升温至110℃并搅拌8小时,待反应完成,将反应液旋转蒸发浓缩。柱层析方式(乙
酸乙酯:石油醚=1:5)纯化得到淡黄色油状物,即得到中间产物2,产率93.7%;
[0066]
3)中间产物3的制备
[0067]
称取中间产物2(3g,6.9mmol)加入250ml圆底烧瓶中。在氩气氛围下,加入80ml超干thf。然后在低温反应仪中将反应体系冷却至-78℃,然后在反应体系中缓慢滴加正丁基锂(2.4m己烷溶液,2.76ml,)。随后,反应体系继续维持在-78℃并搅拌2小时。2小时后,在反应体系中加入2.4ml三丁基氯化锡(2.60g,8.0mmol),将反应体系缓慢升温至室温,搅拌过夜,即得到中间产物3。反应完成后,将反应液旋转蒸发浓缩,获得的粗品无需进一步提纯即可用于下一步反应。
[0068]
4)目标产物aie分子的制备
[0069]
称取中间产物3(3.26g,4.5mmol)和4,7-二溴苯并[1,2-c:4,5-c']双([1,2,5]噻二唑(580mg,1.5mmol)和四三苯基膦钯(34.7mg,0.03mmol)加入250ml两口圆底烧瓶中。在氩气氛围下,加入无水甲苯(100ml)。利用油浴加热升温至110℃搅拌小时,待反应完成,将反应液旋转蒸发浓缩。柱层析方式(二氯甲烷:石油醚=5:1)纯化得950mg黑色固体粉末,即为目标产物aie分子c-ntbd,产率57.4%。
[0070]
上述化合物的分子式如表1所示:
[0071]
表1实施例1中化合物结构式一览表
[0072][0073]
[0074]
为了证明反应的进行,特别做出如下表征,如附图1-4所示:
[0075]
如附图1所示,实施例1中间产物2的核磁氢谱表征如下:1h nmr(400mhz,chloroform-d,298k)δ(ppm):8.16
–
8.09(m,1h),7.99(d,j=8.2hz,1h),7.72
–
7.67(m,2h),7.63
–
7.59(m,2h),7.57
–
7.49(m,2h),7.46(d,j=8.8hz,2h),7.32(d,j=8.8hz,1h),7.10
–
7.01(m,3h),6.95(d,j=8.8hz,1h),4.02(s,3h),2.87(q,j=7.5hz,2h),1.18(t,j=7.3hz,3h).
[0076]
如附图2所示,实施例1目标产物aie分子c-ntbd的核磁氢谱表征如下:1h nmr(400mhz,chloroform-d,298k)δ(ppm):7.97(d,j=8.2hz,2h),7.89(d,j=8.2hz,2h),7.77(d,j=8.2hz,2h),7.50
–
7.45(m,8h),7.42
–
7.36(m,2h),7.36
–
7.32(m,4h),7.15(d,j=8.8hz,4h),6.87
–
6.82(m,8h),3.79(s,6h),2.59(q,j=7.5hz,4h),1.22(t,j=7.5hz,6h).
[0077]
如附图3所示,实施例1目标产物aie分子c-ntbd的核磁碳谱表征如下:
13
c nmr(101mhz,chloroform-d,298k)δ(ppm):155.88,153.26,149.14,147.57,146.88,143.47,141.05,135.32,131.04,128.48,127.44,126.83,126.73,126.40,126.21,125.68,124.35,123.89,119.47,115.97,114.73,55.53,23.83,14.77.
[0078]
如附图4所示,实施例1目标产物aie分子c-ntbd的高清质谱表征如下:hrms,m/z:[m] calcd.1060.2722,found 1060.2686.
[0079]
实施例2
[0080]
r取代基选取甲氧基,制备出的目标产物记作o-ntbd。合成步骤与实施例1相同,区别仅在于因分子量差异导致加入的质量差异,及产率的差异。具体操作如下:
[0081]
新型aie分子的合成方法,包括如下步骤:
[0082]
1)中间产物1的制备
[0083]
称取化合物b1(3-甲氧基噻吩)(114mg,1.0mmol)加入250ml圆底烧瓶中。在氩气氛围下,加入80ml超干thf。然后在低温反应仪中将反应体系冷却至-78℃,然后在反应体系中缓慢滴加正丁基锂(2.5m己烷溶液,0.4ml,1.0mmol)。之后,反应体系继续维持在-78℃并搅拌2小时。2小时后,在反应体系中加入0.36ml三丁基氯化锡(390mg,1.2mmol),将反应体系缓慢升温至室温,搅拌过夜,即得到中间产物1。反应完成后,待反应降至室温,将反应液旋转蒸发浓缩,获得的粗品无需进一步提纯即可用于下一步反应;
[0084]
2)中间产物2的制备
[0085]
称取中间产物1(404mg,1.0mmol)和化合物b2(404mg,1.0mmol)和四三苯基膦钯(23.1mg,0.02mmol)加入50ml两口圆底烧瓶中。在氩气氛围下,加入无水甲苯(10ml)。利用油浴加热升温至110℃并搅拌8小时,待反应完成,将反应液旋转蒸发浓缩。柱层析方式(乙酸乙酯:石油醚=1:5)纯化得到淡黄色油状物,即得到中间产物2,产率90.3%;
[0086]
3)中间产物3的制备
[0087]
称取中间产物2(2.80g,6.5mmol)加入250ml圆底烧瓶中。
[0088]
在氩气氛围下加入80ml超干thf。然后在低温反应仪中将反应体系冷却至-78℃,然后在反应体系中缓慢滴加正丁基锂(2.4m己烷溶液,2.6ml)。随后,反应体系继续维持在-78℃并搅拌2小时。2小时后,在反应体系中加入2.4ml三丁基氯化锡(2.60g,8.0mmol),将反应体系缓慢升温至室温,搅拌过夜,即得到中间产物3。反应完成后,将反应液旋转蒸发浓缩,获得的粗品无需进一步提纯即可用于下一步反应。
[0089]
4)目标产物aie分子的制备
[0090]
称取中间产物3(3.26g,4.5mmol)和4,7-二溴苯并[1,2-c:4,5-c']双([1,2,5]噻二唑(580mg,1.5mmol)和四三苯基膦钯(34.7mg,0.03mmol)加入250ml两口圆底烧瓶中。在氩气氛围下,加入无水甲苯(100ml)。利用油浴加热升温至110℃搅拌小时,待反应完成,将反应液旋转蒸发浓缩。柱层析方式(二氯甲烷:石油醚=5:1)纯化得950mg黑色固体粉末,即为目标产物aie分子c-ntbd,产率53.5%。
[0091]
上述化合物的分子式如表2所示:
[0092]
表2实施例2中化合物结构式一览表
[0093]
[0094][0095]
为了证明反应的进行,特别做出如下表征,如附图5-8所示:
[0096]
如附图5所示,实施例2中间产物2的核磁氢谱表征如下:1h nmr(400mhz,chloroform-d,298k)δ(ppm):7.95(d,j=8.2hz,1h),7.88(d,j=8.2hz,1h),7.76(d,j=8.2hz,1h),7.46(t,j=7.8hz,2h),7.38(d,j=8.2hz,1h),7.36
–
7.30(m,3h),7.11(d,j=8.8hz,2h),6.83
–
6.80(m,5h),6.10(d,j=1.8hz,1h),3.81(s,3h),3.78(s,3h).
[0097]
如附图6所示,实施例2目标产物aie分子o-ntbd的核磁氢谱表征如下:1h nmr(400mhz,chloroform-d,298k)δ(ppm):7.96(d,j=8.4hz,2h),7.89(d,j=8.4hz,2h),7.77(d,j=8.4hz,2h),7.51
–
7.43(m,8h),7.42
–
7.32(m,4h),7.19(s,2h),7.17
–
7.12(m,4h),6.89
–
6.78(m,8h),3.93(s,6h),3.78(s,6h).
[0098]
如附图7所示,实施例2目标产物aie分子o-ntbd的核磁碳谱表征如下:
13
c nmr(101mhz,chloroform-d,298k)δ(ppm):
13
c nmr(101mhz,cdcl3)δ157.38,156.00,152.81,149.46,146.60,143.32,140.87,135.32,131.01,128.50,126.87,126.52,126.49,126.40,126.35,126.24,126.04,125.80,124.28,119.28,114.75,113.63,112.26,111.59,58.95,55.53.
[0099]
如附图8所示,实施例1目标产物aie分子o-ntbd的高清质谱表征如下:hrms,m/z:[m h] calcd.1064.2307,found 1064.2322.
[0100]
实施例3
[0101]
所述新型aie分子的纳米探针的制备方法,按照如下步骤制备:
[0102]
1)将1mg的c-ntbd与4mg的dspe-peg2000和1ml的thf的混合物超声处理,以充分溶解获得透明的溶液;
[0103]
2)将步骤1)制备的混合物快速注入的10ml水中,在水中超声处理4min;随后将溶液转移到透析袋中,分子量截留量为5000da(molecular weight cut-off,mwco)=5000da),在蒸馏水中透析24h,使用前在mwco=10000da的超滤离心管中超滤至1ml备用;
[0104]
3)使用动态光散射仪对步骤2)制备的产物的尺寸和粒径分布进行测定;后在透射电子显微镜下对对步骤2)制备的产物的形貌与尺寸进行表征,合格后即为所述新型aie分子的纳米探针(c-ntbd nps)。
[0105]
实施例4
[0106]
实施例4与实施例3区别在于将c-ntbd替换为o-ntbd,其他步骤相同,制备得到o-ntbd nps。
[0107]
应用例1
[0108]
将实施例3制备得到c-ntbd nps,配制为300μm的水溶液,取200μl通过静脉注射方式注入stc神经内分泌肿瘤荷瘤裸鼠体内用于肿瘤成像及手术导航。
[0109]
应用例2-4
[0110]
应用例2-4与应用例1区别如下:
[0111]
表3应用例1-4参数一览表
[0112]
组别探针种类给药方式浓度(μmol/l)给药量(μl)应用例1c-ntbd静脉注射300200应用例2o-ntbd静脉注射300200应用例3c-ntbd瘤内注射30050应用例4o-ntbd瘤内注射30050
[0113]
为了验证本发明的有益效果,特设置了如下检测:
[0114]
小分子的光物理特性
[0115]
通过紫外可见吸收光谱研究了实施例1产物c-ntbd和实施例2产物o-ntbd的光物理特性。
[0116]
我们首先评估了这两个分子在thf溶液中的吸收特性。如附图9所示:
[0117]
图9a为c-ntbd在thf中的紫外吸收光谱;
[0118]
图9b为o-ntbd在thf中的紫外吸收光谱;
[0119]
图9c为c-ntbd紫外吸收与浓度梯度之间的的定量关系;
[0120]
图9d为o-ntbd紫外吸收与浓度梯度之间的的定量关系。
[0121]
可以看出c-ntbd在760nm处显示了一个吸收最大值,ε(摩尔消光系数molar extinction coefficient)为1.759
×
104l mol-1
cm-1
(附图9a);
[0122]
o-ntbd在784nm处显示了一个吸收最大值,ε为1.081
×
104l mol-1
cm-1
(附图9b)。
[0123]
通过荧光光谱仪研究了c-ntbd和o-ntbd在水溶液中的荧光光谱。之后通过nir-ii成像仪,研究了c-ntbd和o-ntbd在不同比例二甲基亚砜-甲苯体系中的荧光强度。如附图10所示:
[0124]
图10a为c-ntbd的二甲基亚砜-甲苯混合物在1000nm lp滤光片下的相对荧光强度(i/i0)与fw的关系,激发波长:808nm;
[0125]
图10b为o-ntbd的二甲基亚砜-甲苯混合物在1000nm lp滤光片下的相对荧光强度(i/i0)与fw的关系,激发波长:808nm;
[0126]
可以看出,随着混合物中甲苯比例(fw)的增加,c-ntbd和o-ntbd的发射急剧增强,现出典型的aie特征。
[0127]
纳米探针的光物理特性
[0128]
1、纳米探针的光物理特性
[0129]
对于实施例3制备的c-ntbd nps和实施例4制备的o-ntbd nps进行表征。如图11所示:
[0130]
图11a为c-ntbd nps的动态光散射(dls)图;
[0131]
图11b为c-ntbd nps的透射电镜(tem)图;
[0132]
图11c为c-ntbd nps的紫外吸收和荧光发射光谱图;
[0133]
图11d为o-ntbd nps的动态光散射(dls)图;
[0134]
图11e为o-ntbd nps的透射电镜(tem)图;
[0135]
图11f为o-ntbd nps的紫外吸收和荧光发射光谱图。
[0136]
由图11a、d可知c-ntbd nps的平均流体动力学直径分别为142.49nm,o-ntbd nps的平均流体动力学直径分别为129.34nm。
[0137]
由图11b、e可知tem图片均显示出均匀的球形结构,c-ntbd nps平均直径为约139nm、o-ntbd nps平均直径为约111nm。对比相对于tem与dls的结果,dls测量的直径稍大,这可能是由于tem样品制备过程中纳米颗粒的收缩造成的。
[0138]
由图11c、f可知c-ntbd nps的最大吸收峰为732nm、o-ntbd nps的最大吸收峰为776nm;和c-ntbd nps的发射峰为1042nm、o-ntbd nps的发射峰为1110nm;c-ntbd nps明显红移。值得注意的是,c-ntbd nps和o-ntbd nps的最大发射波长均位于nir-ii窗口,表明两种探针均为nir-ii型纳米探针。
[0139]
2、纳米探针的体外nir-ii荧光成像
[0140]
对于实施例3制备的c-ntbd nps和实施例4制备的o-ntbd nps进行表征。如图12所示:
[0141]
图12a为nps穿透的最大深度测试图;
[0142]
图12b为808nm激光激发下实施例3-4(100μm)的穿透深度图;
[0143]
图12c-d为不同浓度c-ntbd nps(0-100μm)在1000nm lp滤光片下的nir-ii荧光图像以及nir-ii荧光强度与浓度的定量关系图;
[0144]
图12e-f为不同浓度o-ntbd nps(0-100μm)在1000nm lp滤光片下的nir-ii荧光图像以及nir-ii荧光强度与浓度的定量关系图。
[0145]
如图12a-b所示,利用火腿片模拟生物组织,研究了c-ntbd nps和o-ntbd nps的组织穿透能力。得益于c-ntbd nps明亮的nir
‑ⅱ
发光,c-ntbd nps在9毫米火腿片覆盖下还可以显示出明显的nir
‑ⅱ
荧光信号,而o-ntbd nps由于nir
‑ⅱ
荧光较弱,在6毫米火腿片覆盖下即已观察不到荧光信号。
[0146]
如图12c-f所示,在808nm激光激发下,1000nm lp滤光片下,实施例3-4制备的两种
纳米探针均显示出明显的荧光信号,其中c-ntbd nps具有更强的荧光信号。
[0147]
随着纳米探针浓度的上升,纳米探针的荧光强度不断升高,并在3.125至25μm浓度区间内与浓度呈线性关系,这为定量分析提供了可能。
[0148]
这些结果证明了c-ntbd nps出色的nir
‑ⅱ
成像能力。
[0149]
3、纳米探针的光热转换特性
[0150]
为了评估光热转换特性,通过热成像测温仪研究了不同浓度的c-ntbd nps和o-ntbd nps溶液的温度变化与808nm激光照射时间的关系。
[0151]
c-ntbd nps和o-ntbd nps在不同照射时间下温度升高的差异可以从红外热图像中直观地看到。
[0152]
如图13所示,在808nm激光(0.5w/cm2)照射下,两种纳米探针的温度均快速上升。
[0153]
如图14所示:
[0154]
图14a为不同浓度c-ntbd nps(3.125-100μm)在808nm激光照射下升温曲线;
[0155]
图14b为不同浓度o-ntbd nps(3.125-100μm)在808nm激光照射下升温曲线;
[0156]
图14c为c-ntbd nps、o-ntbd nps和icg在相同浓度(100μm)蒸馏水中的光热性能比较曲线(将808nm激光照射5min,去除激光,自然冷却至环境温度);
[0157]
图14d为c-ntbd nps、o-ntbd nps和icg nps(100μm)在5个加热-冷却循环中的光热稳定性和抗光漂白性能曲线。
[0158]
由此可以看出c-ntbd nps和o-ntbd nps显示出浓度依赖性的光热效应,纳米探针的最高温度与浓度成正比(图14a-b)。
[0159]
如图14c所示,在激光照射3分钟后达到平稳。
[0160]
进一步比较了c-ntbd nps,o-ntbd nps和icg溶液(100μm)在808nm激光照射下的温度变化情况。如图14d所示,c-ntbd nps比icg表现出更优越的光热性能(5分钟内δt分别为49.8℃和43.6℃),o-ntbd nps的光热性能则比icg稍差(5分钟内δt分别为43.6℃和45.7℃),c-ntbd nps在三种光热材料中具有最佳的光热性能。值得注意的是,在第二次升温过程中,icg溶液的最高温度出现下降,这在后面的升降温循环中更为明显,这意味着icg光热稳定性较差。作为对比,c-ntbd nps和o-ntbd nps的光热特性在5个升降温循环周期后几乎不变,这表明它们具有优异的抗光漂白能力。
[0161]
如图15所示,经计算,c-ntbd nps和o-ntbd nps的光热转换率(photothermal conversion efficiency,pce)分别为58.14%和45.27%。这些结果表明,c-ntbd和o-ntbd是一种有前途的候选光热剂。
[0162]
4、纳米探针的体外光声性质
[0163]
如图16所示,利用不同波长(680-900nm)的激光照射纳米探针溶液并采集光声信号,我们得到了c-ntbd nps和o-ntbd nps的光声图谱,其最大强度分别在755nm和785nm,这与吸收曲线基本一致,显示光声信号来自有机小分子的强烈近红外吸收。
[0164]
进一步研究了c-ntbd nps和o-ntbd nps的光声强度与探针浓度的关系。如图17所示:
[0165]
图17a为不同浓度的c-ntbd nps和o-ntbd nps(0-12.5μm)在激光激发下的pa图像;
[0166]
图17b为c-ntbd nps和o-ntbd nps在760nm处的pa振幅作为浓度的函数。
[0167]
在760nm激光照射下,两种纳米探针的光声信号均随探针浓度的升高而增强,并在0-12.5μm浓度范围保持线性关系。此外,从图17a中我们还可以看出,c-ntbd nps相比o-ntbd nps表现出更好的体外光声成像性能,这与两种探针的光热性能一致。
[0168]
纳米探针体内测试
[0169]
1、细胞毒性和体内安全性
[0170]
生物安全性是纳米探针应用的关键。因此,首先通过体外实验检测了c-ntbd nps和o-ntbd nps的细胞毒性。如图18所示,分别用不同浓度的纳米探针与stc细胞株共孵育24小时后,各组的细胞存活率均高于95%,未见明显细胞毒性。
[0171]
进一步检测两种纳米探针的体内生物安全性,通过分别给balb/c小鼠尾静脉注射c-ntbd nps/o-ntbd nps(应用例1-2),十天后眼眶取血检验。结果如图19所示,实验结果表明两组小鼠的血常规及肝肾功能指标正常,未见明显生物毒性。
[0172]
图19分别为如下表征:
[0173]
血常规:白细胞、红细胞、血红蛋白、血小板;
[0174]
肾功能:肌酐和尿素氮;
[0175]
肝功能:丙氨酸转氨酶、天冬氨酸转氨酶、血清白蛋白。
[0176]
2、纳米探针的体内光声成像
[0177]
鉴于c-ntbd nps更优越的光声成像性能,我们之后使用c-ntbd nps进一步研究了其对于神经内分泌肿瘤的体内光声成像效果。
[0178]
将应用例1通过尾静脉注射到stc神经内分泌肿瘤荷瘤裸鼠体内后,研究肿瘤部位在不同时间点的光声成像情况。
[0179]
结果如图20所示,其中,
[0180]
图20a为指定时间间隔尾静脉注射c-ntbd nps(100μm)后肿瘤部位pa图;
[0181]
图20b为肿瘤部位pa强度与注射后时间的关系曲线图。
[0182]
如图20a所示,在c-ntbd nps给药前(0h),肿瘤部位有微弱的光声信号,这可能是由于内源性黑色素和血红蛋白在近红外光谱区的吸收造成的83,100。与0小时的肿瘤光声图像相比,尾静脉注射c-ntbd nps后肿瘤部位的光声亮度在前期随时间明显增加,在注射后8小时达到最大值,表明注射后8小时是光声成像肿瘤的最佳时间点。
[0183]
如图20b所示,c-ntbd nps借助增强渗透和保留效应(enhanced permeability and retention,epr)在神经内分泌肿瘤组织中实现了有效的富集。这些结果证实c-ntbd nps可以作为高对比度的探针对神经内分泌肿瘤进行有效的光声成像。
[0184]
3、纳米探针的nir-ii血管成像
[0185]
为了评估纳米探针在体内的nir
‑ⅱ
成像性能,将应用例1注射入正常裸鼠体内,然后进行了脑部和后肢血管nir
‑ⅱ
荧光成像。
[0186]
图21a为脑血管nir-ii荧光成像图;
[0187]
图21b为a图中指定区域放大后的微血管nir-ii成像图;
[0188]
图21c为沿红虚线的脑部微血管横截面nir-ii荧光成像强度分布图。
[0189]
如图21a所示,在尾静脉注射1分钟后,小鼠脑部血管呈现出明亮的nir
‑ⅱ
荧光信号。借助于nir
‑ⅱ
荧光信号,小鼠的脑部血管被清晰显像。
[0190]
为了进一步评估血管成像的分辨率,选择其中一个脑部区域进行放大研究。如图
21b展示了所选区域的相应放大图像。从图中可以看出,小鼠的脑部微血管荧光信号清晰明亮,具有高的信噪比与分辨率。此外,借助于c-ntbd nps的nir
‑ⅱ
荧光信号,还可以清晰观察到血管中的血液流动(为视频动画,在此不展示)。这些结果证明c-ntbd nps在体内血管成像中具有优异的nir
‑ⅱ
荧光成像能力,可以提供机体血液循环系统的准确图谱。
[0191]
为了进一步研究评估纳米探针的体内生物分布,对于应用例1的小鼠,在24小时后从身上收集心脏、肝脏、脾、双肺、肾脏和大脑进行体外成像检测。
[0192]
图22a为明场成像;图22b为nir-ii成像;
[0193]
结果如图22所示,在心脏、双肺、肾脏和大脑没有观察到nir
‑ⅱ
荧光信号,肝脏和脾脏则出现了明显的nir
‑ⅱ
荧光信号。基于上述结果c-ntbd nps的主要排泄机制可能是肝脏排泄途径。
[0194]
4、纳米探针的前哨淋巴结成像及手术导航
[0195]
前哨淋巴结是原发肿瘤淋巴结引流区的一种特殊淋巴结,是原发肿瘤进行淋巴结转移必须经过的第一站淋巴结。因此,快速、准确地识别前哨淋巴结是手术中不可或缺的一部分。
[0196]
由此,特意设置实验在神经内分泌肿瘤模型中进行了nir
‑ⅱ
荧光成像引导的前哨淋巴结手术。
[0197]
首先,使用stc细胞进行裸鼠皮下接种,直到肿瘤直径约5mm。将c-ntbd nps(50μl,300μm)(应用例3)直接注射到肿瘤内部,随后利用nir
‑ⅱ
活体成像系统对裸鼠全身进行nir
‑ⅱ
荧光成像。如图23所示:
[0198]
图23a为stc荷瘤小鼠前哨淋巴结明场成像;
[0199]
图23b-f为stc荷瘤裸鼠瘤内注射c-ntbd nps后不同时间点前哨淋巴结nir-ii荧光成像;
[0200]
如图23b所示,注射后1分钟,在808nm激光激发下,除肿瘤处可见明亮信号外,还隐约可见肿瘤前哨淋巴结和远处胸壁淋巴结,以及两者之间的淋巴管引流信号。10分钟后(图23c),肿瘤前哨淋巴结、远处胸壁淋巴结以及两者之间的淋巴管引流信号更为明显,且在注射后1小时内强度随着时间的增加而增强(图23b-e)。此外脾脏和肝脏的nir
‑ⅱ
荧光信号在注射后也逐渐增加。
[0201]
随后,进行外科手术。首先切除了淋巴结区域的外皮,然后再次进行nir
‑ⅱ
荧光成像。如图24所示:
[0202]
图24a为明场成像;
[0203]
图24b为荷瘤小鼠c-ntbd nps瘤内注射5小时后nir-ii荧光成像;
[0204]
图24c为荷瘤小鼠前哨淋巴结区域表皮剥离后nir-ii荧光成像(前哨淋巴结切除术前);
[0205]
图24d为荷瘤小鼠前哨淋巴结区域表皮剥离后nir-ii荧光成像(前哨淋巴结切除术后);
[0206]
结果如图24所示,淋巴结信号相比较切除表皮前亮度增加(图24b-c),表明手术定位准确,随后在nir
‑ⅱ
荧光信号引导下对淋巴结进行了精准摘除(图24d)。
[0207]
手术耗时约15分钟,经测量,分离的淋巴结大小约为1mm(图25)(其中,图25a为明场成像;图25b为nir-ii荧光成像)。在切除淋巴结后,通过h&e染色来确认前哨淋巴结中是
否存在肿瘤转移。
[0208]
为了进一步研究纳米探针的体内生物分布,对于应用例3的小鼠,5小时后从小鼠身上收集心脏、肝脏、脾、双肺和肾脏进行体外成像检测。
[0209]
如图26所示:
[0210]
图26a为明场成像;
[0211]
图26b为nir-ii荧光成像;
[0212]
在心脏和肾脏没有观察到nir
‑ⅱ
荧光信号,肝脏和脾脏则出现了明显的nir
‑ⅱ
荧光信号,与尾静脉注射后体内分布结果一致。
[0213]
有上述测试可知,本发明实施例可以提供更高分辨率的荧光成像,在手术过程中可以为临床医生提供更清晰的实时可视化效果,有助于手术的精准定位,并减少对健康组织的损伤。
[0214]
最后应说明的是:以上各实施例仅用以说明本发明的技术方案,而非对其限制;尽管参照前述各实施例对本发明进行了详细的说明,本领域的普通技术人员应当理解:其依然可以对前述各实施例所记载的技术方案进行修改,或者对其中部分或者全部技术特征进行等同替换;而这些修改或者替换,并不使相应技术方案的本质脱离本发明各实施例技术方案的范围。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。