id no.2所示,所述cslf6基因的核苷酸序列如seq id no.3所示;
12.(2)将步骤(1)的glub-1启动子和cslf6基因连接至原始表达载体上,得到同时包含有glub-1启动子和cslf6基因的重组表达载体;
13.(3)将重组表达载体转化至感受态细胞进行培养,得到基因工程菌;
14.(4)将步骤(3)的基因工程菌转化至受体植株内,得到转基因植株;
15.(5)验证步骤(4)的转基因植株,测定转基因植株籽粒中的β-葡聚糖含量,得到籽粒β-葡聚糖含量提高的转基因水稻。
16.进一步地,步骤(1)中,获取glub-1启动子的方法为:
17.(a)提取水稻中花11幼苗叶片的基因组dna;
18.(b)对基因组dna进行一次pcr扩增,再对一次扩增后的产物进行二次pcr扩增,得到目标扩增产物;
19.所述一次pcr扩增所用引物如seq id no.6和seq id no.7所示;所述二次pcr扩增所用引物如seq id no.8和seq id no.9所示。
20.进一步地,步骤(1)中,获取cslf6基因的方法为:
21.(a)提取水稻叶片总rna,反转录成单链cdna;
22.(b)以单链cdna为模板,进行第一轮pcr扩增,再对第一轮pcr扩增后的产物进行第二轮pcr扩增,得到目标扩增产物;
23.所述第一轮pcr扩增所用引物如seq id no.10和seq id no.11所示;所述第一轮pcr扩增所用引物如seq id no.12和seq id no.13所示。
24.进一步地,所述原始表达载体为b24_pcambia-1300-35s-gfp-nos。
25.进一步地,所述感受态细胞为大肠杆菌dh5α。
26.与现有技术相比,本发明具有以下有益效果:
27.本发明将glub-1启动子和cslf6基因进行重组,重组后的目标基因转入至受体植株中,获得的转基因水稻能够显著提高水稻籽粒中的β-葡聚糖含量,在水稻遗传育种领域可用于培育高β-葡聚糖含量的水稻新品种,为功能稻的筛选和培育提供理论指导。
附图说明
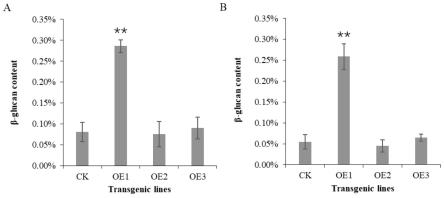
28.图1为实施例1、2、3中过表达植株与对照植株籽粒β-葡聚糖含量的比较;
29.其中,图a受体材料为中花11,图b受体材料为华占;ck表示阴性对照材料;oe1,oe2,oe3分别表示实施例1、2、3中的转基因阳性植株;**所示为实施例1中的转基因植株与对照植株的差异为极显著,显著水平为p《0.05。
具体实施方式
30.下面结合具体实施例对本发明作进一步描述,以下列举的仅是本发明的具体实施例,但本发明的保护范围不仅限于此。
31.实施例1转基因植株的制备(glub-1启动子连接cslf6基因)
32.1)水稻基因组dna的提取
33.水稻种子(中花11)在25℃条件下发芽,水稻幼苗长到3~4片叶时,采用ctab法提取水稻幼苗叶片基因组dna。
34.2)启动子的分离
35.以上述步骤中的基因组dna为模板,用以下引物按下述方法进行两轮pcr扩增,获得启动子核苷酸序列。
36.第一轮pcr扩增:
37.模板:步骤1)中的基因组dna
38.引物如下:
39.f:5
’‑
acagattcttgctaccaacaac-3’;
40.r:5
’‑
agttcaaagacagaccaagctag-3’;
41.以水稻基因组dna为模板,在上述引物的作用下,通过pcr扩增得到启动子片段。
42.pcr体系(50μl):
[0043][0044]
pcr程序:
[0045][0046]
第二轮pcr扩增:
[0047]
模板:第一轮纯化后的pcr产物
[0048]
引物:
[0049]
f:5
’‑
gtaaaacgacggccagtgccaagcttacagattcttgctaccaacaac-3’;
[0050]
r:5
’‑
agttcaaagacagaccaagctag-3’;
[0051]
pcr体系和程序与第一轮相同。
[0052]
扩增结束后,pcr产物进行琼脂糖凝胶电泳检测(长约为2.3kb的特异性扩增条带)并切胶回收目的片段,采用北京天根生化公司的胶回收试剂盒。
[0053]
3)水稻总rna提取及cdna合成
[0054]
采用takara公司的takaraminibest plant rna extraction kit提取水稻(中花11)叶片中总rna,采用dnase i酶去除基因组dna,随后使用takara公司的rt reagent kit perfect real time试剂盒将提取的总rna反转录成单链cdna。
[0055]
4)a基因编码区扩增
[0056]
以上述步骤中的cdna为模板,用以下引物按下述方法进行两轮pcr扩增,选用toyobo公司的kod-fx聚合酶,扩增得到pcr产物,全长为2865bp。pcr产物进行琼脂糖凝胶电泳检测并切胶回收目的片段,采用北京天根生化公司的胶回收试剂盒。
[0057]
第一轮pcr扩增:
reagent kit perfect real time试剂盒将提取的总rna反转录成单链cdna。
[0079]
2)基因编码区扩增
[0080]
以上述步骤中的cdna为模板,用以下引物按下述方法进行两轮pcr扩增,选用toyobo公司的kod-fx聚合酶,扩增得到pcr产物,全长为2865bp。pcr产物进行琼脂糖凝胶电泳检测并切胶回收目的片段,采用北京天根生化公司的胶回收试剂盒。
[0081]
第一轮pcr扩增:
[0082]
模板:步骤3)中的cdna
[0083]
引物:f:5
’‑
ttagcaatggcgccagcggt-3’;
[0084]
r:5
’‑
tcatggccaggcgtaggtga-3’;
[0085]
pcr体系(50μl):
[0086][0087]
pcr程序:
[0088][0089]
第二轮pcr扩增:
[0090]
模板:第一轮纯化后的pcr产物
[0091]
引物:
[0092]
f:5
’‑
agaacacgggggactctagattagcaatggcgccagcggt-3’;
[0093]
r:5
’‑
ttgaacgatcggggaaattcgagctctcatggccaggcgtaggtga-3’;
[0094]
pcr体系和程序与第一轮相同。
[0095]
3)重组载体构建
[0096]
采用vazyme的同源重组试剂盒进行线性化载体、启动子片段和基因编码区片段的同源重组,在此所用载体为pcambia-1300-35s-gfp-nos,限制性酶切位点分别为xbai(tctaga)和saci(gagctc)。
[0097]
将重组载体转化大肠杆菌感受态,涂板至含50μg/ml卡那霉素的lb培养基,过夜培养后挑取单克隆采用引物f(5
’‑
agaacacgggggactctagattagcaatggcgccagcggt-3’)和r:(5
’‑
ttgaacgatcggggaaattcgagctctcatggccaggcgtaggtga-3’)进行菌液pcr验证并测序验证其序列(即如seq id no.3所示,重组片段总长为3739bp)。
[0098]
将序列正确的阳性克隆进行过夜培养抽提质粒。质粒提取试剂盒购自北京天根生化公司,提取方法参照说明书。将质粒进行遗传转化,转化受体材料为中花11和华占。
[0099]
经潮霉素筛选后,获得数十株转基因候选植株;再依次提取转基因候选植株和对
照组植株ck(不含潮霉素抗性基因)的dna,通过pcr的验证方法获得转基因阳性植株和阴性植株(作为对照组材料),其中验证引物为上述菌液pcr验证引物,引物信息前已所述。
[0100]
实施例3转基因植株的制备(glub-1启动子连接cslf3基因)
[0101]
1)水稻基因组dna的提取
[0102]
水稻种子(中花11)在25℃条件下发芽,水稻幼苗长到3~4片叶时,采用ctab法提取水稻幼苗叶片基因组dna。
[0103]
2)启动子的分离
[0104]
以上述步骤中的基因组dna为模板,用以下引物按下述方法进行两轮pcr扩增,获得启动子核苷酸序列。
[0105]
第一轮pcr扩增:
[0106]
模板:步骤1)中的基因组dna
[0107]
引物如下:
[0108]
f:5
’‑
acagattcttgctaccaacaac-3’;
[0109]
r:5
’‑
agttcaaagacagaccaagctag-3’;
[0110]
以水稻基因组dna为模板,在上述引物的作用下,通过pcr扩增得到启动子片段。
[0111]
pcr体系(50μl):
[0112][0113]
pcr程序:
[0114][0115]
第二轮pcr扩增:
[0116]
模板:第一轮纯化后的pcr产物
[0117]
引物:
[0118]
f:5
’‑
gtaaaacgacggccagtgccaagcttacagattcttgctaccaacaac-3’;
[0119]
r:5
’‑
agttcaaagacagaccaagctag-3’;
[0120]
pcr体系和程序与第一轮相同。
[0121]
扩增结束后,pcr产物进行琼脂糖凝胶电泳检测(长约为2.3kb的特异性扩增条带)并切胶回收目的片段,采用北京天根生化公司的胶回收试剂盒。
[0122]
3)水稻总rna提取及cdna合成
[0123]
采用takara公司的takaraminibest plant rna extraction kit提取水稻(中花
11)叶片中总rna,采用dnase i酶去除基因组dna,随后使用takara公司的rt reagent kit perfect real time试剂盒将提取的总rna反转录成单链cdna。
[0124]
4)基因编码区扩增
[0125]
以上述步骤中的cdna为模板,用以下引物按下述方法进行两轮pcr扩增,选用toyobo公司的kod-fx聚合酶,扩增得到pcr产物,全长为2553bp。pcr产物进行琼脂糖凝胶电泳检测并切胶回收目的片段,采用北京天根生化公司的胶回收试剂盒。
[0126]
第一轮pcr扩增:
[0127]
模板:步骤3)中的cdna
[0128]
引物:f:5
’‑
atggcgtcggcggccggtgc-3’;
[0129]
r:5
’‑
aaatggaagaaaactaagaa-3’;
[0130]
pcr体系(50μl):
[0131][0132]
pcr程序:
[0133][0134]
第二轮pcr扩增:
[0135]
模板:第一轮纯化后的pcr产物
[0136]
引物:
[0137]
f:5
’‑
ctagcttggtctgtctttgaactatggcgtcggcggccggtgc-3’;
[0138]
r:5
’‑
ttgaacgatcggggaaattcgagctcaaatggaagaaaactaagaa-3’;
[0139]
pcr体系和程序与第一轮相同。
[0140]
5)重组载体构建
[0141]
采用vazyme的同源重组试剂盒进行线性化载体、启动子片段和基因编码区片段的同源重组,在此所用载体为pcambia-1300-35s-gfp-nos,限制性酶切位点分别为hindiii(aagctt)和saci(gagctc)。
[0142]
将重组载体转化大肠杆菌感受态,涂板至含50μg/ml卡那霉素的lb培养基,过夜培养后挑取单克隆采用引物f(5
’‑
ctagcttggtctgtctttgaactatggcgtcggcggccggtgc-3’)和r:(5
’‑
ttgaacgatcggggaaattcgagctcaaatggaagaaaactaagaa-3’)进行菌液pcr验证并测序验证其序列(即如seq id no.4所示,重组片段总长为4897bp)。
[0143]
将序列正确的阳性克隆进行过夜培养抽提质粒。质粒提取试剂盒购自北京天根生化公司,提取方法参照说明书。将质粒进行遗传转化,转化受体材料为中花11。
[0144]
经潮霉素筛选后,获得数十株转基因候选植株;再依次提取转基因候选植株和对照组植株ck(不含潮霉素抗性基因)的dna,通过pcr的验证方法获得转基因阳性植株和阴性植株(作为对照组材料),其中验证引物为上述菌液pcr验证引物,引物信息前已所述。
[0145]
实施例4功能验证
[0146]
对上述实施例1~3中的转基因阳性植株与对照组植株ck(非转基因植株)成熟籽粒进行β-葡聚糖含量的测定分析,测定采用megazyme试剂盒。结果发现,与对照相比,仅实施例1中导入seq id no.1(glub-1启动子连接cslf6基因组合)的转基因阳性植株籽粒β-葡聚糖含量极显著升高,最高可分别达对照的350%(中花11)和500%(华占)左右,而实施例2和3(其他启动子和基因组合)在两个受体材料中均不能提高水稻籽粒β-葡聚糖含量。因此,通过以上分析发现通过在水稻中外源导入seq id no.1序列可提高水稻籽粒β-葡聚糖含量。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。