1.本发明属于纳米药物技术领域,具体涉及一种细菌外膜囊泡及其在制备先兆子痫治疗药物中的应用。
背景技术:
2.妊娠并发症每年影响着数百万妇女,其中一些疾病具有严重的发病率和死亡率,例如先兆子痫(preeclampsia,pe),它是全世界孕产妇及胎儿死亡的主要原因。pe的症状一般包括在怀孕20周以后出现高血压并发蛋白尿、水肿、多器官功能障碍以及胎儿宫内生长受限等,另外还有胎盘缺氧、氧化应激、血管生成失衡、过度炎症和内皮功能障碍等现象发生。如果不及时对孕妇进行干预治疗,病情逐渐发展导致多器官受累,可能会引发子痫、肾功能衰竭、hellp综合征、胎盘早剥等严重的并发症,对母体和胎儿健康造成极其严重的威胁。
3.pe是一种与胎盘异常发育密切相关的疾病,目前仍旧没有兼顾安全与疗效的药物用于pe的治疗。例如,临床上常用的pe治疗药物包括如拉贝洛尔、硝苯地平、甘露醇等降压药以缓解高血压的症状;另外还有地西泮、硫酸镁等镇静解痉药物以缓解控制抽搐症状;也常用碳酸氢钠纠正抽搐后的酸中毒或者通过终止妊娠的方法保障母亲的生命安全。
4.但是,上述药物和治疗手段主要以预防和控制病情发展和恶化为主,没有从根源去治疗pe。并且pe患者即使在分娩后,仍有发生高血压,心肌病和长期肾脏疾病等产后并发症的可能。新生命的诞生与人类的未来息息相关,因此研发一种从根源上有效控制治疗pe,并且对产妇及胎儿毒副作用小的药物对人类健康发展具有重要意义。
技术实现要素:
5.基于解决上述问题,本发明的目的在于提供一种细菌外膜囊泡,其能够有效负载sirna药物,主动胎盘靶向递送sirna药物,有效治疗先兆子痫(pe)的同时更大程度地减少副作用。
6.本发明的目的还在于提供一种细菌外膜囊泡在制备先兆子痫治疗药物中的应用。
7.为了实现上述目的,本发明的细菌外膜囊泡,采用如下技术方案实现:
8.一种细菌外膜囊泡,所述细菌外膜囊泡是通过大肠杆菌重组表达载体诱导表达、纯化得到,细菌外膜囊泡的表面表达有plcsa-bp目标蛋白;所述大肠杆菌重组表达载体,含有如seq id no.1所示的核苷酸序列,表达载体在构建时,是将inaxn冰核蛋白、sfgfp绿色荧光蛋白和plcsa-bp目标蛋白的编码基因构建成重组质粒后,转入减毒大肠杆菌得到。
9.现有研究表明,pe患者体内高表达的生长阻滞和dna损伤45α基因(growth arrest and dna damage-inducible 45alpha,gadd45α),其同时参与多种pe关键因子的调控,因此本发明考虑是否能够通过靶向调控gadd45α的表达来实现多种因子共同作用以治疗pe。
10.sirna是一种能靶向核酸的高效治疗药物,但极易降解、难以跨膜等缺点极大地限制了其临床应用。基因工程技术的进步使得利用工程化细菌外膜囊泡(omvs)实现主动胎盘
靶向递送sirna药物成为了可能。
11.基于上述构想,本发明首创性地设计构建了一种具有主动胎盘靶向性的减毒工程化细菌外膜囊泡用于递送针对gadd45α的sirna药物以治疗pe,以期实现有效治疗pe的同时更大程度地减少对产妇与胎儿的副作用。
12.本发明提供的细菌外膜囊泡,表面表达有plcsa-bp蛋白。实验证实,本发明采用基因工程技术构建得到的omvs,内毒素值低,表达量高,是一种更加安全的omvs载体。并且,本发明提供的细菌外膜囊泡omvs能实现对sirna药物在体内的长效保护作用以及对胎盘的靶向作用,载药后能够有效地减缓子痫进程,在制备抗子痫药物方面具有良好的临床应用前景。
13.本发明制备细菌外膜囊泡所涉及的大肠杆菌重组表达载体中,inaxn冰核蛋白为冰核蛋白n末端结构域蛋白,sfgfp为超折叠绿色荧光蛋白(super fold green fluorescent protein),plcsa-bp为胎盘硫酸软骨素a结合肽。本发明通过前期研究证实,采用inaxn冰核蛋白作为铆钉蛋白,可将sfgfp绿色荧光蛋白和pics-bp目标蛋白有效融合表达在细胞膜上。
14.大肠杆菌重组表达载体中含有如seq id no.1所示的核苷酸序列,开放阅读框序列全长1326bp,依次编码inaxn冰核蛋白、sfgfp绿色荧光蛋白、pics-bp目标蛋白。其中1~528bp位点处为inaxn冰核蛋白编码基因(528bp),529-1242bp位点处为sfgfp绿色荧光蛋白编码基因(714bp),1243~1326bp位点处为pics-bp目标蛋白编码基因(84bp)。
15.而为了使目标蛋白plcsa-bp稳定表达于大肠杆菌以及omvs表面,并有效提高omvs的表达量,本发明通过将plcsa-bp与inaxn冰核蛋白融合表达,并连接sfgfp作为指示蛋白,使得omv表达量提高,并且具有绿色荧光可以在显微镜下被示踪,同时,表达得到omv的既具有优于脂质体的特点,同时有更好的稳定性、生物相容性、安全性以及胎盘靶向性,是一种能有效保护sirna的载体。
16.优选地,本发明所涉及的细菌外膜囊泡的粒径为20~80nm。
17.基于安全性的首要考虑,本发明采用的减毒大肠杆菌,为预先敲除了msbb基因的大肠杆菌。具体操作时,可采用crispr法敲除大肠杆菌msbb基因。本发明通过前期实验证实,通过msbb基因的预先敲除,能够有效降低表达产物的毒性,更利于产物安全性的提高。
18.产物的表达同时受培养温度、培养时间和诱导剂的多重影响。本发明在进行诱导剂、温度、时间筛选后,优选出,所述大肠杆菌重组表达载体在诱导表达细菌外膜囊泡时,诱导表达的条件为:含有0.1~1mm的异丙基β-d-1-硫代吡喃半乳糖苷的lb液体培养基,20~30℃条件下诱导4~14h。进一步优选地,所述大肠杆菌重组表达载体在诱导表达细菌外膜囊泡时,诱导表达的条件为:含有1mm的异丙基β-d-1-硫代吡喃半乳糖苷的lb液体培养基,30℃条件下诱导14h。
19.为提高omvs分离回收效果,优选地,所述大肠杆菌表达载体在诱导表达细菌外膜囊泡后,采用超滤浓缩法对表达得到的细菌外膜囊泡进行提取和纯化。
20.本发明的细菌外膜囊泡在制备先兆子痫治疗药物中的应用的技术方案是:
21.一种细菌外膜囊泡在制备先兆子痫治疗药物中的应用,具体将所述细菌外膜囊泡作为载体负载sirna药物构成载药纳米粒子从而制备先兆子痫治疗药物。
22.本发明通过小鼠子痫前期模型实验证实,本发明提供的细菌外膜囊泡omvs能实现
对sirna药物在体内的长效保护作用以及对胎盘的靶向作用。妊娠小鼠药效学实验结果表明,与亚硝基左旋精氨酸甲酯(l-name)组相比,本发明提供的细菌外膜囊泡载药组omvs
sirna
显著改善了妊娠小鼠24h尿蛋白、氧化应激水平、炎症因子以及血管内皮功能、高血压相关因子的表达,改善了孕鼠、胎鼠以及胎盘的生长发育结局,并降低了子痫小鼠肝肾功能损坏的程度,有效地减缓子痫进程,在制备抗子痫药物方面具有良好的临床应用前景。
23.为了将sirna药物有效负载在细菌外膜囊泡中,优选地,采用电穿孔技术将sirna药物载入细菌外膜囊泡中构成载药纳米粒子,以用于先兆子痫治疗药物的制备中。
24.为了提高sirna负载效果并提高后续制药效果,优选地,电穿孔技术的操作条件为:细菌外膜囊泡与sirna质量比为(1~3):(1~3),电穿孔施加电压100~900v。更优选地,细菌外膜囊泡与sirna质量比为1:1,电穿孔施加电压700v。
附图说明
25.图1为本发明实施例1所涉及的表达载体中大肠杆菌sfgfp的蛋白质印迹分析;
26.图2为本发明实施例1和对照组得到的omv的重组蛋白检测结果;
27.图3为本发明中wtomv、momv和affi
plcsa-bp
omv水合粒径及电位分布曲线图;
28.图4为本发明实施例1中重组大肠杆菌的透射电镜图;
29.图5为本发明中纯化前后omvs的透射电镜图(标尺:200nm);
30.图6为本发明中wtomv、momv和affi
plcsa-bp
omv的透射电镜图;
31.图7为本发明中放置前后omv的透射电镜图:(a)现制omv;(b)pbs中放置一个月后;
32.图8为本发明中不同实验组中omvs的产率;
33.图9为本发明中不同诱导条件下omv的重组蛋白检测结果;
34.图10为本发明中裂解前后各组omvs的内毒素结果;
35.图11为本发明实验组中不同制剂在妊娠小鼠中的体内分布情况;
36.图12为本发明实验组中妊娠第18天小鼠血浆sflt-1的含量变化;
37.图13为本发明实验组中妊娠期间小鼠体重变化:(a)妊娠期间pe小鼠体重变化;(b)妊娠第18天各组子痫小鼠体重比较;
38.图14为本发明实验组中外观形态图:(a)胎鼠外观形态图;(b)胎盘外观形态图;(a)control;(b)l-name;(c)sirna;(d)momv
sirna
;(e)affi
plcsa-bp
omv
sirna
;
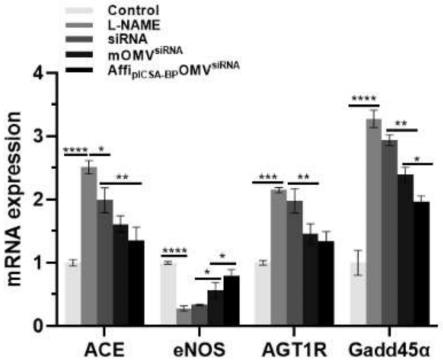
39.图15为本发明实验组中不同制剂对胎盘内相关基因mrna表达的影响;
40.图16为本发明实验组中血浆8-epi-pgf2α和mda水平:(a)8-epi-pgf2α;(b)mda;
41.图17为本发明实验组中血浆炎症因子水平:(a)tnf-α;(b)mcp-1;(c)il-17a;(d)ifn-γ。
具体实施方式
42.下面结合附图以及具体实施例对本发明做进一步的详细说明。以下实施例中所用大肠杆菌为杭州丰海生物科技有限公司提供的大肠杆菌bl21(de3),lb液体培养基购自北京索莱宝科技有限公司;bca蛋白定量试剂盒购自上海雅酶生物科技有限公司;n-硝基-l-精氨酸甲酯盐酸盐购自sigma-aldrich贸易有限公司。其他未做特殊说明的设备及试剂,均可从商业途径得到。
43.实施例1
44.本实施例的细菌外膜囊泡,表面表达有plcsa-bp目标蛋白,是通过大肠杆菌重组表达载体诱导表达、纯化得到;所述大肠杆菌重组表达载体,含有如seq id no.1所示的核苷酸序列,表达载体在构建时,是将inaxn冰核蛋白、sfgfp绿色荧光蛋白和plcsa-bp目标蛋白的编码基因构建成重组质粒后,转入减毒大肠杆菌得到。减毒大肠杆菌为预先敲除了msbb基因的大肠杆菌bl21(de3)
△
msbb。
45.具体制备过程如下:
46.一、大肠杆菌重组表达载体的制备
47.1)sfgfp基因的扩增:以sfgfp绿色荧光蛋白的质粒作为模板,采用sfgfp-ecori-f/sfgfp-saci-r引物按照如下程序进行扩增:2
×
superpfu pcr mix 25μl;引物p1(10μm)2μl;引物p2(10μm)2μl;sfgfp质粒2μl;ddh2o 19μl;total 50μl。扩增条件:94℃预变性5min;(94℃ 30s、55℃ 30s、68℃ 20s)30个循环;然后10℃保持。其中,sfgfp-ecori-f/sfgfp-saci-r引物序列如下所示:
48.sfgfp-ecori-f:ggaattcatgagcaaaggagaagaactttt;
49.sfgfp-saci-r:cgagctctttgtagagctcatccatgccat。
50.2)多肽片段融合:反应体系为:10
×
退火buffer 1μl;tai-f1(50μm)4.5μl;tai-r1(50μm)4.5μl;total 10μl。其中,tai-f1、tai-r1序列如下:
51.tai-f1:attaattttgatacaaaagagaaatttctagcaggatgcttaattgtttct;
52.tai-r1:agaaacaattaagcatcctgctagaaatttctcttttgtatcaaaattaat。
53.上述反应体系于95℃反应5min,自然降温后作为pcr模板,采用引物tai-f2saci和tai-r2hindiii进行反应。反应体系为:2
×
superpfu pcr mix 25μl;tai-f2saci(10μm)2μl;tai-r2hindiii(10μm)2μl;sfgfp质粒2μl;ddh2o 19μl;total 50μl。反应条件为:94℃预变性5min;(94℃ 30s、55℃ 30s、68℃ 10s)30个循环;然后10℃保持。引物序列如下:
54.tai-f2saci:cgagctctacaaagaagatgtaaaggatattaattttgatacaaaagag;
55.tai-r2hindiii:cccaagcttttaattttttccttcatgaaaagaaacaattaagcatcctgct。
56.3)sfgfp与多肽片段融合:扩增的sfgfp及多肽片段经saci单酶切后连接后作为pcr模板,用sfgfp-ecori-f/tai-r2hindiii进行扩增,扩增体系为:2
×
superpfu pcr mix 25μl;sfgfp-ecori-f(10μm)2μl;tai-r2hindiii(10μm)2μl;sfgfp-肽连接产物2μl;ddh2o 19μl;total 50μl。扩增条件为:94℃预变性5min,(94℃30s、55℃30s、68℃30s)30个循环,然后10℃保持。
57.4)酶切:将步骤3)融合的扩增产物经pcr产物纯化试剂盒回收后,按照如下条件进行酶切:
58.10
×
fast digest buffer 5μl;fast digest ecori 1μl;fast digest hindiii 1μl;sfgfp-picsa-bps 43μl;total 50μl。37℃酶切3h,pcr产物纯化后得载体酶切回收产物。
59.10
×
fast digest buffer 5μl;fast digest ecori 1μl;fast digest hindiii 1μl;pet30b-inaxn 20μl;ddh2o 23μl;total 50μl。37℃酶切1h,pcr产物纯化后得pcr酶切产物。
60.5)连接转化:取10
×
t4 dna ligase buffer 1μl;载体酶切回收产物2μl;pcr酶切
产物6μl;t4 dna ligase 1μl;total 10μl。16℃过夜连接转化ecoli dh5alpha感受态细胞涂布kan抗性(50μg/ml)平板,37℃培养,对长出的克隆菌落进行pcr鉴定。
61.6)菌落pcr鉴定:鉴定采用的引物为:t7:taatacgactcactataggg;t7 ter:tgctagttattgctcagcgg。
62.扩增体系:挑取单克隆产物至10μl无菌水中混匀,取0.5μl作为模板按照如下体系扩增:2
×
taq pcr mix 10μl;t7(10μm)0.5μl;t7 ter(10μm)0.5μl;菌液0.5μl;ddh2o 8.5μl;total 20μl;扩增条件为:94℃预变性5min;(94℃ 30s、55℃ 30s、72℃ 30s)32个循环,然后10℃保持。扩增后挑取阳性克隆体接种至lb液体培养基中培养提取质粒进行测序。
63.7)转化大肠杆菌:将测序正确的inaxn-sfgfp-plcsa-bp重组质粒(序列如seq id no.1所示)转化至制备好的减毒大肠杆菌bl21(de3)
△
msbb感受态细胞中,得到重组大肠杆菌bl21(de3)。
64.二、重组大肠杆菌bl21(de3)的培养
65.将实施例1得到的重组大肠杆菌bl21(de3)菌株于37℃融化,pbs稀释10倍,平板划线法接种至平板中,37℃培养20~22h,挑单菌落接种到11ml lb液体培养基中,37℃,150r/min培养20~22h得到种子液,种子液以每1ml接种到100ml空白lb液体培养基的同条件比例扩大培养,以空白培养基作为对照,用酶标仪测细菌培养液的od600值,直到od600值为1,即可进行提取细菌外膜囊泡。另外重组大肠杆菌od600为0.5~0.8时,通过添加1m(0.2383g/ml)异丙基β-d-1-硫代吡喃半乳糖苷(iptg;在细菌培养物中以1:1000稀释)诱导蛋白质表达。将培养物在30℃下孵育14h,测od600后提取细菌外膜囊泡。
66.三、omvs的制备及纯化
67.使用超滤浓缩法,1l菌液通过在4℃下5000g离心30min来去除细菌细胞。通过0.45μm醋酸纤维素滤膜过滤所得上清液,并使用100k超滤膜(millipore)浓缩至1/5体积,4℃下4000g离心。4℃下5000g离心10min来去除浓缩过程中的杂质,0.22μm微孔滤膜过滤。然后在4℃、150000g超速离心3h,弃去上清,沉淀以适量pbs缓冲液重悬;再次在4℃、150000g超速离心3h,弃去上清。然后用pbs将沉淀重悬在50ml、100k超滤离心管中浓缩至原体积的1/5,再次在超滤管中加入pbs浓缩至原体积的1/5,重复该步骤10次。4℃下5000g离心10分钟来去除浓缩过程中的杂质,0.22μm微孔滤膜过滤。然后在4℃、150000g超速离心3h,弃去上清,最终将沉淀重悬于200μlpbs,再次用0.22μm醋酸纤维素滤膜过滤,分装50微升每管,共4管,并保存在-20℃的条件下。平板划线培养过夜以确定无菌。
68.实施例2
69.利用本发明实施例1纯化得到的细菌外膜囊泡作为载体制备成载sirna的纳米粒子,以用于子痫治疗药物的制备。具体是将提取纯化后的omvs与sirna药物混合进行电穿孔,施加电压时omvs的磷脂双分子层会形成孔洞使sirna药物进入omvs内部。在电穿孔过程中,电穿孔技术的操作条件可为:细菌外膜囊泡与sirna质量比为(1~3):(1~3),电穿孔施加电压100~900v。本实施例采用的电穿孔条件具体是:细菌外膜囊泡与sirna质量比为1:1,电穿孔施加电压700v。
70.实验例
71.实验例1蛋白质印迹分析检测重组蛋白的表达
72.为了确认重组菌株上是否存在特定抗原,对野生型大肠杆菌菌株(wte.coli)、减
毒大肠杆菌菌株(me.coli)、本发明实施例1所涉及的重组大肠杆菌菌株(affi
plcsa-bp
e.coli)进行蛋白质印迹分析(westerrn blotting),以标签蛋白sfgfp荧光蛋白为目标检测融合蛋白(约55kda)(包括有inaxn冰核蛋白(约25kda)、sfgfp荧光蛋白(26.2kda)、plcsa-bp肽(3.4kda))的表达情况。具体操作时包括以下步骤:(1)大肠杆菌细胞培养物蛋白的提取;(2)bca蛋白定量;(3)聚丙烯酰胺凝胶电泳;(4)转膜、封闭、抗体孵育;(5)使用化学发光凝胶成像仪对目标蛋白条带进行扫描成像。结果如图1所示。
73.由图1可知,将在野生型大肠杆菌(wte.coli)、减毒大肠杆菌(me.coli)和重组大肠杆菌(affi
plcsa-bp
e.coli)中分别提取的外膜蛋白进行westerrn blotting检测,以sfgfp蛋白作为指示蛋白对其进行检测,55kda是融合蛋白理论上表达的位置,wte.coli和me.coli在55kda处均没有蛋白印迹,而affi
plcsa-bp
e.coli在此处有明显的印迹。上述结果表明野生型大肠杆菌和减毒大肠杆菌外膜蛋白中不含重组蛋白,而本发明的重组大肠杆菌的外膜成功表达了融合蛋白。
74.进一步的,为了进一步确认affi
plcsa-bp
omv是否表达了重组蛋白以及蛋白是否定位在外膜上,继续用westerrn blotting实验提取纯化后的wtomv(野生)、momv(减毒)和本发明实施例1表达得到的affi
plcsa-bp
omv以及经pk或edta处理后的affi
plcsa-bp
omv进行检测。其中pk只能降解暴露在omvs外面的蛋白质,而edta能够破坏膜结构,使膜内蛋白暴露出来。结果如图2所示,首先wtomv、momv和affi
plcsa-bp
omv中,只有affi
plcsa-bp
omv在55kda处有蛋白印迹,说明affi
plcsa-bp
omv成功表达了目标蛋白。另外,经pk单独处理的affi
plcsa-bp
omv在55kda处的有蛋白印迹消失,说明在affi
plcsa-bp
omv暴露在外面的重组蛋白被降解,膜内表达的重组蛋白不会被westerrn blotting技术检测到;edta单独处理affi
plcsa-bp
omv则对融合蛋白几乎无影响,即裂解前后目标蛋白表达无变化,可见该蛋白大部分暴露在膜表面;而pk处理后再经edta裂解的affi
plcsa-bp
omv在55kda处没有蛋白印迹,再次印证重组蛋白在膜内几乎没有表达。上述结果说明经由inaxn冰核蛋白引导序列引导,目的蛋白成功地呈递在omvs的表面,并且在膜内几乎不表达。
75.实验例2omvs的形貌和尺寸
76.本实验例对实施例2表达得到的omvs的形貌和尺寸进行分析,具体过程简述如下:实验采用激光粒度仪来测定omvs的粒径和电位。取适量affi
plcsa-bp
omv,加入pbs稀释至1ml,混合均匀,使用马尔文激光粒径仪测定。利用tccnai透射电子显微镜对纯化前后和在室温条件下放置一个月前后的affi
plcsa-bp
omv以及重组大肠杆菌的形貌进行表征。选择200目的铜网,吸取10μl纳米粒稀释液滴于其正面,放置1~3min后,从液珠边缘吸去多余液体,稍晾干,取2%磷钨酸染色液,滴一小滴于蜡盘上,将吸附有样品的铜网放置于染液表面,染色时间3~5min,白炽灯下晾干,拍照。结果如下所示:
77.采用激光粒度仪对提取纯化的wtomv、momv和affi
plcsa-bp
omv进行水合粒径及电位的测定。如图3所示,wtomv的水合粒径为51.49
±
1.31nm,电位为-16.3
±
1.9mv,pdi为0.31
±
0.04;momv的水合粒径为51.33
±
1.64nm,电位为-16.6
±
1.3mv,pdi为0.33
±
0.05;affi
plcsa-bp
omv的水合粒径为51.34
±
1.44nm,电位为-16.9
±
0.7mv,pdi为0.31
±
0.03。三组载体的水合粒径及电位均没有观察到显著的差别。
78.利用透射电子显微镜对重组大肠杆菌、纯化前后的omvs以及wtomv、momv和affi
plcsa-bp
omv以及在室温条件下放置一个月前后的affi
plcsa-bp
omv的形貌特征进行表征,
对重组大肠杆菌形态、纯化效果、三组omvs的形态进行评价,结果如图4~7所示。
79.通过透射电镜观察重组大肠杆菌的形态如图4所示,是两端钝圆的杆菌,长度约在1~3微米左右,因生长条件的不同,个别菌体可呈近视球状或长丝状,没有观察到与普通大肠杆菌的明显区别。
80.在透射电镜下对纯化前后的omvs进行了观察,结果如图5所示,发现经过纯化后,原本存在的大量鞭毛几乎都消失了。对比wtomv、momv和affi
plcsa-bp
omv的透射电镜图(图6),未发现三组omvs的形态大小有明显差异。omvs的粒径大多分布在20~60nm,较激光粒度仪测得的50nm左右的水合粒径小,个别较大的omvs粒径可以达到80nm左右。omvs呈球形囊泡结构,表现出细胞膜的磷脂双分子层结构,并且个别omvs呈类似红细胞扁状的囊泡结构。
81.对比在室温条件下的pbs中放置一个月前后的透射电镜图,未发现affi
plcsa-bp
omv的形态大小有明显改变,只有轻微的聚集现象(见图7),说明本发明得到的affi
plcsa-bp
omv在pbs中的稳定性良好,在室温下的pbs中至少可以放置一个月。
82.实验例3omvs的产率测定
83.omvs的产率是衡量细菌成囊率的关键指标。本实验例对不同实验组的omvs的产率进行测定,具体过程如下:
84.根据bca试剂盒说明,按照体积比50:1将试剂a和试剂b混合,配制bca工作液。于96孔板中,将标准蛋白(2mg/ml)用dd h2o稀释成不同浓度比例(n=3),每孔分别加入200μlbca工作液,于微孔板恒温振荡器中37℃轻微震荡孵育30min。待冷却至室温后,用多功能酶标仪在562nm的波长处测定吸光值。根据设置的标准蛋白浓度绘制标准曲线,并计算待测蛋白样品浓度。分别测得提取纯化出的wtomv、momv和实施例2得到的affi
plcsa-bp
omv的蛋白含量后,以od600值计算所收获细菌的数量(od600=1所对应的细菌数为5.6*10
10
cfu/ml)。最后以蛋白产率比,即每10
10
个细菌所获得的总蛋白量(μg)分别计算三种omvs的产率。结果如图8所示。
85.由图8可知,wtomv、momv和affi
plcsa-bp
omv的产率比分别为14.32
±
1.24μg/10
10
个细菌、15.19
±
1.97μg/10
10
个细菌、19.98
±
2.18μg/10
10
个细菌。其中wtomv和momv的产率无显著性差异(p》0.05);affi
plcsa-bp
omv的产量显著性高于wtomv和momv的产率(**p《0.01),可见本发明通过蛋白融合表达,能够显著提高owvs的产率。
86.实验例4omvs膜上重组蛋白表达条件的优化
87.本实验例在前期探究实验的基础上,选择的较佳表达条件为:含有0.1~1mm的异丙基β-d-1-硫代吡喃半乳糖苷的lb液体培养基,20~30℃条件下诱导4~14h。为了进一步确定最佳条件,本发明进一步研究了两个温度、两个时间段和两个诱导剂浓度对表达量的影响。实验条件和结果如图9所示,1组和2组,以及4和5组比较,发现无论是诱导4h还是诱导14h,30℃条件下诱导的蛋白条带都比20℃诱导更多的重组蛋白表达(*p《0.05);2组和3组,以及5组和6组比较,发现无论是20℃还是30℃条件下,诱导14h的条件下诱导的蛋白表达量都比诱导4h多(****p《0.0001);另外1和4组,2和5组,以及3和6组比较,发现1mm异丙基β-d-1-硫代吡喃半乳糖苷(iptg)诱导的蛋白条带都比0.1mm的iptg诱导的蛋白条带明显(**p《0.01)。综上所述,在本实验中目标蛋白诱导的最佳条件是加入终浓度为1mm的iptg,30℃条件下诱导14h。
88.实验例5鲎试剂法检测omvs的内毒素含量
89.通过配制一系列浓度梯度的内毒素标准品,利用鲎试剂试剂盒,以内毒素浓度为横坐标,以545nm处的吸光度为纵坐标进行线性回归,标准曲线方程为y=1.2917x 0.0161,r2=0.998。标准曲线的相关系数r2为0.998》0.980。affi
plcsa-bp
omvs和momvs均为敲除内毒素的大肠杆菌所分泌的囊泡,所以affi
plcsa-bp
omvs内毒素检测浓度与momvs一致。wtomvs、momvs和affi
plcsa-bp
omvs三组载体裂解前后的内毒素结果如图10所示,结果显示裂解前后三组内毒素均没有显著性差异(p》0.05);且裂解前后wtomvs的内毒素值均显著大于momvs和affi
plcsa-bp
omvs的内毒素值(****p《0.0001)。上述结果表明经过内毒素基因敲除的大肠杆菌与普通大肠杆菌相比,其所分泌的omvs内毒素值显著减小,降低了细菌内毒素在体内外给药带来的毒性,是一种更加安全的omvs载体。
90.实验例6affi
plcsa-bp
omv载体的载药性能研究
91.本实验所使用的gadd45αsirna序列为5
’‑
aacgtcgaccccgataacgtg-3’,该序列由上海吉玛制药技术有限公司合成。采用电穿孔的方法将sirna药物载入实施例1得到的affi
plcsa-bp
omv载体中,共聚焦显微镜、聚丙烯酰胺凝胶电泳以及westerrn blotting实验均验证了载药后affi
plcsa-bp
omv
sirna
膜上靶向蛋白plcsa-bp在电穿孔后依旧正常表达。同时tem图像显示在本实验的电穿孔条件下affi
plcsa-bp
omv
sirna
没有破损现象,粒径有增大现象,主要集中在90nm左右。affi
plcsa-bp
omv
sirna
的水合粒径为90.00
±
2.04nm,电位为-20.0
±
0.2mv,pdi为0.344
±
0.013。affi
plcsa-bp
omv
sirna
在最佳条件下(电压700v、omv与sirna质量比为1:1)可实现的载药率达20.17
±
1.56%。体外释放研究表明affi
plcsa-bp
omv
sirna
在正常生理环境以及酸性环境中均具有良好的释药特性,保护sirna药物在到达靶细胞之前不被代谢消除。此外,琼脂糖凝胶电泳结果显示affi
plcsa-bp
omv
sirna
在rnase a中的稳定性良好,该制剂是一种能有效保护sirna的载体,大大提高了sirna药物在血液循环中的稳定性。
92.实验例7载药后affi
plcsa-bp
omv
sirna
纳米粒子体内评价实验
93.本实验例对affi
plcsa-bp
omv
sirna
在体内的靶向性、药效以及生物安全性进行考察。通过活体成像研究affi
plcsa-bp
omv
sirna
的体内分布,验证其靶向性;以24h尿蛋白量、血浆中炎症因子和氧化因子的含量、胎盘组织中gadd45a和ace、agt1r及enos等血管扩张相关基因等为考察指标,评价affi
plcsa-bp
omv
sirna
的体内药效及生物安全性。具体实验材料和方法为:本实验使用的小鼠为spf级别的km小鼠,购买自北京斯贝福生物技术有限公司,体重为30~40g,雌性,8~10周龄。饲养实验室为清洁级,标准化流程喂养,每天更换垫料,自由饮食,光照/黑暗周期为12h,温度保持在22~25℃之间,相对湿度保持在60%
±
10%之间。
94.动物模型构建采用参考文献中的子痫前期建模方法,颈背部皮下注射亚硝基左旋精氨酸甲酯(l-name)构建子痫妊娠小鼠模型。用磷酸盐缓冲液溶解l-name配制得30mg/ml的l-name溶液,现配现用。妊娠小鼠自由摄食、饮水,然后在妊娠第9天(gd9)颈背部皮下注射l-name溶液(75mg/kg/d)、,连续给药至gd19。
95.实验分组如下:km小鼠适应性喂养一周后,按雌鼠与雄鼠2:1在傍晚6点合笼,次晨7-8发现阴道栓为gd0,而后将孕鼠单笼饲养。50只妊娠小鼠鼠随机分为5组,每组10只。具体分组如下:正常妊娠组(control组):每隔一天尾静脉注射生理盐水直至gd19;l-name组:gd 9皮下注射l-name 75mg/kg/d直至gd19;游离sirna组:gd 9皮下注射l-name 75mg/kg/d,并于gd10每隔一天尾静脉注射游离sirna直至gd19;momv
sirna
组:gd9皮下注射l-name 75mg/kg/d,并于gd10每隔一天尾静脉注射momv
sirna
直至gd19;affi
plcsa-bp
omv
sirna
组:gd 9皮下注
射l-name 75mg/kg/d,并于gd 10每隔一天尾静脉注射affi
plcsa-bp
omv
sirna
直至gd19。
96.近红外活体荧光成像考察制剂的体内分布测定时:以ir-783代替sirna进行体内生物分布研究。km孕鼠随机分为三组(n=3),分别为:游离ir-783、非靶向组momv
ir-783
以及靶向组affi
plcsa-bp
omv
ir-783
。具体实验操作为:75%酒精对尾部消毒并使其血管暴露,固定小鼠尾巴,将三个组别的制剂分别通过尾静脉的方式注入小鼠体内,其中ir-783剂量为5.0mg/kg。先用4%水合氯醛对小鼠进行麻醉,然后将小鼠固定好置于光学活体成像仪中,分别采集小鼠的x-ray图像和荧光图像。使用活体成像法检测心、肝、脾、肺、肾以及胎盘部位不同时间(1h、4h、8h、12h、24h、48h和72h)ir-783的荧光强度,观察载药纳米粒在各组织的分布,评价肿瘤组织的靶向性和各非靶组织的浓度以评价副作用。为进一步考察各制剂在体内的分布状态,选取妊娠后期的小鼠按照上述分组及给药,在12h各制剂达到最大分布时,颈椎脱白处死后,解剖取其心、肝、脾、肺、肾、胎盘及胎儿组织,置于活体成像仪上进行x-ray射线及荧光图片的拍照,分析各制剂在脏器的分布状况。
97.采用tba法测定血浆丙二醛(mda)水平;炎症因子水平检测是将孕鼠于妊娠第19天采用摘眼球取血的方法收集血液于肝素润过的1.5mlep管中。30min内以1000
×
g离心30分钟,取上清冻存于-80℃。实验前30min将试剂盒和收集的血浆样品恢复至室温,然后加检测抗体、孵育、显色后采用酶标仪测定。
98.24小时尿蛋白的测定步骤如下:bca法测定24小时尿蛋白浓度。在小鼠妊娠第18天时分别将其放置在代谢笼内,为了排除含蛋白饮食对结果的干扰,禁食不禁水,采集24h尿液并记录尿量,3000rpm离心20min,取上清,冻存于-80℃冰箱。测定前提前拿出存放于-80℃冰箱中冻存的尿液,然后用超纯水稀释10倍后置于冰上待检测。
99.qrt-pcr技术检测mrna的表达测定过程如下:分别从空白对照组、造模对照组、游离sirna组、momv
sirna
组、affi
plcsa-bp
omv
sirna
组共5组小鼠中各随机选取胎盘,利用qrt-pcr技术检测gadd45α基因、血管紧张素ⅰ转入酶(ace)、agt1r是血管紧张素ⅱ的受体、内皮性一氧化氮合酶(enos)的mrna在不同制剂组胎盘内的表达情况。pcr引物序列是由上海生工有限公司设计合成。检测孕鼠胎盘组织相关基因分别为gadd45α、ace、agt1r、enos,参照引物为gapdh,引物序列及产物大小见表1。采用相对定量法来统计gadd45α在各组细胞中的表达差异,根据pcr绘制的扩增曲线,计算得到每个样本的ct值,然后用公式:y=2
‑△△
ct,δδct=[实验组(ct目的-ct内参)]-[对照组(ct目的-ct内参)]计算出mrna的相对表达量。实验结果如下所示:
[0100]
表1 real-time pcr所用引物序列及产物
[0101][0102]
通过小动物近红外荧光成像仪实时监测不同制剂在体内各组织、器官的分布状况。通过尾静脉将游离ir-783、非靶向组momv ir-783以及靶向组affi
plcsa-bp
omv ir-783注入小鼠体内后,随着时间的增加,其分布结果如图11所示。首先三组制剂都没有到达胎儿部位。游离组药物ir-783的荧光强度最弱,大部分游离于肝脏和肺部,在肿瘤部位几乎没有蓄
积,体内代谢速度较快,8h时荧光强度达到最强后便开始减少,24h时只残留有极弱的荧光,表明sirna基本清除。非靶向组制剂momv ir-783大量分布于肝脏、肺与肾脏组织中,在胎盘部位有部分蓄积,12h荧光强度达至最大,24h荧光强度仍处于中等水平,表明momv ir-783负载荧光染料可明显增强制剂在体内的循环时间。靶向组制剂affi
plcsa-bp
omv ir-783在肝脏等组织中的蓄积相对较少,12h时实现在胎盘部位的最大蓄积,荧光强度明显高于游离药物与非靶向组,实现了很好的靶向作用。另外选取一只妊娠晚期小鼠静脉注射给药12h后通过颈椎脱白处死,解剖取出其心、肝、脾、肺、肾及胎盘胎儿组织,置于活体成像仪中拍照,其结果与上述结果一致。综上所述,affi
plcsa-bp
omv ir-783可在体内实现长循环及肿瘤部位的蓄积,具备优异的靶向能力。
[0103]
肾脏损害通常出现在像子痫这样的与妊娠有关的并发症中,肾脏为了适应妊娠体液变化而功能失常导致了肾脏损害。子痫前期会导致肾小球滤过屏障受到不同程度破坏,肾小球滤过功能显著下降,出现肾小球性蛋白尿及血清肌配的升高。蛋白尿可反映出子痫前期对肾的影响,临床上经常以蛋白尿的程度,作为评估子痫前期患者肾脏受累和判断病情轻重的指标之一。妊娠第18天小鼠24h尿蛋白量的变化结果如图12所示。其中,l-name组与正常对照组相比子痫小鼠24h尿蛋白量显著升高,差异具有统计学意义(p《0.0001);游离sirna组对尿蛋白量无显著影响(p》0.05);而momv
sirna
组和affi
plcsa-bp
omv
sirna
组抑制24h尿蛋白量的效果显著(p《0.0001),且momv
sirna
组和affi
plcsa-bp
omv
sirna
组治疗效果并无显著性差异(p》0.05)。以上结果说明momv
sirna
组和affi
plcsa-bp
omv
sirna
组均能有效改善子痫小鼠肾功能,减少24h尿蛋白量。
[0104]
妊娠期间小鼠的体重变化是评价药效以及制剂的生物安全性的重要指标之一,正常妊娠期小鼠体重会明显增加,正常范围内的体重增加是为了满足妊娠这一特殊生理现象的代谢需求。根据小鼠妊娠天数与体重变化绘制曲线,结果如图13所示,在妊娠第18天时,control组孕鼠体重为显著大于l-name组,说明在妊娠第9天开始连续给予l-name,使得孕鼠体重的增长受到抑制;游离sirna组孕鼠的体重较l-name组无明显变化(p>0.1),而momv
sirna
组和affi
plcsa-bp
omv
sirna
组孕鼠体重显著增加(p《0.0001),并且affi
plcsa-bp
omv
sirna
组孕鼠体重增加幅度最大(p《0.0001),说明affi
plcsa-bp
omv
sirna
组能有效改善妊娠期子痫小鼠的体重抑制现象。同时,也说明该制剂具有良好的生物安全性,对机体无明显毒副作用。
[0105]
胎鼠以及胎盘外观形态如图14所示,l-name组胎鼠由于胎盘病变,胎鼠在缺血缺氧的环境中生长,使胎鼠生长发育受限,胎盘也发生水肿,且表面明显泛白,表现出严重的胎盘血管收缩和宫内生长受限(iugr)。而游离sirna组、momv
sirna
组和affi
plcsa-bp
omv
sirna
组胎鼠和胎盘的正常发育均得到改善,并且affi
plcsa-bp
omv
sirna
组较游离sirna组和momv
sirna
组表现出更显著的效果。以上结果显示affi
plcsa-bp
omv
sirna
载体能保护sirna药物并靶向胎盘使其发挥出更大的药效,并且没有发现明显的生物安全性问题。
[0106]
mrna的表达情况如图15所示:当妊娠小鼠经l-name造模后,胎盘内ace、agt1r和gadd45a的mrna表达显著上调(p《0.001),同时enos的mrna表达显著下降(p《0.0001),游离sirna组、momv
sirna
组和affi
plcsa-bp
omv
sirna
组均能显著降低胎盘内ace、agt1r和gadd45a的mrna表达,同时增加胎盘内enos mrna的表达。其中affi
plcsa-bp
omv
sirna
组显示出最显著的作用,表明affi
plcsa-bp
omv
sirna
极大地提高了sirna的体内基因沉默效果并且能显著改善子痫小鼠的症状。
[0107]
子痫前期的病因十分复杂,其主要病因包括血管内皮细胞的激活和损伤,而氧化应激尤其是脂质过氧化是血管内皮功能损伤的重要因素。丙二醛(mda)和8-异前列腺素(8-epi-pgf2α)为体内重要的脂质过氧化产物,并且有研究表明脂质氧化应激有可能反映子痫前期的严重程度。各组孕鼠血浆中的8-epi-pgf2α和mda水平如图16所示。其中,l-name组与正常对照组相比,血浆中的8-epi-pgf2α和mda水平均显著升高,差异具有统计学意义(p《0.0001);游离sirna组对氧化应激水平无显著影响(p》0.05)momv
sirna
组和affi
plcsa-bp
omv
sirna
组均能显著降低血液中8-epi-pgf2α和mda的浓度,并且affi
plcsa-bp
omv
sirna
组显示出更显著的降低效果(p《0.01)。以上结果说明momv
sirna
组和affi
plcsa-bp
omv
sirna
组均能有效降低子痫小鼠体内的氧化应激水平,改善其子痫前期症状,且affi
plcsa-bp
omv
sirna
组表现出更为优秀的效果。
[0108]
子痫前期是一种过度炎症反应,其发生及其临床表现与一些炎症细胞因子水平变化密切相关,因此可以通过对各组妊娠小鼠血浆中炎症因子进行检测以反映子痫前期的严重程度。各组孕鼠血浆中炎症因子tnf-α、mcp-1、il-17a和ifn-γ的水平如图17所示。其中,l-name组与正常对照组相比,血浆中的tnf-α、mcp-1、il-17a和ifn-γ水平均显著升高;游离sirna组对血浆炎症因子浓度无显著影响(p》0.05);momv
sirna
组和affi
plcsa-bp
omv
sirna
组均能显著降低血液中tnf-α、mcp-1和il-17a的浓度,并且affi
plcsa-bp
omv
sirna
组显示出更显著的降低效果(p《0.01)。而各治疗组血浆中ifn-γ的水平差异没有统计学意义(p》0.05)。以上结果说明affi
plcsa-bp
omv
sirna
组能有效降低子痫小鼠体内炎症因子tnf-α、mcp-1和il-17a的浓度。
[0109]
综上可知,本发明提供的表达目的蛋白plcsa-bp的细菌外膜囊泡(affi
plcsa-bp
omv),是一种兼具靶向性和安全性的天然生物载体。载药后(affi
plcsa-bp
omv
sirna
)能实现对sirna药物在体内的长效保护作用以及对胎盘的靶向作用。妊娠小鼠药效学实验结果表明,与l-name组相比,affi
plcsa-bp
omv
sirna
组显著改善了妊娠小鼠24h尿蛋白、氧化应激水平、炎症因子以及血管内皮功能、高血压相关因子的表达,改善了孕鼠、胎鼠以及胎盘的生长发育结局,并降低了子痫小鼠肝肾功能损坏的程度,有效地减缓子痫进程。此外,治疗期间affi
plcsa-bp
omv
sirna
组小鼠体重、肝肾胎盘h&e染色结果以及肝肾生化指标检测均表明,affi
plcsa-bp
omv
sirna
并未对小鼠产生明显毒副作用,并且无法穿过胎盘屏障到达胎儿,具有良好的生物安全性。以上实验结果均表明本发明的细菌外膜囊泡在制备子痫治疗药物制剂中具有良好的临床应用前景。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。