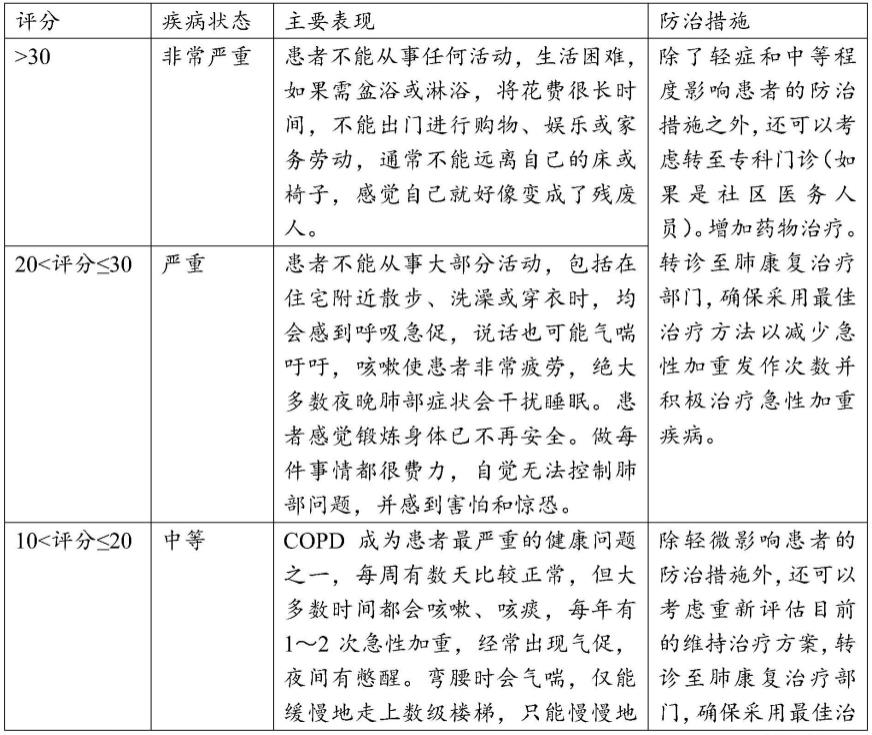
1.本发明属于医药技术领域,涉及沙利度胺或其衍生物在制备治疗/预防皮肤、黏膜损伤药 物中的应用。所述皮肤、黏膜损伤可由皮炎、过度增生性皮肤病、以及皮肤间接免疫表现的 疾病所导致。
背景技术:
2.银屑病是一种病因尚不明确的常见皮肤病,以红斑、鳞屑为主要症状表现。银屑病是一 种多表现为迁延反复、甚至终生不愈的慢性疾病,被世界卫生组织列为20世纪人类皮肤病领 域两大顽症之一,在白种人中的发生率高达2%,在中国人群的发生率为0.123%,国内的患 者人数约为500万。
3.就发病机制而言,目前认为银屑病是由遗传、感染、药物、应激、免疫、以及环境等因 素共同作用引发的疾病,其症状主要以皮肤损伤为主。在局部或连片皮肤处出现红斑丘疹, 表面覆盖一层层银白鳞屑。银屑病的发作具有明显的季节性,多数患者病情在春季、冬季加 重,夏季缓解。初发年龄多在10-30岁,男性多于女性。
4.在患者皮肤的病理切片中,可见角质细胞过度增生,向基底细胞层生长形成“杵状”突出。 在表皮部位形成多层重叠的角质细胞,由于角化不全,这些表皮细胞中含有细胞核,在角质 细胞之间有明显的、散在的中性粒细胞浸润,形成“微脓疡”。
5.银屑病治疗药物主要分为传统药物和生物制剂两类。传统治疗药物有糖皮质激素、维生 素d等,它们的治疗作用有限、副作用大,并且药效作用时间短。生物制剂有tnf-α抑制剂, il-12/23抑制剂、以及il-17抑制剂。生物制剂的短期疗效要好于传统药物,毒副作用相对较 小,然而长期使用容易产生抗药性。
6.除银屑病外,其他免疫性疾病,如特应性皮炎、系统性红斑狼疮、混合性结缔组织病、 皮肌炎、天疱疮等也常常会导致皮肤和黏膜系统的损伤。对这些免疫性疾病导致的皮肤、黏 膜目前还还没有很好的解决方案。
7.以“沙利度胺”的分子结构为母体,celgene公司进行了分子改构的研究,先后推出了第二 代产品“来那度胺”(lenalidomide,商品名revlimid)和第三代产品“泊马度胺”(pomalidomide, 商品名pomalyst)。从2005年来那度胺获得fda批准,用于治疗骨髓增生异常综合症开始, 随后的15年时间里,又先后获批用于治疗多发性骨髓瘤、套细胞淋巴瘤、以及先前接受过治 疗的滤泡性琳巴瘤或边缘区琳巴瘤患者。第三代产品泊马度胺在2013年获f da批准,用于 与地塞米松联用,治疗既往已接受过至少2次治疗方案且出现疾病进展的多发性骨髓瘤的患 者;2020年再次获fd时比准,用于符合特定条件的卡披西肉瘤患者的治疗。
8.这样在沙利度胺出现以来的50年中,以其为母体诞生了一些列衍生物及衍生物药物,并 在诸多适应症的治疗中获得了成功,但均未涉及对免疫性疾病造成的皮肤、黏膜损伤的治疗。
技术实现要素:
9.为了获得银屑病治疗药物,申请人以小鼠银屑病模型为对象,对十余种临床药物的软膏 剂型的治疗作用进行了研究。相对于其他药物而言,我们发现沙利度胺、以及其衍生物来那 度胺和泊马度胺的软膏剂型对小鼠模型的皮肤损伤症状具有显著的治疗和/或预防效果。
10.进一步的,我们对沙利度胺、来那度胺和泊马度胺在银屑病患者中的治疗作用进行了研 究。研究结果显示沙利度胺、来那度胺、泊马度胺软膏能很好地治疗、缓解银屑病的皮肤症 状。
11.为了扩大沙利度胺、来那度胺、泊马度胺软膏的适应症种类,我们对由特应性皮炎、系 统性红斑狼疮、混合性结缔组织病、皮肌炎、天疱疮导致的皮肤和黏膜损伤进行了治疗性研 究,均发现了明显的治疗作用。
12.在这些工作的基础,本发明一方面提供了一种含有沙利度胺、或沙利度胺的一种或多种 衍生物的药物组合物,所述药物组合物还含有药学上可接受的载体、辅料和/或基质。
13.沙利度胺的衍生物不仅包括目前已经成药的来那度胺和泊马度胺,还包括以沙利度胺、 来那度胺、泊马度胺为母核结构进行结构优化得到的衍生物。
14.在药物组合物的种类上至少包括:单独由沙利度胺作为药物分子的组合物,单独由来那 度胺作为药物分子的组合物,单独由泊马度胺作为药物分子的组合物,由沙利度胺和来那度 胺作为药物分子的组合物,由沙利度胺和泊马度胺作为药物分子的组合物,以及由来那度胺 和泊马度胺作为药物分子的组合物。
15.另一方面,本发明提供的药物组合物还可含有药学上可接受的载体、辅料和/或基质。包 括:药学上可接受的有机溶剂,如醇类、丙酮、乙腈、二恶烷等;药学上可接受的非离子表 面活性剂,如hlb9、聚氧乙烯山梨糖醇酐脂肪酸酯等;药学上可接受的阻凝剂,如羟丙基甲 基纤维素、d-甘露糖醇等;药学上可接受的防沫剂,如simethicone硅类等;药学上可接受的 等渗压剂,如氯化钠等;药学上可接受的缓冲剂,如硼酸、磷酸氢二钠、磷酸二氢钠等;药 学上可接受的防腐剂,如沽尔灭、苄乙按、三氯叔丁醇、对羟苯甲酸甲醋、对羟苯甲酸丙醋 等;药学上可接受的增稠剂,如糖类选自乳糖、甘露醇糖、麦芽糖等;药学上可接受的透明 质酸或其盐,如透明质酸钠、透明质酸钾等;药学上可接受的粘多糖类,如硫酸软骨素等; 药学上可接受的基质,如液体石蜡、白蜂蜡、白蜡、白凡士林、液态聚乙二醇、甘油、丙二 醇等;以及药学上可接受的其他添加剂,如聚丙烯酸钠、羟基乙烯基聚合物、交联聚丙烯酸 醋等。
16.另一方面,本发明提供的药物组合物可采用软膏、凝胶、滴剂、吸入剂、洗液等剂型形 式。
17.另一方面,本发明还提供了一种来那度胺软膏的制备方法,包括:将来那度胺或其药学 上可接受的盐溶解于至少一种增溶和/或吸收促进剂中;将所得到的溶液加入到已加热熔解的 软膏基质成分中,在加热条件下进行搅拌,然后冷却得到软膏制剂。
18.在本发明提供的来那度胺软膏的制备方法中,其中得到的含有药物成分的溶液可以进一 步与一种或多种添加剂混合,添加剂中可以含有一定量的一种或多种增溶和/或吸收促进剂, 所述的增溶和/或吸收促进剂可与溶解药物成分所使用的增溶和/或吸收促进
剂相同或不同。
19.来那度胺药学上可接受的盐包括常用的在药学上可接受的无毒盐,如与无机或有机碱形 成的盐,有碱金属盐如钠盐和钾盐、碱土金属盐如钙盐或镁盐、铵盐或胺盐如三乙胺盐或n
‑ꢀ
苯甲基-n-甲胺盐。
20.本发明提供的包含来那度胺或其盐的软膏,所述的盐有一部分是以结晶的形式存在。
21.本发明所使用的增溶和/或吸收促进剂是指当用来那度胺或其药学上可接受的盐制备软膏 时,能有效溶解化合物、且对化合物的溶解度至少达到1%(w/w)或更高,而且还能促进化 合物经皮肤的吸收的试剂。也就是说,增溶和/或吸收促进剂能够增加化合物的溶解和吸收能 力。
22.本发明提供的增溶和/或吸收促进剂包括具有增溶能力或具有吸收促进能力的试剂,具体 如下:
23.低级链烷二醇,如乙二醇、丙二醇、丁二醇等;
24.碳酸低级亚烷酯,如碳酸亚丙酯、碳酸亚乙酯等;
25.链烷二羧酸酯,如己二酸二甲酯、己二酸二乙酸、己二酸二异丙酯、庚二酸二乙酯、癸 二酸二乙酯、癸二酸二丙酯等;
26.高级链烷羧酸甘油酯,如甘油一月桂酸酯、甘油二月桂酸酯、甘油三月桂酸酯等;
27.高级链烯酸甘油酯,如甘油一油酸酯、甘油二油酸酯、甘油三油酸酯等;
28.高级链烷羧酸烷酯,如肉豆蔻酸异丙酯、肉豆蔻酸乙酯等;
29.高级不饱和醇,如牻牛儿醇、油醇等;
30.氮杂环烷,如1-十二烷基氮杂环庚烷-2-酮等。
31.其中,优选的是低级链烷二醇、低级碳酸亚烷酯和二羧酸链烷酯;更优选的是碳酸亚丙 酯、丙二醇和己二酸二异丙酯。
32.增溶和/或吸收促进剂可以单独使用,也可混合使用。
33.按照本发明,可以用任何已知的方法将含来那度胺或其药学上可接受的盐的溶液(溶于 增溶和/或吸收促进剂中)与软膏基质一起制成制剂。
34.软膏基质的例子有油和脂肪,具体包括:天然蜡,如白蜂蜡、巴西棕桐蜡、纯化的羊毛 脂、脱水羊毛脂等;石蜡,如固体石蜡、微晶石蜡等;高级脂肪酸甘油酯,如甘油-硬醋酸脂 等;烃,如液态烃、白凡士林、黄凡士林等。将它们混合使用能达到更好的对药物成分的溶 解和/或吸收促进效果。
35.本发明软膏除含软膏基质外,还可含其它可用于软膏的添加剂,如香料、颜料、防腐剂 或吸收促进剂,如高级烯酸(如油酸)或其它对皮肤病有效的成分。
36.另一方面,本发明提供了来那度胺软膏的组成配比,按所述配比制备的软膏具有优良的 稳定性和良好的皮肤吸收性。其中,来那度胺或其药学上可接受的盐的含量为0.005-12% (w/w);优选的,来那度胺或其药学上可接受的盐的含量为0.01-6%(w/w);更优选的,来那度 胺或其药学上可接受的盐的含量为0.01-2%(w/w)。
37.增溶和/或吸收促进剂的用量为至少足能溶解来那度胺或其药学上可接受的盐,用量为每 份化合物用1-400份,优选的为5-200份(重量)。该试剂的上限用量为不破坏软膏的预期特 性。具体的,碳酸亚丙酯的用量为每份化合物用1-120份(重量),丙二醇的用量为
75℃条 件下加热熔解,制成基质溶液。3)在70℃条件下,将来那度胺溶液加入到基质溶液,用搅 匀器以7000rpm的速度搅拌10分钟。4)以5000rpm的速度继续搅拌30分钟,使溶液温度 在此期间内逐步降低至50℃。5)在室温下,用搅棒缓慢搅拌溶液,使其冷却至约40℃,得 到来那度胺软膏。
69.按照上述方法,制备具有以下成分比例的来那度胺软膏:
70.来那度胺软膏-11:来那度胺原料药4g;增溶/吸收促进剂:碳酸亚丙酯5g;基质成分: 甘油-月桂酸酯5g,白蜂蜡6.7g,液体石蜡9.15g,白凡士林70.15g。制备4.00%的来那度胺 软膏,其中含有5.00%的碳酸亚丙酯,5.00%的甘油-月桂酸酯。
71.来那度胺软膏-12:来那度胺原料药0.16g;增溶/吸收促进剂:油醇16g;基质成分:白 峰蜡5.6g,固体石蜡4.8g,白凡士林133.44g。制备0.10%的来那度胺软膏,其中含有10.00% 的油醇。
72.来那度胺软膏-13:来那度胺原料药0.175g;增溶/吸收促进剂:丙二醇7g;基质成分: 白蜂蜡28g,液体石蜡59.5g,白凡士林255.325g。制备0.05%的来那度胺软膏,其中含有2.00% 的丙二醇。
73.来那度胺软膏-14:来那度胺原料药1.8g;增溶/吸收促进剂:碳酸丙酯9g;基质成分: 白蜂蜡12.42g,液体石蜡25.92g,白凡士林130.86g。制备1.00%的来那度胺软膏,其中含有 5.00%的碳酸丙酯。
74.来那度胺软膏-15:来那度胺原料药3g;增溶/吸收促进剂:丙二醇15g;基质成分:白蜂 蜡20.1g,液体石蜡43.2g,白凡士林218.7g。制备1.00%的来那度胺软膏,其中含有5.00%的 丙二醇。
75.来那度胺软膏-16:来那度胺原料药15g;增溶/吸收促进剂:甘油-月桂酸酯15g;基质成 分:白峰蜡4.5g,固体石蜡4.5g,白凡士林111g。制备10.00%的来那度胺软膏,其中含有 10.00%的甘油-月桂酸酯。
76.来那度胺软膏-17:来那度胺原料药0.12g;增溶/吸收促进剂:丙二醇2.4g;基质成分: 肉豆蔻酸异丙酯12g,白蜂蜡4.2g,液体石蜡6g,固体石蜡3.6g,白凡士林91.68g。制备0.10% 的来那度胺软膏,其中含有2.00%的丙二醇,10.00%的肉豆蔻酸异丙酯。
77.来那度胺软膏-18:来那度胺原料药0.25g;增溶/吸收促进剂:碳酸亚丙基酯12.5g;基质 成分:固体石蜡7.5g,液体石蜡29.75g,白凡士林200g。制备0.10%的来那度胺软膏,其中 含有5.00%的碳酸亚丙基酯。
78.来那度胺软膏-19:来那度胺原料药2g;增溶/吸收促进剂:碳酸亚丙酯10g;基质成分: 己二酸二异丙酯20g,液体石蜡2g,固体石蜡9g,纯化的羊毛脂4g,白凡士林153g。制备 1.00%的来那度胺软膏,其中含有5.00%的碳酸亚丙酯,10.00%的己二酸二异丙酯。
79.来那度胺软膏-20:来那度胺原料药1.49g;增溶/吸收促进剂:碳酸亚丙酯7.43g;基质 成分:己二酸二异丙酯14.85g,白蜂蜡9.95g,液体石蜡7.45g,微晶石蜡1.49g,白凡士林 107.38g。制备0.99%的来那度胺软膏,其中含有4.95%的碳酸亚丙酯,9.90%的己二酸二异丙 酯。
80.来那度胺软膏-21:来那度胺原料药0.18g;增溶/吸收促进剂:碳酸业丙酯9.08g;基质 成分:油酸9.08g,白蜂蜡12.17g,液体石蜡17.07g,白凡士林132.41g。制备0.10%的来那 度胺软膏,其中含有5.05%的碳酸亚丙酯,5.05%的油酸。
81.来那度胺软膏-22:来那度胺原料药0.28g;增溶/吸收促进剂:碳酸丙酯5.6g;基质成分: 白蜂蜡22.4g,液体石蜡47.6g,白凡士林204.12g。制备0.10%的来那度胺软膏,其中含有2.00% 的碳酸亚丙酯。
82.来那度胺软膏-23:来那度胺原料药0.12g;增溶/吸收促进剂:己二酸二异丙酯24.07g; 基质成分:微晶石蜡7.22g,白凡士林88.59g。制备0.10%的来那度胺软膏,其中含有20.06% 的己二酸二异丙酯。
83.来那度胺软膏-24:来那度胺原料药1.25g;增溶/吸收促进剂:碳酸亚丙酯6.25g;基质成 分:己二酸二异丙酯12.5g,液体石蜡1.25g,固体石蜡2.5g,甘油-硬脂酸酯1.25g,白凡士 林100g。制备1.00%的来那度胺软膏,其中含有5.00%的碳酸亚丙酯,10.00%的己二酸二异 丙酯。
84.来那度胺软膏-25:来那度胺原料药3.2g;增溶/吸收促进剂:丙二醇8g;基质成分:白 蜂蜡11.04g,液体石蜡21.44g,白凡士林116.32g。制备2.00%的来那度胺软膏,其中含有5.00% 的丙二醇。
85.来那度胺软膏-26:来那度胺原料药0.12g;增溶/吸收促进剂:碳酸亚丙酯60g;基质成 分:己二酸二异丙酯120g,白蜂蜡42g,液体石蜡12g,固体石蜡36g,白凡士林929.88g。 制备0.01%的来那度胺软膏,其中含有5.00%的碳酸亚丙酯,10.00%的己二酸二异丙酯。
86.来那度胺软膏-27:来那度胺原料药2.3g;增溶/吸收促进剂:碳酸亚丙酯11.5g;基质成 分:白蜂蜡15.41g,液体石蜡33.12g,白凡士林167.67g。制备1.00%的来那度胺软膏,其中 含有5.00%的碳酸亚丙酯。
87.来那度胺软膏-28:来那度胺原料药0.12g;增溶/吸收促进剂:癸二酸二乙酯24g;基质 成分:白蜂蜡4.2g,固体石蜡3.6g,白凡士林88.08g。制备0.10%的来那度胺软膏,其中含 有20.00%的癸二酸二乙酯。
88.来那度胺软膏-29:来那度胺原料药0.22g;增溶/吸收促进剂:碳酸亚丙酯11.10g;基质 成分:油醇11.10g,白蜂蜡14.87g,液体石蜡20.87g,白凡士林161.84g。制备0.10%的来 那度胺软膏,其中含有5.05%的碳酸亚丙酯,5.05%的油醇。
89.来那度胺软膏-30:来那度胺原料药0.2g;增溶/吸收促进剂:甘油-油酸酯20g;基质成分: 白峰蜡7g,固体石蜡6g,白凡士林166.8g。制备0.10%的来那度胺软膏,其中含有10.00%的 甘油-月桂酸酯。
90.来那度胺软膏-31:来那度胺原料药2.23g;增溶/吸收促进剂:碳酸亚丙酯11.17g;基质 成分:己二酸二异丙酯22.33g,白蜂蜡14.96g,液体石蜡11.17g,固体石蜡6.70g,白凡士 林161.45g。制备0.97%的来那度胺软膏,其中含有4.85%的碳酸亚丙酯,9.71%的己二酸二 异丙酯。
91.来那度胺软膏-32:来那度胺原料药6g;增溶/吸收促进剂:碳酸亚丙酯30g;基质成分: 白蜂蜡18.9g,液体石蜡26.4g,白凡士林218.7g。制备2.00%的来那度胺软膏,其中含有10.00% 的碳酸亚丙酯。
92.来那度胺软膏-33:来那度胺原料药1.5g;增溶/吸收促进剂:碳酸亚丙酯7.5g;基质成分: 己二酸二异丙酯15g,液体石蜡1.5g,固体石蜡4.5g,白蜂蜡0.75g,白凡士林119.25g。制 备1.00%的来那度胺软膏,其中含有5.00%的碳酸亚丙酯,10.00%的己二酸二异丙酯。
93.来那度胺软膏-34:来那度胺原料药0.35g;增溶/吸收促进剂:碳酸亚丙酯17.5g;基质成 分:白蜂蜡24.5g,液体石蜡52.5g,白凡士林255.15g。制备0.10%的来那度胺软膏,其中含 有5.00%的碳酸亚丙酯。
94.来那度胺软膏-35:来那度胺原料药0.54g;增溶/吸收促进剂:碳酸亚丙酯9g;基质成分: 己二酸二异丙酯18g,白蜂蜡6.3g,液体石蜡1.8g,固体石蜡5.4g,白凡士林138.96g。制备 0.30%的来那度胺软膏,其中含有5.00%的碳酸亚丙酯,10.00%的己二酸二异丙酯。
95.3、来那度胺制剂的皮肤吸收试验
96.实验动物为7周龄的sd雄性大鼠,购自北京维通利华实验动物技术有限公司,在glp环 境条件下饲养。将大鼠随机分为对照组和实验组,每组5只。每个实验组大鼠用一种软膏制 剂来处理。
97.试验前一天,对大鼠背部的一块皮肤进行脱毛处理(3
×
2.5cm)。试验当天,将大鼠背部 固定在一个固定架上,给脱毛处的皮肤涂抹来那度胺的dmso制剂或软膏制剂,用量为每10 cm2的皮肤面积涂抹120mg的dmso或软膏制剂,dmso制剂采取分次涂抹的方式进行。
98.对照组大鼠处理:药物涂抹5分钟后,用小软膏刀刮去皮肤表面的样品,随后用四个蘸 有少量酒精的棉球擦拭皮肤表面。将收集到的材料放入离心管中,向其中加入20ml正己烷/ 乙醇溶液(正己烷/乙醇=1∶1)。摇动离心管,提取其中的药品成分,将上清液上样到高效液 相色谱仪(hplc)中,利用文献报道的方案,检测样品中来那度胺的浓度(n=3)。计算得到 在实验开始阶段,能够从皮肤表面提取的那度胺物质的量。
99.试验组大鼠处理:用药8小时后,用小软膏刀刮去皮肤表面的样品,随后用四个蘸有少 量酒精的棉球擦拭皮肤表面。将收集到的材料放入离心管中,向其中加入20ml正己烷/乙醇 溶液(正己烷/乙醇=1∶1)。摇动离心管,提取其中的药品成分,将上清液上样到高效液相色 谱仪(hplc)中,利用文献报道的检测方案,检测样品中来那度胺的浓度(n=3)。计算得到 用药8小时后,能够从皮肤表面残存的来那度胺物质的量。以从对照组大鼠皮肤表面提取的、 初始阶段的来那度胺物质的量为参照,计算药品的皮肤吸收率。
100.实验结果:来那度胺dmso溶液-1的皮肤吸收率为12.3%;来那度胺dmso溶液-3的皮 肤吸收率为8.9%;来那度胺dmso溶液-5的皮肤吸收率为17.4%;来那度胺dmso溶液-6的 皮肤吸收率为10.1%.
101.来那度胺软膏-11的皮肤吸收率为15.8%;来那度胺软膏-16的皮肤吸收率为10.9%;来那 度胺软膏-17的皮肤吸收率为16.5%;来那度胺软膏-18的皮肤吸收率为16.3%;来那度胺软膏
ꢀ‑
22的皮肤吸收率为21.1%;来那度胺软膏-21的皮肤吸收率为23.1%;来那度胺软膏-26的皮 肤吸收率为13.5%;来那度胺软膏-29的皮肤吸收率为13.1%;来那度胺软膏-30的皮肤吸收率 为19.8%;来那度胺软膏-32的皮肤吸收率为17.3%。
102.4、来那度胺软膏制剂的稳定性试验
103.将制备的来那度胺软膏制剂(5g)装入酚涂层管中,在40℃下保持一定的时间。利用hplc 和文献报道的检测方案,分别检测试验开始时和结束时软膏制剂中来那度胺物质的量,计算 物质的剩余率。
104.实验结果:
105.来那度胺软膏-20:1个月后,剩余率98.0%;2个月后,剩余率97.2%;3个月后,剩
余 率95.4%。
106.来那度胺软膏-23:1个月后,剩余率97.5%;2个月后,剩余率96.2%;3个月后,剩余 率94.1%。
107.来那度胺软膏-30:1个月后,剩余率97.1%;2个月后,剩余率95.2%;3个月后,剩余 率93.8%。
108.4、来那度胺制剂的皮肤刺激性试验
109.利用豚鼠试验,检测来那度胺制剂对皮肤的刺激性。给豚鼠涂上来那度胺dmso制剂-1、 来那度胺dmso制剂-3、来那度胺软膏制剂-13、来那度胺软膏制剂-15、来那度胺软膏制剂-18、 来那度胺软膏制剂-21、来那度胺软膏制剂-25,进行皮肤刺激试验,结果表明均未观察到皮肤 刺激现象。
110.综上所述,本发明提供的来那度胺dmso制剂、来那度胺软膏制剂均具有较好的皮肤吸 收性,对皮肤无刺激性,本发明提供的来那度胺软膏制剂具有较好的稳定性,可用于皮肤、 黏膜损伤的治疗和预防。
111.实施例三:来那度胺软膏对小鼠模型的治疗作用研究
112.1、银屑病皮损模型小鼠的制备及分组
113.按照实施例一描述的方法,制备200只银屑病皮损模型小鼠,随机分为20组,用于来那 度胺dmso溶液-1、来那度胺dmso溶液-5、来那度胺dmso溶液-6、来那度胺软膏-11、来 那度胺软膏-13、来那度胺软膏-14、来那度胺软膏-15、来那度胺软膏-18、来那度胺软膏-19、 来那度胺软膏-20、来那度胺软膏-21、来那度胺软膏-23、来那度胺软膏-25、来那度胺软膏-26、 来那度胺软膏-28、来那度胺软膏-29、来那度胺软膏-30、来那度胺软膏-31、来那度胺软膏-34、 来那度胺软膏-35的皮损治疗试验。同时,制备10只对照小鼠,作为试验的对照组。
114.2、药物干预实验
115.按照实施例二“来那度胺制剂的皮肤吸收试验”中描述的方法,给实验组小鼠脱毛处的 皮肤涂抹来那度胺的dmso溶液或软膏,用量为每10cm2的皮肤面积涂抹120mg的dmso 或软膏制剂,dmso制剂采取分次涂抹的方式进行。对照组小鼠涂抹医用凡士林。药物连续 涂抹10天。
116.3、实验结果
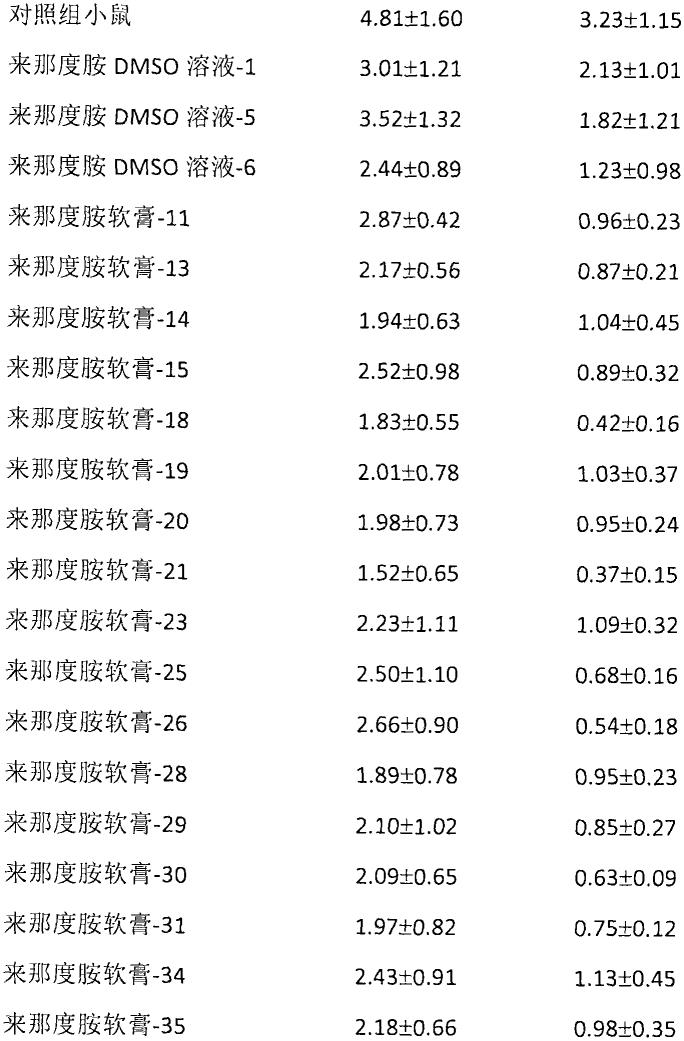
117.按照实施例一描述的方法,在开始使用药物的第6天和第10天,对各组小鼠的皮损状态 进行评价,小鼠皮损状况的pasi总评分的平均值如下。
118.[0119][0120]
实验结果提示,与对照组小鼠相比,来那度胺的dmso溶液或软膏对小鼠皮肤损伤具有 较好的治疗效果。
[0121]
实施例四:沙利度胺、泊马度胺软膏的制备及对小鼠模型的治疗作用研究
[0122]
1、软膏配制:
[0123]
利用沙利度胺和泊马度胺原料药,按照以下配方,配制沙利度胺、泊马度胺软膏。
[0124]
沙利度胺软膏-1:沙利度胺原料药0.25g;增溶/吸收促进剂:碳酸亚丙基酯12.5g;基质 成分:固体石蜡7.5g,液体石蜡29.75g,白凡士林200g。制备0.10%的沙利度胺软膏,其中 含有5.00%的碳酸亚丙基酯。
[0125]
沙利度胺软膏-2:沙利度胺原料药0.18g;增溶/吸收促进剂:碳酸亚丙酯9.08g;基质成 分:油酸9.08g,白蜂蜡12.17g,液体石蜡17.07g,白凡士林132.41g。制备0.10%的沙利度 胺软膏,其中含有5.05%的碳酸亚丙酯,5.05%的油酸。
[0126]
泊马度胺软膏-1:泊马度胺原料药0.25g;增溶/吸收促进剂:碳酸亚丙基酯12.5g;基质 成分:固体石蜡7.5g,液体石蜡29.75g,白凡士林200g。制备0.10%的泊马度胺软膏,其中 含有5.00%的碳酸亚丙基酯。
[0127]
泊马度胺软膏-2:泊马度胺原料药0.18g;增溶/吸收促进剂:碳酸亚丙酯9.08g;基质成 分:油酸9.08g,白蜂蜡12.17g,液体石蜡17.07g,白凡士林132.41g。制备0.10%的泊马度 胺软膏,其中含有5.05%的碳酸亚丙酯,5.05%的油酸。
[0128]
2、药物干预实验
[0129]
按照实施例三描述的方法,获得小鼠模型,利用沙利度胺软膏-1、沙利度胺软膏-2、泊马 度胺软膏-1、泊马度胺软膏-2进行联系10天的药物干预实验。
[0130]
4、实验结果
[0131]
按照实施例三描述的方法,在开始使用药物的第6天和第10天,对各组小鼠的皮损状态 进行评价,小鼠皮损状况的pasi总评分的平均值如下。
[0132][0133]
实验结果提示,与对照组小鼠相比,沙利度胺和泊马度胺软膏对小鼠皮肤损伤均具有较 好的治疗效果。
[0134]
实施例四:来那度胺软膏对银屑病患者皮肤损伤的治疗
[0135]
1、测试药物:利用来那度胺软膏-18、来那度胺软膏-21进行人体治疗研究。对照组患者 涂抹医用凡士林。
[0136]
2、银屑病患者入组:入组临床诊断为银屑病的男性患者60人,年龄17-58岁。随机分为 三组,每组20人。两个实验组患者分别涂抹那度胺软膏-18和来那度胺软膏-21,对照组患者 涂抹医用凡士林。每日涂抹药膏4次,在早、中、晚和临睡前各涂抹一次,连续涂抹药品两 周。两周后,依据银屑病面积与严重性指数(pasi)评分标准,对治疗效果进行评价。
[0137]
3、治疗及疗效评估:
[0138]
各组患者的pasi评分的平均值值如下:
[0139][0140]
试验结果显示,与医用凡士林对照组相比,来那度胺软膏-18、来那度胺软膏-21均具有较 好的治疗和症状缓解效果。
[0141]
实施例四:来那度胺软膏对特应性皮炎患者皮肤损伤的治疗
[0142]
1、测试药物:利用来那度胺软膏-18、来那度胺软膏-21进行人体治疗研究。对照组患者 涂抹医用凡士林。
[0143]
2、特应性皮炎患者入组:入组临床诊断为特应性皮炎的患者21人,年龄19-37岁。随机 分为三组,每组7人。两个实验组患者分别涂抹那度胺软膏-18和来那度胺软膏-21,对照组 患者涂抹医用凡士林。每日涂抹药膏4次,在早、中、晚和临睡前各涂抹一次,连续涂抹药 品两周。两周后,以湿疹面积及严重度指数(eczema area severity index,easi)为标准,对药 物治疗效果进行评估。将特异反应性没有得到改善的情况设为5,改善较多的情况设为0。
[0144]
3、治疗及疗效评估:
[0145]
各组患者的easi评分的平均值值如下:
[0146][0147]
试验结果显示,与医用凡士林对照组相比,来那度胺软膏-18、来那度胺软膏-21均具有较 好的治疗和症状缓解效果。
[0148]
实施例五:来那度胺软膏对系统性红斑狼疮患者皮肤损伤的治疗
[0149]
1、测试药物:利用来那度胺软膏-18、来那度胺软膏-21进行人体治疗研究。对照组患者 涂抹医用凡士林。
[0150]
2、系统性红斑狼疮患者入组:入组临床诊断为系统性红斑狼疮的女性患者45人,年龄 18-50岁。随机分为三组,每组15人。两个实验组患者分别涂抹那度胺软膏-18和来那度胺 软膏-21,对照组患者涂抹医用凡士林。每日涂抹药膏4次,在早、中、晚和临睡前各涂抹一 次,连续涂抹药品两周。两周后,以双手和面部脸部红斑的状态对治疗效果进行评估。
[0151]
3、治疗及疗效评估:
[0152][0153]
试验结果显示,与医用凡士林对照组相比,来那度胺软膏-18、来那度胺软膏-21均具有较 好的治疗和症状缓解效果。
[0154]
实施例六:来那度胺软膏对混合性结缔组织病患者皮肤损伤的治疗
[0155]
1、测试药物:利用来那度胺软膏-18、来那度胺软膏-21进行人体治疗研究。对照组患者 涂抹医用凡士林。
[0156]
2、混合性结缔组织病患者入组:入组临床诊断为混合性结缔组织病的患者12人,年龄 22-38岁。随机分为三组,每组4人。两个实验组患者分别涂抹那度胺软膏-18和来那度胺软 膏-21,对照组患者涂抹医用凡士林。每日涂抹药膏4次,在早、中、晚和临睡前各涂抹一次, 连续涂抹药品两周。两周后对治疗效果进行评估。
[0157]
3、治疗及疗效评估:
[0158][0159]
试验结果显示,与医用凡士林对照组相比,来那度胺软膏-18、来那度胺软膏-21均具有较 好的治疗和症状缓解效果。
[0160]
实施例七:来那度胺软膏对皮肌炎病患者皮肤损伤的治疗
[0161]
1、测试药物:利用来那度胺软膏-18、来那度胺软膏-21进行人体治疗研究。对照组患者 涂抹医用凡士林。
[0162]
2、皮肌炎病患者入组:入组临床诊断为皮肌炎病的患者27人,年龄20-45岁。随机分为 三组,每组9人。两个实验组患者分别涂抹那度胺软膏-18和来那度胺软膏-21,对照组患者 涂抹医用凡士林。每日涂抹药膏4次,在早、中、晚和临睡前各涂抹一次,连续涂抹药品两 周。两周后对治疗效果进行评估。
[0163]
3、治疗及疗效评估:
[0164][0165][0166]
试验结果显示,与医用凡士林对照组相比,来那度胺软膏-18、来那度胺软膏-21均具有较 好的治疗和症状缓解效果。
[0167]
实施例八:来那度胺软膏对天疱疮患者皮肤损伤的治疗
[0168]
1、测试药物:利用来那度胺软膏-18、来那度胺软膏-21进行人体治疗研究。对照组患者 涂抹医用凡士林。
[0169]
2、天疱疮患者入组和药物治疗:入组临床诊断为天疱疮的男性患者15人,年龄18-35 岁。随机分为三组,每组5人。两个实验组患者分别涂抹那度胺软膏-18和来那度胺软膏-21, 对照组患者涂抹医用凡士林。每日涂抹药膏4次,在早、中、晚和临睡前各涂抹一次,连续 涂抹药品两周。两周后对治疗效果进行评估。
[0170]
3、治疗及疗效评估:
[0171][0172]
试验结果显示,与医用凡士林对照组相比,来那度胺软膏-18、来那度胺软膏-21均具有较 好的治疗和症状缓解效果。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。