1.本发明涉及生物技术领域,具体涉及两种小麦诱导系在小麦单倍体幼胚及籽粒鉴别中的应用。
背景技术:
2.小麦是重要的粮食作物,在全世界范围内广泛种植。随着社会的进步和生活水平的提高,消费者对小麦的品质要求也不断提高。小麦的产量不再是育种家追求的单一目标,营养、优质、特用小麦成为新的选育方向。传统小麦育种通过杂交、自交以及回交等手段进行新品种的选育,一般至少需要6-7年才能育成一个优质的小麦品种。该育种方法周期长、效率低,人力物力耗费巨大。相比与传统育种手段,单倍体育种技术由于其显著缩短育种周期的优势,逐步成为主要的育种方式之一,尤其是玉米单倍体育种技术。单倍体育种技术主要包括三大环节,单倍体诱导、单倍体鉴别和单倍体加倍。近年来,单倍诱导研究取得突破性进展。中国农业大学等多家单位先后克隆了单倍体主效诱导基因zmpla1和zmdmp(liu et al.,2017;kelliher et al.,2017;gilles et al.,2017;zhong et al.,2019)。通过同源基因序列比对,在水稻和小麦中敲除zmpla1同源基因也能够实现单倍体诱导,其中小麦单倍体诱导效率超过10%,为小麦单倍体育种技术体系的创建奠定了基础(liu et al.,2019;yao et al.,2018)。
3.在玉米中,单倍体籽粒的鉴别主要包括籽粒颜色标记鉴别、籽粒油分鉴别和荧光鉴别三种方式。chase and nanda(1965)首次将r1-nj(navajo)颜色标记引入玉米孤雌生殖单倍体诱导系。该标记为显性标记,当含有纯合r1-nj标记系统的玉米单倍体诱导系诱导不含r1-nj标记系统的常规玉米后,其杂交后代二倍体表现为胚和胚乳都为紫色,单倍体表现为只有胚乳为紫色,因而可以实现单倍体的鉴别。然而该鉴别系统易受被诱导材料遗传组成的影响,尤其是含有颜色抑制基因c1-i和c2-idf的材料(chaikam,et al.2015),如热带材料和欧洲硬粒种质等,r1-nj的表达受到强烈抑制,单倍体鉴别准确率降低。陈绍江等(2003)提出利用玉米籽粒油分的花粉直感效应鉴别单倍体,利用高油诱导系诱导常规材料,其后代单倍体籽粒油分低于杂合二倍体籽粒油分,因而可实现单倍体的鉴别。该方法结合核磁共振技术已经实现自动化鉴别,但专用诱导系和核磁共振技术的结合在一定程度上限制了该方法的应用。董乐等(2018)利用胚和胚乳特异性表达启动子驱动荧光蛋白,并构建了双荧光诱导系。利用该诱导系诱导的后代,可根据胚和胚乳的荧光实现单倍体的鉴别。然而,该方法需要使用特殊的荧光激发设备才能实现鉴别。在小麦中,通过敲除taplas基因可实现小麦单倍体的诱导(liu et al.,2019),但关于小麦单倍体的鉴别研究还未见报道,尤其是小麦单倍体幼胚的鉴别和籽粒的鉴别,严重限制了小麦单倍体育种技术体系的构建。因此,急需建立一套简单高效的小麦单倍鉴别方法。
技术实现要素:
4.本发明的目的是提供两种小麦诱导系在小麦单倍体幼胚及籽粒鉴别中的应用。
5.第一方面,本发明要求保护一种创制小麦单倍体诱导系的方法。
6.本发明要求保护的创制小麦单倍体诱导系的方法,为方法i或方法ii:
7.方法i:一种创制小麦紫胚芽鞘单倍体诱导系的方法,可包括如下步骤:
8.p1、将zmc1基因导入到小麦非紫胚芽鞘单倍体诱导系中进行过表达,得到小麦紫胚芽鞘单倍体诱导系(pci)。
9.其中,所述zmc1基因在所述小麦非紫胚芽鞘单倍体诱导系中的过表达可为组成型过表达,也可为胚芽鞘特异性过表达,因为均不会影响小麦植株的正常生长。
10.方法ii:一种创制小麦紫胚单倍体诱导系的方法,可包括如下步骤:
11.p2、将zmc1基因和zmr基因导入到小麦非紫胚单倍体诱导系中进行胚特异性过表达,得到小麦紫胚单倍体诱导系(pei)。
12.其中,所述zmc1基因和所述zmr基因在所述小麦非紫胚单倍体诱导系中的过表达为胚特异性过表达,不能为组成型过表达,因为当所述zmc1基因和所述zmr基因为组成型过表达时,会影响小麦植株的正常生长。
13.进一步地,步骤p1中,将所述zmc1基因导入到所述小麦非紫胚芽鞘单倍体诱导系中进行过表达可通过杂交或/和转基因的方式实现。
14.进一步地,步骤p2中,将所述zmc1基因和所述zmr基因导入到所述小麦非紫胚单倍体诱导系中进行胚特异性过表达通过转基因或/和杂交的方式实现。
15.在一些实施案例中,步骤p1中,所述小麦紫胚芽鞘单倍体诱导系(pci)可通过包括如下步骤的杂交方法获得:
16.(a1)将过表达所述zmc1基因的小麦材料与所述小麦非紫胚芽鞘单倍体诱导系进行杂交,得到f1代;
17.(a2)将所述f1代进行一次或多次的自交或回交,从自交或回交后代中筛选单株结实率低于50%(单株后代的结实率低说明其单倍体诱导能力强)且种子紫胚芽鞘表型不发生分离(种子紫胚芽鞘表型不发生分离说明纯合)的后代即为所述小麦紫胚芽鞘单倍体诱导系(pci)。
18.其中,所述zmc1基因如seq id no.1自5’端第3320-4141位核苷酸所示。
19.在本发明的具体实施方式中,所述小麦紫胚芽鞘单倍体诱导系(pci)来自于f3代。
20.在本发明的具体实施方式中,过表达所述zmc1基因的小麦材料为小麦al-30。小麦al-30记载于“riaz et al.,(2019)overexpression of maize zmc1 and zmr transcription factors in wheat regulates anthocyanin biosynthesis in a tissue-specific manner.int.j.mol.sci.20:5806”一文。
21.在一些实施案例中,步骤p2中,所述小麦紫胚芽鞘单倍体诱导系(pei)可通过包括如下步骤的转基因方法获得:
22.(b1)构建重组载体;所述重组载体中含有胚特异性表达启动子,以及由所述胚特异性表达启动子启动表达的融合基因;所述融合基因为将所述zmc1基因和所述zmr基因依靠p2a连接肽的编码核酸序列融合而成;进一步地,所述融合基因至5’端到3’端依次由所述zmr基因、所述p2a连接肽的编码核酸序列和所述zmc1基因组成。
23.(b2)将所述重组载体导入到所述小麦非紫胚单倍体诱导系中,得到t0代阳性转基因株系。
24.(b3)将所述t0代阳性转基因株系进行一次或多次自交,从自交后代中筛选纯合的阳性转基因株系即为所述小麦紫胚单倍体诱导系(pei)。
25.在本发明的具体实施方式中,所述小麦紫胚芽鞘单倍体诱导系(pei)来自于t1代。
26.进一步地,所述胚特异性表达启动子为小麦内源traescs2d02g414800基因启动子。
27.更进一步地,所述小麦内源traescs2d02g414800基因启动子如seq id no.1自5’端第1-1419位核苷酸所示。
28.进一步地,所述zmr基因如seq id no.1自5’端第1421-3250位核苷酸所示;所述p2a连接肽的编码核酸序列如seq id no.1自5’端第3260-3316位核苷酸所示;所述zmc1基因如seq id no.1自5’端第3320-4141位核苷酸所示。
29.进一步地,所述重组载体中还含有用于终止所述融合基因表达的终止子。
30.更进一步地,所述终止子为e9终止子。
31.更加具体地,所述e9终止子如seq id no.1自5’端第4146-4812位核苷酸所示。
32.在本发明的具体实施方式中,所述重组载体为将seq id no.1自5’端第1-4812位核苷酸所示dna片段克隆到pagm4723(addgene,plasmid#48015)载体后得到的重组载体。
33.当然,将所述重组载体导入到所述小麦非紫胚单倍体诱导系中也可以通过如下方式实现:先将所述重组载体转入野生型小麦,然后将所述野生型小麦与所述小麦非紫胚诱导系杂交。
34.在一些实施方案中,步骤p1中的所述小麦非紫胚芽鞘单倍体诱导系为小麦单倍体诱导基因tapla-a、tapla-b和tapla-d同时发生突变的材料。
35.在一些实施方案中,步骤p2中的所述小麦非紫胚单倍体诱导系为小麦单倍体诱导基因tapla-a和tapla-d同时发生突变的材料。
36.第二方面,本发明要求保护如下任一应用:
37.q1、前文第一方面所述方法或利用前文第一方面所述方法创制得到的小麦紫胚芽鞘单倍体诱导系(pci)或小麦紫胚单倍体诱导系(pei)在小麦单倍体鉴别中的应用。
38.进一步地,对于所述小麦紫胚芽鞘单倍体诱导系(pci)而言,所述鉴别为通过幼胚和/或籽粒的胚芽鞘颜色进行鉴别。对于所述小麦紫胚单倍体诱导系(pei)而言,所述鉴别为通过幼胚和/或籽粒的胚颜色进行鉴别。
39.q2、前文第一方面所述方法或利用前文第一方面所述方法创制得到的小麦紫胚芽鞘单倍体诱导系(pci)或小麦紫胚单倍体诱导系(pei)在小麦单倍体育种中的应用。
40.第三方面,本发明要求保护如下任一方法:
41.方法a:一种通过幼胚和/或籽粒的胚芽鞘颜色鉴别小麦单倍体的方法,包括如下步骤:以利用前文第一方面所述方法创制得到的小麦紫胚芽鞘单倍体诱导系(pci)作为父本,对母本小麦材料进行杂交诱导,从杂交后代中选择胚芽鞘为正常浅绿色的个体即为或候选为小麦单倍体(杂合个体的胚芽鞘为紫色)。
42.方法b:一种通过幼胚和/或籽粒的胚颜色鉴别小麦单倍体的方法,包括如下步骤:以利用前文第一方面所述方法创制得到的小麦紫胚单倍体诱导系(pei)作为父本,对母本小麦材料进行杂交诱导,从杂交后代中选择胚非花青素积累的个体即为或候选为小麦单倍体(杂合个体的胚为紫色)。
43.方法c:一种小麦单倍体育种方法,包括如下步骤:以利用前文第一方面所述方法创制得到的小麦紫胚芽鞘单倍体诱导系(pci)作为父本,对母本小麦材料进行杂交诱导,从杂交后代中选择胚芽鞘为正常浅绿色的个体即为或候选为小麦单倍体(杂合个体的胚芽鞘为紫色)。
44.方法d:一种小麦单倍体育种方法,包括如下步骤:以利用前文第一方面所述方法创制得到的小麦紫胚单倍体诱导系(pei)作为父本,对母本小麦材料进行杂交诱导,从杂交后代中选择胚非花青素积累的个体即为或候选为小麦单倍体(杂合个体的胚为紫色)。
45.在所述方法a中,所述鉴别为通过幼胚和/或籽粒的胚芽鞘颜色进行鉴别。在所述方法b中,所述鉴别为通过幼胚和/或籽粒的胚颜色进行鉴别。
46.在一些实施例中,所述母本小麦材料选自:小麦jw1、cs(中国春)或mr-h。
47.在所述方法中,父母本材料错期种植,保证花期相遇。开花前母本整穗去雄,去雄3-5天后取诱导系pci或pei花粉进行诱导授粉,授粉后20-25天进行单倍体幼胚鉴别,种子成熟后进行单倍体籽粒鉴别。
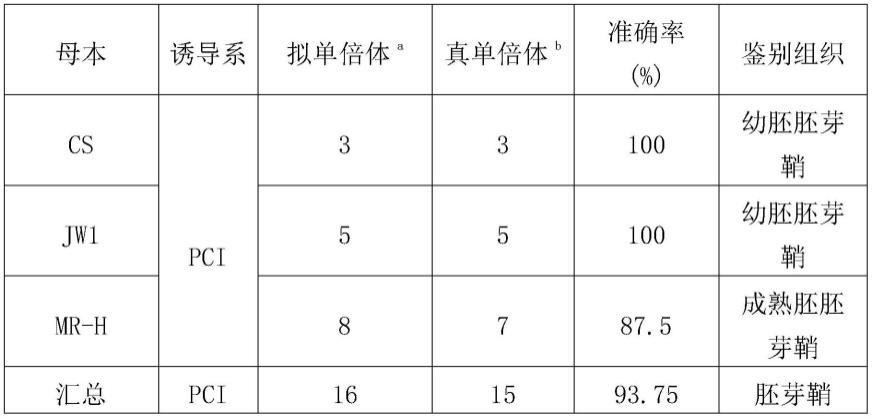
48.实验证明,利用本发明方法创制得到的小麦紫胚芽鞘单倍体诱导系pci,通过幼胚和籽粒进行单倍体鉴别方法,共鉴定拟单倍体16株,其中15株为真单倍体,鉴别准确率为93.75%(表1);利用本发明方法创制得到的小麦紫胚单倍体诱导系pei,通过幼胚和籽粒进行单倍体鉴别方法,共鉴定拟单倍体35株,其中32株为真单倍体,鉴别准确率为91.43%(表1)。可见本发明创制得到的两种小麦单倍体诱导系均可实现小麦单倍体的高效鉴别。本发明对于小麦单倍体育种具有重要意义。
附图说明
49.图1为al-30和al-40胚和胚芽鞘表型观察。
50.图2为al-30/al-40幼苗表型。
51.图3为pci选育过程中不同世代胚芽鞘表型。a为f1代胚芽鞘;b为f2代胚芽鞘;c为分离的f3代胚芽鞘;d为无分离的f3代胚芽鞘。
52.图4为利用pci鉴别小麦单倍体示意图。a为幼胚胚芽鞘鉴别;b为成熟籽粒胚芽鞘鉴别。
53.图5为利用流式细胞术鉴别小麦单倍体。左图为单倍体;右图为六倍体对照。
54.图6为traescs2d02g414800基因表达模式分析。
55.图7为pq52载体结构图。
56.图8为阳性苗鉴定。
57.图9为pei幼胚和成熟胚表型。
58.图10为利用pei鉴别小麦单倍体示意图。h为单倍体;he为六倍体。
具体实施方式
59.下面结合具体实施方式对本发明进行进一步的详细描述,给出的实施例仅为了阐明本发明,而不是为了限制本发明的范围。以下提供的实施例可作为本技术领域普通技术人员进行进一步改进的指南,并不以任何方式构成对本发明的限制。
60.下述实施例中的实验方法,如无特殊说明,均为常规方法,按照本领域内的文献所
描述的技术或条件或者按照产品说明书进行。下述实施例中所用的材料、试剂等,如无特殊说明,均可从商业途径得到。
61.实施例1、al-30和al-40转基因材料表型观察
62.al-30为过表达zmc1所形成的转基因小麦材料(组成型过表达),al-40为过表达zmr所形成的转基因小麦材料(组成型过表达),上述材料由中国农业科学院作物科学研究所叶兴国老师惠赠(这两个小麦材料记载于文献“riaz et al.,(2019)overexpression of maize zmc1 and zmr transcription factors in wheat regulates anthocyanin biosynthesis in a tissue-specific manner.int.j.mol.sci.20:5806”,公众可从申请人处获得,仅可用于重复本发明实验使用,不得他用),zmc1和zmr是玉米中花青素合成的调控因子。过表达zmc1的al-30籽粒与野生型表现一致,胚、胚乳以及种皮中都无花青素积累。al-40的种皮中有花青素积累呈现为褐色,胚和胚乳无明显表型(图1)。将al-30和al-40进行杂交,杂合后代可同时表达zmc1和zmr基因。后代幼胚和成熟籽粒胚中积累了大量的花青素,呈现为深紫色,胚乳中无明显花青素积累(图1)。因此利用含有zmc1和zmr基因的小麦单倍体诱导系诱导常规材料,理论上可根据胚的颜色实现小麦单倍体的鉴别。al-40的胚芽鞘与野生型一致,呈现为浅绿色。al-30的胚芽鞘呈现为浅紫色,且al-30和al-40杂交后代的胚芽鞘紫色加深,表明zmr基因可以在zmc1的基础上,促进花青素在胚芽鞘中的积累(图1)。然而,zmc1和zmr的组成型过表达也导致了小麦叶片中积累大量花青素,严重妨碍了幼苗的正常生长(图2),过表达zmc1基因的al-30不影响植株的生长,可根据胚芽鞘的颜色鉴别单倍体。
63.实施例2、小麦紫胚芽鞘诱导系选育
64.将zmc1基因过表达材料al-30和小麦单倍体诱导系(将小麦品种fielder的单倍体诱导基因tapla-a、tapla-b和tapla-d同时进行突变后得到的纯合三基因突变小麦单倍体诱导系,具体突变方法参考中国专利申请202010074738.8,公众可从中国农业大学陈绍江课题组处申请获得该材料,仅可用于重复本发明实验使用,不得他用)进行杂交,杂交后取部分f1幼胚进行培养,观察胚芽鞘颜色。结果表明所有幼胚都呈现紫色胚芽鞘(图3中a)。f2代胚芽鞘表型开始分离(图3中b),挑选紫胚芽鞘个体培养成苗并单株收获f3种子。单倍体诱导能力可通过单株的结实率进行评估,一般结实率低于50%的个体单倍体诱导能力较高。zmc1基因的纯合性可通过f3种子的表型分离情况进行判断。因此,结实率低于50%且种子紫胚芽鞘表型不发生分离的后代(f3代)被选择并命名为小麦紫胚芽鞘诱导系(pci)(图3中c和d)。
65.实施例3、利用紫胚芽鞘诱导系鉴别单倍体
66.材料种植与杂交:材料于10月中上旬播种,父母本材料错期种植,保证花期相遇。其中母本材料为jw1、cs(中国春)和mr-h;父本材料为实施例2得到的紫胚芽鞘诱导系pci。开花前母本整穗去雄,去雄3-5天后取紫胚芽鞘诱导系pci花粉进行诱导授粉,单倍体采用幼胚和成熟种子两种方式进行鉴别。
67.利用幼胚鉴别单倍体:取授粉后20-25天籽粒,先用70%酒精表面消毒1min,其次用2%次氯酸钠灭菌15min,最后用无菌水冲洗5次去除残留的酒精和次氯酸钠。在解剖镜下取出小麦幼胚,接种至1/2ms培养基(1/2ms 30g
·
l-1
蔗糖 6g
·
l-1
植物凝胶,ph=5.8)上,培养5-7天左右,单倍体胚的胚芽鞘表现为浅绿色(正常颜色),杂合胚的胚芽鞘表现为紫色
(图4中a)。共鉴定cs拟单倍体胚3个,jw1拟单倍体胚5个。对紫胚芽标记鉴别的拟单倍体进行流式细胞检测(样品制备方法请参见“suda,j.et al.,(2007)estimation of nuclear dna content in plants using flow cytometry.,2,2233-2244”),并以六倍体作为对照。由于单倍体核酸含量是六倍体的一半,因此单倍体细胞核信号峰位为六倍体细胞核信号峰位的一半(图5)。结果表明8个拟单倍体胚均为真单倍体,鉴别效率100%(表1)。
68.利用成熟籽粒鉴别单倍体:诱导杂交籽粒成熟后,对籽粒进行催芽,根据胚芽鞘颜色进行单倍体鉴别,浅绿色胚芽鞘的籽粒为单倍体籽粒,浅紫色胚芽鞘的籽粒为杂合六倍体(图4中b)。共鉴定8颗mr-h拟单倍体,通过流式细胞进行倍性确认,其中7颗为真单倍体,单倍体鉴别效率为87.5%(表1)。
69.通过以上两种鉴别方法,共鉴定拟单倍体16株,其中15株为真单倍体,鉴别准确率为93.75%(表1),表明紫胚芽诱导系可实现小麦单倍体的高效鉴别。
70.表1、两种诱导系单倍体鉴别准确率统计
71.[0072][0073]
注:a表示根据胚芽鞘或胚鉴别的拟单倍体;b表示拟单倍体经过流式细胞术验证为真单倍体。“pei
‑……”
表示不同的t1代pei阳性纯合单株。
[0074]
实施例4、胚特异性花青素标记表达载体的构建
[0075]
为进一步优化小麦单倍体鉴别方法,本发明选用胚特异性表达启动子驱动zmc1和zmr表达,构建了胚特异性花青素标记表达载体。所述胚特异性表达启动子克隆自基因traescs2d02g414800,该基因表达模式所图6所示。本发明提供的胚特异性花青素标记表达盒,自上游至下游依次包括如下元件:胚特异性启动子ptraescs2d02g414800、花青素调控基因zmr基因,多肽编码序列p2a、花青素调控基因zmc1和e9终止子;所述胚特异性启动子ptraescs2d02g414800启动zmr、p2a和zmc1融合表达。
[0076]
所述胚特异性启动子ptraescs2d02g414800如seq id no.1自5’端第1-1419位核苷酸所示;所述花青素调控基因zmr如seq id no.1自5’端第1421-3250位核苷酸所示;所述多肽编码序列p2a如seq id no.1自5’端第3260-3316位核苷酸所示;所述花青素调控基因
zmc1如seq id no.1自5’端第3320-4141位核苷酸所示;所述e9终止子如seq id no.1自5’端第4146-4812位核苷酸所示。
[0077]
所述胚特异性花青素标记表达盒如seq id no.1自5’端第1-4812位核苷酸所示。
[0078]
利用moclo tool kit(addgene,#1000000044)将上述胚特异性花青素标记表达盒插入载体pagm4723(addgene,plasmid#48015)上,经测序验证正确后得到胚特异性花青素标记表达载体pq52(图7)。
[0079]
实施例5、紫胚诱导系创建
[0080]
紫胚诱导系pei的获得:将实施例4测序验证后的载体pq52通过热激法转化农杆菌菌株eha105(全式金生物技术有限公司,公众可通过购买获得),获得重组菌eha105/pq52。利用农杆菌介导法将上述胚特异性花青素标记表达载体pq52转化小麦单倍体诱导系(将小麦品种fielder的单倍体诱导基因tapla-a和tapla-d同时进行突变后得到的纯合双基因突变小麦单倍体诱导系,具体突变方法参考“liu,c.et al.,(2019)extension of thein vivo haploid induction system from diploid maize to hexaploid wheat.plant biotechnology journal,18,316-318”一文,公众可从中国农业大学陈绍江课题组处申请获得该材料,仅可用于重复本发明实验使用,不得他用)中,经过诱导愈伤,筛选和分化培养后,生根成苗,获得转基因植株,形成紫胚诱导系pei(具体方法请参见“zhang et al.,(2018)targeted mutagenesis using the agrobacterium tumefaciens-mediated crispr-cas9 system in common wheat.bmc plant biology,18,302”)。
[0081]
阳性苗鉴定:提取t0代转基因小麦植株叶片dna并利用pq52载体检测引物进行pcr扩增,扩增产物进行琼脂糖凝胶电泳鉴定。目标产物大小为566bp,pq52载体检测引物如下:
[0082]
zmr-f:5
’‑
cgacatagaggcgatgac-3’;
[0083]
zmr-r:5
’‑
acttgaggacgaggaaca-3’。
[0084]
转基因苗t0-1至t0-4都能扩增出566bp条带,非转基因对照fielder无对应条带扩增,证明被检测植株都为成功转化pq52质粒的阳性苗(图8)。
[0085]
利用小麦单倍体诱导基因检测引物进行pcr扩增,检测引物如下:
[0086]
用于检测tapla-a基因的引物对:
[0087]
4af:5
’‑
gtcaagatctccagccgagac-3’;
[0088]
4ar:5
’‑
ggtacttgccgctgtacct-3’。
[0089]
用于检测tapla-b基因的引物对:
[0090]
4bf:5
’‑
aactcaacatggggcgtcctc-3’;
[0091]
4br:5
’‑
acgtcgtatgtggagaagatgatg-3’。
[0092]
用于检测tapla-d基因的引物对:
[0093]
4df:5
’‑
ttcgggtccggattctattgtg-3’;
[0094]
4dr:5
’‑
gcaggtacttgccgttgtacc-3’。
[0095]
扩增产物进行sanger测序,并将测序结果与野生型小麦fielder的plas基因序列进行比对,t0代四株阳性苗比对结果如表2。
[0096]
表2、t0代四株阳性苗taplas基因序列比对结果
[0097]
wtccagggacgtcaaccgcttctapla-a突变ccagg-acgtcaaccgcttc
tapla-b突变wttapla-d突变ccagg-acgtcaaccgcttc
[0098]
结果表明,所有被检测植株都为小麦单倍体诱导基因tapla-a和tapla-d发生纯合突变的阳性植株。
[0099]
阳性苗花青素表达观察:阳性苗开花后20-25天,取未成熟籽粒进行幼胚分离。转基因幼胚呈现紫色,非转基因幼胚无花青素积累(正常颜色)(图9),证明ptraescs2d02g414800启动的zmr、p2a和zmc1融合表达盒可以在小麦幼胚中表达;种子成熟收获后,对种子花青素颜色进行观察,转基因种胚呈现紫色,非转基因种胚无花青素积累(正常颜色)(图9),证明ptraescs2d02g414800启动的zmr、p2a和zmc1融合表达盒可以在小麦成熟胚中表达。更重要的是转基因苗叶片中无明显花青素积累,可正常发育成熟。
[0100]
实施例6、利用紫胚诱导系鉴别单倍体
[0101]
材料种植与杂交:材料于10月中上旬播种,父母本材料错期种植,保证花期相遇。其中母本材料为jw1、cs和mr-h,父本材料为实施例5获得的t1代紫胚诱导系(纯合阳性单株)。开花前母本整穗去雄,去雄3-5天后取紫胚诱导系花粉进行诱导授粉,授粉后20-25天进行单倍体幼胚鉴别,种子成熟后进行单倍体籽粒鉴别。
[0102]
利用幼胚鉴别单倍体:幼胚分离和培养方法同上。单倍体幼胚表现为无花青素积累(正常颜色),杂合胚为紫色(图10)。根据胚的颜色,共鉴定cs拟单倍体胚11个,jw1拟单倍体胚9个。通过流式细胞进行幼胚倍性验证,上述20个都为真单倍体,单倍体鉴别效率100%(表1)。
[0103]
利用成熟籽粒鉴别单倍体:诱导杂交籽粒成熟后,对籽粒胚部进行观察,根据胚的颜色进行单倍体鉴别,正常颜色胚的籽粒为单倍体籽粒,紫胚的籽粒为杂合六倍体(图10)。共鉴定8粒jw1的拟单倍体、3粒mr-h拟单倍体和4粒cs拟单倍体,通过流式细胞进行倍性确认,其中12粒为真单倍体,单倍体鉴别效率为80%(表1)。
[0104]
通过以上两种鉴别方法,共鉴定拟单倍体35株,其中32株为真单倍体,鉴别准确率为91.43%(表1),表明紫胚诱导系可实现小麦单倍体的高效鉴别。
[0105]
以上对本发明进行了详述。对于本领域技术人员来说,在不脱离本发明的宗旨和范围,以及无需进行不必要的实验情况下,可在等同参数、浓度和条件下,在较宽范围内实施本发明。虽然本发明给出了特殊的实施例,应该理解为,可以对本发明作进一步的改进。总之,按本发明的原理,本技术欲包括任何变更、用途或对本发明的改进,包括脱离了本技术中已公开范围,而用本领域已知的常规技术进行的改变。按以下附带的权利要求的范围,可以进行一些基本特征的应用。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。