1.本发明属于微生物基因工程技术领域,具体涉及一种高效合成羟基酪醇的地衣芽胞杆菌、构建方法及其应用。
背景技术:
2.羟基酪醇(hydroxytyrosol,ht)又叫3,4-二羟基苯乙醇,是一种生物活性多酚,是目前已知的最强的天然抗氧化剂之一。羟基酪醇可以清除自由基,减少低密度脂蛋白的氧化,刺激钙的沉积。它还具有抗癌、抗炎和抗微生物活性。因此,羟基酪醇可用于化妆品、食品、保健品和医疗行业。
3.目前,ht是通过植物提取或化学合成在工业上制造的。自然界中,ht以橄榄苦苷的形式存在于橄榄植物中,可以从新鲜橄榄叶和橄榄加工废水中提取羟基酪醇。尽管这些材料丰富且价格低廉,但也存在一些缺点,例如收率低、酸性水蒸汽强和方法的持续时间长。化学合成则利用ht的一些类似物,如3,4-二羟基苯乙酸、3,4-二羟基苯甲醛和酪醇等作为底物合成羟基酪醇,这些方法由于基材昂贵、条件恶劣、步骤复杂或产量低不适合大规模工业化生产。
4.随着代谢工程和合成生物学的进步,通过重建天然途径或在微生物中引入人工生物合成途径,已经实现了从简单碳源从头生产ht。目前大多数报道都是利用大肠杆菌经过微生物改造合成羟基酪醇,这为微生物发酵法生产羟基酪醇奠定了重要基础。但是利用简单碳源从头合成ht,合成途径较长,代谢负担重,也存在效率不高和底物转化率低的问题,需要进一步提高从头效率以实现经济生产ht。
技术实现要素:
5.针对上述现有技术中存在的问题,本发明的目的之一是提供一种高效合成羟基酪醇的地衣芽胞杆菌。开发一种重组地衣芽胞杆菌,在产酪醇的地衣芽胞杆菌中优化表达合成羟基酪醇的基因酮酸脱羧酶基因以及羟化酶基因,构建异源合成羟基酪醇的地衣芽胞杆菌菌株。
6.本发明的另一个目的在于提供上述重组地衣芽胞杆菌在生产羟基酪醇中的应用。
7.为了解决上述问题,本发明的技术方案如下:
8.一种高效合成羟基酪醇的地衣芽胞杆菌,包括如下步骤:
9.依次敲除地衣芽胞杆菌dw2中的丙酮酸激酶基因pyk、酪氨酸/苯丙氨酸转氨酶基因hisc和醛脱氢酶基因dhas,醇脱氢酶基因adha获得地衣芽胞杆菌dh4,将tyra
fbr
基因整合至地衣芽胞杆菌dh4的ldh的位点,获得地衣芽胞杆菌dh5,将地衣芽胞杆菌dh5中的基因,arok和aroa启动子均替换为pbaca,获得地衣芽胞杆菌dh7;
10.将大肠杆菌bl21(de3)基因组中4-羟基苯乙酸-3-羟化酶基因hpabc与kivd
v461a
或kivd
v461i
进行共表达,然后转入dh7中,kivd
v461a
序列为seq id no.89所示,kivd
v461i
序列为seq id no.90所示。
11.其中hpabc的启动子可以为:pbaca,p43或pbay;
12.kivd
v461a
或kivd
v461i
的启动子可以为:pbaca,p43或pbay。
13.本发明的保护范围还包括:上述的地衣芽胞杆菌用于合成羟基酪醇。
14.与现有技术相比,本发明具有以下优点:
15.1、本发明在地衣芽胞杆菌dh7中过表达kivd突变体(v461a和v461i)和hpabc的目的基因。通过这些酶在重组地衣芽胞杆菌dh7中的有效表达,菌株可以利用葡萄糖为底物从头合成羟基酪醇,合成成本低廉,操作简单。
16.2、本发明利用强启动子p43、pbaca和pbay高效驱动外源基因在重组地衣芽胞杆菌dh7中特异性表达,提高了重组表达载体的构建和转化效率,进而有效提高了地衣芽胞杆菌合成羟基酪醇的能力,提高了羟基酪醇的产量。
附图说明
17.图1为羟基酪醇的合成路线。
18.图2为dw2/phy300和ht1羟基酪醇液相图。
具体实施方式
19.下面结合实施例对本发明进一步详细说明,但本发明的保护范围不仅限于这些实施例。
20.实施例1:
21.基因工程菌株dh7的构建:
22.(1)敲除pyk、hisc和dhas:以地衣芽胞杆菌dw2的基因组为模板,利用引物pyk-af/ar和pyk-bf/br分别扩增丙酮酸激酶基因pyk片段的上下游同源臂,将上下游同源臂片段融合得到pyk敲除盒;利用引物(t2-t5-f/r),以质粒t2(2)-ori为模板扩增骨架;将pyk敲除盒插入质粒t2中,利用t2-f/t2-r进行菌落pcr,获得阳性转化子,经过dna测序,成功构建pyk敲除质粒t2
‑△‑
pyk,导入地衣芽胞杆菌dw2中(或称为地衣芽孢杆菌dw2,cn112226437a),通过同源重组获得pyk敲除菌株dh1;酪氨酸/苯丙氨酸转氨酶基因hisc和醛脱氢酶基因dhas敲除载体构建方法同pyk,并通过迭代敲除获得pyk,hisc和dhas基因同时敲除的菌株dh3;
23.其中,pyk敲除所需引物序列为:
24.pyk-af:ctgcagcccgggggatccgggatacagctacatccc
25.pyk-ar:ttaaagtacgcttgcacgcggcccaattgtacaaact
26.pyk-bf:agtttgtacaattgggccgcgtgcaagcgtactttaa
27.pyk-br:gatcttttctacgagctcgcggcagcctgctttttc
28.t2-t5-f:ggatcccccgggctgcaggaattc
29.t2-t5-r:gagctcgtagaaaagatcaaagga
30.t2-f:atgtgataactcggcgta
31.t2-r:gcaagcagcagattacgc
32.pyk-yf:ttctcggattgatcatgg
33.pyk-yr:aacggcttgacgactttc
34.敲除hisc的引物
35.hisc-af:ctgcagcccgggggatccaacggcgtcgtgttcagc
36.hisc-ar:gtaaaatgaggtgacagagaggtgatgattcagtca
37.hisc-bf:tgactgaatcatcacctctctgtcacctcattttac
38.hisc-br:gatcttttctacgagctccttggcggtgaaatgaaa
39.hisc-yf:gtgcggaaagtggctgat
40.hisc-yr:acatgaacatcgtaaaagc
41.敲除hisc的引物
42.dhas-af:ctgcagcccgggggatccgtgcgggtgtatgttcaa
43.dhas-ar:atttcacgtccgagtccctcgggtgagttgtcttgg
44.dhas-bf:ccaagacaactcacccgagggactcggacgtgaaat
45.dhas-br:gatcttttctacgagctcaataccaggaaccgacaa
46.dhas-yf:accgcagcaggatgttct
47.dhas-yr:cgcatttgctaaaccttc
48.(2)敲除醇脱氢酶基因adha:以地衣芽胞杆菌dw2的基因组为模板,利用引物adha-af/ar和adha-bf/br分别扩增adha片段的上下游同源臂,将上下游同源臂片段融合得到ahda敲除盒,利用引物(t2-t5-f/r),以质粒t2(2)-ori为模板扩增骨架;将其插入质粒t2中,利用t2-f/t2-r进行菌落pcr,获得阳性转化子,经过dna测序,成功构建ad ha敲除质粒t2
‑△‑
adha,导入地衣芽胞杆菌dh3中,通过同源重组获得adha敲除菌株d h4;
49.adha敲除所用引物如下
50.adha-af:ctgcagcccgggggatccagcagtgtagcacgataa
51.adha-ar:gggaggcggaatctttccaatcatatgtaatacagagag
52.adha-bf:ctctctgtattacatatgattggaaagattccgcctccc
53.adha-br:gatcttttctacgagctcccttaatggagggcggtcaa
54.adha-yf:tcatgagtcctccgattc
55.adha-yr:ttttatacgagcggtgac。
56.(3)tyra
fbr
整合至ldh位点:根据地衣芽胞杆菌基因组dna序列中ldh的序列,设计引物(ldh-af/ar、ldh-bf/br)扩增ldh的上下游同源臂;根据枯草芽胞杆菌dna序列中pylb的序列,设计引物(pylb-f/r)扩增启动子pylb;根据大肠杆菌dna序列中tyra的序列及tyra的突变位点序列(seq id no.85所示),设计引物(tyra-f/tyra-r)扩增tyra
fbr
;根据地衣芽胞杆菌dna序列中tamyl的序列,设计引物(tamyl-f和tamyl-r)扩增tamyl;利用引物将ldh上下游同源臂,pylb启动子和tyra
fbr
片段融合构建tyra
fbr
表达盒;利用引物(t2-t5-f/r),以质粒t2(2)-ori为模板扩增骨架;将其插入质粒t2中,利用t2-f/t2-r进行菌落pcr,获得阳性转化子,经过dna测序,成功构建tyra
fbr
整合表达质粒t2-ldh-tyra
fbr
,导入地衣芽胞杆菌dh4中,通过同源重组获得tyra
fbr
整合表达菌株dh5;所述的预苯酸脱氢酶tyra
fbr
编码的氨基酸序列为seq id no.86所示.
57.tyra
fbr
整合至ldh位点所用引入如下:
58.ldh-af:ctgcagcccgggggatccccgacctgtgatggagat
59.ldh-ar:ggagcgcgttcgacgatgcatattgtgcaatacttc
60.pylb-f:gaagtattgcacaatatgcatcgtcgaacgcgctcc
61.pylb-r:ggtcaattcagcaaccatacaaatctccccctttgt
62.tyra-f:acaaagggggagatttgtatggttgctgaattgacc
63.tyra-r:tccgtcctctctgctcttaatgaaggtattgggctg
64.tamyl-f:cagcccaataccttcattaagagcagagaggacgga
65.tamyl-r:aacagattcccaaacggacgcaataatgccgtcgca
66.ldh-bf:tgcgacggcattattgcgtccgtttgggaatctgtt
67.ldh-br:gatcttttctacgagctctcaagcctcccatctgtg
68.ldh-yf:catatcagcggaatcatc
69.ldh-yr:ccgcttaatacaaggaga
70.(4)arok和aroa启动子替换为pbaca:
71.利用引物parok-af/ar扩增arok启动子上下游500bp序列,分别作为上下同源臂,以地衣芽胞杆菌dw2基因组dna为模板扩增pbaca启动子序列,将上同源臂,启动子和下同源臂进行融合,设计引物(t2-t5-f和t2-t5-r),以质粒t2(2)-ori为模板扩增骨架;使用一步克隆试剂盒将融合片段和线性质粒片段进行连接,转化大肠杆菌dh5α感受态细胞中,通过pcr验证,测序分析,分别获得重组质粒t2(2)-pbaca-arok。将重组质粒电转至地衣芽胞杆菌dh5中,进行同源重组交换,筛选验证,获得启动子置换arok启动子菌株dh6。
72.aroa强化表达载体菌株构建方法同arok启动子置换菌株,最终获得dh7菌株。
73.arok启动子置换所用引物如下所示:
74.parok-af:ctgcagcccgggggatccgtaggctcatttgctgat
75.pbaca(arok)-ar:aatctcgccgaaatcgcaggctatttccaccagtcgtcaa
76.pbaca(arok)-f:ttgacgactggtggaaatagcctgcgatttcggcgagatt
77.pbaca(arok)-r:tctcattgcggcattcatataaaaattctcctttttgat
78.pbaca(arok)-bf:atcaaaaaggagaatttttatatgaatgccgcaatgaga
79.parok-br:gatcttttctacgagctcctttcaagttgtggaatg
80.parok-yf:aggcgttcaggcggaatt
81.parok-yr:gacacagcgatagaaaca
82.aroa启动子置换所用引物如下所示:
83.paroa-af:ctgcagcccgggggatccgaagtggacgcacatttc
84.pbaca(aroa)-ar:tctcgccgaaatcgcagggttatccatcctttcttt
85.pbaca(aroa)-f:aaagaaaggatggataaccctgcgatttcggcgaga
86.pbaca(aroa)-r:aagttcagtgttgctcatataaaaattctccttttt
87.pbaca(aroa)-bf:aaaaaggagaatttttatatgagcaacactgaactt
88.paroa-br:gatcttttctacgagctccaacacgctttaagattt
89.paroa-yf:gttgacgcacgcttcgtt
90.paroa-yr:attgatgaattccttcag
91.实施例2:
92.野生型kivd和hpabc共表达菌株构建
93.步骤1:根据大肠杆菌bl21(de3)基因组中hpabc的序列,设计引物(p43-hpabc-f和
hpabc-r)扩增hpabc的序列,根据枯草芽胞杆菌168基因组中p43启动子的序列(seq id no.92所示),设计引物(amp-p43-f和p43-hpabc-r)扩增出p43的序列;
94.其中,amp-p43-f、p43-hpabc-r、p43-hpabc-f、hpabc-r的序列为:
95.amp-p43-f:acttttcggggaaatgtctgataggtggtatgtttt
96.p43-hpabc-r:gaaatcttctggtttcatgtgtacattcctctctta
97.p43-hpabc-f:taagagaggaatgtacacatgaaaccagaagatttc
98.hpabc-r:gtaaacttggtctgacagttaaatcgcagcttccattt
99.步骤2:通过重叠延伸pcr将p43和hpabc(seq id no.91所示)连接到一起(所用引物为amp-p43-f和hpabc-r),获得融合片段;
100.步骤3:设计引物(t5-amp-f和t5-amp-r),以质粒phy-pbaca-kivd(zhany,et al.efficient synthesis of 2-phenylethanol from l-phenylalanine by engineered bacillus lichenif ormis using molasses as carbon source.appl microbiol biotechnol.2020.104(17):7507-7520)为模板扩增骨架。kivd序列为seq id no.88所示。
101.其中,t5-amp-f和t5-amp-r的序列为:
102.t5-amp-f:gacatttccccgaaaagtgccac
103.t5-amp-r:ctgtcagaccaagtttactcatata;
104.步骤4:使用一步克隆试剂盒将步骤(6)和(7)得到的基因片段和线性质粒片段进行连接,通过氯化钙转化法将该连接产物转入大肠杆菌dh5α,在37℃的条件下经含有四环抗性的培养基进行筛选,筛选得到转化子,对转化子挑质粒进行菌落pcr验证(所用引物为:amp-yf和amp-yr)筛选到阳性转化子,dna测序验证正确,命名为共表达载体phy-pbaca-kivd-p43-hpabc;
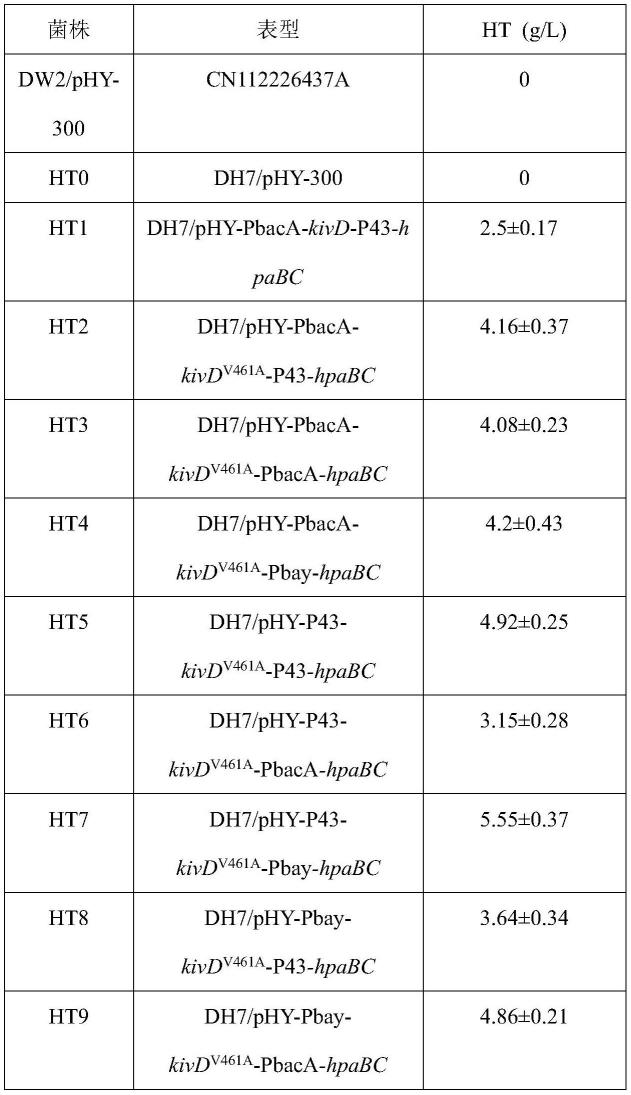
105.其中,amp-yf和amp-yr的序列为:
106.amp-yf:ccctgatctcgacttcgt
107.amp-yr:ttaaggggtctgacgctc
108.步骤5:将phy-pbaca-kivd-p43-hpabc质粒电转至dh7中,菌株pcr验证,成功获得成功转化重组质粒phy-pbaca-kivd-p43-hpabc的重组菌株ht1。
109.实施例3:
110.突变型kivd(v461a或v461i)和hpabc共表达菌株的构建
111.步骤1:以实施例2中的载体phy-pbaca-kivd-p43-hpabc为模板,分别以引物v461a-f/r和v461i-f/r扩增含v461a和v461i的突变的骨架。
112.v461a-f:gttatacagctgaaagagaaattcatggaccaaatcaaa
113.v461a-r:ctctttcagctgtataaccatcattattgataataaagc
114.v461i-f:gttatacaatcgaaagagaaattcatggaccaaatcaaa
115.v461i-r:ctctttcgattgtataaccatcattattgataataaagc
116.步骤2:使用一步克隆试剂盒将步骤(1)得到的v461a和v461i的线性骨架进行载体自连,通过氯化钙转化法将该连接产物转入大肠杆菌dh5α,在37℃的条件下经含有四环抗性的培养基进行筛选,筛选得到转化子,对转化子挑质粒进行菌落pcr验证(所用引物为:phy-yf和phy-yr),并通过dna测序验证突变位点成功突变,并将v461a和v461i突变体载体分别命名为phy-pbaca-kivd
v461a-p43-hpabc和phy-pbaca-kivd
v461i-p43-hp abc。kivd
v461a
序列为seq id no.89所示,kivd
v461i
序列为seq id no.90所示。
117.步骤3:将phy-pbaca-kivd
v461a-p43-hpabc和phy-pbaca-kivd
v461i-p43-hpabc质粒分别电转至重组菌株dh7中,获得ht2和ht3菌株。
118.实施例4:
119.不同启动子组合表达突变型kivd(v461a和v461i)和hpabc的重组菌株的构建
120.步骤1:以实施例3中的质粒phy-pbaca-kivd
v461a-p43-hpabc和phy-pbaca-kivd
v461i-p43-hpabc为模板,分别以pbaca(seq id no.93所示),p43和pbay(seq id no.94所示)为启动子,构建18种不同组合的表达载体。以构建phy-p43-kivd
v461i-p43-hpabc为例,以p43片段为模板,以p43-kivd-f/r引物扩增p43启动子,以phy-pbaca-kivd
v461i-p43-hpabc为模板,以kivd-t5-f/r引物扩增phy-p43-kivd
v461i-p43-hpabc载体骨架;使用一步克隆试剂盒将p43启动子片段和phy-p43-kivd
v461i-p43-hpabc线性骨架进行连接,通过氯化钙转化法将该连接产物转入大肠杆菌dh5α,在37℃的条件下经含有四环抗性的培养基进行筛选,筛选得到转化子,命名为共表达载体phy-p43-kivd
v461i-p43-hpabc。其余15种不同组合表达载体构建方法类似于phy-p43-kivd
v461i-p43-hpabc。
121.其余15种组合表达载体如下表所示:
122.重组质粒重组质粒phy-pbaca-kivd
v461a-pbaca-hpabcphy-pbaca-kivd
v461i-pbaca-hpabcphy-pbaca-kivd
v461a-pbay-hpabcphy-pbaca-kivd
v461i-pbay-hpabcphy-p43-kivd
v461a-p43-hpabcphy-p43-kivd
v461i-pbaca-hpabcphy-p43-kivd
v461a-pbaca-hpabcphy-p43-kivd
v461i-pbay-hpabcphy-p43-kivd
v461a-pbay-hpabcphy-pbay-kivd
v461i-p43-hpabcphy-pbay-kivd
v461a-p43-hpabcphy-pbay-kivd
v461i-pbaca-hpabcphy-pbay-kivd
v461a-pbaca-hpabcphy-pbay-kivd
v461i-pbay-hpabcphy-pbay-kivd
v461a-pbay-hpabc 123.p43-kivd-f:tttttataacaggaattctgataggtggtatgtttt
124.p43-kivd-r:atctcctactgtatacatgtgtacattcctctctta
125.pbaca-kivd-f:tttttataacaggaattccctgcgatttcggcgaga
126.pbaca-kivd-r:atctcctactgtatacatataaaaattctccttttt
127.pbay-kivd-f:tttttataacaggaattccctgcgatttcggcgaga
128.pbay-kivd-r:atctcctactgtatacatacaaatctccccctttgt
129.kivd-t5-f:gaattcctgttataaaaaaaggatc
130.kivd-t5-r::atgtatacagtaggagattaccta
131.p43-hpabc-f:acttttcggggaaatgtctgataggtggtatgtttt
132.p43-hpabc-r:gaaatcttctggtttcatgtgtacattcctctctta
133.pbaca-hpabc-f:acttttcggggaaatgtccctgcgatttcggcgaga
134.pbaca-hpabc-r:gaaatcttctggtttcatataaaaattctccttttt
135.pbay-hpabc-f:acttttcggggaaatgtccctgcgatttcggcgaga
136.pbay-hpabc-r:gaaatcttctggtttcatacaaatctccccctttgt
137.hpabc-t5-f:gacatttccccgaaaagtgccac
138.hpabc-t5-r:atgaaaccagaagatttccg
139.步骤2:将构建的18种不同组合表达的重组质粒和对照载体phy300电转化至重组菌株dh7中,获得18中重组地衣芽胞杆菌ht2~ht19和ht0对照菌株。
140.实施例5:
141.重组地衣芽胞杆菌羟基酪醇发酵
142.1)种子发酵:平板上活化地衣芽胞杆菌dw2/phy-300,ht0和不同重组地衣芽胞杆菌ht1~ht19,挑菌接至分别接种至含有50ml液体lb的250ml三角瓶中,37℃,230rp m培养13h。然后随后以2%(体积比)的接种量接种至发酵培养基中;羟基酪醇发酵培养基的培养条件为37℃,230rpm培养48h,发酵结束后测定羟基酪醇产量。
143.所述的羟基酪醇发酵培养基的配方是10g/l蛋白胨,5g/l酵母粉,10g/lnacl,18.6g/lk2hpo4,5.2g/lkh2po4,70g/l葡萄糖,ph 7.0,其余为水。
144.2)发酵液前处理:利用去离子水将发酵液稀释,离心除菌体,再经0.22μm水相滤膜过滤。
145.3)采用高效液相色谱(hplc)检测羟基酪醇。测定条件具体为:使用agilent 1260高效液相色谱仪,色谱柱为c18柱(4.6mm id
×
250mm,5μm),流动相为甲醇:0.1%甲酸=2:8,流速0.6ml/min,柱温30℃,进样量10.0μl,检测波长为224nm,洗脱25min。根据羟基酪醇标准品制作的标准曲线计算出发酵液中羟基酪醇的含量。结果表明,对照菌株dw2/phy-300和dh0菌株未检测到羟基酪醇,而重组菌株中都检测到有羟基酪醇,其中h t7(phy-p43-kivd
v461a-pbay-hpabc)和ht16(phy-p43-kivd
v461i-pbay-hpabc)菌株产量最高达到5.55
±
0.37和5.49
±
0.33g/l。
146.表1不同重组菌株羟基酪醇产量
147.148.
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。
