针对铜绿假单胞菌生物膜形成的二价leca抑制剂
技术领域
1.本发明涉及与leca结合的二价化合物。这些化合物可用于阻断铜绿假单胞菌的生物膜形成。本发明还涉及包含这些化合物的药物组合物以及这些化合物的治疗方法和用途,特别是用于治疗对象中的铜绿假单胞菌感染的治疗方法和用途。本发明还涉及通过使用这些二价化合物对感染成像,例如对由铜绿假单胞菌产生的生物膜进行成像。
背景技术:
2.铜绿假单胞菌是一种形成生物膜的革兰氏阴性机会性eskape病原菌,形成生物膜是慢性感染和抗菌素耐药性的标志。铜绿假单胞菌四聚体d-半乳糖特异性凝集素leca在黏附和生物膜形成中起关键作用(diggle等人,environ microbiol 8 1095-104(2006))。因此,抑制leca和细菌黏附以及生物膜的完整性是破坏amr的替代治疗策略。
3.糖凝集素的相互作用通常具有低亲和力。增强抑制剂活性的一种方法是通过多价结合(cecioni等人,chem rev,2015,115(1),525-61)。多价抑制剂能够比它们的单价类似物强几个数量级。多价配体的结合亲和力可以通过仔细的接头设计进行微调,特别是通过优化接头长度和灵活性。然而,多价分子可通过免疫原性和不同于它们的设计增加生物膜的形成而不是期望的相反效果。pieters实验室设计了二价分子,它同时适合leca中的两个相邻结合位点,因此不能交联生物膜,而是关闭leca功能(f.pertici和r.j.pieters,chem commun(camb)48 4008-10(2012);g.yu,r.j.pieters等人,j org chem 84 2470-2488(2019))。
4.yu等人制备的分子显示出低至12nm的优异效力,但由于其寡糖接头性质,合成复杂且在药物开发中存在缺点,因此缺乏合成可及性和类药性质。
5.综上所述,pieters(二价)和其他多价结构的复杂分子具有合成复杂和对先天免疫蛋白(prr、凝集素等)非特异性作用的缺点。目前在多价配体中不存在类药性质。二价pieters分子也缺乏类药性。
6.构成本发明的基础的技术问题
7.考虑到现有技术的二价和多价化合物的这些缺点,本领域仍然需要能够容易合成并表现出类药性质的leca抑制剂。
8.本发明人设计、合成和评估了一系列二价leca抑制剂,其中重点关注接头的简单性和可及性。通过使用具有优化的长度的双醛的酰基酰肼的接头,它们具有易于获得的半乳糖和接头的合成砌块的简单一步偶联方法。事实证明,这些新分子与pieters分子等效,具有改善的合成可及性。下面的实施例部分示出了spr对leca的两位数纳摩尔的活性。此外,本发明人设计了一种合成方法来修饰最佳的二价leca配体,该二价leca配体具有用于连接染料以进行生物膜成像和连接溶解度标签以增加双酰基酰肼的溶解度的点击化学连接部位。本发明人还设想取代酰腙连接基序以进一步改善分子类药性质和合成可及性。
9.在保持对靶标的非常高亲和力的同时,本文公开的分子在合成的容易性、简单性、类药性(mw、h-键供体和受体等)方面具有有益性质。r11
、-conh2、r
13
为c1至c4烷基的-conhr
13
、r
13
和r
14
彼此独立地为c1至c4烷基的-conr
13r14
和
–
ch
2-r
11
;
26.其中r
12
是c1至c4烷基;和
27.其中r
11
选自
[0028]-氢、
[0029]-c1至c4烷基、
[0030]-任选地被一个、两个或三个取代基取代的芳基,所述取代基彼此独立地选自c1至c4烷基、卤素、c1至c4卤代烷基、-oh、c1至c4烷氧基、-nh2、r
13
为c1至c4烷基的-nhr
13
、r
13
和r
14
彼此独立地为c1至c4烷基的-nr
13r14
、-no2、-cn、-cooh、r
13
为c1至c4烷基的-coor
13
和-so3h,和
[0031]-任选地被一个、两个或三个取代基取代的杂芳基,所述取代基彼此独立地选自c1至c4烷基、卤素、c1至c4卤代烷基、-oh、c1至c4烷氧基、-nh2、r
13
为c1至c4烷基的-nhr
13
、r
13
和r
14
彼此独立地为c1至c4烷基的-nr
13r14
、-no2、-cn、-cooh、r
13
为c1至c4烷基的-coor
13
和-so3h、
[0032]
(d)任选地被一个或多于一个取代基取代的c1至c6烷二基,所述取代基选自卤素、-cn、-nh2、-nr
11r12
、-nh-co-r
11
、-nh-so
2-r
11
、-or
11
、-sr
11
、-so2r
11
、-coor
11
、-no2、-三唑-r
11
、-conh2、r
13
为c1至c4烷基的-conhr
13
、r
13
和r
14
彼此独立地为c1至c4烷基的-conr
13r14
和
–
ch
2-r
11
;
[0033]
其中r
12
是c1至c4烷基;和
[0034]
其中r
11
选自
[0035]-氢、
[0036]-c1至c4烷基、
[0037]-任选地被一个、两个或三个取代基取代的芳基,所述取代基彼此独立地选自c1至c4烷基、卤素、c1至c4卤代烷基、-oh、c1至c4烷氧基、-nh2、r
13
为c1至c4烷基的-nhr
13
、r
13
和r
14
彼此独立地为c1至c4烷基的-nr
13r14
、-no2、-cn、-cooh、r
13
为c1至c4烷基的-coor
13
和-so3h,和
[0038]-任选地被一个、两个或三个取代基取代的杂芳基,所述取代基彼此独立地选自c1至c4烷基、卤素、c1至c4卤代烷基、-oh、c1至c4烷氧基、-nh2、r
13
为c1至c4烷基的-nhr
13
、r
13
和r
14
彼此独立地为c1至c4烷基的-nr
13r14
、-no2、-cn、-cooh、r
13
为c1至c4烷基的-coor
13
和-so3h;
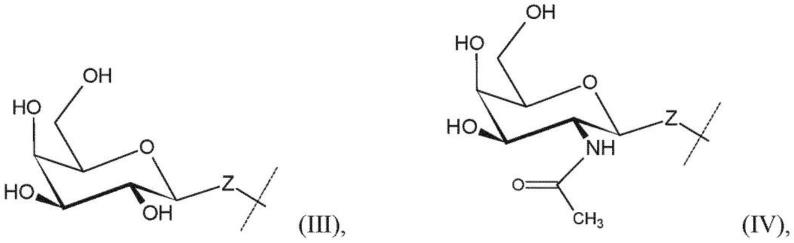
[0039]
r1选自-o-、-s-、-nh-、-co-nh-、-nh-co-、-c(o)-、-x1(ch2)nx
2-,其中n是1、2、3、4或5;并且x1和x2彼此独立地选自-o-、-s-、-nh-、-co-nh-、-nh-co-和-c(o)-;
[0040]
其中(ch2)n基团任选地带有通过烷基、杂烷基、芳基-烷基、杂芳基-烷基、芳基-杂烷基或杂芳基-杂烷基基团连接至(ch2)n基团的标记,其中这些基团中的任一个能够任选地被取代;和
[0041]
r5是-o-c
1-6
烷基;
[0042]
或其盐或其溶剂合物或其前药。
[0043]
在第二方面,本发明涉及一种药物组合物,其包含根据第一方面的化合物,并且任选地包含选自药学上可接受的载体、稀释剂、赋形剂和抗菌治疗剂的一种或多于一种组分。
[0044]
在第三方面,本发明涉及根据第一方面的化合物,其用于药物。
[0045]
在第四方面,本发明涉及根据第一方面的化合物,其任选地与一种或多于一种抗
菌治疗剂组合,
[0046]-用于预防或治疗患者的铜绿假单胞菌感染,或
[0047]-用于预防或治疗患有囊性纤维化的患者的铜绿假单胞菌相关呼吸道感染。
[0048]
在第五方面,本发明涉及根据第一方面的化合物,其用于体内感染成像。
[0049]
在第六方面,本发明涉及根据第一方面的化合物在体外生物膜成像和体外筛选测定中的用途,优选用于对由铜绿假单胞菌产生的生物膜进行成像。
[0050]
本发明的内容未必描述了本发明的所有特征。通过查看随后的具体实施方式,其他实施方案将变得明显。
附图说明
[0051]
图1:双苯甲醛接头a至e和单苯甲醛接头f的结构。具有leca并覆盖有pdb 4ywa的a6p至e6p的moe模型。
[0052]
图2:用于竞争结合测定的报告配体8的结构(joachim等人,2016)。
[0053]
图3:二价抑制剂与leca的竞争结合测定。通过在一个板上进行三个重复实验计算得到误差棒。
[0054]
图4:用配体f6m和f6p进行leca的等温滴定微量热法。示出了一种代表性的滴定。
[0055]
图5:b6p与固定在cm5芯片上的leca直接结合的表面等离子体共振分析。
[0056]
图6:双酰腙的计划的电子等排体
[0057]
图7:属于表5第二列的图。
[0058]
图8:属于表5第三列的图。
具体实施方式
[0059]
定义
[0060]
在下文详细描述本发明之前,应理解本发明不限于本文所述的特定方法、方案和试剂,因为这些可以变化。还应理解,本文所用的术语仅出于描述特定实施方案的目的,并且无意限制本发明的范围,本发明的范围将仅由所附权利要求书限定。除非另外定义,否则本文所用的所有技术和科学术语均具有与由本发明所属领域的普通技术人员通常所理解的相同的含义。
[0061]
优选地,如“a multilingual glossary of biotechnological terms:(iupac recommendations)”(leuenberger,h.g.w,nagel,b.andh.eds.(1995),helvetica chimica acta,ch-4010 basel,switzerland)中定义的本文使用的术语。在整个说明书和所附的权利要求书中,除非上下文另有要求,否则“包含”一词及其变体将被理解为暗示包含所陈述的整数或步骤或整数或步骤的组合,但不排除任意其他整数或步骤或整数或步骤的组合。
[0062]
本说明书全文引用了若干文件(例如:专利、专利申请、科学出版物、制造商的说明书、说明、genbank accession number序列提交等)。本文中的任意信息都不应解释为承认发明无权凭借在先发明而先于此类公开。本文引用的一些文件的特点是“通过引用并入”。在这种并入参考文献的定义或教导与本说明书中引用的定义或教导之间发生冲突的情况下,本说明书的文本优先。
[0063]
如本文所用,如果第一化合物(例如本发明的化合物)对第二化合物的解离常数kd为1mm或小于1mm、优选100μm或小于100μm、优选50μm或小于50μm、优选30μm或小于30μm、优选20μm或小于20μm、优选10μm或小于10μm、优选5μm或小于5μm、更优选1μm或小于1μm、更优选900nm或小于900nm、更优选800nm或小于800nm、更优选700nm或小于700nm、更优选600nm或小于600nm、更优选500nm或小于500nm、更优选400nm或小于400nm、更优选300nm或小于300nm、更优选200nm或小于200nm、甚至更优选100nm或小于100nm、甚至更优选90nm或小于90nm、甚至更优选80nm或小于80nm、甚至更优选70nm或小于70nm、甚至更优选60nm或小于60nm、甚至更优选50nm或小于50nm、甚至更优选40nm或小于40nm、甚至更优选30nm或小于30nm、甚至更优选20nm或小于20nm和甚至更优选10nm或小于10nm,则认为第一化合物(例如本发明的化合物)与第二化合物(例如,诸如leca的靶蛋白)“结合”。
[0064]
根据本发明的术语“结合”优选地涉及特异性结合。“特异性结合”意指化合物(例如蛋白质配体)与其特异性的靶标(例如靶标蛋白质或靶标表位)的结合比与另一靶标的结合更强。与第二靶标相比,如果化合物以低于第二靶标的解离常数的解离常数(kd)结合第一靶标,则化合物与第一靶标的结合更强。优选地,化合物特异性结合的靶标的解离常数(kd)是化合物未特异性结合的靶标的解离常数(kd)的不到10分之一、优选不到20分之一、更优选不到50分之一、甚至更优选不到100分之一、200分之一、500分之一或1000分之一。
[0065]
如本文所用,术语“k
d”(通常以“mol/l”测定,有时缩写为“m”)意指化合物(例如本发明的化合物)和靶分子之间特定相互作用的解离平衡常数。
[0066]
用于确定化合物的结合亲和力,即用于确定解离常数kd的方法是本领域普通技术人员已知的并且可以选自例如本领域已知的以下方法:基于表面等离子体共振(spr)的技术、生物层干涉法(bli)、酶联免疫吸附测定(elisa)、流式细胞术、等温滴定量热法(itc)、分析超速离心法、放射免疫测定法(ria或irma)和增强化学发光法(ecl)。通常,解离常数kd是在20℃、25℃、30℃或37℃下测定的。如果没有特别指出,本文所述的kd值是由spr和itc在25℃下测定的,特别是由spr在25℃下测定的。
[0067]
在以下段落中,提供了以下术语的定义:烷基、杂烷基、卤代烷基、环烷基、杂环烷基、脂环系统、芳基、芳烷基、杂芳基、杂芳烷基、烯基、环烯基、杂烯基、杂环烯基和炔基。这些术语在其在说明书其余部分中使用的每种情况下将分别具有定义的含义和优选含义。然而,在整个说明书中使用它们的一些情况中,指出了这些术语的优选含义。
[0068]
下面给出的定义以完全类似的方式适用于具有两个自由键而不是只有一个自由键的基团。因此,为术语烷基、杂烷基、卤代烷基、环烷基、杂环烷基、芳基、芳烷基、杂芳基、杂芳烷基、烯基、环烯基、杂烯基、杂环烯基和炔基提供的定义以完全类似的方式分别适用于术语烷二基、杂烷二基、卤代烷二基、环烷二基、杂环烷二基、芳二基、芳烷二基、杂芳二基、杂芳烷二基、烯二基、环烯二基、杂烯二基、杂环烯二基和炔二基。
[0069]
术语“烷基”是指饱和的直链或带支链的碳链。优选地,该链包含1个至10个碳原子,即1个、2个、3个、4个、5个、6个、7个、8个、9个或10个,例如甲基、乙基、丙基(正丙基或异丙基)、丁基(正丁基、异丁基、仲丁基、叔丁基)、戊基、己基、庚基、辛基、壬基、癸基。烷基任选地被取代。
[0070]
术语“杂烷基”是指饱和的直链或带支链的碳链。优选地,该链包含1个至9个碳原子,即1个、2个、3个、4个、5个、6个、7个、8个或9个,例如甲基、乙基、丙基、异丙基、丁基、异丁
基、仲丁基、叔丁基、戊基、己基、庚基、辛基、壬基,其用相同或不同的杂原子间断一次或多于一次,例如1次、2次、3次、4次、5次。优选地,杂原子选自o、s和n,例如-(ch2)
p-x-(ch2)qch3,其中p=0、1、2、3、4、5、6、7、8或9,q=0、1、2、3、4、5、6、7、8或9且x=s、o或nr',其中r'=h或烃(例如c1至c6烷基)。特别地,“杂烷基”是指-o-ch3、-oc2h5、-ch
2-o-ch3、-ch
2-o-c2h5、-ch
2-o-c3h7、-ch
2-o-c4h9、-ch
2-o-c5h
11
、-c2h
4-o-ch3、-c2h
4-o-c2h5、-c2h
4-o-c3h7、-c2h
4-o-c4h9等。杂烷基任选地被取代。
[0071]
术语“卤代烷基”是指饱和的直链或带支链的碳链,其中一个或多于一个氢原子被卤素原子取代,例如氟、氯、溴或碘。优选地,该链包含1个至10个碳原子,即1个、2个、3个、4个、5个、6个、7个、8个、9个或10个。特别地,“卤代烷基”是指-ch2f、-chf2、-cf3、-c2h4f、-c2h3f2、-c2h2f3、-c2hf4、-c2f5、-c3h6f、-c3h5f2、-c3h4f3、-c3h3f4、-c3h2f5、-c3hf6、-c3f7、-ch2cl、-chcl2、-ccl3、-c2h4cl、-c2h3cl2、-c2h2cl3、-c2hcl4、-c2cl5、-c3h6cl、-c3h5cl2、-c3h4cl3、-c3h3cl4、-c3h2cl5、-c3hcl6和-c3cl7。卤代烷基任选地被取代。
[0072]
除非另有说明,否则术语“环烷基”和“杂环烷基”本身或与其他术语组合分别表示环形式的“烷基”和“杂烷基”,其中优选3个、4个、5个、6个、7个、8个、9个或10个原子形成环,例如环丙基、环丁基、环戊基、环己基、环庚基、环辛基等。术语“环烷基”和“杂环烷基”还意在包括其双环、三环和多环形式。如果形成双环、三环或多环,优选各个环在两个相邻的碳原子处彼此连接,然而,或者两个环通过同一的碳原子连接,即它们形成螺环系统或者它们形成“桥”环系统,优选三环[3.3.1.1
3,7
]癸烷。术语“杂环烷基”优选是指具有五个成员的饱和环,其中至少一个成员是n、o或s原子并且任选地包含一个另外的o或一个另外的n;具有六个成员的饱和环,其中至少一个成员是n、o或s原子并且任选地包含一个另外的o或一个另外的n或两个另外的n原子;或具有九个或十个成员的饱和双环,其中至少一个成员是n、o或s原子并且任选地包含一个、两个或三个另外的n原子。“环烷基”和“杂环烷基”基团任选地被取代。此外,对于杂环烷基,杂原子可以占据杂环与分子其余部分连接的位置。环烷基的实例包括环丙基、环丁基、环戊基、环己基、环庚基、螺[3,3]庚基、螺[3,4]辛基、螺[4,3]辛基、螺[3,5]壬基、螺[5,3]壬基、螺[3,6]癸基、螺[6,3]癸基、螺[4,5]癸基、螺[5,4]癸基、双环[2.2.1]庚基、双环[2.2.2]辛基、金刚烷基等。杂环烷基的实例包括1-(1,2,5,6-四氢吡啶基)、1-哌啶基、2-哌啶基、3-哌啶基、4-吗啉基、3-吗啉基、1,8-重氮-螺[4,5]癸基、1,7-重氮-螺[4,5]癸基、1,6-重氮-螺[4,5]癸基、2,8-重氮-螺[4,5]癸基、2,7-重氮-螺[4,5]癸基、2,6-重氮-螺[4,5]癸基、1,8-重氮-螺[5,4]癸基、1,7-重氮-螺[5,4]癸基、2,8-重氮螺[5,4]癸基、2,7-重氮-螺[5,4]癸基、3,8-重氮-螺[5,4]癸基、3,7-重氮-螺[5,4]癸基、1,4-二氮杂双环[2.2.2]辛-2-基、四氢呋喃-2-基、四氢呋喃-3-基、四氢噻吩-2-基、四氢噻吩-3-基、1-哌嗪基、2-哌嗪基等。
[0073]
术语“脂环系统”是指包含至少一个双键和/或三键的环烷基或杂环烷基的单环、双环、三环或多环形式。然而,脂环系统不是芳族或杂芳族的,即不具有共轭双键/自由电子对系统。因此,脂环系统中允许的双键和/或三键的最大数量由环原子的数量决定,例如在具有最多5个环原子的环系统中,脂环系统包含最多一个双键,在具有6个环原子的环系统中,脂环系统包含最多两个双键。因此,如下定义的“环烯基”是脂环系统的优选实施方案。脂环系统任选地被取代。
[0074]
术语“芳基”优选是指含有6个碳原子的芳族单环、含有10个碳原子的芳族双环体
系或含有14个碳原子的芳族三环系统。实例是苯基、萘基或蒽基。芳基任选地被取代。
[0075]
术语“芳烷基”是指被芳基取代的烷基部分,其中烷基和芳基具有上述含义。一个实例是苄基。优选地,在这种情况下,烷基链包含1个至8个碳原子,即1个、2个、3个、4个、5个、6个、7个或8个,例如甲基、乙基、丙基、异丙基、丁基、异丁基、仲丁基、叔丁基、戊基、己基、庚基、辛基。芳烷基在该基团的烷基和/或芳基部分任选地被取代。优选地,与烷基连接的芳基具有苯基、萘基或蒽基的含义。
[0076]
术语“杂芳基”优选是指五元或六元芳族单环,其中至少一个碳原子被1个、2个、3个或4个(对于五元环)或1个、2个、3个、4个或5个(对于六元环)相同或不同的杂原子取代,杂原子优选选自o、n和s;具有8个至12个成员的芳族双环体系,其中8个、9个、10个、11个或12个碳原子中的1个、2个、3个、4个、5个或6个碳原子已被相同或不同的杂原子取代,杂原子优选选自o、n和s;或具有13个至16个成员的芳族三环系统,其中13个、14个、15个或16个碳原子中的1个、2个、3个、4个、5个或6个碳原子已被相同或不同的杂原子取代,杂原子优选选自o、n和s。实例是呋喃基、噻吩基、唑基、异唑基、1,2,5-二唑基、1,2,3-二唑基、吡咯基、咪唑基、吡唑基、1,2,3-三唑基、噻唑基、异噻唑基、1,2,3-噻二唑基、1,2,5-噻二唑基、吡啶基、嘧啶基、吡嗪基、1,2,3-三嗪基、1,2,4-三嗪基、1,3,5-三嗪基、1-苯并呋喃基、2-苯并呋喃基、吲哚基、异吲哚基、苯并噻吩基、2-苯并噻吩基、1h-吲唑基、苯并咪唑基、苯并唑基、吲哚嗪基、2,1-苯并唑基、苯并噻唑基、1,2-苯并异噻唑基、2,1-苯并异噻唑基、苯并三唑基、喹啉基、异喹啉基、2,3-苯并二嗪基、喹喔啉基、喹唑啉基、喹啉基、1,2,3-苯并三嗪基或1,2,4-苯并三嗪基。
[0077]
术语“杂芳烷基”是指被杂芳基取代的烷基部分,其中烷基和杂芳基具有上述含义。实例是2-烷基吡啶基、3-烷基吡啶基或2-甲基吡啶基。优选地,在这种情况下,烷基链包含1个至8个碳原子,即1个、2个、3个、4个、5个、6个、7个或8个,例如甲基、乙基、丙基、异丙基、丁基、异丁基、仲丁基、叔丁基、戊基、己基、庚基、辛基。杂芳烷基在该基团的烷基和/或杂芳基部分任选地被取代。优选地,与烷基连接的杂芳基具有唑基、异唑基、1,2,5-二唑基、1,2,3-二唑基、吡咯基、咪唑基、吡唑基、1,2,3-三唑基、噻唑基、异噻唑基、1,2,3-噻二唑基、1,2,5-噻二唑基、吡啶基、嘧啶基、吡嗪基、1,2,3-三嗪基、1,2,4-三嗪基、1,3,5-三嗪基、1-苯并呋喃基、2-苯并呋喃基、吲哚基、异吲哚基、苯并噻吩基、2-苯并噻吩基、1h-吲唑基、苯并咪唑基、苯并唑基、吲哚嗪基、2,1-苯并唑基、苯并噻唑基、1,2-苯并异噻唑基、2,1-苯并异噻唑基、苯并三唑基、2,3-苯并二嗪基、喹啉基、异喹啉基、喹啉基、1,2,3-苯并三嗪基或1,2,4-苯并三嗪基的含义。
[0078]
术语“烯基”和“环烯基”是指具有一个或多于一个双键的包含烯属不饱和碳原子的链或环。实例是丙烯基和环己烯基。优选地,烯基链包含2个至8个碳原子,即2个、3个、4个、5个、6个、7个或8个,例如乙烯基、1-丙烯基、2-丙烯基、异丙烯基、1-丁烯基、2-丁烯基、3-丁烯基、异丁烯基、仲丁烯基、1-戊烯基、2-戊烯基、3-戊烯基、4-戊烯基、己烯基、庚烯基、辛烯基。优选地,环烯基环包含3个至8个碳原子,即3个、4个、5个、6个、7个或8个,例如1-环丙烯基、2-环丙烯基、1-环丁烯基、2-环丁烯基、1-环戊烯基、2-环戊烯基、3-环戊烯基、1-环己烯基、2-环己烯基、3-环己烯基、环庚烯基、环辛烯基。
[0079]
术语“杂烯基”和“杂环烯基”分别是指不饱和形式的“杂烷基”和“杂环烷基”。因此,术语“杂烯基”是指不饱和的直链或带支链的碳链。优选地,该链包含1个至9个碳原子,
即1个、2个、3个、4个、5个、6个、7个、8个或9个,其用相同或不同的杂原子间断一次或多于一次,例如1次、2次、3次、4次、5次。优选地,杂原子选自o、s和n。在一个或多于一个中断杂原子是n的情况下,n可以作为-nr'-部分存在,其中r'是氢或烃(例如c1到c6烷基),或者它可以作为=n-或-n=基团存在,即氮原子可以与相邻的c原子或相邻的另外的n原子形成双键。“杂烯基”基团任选地被取代。术语“杂环烯基”代表环形式的“杂烯基”,优选3个、4个、5个、6个、7个、8个、9个或10个原子形成环。术语“杂环烯基”还意在包括其双环、三环和多环形式。如果形成双环、三环或多环,优选各个环在两个相邻原子处彼此连接。这两个相邻的原子可以都是碳原子;或者一个原子可以是碳原子,另一个可以是杂原子;或者两个相邻的原子可以都是杂原子。然而,或者两个环通过同一碳原子连接,即它们形成螺环系统或者它们形成“桥”环系统。术语“杂环烯基”优选是指具有五个成员的不饱和环,其中至少一个成员是n、o或s原子并且任选地包含一个另外的o或一个另外的n;具有六个成员的不饱和环,其中至少一个成员是n、o或s原子并且任选地包含一个另外的o或一个另外的n或两个另外的n原子;或具有九个或十个成员的不饱和双环,其中至少一个成员是n、o或s原子并且任选地包含一个、两个或三个另外的n原子。“杂环烯基”基团任选地被取代。此外,对于杂烯基和杂环烯基,杂原子可以占据杂环与分子其余部分连接的位置。
[0080]
术语“芳烯基”是指被芳基取代的烯基部分,其中烯基和芳基具有上述含义。
[0081]
术语“杂芳烯基”是指被杂芳基取代的烯基部分,其中烯基和杂芳基具有上述含义。
[0082]
术语“炔基”是指具有一个或多于一个三键的包含不饱和碳原子的链或环。优选地,炔基链包含2个至8个碳原子,即2个、3个、4个、5个、6个、7个或8个,例如乙炔基、1-丙炔基、2-丙炔基、1-丁炔基、2-丁炔基、3-丁炔基、1-戊炔基、2-戊炔基、3-戊炔基、4-戊炔基、己炔基、庚炔基、辛炔基。
[0083]
术语“杂炔基”、“环炔基”和“杂环炔基”是指基本上分别对应于如上定义的“杂烯基”、“环烯基”和“杂环烯基”但与“杂烯基”、“环烯基”、“杂环烯基”的不同之处在于至少一个双键被三键取代的部分。
[0084]
在一个实施方案中,烷基、环烷基、芳基、芳烷基、烯基、环烯基、炔基中的碳原子或氢原子可以彼此独立地被选自o、s、n的一种或多于一种元素或被包含选自o、s和n一种或多于一种元素即1种、2种、3种、4种、5种、6种或多于6种元素的基团取代。实施方案包括烷氧基、环烷氧基、芳氧基、芳烷氧基、烯氧基、环烯氧基、炔氧基、烷基硫代、环烷基硫代、芳基硫代、芳烷基硫代、烯基硫代、环烯基硫代、炔基硫代、烷基氨基、环烷基氨基、芳基氨基、芳烷基氨基、烯基氨基、环烯基氨基、炔基氨基。其他实施方案包括羟基烷基、羟基环烷基、羟基芳基、羟基芳烷基、羟基烯基、羟基环烯基、羟基炔基、巯基烷基、巯基环烷基、巯基芳基、巯基芳烷基、巯基烯基、巯基环烯基、巯基炔基、氨基烷基、氨基环烷基、氨基芳基、氨基芳烷基、氨基烯基、氨基环烯基、氨基炔基。
[0085]
在另一个实施方案中,烷基、杂烷基、环烷基、杂环烷基、脂环系统、芳基、芳烷基、杂芳基、杂芳烷基、烯基、环烯基、杂烯基、杂环烯基、炔基中的一个或多于一个氢原子,例如1个、2个、3个、4个、5个、6个、7个或8个氢原子可以彼此独立地被一个或多于一个卤素原子,例如cl、f或br取代。一个优选的基团是三氟甲基基团。
[0086]
如果可以彼此独立地选择两个或多于两个基团,那么术语“独立地”是指这些基团
可以相同或可以不同。
[0087]
如果没有进一步说明,在每种情况下,术语“任选地被取代”是指卤素(特别是f、cl、br或i)、-no2、-cn、-or”'、-nr'r”、-coor”'、-conr'r”、-nr'cor”、-nr”cor”'、-nr'conr'r”、-nr'so2e、-cor”';-so2nr'r”、-oocr”'、-cr”'r
””
oh、-r”'oh和-e;
[0088]
r'和r”各自独立地选自氢、烷基、烯基、炔基、环烷基、杂环烷基、芳基、芳烷基和杂芳基或一起形成杂芳基或杂环烷基;
[0089]
r”'和r
””
各自独立地选自氢、烷基、烯基、炔基、环烷基、杂环烷基、烷氧基、芳基、芳烷基、杂芳基和-nr'r”;
[0090]
e选自烷基、烯基、炔基、环烷基、烷氧基、烷氧基烷基、杂环烷基、脂环系统、芳基和杂芳基;任选地被取代。
[0091]
如本文所用,表述“其中(ch2)n基团任选地带有标记”是指(ch2)n基团的一个或多于一个氢原子任选地被包含“标记”的化学基团替代。取代氢原子的化学基团可包含将(ch2)n基团连接至“标记”的接头。
[0092]
如本文所用,“标记”是指可通过物理、化学或生物学手段检测的任意化学基团。特别适合实施本发明的“标记”是可通过光谱技术例如荧光光谱、正电子发射层析术(pet)或磁共振成像(mri)检测的化学基团。
[0093]“r.t.”是室温的缩写。
[0094]“ipr”是异丙基的缩写,即
–
ch(ch3)2。
[0095]“药学上可接受的”是指由联邦或州政府的监管机构批准或在美国药典(united states pharmacopeia-33/national formulary-28 reissue,由美国药典委员会股份有限公司出版,rockville md.,出版日期:2010年4月)或其他公认的药典中列出的用于动物,尤其是用于人类的。
[0096]
术语“药学上可接受的盐”是指本发明化合物的盐。本发明化合物的合适的药学上可接受的盐包括酸加成盐,其可以例如通过将本文所述的化合物或其衍生物的溶液与药学上可接受的酸例如盐酸、硫酸、富马酸、马来酸、琥珀酸、乙酸、苯甲酸、柠檬酸、酒石酸、碳酸或磷酸的溶液混合形成。此外,当本发明的化合物带有酸性部分时,其合适的药学上可接受的盐可以包括碱金属盐(例如钠盐或钾盐);碱土金属盐(例如钙盐或镁盐);和与合适的有机配体形成的盐(有机配体例如,使用抗衡阴离子如卤化物、氢氧化物、羧酸根、硫酸根、磷酸根、硝酸根、烷基磺酸根和芳基磺酸根形成的铵、季铵和胺阳离子)。药学上可接受的盐的说明性实例包括但不限于:乙酸盐、己二酸盐、藻酸盐、抗坏血酸盐、天冬氨酸盐、苯磺酸盐、苯甲酸盐、碳酸氢盐、硫酸氢盐、酒石酸氢盐、硼酸盐、溴化物、丁酸盐、依地酸钙、樟脑酸盐、樟脑磺酸盐、右旋樟脑磺酸盐、碳酸盐、氯化物、柠檬酸盐、克拉维酸盐、环戊烷丙酸盐、二葡萄糖酸盐、二盐酸盐、十二烷基硫酸盐、依地酸盐、乙二磺酸盐、依托酸盐、乙磺酸盐、乙磺酸盐、甲酸盐、富马酸盐、葡庚糖酸盐、葡庚糖酸盐、葡萄糖酸盐、谷氨酸盐、甘油磷酸盐、乙醇酰对氨基苯胂酸盐、半硫酸盐、庚酸盐、己酸盐、己基苯间二酚盐、海巴胺、氢溴酸盐、盐酸盐、氢碘酸盐、2-羟乙基磺酸盐、羟基萘甲酸盐、碘化物、异硫代羟酸盐、乳酸盐、乳糖醛酸盐、月桂酸盐、十二烷基硫酸盐、苹果酸盐、马来酸盐、丙二酸盐、扁桃酸盐、甲磺酸盐、甲磺酸盐、甲基硫酸盐、黏酸盐、2-萘磺酸盐、萘磺酸盐、烟酸盐、硝酸盐、n-甲基葡糖胺铵盐、油酸盐、草酸盐、双羟萘酸盐(恩波酸盐)、棕榈酸盐、泛酸盐、果胶酸盐、过硫酸盐、3-苯丙酸
盐、磷酸盐/二磷酸盐、苦味酸盐、新戊酸盐、聚半乳糖醛酸盐、丙酸盐、水杨酸盐、硬脂酸盐、硫酸盐、碱式乙酸盐、琥珀酸盐、单宁酸盐、酒石酸盐、茶氯酸盐、甲苯磺酸盐、三乙基碘、十一烷酸盐、戊酸盐等(参见,例如,berge,s.m.等人,"pharmaceutical salts",journal of pharmaceutical science,1977,66,1-19)。本发明的某些特定化合物既含有碱性官能团又含有酸性官能团,这使得化合物可以转化为碱加成盐或酸加成盐。
[0097]
化合物的中性形式可以通过使盐与碱或酸接触并以常规方式分离母体化合物来再生。化合物的母体形式在某些物理性质上不同于各种盐形式,例如在极性溶剂中的溶解度,但是对于本发明的目的,盐等同于化合物的母体形式。
[0098]
除了盐形式之外,本发明还提供了前药形式的化合物。本文所述化合物的前药是那些在生理条件下容易发生化学变化以提供式i、ii、vii或viii化合物的化合物。前药是活性或无活性化合物,其在将前药施用于患者后通过体内生理作用,例如水解、代谢等,被化学修饰成本发明的化合物。此外,前药可以在离体环境中通过化学或生化方法转化为本发明的化合物。例如,当将前药置于具有合适酶的贮库型透皮贴剂中时,前药可以缓慢地转化为本发明的化合物。制备和使用前药所涉及的适用性和技术是本领域技术人员熟知的。有关涉及酯的前药的一般性讨论,请参见svensson l.a.和tunek a.(1988)drug metabolism reviews 19(2):165-194和bundgaard h.“design of prodrugs”,elsevier science ltd.(1985)。掩蔽的羧酸根阴离子的实例包括多种酯,例如烷基(例如,甲基、乙基)、环烷基(例如,环己基)、芳烷基(例如,苄基、对甲氧基苄基)和烷基羰基氧基烷基(例如,新戊酰氧基甲基)。胺已被掩蔽为芳基羰基氧基甲基取代的衍生物,其在体内被酯酶切割,释放出游离药物和甲醛(bundgaard h.等人.(1989)j.med.chem.32(12):2503-2507)。此外,含有酸性nh基团如咪唑、酰亚胺、吲哚等的药物,已被n-酰氧基甲基基团掩蔽(bundgaard h.“design of prodrugs”,elsevier science ltd.(1985))。羟基被掩蔽为酯和醚。ep 0 039 051 a2公开了曼尼希碱异羟肟酸前、其制备及用途。
[0099]
本发明的某些化合物具有不对称碳原子(光学中心)或双键;外消旋体、非对映异构体、几何异构体、区域异构体和单独的异构体(例如,单独的对映异构体)都旨在涵盖在本发明的范围内。本发明的化合物还可以在构成此类化合物的一个或多于一个原子处包含非自然比例的原子同位素。例如,可以用放射性同位素例如氚(3h)、碘-125(
125
i)或碳-14
(14
c)对化合物进行放射性标记。本发明化合物的所有同位素变体,无论是否具有放射性,都旨在涵盖在本发明的范围内。
[0100]
如本文所用,“患者”是指可以受益于本文所述化合物的治疗的任意哺乳动物或鸟类。优选地,“患者”选自实验动物(例如小鼠或大鼠)、家畜(包括例如豚鼠、兔、鸡、火鸡、猪、绵羊、山羊、骆驼、牛、马、驴、猫或狗),或包括黑猩猩和人类的灵长类动物。特别优选“患者”是人。
[0101]
如本文所用,疾病或病症的“治疗”是指完成以下的一项或多于一项:(a)降低病症的严重程度;(b)限制或预防所治疗病症特征性症状的发展;(c)抑制所治疗病症特征性症状的恶化;(d)限制或预防先前患有病症的患者的病症复发;和(e)限制或预防先前有病症症状的患者的症状复发。
[0102]
如本文所用,疾病或病症的“预防”是指在一段时期内防止对象发生病症。例如,如果将本文所述的化合物施用于对象以预防疾病或病症,则所述疾病或病症至少在施用当天
并且优选在施用后的一天或多于一天(例如在施用后的1天至第30天;或2天至28天;或3天至21天;或4天至14天;或5天至10天)得以预防。
[0103]
根据本发明的“药物组合物”可以以组合物的形式存在,其中不同的活性成分和稀释剂和/或载体彼此混合,或者可以采用组合制剂的形式,其中活性成分以部分或完全不同的形式存在。这种组合或组合制剂的实例是具有部件的试剂盒。
[0104]“有效量”是足以达到预期目的的治疗剂的量。给定治疗剂的有效量将随着诸如药剂的性质、施用途径、接受治疗剂的动物的大小和种类以及施用的目的等因素而变化。每个单独情况下的有效量可以由熟练的技术人员根据本领域中确立的方法凭经验确定。
[0105]
如本文所用,术语“载体”是指与治疗剂一起施用的稀释剂、佐剂、赋形剂或载剂。这样的药物载体可以是无菌液体,例如水和油中的盐溶液,其中油包括石油、动物、植物或合成来源的那些,例如花生油、大豆油、矿物油、芝麻油等。当药物组合物经静脉内施用时,盐溶液是优选的载体。盐溶液和右旋糖水溶液和甘油溶液也可以用作液体载体,特别是用于可注射溶液。合适的药物赋形剂包括淀粉、葡萄糖、乳糖、蔗糖、明胶、麦芽、米粉、白垩、硅胶、硬脂酸钠、单硬脂酸甘油酯、滑石粉、氯化钠、脱脂奶粉、甘油、丙二醇、水、乙醇等。如果需要,组合物还可以含有少量的润湿剂或乳化剂,或ph缓冲剂。这些组合物可以采取溶液、混悬剂、乳剂、片剂、丸剂、胶囊剂、散剂、缓释制剂等形式。组合物可以用常规的黏合剂和载体例如甘油三酯配制成栓剂。如上所述,本发明的化合物可以配制成中性形式或盐形式。合适的药物载体的实例在e.w.martin的“remington's pharmaceutical sciences”中描述。这样的组合物将含有治疗有效量的化合物,优选纯化形式的化合物,以及合适量的载体,以便为患者提供合适施用的形式。制剂应适合施用方式。
[0106]
发明的实施方案
[0107]
现在将进一步描述本发明。在以下段落中更详细地定义了本发明的不同方面。除非明确反向指出,否则下文定义的每个方面可以与任意其他一个或多于一个方面组合。特别地,被指示为优选或有利的任意特征可以与被指示为优选或有利的任意其他一个或多于一个特征组合。
[0108]
在第一方面,本发明涉及具有通式结构(i):
[0109]r2-a
1-r
4-b
1-r
1-b
2-r4’-a
2-r2’
ꢀꢀꢀ(i)[0110]
或具有通式结构(ii)的化合物
[0111]r2-a
1-r
4-b
1-r5ꢀꢀ
(ii)
[0112]
其中
[0113]
r2和r
2'
彼此独立地选自半乳糖、galnac、2-脱氧-半乳糖和半乳庚糖的环氧化物,其中形成r2和a1之间的连接的-o-基团和/或形成r
2'
和a2之间的连接的-o-基团可以彼此独立地被-s-基团、-nh-基团或-ch
2-基团替代;
[0114]
a1和a2彼此独立地选自
[0115]
(a)任选地被一个、两个或三个取代基取代的芳二基,所述取代基彼此独立地选自c1至c4烷基、卤素、c1至c4卤代烷基、-oh、c1至c4烷氧基、-nh2、r
13
为c1至c4烷基的-nhr
13
、r
13
和r
14
彼此独立地为c1至c4烷基的-nr
13r14
、-no2、-cn、-cooh、r
13
为c1至c4烷基的-coor
13
、-conh2、r
13
为c1至c4烷基的-conhr
13
、r
13
和r
14
彼此独立地为c1至c4烷基的-conr
13r14
和-so3h,和
[0116]
(b)任选地被一个、两个或三个取代基取代的杂芳二基,所述取代基彼此独立地选自c1至c4烷基、卤素、c1至c4卤代烷基、-oh、c1至c4烷氧基、-nh2、r
13
为c1至c4烷基的-nhr
13
、r
13
和r
14
彼此独立地为c1至c4烷基的-nr
13r14
、-no2、-cn、-cooh、r
13
为c1至c4烷基的-coor
13
、-conh2、r
13
为c1至c4烷基的-conhr
13
、r
13
和r
14
彼此独立地为c1至c4烷基的-conr
13r14
和-so3h;
[0117]
r4选自
–
co-nh-n=ch
–
、
–
ch2–
ch
2-co-nh
–
、e-或z
‑–
co
–
nh-ch=ch
–
、e-或z
‑–
ch=ch-co-nh
–
、
–
co-nh-ch
2-ch2–
、
–
nh
–
co
–
ch2–
ch2–
、e-或z
‑–
ch=ch
–
nh
–
co
–
、e-或z
‑–
nh
–
co
–
ch=ch
–
和
–
ch2–
ch2–
nh
–
co
–
;
[0118]r4'
选自
–
ch=n
–
nh
–
co
–
、
–
nh
–
co
–
ch2–
ch2–
、e-或z
‑–
ch=ch
–
nh
–
co
–
、e-或z
‑–
nh
–
co
–
ch=ch
–
、
–
ch2–
ch2–
nh
–
co
–
、
–
ch2–
ch
2-co
–
nh
–
、e-或z
‑–
co-nh-ch=ch
–
、e-或z
‑–
ch=ch-co-nh
–
和
–
co
–
nh
–
ch2–
ch2–
;
[0119]
b1和b2彼此独立地选自
[0120]
(a)任选地被一个、两个或三个取代基取代的芳二基,所述取代基彼此独立地选自c1至c4烷基、卤素、c1至c4卤代烷基、-oh、c1至c4烷氧基、-nh2、r
13
为c1至c4烷基的-nhr
13
、r
13
和r
14
彼此独立地为c1至c4烷基的-nr
13r14
、-no2、-cn、-cooh、r
13
为c1至c4烷基的-coor
13
、-conh2、r
13
为c1至c4烷基的-conhr
13
、r
13
和r
14
彼此独立地为c1至c4烷基的-conr
13r14
和-so3h,
[0121]
(b)任选地被一个、两个或三个取代基取代的杂芳二基,所述取代基彼此独立地选自c1至c4烷基、卤素、c1至c4卤代烷基、-oh、c1至c4烷氧基、-nh2、r
13
为c1至c4烷基的-nhr
13
、r
13
和r
14
彼此独立地为c1至c4烷基的-nr
13r14
、-no2、-cn、-cooh、r
13
为c1至c4烷基的-coor
13
、-conh2、r
13
为c1至c4烷基的-conhr
13
、r
13
和r
14
彼此独立地为c1至c4烷基的-conr
13r14
和-so3h;和
[0122]
(c)任选地被一个或多于一个取代基取代的c3至c7环烷二基,所述取代基选自卤素、-cn、-nh2、-nr
11r12
、-nh-co-r
11
、-nh-so
2-r
11
、-or
11
、-sr
11
、-so2r
11
、-coor
11
、-no2、-三唑-r
11
、-conh2、r
13
为c1至c4烷基的-conhr
13
、r
13
和r
14
彼此独立地为c1至c4烷基的-conr
13r14
和
–
ch
2-r
11
;
[0123]
其中r
12
是c1至c4烷基;和
[0124]
其中r
11
选自
[0125]-氢、
[0126]-c1至c4烷基、
[0127]-任选地被一个、两个或三个取代基取代的芳基,所述取代基彼此独立地选自c1至c4烷基、卤素、c1至c4卤代烷基、-oh、c1至c4烷氧基、-nh2、r
13
为c1至c4烷基的-nhr
13
、r
13
和r
14
彼此独立地为c1至c4烷基的-nr
13r14
、-no2、-cn、-cooh、r
13
为c1至c4烷基的-coor
13
和-so3h,和
[0128]-任选地被一个、两个或三个取代基取代的杂芳基,所述取代基彼此独立地选自c1至c4烷基、卤素、c1至c4卤代烷基、-oh、c1至c4烷氧基、-nh2、r
13
为c1至c4烷基的-nhr
13
、r
13
和r
14
彼此独立地为c1至c4烷基的-nr
13r14
、-no2、-cn、-cooh、r
13
为c1至c4烷基的-coor
13
和-so3h、
[0129]
(d)任选地被一个或多于一个取代基取代的c1至c6烷二基,所述取代基选自卤素、-cn、-nh2、-nr
11r12
、-nh-co-r
11
、-nh-so
2-r
11
、-or
11
、-sr
11
、-so2r
11
、-coor
11
、-no2、-三唑-r
11
、-conh2、r
13
为c1至c4烷基的-conhr
13
、r
13
和r
14
彼此独立地为c1至c4烷基的-conr
13r14
和
–
ch
2-r
11
;
[0130]
其中r
12
是c1至c4烷基;和
[0131]
其中r
11
选自
[0132]-氢、
[0133]-c1至c4烷基、
[0134]-任选地被一个、两个或三个取代基取代的芳基,所述取代基彼此独立地选自c1至c4烷基、卤素、c1至c4卤代烷基、-oh、c1至c4烷氧基、-nh2、r
13
为c1至c4烷基的-nhr
13
、r
13
和r
14
彼此独立地为c1至c4烷基的-nr
13r14
、-no2、-cn、-cooh、r
13
为c1至c4烷基的-coor
13
和-so3h,和
[0135]-任选地被一个、两个或三个取代基取代的杂芳基,所述取代基彼此独立地选自c1至c4烷基、卤素、c1至c4卤代烷基、-oh、c1至c4烷氧基、-nh2、r
13
为c1至c4烷基的-nhr
13
、r
13
和r
14
彼此独立地为c1至c4烷基的-nr
13r14
、-no2、-cn、-cooh、r
13
为c1至c4烷基的-coor
13
和-so3h;
[0136]
r1选自-o-、-s-、-nh-、-co-nh-、-nh-co-、-c(o)-、-x1(ch2)nx
2-,其中n是1、2、3、4或5;并且x1和x2彼此独立地选自-o-、-s-、-nh-、-co-nh-、-nh-co-和-c(o)-;
[0137]
其中(ch2)n基团任选地带有通过烷基、杂烷基、芳基-烷基、杂芳基-烷基、芳基-杂烷基或杂芳基-杂烷基连接至(ch2)n基团的标记,其中这些基团中的任一个可以任选地被取代;和
[0138]
r5是-o-c
1-6
烷基;
[0139]
或其盐或其溶剂合物或其前药。
[0140]
在第一方面的实施方案中,r2和r
2'
彼此独立地选自式(iii)至(vi):
[0141][0142]
其中z选自o、s、nh和ch2。
[0143]
在第一方面的实施方案中,a1和a2彼此独立地选自
[0144]
(i)亚苯基;
[0145]
(ii)萘二基;
[0146]
(iii)五元芳族单环,其中1个、2个、3个或4个环原子为相同或不同的杂原子,所述杂原子选自o、n或s;
[0147]
(iv)六元芳族单环,其中1个、2个、3个、4个或5个环原子为相同或不同的杂原子,
所述杂原子选自o、n或s;和
[0148]
(v)具有8个至12个成员的芳族双环体系,其中1个、2个、3个、4个、5个或6个环原子是相同或不同的杂原子,所述杂原子选自o、n或s;
[0149]
其中上述基团(i)至(v)中的每一个任选地被一个、两个或三个取代基取代,所述取代基彼此独立地选自c1至c4烷基、卤素、c1至c4卤代烷基、-oh、c1至c4烷氧基、-nh2、r
13
为c1至c4烷基的-nhr
13
、r
13
和r
14
彼此独立地为c1至c4烷基的-nr
13r14
、-no2、-cn、-cooh、r
13
为c1至c4烷基的-coor
13
、-conh2、r
13
为c1至c4烷基的-conhr
13
、r
13
和r
14
彼此独立地为c1至c4烷基的-conr
13r14
和-so3h。
[0150]
在第一方面的实施方案中,r4和r
4'
形成对称组合,即形成基团r
4'
的原子以形成基团r4的原子的相反顺序排列。更具体地,优选r4和r
4'
形成以下组合之一:
[0151]
(a)r4是-co-nh-n=ch-并且r
4'
是-ch=n-nh-co-;
[0152]
(b)r4是
–
ch2–
ch2–
co
–
nh
–
并且r
4'
是
–
nh
–
co
–
ch2–
ch2–
;
[0153]
(c)r4是e
‑–
co
–
nh
–
ch=ch
–
并且r
4'
是e
‑–
ch=ch
–
nh
–
co
–
;
[0154]
(d)r4是z
‑–
co
–
nh
–
ch=ch
–
并且r
4'
是z
‑–
ch=ch
–
nh
–
co
–
;
[0155]
(e)r4为e
‑–
ch=ch
–
co
–
nh
–
并且r
4'
为e
‑–
nh
–
co
–
ch=ch
–
;
[0156]
(f)r4为z
‑–
ch=ch
–
co
–
nh
–
并且r
4'
为z
‑–
nh
–
co
–
ch=ch
–
;
[0157]
(g)r4是
–
co
–
nh
–
ch2–
ch2–
并且r
4'
是
–
ch2–
ch2–
nh
–
co:
[0158]
(h)r4是
–
nh
–
co
–
ch2–
ch2–
;并且r
4'
是
–
ch2–
ch
2-co
–
nh
–
;
[0159]
(i)r4是e
‑–
ch=ch
–
nh
–
co
–
;并且r
4'
是e
‑–
co-nh-ch=ch
–
;
[0160]
(j)r4是z
‑–
ch=ch
–
nh
–
co
–
;并且r
4'
是z
‑–
co-nh-ch=ch
–
;
[0161]
(k)r4是e
‑–
nh
–
co
–
ch=ch
–
;并且r
4'
是e
‑–
ch=ch-co-nh
–
;
[0162]
(l)r4是z
‑–
nh
–
co
–
ch=ch
–
;并且r
4'
是z
‑–
ch=ch-co-nh
–
;或者
[0163]
(m)r4是
–
ch2–
ch2–
nh
–
co
–
;并且r
4'
是
–
co
–
nh
–
ch2–
ch2–
。
[0164]
在第一方面的实施方案中,b1和b2彼此独立地选自
[0165]
(i)亚苯基;
[0166]
(ii)萘二基;
[0167]
(iii)五元芳族单环,其中1个、2个、3个或4个环原子为相同或不同的杂原子,所述杂原子选自o、n或s;
[0168]
(iv)六元芳族单环,其中1个、2个、3个、4个或5个环原子为相同或不同的杂原子,所述杂原子选自o、n或s;和
[0169]
(v)具有8个至12个成员的芳族双环体系,其中1个、2个、3个、4个、5个或6个环原子是相同或不同的杂原子,所述杂原子选自o、n或s;
[0170]
(vi)c3至c7环烷二基;和
[0171]
(vii)c1至c6烷二基;
[0172]
其中以上所列基团(i)至(v)中的每一个任选地被一个、两个或三个取代基取代,所述取代基彼此独立地选自c1至c4烷基、卤素、c1至c4卤代烷基、-oh、c1至c4烷氧基、-nh2、r
13
为c1至c4烷基的-nhr
13
、r
13
和r
14
彼此独立地为c1至c4烷基的-nr
13r14
、-no2、-cn、-cooh、r
13
为c1至c4烷基的-coor
13
、-conh2、r
13
为c1至c4烷基的-conhr
13
、r
13
和r
14
彼此独立地为c1至c4烷基的-conr
13r14
和-so3h;和
[0173]
其中以上所列基团(vi)至(vii)中的每一个任选地被一个或多于一个取代基取代,所述取代基选自卤素、-cn、-nh2、-nr
11r12
、-nh-co-r
11
、-nh-so
2-r
11
、-or
11
、-sr
11
、-so2r
11
、-coor
11
、-no2、-三唑-r
11
、-conh2、r
13
为c1至c4烷基的-conhr
13
、r
13
和r
14
彼此独立地为c1至c4烷基的-conr
13r14
和
–
ch
2-r
11
;其中r
12
是c1至c4烷基;并且r
11
选自氢和c1至c4烷基。
[0174]
在第一方面的实施方案中,化合物具有以下结构(vii)
[0175][0176]
或以下结构(viii)
[0177][0178]
其中
[0179]
r2在间位或对位;和
[0180]r2'
在间位或对位。
[0181]
在第一方面的实施方案中,化合物对leca表现出kd值为500nm或小于500nm,优选400nm或小于400nm,更优选300nm或小于300nm,更优选200nm或小于200nm,更优选100nm或小于100nm,甚至更优选90nm或小于90nm,甚至更优选80nm或小于80nm,甚至更优选70nm或小于70nm,甚至更优选60nm或小于60nm,甚至更优选50nm或小于50nm,甚至更优选40nm或小于40nm,甚至更优选30nm或小于30nm,甚至更优选20nm或小于20nm,最优选10nm或小于10nm的结合亲和力。
[0182]
在第一方面的实施方案中,(ch2)n基团(即
–
x1(ch2)nx2–
基团内的(ch2)n基团是r1的一个可能的定义)带有标记,并且(ch2)n基团具有以下结构:
[0183][0184]
其中
[0185]
m是0、1、2或3,
[0186]
o是0、1、2或3,
[0187]
m o之和≤4,并且
[0188]“接头”是烷基、杂烷基、芳基-烷基、杂芳基-烷基、芳基-杂烷基或杂芳基-杂烷基,其中这些基团中的任一个可以任选地被取代。
[0189]
在第一方面的另一个实施方案中,(ch2)n基团带有所述标记,并且所述标记是可通过荧光光谱、通过正电子发射层析术(pet)或通过磁共振成像(mri)检测的化学基团。
[0190]
在第一方面的另一个实施方案中,可通过荧光光谱检测的标记是荧光素。
[0191]
可通过pet检测的合适标记包括带有
18
f取代基的基团。
[0192]
可通过mri检测的合适标记包括带有gd-iii的螯合剂或氧化铁纳米颗粒。
[0193]
在第二方面,本发明涉及一种药物组合物,其包含根据第一方面的化合物,并且任选地包含选自药学上可接受的载体、稀释剂、赋形剂和抗菌治疗剂的一种或多于一种组分。
[0194]
在第三方面,本发明涉及根据第一方面的化合物,其用于药物。
[0195]
在第四方面,本发明涉及根据第一方面的化合物,其任选地与一种或多于一种抗菌治疗剂组合,
[0196]-用于预防或治疗患者的铜绿假单胞菌感染,或
[0197]-用于预防或治疗患有囊性纤维化的患者的铜绿假单胞菌相关呼吸道感染。
[0198]
在第四方面的一些实施方案中,一种或多于一种抗菌治疗剂选自β-内酰胺类抗生素(包括青霉素类、头孢菌素类、碳青霉烯类和单环菌素类)、氟喹诺酮类、四环素类、大环内酯类抗生素、氨基苷类、肽抗生素、林可酰胺类抗生素和链阳性菌素类。
[0199]
在第五方面,本发明涉及根据第一方面的化合物,其用于体内感染成像。
[0200]
在第六方面,本发明涉及根据第一方面的化合物在体外生物膜成像和体外筛选测定中的用途,优选用于对由铜绿假单胞菌产生的生物膜进行成像。
[0201]
实施例
[0202]
提出以下实施例是为了向本领域普通技术人员提供关于如何制备和使用本发明的化合物、组合物和方法的完整公开和描述,并不旨在限制发明人认为是他们的发明的范围。已努力确保所用数字的准确性,但应考虑一些实验误差和偏差。除非另有说明,否则分子量是平均分子量,温度是摄氏度,压力是大气压或接近大气压。
[0203]
材料和方法
[0204]
化学合成
[0205]
一般实验细节。在bruker avance iii 500 ultrashield谱仪于500mhz和126mhz下记录1h-nmr和
13
c-nmr谱。化学位移(δ)以ppm为单位,并根据残留溶剂峰进行校准:氯仿-d1(1h-nmrδ=7.26ppm,
13
c-nmrδ=77.0ppm),甲醇-d4(1h-nmrδ=3.31ppm,
13
c-nmrδ=49.0ppm),二甲基亚砜-d6(1h-nmrδ=2.50ppm,
13
c-nmrδ=39.51ppm)。
[1]
氘代溶剂购自sigma-aldrich。多重态指定为s=单重态,d=双重态,t=三重态,q=四重态,m=多重态。谱是在1h,1h-cosy;1h,
13
c-hsqc和1h,
13
c-hmbc实验的帮助下指定的。
[0206]
使用merck(merck kgaa,达姆施塔特,德国)生产的含有荧光指示剂的硅胶60铝板进行薄层色谱法(tlc),并在紫外光(254nm)和加热的钼酸盐溶液((nh4)4ce(so4)4·
2h2o和(nh4)6mo7o
24
·
4h2o在10%h2so4水溶液中的0.02m溶液)或高锰酸钾溶液(在5ml 5%naoh和300ml水中加入3g kmno4、20g k2co3)下显色。
[0207]
在teledyne isco combiflash rf200系统上使用自填充硅胶柱(400目粒径,fluka)或macherey-nagel的预填充硅胶柱(c
18
ec,封端)进行中压液相色谱(mplc)。
[0208]
在与bruker amazon sl质谱仪连接的thermo dionex ultimate 3000hplc上进行分析型hplc-ms,使用rp-18柱(100/2nucleoshell rp18plus,2.7μm,来自德国machery nagel)作为固定相在254nm处进行紫外检测。
[0209]
在ultimate 3000uplc系统上进行高分辨率质谱(hrms),该系统与带有hesi源(thermo fisher,德赖艾希,德国)的q exactive focus orbitrap系统连接。uplc使用c18色谱柱(ec 150/2 nucleodur c18 pyramid,3μm,来自德国macherey-nagel)进行操作。
(2.5ml,20.3mmol)。使混合物升温至室温并搅拌过夜。将反应混合物倒入冰冷的饱和nahco3上并用二氯甲烷稀释。有机相用饱和nahco3和盐水洗涤,用无水na2so4干燥,过滤并真空浓缩。通过从乙醇(2.45g,5.08mmol,47%)中结晶来纯化3p。
[4]
[0224]1h nmr(500mhz,cdcl3)δ8.06-7.95(m,2h,arh),7.08-6.96(m,2h,arh),5.51(dd,j=10.4,7.9hz,1h,h-2),5.47(d,j=3.4hz,1h,h-4),5.17-5.07(m,2h,h-1,h-3),4.25-4.14(m,2h,h-6),4.10(t,j=6.5hz,1h,h-5),3.90(s,3h,ch3),2.19(s,3h,ch3),2.07(d,j=2.9hz,6h,ch3),2.02(s,3h,ch3),1.59(s,3h,ch3)。
[0225]
13
c nmr(126mhz,cdcl3)δ170.50(ch3c=o),170.34(ch3c=o),170.24(ch3c=o),169.49(ch3c=o),166.60(c=o),160.36(arc),131.72(2c,arch),125.19(arc),116.29(2c,arch),98.92(c-1),71.40(c-5),70.87(c-3),68.60(c-2),66.94(c-4),61.54(c-6),52.21(och3),20.86(ch3),20.81(ch3),20.79(ch3),20.72(ch3)。
[0226]
hplc-ms:[c
22h26o12
na]
计算值505.13,实际值505.12。
[0227]
间甲氧羰基苯基β-d-吡喃半乳糖苷(4m)
[0228]
将化合物3m(2.32g,4.81mmol)悬浮在无水甲醇(40ml)中并加入1m甲醇钠(0.5ml,0.50mmol)。将反应混合物在室温搅拌过夜。用amberlite ir 120/h
将反应混合物中和至ph 7,然后过滤。真空除去溶剂,得到白色粉末状的4m(1.49g,4.75mmol,定量)。
[0229]1h nmr(500mhz,dmso-d6)δ7.61-7.57(m,2h,arh),7.45(t,j=7.9hz,1h,arh),7.32(ddd,j=8.3,2.5,0.9hz,1h,arh),5.21(d,j=5.1hz,1h,oh-2),4.89(d,j=5.7hz,1h,oh-3),4.86(d,j=7.7hz,1h,h-1),4.66(t,j=5.5hz,1h,oh-6),4.53(d,j=4.6hz,1h,oh-4),3.85(s,3h,och3),3.72-3.68(m,1h,h-4),3.62-3.52(m,3h,h-2,h-5,h-6a),3.51-3.46(m,1h,h-6b),3.45-3.40(m,1h,h-3)。
[0230]
13
c nmr(126mhz,dmso-d6)δ165.96(c=o),157.65(arc),130.91(arc),129.95(arch),122.58(arch),121.32(arch),116.96(arch),101.36(c-1),75.59(c-5),73.13(c-3),70.29(c-2),68.07(c-4),60.29(c-6),52.28(och3)。
[0231]
hplc-ms:c
14h17o8-[m-h]-计算值313.09,实际值313.16。
[0232]
对甲氧羰基苯基β-d-吡喃半乳糖苷(4p)
[0233]
将化合物3p(2.39g,4.95mmol)悬浮在无水甲醇(40ml)中并加入1m甲醇钠(0.5ml,0.5mmol)。将反应混合物在室温搅拌过夜。用amberlite ir 120/h
将反应混合物中和至ph 7,然后过滤。真空除去溶剂,得到白色粉末状的4p(1.55g,4.93mmol,定量)。
[0234]1h nmr(500mhz,dmso-d6)δ7.90(d,j=8.5hz,2h,arh),7.12(d,j=8.5hz,2h,arh),5.22(d,j=5.1hz,1h,oh-2),4.95(d,j=7.6hz,1h,h-1),4.90(d,j=5.6hz,1h,oh-3),4.66(t,j=5.5hz,1h,oh-6),4.54(d,j=4.6hz,1h,oh-4),3.82(s,3h,och3),3.71(t,j=4.0hz,1h,h-4),3.65-3.45(m,4h,h-2,h-5,h-6),3.42(dt,j=9.1,4.2hz,1h,h-3)。
[0235]
13
c nmr(126mhz,dmso-d6)δ165.85(c=o),161.25(arc),131.08(2c,arch),122.86(arc),116.03(2c,arch),100.41(c-1),75.62(c-5),73.21(c-3),70.17(c-2),68.07(c-4),60.28(c-6),51.91(och3)。
[0236]
hplc-ms:c
14h17o8-[m-h]-计算值313.09,实际值313.10。
[0237]
间肼羰基苯基β-d-吡喃半乳糖苷(5m)
[0238]
向化合物4m(1.46g,4.66mmol)在甲醇(40ml)中的悬浮液中加入nh2nh2·
h2o
(1.60ml,32.98mmol)。将反应混合物在回流下在70℃搅拌72小时。真空除去溶剂,得到灰色固体状的粗产物5m(1.63g,约70%纯度,约80%产率)。
[0239]
hplc-ms:[c
13h18
n2o7 h]
计算值315.12,实际值315.12。
[0240]
对肼羰基苯基β-d-吡喃半乳糖苷(5p)
[0241]
向化合物4p(1.70g,5.41mmol)在甲醇(60ml)中的悬浮液中加入nh2nh2·
h2o(2.52ml,51.95mmol)。将反应混合物在回流下搅拌72小时。真空除去溶剂,产物用冷甲醇洗涤。得到白色固体状的纯5p(1.60g,5.09mmol,94%)。
[0242]1h nmr(500mhz,dmso-d6)δ9.63(s,1h,nh),7.77(d,j=8.4hz,2h,arh),7.05(d,j=8.4hz,2h,arh),5.19(d,j=5.2hz,1h,oh-2),4.93-4.86(m,2h,h-1,oh-3),4.66(t,j=5.5hz,1h,oh-6),4.52(d,j=4.6hz,1h,oh-4),4.42(s,2h,oh-5),3.70(t,j=4.0hz,1h,h-4),3.63-3.44(m,4h,h-2,h-5,h-6),3.44-3.38(m,1h,h-3)。
[0243]
13
c nmr(126mhz,dmso-d6)δ166.01(c=o),160.06(arc),129.02(arch),127.01(arc),116.09(arch),101.00(c-1),76.03(c-5),73.72(c-3),70.66(c-2),68.59(c-4),60.83(c-6)。
[0244]
hplc-ms:[c
13h18
n2o7 h]
计算值315.12,实际值315.00。
[0245]
合成双苯甲醛b至e的一般程序
[0246]
将相应的二卤代烃(1当量)、4-羟基苯甲醛(4当量)和碳酸钾(3当量)溶解在无水二甲基甲酰胺(1.5ml)中。将反应瓶密封并在最大功率300w的微波中在预先选择的70℃下辐照3至10小时。冷却后,反应混合物用二氯甲烷稀释,用饱和nahco3和盐水洗涤,用无水na2so4干燥,过滤并真空浓缩。无需进一步纯化即可获得纯产物。
[5]
[0247]
双(4-甲酰基苯氧基)甲烷(b)
[0248]
按照双苯甲醛的一般程序由二氯甲烷(30μl,0.47mmol)、4-羟基苯甲醛(228mg,1.86mmol)和碳酸钾(138mg,1.42mmol)合成化合物b(99.6mg,0.39mmol,83%)。
[0249]1h nmr(500mhz,cdcl3)δ9.92(s,2h,cho),7.89-7.85(m,4h,arh),7.25-7.22(m,4h,arh),5.88(s,2h,ch2)。
[0250]
13
c nmr(126mhz,cdcl3)δ190.87(2c,cho),161.40(2c,arc),132.09(4c,arch),131.66(2c,arc),116.49(4c,arch),89.96(ch2)。
[0251]
hplc-ms:[c
15h12
o4 h]
计算值257.08,实际值257.09。
[0252]
1,2-双(4-甲酰基苯氧基)乙烷(c)
[0253]
按照双苯甲醛的一般程序由1,2-二氯乙烷(25μl,0.32mmol)、4-羟基苯甲醛(165.2mg,1.35mmol)和碳酸钾(133.4mg,0.97mmol)合成化合物c(34.1mg,0.13mmol,40%)。
[0254]1h nmr(500mhz,cdcl3)δ9.90(s,2h,cho),7.89-7.84(m,4h,arh),7.08-7.03(m,4h,arh),4.45(s,4h,ch2)。
[0255]
13
c nmr(126mhz,cdcl3)δ190.90(2c,cho),163.53(2c,arc),132.17(4c,arch),130.54(2c,arc),115.01(4c,arch),66.63(2c,ch2)。
[0256]
hplc-ms:[c
16h14
o4 h]
计算值271.10,实际值271.11。
[0257]
1,3-双(4-甲酰基苯氧基)丙烷(d)
[0258]
按照双苯甲醛的一般程序由1,3-二氯丙烷(40μl,0.42mmol)、4-羟基苯甲醛
(227.1mg,1.86mmol)和碳酸钾(192.6mg,1.39mmol)合成化合物d(102.0mg,0.36mmol,85%)。
[0259]1h nmr(500mhz,cdcl3)δ9.88(s,2h,cho),7.85-7.81(m,4h,arh),7.04-6.99(m,4h,arh),4.26(t,j=6.0hz,4h,ch2ch2ch2),2.34(m,2h,ch2ch2ch2)。
13
c nmr(126mhz,cdcl3)δ190.89(2c,cho),163.87(2c,arc),132.14(4c,arch),130.22(2c,arc),114.87(4c,arch),64.65(2c,ch2ch2ch2),29.10(ch2ch2ch2)。
[0260]
hplc-ms:[c
17h16
o4 h]
计算值285.11,实际值285.15。
[0261]
1,4-双(4-甲酰基苯氧基)丁烷(e)
[0262]
按照双苯甲醛的一般程序由1,4-二溴丁烷(50μl,0.42mmol)、4-羟基苯甲醛(211.5mg,1.73mmol)和碳酸钾(138.2mg,1.29mmol)合成化合物e(111.0mg,0.37mmol,89%)。
[0263]1h nmr(500mhz,cdcl3)δ9.88(s,2h,cho),7.87-7.80(m,4h,arh),7.03-6.96(m,4h,arh),4.17-4.10(m,4h,ch2ch2ch2ch2),2.06-2.00(m,4h,ch2ch2ch2ch2)。
[0264]
13
c nmr(126mhz,cdcl3)δ190.92(2c,cho),164.08(2c,arc),132.15(4c,arch),130.08(2c,arc),114.84(4c,arch),67.88(2c,ch2ch2ch2ch2),25.93(2c,ch2ch2ch2ch2)。
[0265]
hplc-ms:[c
18h18
o4 h]
计算值299.13,实际值299.17。
[0266]
合成双酰腙的一般程序
[0267]
将相应的双苯甲醛a至e(1当量)和酰肼5(3当量)溶解在1ml至10ml的二甲基亚砜中(除非另有说明),并加入100μl甲酸。4小时后,用nh4oh将反应淬灭至ph 8并真空干燥。通过c18柱层析(水/乙腈,15%至40%乙腈)纯化产物。
[0268]
二价配体a6m
[0269]
按照双酰腙的一般程序使用双苯甲醛a(13.9mg,0.06mmol)和酰肼5m(62.3mg)合成化合物a6m(11.5mg,0.01mmol,23%)。
[0270]1h nmr(500mhz,dmso-d6)δ11.81(s,2h,nh),8.45(s,2h,n=ch),7.79(d,j=8.4hz,4h,arh),7.54(m,4h,arh),7.45(t,j=8.1hz,2h,arh),7.26(d,j=7.5hz,2h,arh),7.16(d,j=8.4hz,4h,arh),5.22(d,j=5.0hz,2h,oh-2),4.92-4.91(m,4h,h-1,oh-3),4.69(t,j=5.3hz,2h,oh-6),4.55(d,j=4.4hz,2h,oh-4),3.72(t,j=3.9hz,2h,h-4),3.62-3.54(m,6h,h-2,h-5,h-6a),3.52-3.48(m,2h,h-6b),3.44-3.43(m,2h,h-3)。
[0271]
13
c nmr(126mhz,dmso-d6)δ162.75(2c,c=o),157.69(2c,arc),157.52(2c,arc),147.17(2c,c=n),134.79(2c,arc),130.05(2c,arc),129.64(2c,arch),129.13(4c,arch),120.96(2c,arch),119.46(2c,arch),119.17(4c,arch),115.73(2c,arch),101.15(2c,c-1),75.61(2c,c-5),73.32(2c,c-3),70.32(2c,c-2),68.10(2c,c-4),60.34(2c,c-6)。
[0272]
hplc-ms:[c
40h42
n4o
15
h]
计算值819.27,实际值819.34。
[0273]
二价配体a6p
[0274]
按照双酰腙的一般程序合成化合物a6p(38.5mg,0.05mmol)。
[0275]1h nmr(500mhz,dmso-d6)11.74(s,2h,nh),8.45(s,2h,n=ch),7.89(d,j=8.3hz,4h,arh),7.78(d,j=7.9hz,4h,arh),7.15(d,j=7.6hz,8h,arh),5.23(s,2h,oh-2),4.95(d,j=7.7hz,2h,h-1),4.91(s,2h,oh-3),4.69(s,2h,oh-6),4.55(s,2h,oh-4),3.71(s,
2h,h-4),3.66-3.41(m,10h,h-2,h-3,h-5,h-6)。
[0276]
13
c nmr(126mhz,dmso-d6)δ162.52(2c,c=o),160.10(2c,arc),157.62(2c,arc),146.61(2c,c=n),130.16(2c,arc),129.38(4c,arch),129.05(4c,arch),126.53(2c,arc),119.15(2c,arch),115.82(2c,arch),100.47(2c,c-1),75.63(2c,c-5),73.30(2c,c-3),70.24(2c,c-2),68.15(2c,c-4),60.38(2c,c-6)。
[0277]
hplc-ms:[c
40h42
n4o
15
h]
计算值819.27,实际值819.34。
[0278]
hrms:[c
40h42
n4o
15
h]
计算值819.2719,实际值819.2724。
[0279]
二价配体b6m
[0280]
按照双酰腙的一般程序使用双苯甲醛b(25.6mg,0.10mmol)和酰肼5m(106.4mg)合成化合物b6m(1.2mg,1.4μmol,1%)。
[0281]1h nmr(500mhz,dmso-d6)δ11.74(s,2h,nh),8.40(s,2h,n=ch),7.71(d,j=8.6hz,4h,arh),7.52-7.53(m,4h,arh),7.44(t,j=8.1hz,2h,arh),7.25(dd,j=8.3,1.4,2h,arh),7.21(d,j=8.6hz,4h,arh),5.98(s,2h,ch2),5.22(d,j=4.9hz,2h,oh-2),4.90-4.92(m,4h,h-1,oh-3),4.68(t,j=5.1hz,2h,oh-6),4.55(d,j=4.3hz,2h,oh-4),3.71(t,j=3.8hz,2h,h-4),3.61-3.53(m,6h,h-2,h-5,h-6a),3.51-3.47(m,2h,h-6b),3.44-3.42(m,2h,h-3)。
[0282]
13
c nmr(126mhz,dmso-d6)δ162.71(2c,c=o),157.70(2c,arc),157.50(2c,arc),147.46(2c,n=c),134.86(2c,arc),129.62(2c,arch),128.78(4c,arch),128.59(2c,arc),120.93(2c,arch),119.40(2c,arch),116.43(4c,arch),115.69(2c,arch),101.13(2c,c-1),89.66(ch2),75.60(2c,c-5),73.31(2c,c-3),70.31(2c,c-2),68.09(2c,c-4),60.33(2c,c-6)。
[0283]
hplc-ms:[c
41h44
n4o
16
h]
计算值849.29,实际值849.35。
[0284]
二价配体b6p
[0285]
按照双酰腙的一般程序使用双苯甲醛b(16.6mg,0.06mmol)和酰肼5p(51.3mg,0.16mmol)合成化合物b6p(26.8mg,0.03mmol,49%)。
[0286]1h nmr(500mhz,dmso-d6)δ11.68(s,2h,nh),8.39(s,2h,n=ch),7.88(d,j=8.5hz,4h,arh),7.71(d,j=8.3hz,4h,arh),7.20(d,j=8.3hz,4h,arh),7.13(d,j=8.7hz,4h,arh),5.97(s,2h,ch2),5.24(s,2h,oh-2),4.98-4.87(m,4h,h-1,oh-3),4.70(s,2h,oh-6),4.56(s,2h,oh-4),3.71(d,j=3.4hz,2h,h-4),3.65-3.43(m,10h,h-2,h-3,h-5,h-6)。
[0287]
13
c nmr(126mhz,dmso-d6)δ162.54(2c,c=o),160.09(2c,arc),157.64(2c,arc),146.95(2c,n=ch),129.38(4c,arch),128.74(4c,arch),126.62(2c,arc),116.46(4c,arch),115.83(4c,arch),100.50(2c,c-1),89.73(ch2),75.65(2c,c-5),73.32(2c,c-3),70.27(2c,c-2),68.18(2c,c-4),60.41(2c,c-6)。
[0288]
hplc-ms:[c
41h44
n4o
16
h]
计算值849.29,实际值849.38。
[0289]
hrms:[c
41h44
n4o
16
h]
计算值849.2825,实际值849.2835。
[0290]
二价配体c6m
[0291]
按照双酰腙的一般程序在二甲基亚砜/乙腈(11ml∶1ml)中使用双苯甲醛c(22.3mg,0.08mmol)和酰肼5m(100.4mg)合成化合物c6m(4.6mg,5.3μmol,6%)。
[0292]1h nmr(500mhz,dmso-d6)δ11.71(s,2h,nh),8.40(s,2h,n=ch),7.69(d,j=8.6hz,4h,arh),7.54-7.53(m,4h,arh),7.44(t,j=8.1hz,2h,arh),7.25(d,j=7.1hz,2h,arh),7.10(d,j=8.6hz,4h,arh),5.22(d,j=4.3hz,2h,oh-2),4.90-4.92(m,4h,oh-3,h-1),4.69(s,2h,oh-6),4.55(d,j=3.8hz,2h,oh-4),4.41(s,2h,ch2),3.72(s,2h,h-4),3.62-3.54(m,6h,h-2,h-5,h-6a),3.52-3.48(m,2h,h-6b),3.43(d,j=9.2hz,2h,h-3)。
[0293]
13
c nmr(126mhz,dmso-d6)δ162.65(2c,c=o),159.93(2c,arc),157.51(2c,arc),147.73(2c,n=c),134.92(2c,arc),129.62(2c,arch),128.79(4c,arch),127.17(2c,arc),120.93(2c,arch),119.37(2c,arch),115.68(2c,arch),114.95(4c,arch),101.13(2c,c-1),75.61(2c,c-5),73.32(2c,c-3),70.32(2c,c-2),68.10(2c,c-4),66.48(2c,ch2),60.34(2c,c-6)。
[0294]
hplc-ms:[c
42h46
n4o
16
h]
计算值863.30,实际值863.37。
[0295]
二价配体c6p
[0296]
按照双酰腙的一般程序在二甲基亚砜/二甲基甲酰胺(1ml∶1ml)中使用双苯甲醛c(18.9mg,0.06mmol)和酰肼5p(50.2mg,0.16mmol)合成化合物c6p(18.1mg,0.021mmol,33%)。
[0297]1h nmr(500mhz,dmso-d6)δ11.65(s,2h,nh),8.39(s,2h,n=ch),7.92-7.82(m,4h,arh),7.68(d,j=8.3hz,4h,arh),7.13(d,j=8.4hz,4h,arh),7.09(d,j=8.3hz,4h,arh),5.24(s,2h,oh-2),4.95(m,4h,h-1,oh-3),4.70(s,2h,oh-6),4.57(s,2h,oh-4),4.40(s,4h,ch2),3.72(d,j=3.3hz,2h,h-4),3.66-3.41(m,10h,h-2,h-3,h-5,h-6)。
[0298]
13
c nmr(126mhz,dmso-d6)δ162.45(2c,c=o),160.05(2c,arc),159.85(2c,arc),147.19(2c,n=ch),129.34(4c,arch),128.72(4c,arch),127.31(2c,arc),126.66(2c,arc),115.81(4c,arch),114.96(4c,arch),100.49(2c,c-1),75.64(2c,c-5),73.31(2c,c3-),70.26(2c,c-2),68.15(2c,c-4),66.50(2c,ch2),60.38(2c,c-6)。
[0299]
hplc-ms:[c
42h46
n4o
16
h]
计算值863.30,实际值863.40。
[0300]
hrms:[c
42h46
n4o
16
h]
计算值863.2982,实际值863.2991。
[0301]
二价配体d6m
[0302]
按照双酰腙的一般程序使用双苯甲醛d(28.7mg,0.08mmol)和酰肼5m(101.8mg)合成化合物d6m(0.4mg,0.5μmol,1%)。
[0303]1h nmr(500mhz,dmso-d6)δ11.69(s,2h,nh),8.38(s,2h,n=ch),7.67(d,j=8.6hz,4h,arh),7.53-7.52(m,4h,arh),7.44(t,j=8.1hz,2h,arh),7.25(dd,j=8.2,1.2hz,2h,arh),7.06(d,j=8.6hz,4h,arh),5.22(d,j=4.8hz,2h,oh-2),4.91-4.90(m,4h,oh-3,h-1),4.69(t,j=5.0hz,2h,oh-6),4.55(d,j=3.4hz,2h,oh-4),4.21(t,j=6.0hz,4h,ch2ch2ch2),3.71(s,2h,h-4),3.61-3.54(m,6h,h-2,h-5,h-6a),3.51-3.47(m,2h,h-6b),3.44-3.41(m,2h,h-3),2.22(t,j=5.9,2h,ch2ch2ch2)。
[0304]
hplc-ms:[c
43h48
n4o
16
h]
计算值877.32,实际值877.38。
[0305]
二价配体d6p
[0306]
按照双酰腙的一般程序使用双苯甲醛d(18.3mg,0.06mmol)和酰肼5p(55.7mg,0.18mmol)合成化合物d6p(17.3mg,0.20mmol,31%)。
[0307]1h nmr(500mhz,dmso-d6)δ11.63(s,2h,nh),8.38(s,2h,n=ch),7.87(d,j=
8.6hz,4h,arh),7.66(d,j=8.4hz,4h,arh),7.12(d,j=8.7hz,4h,arh),7.05(d,j=8.5hz,4h,arh),5.23(s,2h,oh-2),4.97-4.88(m,4h,h-1,oh-3),4.69(s,2h,oh-6),4.55(s,2h,oh-4),4.21(t,j=5.8hz,4h,ch2ch2ch2),3.71(s,2h,h-4),3.65-3.41(m,10h,h-2,h-3,h-5,h-6),2.26-2.18(m,2h,ch2ch2ch2)。
[0308]
13
c nmr(126mhz,dmso-d6)δ162.41(2c,c=o),160.03(4c,arc),147.20(2c,n=ch),129.32(4c,arch),128.69(4c,arch),127.10(2c,arc),126.67(2c,arc),115.79(4c,arch),114.89(4c,arch),100.48(2c,c-1),75.63(2c,c-5),73.30(2c,c-3),70.24(2c,c-2),68.14(2c,c-4),64.43(2c,ch2ch2ch2),60.37(2c,c-6),28.57(ch2ch2ch2)。
[0309]
hplc-ms:[c
43h48
n4o
16
h]
计算值877.32,实际值877.40。
[0310]
hrms:[c
43h48
n4o
16
h]
计算值877.3138,实际值877.3145。
[0311]
二价配体e6m
[0312]
按照双酰腙的一般程序使用双苯甲醛e(25.6mg,0.09mmol)和酰肼5m(84.2mg)合成化合物e6m(5.0mg,5.6μmol,7%)。
[0313]1h nmr(500mhz,dmso-d6)δ11.69(s,2h,nh),8.38(s,2h,n=ch),7.66(d,j=8.7hz,4h),7.54-7.52(m,4h,arh),7.44(t,j=8.1hz,2h,arh),7.24(d,j=7.2hz,2h,arh),7.04(d,j=8.6hz,4h,arh),5.23(s,2h,oh-2),4.91(m,4h,h-1,oh-3),4.70(s,2h,oh-6),4.56(s,2h,oh-4),4.11(s,4h,ch2ch2ch2ch2),3.71(d,j=2.6hz,2h,h-4),3.61-3.54(m,6h,h-2,h-5,h-6a),3.49(m,2h,h-6b),3.43(dd,j=9.5,2.9hz,2h,h-3),1.91(s,4h,ch2ch2ch2ch2)。
[0314]
13
c nmr(126mhz,dmso-d6)δ162.69(2c,c=o),160.25(2c,arc),157.49(2c,arc),147.77(2c,n=c),135.06(2c,arc),129.57(2c,arch),128.74(4c,arch),126.88(2c,arc),120.93(2c,arch),119.30(2c,arch),115.68(2c,arch),114.86(4c,arch),101.14(2c,c-1),75.60(2c,c-5),73.32(2c,c-3),70.32(2c,c-2),68.09(2c,c-4),67.33(2c,ch2ch2ch2ch2),60.33(2c,c-6),25.36(2c,ch2ch2ch2ch2)。
[0315]
hplc-ms:[c
44h50
n4o
16
h]
计算值891.33,实际值891.39。
[0316]
二价配体e6p
[0317]
按照双酰腙的一般程序使用双苯甲醛e(18.9mg,0.06mmol)和酰肼5p(50.2mg,0.16mmol)合成化合物e6p(11.0mg,0.01mmol,19%)。
[0318]1h nmr(500mhz,dmso-d6)δ11.63(s,2h,nh),8.37(s,2h,n=ch),7.87(d,j=8.5hz,4h,arh),7.66(d,j=8.3hz,4h,arh),7.12(d,j=8.7hz,4h,arh),7.03(d,j=8.5hz,4h,arh),5.24(s,2h,oh-2),4.93(m,4h,h-1,oh-3),4.71(s,2h,oh-6),4.56(s,2h,oh-4),4.10(s,4h ch2ch2ch2ch2),3.71(s,2h,h-4),3.66-3.48(m,10h,h-2,h-3,h-5,h-6),1.90(s,4h,ch2ch2ch2ch2)。
[0319]
13
c nmr(126mhz,dmso-d6)δ162.50(2c,c=o),160.24(2c,arc),160.07(2c,arc),147.34(2c,n=ch),129.36(4c,arch),128.74(4c,arch),126.97(2c,arc),126.69(2c,arc),115.85(4c,arch),114.91(4c,arch),100.51(2c,c-1),75.66(2c,c-5),73.33(2c,c-3),70.28(2c,c-2),68.19(2c,c-4),67.40(2c,ch2ch2ch2ch2),60.43(2c,c-6),25.41(2c,ch2ch2ch2ch2)。
[0320]
hplc-ms:[c
44h50
n4o
16
h]
计算值891.33,实际值891.45。
[0321]
hrms:[c
44h50
n4o
16
h]
计算值891.3295,实际值891.3306。
[0322]
二价配体f6m
[0323]
按照双酰腙的一般程序使用双苯甲醛f(20μl,0.15mmol)和酰肼5m(88.5mg)合成化合物f6m(26.5mg,0.06mmol,42%)。
[0324]1h nmr(500mhz,dmso-d6)δ11.69(s,1h,nh),8.39(s,1h,n=ch),7.67(d,j=8.7hz,2h,arh),7.53-7.52(m,2h,arh),7.44(t,j=8.1hz,1h,arh),7.25(dd,j=8.2,1.1hz,1h,arh),7.03(d,j=8.7hz,2h,arh),5.22(d,j=5.1hz,1h,oh-2),4.92-4.90(m,2h,oh-3,h-1),4.68(t,j=5.3hz,1h,oh-6),4.54(d,j=4.4hz,1h,oh-4),3.81(s,3h,ch3),3.72(t,1h,h-4),3.62-3.54(m,3h,h-2,h-5,h-6a),3.52-3.49(m,1h,h-6b),3.45-3.41(m,1h,h-3)。
[0325]
13
c nmr(126mhz,dmso-d6)δ162.63(c=o),160.89(arc),157.50(arc),147.79(c=n),134.93(arc),129.61(arch),128.74(2c,arch),126.89(arc),120.91(arch),119.35(arch),115.68(arch),114.39(2c,arch),101.13(c-1),75.60(c-5),73.32(c-3),70.32(c-2),68.11(c-4),60.35(c-6),55.34(ch3)。
[0326]
hplc-ms:[c
21h24
n2o8 h]
计算值433.16,实际值433.10。
[0327]
二价配体f6p
[0328]
按照双酰腙的一般程序使用双苯甲醛f(30μl,0.24mmol)和酰肼5p(50.9mg,0.16mmol)合成化合物f6p(64mg,0.15mmol,82%)。
[0329]1h nmr(500mhz,dmso-d6)δ11.63(s,1h,nh),8.38(s,1h,n=ch),7.88(d,j=8.6hz,2h,arh),7.67(d,j=8.5hz,2h,arh),7.13(d,j=8.7hz,2h,arh),7.02(d,j=8.6hz,2h,arh),5.23(d,j=5.2hz,1h,oh-2),4.95(d,j=7.7hz,1h,h-1),4.91(d,j=5.5hz,1h,oh-3),4.68(t,j=5.5hz,1h,oh-6),4.55(d,j=4.6hz,1h,oh-4),3.81(s,3h,ch3),3.71(t,j=3.8hz,1h,h-4),3.65-3.46(m,4h,h-5,h-6),3.46-3.40(m,1h,h-3)。
[0330]
13
c nmr(126mhz,dmso-d6)δ162.37(c=o),160.78(arc),160.01(arc),147.20(n=c),129.30(2c,arch),128.65(2c,arch),127.01(arc),126.66(arc),115.77(2c,arch),114.37(2c,arch),100.45(c-1),75.62(c-5),73.29(c-3),70.22(c-2),68.14(c-4),60.36(c-6),55.33(ch3)。
[0331]
hplc-ms:[c
21h24
n2o8 h]
计算值433.16,实际值433.20。
[0332]
hrms:[c
21h24
n2o8 h]
计算值433.1605,实际值433.1608。
[0333]
4-(二氯甲基)-n-(丙-2-炔-1-基)苯甲酰胺(10)
[0334]
将4-甲酰基苯甲酸(9,283.0mg,1.89mmol)溶解在亚硫酰氯(6ml,82.21mmol)中。将反应混合物在80℃搅拌20小时。真空除去溶剂。将粗品4-(二氯甲基)苯甲酰氯(98.0mg)溶解在二氯甲烷中。将反应混合物冷却至0℃并逐滴加入三乙胺(183μl,1.32mmol)和炔丙基胺(56μl,0.88mmol)。使混合物升温至室温并搅拌3小时。将反应混合物倒在水上并用二氯甲烷萃取。合并的有机相用饱和nahco3和盐水洗涤,用无水na2so4干燥,过滤并真空浓缩。产物通过正相mplc(石油醚/乙酸乙酯,5%至60%乙酸乙酯)纯化。得到白色固体状的10(17.2mg,0.07mmol,16%,经过两步骤)。
[0335]1h nmr(500mhz,cdcl3)δ7.82(d,j=8.1hz,2h,arh),7.65(d,j=8.1hz,2h,arh),6.73(s,1h,chcl2),6.33(s,1h,nh),4.27(dd,j=5.0,2.3,2h,ch2),2.30(s,1h,c≡ch)。
[0336]
13
c nmr(126mhz,cdcl3)δ166.21(c=o),143.69(arc),135.22(arc),127.74(2c,arch),126.69(2c,arch),79.30(c≡ch),72.31(c≡ch),70.89(chcl2),30.04(ch2)。
[0337]
hplc-ms:[c
11
h9cl2no h]
计算值242.02,实际值241.89。
[0338]
4-(双(4-甲酰基苯氧基)甲基)-n-(丙-2-炔-1-基)苯甲酰胺(11)
[0339]
将化合物10(17.2mg,0.07mmol)、4-羟基苯甲醛(51.2mg,0.43mmol)和碳酸钾(37.5mg,0.27mmol)溶解在无水二甲基甲酰胺中并在回流下搅拌48小时(参见下面的方案2)。反应混合物用乙酸乙酯稀释,用水、饱和nahco3和盐水洗涤,用无水na2so4干燥,过滤并真空浓缩。产物通过正相mplc(石油醚/乙酸乙酯,10%至70%乙酸乙酯)纯化。得到白色固体状的11(17.6mg,0.04mmol,60%)。
[0340]1h nmr(500mhz,cdcl3)δ9.89(s,2h,cho),7.86(d,j=7.8hz,2h,arh),7.81(d,j=8.4hz,4h,arh),7.70(d,j=8.0hz,2h,arh),7.13(d,j=8.3hz,4h,arh),6.93(s,1h,ch),6.41(s,1h,nh),4.25(dd,j=4.6,2.1hz,2h,ch2),2.28(s,1h,c≡ch)。
[0341]
13
c nmr(126mhz,cdcl3)δ190.88(o=ch),166.51(c=o),160.20(arc),139.22(arc),135.24(arc),132.05(4c,arch),131.74(arc),127.85(2c,arch),127.16(2c,arch),117.58(4c,arch),98.92(ch),79.26(c≡ch),72.29(c≡ch),30.04(ch2)。
[0342]
hplc-ms:[c
25h19
no5 h]
计算值414.14,实际值414.10。
[0343]
leca的表达和纯化
[0344]
如joachim等人(org.biomol.chem.2016)所述,进行leca的表达和纯化以及通过荧光偏振进行的竞争性结合。使用itc200(ge healthcare)以在细胞中尽可能高的leca浓度(通常为200μm至400μm)进行微量热法,并在25℃下在相同缓冲液中滴定配体。
[0345]
表面等离子体共振
[0346]
所有实验均于25℃下在biacore x100仪器(ge healthcare)上进行,流速为10μl min-1
。对于leca的固定,系统用pbs缓冲液(ph 7.4的10mm磷酸盐缓冲液、2.7mm kcl、137mm nacl、100μm cacl2、0.05%吐温20)预平衡,然后通过在通道1和2上注射3次1∶1的n-羟基琥珀酰亚胺(nhs)/1-乙基-3(3-二甲基氨基丙基)碳二亚胺盐酸盐(edc)混合物(接触时间为540秒),直到结合响应超过800ru,从而将cm5芯片表面激活。将leca溶解在ph4.5的10mm醋酸钠(100μg ml-1
)中并在通道2上注入激活的芯片表面(接触时间为540秒),直到达到约4000ru的响应。过量的游离胺基团通过注射1m乙醇胺(接触时间540秒)进行封端。将二价化合物溶解在100%dmso中,随后在电泳缓冲液(ph 7.4的10mm磷酸盐缓冲液、2.7mm kcl、137mm nacl、100μm cacl2、0.05%吐温20、5%dmso)中稀释至所需浓度。对二价分析物进行单循环动力学分析(接触时间为120秒,解离时间为120秒),其包括在固定的leca上以0nm、10nm、50nm、100nm和200nm的浓度注射分析物。芯片表面通过注射5次100μm 4-硝基苯基-β-d-半乳糖(接触时间120秒)再生。使用biacore x100评估软件(2.0版)通过应用1∶1的结合模型来拟合实验数据以进行kd的测定。
[0347]
[1]h.e.gottlieb,v.kotlyar,a.nudelman,j.org.chem.1997,62,7512-7515。
[0348]
[2]m.seligman,j.biol.chem.1952,195,239-249。
[0349]
[3]s.t.xue,w.y.he,l.l.ma,h.q.wang,b.wang,g.h.zheng,x.y.ji,t.zhang,y.h.li,j.d.jiang,et al.,molecules 2013,18,3789-3805。
[0350]
[4]y.li,h.mo,g.lian,b.yu,carbohydr.res.2012,363,14-22。
[0351]
[5]f.yang,f.xie,y.zhang,y.xia,w.liu,f.jiang,c.lam,y.qiao,d.xie,j.li,et al.,bioorganic med.chem.lett.2017,27,2166-2170。
[0352]
生物物理测定的合成方案和结果
[0353]
含4-硝基苯基β-d-吡喃半乳糖苷的leca的晶体结构(pdb:3zyf)揭示了两个相邻结合位点中苯环的两个c4原子之间的距离为约因此,在该位置引入酰肼基团将允许使用双醛接头将两个半乳糖苷桥接至两个结合位点。
[0354]
接头旨在桥接这个约的距离。选择间/对-苯并酰肼-β-d-吡喃半乳糖苷(5)和五种双苯甲醛(a至e,图1)作为合成二价酰腙leca配体(a6至e6)的合成砌块。我们使用moe对二价配体进行建模,并将它们与现有高效二价pieters配体的晶体结构(pdb:4ywa)进行比较(见图1)。
[0355]
二价配体的5步合成(参见下面的方案1)从d-半乳糖的乙酸酯保护(1
→
2)开始,用间/对羟基苯甲酸甲酯糖基化(2
→
3),随后是zemlen的去保护(3
→
4)和酰肼5的形成。5与苯甲醛间隔物a至f成功连接形成酰腙a6至f6。
[0356][0357]
方案1:合成双醛b至e和二价leca配体。试剂和条件:(i)naoac,ac2o;100℃,1小时;(ii)间/对羟基苯甲酸甲酯,bf3*et2o,ch2cl2,0℃至室温,过夜;(iii)naome,meoh,室温,过夜;(iv)nh2nh2,meoh,70℃,过夜;(v)a至f,甲酸,dmso,室温,4小时,在dmso/mecn中的c的6m和在h2o/mecn中的e的6m。(vi)4-羟基苯甲醛,k2co3,dmf,70℃,微波,3小时至10小时;o.n.=过夜。
[0358]
然后使用一套生物物理测定法评估所有合成的分子、单价对照和间位和对位系列
的双半乳糖苷(表1)。
[0359][0360]
表1:使用基于荧光偏振(fp)、表面等离子体共振(spr)和等温滴定微量热法(itc)的竞争性结合测定法评估leca配体。fp测定条件:20μm leca、10nm报告配体8、含4%dmso(*)或25%dmso(**)的tbs/ca
2
缓冲液(ph 7.4,20mm tris、137mm nacl、2.6mm kcl,辅以1mm cacl2)。itc缓冲液:tbs/ca
2
。spr的直接结合实验在固定有leca的cm5芯片上进行。示出了平均值和标准偏差。n=独立实验的次数。
[0361]
在基于荧光偏振的竞争性测定中评估配体与leca的结合。使用二价配体a6至e6达到了测定下限,以陡峭的滴定斜率说明(图3)。这是由于荧光示踪剂8(参见图2)对leca的内在亲和力为7.4μm(joachim等人,org biomol chem 14 7933-48(2016))。由于在该竞争性结合实验中存在20μm leca,它必须接近或高于示踪剂的kd,因此无法测定低于示踪剂/蛋白质系统的竞争性测试化合物的活性。因此,我们转向使用spr的直接结合。在spr中,这种
限制不存在,并且可以确定真正的kd,并且它们揭示了作为接头长度的函数的二价化合物的两位数纳摩尔亲和力(表1)。
[0362]
作为进一步的改善,二价配体可以用侧链进行修饰,如在12中允许点击染料、探针或溶解度增强剂(方案2)。计划使用其他桥接(由ch2基团延长)和支链官能团(用烷基或其他官能团代替芳基)来评估它们的适用性。与荧光素(13,方案2)的连接将允许其用于具有更高灵敏度的改善的竞争性结合测定,此外,可以评估该化合物的生物膜成像可用性。
[0363][0364]
方案2:合成二价荧光leca配体。试剂和条件:
[0365]
(i),socl2,回流,1天;(ii)炔丙基胺,et3n,ch2cl2,0℃至室温,3小时;(iii)5p,甲酸,dmso,室温,6小时;(iv)fitc-peg
3-叠氮化物,cuso4,抗坏血酸钠,dmf/h2o/dmso,室温,2天。
[0366]
为了进一步改善分子的性质,可以等排取代酰肼部分以提高溶解度、稳定性和类药性。这可以使用一组三唑、酰胺、反酰胺、肉桂酰胺或反肉桂酰胺来完成(图6)。肉桂酰胺等排体的合成设计在方案3中。
[0367][0368]
方案3:设计了肉桂酰胺类似物的合成方法。
[0369]
参考文献
[0370]
joachim et al.,org biomol chem 14 7933-48(2016)
[0371]
diggle et al.,environ microbiol 8 1095-104(2006)
[0372]
cecioni et al.,chem rev,2015,115(1),525-61)
[0373]
f.pertici&r.j.pieters,chem commun(camb)48 4008-10(2012)
[0374]
g.yu,r.j.pieters et al.,j org chem 84 2470-2488(2019)
[0375][0376]
方案4:完全合成二价荧光leca配体。试剂和条件:(i)socl2,回流,1天;(ii)炔丙
基胺,et3n,ch2cl2,0℃至室温,3小时;(iii)4-羟基苯甲醛,k2co3,dmf,回流,2天;(iv)5p,甲酸,dmso,室温,2.5小时;(v)19
[1]
,cuso4,抗坏血酸钠,dmf/h2o/dmso,室温,7.5小时。
[0377]
二价配体(12)
[0378]
将化合物11(15.1mg,36.5μmol)和酰肼5p(51.6mg,164μmol)溶解在1.5ml二甲基亚砜中,加入20μl甲酸。2.5小时后,将反应混合物冻干。通过c18柱制备型hplc层析(水/乙腈,15%至40%的乙腈梯度)纯化化合物12。得到白色固体状的化合物12(32.3mg,32.1μmol,83%)。
[0379]1h nmr(500mhz,dmso-d6)δ11.70(s,2h,n-nh),9.03(t,j=5.6hz,1h,conh),8.38(s,2h,n=ch),7.94(d,j=8.1hz,2h,arh),7.88(d,j=8.4hz,4h,arh),7.80(d,j=8.0hz,2h,arh),7.68(d,j=8.3hz,4h,arh),7.37(s,1h,ch),7.23-7.03(m,8h,arh),5.25(s,2h,oh-2),5.03-4.85(m,4h,h-1,oh-3),4.70(s,2h,oh-6),4.57(s,2h,oh-4),4.06(dd,j=5.6,2.6hz,2h,ch2),3.72(d,j=3.3hz,2h,h-4),3.67-3.47(m,8h,h-2,h-5,h-6),3.47-3.41(m,2h,h-3),3.14(t,j=2.5hz,1h,c≡ch)。
[0380]
13
c nmr(126mhz,dmso-d6)δ165.59(1c,c=o),162.48(2c,c=o),160.09(2c,arc),156.85(2c,arc),146.82(2c,n=ch),139.73(1c,arc),134.93(1c,arc),129.40(4c,arch),128.92(2c,arc),128.71(4c,arch),127.75(2c,arch),127.01(2c,arch),126.56(2c,arc),117.26(4c,arch),115.81(4c,arch),100.45(2c,c-1),98.09(1c,ch),81.27(1c,c≡ch),75.65(2c,c-5),73.32(2c,c-3),73.06(1c,c≡ch),70.25(2c,c-2),68.18(2c,c-4),60.40(2c,c-6),28.61(1c,ch2)。
[0381]
hplc-ms:[c
51h51
n5o
17
h]
计算值1006.34,实际值1006.44。
[0382]
双苯甲醛荧光接头(20)
[0383]
将叠氮化物修饰的fitc(19
[1]
,16.9mg,27.8μmol)和炔丙基化双苯甲醛11(10.3mg,24.9μmol)溶解在二甲基甲酰胺(1.5ml)中。添加硫酸铜(ii)溶液(75μl,100mm,在h2o中,7.5μmol)和抗坏血酸钠溶液(75μl,100mm,在h2o中,7.5μmol)。反应混合物在室温下搅拌2天并真空干燥。产物20通过c18柱制备型hplc层析纯化(水/乙腈,含1%甲酸,30%至60%的乙腈梯度)。得到黄色固体状的化合物20(16.7mg,16.4μmol,66%)。
[0384]1h nmr(500mhz,dmso-d6)δ10.14(s,2h,oh-荧光素),10.05(s,1h,nh-硫脲),9.87(s,2h,cho),9.11(t,j=5.7hz,1h,nh-硫脲),8.27(s,1h,arh-荧光素),8.10(s,1h,conh),7.98-7.91(m,3h,arh,ch-三唑),7.87(d,j=8.7hz,4h,arh),7.79(d,j=8.3hz,2h,arh),7.73(d,j=7.8hz,1h,arh-荧光素),7.57(s,1h,ch),7.25(d,j=8.7hz,4h,arh),7.17(d,j=8.3hz,1h,arh-荧光素),6.67(d,j=2.2hz,2h,arh-荧光素),6.62-6.53(m,4h,arh-荧光素),4.53-4.44(m,4h,ch2),3.78(t,j=5.2hz,2h,ch2),3.67(s,2h,ch2),3.57(t,j=5.4hz,2h,ch2),3.54-3.44(m,8h,ch2)。
[0385]
13
c nmr(126mhz,dmso-d6)δ191.50(2c,o=ch),180.53(1c,c=s),168.55(1c,c=o,荧光素),165.60(1c,c=o),159.96(2c,arc),159.51(2c,arc-荧光素),151.90(2c,arc-荧光素),147.16(2c,arc-荧光素),144.86(1c,c=ch-三唑),141.33(1c,arc-荧光素),138.66(1c,arc),135.48(1c,arc),131.81(4c,arch),131.10(2c,arc)129.44(1c,arc-荧光素),129.08(4c,arch-荧光素),127.81(2c,arch),126.91(2c,arch),126.58(1c,arc-荧光素),124.11(1c,arch-荧光素),123.33(1c,c=ch-三唑),117.01(4c,arch),116.37(1c,
arch-荧光素),112.61(1c,arch-荧光素),109.72(2c,arc-荧光素),102.25(2c,arch-荧光素),97.59(1c,ch),69.73(1c,ch2),69.64(2c,ch2),69.54(1c,ch2),68.75(1c,ch2),68.41(1c,ch2),49.29(1c,ch2),43.71(1c,ch2),34.90(1c,ch2)。
[0386]
hplc-ms:[c
54h48
n6o
13
s 2h]
2
计算值511.16,实际值511.15。
[0387]
hrms:[c
54h48
n6o
13
s 2h]
2
计算值511.1573,实际值511.1572。
[0388]
二价荧光配体(13)
[0389]
将化合物20(4.4mg,4.3μmol)和酰肼5p(5.8mg,18.5μmol)溶解在450μl二甲基亚砜中,加入40μl甲酸。7.5小时后,将反应混合物冻干。通过c18柱制备型hplc层析(含1%甲酸的水/乙腈,15%至40%的乙腈梯度)得到黄色粉末状产物13(2.9mg,1.5μmol,35%,85%纯度)。
[0390]
hplc-ms:[c
80h80n10o25
s 2h]
2
计算值807.2581,实际值807.78。
[0391]
hrms:[c
s0h80n10o25
s 2h]
2
计算值807.2581,实际值807.2589。
[0392][0393]
方案5:合成基于香豆酸的二价leca配体。(i)4-硝基苯甲醛,k2co3,dmf,70℃,微波,11小时至4天(h是10天,无辐照)(ii)h2,pd/c,ch2cl2,室温,过夜;(iii)h2so4,meoh,回流,3小时;(iv)苄基溴,na2co3,dmf,室温,过夜;(v)β-d-吡喃半乳糖五乙酸酯(2),bf3·
et2o,chcl3,0℃至室温,过夜;(vi)naoh,h2o/meoh(1∶1),室温,1小时;(vii)hbtu,dipea,dmf,室温,1小时至3天;o.n.=过夜。
[0394]
合成双苯胺h至k的一般程序
[0395]
将相应的二卤代烃(1当量)、4-硝基苯酚(4当量)和碳酸钾(3当量)溶解在微波反应瓶中的无水二甲基甲酰胺(6ml,对于i是9ml)中。将小瓶密封并以300w的最大功率在70℃下微波辐照(discover sp sequential microwave synthesis system,cem corporation,north carolina,usa)11小时至4天(对于h,在油浴中10天,无辐照)。冷却后,反应混合物用乙酸乙酯稀释,用饱和的nahco3水溶液洗涤,用无水na2so4干燥,过滤并真空浓缩。双硝基中间体通过正相mplc(甲苯,含1%乙酸乙酯和1%三乙胺,等度)或在j的情况下通过c18柱mplc层析(水/乙腈,含0.1%甲酸,40%至75%的乙腈梯度)纯化。然后将纯双硝基中间体溶解在二氯甲烷/甲醇(3∶1,对于h是2∶1)中,加入10%pd/c(0.1当量)。在三个真空/h2循环后,将反应混合物在h2气氛(1个标准大气压)下搅拌过夜。将反应混合物通过硅藻土过滤并真空浓缩。无需进一步纯化即可获得纯产物。化合物h至k的分析数据与文献相符。
[3][3][4]
[0396]
双(4-氨基苯氧基)甲烷(h)
[0397]
按照合成双苯胺的一般程序,使用二氯甲烷(192μl,3.0mmol)、4-硝基苯酚(1.67g,12mmol)和碳酸钾(1.24g,9.0mmol),得到浅棕色固体状的化合物h(326mg,1.42mmol,47%,经过两步骤)。
[0398]1h nmr(500mhz,甲醇-d4)δ6.91-6.84(m,4h,arh),6.74-6.68(m,4h,arh),5.52(s,2h,ch2)。
[0399]
13
c nmr(126mhz,甲醇-d4)δ151.77(2c,arc),142.80(2c,arc),118.98(4c,arch),118.07(4c,arch),94.31(1c,ch2)。
[0400]
hplc-ms:[c
13h14
o2 h]
计算值231.11,实际值231.04。
[0401]
hrms:[c
13h14
o2 h]
计算值231.1128,实际值231.1125。
[0402]
双(4-氨基苯氧基)乙烷(i)
[0403]
按照合成双苯胺的一般程序,使用1,2-二氯乙烷(181μl,2.3mmol)、4-硝基苯酚(1.11g,8mmol)和碳酸钾(829mg,6.0mmol),得到棕灰色固体状的化合物i(182mg,0.75mmol,33%,经过两步骤)。
[0404]1h nmr(500mhz,dmso-d6)δ6.81-6.71(m,4h,arh),6.70-6.54(m,4h,arh),4.12(s,4h,ch2)。
[0405]
13
c nmr(126mhz,dmso-d6)δ150.95(2c,arc),139.66(2c,arc),116.45(4c,arch),115.44,(4c,arch)66.93(2c,ch2)。
[0406]
hplc-ms:[c
14h16
o2 h]
计算值245.13,实际值245.05。
[0407]
hrms:[c
14h16
o2 h]
计算值245.1285,实际值245.1281
[0408]
双(4-氨基苯氧基)丙烷(j)
[0409]
按照合成双苯胺的一般程序,使用1,3-二氯丙烷(190μl,2.0mmol)、4-硝基苯酚(1.11g,8mmol)和碳酸钾(829mg,6.0mmol),得到棕灰色固体状的化合物j(342mg,1.32mmol,67%,经过两步骤)。
[0410]1h nmr(500mhz,甲醇-d4)δ6.84-6.67(m,8h,arh),4.06(t,j=6.2hz,4h,ch2ch2ch2),2.18-2.07(m,2h,ch2ch2ch2)。
[0411]
13
c nmr(126mhz,甲醇-d4)δ154.21(2c,arc),140.39(2c,arc),118.73(4c,arch),116.67(4c,arch),66.38(2c,ch2ch2ch2),30.67(1c,ch2ch2ch2)。
[0412]
hplc-ms:[c
15h18
o2 h]
计算值259.14,实际值259.06。
[0413]
hrms:[c
15h18
o2 h]
计算值259.1441,实际值259.1438。
[0414]
双(4-氨基苯氧基)丁烷(k)
[0415]
按照合成双苯胺的一般程序,使用1,4-二氯丁烷(236μl,2.0mmol)、4-硝基苯酚(1.11g,8mmol)和碳酸钾(829mg,6.0mmol),得到棕灰色固体状的化合物k(562mg,2.1mmol,定量,经过两步骤)。
[0416]1h nmr(500mhz,甲醇-d4)δ6.77(s,8h,arh),4.04-3.89(m,4h,ch2ch2ch2ch2),2.00-1.78(m,4h,ch2ch2ch2ch2)。
[0417]
13
c nmr(126mhz,甲醇-d4)δ153.35(2c,arc),137.81(2c,arc),117.78(4c,arch),115.24(4c,arch),67.96(2c,ch2ch2ch2ch2),25.85(2c,ch2ch2ch2ch2)。
[0418]
hplc-ms:[c
16h20
o2 h]
计算值273.16,实际值273.07。
[0419]
hrms:[c
16h20
o2 h]
计算值273.1598,实际值273.1594。
[0420]
4-(2
′
,3
′
,4
′
,6
′‑
四-o-乙酰基)-β-d-吡喃半乳糖基香豆酸甲酯(24)
[0421]
用类似于menon等人的程序的程序合成对香豆酸甲酯。
[5]
将对香豆酸(21,1.5g,9.3mmol)溶解在甲醇(30ml)中。添加h2so4(浓的,1ml)并将反应混合物回流(65℃)3小时。将反应混合物真空浓缩,用水稀释并用饱和nahco3溶液中和。将产物22萃取至乙酸乙酯中,合并的有机层用半饱和的盐水洗涤,用na2so4干燥,过滤并真空干燥。无需进一步纯化即可获得纯的对香豆酸甲酯(22,1.7g,9.3mmol,定量)。将β-d-吡喃半乳糖五乙酸酯(2,510.8mg,1.31mmol)和对香豆酸甲酯(22,466.4mg,2.62mmol)溶解在无水氯仿(20ml)中。将反应混合物冷却至0℃并滴加bf3·
oet2(1ml,7.85mmol)。使混合物升温至室温并搅拌5小时。将反应混合物倒入冰冷的饱和nahco3中并用二氯甲烷稀释。有机相用饱和nahco3溶液和盐水洗涤,用无水na2so4干燥,过滤并真空浓缩。产物24通过正相mplc(石油醚/乙酸乙酯,15%至50%的乙酸乙酯梯度)纯化。获得白色固体状的化合物24(162.8mg,0.32mmol,24%)。
[0422]1h nmr(500mhz,cdcl3)δ7.64(d,j=16.0hz,1h,ch=chcooch3),7.50-7.44(m,2h,arh),7.03-6.97(m,2h,arh),6.34(d,j=16.0hz,1h,ch=chcooch3),5.49(dd,j=10.4,7.9hz,1h,h-2),5.46(dd,j=3.5,1.1hz,1h,h-4),5.12(dd,j=10.5,3.5hz,1h,h-3),5.09(d,j=7.9hz,1h,h-1),4.26-4.13(m,2h,h-6),4.08(td,j=6.6,1.2hz,1h,h-5),3.80(s,3h,ch=chcooch3),2.18(s,3h,ch3),2.06(s,6h,ch3),2.01(s,3h,ch3)。
[0423]
13
c nmr(126mhz,cdcl3)δ170.48(1c,c=o),170.35(1c,c=o),170.26(1c,c=o),169.49(1c,c=o),167.63(1c,c=o),158.43(1c,arc),144.04(1c,ch=chcooch3),129.75(2c,arch),129.71(1c,arc),117.18(2c,arch),116.88(1c,ch=chcooch3),99.25(1c,c-1),71.30(1c,c-5),70.89(1c,c-3),68.64(1c,c-2),66.93(1c,c-4),61.47(1c,c-6),51.84(1c,cooch3),20.86(1c,ch3),20.80(2c,ch3),20.72(1c,ch3)。
[0424]
hplc-ms:[c
24h28o12
nh4]
计算值526.19,实际值526.14。
[0425]
hrms:[c
24h28o12
nh4]
计算值526.1919,实际值526.1923。
[0426]
4-(2
′
,3
′
,4
′
,6
′‑
四-o-乙酰基)-β-d-吡喃半乳糖基香豆酸苄酯(25)
[0427]
用类似于郭等人的程序合成对香豆酸苄酯23。
[6]
将对香豆酸(21,1.0g,6.2mmol)溶解在二甲基甲酰胺(30ml)中并加入na2co3(1.5g,14.5mmol)。滴加苄基溴(1.5ml,12.5mmol)并搅拌过夜。将反应混合物真空浓缩,用水稀释,将产物萃取至乙酸乙酯中,用半饱和盐水洗涤,用无水na2so4干燥,过滤并真空浓缩。反应粗产物通过正相mplc(石油醚/乙酸乙酯,10%至40%的乙酸乙酯梯度)纯化,得到纯的对香豆酸苄酯(23,1.3g,5.0mmol,80%)。将β-d-吡喃半乳糖五乙酸酯(2,1.0g,2.6mmol)和对香豆酸苄酯23(1.3g,5.0mmol)溶解在装有粉状活性分子筛的圆底烧瓶中的无水氯仿(20ml)中。将反应混合物冷却至0℃并滴加bf3·
oet2(1.9ml,15.2mmol)。使混合物升温至室温并搅拌过夜。将反应混合物倒入冰冷的饱和nahco3溶液中并用二氯甲烷稀释。有机相用饱和nahco3溶液和半饱和盐水洗涤,用无水na2so4干燥,过滤并真空浓缩。产物25通过正相mplc(石油醚/乙酸乙酯,20%至40%的乙酸乙酯梯度)纯化。获得白色固体状的化合物25(1.1g,2.0mmol,76%)。
[0428]1h nmr(500mhz,cdcl3)δ7.68(d,j=16.0hz,1h,ch=chcoobn),7.50-7.44(m,2h,arh),7.44-7.32(m,5h,bn),7.02-6.97(m,2h,arh),6.39(d,j=16.0hz,1h,ch=chcoobn),5.50(dd,j=10.5,7.9hz,1h,h-2),5.46(dd,j=3.5,1.1hz,1h,h-4),5.24(s,2h,bn),5.11
(dd,j=10.4,3.4hz,1h,h-3),5.08(d,j=7.9hz,1h,h-1),4.26-4.12(m,2h,h-6),4.08(ddd,j=7.2,6.2,1.2hz,1h,h-5),2.19(s,3h,ch3),2.06(s,6h,ch3),2.02(s,3h,ch3)。
[0429]
13
c nmr(126mhz,cdcl3)δ170.51(1c,c=o),170.37(1c,c=o),170.28(1c,c=o),169.52(1c,c=o),167.01(1c,c=o),158.43(1c,arc),144.35(1c,ch=chcoobn),136.14(1c,bn),129.79(2c,arch),129.63(1c,arc),128.75(2c,bn),128.47(2c,bn),128.43(1c,bn),117.12(2c,arch),116.88(1c,ch=chcoobn),99.16(1c,c-1),71.26(1c,c-5),70.86(1c,c-3),68.57(1c,c-2),66.89(1c,c-4),66.51(1c,bn),61.47(1c,c-6),20.89(1c,ch3),20.83(2c,ch3),20.75(1c,ch3)。
[0430]
hplc-ms:[c
30h32o12
nh4]
计算值602.22,实际值602.17。
[0431]
hrms:[c
30h32o12
nh4]
计算值602.2232,实际值602.2234。
[0432]
4-o-β-d-吡喃半乳糖基反式对香豆酸(26)
[0433]
将化合物24(124.3mg,0.24mmol)溶解在甲醇(6.2ml)中。添加水(4.1ml)和氢氧化钠溶液(2.1ml,1m,1.96mmol)。将反应混合物在室温搅拌1小时,然后用amberlite ir 120/h
中和并真空浓缩。产物25通过正相mplc(含1%甲酸的二氯甲烷/甲醇,1%至20%的甲醇梯度)纯化。得到白色固体状的化合物26(66.1mg,0.20mmol,83%)。
[0434]
将化合物25(1.1g,2.0mmol)悬浮在甲醇(48ml)中。添加水(32ml)和氢氧化钠溶液(16ml,1m,16mmol)。将反应混合物加热至50℃并搅拌2小时。用amberlite ir 120/h
中和反应混合物并真空浓缩。产物25通过正相mplc(含1%甲酸的二氯甲烷/甲醇,1%至20%的甲醇梯度)纯化。获得白色固体状的化合物26(554.2mg,1.7mmol,76%)。
[0435]
化合物26的合成首先由takada等人描述。
[7]
[0436]1h nmr(500mhz,甲醇-d4)δ7.61(d,j=15.9hz,1h,ch=chcooh),7.57-7.51(m,2h,arch),7.16-7.11(m,2h,arch),6.37(d,j=16.0hz,1h,ch=chcooh),4.92(d,j=7.8hz,1h,h-1),3.93-3.90(m,1h,h-4),3.84-3.69(m,4h.h-2,h-5,h-6),3.59(dd,j=9.7,3.4hz,1h,h-3)。
[0437]
13
c nmr(126mhz,甲醇-d4)δ171.24(1c,cooh),δ160.82(1c,arc),145.43(1c,ch=chcooh),130.63(2c,arch),130.05(1c,arc),118.00(3c,arch,ch=chcooh),102.49(1c,c-1),77.07(1c,c-5),74.81(1c,c-3),72.18(1c,c-2),70.20(1c,c-4),62.40(1c,c-6)。
[0438]
hplc-ms:[c
15h18
o8 hcoo]-计算值371.10,实际值370.94。
[0439]
hrms:[c
15h18
o8 hcoo]-计算值371.0984,实际值371.0982。
[0440]
二价配体g18
[0441]
将4,4
′‑
二氨基二苯醚(g,10.1mg,0.05mmol)、化合物26(38.2mg,0.12mmol)、hbtu(53.1mg,0.14mmol)溶于二甲基甲酰胺(1ml)中并加入dipea(50μl,0.29mmol)。反应混合物在室温下搅拌,过夜,然后真空干燥。产物通过c18柱制备型hplc层析纯化(含l%甲酸的水/乙腈,20%至35%的乙腈梯度)。获得浅黄色固体状的化合物g18(28.3mg,34.6μmo1,69%)。
[0442]1h nmr(500mhz,dmso-d6)δ10.18(s,2h,nh),7.73-7.67(m,4h,arh),7.60-7.50(m,6h,arh,ch=chconh),7.11-7.04(m,4h,arh),7.02-6.95(m,4h,arh),6.68(d,j=15.7hz,2h,ch=chconh),4.90(d,j=7.7hz,2h,h-1),3.81-3.35(m,12h,h-2,h-3,h-4,h-5,h-6)。
[0443]
13
c nmr(126mhz,dmso-d6)δ163.64(2c,c=o),158.75(2c,arc),152.55(2c,arc),139.74(2c,ch=chconh),135.00(2c,arc),129.24(4c,arch),128.36(2c,arc),120.82
(4c,arch),120.15(2c,ch=chconh),118.85(4c,arch),116.63(4c,arch),100.66(2c,c-1),75.62(2c,c-5),73.29(2c,c-3),70.24(2c,c-2),68.15(2c,c-4),60.38(2c,c-6)。
[0444]
hplc-ms:[c
42h44
n2o
15
h]
计算值817.28,实际值817.33。
[0445]
hrms:[c
42h44
n2o
15
h]
计算值817.2814,实际值
[0446]
二价配体h18
[0447]
将双(4-氨基苯氧基)甲烷(h,7.9mg,0.03mmol)、化合物26(25.3mg,0.08mmol)、hbtu(32.7mg,0.09mmol)溶于二甲基甲酰胺(3ml)中并加入dipea(9μl,0.05mmol)。反应混合物在室温下搅拌2天然后真空干燥。产物h18通过c18柱制备型hplc层析纯化(含1%甲酸的水/乙腈,25%至45%的乙腈梯度)。获得白色固体状的化合物h18(6.9mg,8.1μmol,24%)。
[0448]1h nmr(500mhz,dmso-d6)δ10.07(s,2h,nh),7.67-7.60(m,4h,arh),7.59-7.54(m,4h,arh),7.52(d,j=15.6hz,2h,ch=chconh),7.12-7.02(m,8h,arh),6.67(d,j=15.6hz,2h,ch=chconh),5.77(s,2h,ch2),5.19(d,j=5.2hz,2h,oh-2),4.92-4.84(m,4h,h-1,oh-3),4.66(t,j=5.5hz,2h,oh-6),4.52(d,j=4.6hz,2h,oh-4),3.71(t,j=4.1hz,2h,h-4),3.64-3.45(m,8h,h-2,h-5,h-6),3.42(ddd,j=9.3,5.3,3.2hz,2h,h-3)。
[0449]
13
c nmr(126mhz,dmso-d6)δ163.49(2c,c=o),158.68(2c,arc),152.19(2c,arc),139.52(2c,ch=chconh),134.09(2c,arc),129.14(4c,arch),128.38(2c,arc),120.59(4c,arch),120.23(2c,ch=chconh),116.60(4c,arch),116.59(4c,arch),100.68(2c,c-1),90.81(1c,ch2),75.58(2c,c-5),73.27(2c,c-3),70.22(2c,c-2),68.12(2c,c-4),60.36(2c,c-6)。
[0450]
hplc-ms:[c
43h46
n2o
16
h]
计算值847.29,实际值847.33。
[0451]
hrms:[c
43h46
n2o
16
h]
计算值847.2920,实际值847.2924。
[0452]
二价配体i18
[0453]
将双(4-氨基苯氧基)乙烷(i,7.3mg,0.03mmol)、化合物26(21.6mg,0.07mmol)、hbtu(25.2mg,0.07mmol)溶于二甲基甲酰胺(4ml)中并加入dipea(7μl,0.04mmol)。反应混合物在室温下搅拌2天然后真空干燥。产物118通过c18柱制备型hplc层析纯化(添加了1%甲酸的水/乙腈,25%至45%的乙腈梯度)。获得白色固体状的化合物i18(4.5mg,5.2μmol,17%)。
[0454]1h nmr(500mhz,dmso-d6)δ10.04(s,2h,nh),7.65-7.60(m,4h,arh),7.58-7.54(m,4h,arh),7.52(d,j=15.5hz,2h,ch=chconh),7.08(d,j=8.7hz,4h,arh),7.01-6.91(m,4h,arh),6.67(d,j=15.7hz,2h,ch=chconh),4.89(d,j=7.7hz,2h,h-1),4.28(s,4h,ch2),3.70(d,j=3.3hz,2h,h-4),3.63-3.46(m,8h,h-2,h-5,h-6),3.42(dd,j=9.5,3.3hz,4h,h-3)。
[0455]
13
c nmr(126mhz,dmso-d6)δ163.41(2c,c=o),158.67(2c,arc),154.29(2c,arc),139.39(2c,ch=chconh),132.85(2c,arc),129.16(4c,arch),128.43(2c,arc),120.64(4c,arch),120.32(2c,ch=chconh),116.61(4c,arch),114.65(4c,arch),100.67(2c,c-1),75.60(2c,c-5),73.28(2c,c-3),70.23(2c,c-2),68.14(2c,c-4),66.51(2c,ch2),60.37(2c,c-6)。
[0456]
hplc-ms:[c
44h48
n2o
16
h]
计算值861.31,实际值861.36。
[0457]
hrms:[c
44h48
n2o
16
h]
计算值861.3077,实际值861.3083。
[0458]
二价配体j18
[0459]
将双(4-氨基苯氧基)丙烷(j,11.2mg,43.3μmol)、化合物26(30.8mg,94.4μmol)、hbtu(38.1mg,0.10mmol)溶于二甲基甲酰胺(1ml)中并加入dipea(20μl,0.11mmol)。反应混合物在室温下搅拌,过夜,然后真空干燥。产物j18通过c18柱制备型hplc层析纯化(含1%甲酸的水/乙腈,20%至50%的乙腈梯度)。获得浅黄色固体状的化合物j18(25.9mg,29.6μmol,68%)。
[0460]1h nmr(500mhz,dmso-d6)δ10.02(s,2h,nh),7.63-7.58(m,4h,arh),7.58-7.53(m,4h,arh),7.51(d,j=15.6hz,2h,ch=chconh),7.10-7.05(m,4h,arh),6.96-6.91(m,4h,arh),6.66(d,j=15.7hz,2h,ch=chconh),5.21(s,2h,oh-2),4.89(d,j=7.7hz,4h,h-1,oh-3),4.68(s,2h,oh-6),4.55(s,2h,oh-4),4.10(t,j=6.2hz,4h,ch2ch2ch2),3.70(d,j=3.2hz,2h,h-4),3.63-3.46(m,8h,h-2,h-5,h-6),3.41(dd,j=9.5,3.3hz,2h,h-3),2.20-2.11(m,2h,ch2ch2ch2)。
[0461]
13
c nmr(126mhz,dmso-d6)δ163.39(2c,c=o),158.67(2c,arc),154.47(2c,arc),139.36(2c,ch=chconh),132.70(2c,arc),129.16(4c,arch),128.43(2c,arc),120.63(4c,arch),120.34(2c,ch=chconh),116.61(4c,arch),114.60(4c,arch),100.67(2c,c-1),75.61(2c,c-5),73.28(2c,c-3),70.23(2c,c-2),68.15(2c,c-4),64.37(2c,ch2ch2ch2),60.38(2c,c-6),28.77(1c,ch2ch2ch2)。
[0462]
hplc-ms:[c
45h50
n2o
16
h]
计算值875.32,实际值875.40。
[0463]
hrms:[c
45h50
n2o
16
h]
计算值875.3233,实际值875.3223。
[0464]
二价配体k18
[0465]
将双(4-氨基苯氧基)丁烷(k,11.7mg,43.0μmol)、化合物26(33.3mg,102μmol)、hbtu(37.1mg,97.8μmol)溶于二甲基甲酰胺(1ml)中并加入dipea(20μl,0.11mmol)。反应混合物在室温下搅拌,过夜,然后真空干燥。产物k18通过c18柱制备型hplc层析纯化(含1%甲酸的水/乙腈,25%至45%的乙腈梯度)。获得浅黄色固体状的化合物k18(22.8mg,25.6μmol,60%)。
[0466]1h nmr(500mhz,dmso-d6)δ10.00(s,2h,nh),7.62-758(m,4h,arh),7.58-7.54(m,4h,arh),7.51(d,j=15.6hz,2h,ch=chconh),7.08(d,j=8.7hz,4h,arh),6.94-6.89(m,4h,arh),6.67(d,j=15.7hz,2h,ch=chconh),5.19(d,j=5.2hz,2h,oh-2),4.93-4.84(m,4h,h-1,oh-3),4.67(t,j=5.5hz,2h,oh-6),452(d,j=4.6hz,2h,oh-4),400(d,j=5.7hz,4h,ch2ch2ch2ch2),3.71(t,j=4.2hz,2h,h-4),3.63-3.46(m,8h,h-2,h-5,h-6),3.45-3.39(m,2h,h-3),1.90-1.80(m,4h,ch2ch2ch2ch2)。
[0467]
13
c nmr(126mhz,dmso-d6)δ163.36(2c,c=o),158.65(2c,arc),154.61(2c,arc),139.31(2c,ch=chconh),132.55(2c,arc),129.11(4c,arch),128.44(2c,arc),120.64(2c,arc),120.36(2c,ch=chconh),116.61(4c,arch),114.57(4c,arch),100.69(2c,c-1),75.59(2c,c-5),73.28(2c,c-3),70.23(2c,c-2),68.14(2c,c-4),67.29(2c,ch2ch2ch2ch2),60.37(2c,c-6),25.50(2c,ch2ch2ch2ch2)。
[0468]
hplc-ms:[c
46h52
n2o
16
h]
计算值889.34,实际值889.42。
[0469]
hrms:[c
46h52
n2o
16
h]
计算值889.3423,实际值889.3383。
[0470]
单价配体l18
[0471]
将4-甲氧基苯胺(l,20.8mg,169μmol)、化合物26(33.9mg,104μmol)、hbtu(51.4mg,136μmol)溶于二甲基甲酰胺(1ml)中并加入dipea(30μl,172μmol)。反应混合物在室温下搅拌1小时然后用水稀释并冻干。产物l18通过c18柱制备型hplc层析纯化(含1%甲酸的水/乙腈,15%至40%的乙腈梯度)。获得白色固体状的化合物l18(15.9mg,37μmol,35%)。
[0472]1h nmr(500mhz,dmso-d6)δ10.00(s,1h,nh),7.63-7.58(m,2h,arh),7.58-7.53(m,2h,arh),7.51(d,j=15.7hz,1h,ch=chconh),7.11-7.05(m,2h,arh),6.94-6.86(m,2h,arh),6.66(d,j=15.7hz,1h,ch=chconh),4.89(d,j=7.7hz,1h,h-1),3.73(s,3h,och3),3.71(d,j=3.0hz,1h,h-4),3.63-3.47(m,4h,h-2,h-5,h-6),3.44-3.40(m,1h,h-3)。
[0473]
13
c nmr(126mhz,dmso-d6)δ163.37(1c,c=o),158.65(1c,arc),155.23(1c,arc),139.31(1c,ch=chconh),132.58(1c,arc),129.11(2c,arch),128.43(1c,arc),120.65(2c,arch),120.34(1c,ch=chconh),116.61(2c,arch),113.95(2c,arch),100.69(1c,c-1),75.59(1c,c-5),73.28(1c,c-3),7023(1c,c-2),68.13(1c,c-4),60.37(1c,c-6),55.19(1c,och3)。
[0474]
hplc-ms:[c
22h25
no8 h]
计算值432.17,实际值432.13。
[0475]
hrms:[c
22h25
no8 h]
计算值432.1653,实际值432.1652。
[0476][0477]
方案6:合成基于苯丙酸的二价leca配体。(i)β-d-吡喃半乳糖五乙酸酯(2),bf3.et2o,ch2cl2,0℃至室温,过夜;(ii)naoh,h2o/meoh(1∶1),室温,1小时;(iii)hbtu,dipea,dmf,室温,1小时至3天;o.n.=过夜。
[0478]
3-4-苯基(2
′
,3
′
,4
′
,6
′‑
四-o-乙酰基)-β-d-吡喃半乳糖基丙酸甲酯(28)
[0479]
β-d-吡喃半乳糖五乙酸酯(2,1.5g,3.9mmol)和3-(4-羟基苯基)丙酸甲酯(27,1.4g,7.8mmol)在装有粉状活性分子筛的圆底烧瓶中溶解于无水氯仿(20ml)中。将反应混合物冷却至0℃并滴加bf3·
oet2(2.4ml,19.5mmol)。使混合物升温至室温并搅拌过夜。将反应混合物倒入冰冷的饱和nahco3溶液中并用二氯甲烷稀释。有机相用饱和nahco3溶液和半饱和盐水洗涤,用无水na2so4干燥,过滤并真空浓缩。产物28通过正相mplc(石油醚/乙酸乙酯,15%至50%的乙酸乙酯梯度)纯化。得到白色固体状的化合物28(1.8mg,3.4mmol,86%)。
[0480]1h nmr(500mhz,cdcl3)δ7.15-7.08(m,2h,arh),6.95-6.89(m,2h,arh),5.50-5.43
2),68.18(2c,c-4),60.42(2c,c-6),38.21(2c,ch2ch2conh),30.12(2c,ch2ch2conh)。
[0494]
hplc-ms:[c
42h48
n2o
15
h]
计算值821.31,实际值821.30。
[0495]
hrms:[c
42h48
n2o
15-h]-计算值819.2982,实际值819.2981。
[0496]
二价配体h30
[0497]
将双(4-氨基苯氧基)甲烷(h,11.6mg,50.4μmol)、化合物29(41.5mg,0.13mmol)、hbtu(48.7mg,0.13mmol)溶于二甲基甲酰胺(1ml)中并加入dipea(25μl,0.14mmol)。反应混合物在室温下搅拌3小时然后真空干燥。产物h30通过c18柱制备型hplc层析纯化(含1%甲酸的水/乙腈,15%至40%的乙腈)。获得白色固体状的化合物h30(39.3mg,46.2μmol,92%)。
[0498]1h nmr(500mhz,dmso-d6)δ9.83(s,2h,nh),7.54-7.47(m,4h,arh),7.17-7.11(m,4h,arh),7.04-6.96(m,4h,arh),6.96-6.89(m,4h,arh),5.72(s,2h,och2o),4.76(d,j=7.7hz,2h,h-1),3.68(d,j=3.3hz,2h,h-4),3.57-3.43(m,8h,h-2,h-5,h-6),3.38(dd,j=9.5,3.3hz,2h,h-3),2.83(t,j=7.7hz,4h,ch2ch2conh),2.58-2.52(m,4h,ch2ch2conh)。
[0499]
13
c nmr(126mhz,dmso-d6)δ170.11(2c,c=o),155.87(2c,arc),152.03(2c,arc),134.38(2c,arc),133.97(2c,arc),129.10(4c,arch),120.53(4c,arch),116.48(4c,arch),116.19(4c,arch),101.12(2c,c-1),90.78(1c,och2o),75.47(2c,c-5),73.32(2c,c-3),70.31(2c,c-2),68.18(2c,c-4),60.42(2c,c-6),38.20(2c,ch2ch2conh),30.14(2c,ch2ch2conh)。
[0500]
hplc-ms:[c
43h50
n2o
16
h]
计算值851.32,实际值851.32。
[0501]
hrms:[c
43h5n2o16-h]-计算值849.3088,实际值849.3085。
[0502]
二价配体i30
[0503]
将双(4-氨基苯氧基)乙烷(i,14.6mg,59.8μmol)、化合物29(47.2mg,144μmol)、hbtu(34.9mg,92.0μmol)溶于二甲基甲酰胺(1ml)中并加入dipea(16μl,91.9μmol)。反应混合物在室温下搅拌2天然后真空干燥。产物i30通过c18柱制备型hplc层析纯化(含1%甲酸的水/乙腈,25%至45%的乙腈梯度)。获得白色固体状的化合物i30(6.1mg,7.1μmol,12%)。
[0504]1h nmr(500mhz,dmso-d6)δ9.76(s,2h,nh),7.51-7.45(m,4h,arh),7.18-7.11(m,4h,arh),6.96-6.86(m,8h,arh),4.76(d,j=7.7hz,2h,h-1),4.24(s,4h,ch2),3.68(d,j=3.3hz,2h,h-4),3.56-3.44(m,8h,h-2,h-5,h-6),3.38(dd,j=9.5,3.3hz,2h,h-3),2.84(t,j=7.6hz,4h,ch2ch2conh),2.58-2.52(m,4h,ch2ch2conh)。
[0505]
13
c nmr(126mhz,dmso-d6)δ169.94(2c,c=o),155.84(2c,arc),154.08(2c,arc),134.39(2c,arc),132.67(2c,arc),129.06(4c,arch),120.59(4c,arch),116.19(4c,arch),114.50(4c,arch),101.14(2c,c-1),75.45(2c,c-5),73.31(2c,c-3),70.30(2c,c-2),68.16(2c,c-4),66.48(2c,ch2),60.40(2c,c-6),38.16(2c,ch2ch2conh),30.14(2c,ch2ch2conh)。
[0506]
hplc-ms:[c
44h52
n2o
16
h]
计算值865.34,实际值865.37。
[0507]
hrms:[c
44h52
n2o
16
h]
计算值865.3390,实际值865.3389。
[0508]
二价配体j30
[0509]
将双(4-氨基苯氧基)丙烷(j,11.7mg,45.3μmol)、化合物29(34.3mg,104μmol)、
hbtu(46.1mg,122μmol)溶于二甲基甲酰胺(1ml)中并加入dipea(40μl,227μmol)。反应混合物在室温下搅拌24小时然后真空干燥。产物j30通过c18柱制备型hplc层析纯化(含1%甲酸的水/乙腈,20%至45%的乙腈梯度)。获得白色固体状的化合物j30(16.6mg,18.9μmol,42%)。
[0510]1h nmr(500mhz,dmso-d6)δ9.74(s,2h,nh),7.49-7.44(m,4h,arh),7.17-7.12(m,4h,arh),6.96-6.91(m,4h,arh),6.90-6.85(m,4h,arh),5.11(d,j=5.1hz,2h,oh-2),4.83(d,j=5.6hz,2h,oh-3),4.75(d,j=7.7hz,2h,h-1),4.63(t,j=5.3hz,2h,oh-6),4.47(d,j=4.6hz,2h,oh-4),4.07(t,j=6.3hz,4h,ch2ch2ch2),3.68(t,j=4.1hz,2h,h-4),3.57-3.43(m,8h,h-2,h-5,h-6),3.41-3.36(m,2h,h-3),2.83(t,j=7.7hz,4h,ch2ch2conh),2.56-2.51(m,4h,ch2ch2conh),2.16-2.08(m,2h,ch2ch2ch2)。
[0511]
13
c nmr(126mhz,dmso-d6)δ169.91(2c,c=o),155.83(2c,arc),154.25(2c,arc),134.39(2c,arc),132.52(2c,arc),129.05(4c,arch),120.59(4c,arch),116.18(4c,arch),114.45(4c,arch),101.14(2c,c-1),75.44(2c,c-5),73.31(2c,c-3),70.29(2c,c-2),68.15(2c,c-4),64.34(2c,ch2ch2ch2),60.39(2c,c-6),38.15(2c,ch2ch2conh),30.14(2c,ch2ch2conh),28.74(1c,ch2ch2ch2)。
[0512]
hplc-ms:[c
45h54
n2o
16
h]
计算值879.35,实际值879.39。
[0513]
hrms:[c
45h54
n2o
16
h]
计算值879.3546,实际值879.3538。
[0514]
二价配体k30
[0515]
将双(4-氨基苯氧基)丁烷(k,36.5mg,0.13mmol)、化合物29(104mg,0.32mmol)、hbtu(142mg,0.37mmol)溶于二甲基甲酰胺(3ml)中并加入dipea(60μl,0.34mmol)。反应混合物在室温下搅拌2小时然后真空干燥。产物k30通过c18柱mplc纯化(含1%甲酸的水/乙腈,20%至35%的乙腈梯度)。获得白色固体状的化合物k30(13.7mg,15.3μmol,11%)。
[0516]1h nmr(500mhz,dmso-d6)δ9.77(s,2h,nh),7.49-7.43(m,4h,arh),7.18-7.11(m,4h,arh),6.95-6.89(m,4h,arh),6.89-6.82(m,4h,arh),5.16(d,j=5.2hz,2h,oh-2),4.91(d,j=5.5hz,2h,oh-3),4.76(d,j=7.7hz,2h,h-1),4.68(t,j=5.3hz,2h,oh-6),4.54(d,j=4.6hz,2h,oh-4),3.97(d,j=5.4hz,4h,ch2ch2ch2ch2),3.68(t,j=4.0hz,2h,h-4),3.57-3.42(m,8h,h-2,h-5,h-6),3.41-3.37(m,2h,h-3),2.83(t,j=7.7hz,4h,ch2ch2conh),2.56-2.51(m,4h,ch2ch2conh),1.88-1.78(m,4h,ch2ch2ch2ch2)。
[0517]
13
c nmr(126mhz,dmso-d6)δ169.93(2c,c=o),155.86(2c,arc),154.41(2c,arc),134.40(2c,arc),132.43(2c,arc),129.10(4c,arch),120.60(4c,arch),116.18(4c,arch),114.43(4c,arch),101.12(2c,c-1),75.47(2c,c-5),73.33(2c,c-3),70.31(2c,c-2),68.15(2c,c-4),67.24(2c,ch2ch2ch2ch2),60.40(2c,c-6),38.20(2c,ch2ch2conh),30.19(2c,ch2ch2conh),25.52(2c,ch2ch2ch2ch2)。
[0518]
hplc-ms:[c
46h56
n2o
16
h]
计算值893.37,实际值893.43。
[0519]
hrms:[c
46h56
n2o
16
h]
计算值893.3736,实际值893.3691。
[0520]
单价配体l30
[0521]
将4-甲氧基苯胺(l,12.1mg,98.1μmol)、化合物29(36.4mg,111μmol)、hbtu(47.1mg,124μmol)溶于二甲基甲酰胺(1.5ml)中并加入dipea(20μl,115μmol)。反应混合物在室温下搅拌3小时然后真空干燥。产物l30通过c18柱制备型hplc层析纯化(添加了1%甲
酸的水/乙腈,15%至40%的乙腈梯度)。得到白色固体状的化合物l30(36.7mg,84.7μmol,86%)。
[0522]1h nmr(500mhz,dmso-d6)δ9.73(s,1h,nh),7.50-7.44(m,2h,arh),7.18-7.11(m,2h,arh),6.96-6.91(m,2h,arh),6.88-6.82(m,2h,arh),4.75(d,j=7.7hz,1h,h-1),3.71(s,3h,ch3),3.68(d,j=3.3hz,1h,h-4),3.57-3.43(m,4h,h-2,h-5,h-6),3.38(dd,j=9.5,3.3hz,2h,h-3),2.83(t,j=7.7hz,2h,ch2ch2conh),2.54(dd,j=8.6,6.8hz,2h,ch2ch2conh)。
[0523]
13
c nmr(126mhz,dmso-d6)δ169.91(1c,c=o),155.84(1c,arc),155.04(1c,arc),134.39(1c,arc),132.42(1c,arc),129.05(2c,arch),120.62(2c,arch),116.18(2c,arch),113.80(2c,arch),101.14(1c,c-1),75.44(1c,c-5),73.31(1c,c-3),70.30(1c,c-2),68.15(1c,c-4),60.40(1c,c-6),55.14(1c,ch3),38.14(1c,ch2ch2conh),30.15(1c,ch2ch2conh)。
[0524]
hplc-ms:[c
22h27
no8 h]
计算值434.18,实际值434.08。
[0525]
hrms:[c
22h27
no8 h]
计算值434.1809,实际值434.1809。
[0526][0527]
方案7:合成基于吡啶的二价leca配体。反应条件:(i)2-氯-5-硝基吡啶,nah,室温,dmf,1小时至2天(对于m是k2co3,65℃,dmf,5天);(ii)pd/c,h2,室温,3小时至4小时;(iii)相应的半乳糖苷(26或29),hbtu,dipea,dmf,室温,过夜。
[0528]
合成双氨基吡啶m至o的一般程序
[0529]
将相应的二醇(1当量)、2-氯-5-硝基吡啶(2当量至3当量)和氢化钠(3当量,在矿物油中含量为60%)溶解在无水二甲基甲酰胺(1.5ml)中并在室温下搅拌1小时至2天(对于m,使用了3.5当量的碳酸钾,t=65℃,5天)。将反应混合物用冰冷的水和二氯甲烷稀释。有机相用半饱和盐水洗涤,用无水na2so4干燥,过滤并真空浓缩。双硝基中间体通过正相mplc(石油醚/乙酸乙酯,5%至20%的乙酸乙酯梯度)纯化。然后将纯双硝基中间体溶解在二氯甲烷/甲醇(2∶1)中,加入10%pd/c(0.2当量)。在三个真空/h2循环后,将反应混合物在h2气氛(1个标准大气压)下搅拌3小时至4小时。将反应混合物通过硅藻土过滤并真空浓缩。无需进一步纯化即可获得纯产物。
[0530]
1,2-双((5-氨基吡啶-2-基)氧基)乙烷(m)
[0531]
按照合成双氨基吡啶的一般程序,使用乙二醇(50μl,0.89mmol)、2-氯-5-硝基吡啶(436mg,2.75mmol)和碳酸钾(438mg,3.5mmol),得到浅棕色固体状的化合物m(69.0mg,0.28mmol,31%,经过两步骤)。
[0532]1h nmr(500mhz,甲醇-d4)δ7.61(dd,j=2.9,0.7hz,2h arh),7.17(dd,j=8.7,2.9hz,2h,arh),6.65(dd,j=8.7,0.7hz,2h,arh),4.44(s,4h,ch2)。
[0533]
13
c nmr(126mhz,甲醇-d4)δ158.46(2c,arc),139.63(2c,arc),133.72(2c,arch),129.40(2c,arch),111.82(2c,arch),65.88(2c,ch2)。
[0534]
hplc-ms:[c
12h14
n4o2 na]
计算值269.10,实际值269.05。
[0535]
hrms:[c
12h14
n4o2 h]
计算值247.1190,实际值247.1187。
[0536]
1,3-双((5-氨基吡啶-2-基)氧基)丙烷(n)
[0537]
按照合成双氨基吡啶的一般程序,使用丙烷-1,3-二醇(50μl,0.89mmol)、2-氯-5-硝基吡啶(279mg,1.76mmol)和氢化钠(83mg,2.1mmol),得到棕色固体状的化合物n(111.4mg,0.43mmol,62%,经过两步骤)。
[0538]1h nmr(500mhz,甲醇-d4)δ7.60(d,j=2.8hz,2h,arh),7.17(dd,j=8.7,2.9hz,2h,arh),6.64(d,j=8.7hz,2h,arh),4.29(t,j=6.3hz,4h,ch2ch2ch2),2.16(p,j=6.3hz,2h,ch2ch2ch2)。
[0539]
13
c nmr(126mhz,甲醇-d4)δ158.76(2c,arc),139.35(2c,arc),133.81(2c,arch),129.48(2c,arch),111.65(2c,arch),64.18(2c,ch2ch2ch2),30.21(1c,ch2ch2ch2)。
[0540]
hplc-ms:[c
13h16
n4o2 h]
计算值261.13,实际值261.07。
[0541]
hrms:[c
13h16
n4o2 h]
计算值261.1346,实际值261.1340。
[0542]
1,4-双((5-氨基吡啶-2-基)氧基)丁烷(o)
[0543]
按照合成双氨基吡啶的一般程序,使用丁烷-1,4-二醇(50μl,0.56mmol)、2-氯-5-硝基吡啶(284mg,1.79mmol)和氢化钠(72mg,3.2mmol),得到双硝基中间体(143mg,0.43mmol,76%,经过两步骤)。将双硝基中间体(125mg,0.38mmol)还原,得到棕色固体状的纯化合物o(104mg,0.38mmol,76%,经过两步骤)。
[0544]1h nmr(500mhz,甲醇-d4)δ7.60(d,j=2.9hz,2h,arh),7.17(dd,j=8.7,2.9hz,2h,arh),6.62(d,j=8.7hz,2h,arh),4.22-4.16(m,4h,ch2ch2ch2ch2),1.93-1.85(m,4h,ch2ch2ch2ch2)。
[0545]
13
c nmr(126mhz,甲醇-d4)δ158.86(2c,arc),139.36(2c,arc),133.78(2c,arch),129.47(2c,arch),111.62(2c,arch),67.09(2c,ch2ch2ch2ch2),27.05(2c,ch2ch2ch2ch2)。
[0546]
hplc-ms:[c
14h18
n4o2 h]
计算值275.15,实际值275.10。
[0547]
hrms:[c
14h18
n4o2 h]
计算值275.1503,实际值275.1497。
[0548]
二价配体m31
[0549]
将1,2-双((5-氨基吡啶-2-基)氧基)乙烷(m,12.1mg,49.1μmol)、化合物29(46.4mg,141μmmol)、hbtu(60.2mg,159μmol)溶于二甲基甲酰胺(1.5ml)中并加入dipea(50μl,287μmol)。反应混合物在室温下搅拌,过夜,然后冻干。产物m31(19.6mg,22.6μmol,46%)通过c18柱制备型hplc层析纯化(添加了1%甲酸的水/乙腈,15%至30%的乙腈梯度)。获得浅黄色固体状的化合物m31(19.6mg,22.6μmol,46%)。
[0550]1h nmr(500mhz,dmso-d6)δ9.93(s,2h,nh),8.32(d,j=2.6hz,2h,arh),7.88(dd,j
=8.9,2.7hz,2h,arh),7.18-7.12(m,4h,arh),6.97-6.91(m,4h,arh),6.81(d,j=8.9hz,2h,arh),4.76(d,j=7.7hz,2h,h-1),4.51(s,4h,ch2),3.68(d,j=3.3hz,2h,h-4),3.57-3.44(m,8h,h-2,h-5,h-6),3.38(dd,j=9.5,3.3hz,2h,h-3),2.85(t,j=7.7hz,4h,ch2ch2conh),2.57(t,j=7.7hz,4h,ch2ch2conh)。
[0551]
13
c nmr(126mhz,dmso-d6)δ170.47(2c,c=o),158.88(2c,arc),155.86(2c,arc),137.33(2c,arch),134.24(2c,arc),131.48(2c,arch),130.30(2c,arc),129.06(4c,arch),116.20(4c,arch),110.35(2c,arch),101.12(2c,c-1),75.45(2c,c-5),73.31(2c,c-3),70.30(2c,c-2),68.16(2c,c-4),64.05(4c,ch2),60.40(2c,c-6),37.98(2c,ch2ch2conh),30.03(2c,ch2ch2conh)。
[0552]
hplc-ms:[c
42h50
n4o
16
h]
计算值867.33,实际值867.35。
[0553]
hrms:[c
42h50
n4o
16
h]
计算值867.3295,实际值867.3296。
[0554]
二价配体n31
[0555]
将1,3-双((5-氨基吡啶-2-基)氧基)丙烷(n,14.7mg,56.5μmol)、化合物29(40.7mg,124μmmol)、hbtu(49.8mg,131μmol)溶于二甲基甲酰胺(1.5ml)中并加入dipea(50μl,287μmol)。反应混合物在室温下搅拌,过夜,然后冻干。产物n31通过c18柱制备型hplc层析纯化(添加了1%甲酸的水/乙腈,15%至40%的乙腈梯度)。得到白色固体状的化合物n31(20.2mg,22.9μmol,41%)。
[0556]1h nmr(500mhz,dmso-d6)δ9.91(s,2h,nh),8.30(d,j=2.7hz,2h,arh),7.86(dd,j=8.9,2.7hz,2h,arh),7.15(d,j=8.3hz,4h,arh),6.99-6.89(m,4h,arh),6.78(d,j=8.9hz,2h,arh),5.12(d,j=5.2hz,2h,oh-2),4.84(d,j=5.6hz,2h,oh-3),4.76(d,j=7.7hz,2h,h-1),4.63(t,j=5.2hz,2h,oh-6),4.48(d,j=4.6hz,2h,oh-4),4.33(t,j=6.3hz,4h,ch2ch2ch2),3.68(t,j=4.0hz,2h,h-4),3.60-3.43(m,8h,h-2,h-5,h-6),3.41-3.37(m,2h,h-3),2.84(t,j=7.6hz,4h,ch2ch2conh),2.57(t,j=7.7hz,4h,ch2ch2conh),2.12(p,j=6.3hz,2h,ch2ch2ch2)。
[0557]
13
c nmr(126mhz,dmso-d6)δ170.45(2c,c=o),159.14(2c,arc),155.87(2c,arc),137.48(2c,arch),134.25(2c,arc),131.40(2c,arch),130.12(2c,arc),129.07(4c,arch),116.20(4c,arch),110.23(2c,arch),101.13(2c,c-1),75.45(2c,c-5),73.32(2c,c-3),70.30(2c,c-2),68.15(2c,c-4),62.49(2c,ch2ch2ch2),60.40(2c,c-6),37.97(2c,ch2ch2conh),30.05(2c,ch2ch2conh),28.35(1c,ch2ch2ch2)。
[0558]
hplc-ms:[c
43h52
n4o
16
h]
计算值881.35,实际值881.33。
[0559]
hrms:[c
43h52
n4o
16
h]
计算值881.3451,实际值881.3446。
[0560]
二价配体o31
[0561]
将1,4-双((5-氨基吡啶-2-基)氧基)丁烷(o,10.5mg,38.3μmol)、化合物29(46.5mg,142μmmol)、hbtu(45.5mg,120μmol)溶于二甲基甲酰胺(1.5ml)中并加入dipea(40μl,230μmol)。反应混合物在室温下搅拌,过夜,然后冻干。产物o31通过c18柱制备型hplc层析纯化(添加了1%甲酸的水/乙腈,15%至45%的乙腈梯度)。得到白色固体状的化合物o31(16.2mg,18.1μmol,47%)。
[0562]1h nmr(500mhz,dmso-d6)δ9.90(s,2h,nh),8.29(d,j=2.7hz,2h,arh),7.86(dd,j=8.9,2.7hz,2h,arh),7.17-7.12(m,4h,arh),6.96-6.91(m,4h,arh),6.76(d,j=8.8hz,
4.82(m,4h,h-1,oh-3),4.67(s,2h,oh-6),4.53(s,2h,oh-4),4.37(t,j=6.4hz,4h,ch2ch2ch2),3.71(d,j=3.0hz,2h,h-4),3.64-3.45(m,8h,h-2,h-5,h-6),3.45-3.39(m,2h,h-3),2.16(p,j=6.4hz,2h,ch2ch2ch2)。
[0575]
13
c nmr(126mhz,dmso-d6)δ163.82(2c,c=o),159.26(2c,arc),158.77(2c,arc),139.97(2c,ch=chconh),137.51(2c,arch),131.32(2c,arch),130.35(2c,arc),129.24(4c,arch),128.26(2c,arc),119.65(2c,ch=chconh),116.62(2c,arch),110.35(2c,arch),100.67(2c,c-1),75.60(2c,c-5),73.27(2c,c-3),70.22(2c,c-2),68.13(2c,c-4),62.54(2c,ch2ch2ch2),60.36(2c,c-6),28.38(1c,ch2ch2ch2)。
[0576]
hplc-ms:[c
43h48
n4o
16
h]
计算值877.31,实际值877.32。
[0577]
hrms:[c
43h48
n4o
16
h]
计算值877.3138,实际值877.3138。
[0578][0579]
方案8:合成磺化二价leca配体。反应条件:(i)雷尼ni,h2,室温,h2o,6天;(ii)半乳糖苷29,pybop,n-甲基吗啉,dmf,室温,过夜。
[0580]
6,6
′‑
(乙烷-1,2-二基)双(3-氨基苯磺酸)(34)
[0581]
根据bazanova等人的程序合成化合物34。
[8]
在加入1滴饱和naoh水溶液和雷尼镍后,将4,4
′‑
二氨基芪-2,2
′‑
二磺酸(33,235.5mg,0.64mmol)溶解在水(10ml)中。在三个真空/h2循环后,将反应混合物在h2气氛(1个标准大气压)下搅拌4天。将反应混合物通过硅藻土过滤并冻干。转换未完成;因此,将反应粗品重新溶解在水(5ml)和1滴饱和naoh水溶液中。添加雷尼镍,在三个真空/h2循环后,将反应在h2气氛(1个标准大气压)下再搅拌2天。将反应混合物通过硅藻土过滤并冻干。将反应粗品重新溶解在水(10ml)中并且在用hcl(2m)酸化后沉淀出白色固体状的纯产物34(150.6mg,0.40mmol,64%)。
[0582]1h nmr(500mhz,d2o)δ7.28(dd,j=2.4,0.9hz,2h,arh),7.13(d,j=8.0hz,2h,arh),6.85(ddd,j=8.1,2.5,0.9hz,2h,arh),3.15(s,4h,ch2)。
[0583]
13
c nmr(126mhz,d2o)δ144.12(2c,arc),141.07(2c,arc),132.63(2c,arch),130.22(2c,arc),119.20(2c,arch),114.50(2c,arch),33.46(2c,ch2)。
[0584]
hplc-ms:[c
14h16
n2o6s
2-h]-计算值371.0377,实际值370.93。
[0585]
二价配体(35)
[0586]
将磺化接头34(21.6mg,58.0μmol)、半乳糖苷29(59.0mg,198μmol)和pybop(74.3mg,143μmol)悬浮在二甲基甲酰胺(1.5ml)中并加入n-甲基吗啉(50μl,455μmol)。反应混合物在室温下搅拌过夜,然后冻干。产物35通过c18柱制备型hplc层析纯化(ph 7的5mm碳酸氢铵/乙腈,5%至20%的乙腈梯度)。得到白色固体状的化合物35(30.4mg,29.6μmol,
51%)。
[0587]1h nmr(500mhz,dmso-d6)δ9.88(s,2h,nh),7.85(d,j=2.3hz,2h,arh),7.59(dd,j=8.2,2.3hz,2h,arh),7.19(d,j=8.3hz,2h,arh),7.17-7.13(m,4h,arh),6.98-6.89(m,4h,arh),4.77(d,j=7.7hz,2h,h-1),3.67(d,j=3.3hz,2h,h-4),3.57-3.44(m,8h,h-2,h-5,h-6),3.38(dd,j=9.8,3.6hz,2h,h-3),3.18(s,4h,arch2ch2ar),2.84(t,j=7.7hz,4h,ch2ch2conh),2.55(t,j=7.6hz,4h,ch2ch2conh)。
[0588]
13
c nmr(126mhz,dmso-d6)δ170.26(2c,c=o),155.88(2c,arc),146.15(2c,arc),135.89(2c,arc),135.24(2c,arc),134.48(2c,arc),130.49(2c,arch),129.13(4c,arch),119.37(2c,arch),117.98(2c,arch),116.24(4c,arch),101.17(2c,c-1),75.46(2c,c-5),73.32(2c,c-3),70.36(2c,c-2),68.21(2c,c-4),60.41(2c,c-6),38.34(2c,ch2ch2conh),33.77(2c,arch2ch2ar),30.24(2c,ch2ch2ch2ch2)。
[0589]
hplc-ms:[c
44h52
n2o
20s2-2h]
2-计算值495.12,实际值495.11。
[0590]
hrms:[c
44h52
n2o
20s2-h]-计算值991.2482,实际值991.2531。
[0591][0592]
表3:根据joachim等人所述进行的基于荧光偏振的竞争性结合测定中酰胺二价leca配体的评估。
[9]
二价配体显示出陡峭的滴定斜率,表明已达到测定下限。在存在25%
dmso的tbs/ca
2
缓冲液(20mm tris,137mm nacl,2.6mm kcl,ph 7.4,辅以1mm cacl2)中进行测定。来自至少三个独立滴定的平均值和标准偏差,每个滴定重复三次。
[0593]
[0594][0595]
表5:通过itc确定的二价配体35的结合亲和力。滴定于25℃下在tbs/ca
2
缓冲液(20mm tris,137mm nacl,2.6mm kcl,ph 7.4,辅以1mm cacl2)中进行。
movement inhibitor of a nyctinastic weed,sesbania exaltata cory,designed on a naturally occurring leaf-opening substance and its application to a potential,highly selective herbicide,”tetrahedron lett.,vol.43,no.43,pp.7655-7658,2002.
[0605]
[8]i.n.bazanova,n.v.kholodkova and v.p.gostikin,“reduction of 4,4
′‑
dinitrostilbene-2,2
′‑
disulfonic acid with hydrogen on raney nickel,”russ.j.appl.chem.,vol.75,no.3,pp.436-440,2002.
[0606]
[9]i.joachim,s.rikker,d.hauck,d.ponader,s.boden,r.sommer,l.hartmann and a.titz,“development and optimization of a competitive binding assay for the galactophilic low affinity lectin leca from pseudomonas aeruginosa,”org.biomol.chem.,vol.14,pp.7933-7948,2016.
[0607]
[10]e.zahorska,s.kuhaudomlarp,s.minervini,s.yousaf,m.lepsik,t.kinsinger,a.k.h.hirsch,a.imberty and a.titz,“a rapid synthesis of low-nanomolar divalent leca inhibitors in four linear steps from d-galactose,”chem.commun.,vol.56,pp.8822-8825,2020.
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。