1.本发明属于医药技术领域,具体涉及一种药物组合物及其应用。
背景技术:
2.已知上市药物瑞德西韦(rdv),是一种前药,在细胞内转化成活性的三磷酸形式,作为核苷酸类似物被rna依赖性rna聚合酶(rdrp)作为底物使用,插入到正在延长的rna链中,阻断rdrp的复制。冷冻电镜结构也显示,双链rna模板占据rdrp的中心,而瑞德西韦共价插入引物链,终止引物连的延伸。不过,目前瑞德西韦的临床运用尚被限定在中重度住院或需要补充氧气的患者群体,且需要通过静脉输注,存在一定不便。另外,在中国国内的iii期临床试验表明,其并未带来有统计学意义的疗效。
3.又已知莫那比拉韦eidd-2801是核糖核苷类似物eidd-1931的口服生物可利用的异丙酯前药。eidd-2801显示出广泛的抗流感病毒(influenza virus)和冠状病毒(coronaviruses)的活性,如sars-cov-2,mers-cov,sars-cov。eidd-2801有用于covid-19和季节性、流行性流感的潜力。eidd-2801的治疗原理是释出一种名为nhc的化合物并渗入新冠病毒基因内,并在病毒自我复制时造成大量变异,从而杀死病毒。但美国多名专家指出,nhc可能会改变人体细胞基因并致癌。
4.根据已发表的文章(design and development of an oral remdesivir derivative vv116 against sars-co v-2.cell research(2021)31:1212-1214)内容,研究人员验证了瑞德西韦(rdv)及其母体核苷(gs-441524)对sars-cov-2复制的抑制作用,并且确认了gs-441524比rdv更强的病毒复制抑制。因此,研究人员在gs-441524不同位点引进修饰性基团(卤素、羟基或氰基),对其进行改造,以提高对sars-cov-2的成药性,特别是口服给药性的可能性。
[0005][0006]
研究人员为了提高口服生物利用度,通过在核糖片段的2'-、3'-和5'-位置引入单酯、二酯和三酯来设计几种酯前药,并检测相关化合物pk特性。通过一系列理化参数、稳定性、pk特性、生物利用度等数据的检测,最终确定vv116;体内外试验研究证实,vv116具有良好的抗新冠作用。同时,对于vv116类似物,也有多篇文献报道vv116类似物具有良好的抗新冠病毒作用。
[0007]
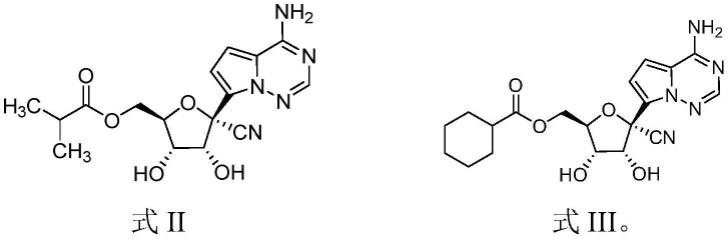
专利申请wo2021213288a1公开了式ii化合物:
[0008][0009]
该化合物体外试验证明其具有较强的抗新冠病毒作用,10μm和5μm浓度的a50对于sars-cov-2的复制抑制率均为99%,ec
50
为0.23μm。
[0010]
专利申请cn113735862a公开了式iii化合物:
[0011][0012]
该化合物同样也具备良好的体外抗新冠作用。10μm浓度的该化合物对于sars-cov-2的复制抑制率达98.23%,其抑制sars-cov-2的ic
50
为0.26μm。
[0013]
但是,对于上述化合物,目前仅有相关活性研究,还没有以上述化合物作为活性成分的药物组合物或药物制剂的报道。鉴于当前新冠病毒防疫形式,急需开发一种口服,低毒,高效的抗新冠病毒药物。
技术实现要素:
[0014]
本发明所要解决的技术问题是克服现有技术中的不足,提供一种药物组合物及其应用。本发明包含4-氨基吡咯并[2,1-f][1,2,4]三嗪衍生物的药物组合物作为抗新冠病毒药物可以口服给药,并且具有高的溶出度、良好的稳定性、优化的质量变化。
[0015]
为解决以上技术问题,本发明采取的技术方案是:
[0016]
一种药物组合物,包括式i化合物或其药学上可接受的盐和辅料;
[0017][0018]
其中,r1选自取代或未取代的c
1-6
烷基、c
1-6
烯基、c
1-6
炔基、c
3-8
环烷基或c
3-7
杂环基;
[0019]
优选地,取代的c
1-6
烷基为c
1-6
卤代烷基;
[0020]
优选地,r1选自未取代的c
1-6
烷基或c
3-8
环烷基;
[0021]
更优选地,辅料包括填充剂、崩解剂及润滑剂。
[0022]
优选地,式i化合物选自式ii化合物或式iii化合物,
[0023][0024]
优选地,填充剂选自乳糖、淀粉、改性淀粉、甘露醇、山梨醇、糊精衍生物、纤维素衍生物、硫酸钙、碳酸钙和磷酸氢钙中的一种或多种;
[0025]
优选地,糊精衍生物选自糊精和/或麦芽糖糊精;
[0026]
纤维素衍生物选自微晶纤维素和/或纤维素;
[0027]
更优选地,填充剂选自微晶纤维素、乳糖、甘露醇和山梨醇中的一种或多种。
[0028]
优选地,崩解剂选自交联羧甲基纤维素钠、交联聚维酮、淀粉、预胶化淀粉、羧甲基淀粉钠、羟丙基淀粉、微晶纤维素和低取代羟丙基纤维素中的一种或多种;
[0029]
优选地,崩解剂选自交联羧甲基纤维素钠、预胶化淀粉和羧甲基淀粉钠中的一种或多种。
[0030]
优选地,润滑剂选自硬脂酸、硬脂酸钙、硬脂酸镁、氢化植物油、巴西棕榈蜡、滑石粉、聚乙二醇和硬脂富马酸钠中的一种或多种;
[0031]
优选地,润滑剂选自硬脂酸镁和/或硬脂富马酸钠。
[0032]
优选地,药物组合物,以重量百分比计,包括:
[0033][0034]
优选地,以重量百分比计,包括:
[0035][0036]
更优选地,以重量百分比计,包括:
[0037][0038]
为解决以上技术问题,本发明采取的又一技术方案是:
[0039]
一种药物制剂,包括如上所述的药物组合物;
[0040]
优选地,药物制剂为胶囊剂或片剂。
[0041]
解决以上技术问题,本发明采取的又一技术方案是:
[0042]
一种如上所述的药物制剂的制备方法,包括如下步骤:将处方量的式i化合物或其药学上可接受的盐、填充剂、崩解剂及润滑剂混合均匀,通过胶囊充填机灌装成胶囊或通过压片机压成片剂。
[0043]
解决以上技术问题,本发明采取的又一技术方案是:
[0044]
一种如上所述的药物制剂的制备方法,包括如下步骤:将处方量的式i化合物或其药学上可接受的盐、填充剂及崩解剂混合均匀,加入溶剂,制湿颗粒,干燥后加入润滑剂,混合均匀,通过胶囊充填机灌装成胶囊或通过压片机压成片剂;
[0045]
优选地,溶剂选自水和/或乙醇。
[0046]
解决以上技术问题,本发明采取的再一技术方案是:
[0047]
如上所述的药物组合物或如上所述的药物制剂在制备治疗和/或预防冠状病毒引起的疾病的药物中的应用
[0048]
优选地,冠状病毒为covid-19。
[0049]
由于以上技术方案的采用,本发明与现有技术相比具有如下优点:
[0050]
1、本发明包含4-氨基吡咯并[2,1-f][1,2,4]三嗪衍生物的药物组合物作为抗新冠病毒药物可以口服给药;
[0051]
2、本发明通过对辅料组合和用量的筛选,解决了混合均匀度、含量均匀度和溶出偏慢的问题,药物组合物或药物制剂具有高的溶出度、改进的含量均匀度、优良的药代动力学性质;
[0052]
3、本发明制备方法简单,成本低廉,节能环保,易于产业化应用;
[0053]
4、本发明药物组合物或药物制剂具有良好的稳定性,在高温、高湿及光照条件下,本发明的药物组合物含量稳定,有关物质无显著性增长,口服给药相较于已上市制剂,服用方便,效果更优;
[0054]
5、本发明药物组合物或药物制剂口服给药,体外溶出效果好,在37℃,75rpm,桨法,900ml ph1.0盐酸溶液(模拟胃液)的条件下,体外溶出度试验45min累积溶出度在90%以上。
具体实施方式
[0055]
为使本发明的技术方案和有益效果能够更加明显易懂,下面通过结合列举具体实
施例的方式进行详细说明。应理解,这些实施例仅用于说明本发明而不用于限制本发明的范围。下列实施例中未注明具体条件的实验方法,通常按照常规实验条件。
[0056]
本发明药物组合物,包括式i化合物或其药学上可接受的盐和辅料;
[0057][0058]
其中,r1选自取代或未取代的c
1-6
烷基、c
1-6
烯基、c
1-6
炔基、c
3-8
环烷基或c
3-7
杂环基;
[0059]
在一些具体的实施例中,取代的c
1-6
烷基为c
1-6
卤代烷基。
[0060]
在一些具体的实施例中,r1选自未取代的c
1-6
烷基或c
3-8
环烷基。
[0061]
在一些具体的实施例中,式i化合物选自式ii化合物或式iii化合物,
[0062][0063]
在一些具体的实施例中,辅料包括填充剂、崩解剂及润滑剂。
[0064]
在一些具体的实施例中,填充剂选自乳糖、淀粉、改性淀粉、甘露醇、山梨醇、糊精衍生物、纤维素衍生物、硫酸钙、碳酸钙和磷酸氢钙中的一种或多种;其中,糊精衍生物选自糊精和/或麦芽糖糊精,纤维素衍生物选自微晶纤维素和/或纤维素。
[0065]
在一些具体的实施例中,填充剂选自微晶纤维素、乳糖、甘露醇和山梨醇中的一种或多种,更优选为微晶纤维素与乳糖的组合,甘露醇与山梨醇的组合。
[0066]
在一些具体的实施例中,崩解剂选自交联羧甲基纤维素钠、交联聚维酮、淀粉、预胶化淀粉、羧甲基淀粉钠、羟丙基淀粉、微晶纤维素和低取代羟丙基纤维素中的一种或多种。
[0067]
在一些具体的实施例中,崩解剂选自交联羧甲基纤维素钠、预胶化淀粉和羧甲基淀粉钠中的一种或多种,更优选为交联羧甲基纤维素钠与预胶化淀粉的组合。
[0068]
在一些具体的实施例中,润滑剂选自硬脂酸、硬脂酸钙、硬脂酸镁、氢化植物油、巴西棕榈蜡、滑石粉、聚乙二醇和硬脂富马酸钠中的一种或多种,更优选为硬脂酸镁和硬脂富马酸钠的组合。
[0069]
在一些具体的实施例中,药物组合物,以重量百分比计,包括:
[0070][0071]
在一些具体的实施例中,药物组合物,以重量百分比计,包括:
[0072][0073]
在一些具体的实施例中,药物组合物,以重量百分比计,包括:
[0074][0075]
在某一具体的实施例中,药物组合物,以重量百分比计,包括:
[0076][0077][0078]
在某一具体的实施例中,药物组合物,以重量百分比计,包括:
[0079][0080]
在某一具体的实施例中,药物组合物,以重量百分比计,包括:
[0081][0082]
在某一具体的实施例中,药物组合物,以重量百分比计,包括:
[0083][0084]
在某一具体的实施例中,药物组合物,以重量百分比计,包括:
[0085][0086]
其中,甘露醇和山梨醇的重量比为1:1,
[0087]
交联羧甲基纤维素钠和预胶化淀粉的重量比为1:1,
[0088]
硬脂酸镁和硬脂富马酸钠的重量比为1:1。
[0089]
在某一具体的实施例中,药物组合物,以重量百分比计,包括:
[0090][0091]
其中,微晶纤维素和乳糖的重量比为1:1,
[0092]
交联羧甲基纤维素钠和预胶化淀粉的重量比为1:1,
[0093]
硬脂酸镁和硬脂富马酸钠的重量比为1:1。
[0094]
在某一具体的实施例中,药物组合物,以重量百分比计,包括:
[0095][0096]
其中,甘露醇、山梨醇、微晶纤维素和乳糖的重量比为1:1:1:1,
[0097]
交联羧甲基纤维素钠和预胶化淀粉的重量比为1:1,
[0098]
硬脂酸镁和硬脂富马酸钠的重量比为1:1。
[0099]
在某一具体的实施例中,药物组合物,以重量百分比计,包括:
[0100][0101][0102]
在某一具体的实施例中,药物组合物,以重量百分比计,包括:
[0103][0104]
在某一具体的实施例中,药物组合物,以重量百分比计,包括:
[0105][0106]
在某一具体的实施例中,药物组合物,以重量百分比计,包括:
[0107]
[0108]
在某一具体的实施例中,药物组合物,以重量百分比计,包括:
[0109][0110]
其中,甘露醇和山梨醇的重量比为1:1,
[0111]
交联羧甲基纤维素钠和预胶化淀粉的重量比为1:1,
[0112]
硬脂酸镁和硬脂富马酸钠的重量比为1:1。
[0113]
在某一具体的实施例中,药物组合物,以重量百分比计,包括:
[0114][0115]
其中,微晶纤维素和乳糖的重量比为1:1,
[0116]
交联羧甲基纤维素钠和预胶化淀粉的重量比为1:1,
[0117]
硬脂酸镁和硬脂富马酸钠的重量比为1:1。
[0118]
在某一具体的实施例中,药物组合物,以重量百分比计,包括:
[0119][0120]
其中,甘露醇、山梨醇、微晶纤维素和乳糖的重量比为1:1:1:1,
[0121]
交联羧甲基纤维素钠和预胶化淀粉的重量比为1:1,
[0122]
硬脂酸镁和硬脂富马酸钠的重量比为1:1。
[0123]
一种药物制剂,包括如上所述的药物组合物。
[0124]
在一些具体的实施例中,药物制剂为胶囊剂或片剂。
[0125]
一种如上所述的药物制剂的制备方法,包括如下步骤:将处方量的式i化合物或其药学上可接受的盐、填充剂、崩解剂及润滑剂混合均匀,通过胶囊充填机灌装成胶囊或通过压片机压成片剂。
[0126]
在一些具体的实施例中,制备方法包括如下步骤:
[0127]
将处方量的式i化合物或其药学上可接受的盐、填充剂、崩解剂及润滑剂先通过筛
网备用,筛网选用30-50目筛,优选为40目筛;
[0128]
使用混合器混合均匀后,通过胶囊充填机灌装成胶囊或通过压片机压成片剂。
[0129]
一种如上所述的药物制剂的制备方法,包括如下步骤:将处方量的式i化合物或其药学上可接受的盐、填充剂及崩解剂混合均匀,加入溶剂,制湿颗粒,干燥后加入润滑剂,混合均匀,通过胶囊充填机灌装成胶囊或通过压片机压成片剂,在一些具体的实施例中,溶剂选自水和/或乙醇。
[0130]
在一些具体的实施例中,制备方法包括如下步骤:
[0131]
将处方量的式i化合物或其药学上可接受的盐、填充剂、崩解剂及润滑剂先通过筛网备用,筛网选用30-50目筛,优选为40目筛;
[0132]
取处方量的式i化合物或其药学上可接受的盐(原料药)、填充剂、崩解剂,用混合器混合均匀,用体积分数为50%的乙醇溶液制软材,用高速剪切制湿颗粒,湿颗粒在65℃以下沸腾干燥,整粒后,加入润滑剂混合均匀,通过胶囊充填机灌装成胶囊或通过压片机压成片剂。
[0133]
本发明药物组合物或药物制剂应用于制备治疗和/或预防冠状病毒引起的疾病的药物中,冠状病毒为covid-19。
[0134]
本发明的具体实施例中对含量、有关物质、溶出度、体外溶出度等评价指标的检测方法如下:
[0135]
有关物质检测方法
[0136]
式ii化合物的有关物质测定方法
[0137]
照高效液相色谱法(2020版中国药典通则0512)测定。
[0138]
供试品溶液:取本品细粉适量,精密称定,加稀释剂溶解(必要时超声5~10分钟)并定量稀释(稀释剂30%乙腈)制成每1ml中约含式ii化合物0.1mg的溶液,离心,取上清液作为供试品溶液。
[0139]
对照品溶液:精密量取供试品溶液1ml置100ml量瓶中,用稀释剂稀释并定容至刻度,作为对照品溶液。
[0140]
系统适用性溶液:空白溶剂对测定无干扰。
[0141]
色谱条件:用十八烷基硅烷键合硅胶为填充剂;以磷酸水溶液(量取纯化水1000ml,用1%磷酸调节ph值至4.5)为流动相a,以乙腈为流动相b,按下表进行梯度洗脱,
[0142][0143]
柱温:35℃,检测波长240nm,进样体积10μl,样品盘温度5℃。
[0144]
测定法:精密量取供试品溶液与对照品溶液,分别注入液相色谱仪,记录色谱图至主成分峰保留时间的2倍。
[0145]
式iii化合物的有关物质测定方法
[0146]
照高效液相色谱法(2020版中国药典通则0512)测定。
[0147]
供试品溶液:取本品细粉适量,精密称定,加稀释剂溶解(必要时超声5~10分钟)并定量稀释(稀释剂80%乙腈)制成每1ml中约含式iii化合物0.1mg的溶液,离心,取上清液作为供试品溶液。
[0148]
对照品溶液:精密量取供试品溶液1ml置100ml量瓶中,用稀释剂稀释并定容至刻度,作为对照品溶液。
[0149]
系统适用性溶液:空白溶剂对测定无干扰。
[0150]
色谱条件:用十八烷基硅烷键合硅胶为填充剂;以磷酸水溶液(量取纯化水1000ml,用1%磷酸调节ph值至4.5)为流动相a,以乙腈为流动相b,按下表进行梯度洗脱,
[0151][0152]
柱温:35℃,检测波长240nm,进样体积10μl,样品盘温度5℃。
[0153]
测定法:精密量取供试品溶液与对照品溶液,分别注入液相色谱仪,记录色谱图至主成分峰保留时间的2倍。
[0154]
溶出检测方法
[0155]
式iii化合物的体外溶出度试验方法
[0156]
对含式iii化合物的药物组合物及对比例进行体外溶出度试验(溶出样品规格:100mg,n=6)。
[0157]
溶出度测定:取本品,照溶出度与释放度测定法(中国药典2020年版四部通则0931第二法)测定,以ph1.0的盐酸900ml为溶出介质,温度为37℃,转速为每分钟75转,依法操作,经10、15、30、45、60分钟时,分别取溶液2.5ml,滤过,取滤液作为供试品溶液;另取式iii化合物对照品适量,精密称定,加稀释剂(乙腈:溶出介质=80:20)溶解并稀释制成每1ml中约含0.11mg的溶液,作为对照品溶液。
[0158]
照高效液相色谱法(中国药典2020年版四部通则0512),用十八烷基基硅烷键合硅胶为填充剂(welch ultimate aq-c18,4.6mm
×
150mm,3μm或效能相当的色谱柱);以ph值4.5的1%磷酸水溶液(量取水900ml,使用1%磷酸调节ph值至4.5)为流动相a,以乙腈为流动相b;检测波长为240nm;柱温35℃;样品盘温度5℃;流速为每分钟1.0ml;按照流动相a:流动相b(70:30)等度洗脱8分钟。精密量取对照品溶液与供试品溶液各10μl,注入液相色谱仪,记录色谱图。对照品溶液连续5针峰面积的相对标准偏差应不大于2.0%。按外标法以峰面积计算,计算每片的溶出量。
[0159]
式ii化合物的体外溶出度试验方法
[0160]
对含式ii化合物的药物组合物及对比例进行体外溶出度试验(溶出样品规格:
100mg,n=6)。
[0161]
溶出度测定:取本品,照溶出度与释放度测定法(中国药典2020年版四部通则0931第二法)测定,以ph1.0的盐酸900ml为溶出介质,温度为37℃,转速为每分钟75转,依法操作,经10、15、30、45、60分钟时,分别取溶液2.5ml,滤过,取滤液作为供试品溶液;另取式ii化合物对照品适量,精密称定,加稀释剂(乙腈:溶出介质=80:20)溶解并稀释制成每1ml中约含0.11mg的溶液,作为对照品溶液。
[0162]
照高效液相色谱法(中国药典2020年版四部通则0512),用十八烷基基硅烷键合硅胶为填充剂(welch ultimate aq-c18,4.6mm
×
150mm,3μm或效能相当的色谱柱);以ph值4.5的1%磷酸水溶液(量取水900ml,使用1%磷酸调节ph值至4.5)为流动相a,以乙腈为流动相b;检测波长为240nm;柱温35℃;样品盘温度5℃;流速为每分钟1.0ml;按照流动相a:流动相b(70:30)等度洗脱8分钟。精密量取对照品溶液与供试品溶液各10μl,注入液相色谱仪,记录色谱图。对照品溶液连续5针峰面积的相对标准偏差应不大于2.0%。按外标法以峰面积计算,计算每片的溶出量。
[0163]
下述实施例中未作特殊说明,所有原料和试剂均来自于商购或通过本领域的常规方法制备而得。其中式ii化合物、式iii化合物为公司自制;乳糖(牌号:g200、f100)购自德国美剂乐沃斯堡牛奶房两合公司;微晶纤维素(牌号:ph101、ph102)购自旭化成株式会社;预胶化淀粉(牌号:starch 1500)购自上海卡乐康包衣技术有限公司;甘露醇(牌号:200sd)购自法国罗盖特公司;山梨糖醇(牌号:60目)购自法国罗盖特公司;聚维酮(别名:聚乙烯吡咯烷酮,牌号:k30)购自美国巴斯夫公司;淀粉、硬脂酸镁(牌号:sh-ym-m)购自安徽山河药用辅料股份有限公司;薄膜包衣预混剂(牌号:欧巴代ys-1-7027cn)购自上海卡乐康包衣技术有限公司;明胶空心胶囊壳(牌号:0#、1#)购自苏州胶囊有限公司。
[0164]
实施例1
[0165]
表1式ii化合物片剂处方辅料的筛选
[0166]
[0167][0168]
制备工艺:
[0169]
(1)原料药、辅料处理:将原料药和辅料,分别过40目筛,备用;
[0170]
(2)工艺过程:取处方量的原料药、填充剂及崩解剂,通过混合器混合均匀,用50%乙醇溶液制软材,高速剪切制湿颗粒;湿颗粒在65℃以下沸腾干燥;整粒后,加入处方量的润滑剂,用混合器混合均匀;
[0171]
(3)测定干颗粒主药含量,确定片重,通过压片机压片,制成片剂。
[0172]
应该理解:在制备过程中,各成分的加入顺序,以及混合,制粒方式上的改动,按本领域熟知的原理进行。另外压成的片剂也可以按照本领域熟知的包衣技术进行包衣。
[0173]
由表1的结果可知:单独加微晶纤维素,淀粉,碳酸钙作为填充剂,流动性一般或较差,而添加乳糖,甘露醇,山梨醇,磷酸氢钙作为填充剂,流动性较好。
[0174]
单独加微晶纤维素,乳糖,甘露醇,山梨醇作为填充剂,可压性较好,且溶出较好,而单独加淀粉,碳酸钙和磷酸氢钙作为填充剂,可压性一般,溶出较慢。
[0175]
实施例2
[0176]
表2式ii化合物片剂处方辅料的筛选
[0177]
[0178][0179]
制备工艺同实施例1。
[0180]
考察微晶纤维素,乳糖,甘露醇和山梨醇的联合使用,以及淀粉,碳酸钙和磷酸氢钙的联合使用。由表2的结果表明,从可压性看,微晶纤维素、乳糖、甘露醇、山梨醇的可压性好;从溶出度看,含有微晶纤维素、乳糖,甘露醇,山梨醇的处方,溶出度好。综合考虑,选择微晶纤维素、乳糖、山梨醇和甘露醇作为填充剂进行下一步筛选。
[0181]
实施例3
[0182]
表3式iii化合物片剂处方辅料的筛选
[0183]
[0184][0185]
制备工艺同实施例1。
[0186]
由表3的结果可知:单独加微晶纤维素,淀粉,碳酸钙作为填充剂,流动性一般或差,而添加乳糖,甘露醇,山梨醇,磷酸氢钙作为填充剂,流动性较好。
[0187]
单独加微晶纤维素,乳糖,甘露醇,山梨醇,可压性较好,且溶出较好,而单独加淀粉,碳酸钙和磷酸氢钙作为填充剂,可行性一般,溶出较慢。
[0188]
实施例4
[0189]
表4式iii化合物片剂处方辅料的筛选
[0190]
[0191][0192]
制备工艺同实施例1。
[0193]
考察微晶纤维素,乳糖,甘露醇和山梨醇的联合使用,以及淀粉,碳酸钙和磷酸氢钙的联合使用。由表4的结果表明,从可压性看,微晶纤维素、乳糖、甘露醇、山梨醇的可压性好;从溶出度看,含有微晶纤维素、乳糖,甘露醇,山梨醇的处方,溶出度好。综合考虑,选择微晶纤维素、乳糖、山梨醇和甘露醇作为填充剂进行下一步筛选。
[0194]
实施例5
[0195]
表5式ii化合物片剂处方辅料的筛选
[0196][0197]
[0198]
制备工艺:
[0199]
将处方量的原料药和填充剂混合均匀后,加入崩解剂,混合均匀后,加入润滑剂,混合均匀后,使用压片机压片,制成片剂。
[0200]
应该理解:在制备过程中,各成分的加入顺序,以及混合,制粒方式上的改动,按本领域熟知的原理进行。另外压成的片剂也可以按照本领域熟知的包衣技术进行包衣。
[0201]
由表5的结果表明,以上处方组合均可以使片剂的质量合格,其中乳糖单独使用,微晶纤维素单独使用以及乳糖与微晶纤维素合用达到的溶出度均能符合要求。
[0202]
实施例6
[0203]
表6式iii化合物片剂处方辅料的筛选
[0204][0205]
制备工艺:
[0206]
将处方量的原料药和填充剂混合均匀后,加入崩解剂,混合均匀后,加入润滑剂,混合均匀后,使用压片机压片,制成片剂。
[0207]
应该理解:在制备过程中,各成分的加入顺序,以及混合,制粒方式上的改动,按本领域熟知的原理进行。另外压成的片剂也可以按照本领域熟知的包衣技术进行包衣。
[0208]
由表6的结果表明,以上处方组合均可以使片剂的质量合格,其中乳糖单独使用,微晶纤维素单独使用以及乳糖与微晶纤维素合用达到的溶出度均能符合要求。
[0209]
实施例7
[0210]
表7式iii化合物片剂处方辅料的筛选
[0211][0212]
制备工艺:
[0213]
将处方量的原料药和填充剂混合均匀后,加入崩解剂,混合均匀后,加入润滑剂,混合均匀后,使用压片机压片,制成片剂。
[0214]
应该理解:在制备过程中,各成分的加入顺序,以及混合,制粒方式上的改动,按本领域熟知的原理进行。另外压成的片剂也可以按照本领域熟知的包衣技术进行包衣。
[0215]
由表7的结果表明,以上处方组合均可以使片剂的质量合格,其中甘露醇单独使用,山梨醇单独使用以及甘露醇与山梨醇合用达到的溶出度均能符合要求。
[0216]
实施例8
[0217]
表8式ii化合物(处方38)片剂和胶囊剂
[0218][0219]
制备工艺:
[0220]
将处方量的原料药和填充剂混合均匀后,加入崩解剂,混合均匀后,加入润滑剂,混合均匀后,一部分使用压片机压片,制成片剂,一部分使用胶囊填充机灌装,制成胶囊。
[0221]
对比例1
[0222]
表9式iii化合物片剂
[0223][0224][0225]
制备工艺:
[0226]
将处方量的原料药和填充剂混合均匀后,加入崩解剂,混合均匀后,加入润滑剂,混合均匀后,使用压片机压片,制成片剂。
[0227]
由表9的结果表明:使用碳酸钙,淀粉,磷酸氢钙作为填充剂,溶出没有使用乳糖,微晶纤维素,甘露醇和山梨醇作为填充剂溶出高。
[0228]
对比例2
[0229]
表10式ii化合物片剂
[0230][0231]
制备工艺:同对比例1
[0232]
结果表明:使用碳酸钙,淀粉,磷酸氢钙作为填充剂,压制成的片剂溶出没有使用乳糖,微晶纤维素,甘露醇和山梨醇作为填充剂溶出高。
[0233]
式iii化合物处方34、处方37以及对比例1的溶出曲线测定结果:
[0234][0235]
式ii化合物制剂样品以及对比例1的溶出曲线测定结果:
[0236][0237]
稳定性研究
[0238]
表11给出了式ii化合物、式ii制剂处方38、式iii化合物、式iii化合物制剂处方37的药物制剂稳定性研究的结果,结果表面样品在92.5%相对湿度和光照(4500
±
500lx、紫外条件0.9μw/cm2)、60℃高温存放5天和10天,杂质及含量无显著性增长。
[0239]
表11相关药物制剂的稳定性测试(有关物质和含量结果)
[0240][0241][0242]
应当理解,以上实施例均为示例性的,不用于包含权利要求所包含的所有可能的实施方式。在不脱离本公开的范围的情况下,还可以在以上实施例的基础上做出各种变形和改变。同样的,也可以对以上实施例的各个技术特征进行任意组合,以形成可能没有被明确描述的本发明的另外的实施例。因此,上述实施例仅表达了本发明的几种实施方式,不对本发明专利的保护范围进行限制。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。