1.本发明涉及复合酶技术领域,尤其涉及一种嵌合纤维小体及其应用。
背景技术:
2.木质素是构成植物细胞壁的主要成分,是自然界含量最高且难以降解的芳香族聚合物。以木质纤维素为原料生产清洁可再生能源——纤维素乙醇时,预处理原料中的木质素不仅会干扰纤维素酶对底物的水解效率,还会通过疏水作用、静电作用、氢键作用与纤维素酶发生不可逆吸附作用,致使同步糖化发酵反应体系中的酶活性降低,生产成本提升。因此,“无害化去木质素”对于提高酵母抗逆性及纤维素乙醇发酵的生产效率,降低工艺成本,乃至减少生产过程中有毒有害物质的排放都具有重要的实践意义。
3.木质素的基本结构单元是苯基丙烷,其通过化合键连接形成芥子醇、松伯醇、5羟基-松柏醇和香豆醇等前体物质,再由后者聚合成复杂酚类聚合物。目前已知的微生物降解木质素的酶系统主要包括木质素降解酶(lignin-modifying enzymes,lme)和木质素降解辅助酶(lignin-degrading auxiliary enzymes,lda)两大类。
4.研究发现,相对于细菌,真菌具有相对更为强大的木质素解聚酶系统。并且,真菌对木质素的高效降解主要是基于木质素降解酶系的协同作用完成。其中,漆酶(laccase,lac)与过氧化物酶(peroxidases)在降解木质素复杂酚类聚合物的过程中发挥了重要作用。漆酶能够作用于单酚类化合物、双酚类化合物、氨基酚类化合物等低氧化还原电位的酚类以及芳香胺,而过氧化物酶则可作用除了低氧化还原电位酚类之外的高氧化还原电位酚类以及非酚类物质。当漆酶以酚类底物进行催化时,可从被氧化的酚类分子中提取一个电子促发自由基产生,进而引起共价键(特别是烷基-芳香基)的断裂,造成木质素多聚体的解聚。最终木质素大分子降解产生大量芳香族化合物,漆酶仍可继续将其作为底物,进行芳香环脱甲氧基、脱甲基作用的酶促水解。过氧化物酶作为另一种重要的木质素氧化酶,主要包括木质素过氧化物酶(lignin peroxidases,lip),锰过氧化物酶(manganese peroxidases,mnp)和多功能过氧化物酶(versatile peroxidases,vp)等。其中,多功能过氧化物酶(vp)可兼具木质素过氧化物酶(lip)和锰过氧化物酶(mnp)的生物学催化特性,其催化反应途径可产生具较高氧化还原电势的自由基,进而引发自由基链式反应,该反应又作用于木质素,产生c-c键或c-o键断裂、脱甲基、羟基化、苄醇氧化等多种反应,这些产物进一步经不同代谢过程被彻底降解为co2和h2o,最终达到降解木质素的目的;此外vp还可直接氧化氢醌和取代酚,这两种底物是其他类型的过氧化物酶都难以有效氧化。
5.但是单独使用漆酶仍然存在一定的问题:1、不能催化具有-o-4和5-5’的非酚型木质素结构单元;2、酶解的效率有限,并且倾向于“聚合”反应,特别是植物漆酶;3、为了改善单一漆酶的催化水解效率,一些团队试图探究在介质(如abts、nha、tempo等)的帮助下来催化转化非酚木质素,但是这些介质均存在毒性,且中间体稳定性差、生产成本高。
6.现有技术为了提高木质素降解酶的降解效率,研究了多种酶的复配方式,例如通过漆酶和过氧化酶搭配促进木质素的降解,但是由于漆酶催化过程产生的氧化剂相对不
足,致使过氧化物酶的酶活性下降。例如同时采用漆酶和溶解性多糖单加氧酶,但是这样反而提高了纤维素的强度,导致纤维素的转化率下降。例如同时采用过氧化物酶和溶解性多糖单加氧酶,但是降解的木质素底物范围有限。例如采用溶解性多糖单加氧酶和纤维素酶促进了纤维素酶的纤维素分解效率,但是溶解性多糖单加氧酶并不主导木质素的降解,不能优化纤维素乙醇的发酵体系。【老师,您好,一般不建议在稿件中标注参考文献的出处】
技术实现要素:
7.为了解决现有技术存在的问题,本发明提供一种嵌合纤维小体及其应用,通过嵌合漆酶、过氧化物酶和溶解性多糖单加氧酶组装得到一种同时具备较高的木质素降解酶体系的稳定性和木质素底物降解活性的复合酶。
8.第一方面,本发明提供一种嵌合纤维小体,所述嵌合纤维小体由漆酶、过氧化物酶和溶解性多糖单加氧酶组装而成。
9.嵌合纤维小体是依据天然纤维小体结构,依赖粘连模块(cohesin)与对接模块(dockerin)的种间特异性识别及高亲和性的蛋白分子组装基础,经过人工设计在异源细胞表达的微型纤维小体结构(mini-cellulosome)。其中支架蛋白(scaffoldin)由不同微生物来源的粘连模块组成,酶蛋白则通过其c端的对接模块与粘连模块之间的特异性高亲和力介导组装到支架蛋白上,最终组成“复合酶系统”。这样的结构可以保证多个酶解反应过程中的上一步反应产物不需要扩散就能直接进入下一步反应的酶蛋白活性中心成为酶解底物,使酶解反应效率得以提高,即形成“底物通道效应”(substrate-channeling effect)。底物通道效应具有促进反应进行,避免不利的反应平衡和动力学过程,保护不稳定的反应中间物等诸多优点,而纤维小体支架蛋白的柔韧性有效地克服了相邻各种酶组分间的空间位阻效应,为酶促反应中底物通道作用提供保障,增强了多种酶组分之间的协同作用和酶与底物的邻近效应,从而赋予了嵌合酶的高效催化特征。
10.由于木质素降解酶系中的lac主要作用于低氧化还原电位的酚类化合物且具有反应速率快的特征,而vp则主要作用于低/高氧化还原电位的酚类和非酚类物质但反应速率较慢,因此将木质素降解酶lac、vp和lpmo蛋白组装在嵌合纤维小体结构中,可通过lac和vp同步催化降解低/高氧化还原电位的底物,将释放的产物如酚类和低分子量木质素衍生物化合物作为电子供体,能够提高lpmo活性和纤维素的水解效率。而在lpmo催化过程产生的h2o2又供给vp和lac催化反应,优先用于木质素氧化。
11.本发明基于构建纤维小体嵌合酶系的理念,为酶促反应中底物通道作用提供保障,增强多种酶组分之间的协同作用,以及酶与底物的邻近效应,将漆酶、过氧化物酶和溶解性多糖单加氧酶组装形成一种嵌合纤维小体,其可降解木质素中的多种酚类和非酚类成分,以及其中的低/高氧化还原电位成分,实现木质素充分地无公害化降解,同时在导入酿酒酵母中之后,不仅够提高菌株在同步糖化发酵反应体系中的抗逆性和发酵性能,同时可以作为一种商业化纤维素酶的辅助酶系使用,在不增加额外添加纤维素酶的情况下,提高底物利用率和乙醇产率。
12.进一步地,采用支架蛋白组装所述漆酶、过氧化物酶和溶解性多糖单加氧酶;所述支架蛋白包括至少三个粘连模块。
13.进一步地,所述组装为通过所述粘连模块和对接模块将所述漆酶、过氧化物酶和
溶解性多糖单加氧酶组装至所述支架蛋白上;所述粘连模块来源于热线梭菌、解纤维梭菌或生黄瘤胃球菌中的一种或多种。
14.进一步地,所述粘连模块为cipa、scab或cipc中的一种或多种,所述对接模块为doc-cipa、doc-scab和doc-cipc或多种。
15.进一步地,所述漆酶、过氧化物酶和溶解性多糖单加氧酶的质量比为1:(0.5~2):(0.5~2)。
16.第二方面,本发明提供一种嵌合纤维小体的制备方法,包括:
17.采用酿酒酵母a凝集素展示系统表达支架蛋白,通过酿酒酵母细胞表面锚定蛋白锚定所述支架蛋白,后通过粘连模块与对接模块将漆酶、过氧化物酶和溶解性多糖单加氧酶组装在所述支架蛋白上。
18.进一步地,包括:采用酿酒酵母a凝集素展示系统表达支架蛋白scafi,通过所述支架蛋白scafi的n端aga2信号肽与酿酒酵母细胞表面锚定蛋白aga1结合从而锚定所述支架蛋白scafi,后通过粘连模块与对接模块将漆酶、过氧化物酶和溶解性多糖单加氧酶组装在所述支架蛋白scafi上。
19.进一步地,所述组装为在0~4℃的环境下放置10~14h。
20.作为一种优选的具体实施方式,本发明提供一种嵌合纤维小体的制备方法,包括:
21.1、扩增得到漆酶、过氧化物酶和溶解性多糖单加氧酶的基因片段,构建至载体上后转化酿酒酵母细胞表达得到漆酶、过氧化物酶和溶解性多糖单加氧酶;
22.2、混合漆酶、过氧化物酶和溶解性多糖单加氧酶之后,进一步混合表面展示杂合支架蛋白scafi的重组酿酒酵母菌株进行在0~4℃的环境下组装。
23.本发明进一步提供所述嵌合纤维小体在提高酿酒酵母抗逆性中的应用。
24.本发明进一步提供所述的嵌合纤维小体在提高纤维素的乙醇发酵性能中的应用。
25.酿酒酵母(saccharomyces cerevisiae)具有遗传背景清晰、基因工程操作技术成熟、生长繁殖快、对抑制剂和有毒物质耐受度较高、以及能高效表达外源蛋白等优势,而且它也是工业化生产乙醇的传统菌株。本发明将制备得到的嵌合纤维小体转化至酿酒酵母中可以有效提高酿酒酵母对木质素分解产生的有害物质的耐受性能,还能够提高其生产乙醇的性能。
26.本发明具备如下有益效果:
27.本发明通过复合漆酶、过氧化物酶和溶解性多糖单加氧酶构建得到了一种具有协同降解多种类型木质素成分的嵌合纤维小体反应体系,其可以使得酿酒酵母对于木质素降解产生的有毒有害化合物,例如苯酚、愈创木酚、香草醛和丁香醛的耐受能力显著提升;同时还具备较高的木质素降解能力和提高酵母菌的乙醇发酵性能。
附图说明
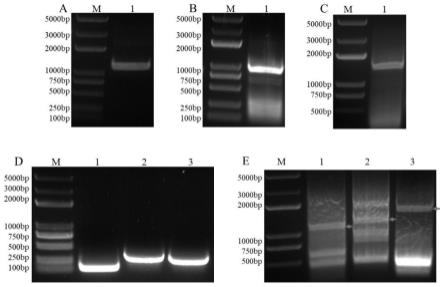
28.图1为本发明实施例1提供的lpmo,vp和lac基因及融合基因的克隆结果示意图;其中a为lpmo基因的扩增结果,泳道m为bl2000plus,1为lpmo;b为vp基因的扩增结果,泳道m为bl2000 plus,1为vp;c为lac基因的扩增结果,泳道m为bl2000 plus,1为lac;d为对接模块的扩增结果,泳道m为bl2000 plus,1为doc-cipa,2为doc-scab,3为doc-cipc;e为融合基因的扩增结果,1为lpmo-cipa,2.vp-scab,3.lac-cipc。
29.图2为本发明实施例1提供的prs423α-mcs载体片段扩增结果;其中a为分泌信号肽、启动子和终止子的扩增结果,泳道m为bl2000plus,1为αmf,2为pgk,3为matt;b为启动子、细胞表面展示信号肽和终止子的扩增结果,泳道m为bl2000 plus,1为pgk,,2为aga2,3为matt;c为分泌表达所用启动子、分泌信号肽和终止子基因大片段的扩增结果,泳道m为bl2000 plus,1为pgk-αmf-matt;d为细胞表面展示表达所用启动子、表面展示信号肽和终止子基因大片段的扩增结果,泳道m为bl2000 plus,1为pgk-aga2-matt。
30.图3为本发明实施例1提供重组酿酒酵母菌株的阳性克隆筛选结果;其中a为重组酿酒酵母菌株w303/lpmo阳性克隆筛选结果,泳道m为bl2000 plus,泳道1为阳性对照,泳道2-6为w303/lpmo阳性单克隆;b为重组酿酒酵母菌株w303/vp阳性克隆筛选结果,泳道m为bl2000 plus,泳道1为阳性对照,泳道2为w303/vp单克隆;c为重组酿酒酵母菌株w303/lac阳性克隆筛选结果,泳道m为bl2000 plus,泳道1为阳性对照,泳道2-3为w303/lac单克隆。
31.图4为本发明实施例1提供的lpmo蛋白的蛋白质免疫印迹检测结果。
32.图5为本发明实施例1提供的vp蛋白质的免疫印迹检测结果。
33.图6为本发明实施例1提供的lac蛋白质的免疫印迹检测结果。
34.图7为本发明实施例2提供的利用激光共聚焦免疫荧光显微镜成像验证嵌合纤维小体酶的组装的检测结果。
35.图8为本发明实施例3提供的重组酿酒酵母菌株的抗逆性能分析结果;其中a为针对苯酚的检测结果,b为针对愈创木酚的检测结果,c为针对香草醛的检测结果,d为丁香醛的检测结果。
36.图9为本发明实施例4提供的酿酒酵母细胞展示嵌合纤维小体降解碱性木质素的性能分析结果。
37.图10为本发明实施例4提供的不同种酶的汽爆玉米秸秆发酵产乙醇。
具体实施方式
38.以下实施例用于说明本发明,但不用来限制本发明的范围。
39.实施例1构建表达嵌合酶蛋白的酿酒酵母重组菌株并测定酶蛋白表达量及酶活
40.1、嵌合酶的基因克隆:
41.分别采用rna提取试剂盒(rnaiso,宝生物工程(大连)有限公司)从粗糙脉孢菌、刺芹侧耳和硬毛栓孔菌提取总rna,再分别以总rna反转录获得cdna模板(first-strand cdna synthesis supermix,北京全式金生物技术有限公司)。
42.以粗糙脉孢菌cdna为模板,通过如下引物对扩增lpmo基因序列(gi:xm_960505.2):
43.lpmo-f:5
’‑
cggaattccacaccatcttccagaaggtgtcc-3’,
44.lpmo-r:5
’‑
tcaccgcggttaatggtgatggtgatgatgagggaggcactggctg-3’;
45.以刺芹侧耳cdna为模板,通过如下引物对扩增vp基因序列(gi:af007221.1):
46.vp-f:5
’‑
cggaattcgcaacttgcgacgacggacgcacc-3’,
47.vp-r:5
’‑
tcaccgcggttaatggtgatggtgatgatgcgatccagggacggg-3’;
48.以硬毛栓孔菌cdna为模板,通过如下引物对扩增lac基因序列(gi:ku055621.1):
49.lac-f:5
’‑
cggaattcgccatcgggccagtcgcagacctc-3’,
50.lac-r:5
’‑
tcaccgcggttaatggtgatggtgatgatgctggtcgtcaggcgag-3’。
51.pcr条件:98℃,30s;98℃,10s;58℃,35s;72℃,30s;72℃,10min;30个循环。琼脂糖凝胶电泳后,目的条带长度为lpmo(1037bp),vp(993bp)和lac(1488bp),结果如图中的a,b和c,回收纯化上述目的基因条带。
52.对接模块基因克隆:以热线梭菌的cdna为模板,通过如下引物扩增doc-cipa基因(cipa为gi:125972525)的序列:
53.doc-cipa-f:5
’‑
cagccagtgcctccctcgaaacagtgctttc-3’,
54.doc-cipa-r:5
’‑
tcaccgcggttaatggtgatggtgatgatgtaatatatacctcttc-3’;
55.以生黄瘤胃球菌的cdna为模板,通过如下引物对扩增对接模块doc-scab基因(scab为gi:13277318))的序列:
56.doc-scab-f:5
’‑
cccgtccctggatcgacaaagctcgttcctac-3’,
57.doc-scab-r:5
’‑
tcaccgcggttaatggtgatggtgatgatgctgaggaagtgtgatg-3’。
58.以解纤维梭菌cdna为模板,通过如下引物对扩增对接模块doc-cipc基因(cipc为gi:11056042)的序列:
59.doc-cipc-f:5
’‑
ctcgcctgacgaccagtaccttgatgaaaag-3’,
60.doc-cipc-r:5
’‑
tcaccgcggttaatggtgatggtgatgatgtaacaagaatgatttg-3’。
61.pcr条件:98℃,30s;98℃,10s;58℃,35s;72℃,10s;72℃,10min;30个循环。结果如图1中的d。
62.以lpmo和doc-cipa片段为模板,利用over-lap pcr方法及引物lpmo-f和doc-cipa-r获得lpmo嵌合酶基因片段lpmo-cipa。
63.以vp和doc-scab为模板,利用over-lap pcr方法及引物vp-f和doc-scab-r获得vp嵌合酶基因片段vp-scab,
64.以lac和doc-cipc片段为模板,利用over-lap pcr方法及引物lac-f和doc-cipc-r获得lac嵌合酶基因片段lac-cipc。
65.pcr条件:98℃,30s;98℃,10s;58℃,35s;72℃,60s;72℃,10min;30个循环。结果如图1中的e。
66.2、启动子pgk,信号肽αmf和aga2,及终止子matt序列扩增
67.以酿酒酵母s288c基因组dna为模板,通过如下引物对扩增三磷酸甘油激酶(phosphaglycerate kinase,pgk)启动子pgk序列:
68.pgk-f:5
’‑
gaggaagctgaaacgcaatattttagattcctgacttc-3’,
69.pgk-r:5
’‑
gtaaaaattgaaggaaatctcatcgttttgttttatatttgttg-3’。
70.以商业化载体pyd1的序列为模板,通过如下引物对扩增aga2和matt序列:
71.aga2-f:5
’‑
caacaaatataaaacagtaataaaagtatcaac-3’,
72.aga2-r:5
’‑
ccgcggggatccactagtgtcgacctcgaggatatcgaattcagaaccaccaccaccag-3’;
73.matt-f:5
’‑
gaattcgatatcctcgaggtcgacactagtggatccccgcgggtttaaacccgctgatc-3’,
74.matt-r:5
’‑
attattatcatcattttttattactgagtagtatttatttaag-3’;
75.以商业化载体ppic9k为模板,通过如下引物对扩增αmf序列:
76.αmf-f:5
’‑
caacaaatataaaacaaaacgatgagatttccttcaatttttac-3’,
77.αmf-r:5
’‑
ccgcggggatccactagtgtcgacctcgaggatatcgaattcagcttcagcctctcttt-3’。
78.扩增程序:98℃30s,98℃10s,56℃25s,72℃30s,72℃10min,30个循环。
79.如上pcr扩增方法得到的目的基因条带为:pgk(778bp),aga2(296bp),αmf(267bp)和matt(367bp),回收纯化目的基因。将pgk、aga2、αmf、matt序列通过over-lap rcr连接形成pgk-αmf-mcs-matt和pgk-aga2-mcs-matt片段。
80.扩增程序:98℃30s,98℃10s,56℃60s,72℃55s,72℃10min,30个循环。
81.目的基因片段条带长度分别为1784bp和1755bp,回收纯化该片段,实施结果如附图2所示。双酶切后与prs423商业化载体连接,经测序验证无误,构建出高拷贝表达载体prs423-pgk-αmf和prs423-pgk-aga2。
82.将lac-cipc、vp-scab和lpmo-cipa分与prs423-pgk-αmf载体链接,将scafi与prs423-pgk-aga2连接,然后采用化学转化法转化大肠杆菌dh5α感受态细胞,挑取并培养单菌落,经菌液pcr筛选和测序验证,获得高拷贝表达载体prs423-lpmo、prs423-vp、prs423-lac和prs423-scafi质粒,其中lpmo和lac的3’端含有6
×
his标签序列,scafi的3’端含有xpress标签序列。
83.3、酿酒酵母转化及阳性克隆筛选
84.采用醋酸锂转化法,分别转化prs423-lpmo、prs423-vp、prs423-lac和prs423-scafi质粒至酿酒酵母w303细胞,将prs423-scafi质粒转化至酿酒酵母eby100细胞。然后通过碱热裂解法提取酵母基因组,进行基因组pcr验证,实施结果筛选获得阳性单克隆w303/lpmo,w303/vp,w303/lac和eby100/scafi,结果如附图3所示。
85.4、酶蛋白质免疫印迹分析
86.将筛选获得的阳性重组酿酒酵母菌株培养48h后,提取蛋白经超微量分光光度计测定并调整蛋白浓度一致,利用蛋白质免疫印迹方法分析。
87.sds-page蛋白质电泳过程如下:先取150rpm,30℃培养了48h的重组酿酒酵母细胞5ml,于4℃,3000rpm离心5min。吸取上清液,转入超滤管,于4℃,4000rpm离心10min。
88.吸取超滤后的蛋白浓缩液,置于2ml离心管备用。取20μl蛋白浓缩液,加入5μl上样缓冲液(5
×
)混匀。
89.加样到10%的sds-page分离胶,电压80v,电泳约20min,然后在120v电压下电泳60min。
90.然后进行蛋白质转膜:冰水浴,设置电流为250ma,转膜1.5h。
91.硝酸纤维素膜封闭:在室温下用5%脱脂奶粉溶液封闭1h。
92.一抗孵育:酶蛋白含有his标签,采用1:10000proteinfind anti-his mouse monoclonal antibody孵育1.5h;
93.二抗孵育:采用1:2000的proteinfind goat anti-mouse igg(h l),hrp conjugate,孵育1h。
94.用tbst缓冲液洗涤3次,每次5min。最后将easysee western blot kit(北京全式金生物技术有限公司)中的a溶液和b溶液按照50:1的比例混合,再加入1
‰
的c溶液混匀。然后均匀平铺到硝酸纤维素膜上,在ge imagequant las4000mini中曝光显色。
95.根据蛋白分子量标准分析显色条带是否为目的蛋白。结果如图4(lpmo)、图5(vp)和图6(lac)所示,蛋白免疫印迹分析证明显色的蛋白条带分子量与目的蛋白分子量lpmo(39.35kda)、vp(44.5kda)和lac(61.95kda)相符,该结果证明w303/lpmo,w303/vp和w303/lac重组菌株均分别可以正确表达酶蛋白。
96.5、酶活测定
97.lpmo酶活测定:以刺槐豆胶为底物,采用3,5-二硝基水杨酸比色法测定lpmo活性。
98.反应体系包括:酶液15μl,0.5%(w/v)刺槐豆胶60μl。
99.反应流程为60℃反应12h。然后加入75μl dns试剂,立即100℃保温10min。自然冷却至室温后,取130μl使用酶标仪测定od
540nm
的吸光值。以100℃加热失活的酶蛋白为空白对照,定义降解刺槐豆胶每生成1mg/l还原糖所需的酶量为一个酶活单位(u),使用超微量分光光度计测定酶蛋白的浓度。
100.vp酶活测定:以愈创木酚为底物,酶促反应体系如下:hac-naac buffer(ph4.5)1.5ml,2.4mm愈创木酚0.5ml,3mm mnso40.5ml酶液0.4ml,3mm h2o20.1ml。
101.使用紫外分光光度计室温测定测定od
465nm
处5min内吸光值的变化,按照下述公式计算vp酶活。
[0102][0103]
其中,消光系数ε
465nm
=12100l/(mol
·
cm),v
总
:反应液总体积(ml),v
酶
:粗酶液体积(ml),δa:吸光值差,δ
t
:酶促反应时间
[0104]
vp酶活定义:每分钟催化1μmol底物反应所需的酶量为一个酶活单位(u)。
[0105]
lac酶活测定:以abts为底物,反应体系如下:hac-naac buffer(ph4.5)125μl,0.6mm abts 125μl,酶液50μl。使用酶标仪测定od
420nm
处5min内吸光值的变化。
[0106][0107]
其中,消光系数ε
420nm
=36000l/(mol
·
cm),v
总
:反应液总体积(ml),v
酶
:粗酶液体积(ml),δa:吸光值差,δ
t
:酶促反应时间
[0108]
lac酶活定义:每分钟催化1μmol底物反应所需的酶量为一个酶活单位(u)。
[0109]
表1分泌表达lpmo,vp和lac的酶活性测定
[0110][0111]
注:*表示为三次测定数值的平均值
[0112]
酶活测定结果如表1所示,分泌表达lpmo,vp和lac的酶活分别为5.620u/ml,6.298u/ml和6.831u/ml,相对应的比酶活为16.788u/mg 18.782u/mg和20.078u/mg。该结果证明酿酒酵母重组菌株胞外分泌lac,vp和lpmo酶蛋白均具有酶活性。
[0113]
实施例2酿酒酵母eby100细胞表面自组装具有lac、vp和lpmo催化模块的嵌合纤维小体
[0114]
1、取培养20~48h时的重组酿酒酵母细胞于4℃,3000rpm,离心10min。其中,eby100/scafi菌株离心后弃上清,保留细胞沉淀,用重悬缓冲液(50mm tris-hcl,100mm nacl,10mm cacl2)重悬eby100/scafi细胞;酶蛋白分泌表达菌株w303/lac、w303/vp和w303/lpmo均保留离心后的培养液上清作为粗酶液。
[0115]
2、取1ml w303/scafi加入1ml粗酶液,于4℃孵育12h完成嵌合纤维小体的组装,最后在4℃,3000rpm离心5min弃上清,收集细胞沉淀。
[0116]
3、用1ml的磷酸缓冲液(phosphate buffered saline,pbs;含137mm nacl,2.7mm kcl,10mm na2hpo4,1.8mm nah2po4,ph为7.4)重悬嵌合纤维小体细胞沉淀,4℃下3000rpm离心10min。然后弃上清,在沉淀中加入250μl的1%bsa(用pbs配制)重悬。
[0117]
4、按比例(1:1000v/v)加入一抗(mouse anti-xpress tag;rabbit anti-6
×
his tag)混匀,室温孵育1h,每隔15min颠倒混匀一次,使细胞呈悬浮状态。再于4℃,3000rpm离心10min,弃上清,用1ml的pbs洗涤细胞沉淀两次。
[0118]
5、重悬细胞沉淀于250μl的1%小牛血清溶液(albumin from bovine serum,bsa),然后按比例(1:250v/v)加入1μl二抗(goat anti-mouse igg(h l),alexa 488;goat anti-rabbit igg(h l),alexa647)混匀,置于黑暗处1.5h,不间断地颠倒混匀,使其始终呈悬浮态。
[0119]
6、在4℃下5000rpm离心5min,用pbs洗涤细胞沉淀两次,重悬细胞于200μl的pbs中。取1μl细胞悬浊液,滴加在载玻片上,并在激光扫描共聚焦显微镜成像系统zeiss lsm live 780中观察。其中,alexa 488在波长488nm的激光激发下呈现绿色荧光,alexa 在波长633nm的激光激发下发出远红外荧光。用carl zeiss zen 2011版软件拍照并进行分析。
[0120]
结果如附图7所示,其中,第1行的左侧为eby100/scafi在488nm激光激发下呈现绿色荧光,而在633nm激光激发下未出现荧光反应,该结果证明scafi蛋白能够通过a凝集素系统锚定在eby100细胞表面。当lac,vp和lpmo蛋白分别与eby100/scafi组装时,在488nm激光激发下呈现绿色荧光,且在633nm激光激发下出现红色荧光反应,如图7中第2行至第4行结果所示,这证明嵌合酶蛋白lac,vp和lpmo通过对接模块与scafi结合并组装,本发明创新性地构建出了具有木质素协同降解酶系功能的嵌合纤维小体。
[0121]
实施例3重组酿酒酵母菌株抗逆性分析
[0122]
培养基的配置:分别在24孔板上配置含有不同浓度的抑制剂(例如:苯酚、愈创木酚、香草醛和丁香醛)的ypd固体培养基。
[0123]
以空白酿酒酵母菌株eby100作为阴性对照,以重组酿酒酵母菌株eby100/lac、eby100/vp、eby100/lpmo以及eby100/lac-vp-lpmo为实验组,按照2%总接种量于20℃、150rpm下在ypg培养基中进行低温诱导培养。将诱导完成的对照菌株及实验菌株分别均匀涂布于24孔板中含有抑制剂的ypd固体培养基上,于30℃静置培养72小时。
[0124]
结果如图8所示,在酿酒酵母细胞表面组装lac,vp和lpmo的嵌合纤维小体(eby100/lac-vp-lpmo)对由木质素降解产生的有毒有害化合物的最大耐受浓度分别为:
12mmol/l苯酚,1g/l愈创木酚,0.75g/l香草醛,2.4g/l丁香醛。已有文献报道中,柳木水解液中香草醛和苯酚浓度分别为0.43g/l和4mmol/l,云杉水解液中丁香醛为0.107g/l。
[0125]
本发明提供的展示嵌合酶的重组酿酒酵母菌株对香草醛、苯酚和丁香醛的最大耐受浓度均高于实际反应体系中预处理后所产生的抑制剂浓度,具有一定的普适性,这说明本发明在开发利用木质纤维素原料生产纤维素乙醇技术中具有应用价值。
[0126]
实施例4
[0127]
本实施例提供的如上实施例2提供的嵌合酶系的降解木质素的具体性能:
[0128]
1、降解碱性木质素底物的性能分析
[0129]
配制含有0.5g/l碱木质素的ypd液体培养基,调节ph至4.5左右,分装至250ml锥形瓶中,每瓶100ml。按照表2中组合添加重组酿酒酵母菌种,接种量为0.5g/l酶蛋白,每组三个平行。
[0130]
表2.重组酿酒酵母降解碱木质素的组合
[0131][0132]
注:1添加终浓度为0.5mm的硫酸铜;2添加终浓度为0.5mm的硫酸锰;3添加150μm的过氧化氢,并且每24小时补加一次;4添加0.5mm抗坏血酸,并且每24小时补加一次。
[0133]
碱木质素降解率测定:将碱木质素酶解样品10000rpm离心5min后,测定酶解液中碱木质素在280nm下的吸光值,以时间为横坐标,吸光值为纵坐标,绘制各组合碱木质素降解曲线。根据吸光值和碱木质素标准曲线,得到碱木质素含量,计算碱木质素降解率,如下述公式:
[0134][0135]
其中:c0:降解前碱木质素含量;c
t
:降解后碱木质素含量。
[0136]
结果如图9所示,嵌合纤维小体结构eby100/lac、eby100/vp、eby100/lpmo以及eby100/lac-vp-lpmo去除碱木质素的百分比分别为47.96%,44.63%,7.82%和67.08%。该结果说明:基于酿酒酵母细胞表面展示系统及在支架蛋白scafi上组装嵌合酶蛋白lac、vp和lpmo,能够增强三种酶在木质素底物降解反应中的协同效应,提高木质素降解效率。
[0137]
2、重组酿酒酵母的纤维素乙醇发酵性能研究
[0138]
(1)木质纤维素协同发酵
[0139]
在木质纤维素发酵培养基中添加商业化纤维素酶ctec2(购自诺维信公司)10fpu/g,以四株重组酿酒酵母混合培养,接种量1.2g/l酶蛋白为实验组,以相同接种量的酿酒酵母eby100宿主细胞为对照组,实验设置三次平行。30℃下150rpm培养120h,每隔12h取样2ml。
[0140]
(2)葡萄糖及乙醇含量测定
[0141]
将发酵液样品经10000rpm离心5min后,用0.22μm滤器过滤,使用高效液相色谱仪
(hplc,mode 1260,agilent technologies)检测乙醇含量。检测条件为:agilent zorbax eclipse xdb-c18柱(250mm
×
4.6mm,5μm),柱温40℃,流动相为甲醇:水=5:95,流速0.6ml/min,进样量5μl,示差检测器温度40℃,运行10min。
[0142]
结果如附图10所示,含有三种嵌合酶的eby100/lac-vp-lpmo发酵96h后,最大乙醇浓度达到4.49g/l,对照组eby100细胞发酵产乙醇最大浓度则为3.40g/l,嵌合纤维小体结构使乙醇浓度提高了32%。
[0143]
该结果说明,一方面,锚定三种嵌合酶的重组酵母菌株eby100/lac-vp-lpmo能够通过嵌合酶系的协同作用降解木质素,进而减少反应体系中的木质素对纤维素酶的不可逆吸附作用,提高纤维素酶与底物的可及性,进而提高纤维素的酶解糖化水平及降低酶用量;另一方面,eby100/lac-vp-lpmo具有更高的发酵抑制剂耐受性和同步糖化发酵产乙醇的性能。
[0144]
虽然,上文中已经用一般性说明及具体实施方案对本发明作了详尽的描述,但在本发明基础上,可以对之作一些修改或改进,这对本领域技术人员而言是显而易见的。因此,在不偏离本发明精神的基础上所做的这些修改或改进,均属于本发明要求保护的范围。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。