变化图。
16.图3为实施例1中三种小球藻在200mmol l-1
中性盐a、碱性盐b和混合盐c下的生长综合评估图。
17.图4为实施例2中对照、bg-11培养液和微藻处理下太谷和应县土壤的ph a、ec b、水分c和有机质d含量图。
18.图5为实施例2中对照、bg-11培养基和微藻处理下的太谷和应县土壤的ph a、ec b、水分c和有机质d含量图。
19.图6为实施例3中对照、bg-11培养基和微藻处理下太谷和应县土壤的ph a、ec b、水分c和有机质d含量图。
20.图7为实施例3中对照、bg-11培养基和微藻处理下太谷和应县土壤的藜麦的spad a和叶绿素含量b图。
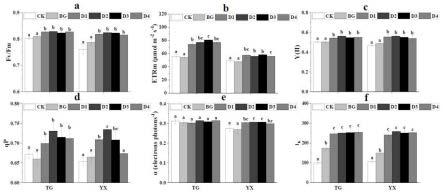
21.图8为实施例3中对照、bg-11培养基和微藻处理下太谷和应县土壤藜麦fv/fm a、etrm b、y(ii)c、qp d、αe和ik f结果图。
22.图9为实施例3中对照、bg-11培养基和微藻处理下太谷和应县土壤的藜麦的mda a、可溶性糖b、花青素c、总蛋白d、sod e和pod f图。
23.图10为实施例3中对照、bg-11培养基和微藻处理下太谷和应县土壤的藜麦的生长情况图。
24.图11为实施例3中对照、bg-11培养基和微藻处理下太谷和应县土壤的藜麦的株高a、茎粗b和干重c图。
25.图12为实施例3中对照、bg-11培养基和微藻处理下太谷和应县土壤的藜麦的种子数量a和种子重量b图。
26.图13为实施例3中对照、bg-11培养基和微藻处理下太谷和应县土壤的藜麦的种子数量a和种子重量b图。
具体实施方式
27.实施例1小球藻耐盐碱特性的评估
28.1.实验设计及方法
29.本研究中,c.pyrenoidosa gy-d26(蛋白核小球藻)、c.vulgaris gy-d25(普通小球藻)和c.emersionii sxnd-25(埃氏小球藻)由institute of molecular agriculture andbioenergy,shanxi agricultural university,china提供。将藻株在含有100ml无菌bg-11 培养基的250ml erlenmeyer烧瓶中培养30天作为种子液,温度25
±
1℃,光强100μmolphotons m-2
s-1
,光周期16:8,每天手动摇晃5次,培养基参考stanier等人的方法。然后在相同的环境条件下,在含有1l无菌bg-11培养基的2l球形玻璃瓶反应器中,对种子液用无菌空气通气培养7天以备使用。无菌bg-11培养基的ph被调节至7.0并进行盐处理后分别培养种子液c.pyrenoidosa、c.vulgaris和c.emersionii,初始od680分别为0.225、0.215 和0.287。培养条件为含有100ml无菌bg-11培养基的250ml erlenmeyer烧瓶,温度25
ꢀ±
1℃,光强100μmol photons m-2
s-1
,光周期16:8,每天手动摇晃5次。本试验包括3 种盐处理(中性盐:nacl;碱性盐:nahco3;混合盐:1:1nacl和nahco3),4个浓度(50、 100、150和200mmol l-1
)和3个重复,以无盐处理为对照组,所有处理仅在试验前配置好,并进行8天的培养试验。
小球藻培养液的ph和盐度分别采用ph meter(inesa pt-11;范围: 0-14;分辨率0.01)和salinity meter(huasheng sa287;范围:0-100;分辨率0.1ppt) 进行监测,每隔1天监测1次,共8天。测定生长、叶绿素含量及光合系统活力。
30.2.研究结果
31.结果(生长方面):第8天小球藻的藻液颜色随着盐处理浓度的增加而变浅,三种小球藻的变化程度在中性盐处理下没有差异。c.pyrenoidosa在100mmol l-1
碱性盐和150mmol l-1
混合盐处理的生长情况与对照相比优于c.vulgaris和c.emersionii。在0(ck)、50(1)、 100(2)、150(3)和200(4)mmol l-1
中性盐(ns)、碱性盐(bs)和混合盐(nbs)处理下,c.pyrenoidosa(a、d和g)、c.vulgaris(b、e和h)和c.emersionii(c、f和i) 的od680,细胞密度和干重结果如图1所示。
32.结果(叶绿素含量):图2为在0(ck)、50(1)、100(2)、150(3)和200(4)mmol l-1中性盐(ns)、碱性盐(bs)和混合盐(nbs)处理下,c.pyrenoidosa、c.vulgaris和 c.emersionii的叶绿素含量(a、b和c)和a型叶绿素/b型叶绿素(d、e和f)变化图,第 8天小球藻与对照相比,在50mmol l-1
中性盐、碱性盐、混合盐处理下c.pyrenoidosa和c. vulgaris的叶绿素含量没有显著变化,而c.emersionii在50mmol l-1
碱性盐处理下叶绿素含量下降了6.4%(图2中a-c)。三种小球藻的叶绿素含量随着盐浓度的增加而显著下降,在200mmol l-1盐处理下c.pyrenoidosa、c.vulgaris和c.emersionii的叶绿素含量与对照相比下降了37.3%、38.0%和42.7%(中性盐),86.5%、94.1%和97.3%(碱性盐),83.9%、 86.1%和97.0%(混合盐)。
33.结果(小球藻的盐碱抗性的评估):图3为在200mmol l-1
中性盐a、碱性盐b和混合盐c下,c.pyrenoidosa、c.vulgaris和c.emersionii的生长综合评估, c.pyrenoidosa、c.vulgaris和c.emersionii在200mmol l-1
盐处理下的od、细胞密度、干重和比生长率的相对值(与对照相比)的面积比例,表明在碱性盐处理下,三种藻的生长相对面积比例小于混合盐和中性盐,且中性盐大于混合盐。在中性盐胁迫下,c.pyrenoidosa 和c.vulgaris的相对面积比例大于c.emersionii,同样在碱性盐和混合盐处理下也表现出相同的结果,而c.pyrenoidosa的相对面积比例大于c.vulgaris。
34.综上所述:三种小球藻在大于100mmol l-1
的盐处理下的生长均受到抑制,且碱性盐对小球藻的抑制能力大于中性盐。小球藻可通过增强光合活性或/和热耗散的能力来抵御盐碱胁迫。综合评估表明c.pyrenoidosa和c.vulgaris对盐碱胁迫的耐性强于c.emersionii,且 c.pyrenoidosa表现最好。
35.实施例2小球藻对盐碱地的改良效果
36.1.实验设计及方法
37.太谷和应县土壤由molecular agriculture and bioenergy,shanxi agriculturaluniversity,china提供,土壤(20cm土层)来源于taigu,shanxi(112
°
28'e-113
°
01
′
e, 37
°
12
′
n-37
°
32
′
n)和yingxian,shanxi(112
°
58'e-113
°
37'e,39
°
17'n-39
°
45'n),这些土样在阳光下晒6天,过3mm筛后置于阴凉处。土壤ph和盐度分别为:太谷7.2和0.5g kg-1,应县9.3和0.5g kg-1。应县土壤被认为是盐碱地,太谷土壤作为对照。按照实施例1的方法培养c.pyrenoidosa 8天至od680为2.0,且每隔8天培养一次。在小球藻培养第3天时,用100ml蒸馏水灌溉应县和太谷土壤(每盆1kg土壤,共60盆),5天后进行微藻处理土壤试验
(10.3cm
×
10.5cm),整个过程在温室(25
±
1℃和75%的相对湿度)中进行,并装置100μmol photons m-2
s-1
的光强(光周期16:8),包括2种土壤,6个处理(ck:蒸馏水;bg:bg-11培养液;d1:培养8天后的藻液用水稀释到od680为0.5;d2:培养8天后的藻液用水稀释到od680为1.0;d3:培养8天后的藻液用水稀释到od680为1.5;d4:培养 8天后的藻液)。处理每隔8天灌溉1次,所有处理均将ph调节至7.0且仅在灌溉前配置好,以保证藻类处理的活力和数量。每个处理设置5个重复和一致的管理,试验周期为100天。土壤取样按照五点取样法从每盆中收集5-7cm土层的土壤(非根际)并充分混合以备测定土壤性质。将土壤放入105℃的坩埚中,在马弗炉中放置24小时,计算土壤重量损失量以评估土壤含水量。将风干的土壤与蒸馏水1:5混合30min后,用ph meter和salinity meter测定土壤ph和电导率(ec)。土壤有机质含量采用重铬酸钾氧化比色法测定。土壤全氮、可利用氮、磷和钾含量分别采用半微量蒸馏法、氯化钾靛酚蓝比色法、碳酸氢钠萃取法钼锑比色法和乙酸铵萃取法火焰光度法测定。
38.2.研究结果
39.结果(对土壤ph、ec、水分和有机质含量的影响):图4为对照、bg-11培养液和微藻处理下太谷和应县土壤的ph a、ec b、水分c和有机质d含量图,与太谷土壤相比,应县土壤的ph高出20.8%,ec值高出40.7%(图4中a和b)。与对照相比,培养液和小球藻处理后的太谷和应县土壤的ph没有显著差异,培养液处理后的ec值分别增加了 91.8%和34.7%。与培养液处理相比,小球藻处理后的土壤ec值没有显著差异。
40.对照组应县与太谷土壤的含水量没有显著差异,而应县土壤的有机质含量比太谷土壤低 22.7%(图4中c和d)。培养液处理后的两种土壤的水分和有机质含量与对照相比均没有显著差异。小球藻od0.5、od1.0、od1.5和od2.0处理后的土壤含水量高于对照组,分别增加了7.2%、11.9%、13.4%和15.3%(太谷),11.1%、15.4%、14.9%和18.8%(应县)。太谷土壤在小球藻od1.0、od1.5和od2.0处理后的有机质含量也显著高于对照组,而对于应县土壤,只有小球藻od2.0处理增加了7.9%的有机质含量。
41.结果(对土壤总氮和养分含量的影响):图5为对照、bg-11培养基和微藻处理下的太谷和应县土壤的ph a、ec b、水分c和有机质d含量图。与太谷土壤相比,应县土壤的可利用氮、磷和钾含量高27.9%、28.1%和30.8%(图5中b-d)。与对照相比,培养液处理增加了太谷土壤中84.6%、85.8%和87.95%的可利用氮、磷和钾,以及应县土壤中 48.2%、43.6%和47.2%的可利用氮、磷和钾。与培养液相比,小球藻od0.5、od1.0和od1.5 处理后的太谷土壤以及小球藻od0.5处理后的应县土壤的可利用氮、磷和钾含量没有显著差异。小球藻处理也增加了两种土壤可利用氮、磷和钾的含量且随着剂量的增加而增加。小球藻od2.0处理后的太谷土壤与对照相比分别增加了103.5%、130.3%和117.3%的可利用氮、磷和钾含量,同时应县土壤分别增加了72.0%、71.8%和64.6%的可利用氮、磷和钾含量。
42.与应县土壤相比,对照组太谷土壤的总氮含量更高(36.9%)(图5中a)。与对照相比,培养液处理显著增加了两种土壤的总氮含量。小球藻od0.5处理下的太谷土壤以及小球藻 od1.5和od2.0处理下的应县土壤的总氮含量与培养液处理没有显著差异,而小球藻od1.0、 od1.5和od2.0处理增加了太谷土壤中9.9%、10.9%和11.4%的总氮含量,同时小球藻od1.5 和od2.0处理增加了应县土壤中16.3%和18.1%的总氮含量。在太谷土壤上,培养液和小球藻处理显著提高了土壤可利用氮和总氮的比率,且两种处理下的比率没有显著差异(图5中a 和b)。对于应县土壤可利用氮和总氮的比率,培养液和小球藻od0.5处理之间
没有显著差异,而小球藻od1.0、od1.5和od2.0与培养液处理相比,增加了5.3%、11.6%和11.1%的比率。
43.实施例3小球藻对盐碱地中藜麦的促生效果
44.1.实验设计及方法
45.陇藜1号藜麦种子和自然土壤由molecular agriculture and bioenergy,shanxiagricultural university,china提供,土壤(20cm土层)来源于taigu,shanxi (112
°
28'e-113
°
01
′
e,37
°
12
′
n-37
°
32
′
n)和yingxian,shanxi(112
°
58'e-113
°
37'e, 39
°
17'n-39
°
45'n),这些土样在阳光下晒6天,过3mm筛后置于阴凉处。土壤ph和盐度分别为:太谷7.2和0.5g kg-1
,应县9.3和0.5g kg-1
。应县土壤被认为是盐碱地,太谷土壤作为对照。
46.大小均匀的藜麦种子用75%乙醇浸泡2min,5%次氯酸钠浸泡10min,无菌蒸馏水冲洗3 次,放在含有湿滤纸上的直径15cm的培养皿中萌发8天。整个过程在温室(25
±
1℃和75%的相对湿度)中进行,在黑暗条件下放置3天,然后转移到100μmol photons m-2
s-1
的光强下进行5天(光周期16:8)。在培养第3天时,100ml蒸馏水灌溉应县和太谷土壤(每盆1kg土壤,共60盆),5天后进行盆栽试验(10.3cm
×
10.5cm)。状态一致的幼苗被筛选并转移至应县和太谷土壤中,一盆4株,并灌溉蒸馏水100ml,培养条件与萌发过程后5天一致。同时按照2.1.1的方法培养c.pyrenoidosa 8天至od680为2.0,且每隔8天培养1 次。盆栽试验包括2种土壤,6个处理(ck:蒸馏水;bg:bg-11培养液;d1:培养8天后的藻液用水稀释到od680为0.5;d2:培养8天后的藻液用水稀释到od680为1.0;d3:培养8 天后的藻液用水稀释到od680为1.5;d4:培养8天后的藻液)。藻液每隔8天灌溉1次,第1次灌溉前,每盆保留1株长势一致的幼苗。所有处理均将ph调节至7.0且仅在灌溉前配置好,以保证藻类处理的活力和数量。每个处理设置5个重复和一致的管理,试验周期为100 天。
47.土壤取样按照五点取样法从每盆中收集5-7cm土层的土壤(非根际)并充分混合以备测定土壤性质。将土壤放入105℃的坩埚中,在马弗炉中放置24小时,计算土壤重量损失量以评估土壤含水量。将风干的土壤与蒸馏水1:5混合30min后,用ph meter和salinity meter 测定土壤ph和电导率(ec)。土壤有机质含量采用重铬酸钾氧化比色法测定。
48.藜麦生长50天后,取样测定叶片叶绿素含量以及原位测定叶绿素荧光参数,方法参考 2.1.5和2.1.6。叶片spad值采用spad仪原位测定。
49.藜麦生长50天后,取样并采用蒽酮比色法、考马斯亮蓝法、硫代巴比妥酸法和酸提法测定藜麦叶片的可溶性糖、蛋白、丙二醛(mda)和花青素含量。超氧化物歧化酶(sod)和过氧化物酶(pod)活性采用氮蓝四唑法和愈创木酚法测定。
50.藜麦生长100天后进行收获,并计算种子数量和重量。藜麦株高、茎粗和干重分别使用直尺、游标卡尺和天平测定。
51.结果(对土壤ph、ec、水分和有机质含量的影响):图6为对照、bg-11培养基和微藻处理下太谷和应县土壤的ph a、ec b、水分c和有机质d含量图。对于太谷和应县土壤的ph,对照、培养液和小球藻处理之间没有显著性差异(图6中a)。与无藜麦土壤相比,对照组种植藜麦的太谷和应县土壤的ec值分别下降了25.1%和31.3%(图5中b和图6中b)。与对照相比,培养液处理显著增加了两种土壤ec值。小球藻与培养液处理后的太谷土壤的ec值没有显著差异,而小球藻处理后的应县土壤的ec值显著低于培养液处理,且小球藻处理之间没有显著差异。此外,培养液处理后的太谷和应县土壤水分和有机质含量与对照相比没有显
著差异,而小球藻处理均显著增加了二者的含量,且小球藻处理之间没有显著差异(图6中c和d)。
52.结果(对藜麦叶绿素含量的影响):图7为对照、bg-11培养基和微藻处理下太谷和应县土壤的藜麦的spad a和叶绿素含量b图。由图7可知,对照组应县土壤上藜麦的spad 值和叶绿素含量显著低于太谷土壤,分别下降了12.4%和18.8%。与对照相比,培养液处理下的藜麦spad值和叶绿素含量增加了25.3%和14.4%(太谷)以及23.9%和20.6%(应县),且小球藻处理后的藜麦spad值和叶绿素含量均显著高于培养液处理。与对照相比,小球藻 od0.5、od1.0、od1.5和od2.0处理后的藜麦spad值增加了25.2%、37.0%、49.7%和53.3% (太谷),40.1%、45.0%、64.8%和64.0%(应县),叶绿素含量增加了50.8%、57.5%、52.3%和56.4%(太谷),44.7%、61.6%、55.3%和58.6%(应县)。
53.结果(对藜麦光合系统的影响):图8为对照、bg-11培养基和微藻处理下太谷和应县土壤藜麦fv/fm a、etrm b、y(ii)c、qp d、αe和ik f结果图。与太谷土壤相比,对照组应县土壤上藜麦的fv/fm,y(ii),α和etrm分别下降了5.2%、7.3%、 11.9%和12.5%,而qp和ik没有显著差异(图8),且npq升高了34.0%(图9)。与对照相比,培养液处理显著增加了太谷和应县土壤上藜麦的ik,而fv/fm、y(ii)、qp、npq、α和etrm均没有显著差异(图8)。在两种土壤上,小球藻处理后藜麦的fv/fm、y(ii)、etrm 和ik显著高于对照组,且这些值在小球藻处理之间没有显著差异。与对照相比,小球藻od1.0、 od1.5和od2.0处理太谷土壤后藜麦的qp分别增加了8.7%、6.4%和5.9%,同时小球藻od0.5、 od1.0和od1.5处理应县土壤后藜麦的qp分别增加了8.5%、12.5%和8.3%,且处理之间没有显著差异(图8中d)。太谷土壤上藜麦的α和npq在对照、培养液和小球藻处理之间没有显著差异。而在应县土壤上,与对照相比,小球藻od1.0和od1.5处理后藜麦的α增加了11.4%,相反的是,小球藻od0.5、od1.0、od1.5和od2.0处理后藜麦的npq减少了23.1%、29.0%、 27.1%和27.8%(图8中e和图9)。
54.结果(对藜麦叶片生化组分的影响):图10为对照、bg-11培养基和微藻处理下太谷和应县土壤的藜麦的mda a、可溶性糖b、花青素c、总蛋白d、sod e和pod f图。小球藻处理后的太谷土壤上藜麦的可溶性糖和蛋白含量与对照相比没有显著差异,而花青素含量增加了89.4%、77.8%、65.9%和65.3%(图10中b-d)。与对照相比,培养液处理两种土壤后的藜麦叶片的可溶性糖和蛋白含量没有显著变化,而花青素含量增加了57.0% (太谷)和21.4%(应县)。与太谷土壤相比,应县土壤对照组藜麦叶片的可溶性糖含量没有显著变化,而蛋白含量减少了36.3%,花青素含量增加了44.4%。对于应县土壤,与对照相比,小球藻od0.5、od1.0、od1.5和od2.0处理后藜麦叶片可溶性糖含量增加了83.8%、131.3%、 109.5和70.4%,蛋白含量增加了43.0%、36.0%、32.9%和34.1%,花青素含量增加了37.9%、 62.5%、25.7%和26.6%。
55.对于太谷土壤,所有处理之间的藜麦叶片的mda、sod和pod含量没有显著差异(图10 中a,e和f)。对照组应县土壤上藜麦叶片的mda、sod和pod含量与太谷土壤相比增加了 64.0%、64.7%和53.2%。小球藻od0.5、od1.0、od1.5和od2.0处理显著降低了应县土壤上藜麦叶片mda、sod和pod含量,且处理之间没有显著差异。
56.结果(对藜麦生长和产量的影响):图11为对照、bg-11培养基和微藻处理下太谷和应县土壤的藜麦的生长情况图。图12为对照、bg-11培养基和微藻处理下太谷和应县土壤的藜麦的株高a、茎粗b和干重c图。与对照相比,太谷土壤上藜麦在培养液处理后的株高没有
显著变化,而茎粗和干重分别增加了11.7%和13.8%,应县土壤上藜麦在处理后的株高、茎粗和干重分别增加了12.2%、12.0%和15.6%(图11和图12)。小球藻处理两种土壤后的藜麦株高、茎粗和干重显著大于培养液处理,且小球藻处理之间没有显著差异(除了应县土壤上的藜麦干重)。与对照相比,小球藻od0.5处理太谷土壤后的藜麦株高、茎粗和干重提高了22.4%、31.9%和65.6%,处理应县土壤后的藜麦株高和茎粗提高了27.0%和31.7%,同时小球藻od0.5、od1.0、od1.5和od2.0处理后干重分别增加了35.4%,74.1%,72.8%,和68.0%。
57.图13为对照、bg-11培养基和微藻处理下太谷和应县土壤的藜麦的种子数量a和种子重量b图。与太谷土壤相比,对照组应县土壤上藜麦的种子数量和重量降低了22.6%和 23.7%(图13)。培养液处理后,两种土壤上藜麦的种子数量和重量与对照相比没有显著变化。在太谷和应县土壤上,小球藻od2.0与对照处理相比,藜麦种子数量和重量增加了28.4%和28.6%(太谷),29.8%和28.2%(应县),而在小球藻处理之间没有显著差异。
58.以上所述的实施例仅是对本发明的优选方式进行描述,并非对本发明的范围进行限定,在不脱离本发明设计精神的前提下,本领域普通技术人员对本发明的技术方案做出的各种变形和改进,均应落入本发明权利要求书确定的保护范围内。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。