1.本发明属于植物多倍体诱导培育技术领域,尤其涉及一种适用于芳香药用植物牛至多倍体品种创新培育的方法。
背景技术:
2.牛至是唇形科(lamiaceae)牛至属(origanum)多年生草本或半灌木植物,原产于欧洲南部及地中海地区,我国西北、华北及长江流域以南地区都有分布。牛至是一种重要的经济植物,在欧洲地区长期作为香料使用,在中国以全株入药,用于预防流感,治疗急性胃肠炎、腹痛、小儿食积腹胀等症。从牛至中提取的精油具有良好的抑菌消炎、抗氧化等作用。牛至精油具有提高动物机体免疫力和促进动物生长的作用,是一种理想的抗生素替代品,已是在世界范围内认可的天然饲料添加剂。
3.牛至在我国虽然分布广泛,但野生资源量较少,而我国目前仍以野生资源开发为主,尚无大规模人工栽培。近年来随着需求量的增加,野生资源因被无序采挖而遭到严重破坏。由此可见,牛至产业的发展亟需解决资源匮乏、供应不足的瓶颈问题。此外,我国野生牛至主产地的牛至精油含量偏低,而人工种植规模小,产量不稳定,质量良莠不齐,生产用种质混乱,缺乏统一纯化的优良种质。因此,培育和筛选优质牛至种质,并建立牛至种质的高效繁殖技术是牛至产业发展的重要一环。
4.多倍体育种对于植物遗传改良的重要地位已被广泛认可。一般而言,多倍体具有植株长势旺盛、营养和生殖器官增大的特性。研究证实,多倍体的次生代谢产物的含量与相应二倍体相比也会大幅提高,是开展植物品种改良的有效手段,然而芳香药用植物多倍体育种技术研究和应用相对较少。开展多倍体育种技术研究最直接、便捷的方法是运用秋水仙素等药剂对植物体生长旺盛的器官进行诱导,包括种子、茎尖和组织培养物等。其中,异花授粉植物产生的种子作为诱导材料时,无法保留相同基因型的二倍体对照,也易提升双亲优良种性丢失的风险。以茎尖作为诱导材料常伴随工作量大、诱导条件不易控制、药品消耗量大、变异率低、后代扩增速度慢等问题。组织培养中的愈伤组织是最常用的离体诱导材料,但存在技术要求高、诱导率低、易出现混倍体、出苗不整齐等问题。目前尚未有牛至多倍体育种的报道,尽管牛至的组织培养技术已有一定的研究,但尚无离体加倍技术的探索。
5.参考文献:
6.林泋君.牛至的组织培养和快速繁殖[j].植物生理学通讯,2006,42(6):1138.刘艳,黄红燕,李金荣,等.天然植物“抗生素”牛至资源及繁育研究进展[j].中国野生植物资源,2020,39(9):51
–
56.
[0007]
刘艳,卓维,卢圣鄂,等.牛至生殖生物学特性研究[j].中国野生植物资源,2021,40(7):13
–
18.
[0008]
沙红.几种药用芳香植物组织培养快速繁殖的研究[d].乌鲁木齐:新疆农业大学,2004.
[0009]
沙红,廖康.药用植物牛至的组织培养技术研究[j].新疆农业大学学报,2003,26
(4):49
–
51.
[0010]
殷庭超,王怡超,杨鹏三,等.营养液浓度和基质配比对牛至扦插繁殖的影响[j].草业科学,2021,38(7):1301
–
1309.
[0011]
欧盟评估牛至精油作为饲料添加剂的安全性和有效性[eb/ol].(2019-12-3).http://news.foodmate.net/2019/12/542742.html
[0012]
lattanzio v,cardinali a,ruta c,et al.relationship of secondary metabolism to growth in oregano(origanum vulgare l.)shoot cultures under nutritional stress.environmental and experimental botany,2009,65(1):54
–
62.
[0013]
nanova z,slavova y.mass vegetative propagation of winter marjoram(origanum vulgare ssp.hirtum(link)jetswaart).bulgarian journal of agricultural science,2006,12:531
–
536.
[0014]
pandey a,belwal t,tamta s,et al.phenolic compounds,antioxidant capacity and antimutagenic activity in different growth stages of in vitro raised plants of origanum vulgare l.molecular biology reports,2019,46:2231
–
2241.
[0015]
yegorova na,yakimova ov.the effect of long-term subcultivation on clonal micropropagation of melissa officinalis l.and origanum vulgare l.2019.
技术实现要素:
[0016]
为了解决上述问题,本发明提供一种适用于芳香药用植物牛至多倍体的培育方法,该方法不仅能够快速获得牛至多倍体,而且可以在短时间内获得大量遗传一致的多倍体植株,对牛至育种研究和大规模生产具有重要意义。
[0017]
本发明提供一种牛至四倍体植株诱导和培育的方法,将牛至无菌苗茎段上萌动的腋芽在离体培养基上进行秋水仙素诱导,然后通过倍性鉴定进行四倍体筛选,再通过配套的离体快繁技术扩增,获得四倍体牛至植株。
[0018]
其中,所述的无菌苗的获得方式为:选取健康、无病虫害的牛至嫩梢作为外植体,表面灭菌后,接种于1/2ms 0.1~0.5mg/l6-ba 3%蔗糖的启动培养基中,待外植体恢复生长后接种于ms 0.5~1.0mg/l 6-ba 3%蔗糖的扩增培养基中,获得大量长势一致的无菌苗。
[0019]
其中,所述的秋水仙素的诱导方法为:配制诱导培养基ms 0.5~1.0mg/l 6-ba 0.05~0.2mg/l iba 3%蔗糖,趁灭菌后的诱导培养基未冷却固化前,量取诱导培养基灌装于无菌容器内,待诱导培养基充分冷却固化后,将所述的无菌苗剪成只有一个节的茎段,接种至所述诱导培养基中,使茎段叶腋处低于诱导培养基上表面,观察茎段腋芽的萌动情况,3~6天后,吸取0.1%秋水仙素无菌溶液,分次均匀滴加至上述容器内,置于黑暗环境中培养,所述诱导培养基与所述秋水仙素无菌溶液的体积比为10:0.1~1;24~72小时后将茎段从诱导培养基中取出,用无菌水清洗2次,接种至ms 0.05~0.2mg/l 6-ba 0.05~0.1mg/l naa 2%蔗糖的恢复培养基中。
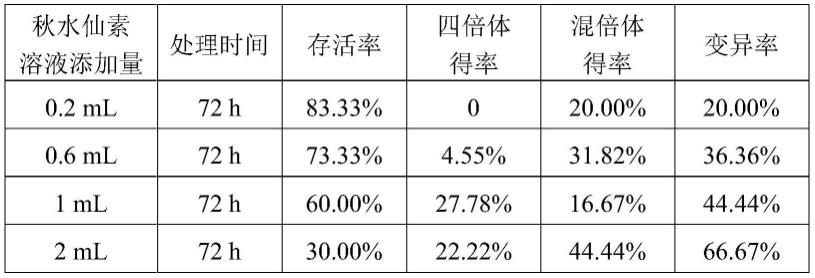
[0020]
本发明使用秋水仙素诱导牛至茎段腋芽时,通过诱导培养基预培养,使不同生理状态的茎段腋芽能够在同时间萌动,避免了因发育不一致导致的诱导率低的问题,为后续
诱导处理打下坚实基础。在接种诱导培养基时,使茎段叶腋处被诱导培养基包裹,在向诱导培养基表面添加秋水仙素无菌溶液后,该无菌溶液逐步被固化的诱导培养基吸收,然后再作用至萌动的腋芽。该处理方式利用固体培养基吸收秋水仙素溶液,使包裹在诱导培养基中的腋芽能够缓慢但充分的与秋水仙素接触,不但有效提高了变异率,还减轻了秋水仙素长时间直接浸泡茎段带来的毒害作用。
[0021]
在本发明一个实施方案中,可通过本领域常规的倍性检测方法检测诱导芽的倍性,优选的,经过秋水仙素诱导的芽生长至至少具有3对叶片时,剪取叶片,用流式细胞仪进行检测,确定倍性。
[0022]
其中,所述的配套的离体快繁技术包括:将鉴定为四倍体的诱导芽剪成具有一个节的茎段,接种于1/6~2/3ms 1/3~2/3n6 0.5~2.0mg/l 6-ba 0.1~0.3mg/l iba 3%蔗糖的增殖培养基中,20~25天后将茎段上分化出的不定芽分段剪下接种于ms 0.1~0.3mg/l 6-ba 0.05~0.2mg/l naa 3%蔗糖的壮苗培养基中,培养7~10天获得生长一致的牛至四倍体无菌苗。
[0023]
更进一步地,所述的配套的离体快繁技术还包括:将获得的牛至四倍体无菌苗接种于1/2ms 0.1~0.5mg/l naa 2%蔗糖的生根培养基中进行生根培养。
[0024]
更进一步地,所述的配套的离体快繁技术还包括:生根培养10~15天后,将牛至四倍体生根苗连同培养容器转移至温室,打开容器盖炼苗5~7天,栽种于常规培养基质中,正常管理。
[0025]
其中,外植体表面灭菌方法为:用洗洁精水浸泡10~20min后自来水冲洗5~8次至无洗洁精残留,转移至超净工作台内,加入75%酒精表面消毒10~30s,无菌水冲洗2次,用0.1~0.2%升汞消毒4~8min,无菌水冲洗6~8次。
[0026]
其中,0.1%秋水仙素无菌溶液可通过本领域常规方法配制,优选的,将秋水仙素用二甲基亚砜助溶后配制成0.1%的溶液,高压灭菌。
[0027]
本发明提供一种获得牛至多倍体植株的方法,该方法通过扩增培养获得大量长势一致的牛至无菌苗,利用无菌苗茎段作为诱导材料,诱导腋芽萌动,然后利用低剂量的秋水仙素处理,再通过流式细胞仪鉴定,获得牛至四倍体无菌芽,再通过增殖和生根,最终可获得大量长势整齐一致的牛至四倍体植株。
[0028]
本发明具有如下有益效果:
[0029]
本发明使用的是牛至茎段萌动的腋芽,此时该部位细胞数量不多,且处于相对一致的生长状态,容易受外源秋水仙素处理,是最佳诱导时期,因此成功获得了牛至四倍体诱导芽。同时,本发明基于离体培养技术,利用茎段腋芽作为诱导材料,有效避免了使用愈伤组织引起的混倍体概率高以及不定芽长势不一致等问题。
[0030]
牛至是异花授粉兼自花授粉植物,以种子作为诱导材料极有可能出现因后代性状分离导致选育时间大幅延长的问题。本发明在先获得无菌苗的基础上再进行四倍体的诱导,可精准保留其二倍体对照,从而有效缩短四倍体培育周期。
[0031]
本发明还提供了配套的牛至四倍体离体快繁方法,与牛至现有二倍体的离体快繁技术相比,具有增殖系数高、周期短的优势,还不易出现玻璃化,实现了诱导率和出苗率的同步提高。由于是在最佳诱导时期进行诱导,因此使用的秋水仙素剂量低,在确保诱导效率的同时,避免了长时间或大剂量浸泡引起的毒害作用,使诱导苗得以迅速恢复生长,大大缩
短了四倍体植株的快繁时间。
[0032]
本发明所用药剂均属常规药剂,操作过程简便,成本低,周期短,可以作为培育牛至新种质的重要方法,具有良好的应用前景。
附图说明
[0033]
图1所示为流式细胞仪检测牛至诱导芽倍性变化。a为二倍体对照,b表示四倍体,c表示混倍体。
具体实施方式
[0034]
为详细说明本发明技术内容,下面提供具体实施例。需要说明的是,以下结合具体实施方式旨在进一步说明本发明,但本发明所述的方法和保护的范围并不限于此。
[0035]
以下实施例所用的试剂和方法如无特别说明,均按常规方法配制和操作;所用的试剂,均可从商业途径得到。
[0036]
本发明的方法包括如下步骤:
[0037]
1、无菌苗获得:选取健康、无病虫害的牛至嫩梢作为外植体,用洗洁精水浸泡10~20min后自来水冲洗5~8次至无洗洁精残留,转移至超净工作台内,加入75%酒精表面消毒10~30s,无菌水冲洗2次,用0.1~0.2%升汞消毒4~8min,无菌水冲洗6~8次。将消毒后的外植体切成小段,接种于1/2ms 0.1~0.5mg/l 6-ba 3%蔗糖的启动培养基中。待外植体恢复生长后接种于ms 0.5~1.0mg/l 6-ba 3%蔗糖的扩增培养基中,获得大量长势一致的无菌苗。
[0038]
2、诱变处理:将通过步骤1获得的无菌苗剪成只有一个节的茎段,接种至ms 0.5~1.0mg/l 6-ba 0.05~0.2mg/l iba 3%蔗糖的诱导培养基中预培养3~6天。吸取0.1%秋水仙素无菌溶液,分次均匀滴加至上述容器内,置于黑暗环境中培养,所述诱导培养基与所述秋水仙素无菌溶液的体积比为10:0.1~1。24~72小时后将处理的茎段取出,用无菌水清洗2次,接种至ms 0.05~0.2mg/l 6-ba 0.05~0.1mg/l naa 2%蔗糖的恢复培养基中。
[0039]
秋水仙素制备和处理:将秋水仙素用二甲基亚砜助溶后配制成0.1%的溶液,高压灭菌。
[0040]
3、倍性检测:待步骤2获得的诱导芽生长至至少具有3对叶片时,剪取叶片,用流式细胞仪进行检测,确定倍性。
[0041]
4、增殖培养:将鉴定为四倍体的诱导芽剪成具有一个节的茎段,接种于1/6~2/3ms 1/3~2/3n6 0.5~2.0mg/l 6-ba 0.1~0.3mg/l iba 3%蔗糖的增殖培养基中,20~25天后将茎段上分化出的不定芽分段剪下接种于ms 0.1~0.3mg/l 6-ba 0.05~0.2mg/lnaa 3%蔗糖的壮苗培养基中,培养7~10天获得生长一致的牛至四倍体无菌苗。
[0042]
5、生根培养和炼苗移栽:将步骤4获得的牛至四倍体无菌苗接种于1/2ms 0.1~0.5mg/l naa 2%蔗糖的生根培养基中。10~15天后将牛至四倍体生根苗连同培养容器转移至温室,打开容器盖炼苗5~7天,栽种于常规培养基质中,正常管理。
[0043]
实施例1
[0044]
本实施例以大根香叶烯型牛至origanum vulgare ssp.vulgare为例,描述o.vulgare ssp.vulgare多倍体植株的诱导方法,包括以下步骤:
[0045]
1、无菌苗获得:选取健康、无病虫害的嫩梢作为外植体,用洗洁精水浸泡20min后自来水冲洗6次,转移至超净工作台内,加入75%酒精表面消毒30s,无菌水冲洗2次,用0.1%升汞消毒5min,无菌水冲洗6次。将消毒后的外植体切成小段,接种于1/2ms 0.1mg/l 6-ba 3%蔗糖的启动培养基中。待外植体恢复生长后接种于ms 1.0mg/l 6-ba 3%蔗糖的扩增培养基中,获得生长一致的无菌苗。
[0046]
2、诱变处理:将通过步骤1获得的无菌苗剪成只有一个节的茎段,接种至ms 0.5mg/l 6-ba 0.05mg/l iba 3%蔗糖的诱导培养基中预培养6天。向培养基中添加秋水仙素无菌溶液,置于黑暗环境中培养。72小时后将处理的茎段取出,用无菌水清洗2次,接种至ms 0.05mg/l 6-ba 0.05mg/l naa 2%蔗糖的恢复培养基中。
[0047]
秋水仙素制备和处理:将秋水仙素用二甲基亚砜助溶后配制成0.1%的溶液,高压灭菌。量取灭菌的诱导培养基20ml灌装于无菌容器内,待冷却固化后接种无菌苗茎段。吸取0.1%秋水仙素无菌溶液0.2~2ml,分次均匀滴加至诱导培养基上。
[0048]
3、倍性检测:待步骤2获得的诱导芽生长至至少具有3对叶片时,剪取叶片,在细胞核裂解液中用锋利的双面刀片快速切碎,过滤后,加入pi染液,用流式细胞仪进行检测,确定倍性。
[0049][0050]
观察发现,随着秋水仙素处理浓度的增加,茎段腋芽的变异率上升,但腋芽的存活率下降。尽管2ml的秋水仙素处理使变异率达到66.67%,但腋芽存活率仅为30.00%,且混倍体出现概率较高。而1ml的秋水仙素处理,茎段腋芽存活率超过50%,四倍体得率超过混倍体得率,且混倍体发生率明显低于其它处理。
[0051]
4、增殖培养:将鉴定为四倍体的诱导芽剪成具有一个节的茎段,接种于1/2ms 1/2n6 1.5mg/l 6-ba 0.1mg/l iba 3%蔗糖的增殖培养基中,25天后将茎段上分化出的不定芽分段剪下接种于ms 0.1mg/l 6-ba 0.1mg/l naa 3%蔗糖的壮苗培养基中,培养10天获得生长一致的四倍体无菌苗。
[0052]
5、生根培养和炼苗移栽:将步骤4获得的四倍体无菌苗接种于1/2ms 0.2mg/l naa 2%蔗糖的生根培养基中。12天后将四倍体生根苗连同培养容器转移至温室,打开容器盖炼苗5天,栽种于常规培养基质中,正常管理。
[0053]
四倍体茎段在增殖培养基中,10天内生长发育缓慢,此时为腋芽萌发和发育时期;10天后,腋芽完全萌发并生长迅速;25天后,将腋芽按节分段接种壮苗培养基,最终每个单节茎段外植体平均可获得14个健壮四倍体不定芽。四倍体生根率为100%,移栽成活率95%。
[0054]
本实施例结果表明,利用本发明的技术方法能够获得大根香叶烯型牛至
o.vulgare ssp.vulgare四倍体植株。
[0055]
实施例2
[0056]
本实施例以香芹酚型牛至origanum vulgare ssp.hirtum为例,描述o.vulgare ssp.hirtum多倍体的诱导方法,包括以下步骤:
[0057]
1、无菌苗获得:选取健康、无病虫害的嫩梢作为外植体,用洗洁精水浸泡10min后自来水冲洗6次,转移至超净工作台内,加入75%酒精表面消毒20s,无菌水冲洗2次,用0.1%升汞消毒6.5min,无菌水冲洗8次。将消毒后的外植体切成小段,接种于1/2ms 0.2mg/l 6-ba 3%蔗糖的启动培养基中。待外植体恢复生长后接种于ms 0.8mg/l 6-ba 3%蔗糖的扩增培养基中,获得生长一致的无菌苗。
[0058]
2、诱变处理:将通过步骤1获得的无菌苗剪成只有一个节的茎段,接种至ms 1.0mg/l 6-ba 0.1mg/l iba 3%蔗糖的诱导培养基中预培养3天。向培养基中添加秋水仙素无菌溶液,置于黑暗环境中培养。24~72小时后将处理的茎段取出,用无菌水清洗2次,接种至ms 0.1mg/l 6-ba 0.1mg/l naa 2%蔗糖的恢复培养基中。
[0059]
秋水仙素制备和处理:将秋水仙素用二甲基亚砜助溶后配制成0.1%的溶液,高压灭菌。量取诱导培养基20ml灌装于无菌容器内,待冷却固化后接种无菌苗茎段。吸取0.1%秋水仙素无菌溶液1~2ml,分次均匀滴加至诱导培养基上。
[0060]
3、倍性检测:待步骤2获得的诱导芽生长至至少具有3对叶片时,剪取叶片,在细胞核裂解液中用锋利的双面刀片快速切碎,过滤后,加入pi染液,用流式细胞仪进行检测,确定倍性。
[0061][0062]
观察统计上述诱导和培育过程发现:
[0063]
1ml秋水仙素处理24~72h均可获得四倍体,其中1ml秋水仙素处理72h,茎段腋芽存活率低于50%,但四倍体得率最高,且混倍体发生率较低。此外,2ml秋水仙素处理48h,混倍体发生率极低,尽管存活率最低,但四倍体得率相对较高。
[0064]
4、增殖培养:将鉴定为四倍体的诱导芽剪成具有一个节的茎段,接种于1/6ms 2/3n6 1.0mg/l 6-ba 0.2mg/l iba 3%蔗糖的增殖培养基中,22天后将茎段上分化出的不定芽分段剪下接种于ms 0.1mg/l 6-ba 0.1mg/l naa 3%蔗糖的壮苗培养基中,培养8天获得生长一致的四倍体无菌苗。
[0065]
5、生根培养和炼苗移栽:将步骤4获得的四倍体无菌苗接种于1/2ms 0.3mg/l naa 2%蔗糖的生根培养基中。12天后四倍体生根率为100%,将生根苗连同培养容器转移至温室,打开容器盖炼苗5天,栽种于常规培养基质中,正常管理。
[0066]
四倍体茎段在增殖培养基中,一周内生长发育缓慢,此时为腋芽萌发和发育时期;
一周后,腋芽完全萌发并生长迅速;22天后,将腋芽按节分段接种壮苗培养基,最终每个单节茎段外植体可获得10个健壮四倍体不定芽。四倍体生根率为96%,移栽成活率为100%。
[0067]
本实施例结果表明,利用本发明的技术方法能够获得香芹酚型牛至o.vulgare ssp.hirtum四倍体植株。
[0068]
实施例3
[0069]
本实施例以百里香酚型牛至origanum vulgare
‘
samothrake’为例,描述o.vulgare
‘
samothrake’多倍体的诱导方法,包括以下步骤:
[0070]
1、无菌苗获得:选取健康、无病虫害的嫩梢作为外植体,用洗洁精水浸泡15min后自来水冲洗5次,转移至超净工作台内,加入75%酒精表面消毒30s,无菌水冲洗2次,用0.2%升汞消毒5min,无菌水冲洗8次。将消毒后的外植体切成小段,接种于1/2ms 0.3mg/l 6-ba 3%蔗糖的启动培养基中。待外植体恢复生长后接种于ms 0.5mg/l 6-ba 3%蔗糖的增殖培养基中,获得生长一致的无菌苗。
[0071]
2、诱变处理:将通过步骤1获得的无菌苗剪成只有一个节的茎段,接种至ms 1.0mg/l 6-ba 0.1mg/l iba 3%蔗糖的诱导培养基中预培养4天。向培养基中添加秋水仙素无菌溶液,置于黑暗环境中培养。48~72小时后将处理的茎段取出,用无菌水清洗2次,接种至ms 0.1mg/l 6-ba 0.05mg/l naa 2%蔗糖的恢复培养基中。
[0072]
秋水仙素制备和处理:将秋水仙素用二甲基亚砜助溶后配制成0.1%的溶液,高压灭菌。量取诱导培养基20ml灌装于无菌容器内,待冷却固化后接种无菌苗茎段。吸取0.1%秋水仙素无菌溶液1~2ml,分次均匀滴加至诱导培养基上。
[0073]
3、倍性检测:待步骤2获得的诱导芽生长至3对叶片时,剪取诱导芽第二节叶片,置于细胞核裂解液中用锋利的双面刀片快速切碎,过滤后,加入pi染液,用流式细胞仪进行检测,确定倍性。
[0074][0075]
观察统计上述诱导和培育过程发现:
[0076]
1~2ml秋水仙素处理48~72h均可获得四倍体,秋水仙素浓度的提高和处理时间的延长均使茎段腋芽萌发率下降,其中2ml秋水仙素处理48h,四倍体得率将近30%,明显高于其它处理。
[0077]
4、增殖培养:将鉴定为四倍体的诱导芽剪成具有一个节的茎段,接种于1/2ms 2/3n6 0.9mg/l 6-ba 0.05mg/l iba 3%蔗糖的增殖培养基中,20天后将茎段上分化出的不定芽分段剪下接种于ms 0.1mg/l 6-ba 0.05mg/l naa 3%蔗糖的壮苗培养基中,培养10天获得生长一致的四倍体无菌苗。
[0078]
5、生根培养和炼苗移栽:将步骤4获得的四倍体无菌苗接种于1/2ms 0.4mg/l naa
2%蔗糖的生根培养基中。15天后四倍体生根率为100%,将生根苗连同培养容器转移至温室,打开容器盖炼苗6天,栽种于常规培养基质中,正常管理。
[0079]
四倍体茎段在增殖培养基中,5天内生长发育缓慢,此时为腋芽萌发和发育时期;5天后,腋芽完全萌发并生长迅速;20天后,将腋芽按节分段接种壮苗培养基,最终每个单节茎段外植体约可获得10个健壮四倍体不定芽。四倍体生根率为88%,移栽成活率为90%。
[0080]
本实施例结果表明,利用本发明的技术方法能够获得百里香酚型牛至o.vulgare
‘
samothrake’四倍体植株。
[0081]
以上所述仅是本发明的优选实施方式,应当指出,对于本技术领域的普通技术人员来说,在不脱离本发明技术原理的前提下,还可以做出若干改进和润饰,这些改进和润饰也应视为本发明的保护范围。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。