dnj及其衍生物在制备预防和/或治疗肺动脉高压药物中的应用
技术领域
1.本发明涉及药物技术领域,具体涉及dnj及其衍生物在制备预防和/或治疗肺动脉高压药物中的应用。
背景技术:
2.肺动脉高压(pulmonary arterial hypertension,pah)号称心血管肿瘤,是一类以肺动脉压力持续升高为特征的疾病,最终导致右心肥厚、心衰甚至死亡。当前临床上无特效治疗药物,患者预后极差,在接受治疗的情况下其一年死亡率仍高达15%。血管内皮是维持血管正常结构与功能,保护血管免受危险因子损伤的屏障。肺动脉内皮损伤(endothelial injury)是诱发肺动脉高压血管病变的关键病理机制,其中肺动脉内皮细胞(pulmonary arterial endothelial cells,paecs)的过度凋亡、迁移可引起内皮通透性增加从而导致其屏障功能被破坏,是肺血管损伤的始动环节。
3.骨形成蛋白2型受体(bone morphogenetic protein receptor type 2,bmpr2)是一种主要表达于肺动脉内皮细胞的丝氨酸/苏氨酸激酶受体。多项研究显示,bmpr2基因突变、炎症、氧化应激等多种致病因素均可导致bmpr2表达显著降低,引起bmpr2信号通路下调,是诱发肺动脉高压形成的关键病理机制之一。目前研究发现溶酶体降解是导致内皮bmpr2缺失的关键因素。
4.溶酶体(lysosomes)是真核细胞中的一种细胞器,其内含多种水解酶,用于分解各种外源及内源大分子物质,在降解和回收细胞废物,细胞信号传导以及能量代谢中起重要作用。溶酶体与人类疾病有着较密切的关系,溶酶体异常会引发多种疾病。
5.dnj是从桑树中发现的一种天然生物碱。中文名称是1-脱氧野尻霉素,分子量为163.7。dnj作为一种α糖苷酶抑制剂,可显著延缓多糖的降解过程,研究方向大多在降血糖,抗病毒、抗肿瘤转移这三个方面,并且不损伤肝肾健康,无胃肠道副作用。基于dnj,现已开发两个市售药物:治疗溶酶体贮积症戈谢病的米格鲁特以及治疗2型糖尿病的米格列醇。其中溶酶体贮积症戈谢病也称脑苷脂沉积症,是一种由于酸性β-葡萄糖脑苷脂酶基因突变引起的常染色体隐性遗传病,虽然突变后的酶活仍有部分保持,但由于结构异常,大部分酶发生内质网关联降解不能运转至溶酶体,导致其底物葡萄糖脑苷脂不能正常降解,而在溶酶体中贮积。但相关技术中,并无dnj在预防和/或治疗肺动脉高压药物中的应用,也无其在预防和/或治疗肺动脉高压药物中的相关机理研究。
6.基于以上背景,开发了一种dnj及其衍生物在制备预防和/或治疗肺动脉高压药物中的应用。
技术实现要素:
7.本发明要解决的技术问题为:dnj及其衍生物在制备预防和/或治疗肺动脉高压药物中的应用。
8.为解决上述技术问题,本发明提供的技术方案为:dnj及其衍生物在制备预防和/或治疗肺动脉高压药物中的应用。
9.根据本发明的一些实施方式,所述dnj及其衍生物包括如通式(i)所示的化合物或其药理上容许的盐中的至少一种:
[0010][0011]
其中,r选自h、烃基、羟烷基和烷氧基中的一种;
[0012]
r1选自h或羟基中的一种。
[0013]
通式(i)中1至6指代碳的位置。
[0014]
根据本发明的一些实施方式,所述通式(i)中c2,c3,c4,c5位取代基的立体化学组合选自(2r,3s,4r,5r),(2r,3s,4r,5s),(2r,3s,4s,5r),(2r,3r,4r,5r),(2r,3r,4r,5s),(2r,3s,4s,5s)中的一种。
[0015]
dnj具有稳定溶酶体的功能,dnj上调了bmpr2表达,从而缓解肺动脉高压进程。
[0016]
bmpr2在pah发生发展中发挥着重要作用,干预溶酶体降解bmpr2这一过程,实现对pah的治疗。
[0017]
根据本发明的一些实施方式,所述烃基选自烷基、烯基、芳基或取代芳基。
[0018]
根据本发明的一些实施方式,所述烷基包括c1~c
12
的烷基。
[0019]
根据本发明的一些实施方式,所述烷基包括丙基、正丁基、正壬基和金刚烷基中的至少一种。
[0020]
根据本发明的一些实施方式,所述烯基包括c1~c
12
的烯基。
[0021]
根据本发明的一些实施方式,所述烯基包括乙烯基、丙烯基、烯丙基中的至少一种。
[0022]
根据本发明的一些实施方式,所述烷氧基包括含3~30个原子的烷氧基。
[0023]
根据本发明的一些实施方式,所述烷氧基包括乙二醇基、二聚乙二醇基、三聚乙二醇基中的至少一种。
[0024]
根据本发明的一些实施方式,所述羟烷基包括3~30个原子的羟烷基。
[0025]
根据本发明的一些实施方式,所述羟烷基包括羟甲基、羟乙基、羟丙基和羟丁基中的至少一种。
[0026]
根据本发明的一些实施方式,所述芳基包括含6~30个原子的芳基。
[0027]
根据本发明的一些实施方式,所述芳基包括苄基、萘基和联苯基中的至少一种。
[0028]
根据本发明的一些实施方式,所述取代芳基包括含6~30个原子的取代芳基。
[0029]
根据本发明的一些实施方式,所述取代芳基包括苯乙基、苯丙基、4-甲氧基苯丙基中的至少一种。
[0030]
根据本发明的一些实施方式,所述dnj及其衍生物包括如下式所示的化合物dl-1至dl-15中的至少一种:
[0031][0032]
根据本发明的一些实施方式,所述药物的制备原料还包括药用载体。
[0033]
根据本发明的一些实施方式,所述药用载体为药学领域常规的药物载体。
[0034]
根据本发明的一些实施方式,所述药用载体包括稀释剂、赋形剂、填充剂、黏合剂、崩解剂、吸收促进剂、表面活性剂、吸附载体、润滑剂、甜味剂和香味剂中的至少一种。
[0035]
根据本发明的一些实施方式,所述赋形剂包括水。
[0036]
根据本发明的一些实施方式,所述填充剂包括淀粉和蔗糖中的至少一种。
[0037]
根据本发明的一些实施方式,所述黏合剂包括纤维素衍生物、藻酸盐、明胶和聚乙烯吡咯烷酮中的至少一种。
[0038]
根据本发明的一些实施方式,所述湿润剂包括甘油。
[0039]
根据本发明的一些实施方式,所述崩解剂包括琼脂、碳酸钙和碳酸氢钠中的至少一种。
[0040]
根据本发明的一些实施方式,所述吸收促进剂包括季铵化合物。
[0041]
根据本发明的一些实施方式,所述表面活性剂包括十六烷醇。
[0042]
根据本发明的一些实施方式,所述吸附载体包括高岭土和皂黏土中的至少一种。
[0043]
根据本发明的一些实施方式,所述润滑剂包括滑石粉、硬脂酸钙、硬脂酸镁和聚乙二醇中的至少一种。
[0044]
根据本发明的一些实施方式,本发明所述药理学上容许的盐包括与无机酸、有机酸、碱金属、碱土金属和碱性氨基酸形成的盐。
[0045]
根据本发明的一些实施方式,所述无机酸包括盐酸、硝酸、硫酸、磷酸、氢溴酸中的
至少一种。
[0046]
根据本发明的一些实施方式,所述有机酸包括马来酸、富马酸、酒石酸、乳酸、柠檬酸、乙酸、甲磺酸、对甲苯磺酸、己二酸、棕榈酸和单宁酸中的至少一种。
[0047]
根据本发明的一些实施方式,所述碱金属包括锂、钠和钾中至少一种。
[0048]
根据本发明的一些实施方式,所述碱土金属包括钙和镁中至少一种。
[0049]
根据本发明的一些实施方式,所述碱性氨基酸包括赖氨酸。
[0050]
根据本发明的一些实施方式,所述药物的剂型为本领域常规的各种剂型,优选地为固体、半固体或液体的形式,可以为水溶液、非水溶液或混悬液,更优选地为片剂、胶囊剂、软胶囊剂、颗粒剂、丸剂、口服液、干混悬剂、滴丸剂、干浸膏剂、注射剂或输注剂。根据本发明的一些实施方式,所述药物的给药方式可以为本领域常规的给药方式,包括但不限于注射给药或口服给药。所述注射给药可以为静脉注射、肌肉注射、腹腔注射、皮内注射或皮下注射等途径。
[0051]
根据本发明的一些实施方式,上述dnj及其衍生物的制备方法,包括以下步骤:
[0052][0053]
s1、还原:
[0054]
将化合物1添加至还原剂和有机溶剂ⅰ中,控制温度反应,固液分离,收集固相,得化合物2;
[0055]
s2、swern氧化/还原胺化:
[0056]
s21、将所述化合物2添加至酰卤和和有机溶剂ⅱ中,控制温度反应,再添加有机胺反应,制得中间体溶液;
[0057]
s22、将所述中间体溶液添加至硼还原剂、铵盐和有机溶剂ⅲ中反应,固液分离,收集固相,得化合物3;
[0058]
s3、还原胺化:
[0059]
将所述化合物3添加至醛、钯催化剂ⅰ、有机羧酸和有机溶剂ⅳ中反应,制得化合物4;
[0060]
s4、催化氢化脱苄基:
[0061]
将所述化合物4添加至醚类溶剂中,再添加无机酸和钯催化剂ⅱ反应,即得dnj或dnj衍生物。
[0062]
根据本发明的一些实施方式,所述还原剂包括氢化铝锂。
[0063]
根据本发明的一些实施方式,所述有机溶剂ⅰ包括四氢呋喃(thf)。
[0064]
根据本发明的一些实施方式,所述还原剂和化合物1的摩尔比为1:3~4。
[0065]
根据本发明的一些实施方式,所述步骤s1中反应温度为-5℃~5℃。
[0066]
根据本发明的一些实施方式,所述酰卤包括酰氯。
[0067]
根据本发明的一些实施方式,所述酰氯保留草酸酰氯。
[0068]
根据本发明的一些实施方式,所述有机溶剂ⅱ包括卤代烃和砜类溶剂中的至少一种。
[0069]
根据本发明的一些实施方式,所述卤代烃包括二氯甲烷(dcm)。
[0070]
根据本发明的一些实施方式,所述砜类溶剂包括二甲基亚砜(dmso)。
[0071]
根据本发明的一些实施方式,所述有机胺包括三乙醇胺(tea)和二乙醇胺中的至少一种。
[0072]
根据本发明的一些实施方式,所述化合物2、酰卤和有机胺的摩尔比为1:1.5~2.5:2.5~3.5。
[0073]
根据本发明的一些实施方式,所述硼还原剂包括nabh3cn。
[0074]
根据本发明的一些实施方式,所述铵盐为醋酸铵和甲酸铵中的至少一种。
[0075]
根据本发明的一些实施方式,所述铵盐和硼还原剂的摩尔比为1:1.9~2.1。
[0076]
根据本发明的一些实施方式,所述有机溶剂ⅲ包括醇类溶剂ⅰ。
[0077]
根据本发明的一些实施方式,所述醇类溶剂ⅰ包括甲醇、乙醇和丙醇中的至少一种。
[0078]
根据本发明的一些实施方式,所述步骤s21中反应温度为-90℃~-70℃。
[0079]
根据本发明的一些实施方式,所述步骤s22中反应温度为20℃~25℃。
[0080]
根据本发明的一些实施方式,所述醛包括烷基醛、芳基醛和烷氧基醛中的至少一种。
[0081]
根据本发明的一些实施方式,所述醛和化合物3的摩尔比为2:3~4。
[0082]
根据本发明的一些实施方式,所述钯催化剂ⅰ包括钯碳催化剂。
[0083]
根据本发明的一些实施方式,所述有机羧酸包括甲酸、乙酸和丙酸中的至少一种。
[0084]
根据本发明的一些实施方式,所述有机溶剂ⅳ包括醇类溶剂ⅱ。
[0085]
根据本发明的一些实施方式,所述醇类溶剂ⅱ包括甲醇、乙醇和丙醇中的至少一种。
[0086]
根据本发明的一些实施方式,所述醚类溶剂包括甲醚、乙醚和甲基叔丁基醚(mtbe)中的至少一种。
[0087]
根据本发明的一些实施方式,所述无机酸包括硫酸、氯化氢和溴化氢中的至少一种。
[0088]
根据本发明的一些实施方式,所述无机酸与化合物4的摩尔比为1:5~10。
[0089]
根据本发明的一些实施方式,所述钯催化剂ⅱ包括钯碳催化剂。
[0090]
本发明还提供另一技术方案为:一种预防和/或治疗肺动脉高压药物,所述药物的有效成分包含dnj及其衍生物。
[0091]
根据本发明的一些实施方式,所述预防和/或治疗肺动脉高压药物中dnj及其衍生物的质量含量为0.1%~99%。
[0092]
根据本发明的一些实施方式,所述预防和/或治疗肺动脉高压药物中dnj及其衍生物的质量含量为0.5~95%。
[0093]
本发明还提供另一技术方案为:一种肺动脉高压治疗药盒,所述药盒中包括上述
的药物。
[0094]
根据本发明的一些实施方式,所述预防和/或治疗肺动脉高压药物的给药量标准为:dnj及其衍生物0.1mg/天~1000mg/天。
[0095]
本文所述的术语“给药剂量”为能够缓解或延迟疾病、退化性或损伤性病症进展的量。可以随被治疗的具体疾病以及其它因素而定,其它因素包括年龄、体重、健康状况、症状的严重程度、给药途径、治疗的频率和在治疗期间是否伴随其它的药物。
[0096]
本文所述的术语“治疗”是指减轻结直肠癌及其并发症的程度,或者治愈结直肠癌及其并发症使之正常化,或者减缓结直肠癌及其并发症的进程。
[0097]
根据本发明实施方式的制备的所述药物的应用,至少具备如下有益效果:dnj及其衍生物通过抑制溶酶体降解bmpr2,改善了肺血管损伤,达到治疗pah的目的。本发明不仅为pah的治疗提供了一条新途径,也拓展了dnj及其衍生物的应用范围。
附图说明
[0098]
图1为本发明dl-1组(不同浓度)、低氧组与对照组右心室收缩压对比图。
[0099]
图2为本发明实施例中dl-1组(不同浓度)、低氧组与对照组右心室质量与(左心室与上室间隔总质量)之比对比图。
[0100]
图3为本发明实施例中dl-1组(不同浓度)、低氧组与对照组处理后的肺动脉he染色后的横断面图。
[0101]
图4为本发明实施例中dl-1组(不同浓度)与对照组细胞活力对比图。
[0102]
图5为本发明实施例中dl-1组与对照组处理后划痕实验结果对比图(放大倍数为20倍)。
[0103]
图6为本发明实施例中dl-1组(不同浓度)与对照组迁移率对比图。
[0104]
图7为本发明实施例中dl-1组(不同浓度)与对照组不同蛋白的凝胶电泳结果图。
[0105]
图8为本发明实施例中dl-1组(不同浓度)与对照组bmpr2蛋白表达水平对比图。
[0106]
图9为本发明实施例中dl-1组(不同浓度)与对照组p-smad1/5/8蛋白表达水平对比图。
[0107]
图10为本发明实施例中dl-1组(不同浓度)与对照组id蛋白表达水平对比图。
[0108]
图11为本发明实施例中dl-1组(不同浓度)、低氧组与对照组不同蛋白的凝胶电泳结果图(所用条件相同)。
[0109]
图12为本发明实施例中dl-1组(不同浓度)、低氧组与对照组bmpr2蛋白表达水平对比图。
[0110]
图13为本发明实施例中dl-1组(不同浓度)、低氧组与对照组p-smad1/5/8蛋白表达水平对比图。
[0111]
图14为本发明实施例中dl-1组(不同浓度)、低氧组与对照组id蛋白表达水平对比图。
[0112]
图15为本发明实施例中dl-2组(不同浓度)与对照组不同蛋白的凝胶电泳结果图。
[0113]
图16为本发明实施例中dl-2组(不同浓度)与对照组bmpr2蛋白表达水平对比图。
[0114]
图17为本发明实施例中dl-2组(不同浓度)与对照组p-smad1/5/8蛋白表达水平对比图。
[0115]
图18为本发明实施例中dl-2组(不同浓度)与对照组id蛋白表达水平对比图。
[0116]
图19为本发明实施例中dl-3组(不同浓度)、tnf组与对照组细胞活力对比图。
[0117]
图20为本发明实施例中dl-3组(不同浓度)与对照组细胞活力对比图。
[0118]
图21为本发明实施例中dl-4组(不同浓度)、tnf组与对照组细胞活力对比图。
[0119]
图22为本发明实施例中dl-4组(不同浓度)与对照组细胞活力对比图。
[0120]
图23为本发明实施例中dl-5组(不同浓度)、tnf组与对照组细胞活力对比图。
[0121]
图24为本发明实施例中dl-5组(不同浓度)与对照组细胞活力对比图。
[0122]
图25为本发明实施例中dl-9组(不同浓度)、对照组与低氧组细胞活力对比图。
[0123]
图26为本发明实施例中dl-10组(不同浓度)、对照组与低氧组细胞活力对比图。
[0124]
图27为本发明实施例中dl-11组(不同浓度)、对照组与低氧组细胞活力对比图。
[0125]
图28为本发明实施例中dl-12组(不同浓度)、对照组与低氧组细胞活力对比图。
[0126]
图29为本发明实施例中dl-13组(不同浓度)、对照组与低氧组细胞活力对比图。
[0127]
图30为本发明实施例中dl-14组(不同浓度)、对照组与低氧组细胞活力对比图。
[0128]
图31为本发明实施例中dl-15组(不同浓度)、对照组与低氧组细胞活力对比图。
[0129]
标记说明:
[0130]
*:p《0.05;**:p《0.01;***:p《0.001。
[0131]
#:p《0.05;##:p《0.01;###:p《0.001。
具体实施方式
[0132]
以下将结合实施例对本发明的构思及产生的技术效果进行清楚、完整地描述,以充分地理解本发明的目的、特征和效果。显然,所描述的实施例只是本发明的一部分实施例,而不是全部实施例,基于本发明的实施例,本领域的技术人员在不付出创造性劳动的前提下所获得的其他实施例,均属于本发明保护的范围。
[0133]
为了更好的理解本发明的实质,下面结合附图,用本发明的实施例来进一步说明本发明的实质性内容,但并不以此来限定本发明。根据本发明的实质对本发明进行的改进都属于本发明的范围。
[0134]
本发明的实施例一为:dnj的制备方法,如下式所示,包括如下步骤:
[0135][0136]
s1、还原
[0137]
在0℃冰浴条件下,向氢化铝锂(lah,2.28g,60mmol)的25ml thf(四氢呋喃)悬浊液中,缓慢滴加化合物1(10.82g,20mmol)的50ml thf溶液,tlc监测反应进程,反应完成后,
在冰浴条件下,加入十水合硫酸钠淬灭lah,然后加入硅藻土助滤,滤液旋干,快速柱层析纯化(dcm:meoh=100:1),得到乳白色产物化合物2(10.4g,产率95%)。
[0138]
s2、swern氧化/还原胺化
[0139]
在-78℃条件下,向(cocl)2(10.24ml,120mmol)的无水dcm(二氯甲烷,50ml)溶液中,滴加dmso(二甲基亚砜,11.35ml,160mmol)的dcm(10ml)溶液,滴加完毕后搅拌半小时后,再向其中滴加化合物2的dcm(50ml)溶液,2h后再滴加tea(三乙醇胺,27.67ml,200mmol),滴加完毕后缓慢升至室温,tlc监测反应进程。
[0140]
原料消耗完后,将上述反应溶液缓慢滴加到预冷至零摄氏度的nh4oac(4.62g,60mmol)、nabh3cn(7.56g,120mmol)的meoh(甲醇,30ml)溶液中,室温反应,tlc监测反应结束后,加入冰水淬灭反应,再加入naoh水溶液调节ph至中性,并用dcm萃取,饱和食盐水洗,粗产品快速柱层析(pe:ea=30:1),得到化合物3为微黄色固体5.6g(54%)。1h nmr(500mhz,chloroform-d)δ7.43
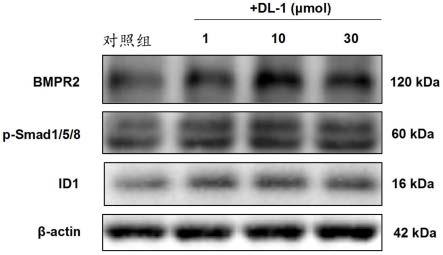
–
7.28(m,18h),7.28
–
7.23(m,2h),5.03(d,j=10.9hz,1h),4.90(t,j=11.4hz,2h),4.78
–
4.69(m,2h),4.58
–
4.50(m,2h),4.48(d,j=11.8hz,1h),3.72(dd,j=9.0,2.6hz,1h),3.61(t,j=8.9hz,1h),3.60
–
3.50(m,2h),3.40(t,j=9.3hz,1h),3.30(dd,j=12.3,5.0hz,1h),2.77(ddd,j=9.1,5.9,2.6hz,1h),2.56(dd,j=12.3,10.3hz,1h),1.89(s,1h)。
13
c nmr(126mhz,cdcl3)δ138.96,138.56,138.46,138.03,128.47,128.45,128.43,128.41,128.06,128.00,127.91,127.83,127.81,127.73,127.71,127.57,87.39,80.72,80.16,75.72,75.23,73.44,72.83,70.33,59.80,48.19。
[0141]
s3、催化氢化脱苄基
[0142]
向化合物3(4.28mmol)的mtbe(甲基叔丁基醚,50ml)溶液中,滴加hcl水溶液(2.0m,12.3ml),加入pd/c(321mg),鼓氮气置换半小时,再换成氢气鼓泡,并在剧烈搅拌下反应12小时,tlc监测反应完毕后,硅藻土过滤浓缩,即得dnj(以下简称为dl-1,612mg,86%)。
[0143]1h nmr(400mhz,deuterium oxide)δ3.70(dd,j=11.6,3.0hz,1h),3.49(dd,j=11.7,6.3hz,1h),3.36(ddd,j=10.8,9.1,5.1hz,1h),3.18(t,j=9.1hz,1h),3.10(t,j=9.4hz,1h),2.98(dd,j=12.3,5.2hz,1h),2.41(ddd,j=9.5,6.2,2.9hz,1h),2.32(dd,j=12.3,10.8hz,1h)。
13
c nmr(126mhz,d2o)δ78.31,71.44,70.81,61.30,60.43,48.60。
[0144]
本发明的实施例二为:dl-2的制备;与实施例一的差异在于:
[0145][0146]
s4、还原胺化
[0147]
向ch3(ch2)8cho(18mmol)、pd/c(650mg)的乙醇(65ml)溶液中,依次加入化合物3(12mmol)的乙醇(65ml)溶液和乙酸(6.7ml),鼓氮气15分钟,然后置换为h2,室温反应12小时,tlc检测反应完毕后,硅藻土过滤浓缩,粗产品(化合物7)直接投下一步。
[0148]
s5、催化氢化脱苄基
[0149]
向化合物7(18mmol)的mtbe(甲基叔丁基醚,100ml)溶液中,滴加hcl水溶液(2.0m,
25ml),加入pd/c(642mg),鼓氮气置换半小时,再换成氢气鼓泡,并在剧烈搅拌下反应12小时,tlc监测反应完毕后,硅藻土过滤浓缩,即得如下式所示产物:
[0150]
以下简称为dl-2(4.96g,91%)。
[0151]1h nmr(400mhz,methanol-d4)δ3.92
–
3.80(m,2h),3.49(ddd,j=10.5,9.1,4.9hz,1h),3.36(t,j=9.3hz,1h),3.14(t,j=9.1hz,1h),3.00(dd,j=11.1,4.9hz,1h),2.86
–
2.75(m,1h),2.66
–
2.53(m,1h),2.18(t,j=10.9hz,1h),2.12(dt,j=9.5,2.8hz,1h),1.51(p,j=7.3hz,2h),1.39
–
1.26(m,14h),0.96
–
0.88(t,3h)。
13
c nmr(101mhz,meod)δ79.19,70.64,69.36,65.97,58.04,56.31,52.41,31.65,29.33,29.28,29.01,27.24,23.78,22.33,13.03.
[0152]
本发明的实施例三为:dl-3的制备;与实施例二的差异在于:
[0153][0154]
步骤s4还原胺化中ch3(ch2)8cho替换为bncho。
[0155]
步骤s5催化氢化脱苄基中制得的产物结构如下式所示:
[0156]
以下简称为dl-3(从5.0mmol化合物3得到dl-3 1.20g,95%)
[0157]1h nmr(400mhz,deuterium oxide)δ7.34
–
7.21(m,5h),4.08
–
3.97(m,2h),3.85(dd,j=12.9,2.7hz,1h),3.38
–
3.29(m,3h),3.11(t,j=9.3hz,1h),2.78(dd,j=11.5,4.9hz,1h),2.13(dt,j=10.1,2.6hz,1h),1.91(t,j=11.1hz,1h).
13
c nmr(101mhz,d2o)δ130.32,128.46,127.77,78.15,69.82,68.43,66.23,57.42,56.17,54.83.
[0158]
本发明的实施例四为:dl-4的制备;与实施例二的差异在于:
[0159][0160]
步骤s4还原胺化中ch3(ch2)8cho替换为ch3(ch2)2cho。
[0161]
步骤s5催化氢化脱苄基中最终制得的产物结构如下式所示:
[0162]
以下简称为dl-4(从5.0mmol化合物3得到dl-4 898.0mg,82%)。
[0163]1h nmr(400mhz,deuterium oxide)δ3.91
–
3.75(m,2h),3.50(ddd,j=10.7,9.2,4.9hz,1h),3.34(t,j=9.5hz,1h),3.22(t,j=9.2hz,1h),2.99(dd,j=11.5,5.0hz,1h),2.70(ddd,j=13.5,10.2,6.3hz,1h),2.57(ddd,j=13.3,10.2,6.2hz,1h),2.32
–
2.20(m,2h),1.41(tdd,j=12.4,7.5,3.7hz,2h),1.23(h,j=7.2hz,2h),0.85(t,j=7.3hz,3h)。
13
c nmr(101mhz,d2o)δ78.26,70.03,68.85,65.00,57.36,55.18,51.83,25.02,20.18,13.32.
[0164]
本发明的实施例五为:dl-5的制备;与实施例二的差异在于:
[0165][0166]
步骤s4还原胺化中ch3(ch2)8cho替换为ch3ch2cho。
[0167]
步骤s5催化氢化脱苄基中制得的产物结构如下式所示:
[0168]
以下简称为dl-5(从5.0mmol化合物3得到dl-5 973mg,96%)。
[0169]1h nmr(500mhz,cd3od)δ3.84(d,j=28.1hz,2h),3.56
–
3.47(m,1h),3.39(t,j=9.2hz,1h),3.18(t,j=9.0hz,1h),3.01(dd,j=10.9,4.2hz,1h),2.81
–
2.69(m,1h),2.62
–
2.51(m,1h),2.20(t,j=10.8hz,1h),2.13(d,j=9.4hz,1h),1.52(d,j=5.4hz,2h),0.91(t,j=7.2hz,3h)。
13
c nmr(126mhz,cd3od)δ79.14,70.63,69.37,65.91,58.07,56.33,54.33,16.94,10.83。
[0170]
本发明的实施例六为:dl-6的制备;与实施例二的差异在于:
[0171][0172]
步骤s4还原胺化中ch3(ch2)8cho替换为bnoch2cho。
[0173]
步骤s5催化氢化脱苄基中制得的产物结构如下式所示:
[0174]
以下简称为dl-6(从5.0mmol化合物3得到dl-6 765mg,74%)。
[0175]
本发明的实施例七为:dl-7的制备;与实施例二的差异在于:
[0176][0177]
步骤s4还原胺化中ch3(ch2)8cho替换为bnoch2ch2och2cho。
[0178]
步骤s5催化氢化脱苄基中制得的产物结构如下式所示:
[0179]
以下简称为dl-7(从5.0mmol化合物3得到dl-7 765mg,56%)。
[0180]
本发明的实施例八为:dl-8的制备;与实施例二的差异在于:
[0181][0182]
步骤s4还原胺化中ch3(ch2)8cho替换为bno(ch2ch2o)2ch2cho。
[0183]
步骤s5催化氢化脱苄基中制得的产物结构如下式所示:
[0184]
以下简称为dl-8(从5.0mmol化合物3得到dl-8501mg,34%)。
[0185]
本发明的实施例九为:dl-9的制备,包括如下步骤:
[0186][0187]
s1、氧化、氨化反应:
[0188]
称取化合物1(2.1626g,4mmol)于100ml圆底烧瓶中,加入碳酸钾(1.1057g,8mmol),碘(2.0304g,8mmol),甲醇40ml,用注射器量取正丁胺(1.2ml,12mmol)加入到反应体系中。50℃反应4个小时tlc监测硫酸乙醇显色发现原料完全反应。加入饱和硫代硫酸钠溶液除去多余的碘单质,然后用旋转蒸发仪除去大部分甲醇溶剂,用乙酸乙酯(50ml
×
3)萃取,有机层用无水硫酸钠干燥,减压浓缩,得到2.3g淡黄色油状粗产品化合物14。
[0189]
s2、swern氧化:
[0190]
将100ml的两口圆底烧瓶进行除水除氧处理,用注射器吸取重蒸过的二氯甲烷40ml加入到圆底烧瓶中,再把圆底烧瓶放置于-78℃的低温反应器中,用注射器吸取草酰氯(0.7ml,8mmol),10分钟后用注射器吸取重蒸过的二甲基亚砜(0.3ml,16mmol)缓慢加入到反应体系中,-78℃条件下反应2个小时。用重蒸过的10ml二氯甲烷溶解干燥过的化合物14,用注射器加入到反应体系中-78℃反应2个小时。再用注射器吸取重蒸过的三乙胺(4.5ml,32mmol)加入到反应体系中,将反应恢复至室温后用tlc监测发现原料完全反应。用二氯甲烷(50ml
×
3)萃取,有机层用无水硫酸钠干燥,减压浓缩,粗产品用硅胶柱纯化(石油醚:乙酸乙酯的体积比为6:1),得到1.9512g白色粉末状固体,经核磁检测为化合物15,两步反应总产率为80%。
[0191]1h nmr(400mhz,cdcl3)δ7.50
–
7.17(m,20h),6.70(t,j=5.8hz,1h),4.76
–
4.70(m,1h),4.69
–
4.59(m,3h),4.59
–
4.53(m,1h),4.53
–
4.45(m,2h),4.39(dd,j=14.1,6.1hz,2h),4.35
–
4.12(m,4h),3.40
–
3.25(m,1h),3.25
–
3.10(m,1h),1.53
–
1.40(m,2h),1.36
–
1.29(m,2h),0.93(t,j=7.3hz,3h)。
13
c nmr(101mhz,cdcl3)δ206.10,170.20,137.53,137.41,137.27,136.78,128.82,128.70,128.57,128.45,128.42,128.25,128.22,128.11,128.02,127.97,127.87,81.37,80.71,79.76,75.33,74.59,74.25,73.53,73.25,38.88,31.57,20.11,13.78。
[0192]
s3、环化:
[0193]
将100ml的两口圆底烧瓶进行除水除氧处理,用注射器吸取重蒸过的乙腈20ml加入到圆底烧瓶中,再分别用注射器吸取5ml重蒸过的乙腈溶解化合物15(1.8293g,3mmol)和三氟甲磺酸(142.3mg,0.3mmol)后分别加入到反应瓶中,用注射器吸取三乙基硅烷(1.4ml,9mmol)加入到反应体系中,60℃条件下反应30分钟tlc监测碘化铋钾显色发现原料完全反应。冷却至室温后然后用旋转蒸发仪除去乙腈溶剂,粗产品用硅胶柱纯化(石油醚:乙酸乙酯的体积比为8:1),得到908.5mg无色透明油状液体,经核磁检测为化合物16,产率为51%。
[0194]1h nmr(400mhz,cdcl3)δ7.56
–
7.17(m,20h),5.19(d,j=11.3hz,1h),4.87(d,j=11.2hz,1h),4.74
–
4.63(m,3h),4.55(d,j=11.7hz,1h),4.51
–
4.40(m,2h),4.10(d,j=
9.1hz,1h),3.95
–
3.89(m,1h),3.84(ddd,j=17.1,9.7,5.3hz,2h),3.62
–
3.50(m,2h),3.50
–
3.39(m,1h),3.00
–
2.88(m,1h),1.60
–
1.50(m,2h),1.36
–
1.29(m,2h),0.92(t,j=7.3hz,3h)。
13
c nmr(101mhz,cdcl3)δ169.43,138.26,138.24,137.87,137.45,128.52,128.44,128.37,128.36,128.32,128.02,127.97,127.92,127.84,127.78,127.70,127.64,81.91,78.35,76.75,74.47,74.12,73.35,72.60,68.27,60.49,45.49,29.59,20.11,13.91。
[0195]
s4、酰胺还原:
[0196]
将50ml的两口圆底烧瓶进行除水除氧处理,然后烧瓶中加入四氢铝锂(170.8mg,4.5mmol),氮气氛围下抽换气3次后将反应体系置于冰水浴中。用注射器吸取重蒸过的四氢呋喃10ml加入到圆底烧瓶中,再用注射器吸取5ml重蒸过的四氢呋喃溶解化合物16(890.76mg,1.5mmol)加入到反应瓶中,0℃条件下反应10分钟tlc监测碘化铋钾显色发现原料完全反应。然后0℃条件下往反应体系中加入过量十水合硫酸钠淬灭反应,继续搅拌直至反应中出现明显分层现象。布氏漏斗抽滤,有机层减压浓缩,得到910.2mg无色透明油状化合物17粗产品。
[0197]
s5、脱除苄基保护
[0198]
将303.4mg化合物8的粗产品用10ml甲醇溶解在50ml的圆底烧瓶中,加入甲酸(0.23ml,6mmol)和10%氢氧化钯303mg。然后放在高压反应釜内用氮气置换反应釜内空气3次,再用氢气置换反应釜内氮气3次,然后往反应釜内充入4mpa氢气室温下反应10个小时。tlc监测氯气熏蒸后邻联甲苯胺显色发现原料反应完全,布氏漏斗抽滤,滤液加入过量碳酸钾50℃条件下反应30分钟,布氏漏斗抽滤,滤液减压浓缩,粗产品用反相硅胶柱纯化(甲醇:水的体积比为1:4),得到61.4mg无色透明油状液体,经核磁检测为化合物dl-9,两步反应总产率为56%。
[0199]1h nmr(500mhz,cd3od)δ4.13(d,j=12.3hz,1h),3.94(d,j=12.3hz,1h),3.75(s,1h),3.63(t,j=9.2hz,1h),3.49(d,j=8.5hz,1h),3.45
–
3.37(m,2h),3.24(s,1h),3.10(d,j=9.6hz,1h),3.02(t,j=11.3hz,1h),1.75(s,2h),1.46(s,2h),1.03(t,j=6.9hz,3h)。
13
c nmr(126mhz,cd3od)δ76.66,67.46,66.43,66.11,53.70,53.52,52.89,24.74,19.58,12.55。
[0200]
本发明的实施例十为:dl-10的制备,包括如下步骤:
[0201][0202]
与实施例九的差异在于:将步骤s1氧化胺化中n-bunh2替换为allylnh2(烯丙基胺),制得的产物结构如下式所示:
[0203]
以下简称为dl-10(从0.5mmol化合物20得到dl-10 60mg,59%)。
[0204]1h nmr(500mhz,cd3od)δ5.89(ddt,j=16.8,10.2,6.5hz,1h),5.22(ddd,j=13.7,10.9,1.1hz,2h),3.91
–
3.84(m,2h),3.74(dd,j=8.5,5.0hz,1h),3.56(td,j=8.5,4.9hz,1h),3.44(dd,j=14.6,6.4hz,2h),3.35(dd,j=11.8,4.7hz,1h),3.05(dd,j=10.8,5.2hz,1h),2.84(dd,j=12.5,4.8hz,1h),2.61(dd,j=12.4,9.2hz,1h)。
13
c nmr(126mhz,cd3od)δ135.24,117.10,74.03,71.30,69.75,62.92,57.38,56.57,50.88.
[0205]
本发明的实施例十一为:dl-11的制备,包括如下步骤:
[0206][0207]
与实施例九的差异在于:将步骤s1氧化胺化中n-bunh2替换为bnch2nh2,制得的产物结构如下式所示:
[0208]
以下简称为dl-11(从0.3mmol化合物24得到dl-11 27mg,59%)。
[0209]1h nmr(400mhz,cd3od)δ7.30
–
7.16(m,5h),3.95(dd,j=11.9,2.5hz,1h),3.90
–
3.84(m,1h),3.52(ddd,j=10.4,9.3,4.9hz,1h),3.36(t,j=9.3hz,1h),3.18(t,j=9.1hz,1h),3.09(dd,j=11.1,4.9hz,1h),3.02
–
2.89(m,2h),2.86
–
2.74(m,2h),2.37(dd,j=21.3,10.5hz,1h),2.32
–
2.22(m,1h)。
13
c nmr(101mhz,cd3od)δ140.25,128.37,128.07,125.65,79.18,70.64,69.44,65.32,58.17,56.44,54.47,30.04.
[0210]
本发明的实施例十二为:dl-12的制备,包括如下步骤:
[0211][0212]
与实施例九的差异在于:将步骤s1氧化胺化中n-bunh2替换为(4-meo)-phch2ch2nh2,制得的产物结构如下式所示:
[0213]
以下简称为dl-12(从0.3mmol化合物28得到dl-12 51mg,58%)。
[0214]1h nmr(500mhz,cd3od)δ7.13(t,j=6.8hz,2h),6.91
–
6.79(m,2h),3.93(dt,j=8.7,4.3hz,1h),3.86(dd,j=12.0,2.9hz,1h),3.77(s,3h),3.53
–
3.47(m,1h),3.39
–
3.34(m,1h),3.19
–
3.15(m,1h),3.09(dd,j=11.1,4.9hz,1h),2.99
–
2.92(m,1h),2.91
–
2.85(m,1h),2.79
–
2.68(m,2h),2.36(t,j=10.8hz,1h),2.30
–
2.21(m,1h)。
13
c nmr(126mhz,cd3od)δ158.13,132.13,129.26,113.51,79.19,70.65,69.43,65.39,58.17,56.42,54.58,54.24,29.22.
[0215]
本发明的实施例十三为:dl-13的制备,包括如下步骤:
[0216][0217]
与实施例九的差异在于:将步骤s1氧化胺化中化合物1替换为化合物30,制得的产物结构如下式所示:
[0218]
以下简称为dl-13(从0.3mmol化合物33得到dl-13 36mg,58%)。
[0219]1h nmr(500mhz,cd3od)δ4.02
–
3.99(m,1h),3.88
–
3.75(m,3h),3.22(dt,j=14.9,7.5hz,1h),2.99(dd,j=11.2,4.9hz,1h),2.78
–
2.69(m,1h),2.56
–
2.45(m,1h),2.38(td,j=5.4,1.6hz,1h),2.14(dd,j=18.6,7.9hz,1h),1.53
–
1.45(m,2h),1.32(ddd,j=15.0,
7.1,2.7hz,2h),0.98
–
0.94(m,3h)。
13
c nmr(126mhz,cd3od)δ75.90,70.81,67.62,63.75,60.89,56.71,52.40,25.82,20.36,12.97.
[0220]
本发明的实施例十四为:dl-14的制备,包括如下步骤:
[0221][0222]
与实施例九的差异在于:将步骤s1氧化胺化中化合物1替换为化合物35,步骤s2-s5与实施例九相同,制得的产物结构如下式所示:
[0223]
以下简称为dl-14(从0.3mmol化合物38得到dl-14 37mg,57%)。
[0224]1h nmr(500mhz,cd3od)δ4.03
–
3.96(m,1h),3.94(dd,j=4.5,2.4hz,1h),3.83(ddd,j=18.9,10.1,3.6hz,2h),3.78(s,1h),2.77
–
2.70(m,2h),2.69(d,j=4.8hz,1h),2.60(dd,j=19.6,9.4hz,2h),1.50(dd,j=18.7,11.2hz,2h),1.32(dd,j=14.7,7.3hz,2h),0.96(t,j=7.3hz,3h)。
13
c nmr(126mhz,cd3od)δ71.52,70.81,66.10,60.19,59.17,53.21,51.71,26.24,20.42,13.02.
[0225]
本发明的实施例十五为:dl-15的制备,包括如下步骤:
[0226][0227]
与实施例九的差异在于:将步骤s1氧化胺化中化合物1替换为化合物40,步骤s2-s5与实施例九相同,制得的产物结构如下式所示:
[0228]
以下简称为dl-15(从0.3mmol化合物43得到dl-15 37mg,61%)。
[0229]1h nmr(400mhz,cd3od)δ3.67(ddt,j=11.0,10.1,4.4hz,1h),3.18(ddd,j=11.2,8.9,4.5hz,1h),3.00(ddd,j=10.8,4.4,1.9hz,1h),2.77
–
2.68(m,1h),2.55(ddd,j=13.3,9.5,6.2hz,1h),2.33
–
2.21(m,1h),2.08(t,j=8.2hz,1h),2.05
–
1.98(m,1h),1.52
–
1.43(m,2h),1.33(ddd,j=9.0,7.3,2.9hz,2h),1.21(t,j=5.1hz,3h),0.97(dd,j=9.5,5.1hz,3h)。
13
c nmr(101mhz,cd3od)δ70.42,64.49,61.64,58.65,52.52,42.18,25.67,20.36,13.89,12.94.
[0230]
以下通过本实施例一~五和实施例九~十五所制备的化合物的药效学试验来进一步阐述本发明所具有的有益效果。
[0231]
骨形成蛋白2型受体(bmpr2)缺失是诱发肺动脉高压内皮功能障碍的始动环节。溶酶体降解是导致内皮bmpr2缺失的关键因素。通过在低氧诱导的肺动脉高压大鼠模型以及tnf-α和3%低氧处理的paecs建立肺动脉高压内皮细胞损伤模型上使用不同浓度的dnj,用wb(western blot法,蛋白质印迹法)、he染色(苏木精-伊红染色法)、划痕实验等方法,验证dnj对于肺动脉高压的治疗作用。
[0232]
研究内容分为以下两个方面。
[0233]
(1)动物和细胞两方面观察肺动脉高压中dnj对bmpr2信号通路的影响。
[0234]
(2)功能性实验:研究dnj对肺动脉内皮细胞增殖、凋亡、迁移的影响。
[0235]
分组说明:
[0236]
dl-1组代表选用实施例一所制备的化合物进行药效学实验。
[0237]
dl-2组代表选用实施例二所制备的化合物进行药效学实验。
[0238]
dl-3组代表选用实施例三所制备的化合物进行药效学实验。
[0239]
dl-4组代表选用实施例四所制备的化合物进行药效学实验。
[0240]
dl-5组代表选用实施例五所制备的化合物进行药效学实验。
[0241]
dl-9组代表选用实施例九所制备的化合物进行药效学实验。
[0242]
dl-10组代表选用实施例十所制备的化合物进行药效学实验。
[0243]
dl-11组代表选用实施例十一所制备的化合物进行药效学实验。
[0244]
dl-12组代表选用实施例十二所制备的化合物进行药效学实验。
[0245]
dl-13组代表选用实施例十三所制备的化合物进行药效学实验。
[0246]
dl-14组代表选用实施例十四所制备的化合物进行药效学实验。
[0247]
dl-15组代表选用实施例十五所制备的化合物进行药效学实验。tnf组代表选用tnf-α处理的paecs。
[0248]
低氧组代表选用3%低氧处理的paecs。
[0249]
1.药效学实验
[0250]
1.1动物实验
[0251]
整个实验根据美国国立卫生研究院实验动物的护理和使用指南进行。实验方案得到中南大学湘雅医学院药用动物福利委员会的批准。雄性健康sprague-dawley(sd)大鼠(100g~150g)由湖南sja实验动物有限公司提供(编号:syxk(xiang)2015
–
0017)。将所有动物在控制温度(18℃~25℃)和湿度(50%~60%)的环境中饲养,并交替进行12小时的明暗循环。食物和水可随意获得。适应性喂养一周后,对动物进行称重,随机分组和编号。分别建立两种ph大鼠模型,低氧诱导ph大鼠模型:分为control(对照组,缩写为con组)、hypoxia(低氧组,缩写为hyp组)、25mg/kg dl-1组、50mg/kg dl-1组四个组,每组10只,造模时长4周。第一周将hypoxia、25mg/kg dl-1组、50mg/kg dl-1组三个组放入低氧箱(氧气浓度设为3%),在低氧箱中饲养4周,第三周开始分别对25mg/kg dl-1组、50mg/kg dl-1组两个组通
过灌胃方式给药,给药时长为两周。control组不做任何干预。
[0252]
1.2血流动力学测量和形态学分析
[0253]
造模完成后,将大鼠麻醉(1%戊巴比妥钠腹膜内注射,50mg/kg)。插入pe导管通过右颈静脉到达右心房,记录右心室收缩压(rvsp)。在检测到rvsp后,收集肺组织样本。分离右心室(rv),左心室加上室间隔(lv s)并分别称重,以计算rv/(lv s)质量比。取大鼠后肢胫骨,用尺子量距离,计算rv/tibial length。取右下肺并将其置于4%多聚甲醛溶液中进行固定保存。固定的组织用于随后的血管形态分析,将组织切片在60℃下保持2小时,然后在二甲苯溶液中保持30分钟。然后将其依次放入100%乙醇溶液,95%乙醇溶液和70%乙醇溶液中,每次5分钟。随后将样品在磷酸盐缓冲液(pbs,procell,china)中洗涤3次,每次5分钟,在高压抗原修复中保持5分钟,在过氧化氢中保持20分钟。用he染色以观察血管形态,在显微镜下观察片子的效果,挑选合适的位置拍摄照片,再进行数据分析。
[0254]
1.3细胞培养
[0255]
人肺动脉内皮细胞(paecs)的培养条件及形态:将肺动脉内皮细胞paecs放置培养箱内,用dmem/f-12 1:1(体积比)完全培养基(双抗1%和胎牛血清fbs10%)培养,待细胞贴壁后观察细胞的正常状态。正常生长的内皮细胞呈现梭行,细胞与细胞间紧密粘贴,排列生长。细胞培养后每天观察一次,不要次数太多,如观察到细胞已经为紧挨着的单层生长(表明细胞融合至90%~95%甚至更高)时,用胰蛋白酶(37℃提前预热)对细胞消化并收集消化下来的肺动脉内皮细胞paecs,用含有10%胎牛血清和1%双抗的dmem/f-12 1:1(体积比)完全培养基终止消化后,在离心机中以800rpm/分钟离心4分钟,弃去原有的培养基再加入新的dmem/f-12 1:1(体积比)完全培养基(双抗1%和胎牛血清fbs10%),在25cm2细胞培养瓶中按1:2的比例传代。
[0256]
1.4cck8检测细胞增殖能力
[0257]
将消化下的paec细胞用1ml枪头吹打,制成细胞悬液,采用细胞计数器计数,接种于96孔板中,再加入培养基补足至每孔中的总体积为100μl,每孔接种的细胞量为1
×
104个,置于恒温37℃,5%co2和饱和湿度的细胞培养箱中培养。待细胞贴壁后且细胞融合度达到80%,细胞分组(不同浓度的待测化合物(dl-1~dl-5和dl-9~dl-15,,即化合物和低氧处理(细胞置于3%氧气浓度的环境中)同时进行)、对照组(con组,对照组,不作任何干预)和hyp组(低氧组,细胞置于3%氧气浓度的环境中))并进行相应的处理,每个组各设5个复孔。96孔板没有用到的孔用pbs溶液填充。置于37℃、5%co2温箱培养1天。向每孔中加入10μlcck-8(cell counting kit-8细胞计数试剂)溶液。将培养板在37℃,5%co2和饱和湿度的细胞培养箱内再孵育2小时。用酶标仪测定在450nm处的吸光度。
[0258]
计算公式为:细胞活力=(处理组od
–
空白组od)/(对照组od
–
空白组od)
×
100%,其中,od值为吸光度。
[0259]
1.5划痕实验检测细胞迁移能力
[0260]
s1、6孔培养板接种肺动脉内皮细胞之前,用marker笔在背面平行(间隔1厘米左右)画3条横线作为标记(以利于不同时间拍照时能够定位到相同的视野)。
[0261]
s2、肺动脉内皮细胞paecs完成消化后,加入dmem/f-12 1:1完全培养基(双抗1%和胎牛血清fbs5%)制成细胞悬液,再将肺动脉内皮细胞悬液接种入6孔板,数量以贴壁后细胞完全融合即完全紧挨着的状态,并且呈现单层状态而没有相互重叠,呈现单层细胞为
宜。
[0262]
s3、将肺动脉内皮细胞铺满板底后,用大小为1ml的tip枪头垂直于6孔板的孔中,贴着板底轻轻划一道痕迹,制造出宽度为一个枪头的细胞划痕,原则上尽量保证每个划痕的宽度都是保持一致的,不要有大的偏差。
[0263]
s4、用巴氏吸管吸去之前的划痕产生的细胞及细胞碎片,用1x pbs再冲洗3次,使6孔板中完全清洗干净,不要残留漂浮的细胞及细胞碎片影响拍照效果。
[0264]
s5、再加入dmem/f-12 1:1(体积比)完全培养基(双抗1%和胎牛血清fbs5%),每个孔加2ml,在显微镜下拍照。将培养板继续放入37℃,5%co2和饱和湿度的细胞培养箱中培养。
[0265]
s6、每隔6小时将6孔板从37℃,5%co2和饱和湿度的细胞培养箱中取出拍照,直至终点时间24小时。根据所拍摄的图片观察实验结果,进行数据分析。
[0266]
1.6western blot检测蛋白表达
[0267]
用含0.1%pmsf(苯甲基磺酰氟)的ripa缓冲液从肺动脉或hpasmcs(人肺血管平滑肌细胞)中提取蛋白,用10%sds-page分离等量的蛋白(30μg),转移到聚偏氟乙烯膜上。1%bsa室温孵育1h。然后将膜与针对bmpr2(protein tech,usa)、p-smad1/5(cell signaling technology,usa)、id1(protein tech,usa)、β-actin(β-actin,usa)的一抗在4℃孵育过夜,将所有pvdf膜浸入含生物素标记的二抗(二抗抗性为羊抗兔或羊抗鼠,tbst稀释1:10000)中,室温摇床上振摇2h,tbst漂洗3次,每次10min;移液枪吸取等量适量的发光液a和b,均匀混合,将混合液尽量均匀滴加在膜上,将膜放入成像仪中显影,全程在避光条件进行。用quantity one(bio.rad)软件进行图像扫描,用image j软件进行半定量,计算各蛋白与β-actin的相对灰度值(relative gray scale,rgs),以此表示各蛋白相对表达量。
[0268]
1.7数据统计与分析
[0269]
采用graph pad软件进行数据统计分析。所有的数据均用均数
±
标准差表示,多组间数据比较采用单因素anova(方差分析)检验分析。p《0.05为差异有统计学意义,p《0.01为有显著统计学差异。
[0270]
从图1中得知,dl-1组的收缩压与低氧组相比出现降低,浓度为50mg/kg的情况下,收缩压远低于低氧组(p<0.01)。
[0271]
从图2中得知,dl-1组的右心室质量与(左心室与上室间隔总质量)之比与低氧组相比出现降低。
[0272]
从图3中得知,dl-1组dnj降低了低氧诱导肺高压大鼠的右心肥厚程度、右心室压力。
[0273]
从图4中得知,dl-1组细胞活力较高,同时随着dnj浓度的升高,细胞活性增强。
[0274]
从图5中得知,不同浓度的化合物1(dl1组)与对照组处理前后的划痕实验结果对比图,从图中得知dl-1处理后,dnj有抑制正常paecs迁移的作用。
[0275]
从图6中得知,dl-1组能显著降低细胞迁移率(p<0.01)。
[0276]
从图7中得知,与对照组相比,dl-1组的各蛋白的表达水平高于对照组。
[0277]
从图8中得知,dl-1组bmpr2蛋白表达水平高于对照组,在低剂量情况下(1μmol~10μmol)bmpr2蛋白表达水平逐渐增强,并在10μmol达到最大(p<0.01);在高剂量情况(10μmol~30μmol)bmpr2蛋白表达水平逐渐降低,但仍高于对照组。
[0278]
从图9中得知,dl-1组p-smad1/5/8蛋白表达水平高于对照组(p<0.05)。
[0279]
从图10中得知,dl-1组id蛋白表达水平高于对照组(p<0.01)。
[0280]
图11为本发明dl-1组(不同浓度)、低氧组与对照组不同蛋白凝胶电泳结果,与低氧组相比,dl-1组的各蛋白的表达水平高于低氧组,说明dnj上调l低氧诱导肺高压大鼠肺组织bmpr2、p-smad蛋白表达。
[0281]
从图12得知,dl-1组的bmpr2蛋白表达水平远高于低氧组,在浓度为25mg/kg的情况下,表达水平略高于对照组(p<0.01)。
[0282]
从图13得知,dl-1组的p-smad1/5/8蛋白表达水平远高于低氧组,在浓度为50mg/kg的情况下,表达水平略低于对照组(p<0.01)。
[0283]
从图14得知,dl-1组的id蛋白表达水平远高于低氧组,在浓度为50mg/kg的情况下,表达水平略高于对照组(p<0.05)。
[0284]
图15为本发明dl-2组(不同浓度)与对照组不同蛋白凝胶电泳结果;与对照组相比,高剂量dl-1组(剂量为10μmol)的各蛋白的表达水平高于对照组。
[0285]
图16~18为本发明dl-2组(不同浓度)与对照组不同蛋白(bmpr2蛋白、p-smad1/5/8蛋白和id蛋白)表达水平对比图;从图16~18得知,dl-2上调正常paecs中bmpr2信号通路。
[0286]
图19、图21和图23是直接对普通细胞进行不同浓度dl-3、dl-4和dl-5处理,目的是探索出没有细胞毒性的浓度;图20、图22和图24分别是在图19、图21和图23得出的无毒性浓度的基础上,使用tnf刺激细胞增殖,再用不同浓度dl-3、dl-4和dl-5处理,目的是得出可以抑制细胞增殖的浓度。
[0287]
图19~24为本发明dl-3组(不同浓度)、dl-4组(不同浓度)和dl-5组(不同浓度)与对照组细胞活力对比图;从图19~24得知,dl-3、dl-4和dl-5抑制了正常paecs增殖。
[0288]
图25~31为本发明dl-9组(不同浓度)、dl-10组(不同浓度)、dl-11组(不同浓度)、dl-12组(不同浓度)、dl-13组(不同浓度)、dl-14组(不同浓度)、dl-15组(不同浓度)、对照组(con组)和低氧组(hyp组)细胞活力对比图;从图25~31得知,相比于低氧组,dl-9、dl-10、dl-11、dl-12、dl-13、dl-14和dl-15抑制了paecs增殖。
[0289]
由此得知,本发明实施例六~十五中dl-6、dl-7、dl-8、dl-9、dl-10、dl-11、dl-12、dl-13、dl-14和dl-15同样也具备与本发明实施例一~五中化合物相近的作用,即能上调bmpr2、p-smad 1/5/8、id蛋白表达,减少肺血管损伤。
[0290]
dnj及其衍生物以溶酶体降解bmpr2为靶点,上调了bmpr2、p-smad 1/5/8、id蛋白表达,减少了肺血管损伤,达到了治疗pah的作用,为pah的治疗寻找新的思路。
[0291]
综上所述,本发明提供的dnj及其衍生物在制备预防和/或治疗肺动脉高压药物中的应用,dnj及其衍生物通过抑制溶酶体降解bmpr2,改善了pah血管状态,拓展了桑叶提取物dnj及其衍生物的用途。
[0292]
上面结合附图对本发明实施例作了详细说明,但是本发明不限于上述实施例,在所属技术领域普通技术人员所具备的知识范围内,还可以在不脱离本发明宗旨的前提下作出各种变化。此外,在不冲突的情况下,本发明的实施例及实施例中的特征可以相互组合。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。