1.本发明属于生物医用材料技术领域,尤其涉及一种核酸适配体修饰的双靶向纳米荧光探针、制备方法及应用。
背景技术:
2.目前,脑胶质瘤是由大脑胶质细胞癌变所产生的原发性颅脑恶性肿瘤,占恶性脑肿瘤的81%。虽然相对罕见,但其是所有肿瘤学中最具挑战性的恶性肿瘤之一,其特点为:发病率逐年上升,且复发率高,死亡率高,治愈率低,造成显著的死亡率和发病率。脑胶质瘤恶性程度高,呈浸润性生长,肿瘤边缘境界不清,不易切除,且切除后易复发,严重威胁患者生命健康,给病人造成沉重的经济和心理负担,给社会带来极大的负担和不安定因素。
3.分子成像是医学成像科学的一个分支,被定义为在活体中可视化和定量测量生物和细胞过程功能的能力,目的是利用高灵敏度仪器和对比剂机制检测、定位和监测细胞、组织和活体中的关键分子过程。分子成像不局限于传统的成像方式,它是一个多学科的努力,利用了不同的专业知识,特别是使用创新的化学策略来开发智能显像剂,这种显像剂可以产生来自细胞和组织中的低浓度目标生物分子的可检测信号。虽然解剖成像在医学影像诊断、手术指导/随访和治疗监测方面发挥着重要作用,但分子成像的快速发展有望提高筛查和早期诊断、集中和个性化治疗以及早期治疗随访的特异性和定量。体内分子成像的主要优势是它能够在没有侵入性活检或外科手术的情况下表征病变组织,有了这些信息,可以应用更个性化的治疗规划方案。
4.然而脑组织存在血脑屏障,一般的物质几乎无法透过,使得显像剂无法准确达到病灶处,无法进行分子成像。随着纳米医学的发展和纳米材料的不断研发,功能性纳米颗粒在生物医学领域的应用得以发展,纳米粒子逐渐成为肿瘤分子成像与治疗的新选择。
5.脂质体是一种结构和组成类似生物膜的囊泡。主要成分为卵磷脂和胆固醇,脂质体在合适的制备工艺条件下可自组装成磷脂双分子层包载亲水性或疏水性药物,且其生物相容性高,细胞毒性低。脂质体作为成像剂载体已广泛应用于许多医学成像技术,在生物医学领域应用广泛。
6.核酸适配体(aptamer)是一类具有高特异性、强亲和力、能精准识别目标物的小分子dna或rna片段,可以通过二级、三级结构的折叠形成特定的三维空间构型,再借助范德华力、氢键、静电作用、碱基堆积力等与不同的靶标分子高特异性、高亲和性地结合。与抗体相比,其靶标分子范围更加广泛,原则上可以在体外为任何给定的目标选择;具有高度的化学稳定性;无免疫原性;与靶标结合时常常发生显著的构象变化,便于设计具有高检测灵敏度和选择性的新型生物传感器;价格低廉、易于合成和修饰等特点,在癌症的诊断和靶向递药系统研发等方面有着广阔的应用前景。
7.目前,针对脑胶质瘤实现双靶向功能的纳米探针专利相对较少,如中国发明专利“一种具有man和wga修饰的双重靶向脂质体及其制备方法和应用”(cn105055318a)公开了一种具有man和wga修饰的双重靶向脂质体的制备方法,采用双配体4-氨基苯-α-d-吡喃甘
露糖苷和麦胚凝集素修饰发挥了双靶向作用;中国发明专利“一种还原响应聚合物囊泡纳米药物在制备脑肿瘤治疗药物中的应用”(cn107998082a)公开了一种还原响应聚合物囊泡纳米药物的制备方法,含靶向分子apoe和ingr的高聚物自组装后交联得到的可逆交联生物可降解聚合物囊泡装载药物,可以实现囊泡纳米药物穿透血脑屏障和深入肿瘤实质的双靶向作用。
8.而关于一种核酸适配体修饰的双靶向纳米荧光探针的相关专利还没有类似报道。因此,亟需设计一种新的核酸适配体修饰的双靶向纳米荧光探针。
9.通过上述分析,现有技术存在的问题及缺陷为:现有技术中的关于一种核酸适配体修饰的双靶向纳米荧光探针的相关专利还没有类似报道。
技术实现要素:
10.针对现有技术存在的问题,本发明提供了一种核酸适配体修饰的双靶向纳米荧光探针、制备方法及应用。
11.本发明是这样实现的,一种核酸适配体修饰的双靶向纳米荧光探针,所述核酸适配体修饰的双靶向纳米荧光探针由卵磷脂和胆固醇构成的脂质体、光敏剂及其表面的修饰物组成;其中,所述脂质体表面的修饰物为转铁蛋白受体的核酸适配体和核仁素的特异性核酸适配体。
12.进一步,所述核酸适配体通过与二硬脂酰基磷脂酰乙醇胺-peg-pdp发生置换反应,与dspe-peg相连后,dspe端插入脂质体表面,得到适配体-脂质体复合物。
13.进一步,所述纳米载体呈圆球状,粒径为50~150nm。
14.本发明的另一目的在于提供一种实施所述的核酸适配体修饰的双靶向纳米荧光探针的核酸适配体修饰的双靶向纳米荧光探针的制备方法,所述核酸适配体修饰的双靶向纳米荧光探针的制备方法包括以下步骤:
15.步骤一,将经tcep活化后的核酸适配体与dspe-peg-pdp在黑暗中共孵育,得到与dspe-peg相连的核酸适配体,为实现通过dspe端插入脂质体表面,实现核酸适配体与脂质体相连;
16.步骤二,称取卵磷脂、胆固醇、光敏剂以及步骤一得到的dspe-peg-核酸适配体溶于有机溶剂中,减压旋蒸,除去有机溶剂,形成脂质膜,为水化反应做准备;
17.步骤三,用一定量的去离子水对步骤二所得脂质膜进行水化后,进行超声破碎仪冰浴超声,得到反应产物;
18.步骤四,对步骤三得到的反应产物进行离心去杂质,得到核酸适配体修饰的双靶向纳米荧光探针。
19.进一步,所述步骤一中的卵磷脂的称取量为50~200mg,所述胆固醇的称取量为5~50mg,所述光敏剂的称取量为5~40mg。
20.转铁蛋白受体的核酸适配体为核酸适配体gs24,核仁素的特异性核酸适配体为核酸适配体as1411;所述核酸适配体的连接量为0.01~2nmol/ml,所述核酸适配体与dspe-peg-pdp的共孵育时间为1~48h;
21.其中,所述核酸适配体的连接量优选为0.5nmol/ml,所述核酸适配体与dspe-peg-pdp的共孵育时间优选为12h。
22.进一步,所述步骤二中的卵磷脂选自大豆卵磷脂和蛋黄卵磷脂中的任意一种或两种;所述卵磷脂和胆固醇的质量比为(1~10):1;其中,所述卵磷脂优选为大豆卵磷脂,所述卵磷脂和胆固醇的质量比优选为8:1。
23.进一步,所述步骤二中的有机溶剂为三氯甲烷、二氯甲烷、无水乙醇、甲醇中的任意一种;所述光敏剂为ir825、ir780中的任意一种,所述脂质体与光敏剂的质量比为(5~50):1;其中,所述有机溶剂优选为三氯甲烷,所述光敏剂优选为ir780,所述脂质体与光敏剂的质量比优选为12:1。
24.进一步,所述步骤二中的旋转蒸发温度为20~80℃,转速为20~100rpm。
25.其中,所述旋转蒸发的温度优选为40℃,转速优选为45rpm。
26.进一步,所述步骤三中的超声条件为:脉冲超声时间5~60min,超声功率50~150w;其中,所述脉冲超声时间优选30min,超声功率优选120w。
27.进一步,所述步骤四中的离心条件为3000~12000rpm,1~30min;
28.其中,所述离心条件优选为5000rpm,15min。
29.结合上述的技术方案和解决的技术问题,请从以下几方面分析本发明所要保护的技术方案所具备的优点及积极效果为:
30.第一、针对上述现有技术存在的技术问题以及解决该问题的难度,紧密结合本发明的所要保护的技术方案以及研发过程中结果和数据等,详细、深刻地分析本发明技术方案如何解决的技术问题,解决问题之后带来的一些具备创造性的技术效果。具体描述如下:
31.本发明提供的核酸适配体修饰的双靶向纳米荧光探针表面经过双核酸适配体的修饰,可靶向血脑屏障与脑胶质瘤,在肿瘤区域富集成像,定位和监测肿瘤生长。本发明的核酸适配体修饰的双靶向纳米荧光探针具有靶向血脑屏障和脑胶质瘤的双重靶向作用,并具有通过成像监控肿瘤的功能。
32.本发明构建了一种核酸适配体修饰的双靶向纳米荧光探针,即用双核酸适配体修饰载光敏剂的脂质体,以脂质体为载体,具有低毒性、高亲和力的优点;核酸适配体通过化学键与dspe-peg相连,能够轻松地连接到脂质体表面;负载光敏剂之后,在核酸适配体的作用下,能够靶向并穿越血脑屏障,精准地靶向脑胶质瘤,在肿瘤区域富集,通过荧光和光声双模态成像,定位和监测肿瘤生长。
33.实验结果说明,脂质体经过核酸适配体as1411修饰,对脑胶质瘤细胞u87实现了很好的靶向作用。包载光敏剂的脂质体经过核酸适配体gs24和as1411共修饰,对小鼠血脑屏障实现了靶向和穿透,并成功靶向脑胶质瘤细胞,实现了精准靶向。在荧光和光声双模态成像下,也实现了对肿瘤生长的监测,对本发明核酸适配体修饰的双靶向纳米荧光探针在体内的代谢情况进行了监测。
34.第二,把技术方案看做一个整体或者从产品的角度,本发明所要保护的技术方案具备的技术效果和优点,具体描述如下:
35.本发明的纳米探针通过表面修饰的核酸适配体能特异性靶向血脑屏障有效穿透,并能特异性靶向脑胶质瘤细胞,在肿瘤区域富集。光敏剂能通过成像对肿瘤进行定位和监控。本发明的纳米探针可通过超声法制备,操作简单,所得纳米粒子粒径均一,分散性好、生物相容性好、生物利用度高、无细胞毒性,也可在后续成为包载药物靶向治疗脑胶质瘤的纳米制剂,为治疗脑胶质瘤提供了一个新的思路,具有重要的理论意义与临床意义。
36.本发明有益效果在于:
37.1、本发明所涉及到的合成方法简便易操作,纳米粒子具有粒径均匀且单分散性良好等优点;
38.2、本发明所合成的双靶向纳米荧光探针以脂质体为载体,具有低毒性、高亲和力的优点;
39.3、本发明所合成的双靶向纳米荧光探针表面修饰了核酸适配体后,具有良好的靶向血脑屏障与脑胶质瘤细胞的双靶向性;
40.4、本发明所合成的双靶向纳米荧光探针包载光敏剂后,通过荧光和光声双模态成像,可以定位和监测肿瘤生长;
41.5、本发明所合成的双靶向纳米荧光探针具有重要的应用价值,尤其是在肿瘤靶向诊疗方面,表现出良好的应用前景和经济价值。
42.第三,作为本发明的权利要求的创造性辅助证据,还体现在以下几个重要方面:
43.(1)本发明的技术方案转化后的预期收益和商业价值为:本发明采用脂质体为载体,采用核酸适配体实现双靶向功能,制备方式简易,脂质体本身低毒性且价格低廉,核酸适配体价格相对较低,转化后预期成本较低,但对于肿瘤的定位与检测效果显著,具备一定的商业价值。
44.(2)本发明的技术方案填补了国内外业内技术空白:本发明首次公开了核酸适配体修饰的双靶向纳米荧光探针在脑胶质瘤定位和监测中的应用,核酸适配体通过化学键与dspe-peg相连,能够轻松地连接到脂质体表面,实现靶向穿越血脑屏障并精准靶向脑胶质瘤的双靶向作用,包载一定量的光敏剂可通过荧光和光声双模态成像,定位和监测肿瘤生长。
45.(3)本发明的技术方案是否解决了人们一直渴望解决、但始终未能获得成功的技术难题:本发明的技术方案通过荧光和光声双模态成像,定位和监测肿瘤生长,可实现肿瘤生长过程可视化,在临床肿瘤诊疗方面提供帮助。
附图说明
46.为了更清楚地说明本发明实施例的技术方案,下面将对本发明实施例中所需要使用的附图做简单的介绍,显而易见地,下面所描述的附图仅仅是本发明的一些实施例,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下还可以根据这些附图获得其他的附图。
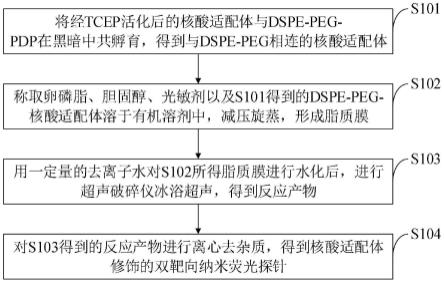
47.图1是本发明实施例提供的核酸适配体修饰的双靶向纳米荧光探针的制备方法流程图。
48.图2是本发明实施例提供的核酸适配体修饰的双靶向纳米荧光探针的透射电镜图。
49.图3是本发明实施例提供的不同核酸适配体修饰的纳米荧光探针与细胞融合后的共聚焦显微镜图。
50.图4是本发明实施例提供的不同纳米荧光探针细胞内化后的荧光强度定量图。
51.图5是本发明实施例提供的核酸适配体修饰的双靶向纳米荧光探针对小鼠脑胶质瘤靶向荧光成像效果图。
52.图6是本发明实施例提供的小鼠体内荧光强度定量图。
53.图7是本发明实施例提供的核酸适配体修饰的双靶向纳米荧光探针对小鼠脑胶质瘤靶向光声成像效果图。
54.图8是本发明实施例提供的小鼠体内光声信号定量图。
具体实施方式
55.为了使本发明的目的、技术方案及优点更加清楚明白,以下结合实施例,对本发明进行进一步详细说明。应当理解,此处所描述的具体实施例仅仅用以解释本发明,并不用于限定本发明。
56.针对现有技术存在的问题,本发明提供了一种核酸适配体修饰的双靶向纳米荧光探针、制备方法及应用,下面结合附图对本发明作详细的描述。
57.一、解释说明实施例。为了使本领域技术人员充分了解本发明如何具体实现,该部分是对权利要求技术方案进行展开说明的解释说明实施例。
58.本发明的目的是提供一种核酸适配体修饰的双靶向纳米荧光探针的制备方法,其表面经过双核酸适配体的修饰,可靶向血脑屏障与脑胶质瘤,在肿瘤区域富集成像,定位和监测肿瘤生长。
59.本发明实施例提供的双靶向纳米荧光探针,通过超声法制备由卵磷脂和胆固醇构成的脂质体,其包载光敏剂,并在其表面修饰转铁蛋白受体的核酸适配体和核仁素的特异性核酸适配体。所述核酸适配体通过与二硬脂酰基磷脂酰乙醇胺-peg-pdp(dspe-peg-pdp)发生置换反应,与dspe-peg相连,然后其dspe端插入脂质体表面得到适配体-脂质体复合物。使其具有靶向血脑屏障和脑胶质瘤的双重靶向作用。通过使用ivis成像设备和光声成像设备,对脂质体中包载的光敏剂进行检测,达到通过成像监控肿瘤的功能。
60.如图1所示,本发明实施例提供的核酸适配体修饰的双靶向纳米荧光探针的制备方法包括以下步骤:
61.s101,将经tcep活化后的核酸适配体与dspe-peg-pdp在黑暗中共孵育,得到与dspe-peg相连的核酸适配体;
62.s102,称取卵磷脂、胆固醇、光敏剂以及s101得到的dspe-peg-核酸适配体溶于有机溶剂中,减压旋蒸,形成脂质膜;
63.s103,用一定量的去离子水对s102所得脂质膜进行水化后,进行超声破碎仪冰浴超声,得到反应产物;
64.s104,对s103得到的反应产物进行离心去杂质,得到核酸适配体修饰的双靶向纳米荧光探针。
65.本发明实施例提供的转铁蛋白受体的核酸适配体为核酸适配体gs24,核仁素的特异性核酸适配体为核酸适配体as1411。核酸适配体的连接量为0.01~2nmol/ml。
66.本发明实施例提供的核酸适配体与dspe-peg-pdp的共孵育时间为1~48h。
67.本发明实施例提供的卵磷脂选自大豆卵磷脂和蛋黄卵磷脂中的一种或两种;所用卵磷脂和胆固醇的质量比为(1~10):1。
68.本发明实施例提供的有机溶剂为三氯甲烷、二氯甲烷、无水乙醇、甲醇中的任意一种;所述光敏剂为ir825、ir780中的任意一种。脂质体与光敏剂的质量比为(5~50):1。
69.本发明实施例提供的旋转蒸发的温度为20~80℃;转速为20~100rpm。
70.本发明实施例提供的超声条件为:脉冲超声时间5~60min,超声功率50~150w。
71.本发明实施例提供的离心条件为3000~12000rpm,1~30min。
72.作为一种优选方案,所述的核酸适配体的连接量为0.5nmol/ml,核酸适配体与dspe-peg-pdp的共孵育时间为12h,卵磷脂选自大豆卵磷脂,卵磷脂和胆固醇的质量比为8:1,有机溶剂为三氯甲烷,光敏剂为ir780,脂质体与光敏剂的质量比为12:1,旋转蒸发的温度为40℃;转速为45rpm,脉冲超声时间30min,超声功率120w,离心条件为5000rpm,15min。
73.二、应用实施例。为了证明本发明的技术方案的创造性和技术价值,该部分是对权利要求技术方案进行具体产品上或相关技术上的应用实施例。
74.实施例1
75.本发明实施例提供的核酸适配体修饰的双靶向纳米荧光探针的制备方法包括以下步骤:
76.1)将经tcep活化后的0.1nmol核酸适配体与适量dspe-peg-pdp在黑暗中共孵育1h,得到与dspe-peg相连的核酸适配体;
77.2)称取50mg卵磷脂、50mg胆固醇、20mg ir825以及步骤1)的dspe-peg-核酸适配体溶于三氯甲烷中,减压旋蒸,旋转蒸发的温度为20℃,转速为20rpm,形成脂质膜;
78.3)用一定量的去离子水对步骤2)所得脂质膜进行水化,后进行超声破碎仪冰浴超声,脉冲超声时间5min,超声功率50w,得到反应产物;
79.4)对步骤3)得到的产物进行离心去杂质,离心条件为3000rpm,1min,得到核酸适配体修饰的双靶向纳米荧光探针。
80.实施例2
81.本发明实施例提供的核酸适配体修饰的双靶向纳米荧光探针的制备方法包括以下步骤:
82.1)将经tcep活化后的3nmol核酸适配体与适量dspe-peg-pdp在黑暗中共孵育6h,得到与dspe-peg相连的核酸适配体;
83.2)称取80mg卵磷脂、40mg胆固醇、15mg ir780以及步骤1)的dspe-peg-核酸适配体溶于二氯甲烷中,减压旋蒸,旋转蒸发的温度为30℃,转速为35rpm,形成脂质膜;
84.3)用一定量的去离子水对步骤2)所得脂质膜进行水化,后进行超声破碎仪冰浴超声,脉冲超声时间10min,超声功率75w,得到反应产物;
85.4)对步骤3)得到的产物进行离心去杂质,离心条件为4500rpm,5min,得到核酸适配体修饰的双靶向纳米荧光探针。
86.实施例3
87.本发明实施例提供的核酸适配体修饰的双靶向纳米荧光探针的制备方法包括以下步骤:
88.1)将经tcep活化后的5nmol核酸适配体与适量dspe-peg-pdp在黑暗中共孵育12h,得到与dspe-peg相连的核酸适配体;
89.2)称取120mg卵磷脂、30mg胆固醇、12.5mg ir825以及步骤1)的dspe-peg-核酸适配体溶于无水乙醇中,减压旋蒸,旋转蒸发的温度为40℃,转速为50rpm,形成脂质膜;
90.3)用一定量的去离子水对步骤2)所得脂质膜进行水化,后进行超声破碎仪冰浴超
声,脉冲超声时间25min,超声90w,得到反应产物;
91.4)对步骤3)得到的产物进行离心去杂质,离心条件为6000rpm,10min,得到核酸适配体修饰的双靶向纳米荧光探针。
92.实施例4
93.本发明实施例提供的核酸适配体修饰的双靶向纳米荧光探针的制备方法包括以下步骤:
94.1)将经tcep活化后的10nmol核酸适配体与适量dspe-peg-pdp在黑暗中共孵育24h,得到与dspe-peg相连的核酸适配体;
95.2)称取150mg卵磷脂、25mg胆固醇、8mg ir780以及步骤1)的dspe-peg-核酸适配体溶于甲醇中,减压旋蒸,旋转蒸发的温度为50℃,转速为75rpm,形成脂质膜;
96.3)用一定量的去离子水对步骤2)所得脂质膜进行水化,后进行超声破碎仪冰浴超声,脉冲超声时间35min,超声功率115w,得到反应产物;
97.4)对步骤3)得到的产物进行离心去杂质,离心条件为8000rpm,15min,得到核酸适配体修饰的双靶向纳米荧光探针。
98.实施例5
99.本发明实施例提供的核酸适配体修饰的双靶向纳米荧光探针的制备方法包括以下步骤:
100.1)将经tcep活化后的15nmol核酸适配体与适量dspe-peg-pdp在黑暗中共孵育36h,得到与dspe-peg相连的核酸适配体;
101.2)称取180mg卵磷脂、22.5mg胆固醇、6mg ir825以及步骤1)的dspe-peg-核酸适配体溶于三氯甲烷中,减压旋蒸,旋转蒸发的温度为60℃,转速为90rpm,形成脂质膜;
102.3)用一定量的去离子水对步骤2)所得脂质膜进行水化,后进行超声破碎仪冰浴超声,脉冲超声时间45min,超声功率130w,得到反应产物;
103.4)对步骤3)得到的产物进行离心去杂质,离心条件为10000rpm,20min,得到核酸适配体修饰的双靶向纳米荧光探针。
104.实施例6
105.本发明实施例提供的核酸适配体修饰的双靶向纳米荧光探针的制备方法包括以下步骤:
106.1)将经tcep活化后的20nmol核酸适配体与适量dspe-peg-pdp在黑暗中共孵育48h,得到与dspe-peg相连的核酸适配体;
107.2)称取200mg卵磷脂、20mg胆固醇、5mg ir780以及步骤1)的dspe-peg-核酸适配体溶于二氯甲烷中,减压旋蒸,旋转蒸发的温度为70℃,转速为100rpm,形成脂质膜;
108.3)用一定量的去离子水对步骤2)所得脂质膜进行水化,后进行超声破碎仪冰浴超声,脉冲超声时间60min,超声功率150w,得到反应产物;
109.4)对步骤3)得到的产物进行离心去杂质,离心条件为12000rpm,30min,得到核酸适配体修饰的双靶向纳米荧光探针。
110.三、实施例相关效果的证据。本发明实施例在研发或者使用过程中取得了一些积极效果,和现有技术相比的确具备很大的优势,下面内容结合试验过程的数据、图表等进行描述。
111.实验1:核酸适配体修饰的双靶向纳米荧光探针的表征
112.对实施例1~实施例6制得的核酸适配体修饰的双靶向纳米荧光探针进行透射电镜(tem)和动态光散射(dls)表征,透射电镜照片如图2所示。
113.由图2可知,本发明核酸适配体修饰的双靶向纳米荧光探针呈圆球状,其粒径主要分布在50~150nm区间。
114.实验2:核酸适配体修饰的双靶向纳米荧光探针体外靶向作用研究
115.1.实验目的:
116.检测本发明提供的核酸适配体修饰的双靶向纳米荧光探针对于脑胶质瘤细胞的靶向效果(因为ir780的激发波长超出激光共聚焦显微镜的最大激发,因此选择ir676替代ir780进行内化情况分析)。
117.2.实验材料及仪器:
118.实验材料:u87细胞、完全培养基、胰酶、4%多聚甲醛、dapi染液、pbs、不修饰核酸适配体纳米荧光探针、修饰对照核酸适配体纳米荧光探针、实施例1~6制得的核酸适配体修饰的双靶向纳米荧光探针。
119.仪器设备:37℃细胞培养箱、超净工作台、倒置显微镜、离心机、激光共聚焦显微镜。
120.3.实验方法:
121.采用不同核酸适配体修饰的纳米荧光探针与细胞融合的方法,通过对比不修饰核酸适配体、修饰对照核酸适配体、修饰as1411核酸适配体的纳米荧光探针相同条件下与u87细胞共孵育后的内化情况,分析本发明提供的核酸适配体修饰的双靶向纳米荧光探针对于脑胶质瘤细胞的靶向性。
122.3.1脑胶质瘤细胞u87的制备
123.将细胞在10%(w/w)fbs培养基中培养,并在5%co2,37℃的细胞培养箱中孵育,定时更换培养基。用显微镜观察细胞生长状况,当培养皿中的细胞覆盖率达到80~90%时传代或铺板使用。
124.3.2接种u87细胞的共聚焦小皿准备
125.将u87细胞用胰酶消化,离心后加入新鲜培养基重新配置为105/ml的细胞悬液,每个共聚焦专用小皿接种1ml细胞悬液,放入37℃,5%co2培养箱中孵育。
126.3.3荧光纳米探针与细胞共孵育
127.用显微镜观察细胞状态,待细胞贴壁并长至75%时,倒掉废弃培养基,用pbs清洗三次后加入无血清培养基,再分别加入20μl不修饰核酸适配体纳米荧光探针、修饰对照核酸适配体纳米荧光探针、实施例1~6制得的核酸适配体修饰的双靶向纳米荧光探针,分别孵育1h。
128.3.4激光共聚焦显微镜观察内化情况
129.孵育结束后,将共聚焦小皿从培养箱中取出,用移液枪轻轻吸取培养基,用pbs清洗三次。之后进行细胞固定及染色。首先加入500μl 4%多聚甲醛对细胞进行固定。固定结束后用去离子水清洗三次,再加入100μl dapi染色液对细胞核进行染色。染色结束后用移液枪吸取dapi,并用pbs清洗三次。激光共聚焦显微镜观察各组的内化情况。光染料的dapi激发波长设置为405nm发射范围设置为430~470nm,ir676激发波长设置为620nm发射范围
设置为670nm。
130.4.数据分析方法
131.使用image j对细胞内化图片荧光强度进行定量分析。
132.5.实验结果
133.如图3所示,与不修饰核酸适配体纳米荧光探针、修饰对照核酸适配体纳米荧光探针相比,实施例1~6制得的核酸适配体修饰的双靶向纳米荧光探针细胞内化程度最高,亮度最强。图4为荧光强度定量图,更直观地说明了情况。
134.6.实验结果
135.本发明提供的核酸适配体修饰的双靶向纳米荧光探针,经过核仁素的特异性核酸适配体as1411修饰后,与不修饰核酸适配体和修饰对照核酸适配体的纳米探针相比,对于脑胶质瘤细胞u87的靶向效果最显著。
136.实验3:核酸适配体修饰的双靶向纳米荧光探针体内靶向作用研究
137.1.实验目的:
138.检测本发明提供的核酸适配体修饰的双靶向纳米荧光探针对于脑胶质瘤小鼠的血脑屏障靶向穿透效果及肿瘤靶向效果。
139.2.实验材料及仪器:
140.实验材料:生理盐水、不修饰核酸适配体纳米荧光探针、实施例1~6制得的核酸适配体修饰的双靶向纳米荧光探针、异氟烷。
141.仪器设备:ivis成像系统、光声成像系统
142.3.实验方法:
143.采用尾静脉注射的方法,通过对比生理盐水、不修饰核酸适配体纳米荧光探针、实施例1~6制得的核酸适配体修饰的双靶向纳米荧光探针注射入小鼠后,在小鼠体内的分布情况,分析本发明提供的核酸适配体修饰的双靶向纳米荧光探针对于小鼠血脑屏障的靶向穿透能力及对脑胶质瘤细胞的靶向性。
144.3.1原位脑胶质瘤小鼠模型构建
145.使用免疫缺陷小鼠,在西安医学院构建u87细胞原位脑胶质瘤小鼠模型,无菌条件下饲养,待小鼠度过icu期之后,向小鼠体内注射自发光底物,用ivis活体成像系统对小鼠肿瘤大小进行检测,当肿瘤长到合适大小时,用于探针在体分布研究。
146.3.2探针注射
147.将原位脑胶质瘤模型小鼠随机分为三组,对照组,不修饰核酸适配体纳米荧光探针组、实施例1~6制得的核酸适配体修饰的双靶向纳米荧光探针组。实验时将各组探针通过尾静脉注射进入小鼠体内200μl。
148.3.3观察纳米荧光探针在小鼠体内的生物分布
149.ivis荧光成像时,提前将仪器温控和参数调试好后,参数选择ir780的波长,激发为780nm,发射为845nm。先使用异氟烷将小鼠麻醉,再将小鼠放入ivis成像系统中,在探针注射12h后对小鼠进行荧光成像,获得荧光图像。
150.光声成像时,提前设置光声成像系统的各项参数,使其水箱预热至33℃,选定之前录入的ir780的全波长为参照。使用异氟烷麻醉小鼠后,将耦合剂均匀涂在小鼠肿瘤区域,避免气泡产生。随后将小鼠固定在成像托载装置上,用保鲜膜将小鼠包裹起来,不要留有空
隙,防止成像时装置进水造成小鼠溺水。将小鼠放进水箱中,连接麻醉仪,于探针注射12h后进行光声成像,调节小鼠位置,选择合适的成像区间,获得小鼠光声图像。
151.4.数据分析方法
152.使用living image软件对荧光图像的荧光信号进行定量分析,使用image j软件对光声图像的光声信号进行定量分析。
153.5.实验结果
154.如图5荧光成像显示,与生理盐水组、不修饰核酸适配体纳米荧光探针组相比,实施例1~6制得的核酸适配体修饰的双靶向纳米荧光探针组更多的积累在肿瘤部位。图6为各组小鼠荧光图像的荧光信号定量分析。
155.如图7光声成像结果所示,与生理盐水组、不修饰核酸适配体纳米荧光探针组相比,实施例1~6制得的核酸适配体修饰的双靶向纳米荧光探针组更多的积累在肿瘤部位。图8为各组小鼠光声图像的信号定量分析。
156.6.实验结果
157.本发明提供的核酸适配体修饰的双靶向纳米荧光探针,经过转铁蛋白受体的核酸适配体gs24和核仁素的特异性核酸适配体as1411修饰后,与不修饰核酸适配体的纳米探针相比,对于脑胶质瘤小鼠的血脑屏障靶向穿透效果及肿瘤靶向效果最好,基于靶向性能透过血脑屏障更多的积累在肿瘤部位。
158.以上所述,仅为本发明的具体实施方式,但本发明的保护范围并不局限于此,任何熟悉本技术领域的技术人员在本发明揭露的技术范围内,凡在本发明的精神和原则之内所作的任何修改、等同替换和改进等,都应涵盖在本发明的保护范围之内。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。