1.本发明属于生物医药领域,具体涉及一种载药多功能纳米凝胶喷雾及其制备方法和应用。
背景技术:
2.恶性黑色素瘤被称为最具侵袭性的皮肤癌,因人体黑素细胞的癌变引起,虽其发病率低,但其恶性度高,转移发生早,死亡率高,并且对传统的化学疗法和放射疗法有着极强的抵抗力,特别是处于晚期阶段与转移性黑色素瘤的患者,5年存活率极低,且治疗方式也极其有限。近年来,免疫治疗、靶向治疗及其联合治疗等在恶性黑色素肿瘤的治疗中取得了一定的效果,但临床也出现了毒副反应的相关报道。鉴于其高度的侵袭性和治疗难度,临床迫切需要开发新的治疗手段。
3.光动力治疗有着安全性好、精准性高、可重复操作、且适用于皮肤癌等浅表性肿瘤的特点,在治疗皮肤肿瘤方面已被写入多国治疗指南与共识。然而在实际临床中,光动力治疗在黑色素瘤治疗方面未能达到满意效果。
4.光动力治疗治疗依赖于ros的释放,但肿瘤细胞因通过自身线粒体的氧化磷酸化过程中消耗氧气而创造出的乏氧肿瘤微环境会降低ros的释放速率,导致光动力治疗疗效降低。因此,改善乏氧肿瘤微环境是光动力治疗治疗中首要考虑的问题。阿托伐醌(ato)为美国药品食品监督管理局批准的用于疟疾和卡氏肺孢子虫性肺炎的药物,有着较高的安全性和良好的耐受性。近年来,阿托伐醌在抗肿瘤方面的作用得到了关注,其可通过抑制肿瘤线粒体氧化磷酸化过程,降低氧气消耗和atp产生,进而发挥抗肿瘤的作用。
5.此外,肿瘤病理中存在的一些普遍性问题对于光动力治疗也有着极大影响。髓系衍生性抑制细胞是一类具免疫抑制功能的未成熟髓细胞,主要存在于外周血、骨髓与肿瘤组织,越来越多的研究显示,髓系衍生性抑制细胞是恶性肿瘤的基本特征之一,也是肿瘤治疗的新途径。在病理情况下,特别是肿瘤细胞存在时,髓系衍生性抑制细胞的数量会大量增加。髓系衍生性抑制细胞可通过多种途径抑制t细胞等免疫细胞活性产生免疫抑制影响肿瘤的临床治疗。有研究表明,酪氨酸激酶抑制剂可减少髓系衍生性抑制细胞的扩增,或将其向成熟髓源细胞诱导转化,进而消除免疫抑制作用。卡博替尼(cabo)为fda批准的多靶点小分子络氨酸酶抑制剂,已在多种肿瘤的临床治疗中显示出了良好效果,同时已有研究显示,卡博替尼可显著降低前列腺癌小鼠髓系衍生性抑制细胞,减弱免疫抑制功能。
技术实现要素:
6.针对现有技术存在的不足,本发明的目的在于提供一种载药多功能纳米凝胶喷雾及其制备方法和应用,以peg-tk-plga nps为载体,对阿托伐醌与卡博替尼进行负载,并将其分散于纤维蛋白原溶液中,通过与凝血酶溶液作用形成凝胶。所得凝胶逆转肿瘤乏氧微环境,缓解髓系衍生性抑制细胞引起的免疫抑制,提高光动力治疗疗效。
7.为了实现上述目的,本发明采用如下技术方案:
8.一种载药多功能纳米凝胶喷雾的制备方法,包括如下步骤:
9.(1)悬浮液的配制:将mpeg(2000)-tk-plga(2000)溶于去离子水中,得悬浮液a;将阿托伐醌和卡博替尼加入二氯甲烷中,得悬浮液b;
10.(2)ato/cabo@peg-tk-plga nps的制备:将悬浮液a加入到悬浮液b中,随后进行超声处理至二氯甲烷挥发完全;接着,加入去离子水,多次离心分离,即得ato/cabo@peg-tk-plga nps;
11.(3)将步骤(2)中所得ato/cabo@peg-tk-plga nps、冰片加入到纤维蛋白原中,混合均匀,得溶液a;将凝血酶加入到水中,搅拌均匀,得溶液b;
12.(4)将步骤(3)所得溶液a和溶液b分别装入喷雾装置中,制得载药多功能纳米凝胶喷雾。
13.优选的,所述步骤(1)中mpeg(2000)-tk-plga(2000)的浓度为0.5~2mg/ml。
14.优选的,所述步骤(1)中,阿托伐醌、卡博替尼、二氯甲烷的用量比为2~6mg:0.5~2mg:1ml。
15.优选的,所述步骤(2)中,悬浮液a、悬浮液b的体积用量比为5~30:1。
16.优选的,所述步骤(2)中,超声处理的时间为40~60min。
17.优选的,所述步骤(3)中,溶液a中,ato/cabo@peg-tk-plga nps的浓度为0.7~1.5mg/ml,冰片的浓度为2~8wt%,纤维蛋白原的浓度为6~12mg/ml。
18.优选的,所述步骤(3)中,溶液b中凝血酶的浓度为6~14u/ml。
19.优选的,所述步骤(4)中,所述喷雾装置为两个腔体相互独立的双腔喷雾装置,溶液a和溶液b分别装在两个所述腔体中。
20.同时,本发明要求保护由上述任一方法制备得到的载药多功能纳米凝胶喷雾。
21.同时,本发明要求保护制备得到的所述载药多功能纳米凝胶喷雾在制备治疗肿瘤药物中的应用。
22.与现有技术相比,本发明具有如下有益效果:
23.1、本发明采用自组装乳液法制备ato/cabo@peg-tk-plga nps,所用药物载体peg-tk-plga nps可成功包裹阿托伐醌和卡博替尼两种药物,包封率分别为80.12%、82.36%,且该载体安全无毒,不仅保留了阿托伐醌和卡博替尼各自的药性,即逆转肿瘤乏氧微环境和缓解髓系衍生性抑制细胞引起的免疫抑制,还能响应肿瘤微环境从而精准释放所包载的药物,实现肿瘤局部的选择性、特异性释放,且释放的两种药物互不干扰,使药效更加集中;
24.2、本发明构建的双系统纳米凝胶喷雾,利用冰片和凝胶的特质,使得该载药喷雾不仅拥有优秀的透皮能力,而且还能延长药物与肿瘤细胞的作用时间,发挥后续治疗作用;
25.3、本发明所构造的双系统纳米凝胶喷雾对光动力治疗疗效的增效明显,与光动力治疗联合治疗时,抑瘤效果显著,疗效为光动力治疗单独治疗疗效的2.3倍、纳米凝胶喷雾单独治疗疗效的4.2倍,而且可以中和免疫抑制,调动全身免疫系统,预防和治疗肿瘤肺转移,规避潜在的肿瘤转移风险,达到最佳治疗效果。
附图说明
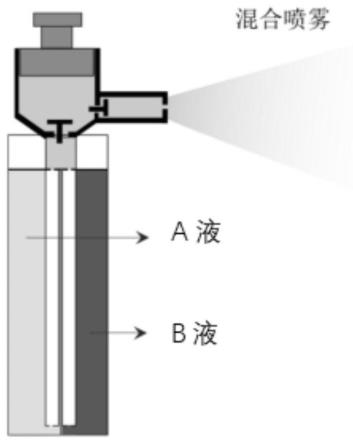
26.图1为本发明载药多功能纳米凝胶喷雾示意图;
27.图2为franz立式扩散池示意图;
28.图3为藻红蛋白标记的皮肤经不同药剂处理后荧光示意图(下)与不同药剂随时间的透过百分比示意图(上);
29.图4为peg-tk-plga及ato/cabo@peg-tk-plga nps形态和粒径表征图,其中a为peg-tk-plga nps tem图像、b为ato/cabo@peg-tk-plga nps tem图像、c为dls粒径测定结果;
30.图5为肿瘤细胞ocr-aot变化图;
31.图6为外周血及脾中髓系衍生性抑制细胞水平图,其中a为血中grl和cd11b检测结果、b为脾中grl和cd11b检测结果;
32.图7为黑色素瘤光动力治疗动物实验结果展示图,其中a为实验流程图,b为肿瘤大小示意图;
33.图8为肿瘤肺实验结果展示图,其中b为肿瘤大小示意图,c为相对肿瘤质量示意图。
具体实施方式
34.为了使本发明的目的、技术方案及优点更加清楚,以下结合实施例,对本发明作进一步的详细说明。当然,此处所描述的具体实施例仅仅用于解释本发明,并不用于限定本发明。
35.本发明中的步骤虽然用标号进行了排列,但并不用于限定步骤的先后次序,除非明确说明了步骤的次序或者某步骤的执行需要其他步骤作为基础,否则步骤的相对次序是可以调整的。可以理解,本文中所使用的术语“和/或”涉及且涵盖相关联的所列项目中的一者或一者以上的任何和所有可能的组合。
36.除非另有特别说明,本发明中用到的各种原材料、试剂、仪器和设备等,均可通过市场购买得到或者可通过现有方法制备得到。
37.实施例1
38.一种载药多功能纳米凝胶喷雾的制备方法,包括如下步骤:
39.(1)悬浮液的配制:将20mg的mpeg(2000)-tk-plga(2000)溶于20ml去离子水中,得悬浮液a;将4mg阿托伐醌和1mg卡博替尼加入2ml二氯甲烷中,得悬浮液b;
40.(2)ato/cabo@peg-tk-plga nps的制备:将悬浮液a加入到悬浮液b中,随后进行超声处理60min至二氯甲烷挥发完全;接着,加入去离子水,多次离心分离,即得ato/cabo@peg-tk-plga nps;
41.(3)将步骤(2)中所得ato/cabo@peg-tk-plga nps、质量分数为5%的冰片加入到10ml的10mg/ml纤维蛋白原中,混合均匀,得溶液a;将10ug的凝血酶加入10ml到水中,搅拌均匀,得溶液b;
42.(4)将步骤(3)所得溶液a和溶液b分别装入喷雾装置中,制得载药多功能纳米凝胶喷雾,所述喷雾装置为两个腔体相互独立的双腔喷雾装置,溶液a和溶液b分别装在两个所述腔体中。
43.实施例2
44.一种载药多功能纳米凝胶喷雾的制备方法,包括如下步骤:
45.(1)悬浮液的配制:将10mg的mpeg(2000)-tk-plga(2000)溶于5ml去离子水中,得
悬浮液a;将1mg阿托伐醌和0.25mg卡博替尼加入1ml二氯甲烷中,得悬浮液b;
46.(2)ato/cabo@peg-tk-plga nps的制备:将悬浮液a加入到悬浮液b中,随后进行超声处理40min至二氯甲烷挥发完全;接着,加入5ml去离子水,多次离心分离,即得ato/cabo@peg-tk-plga nps;
47.(3)将步骤(2)中所得ato/cabo@peg-tk-plga nps、质量分数为5%的冰片加入到10ml的6mg/ml纤维蛋白原中,混合均匀,得溶液a;将6ug的凝血酶加入到10ml水中,搅拌均匀,得溶液b;
48.(4)将步骤(3)所得溶液a和溶液b分别装入喷雾装置中,制得载药多功能纳米凝胶喷雾,所述喷雾装置为两个腔体相互独立的双腔喷雾装置,溶液a和溶液b分别装在两个所述腔体中。
49.实施例3
50.一种载药多功能纳米凝胶喷雾的制备方法,包括如下步骤:
51.(1)悬浮液的配制:将40mg的mpeg(2000)-tk-plga(2000)溶于20ml去离子水中,得悬浮液a;将12mg阿托伐醌和4mg卡博替尼加入2ml二氯甲烷中,得悬浮液b;
52.(2)ato/cabo@peg-tk-plga nps的制备:将悬浮液a加入到悬浮液b中,随后进行超声处理50min至二氯甲烷挥发完全;接着,加入10ml去离子水,多次离心分离,即得ato/cabo@peg-tk-plga nps;
53.(3)将步骤(2)中所得ato/cabo@peg-tk-plga nps、质量分数为5%的冰片加入到10ml的12mg/ml纤维蛋白原中,混合均匀,得溶液a;将14ug的凝血酶加入到10ml水中,搅拌均匀,得溶液b;
54.(4)将步骤(3)所得溶液a和溶液b分别装入喷雾装置中,制得载药多功能纳米凝胶喷雾,所述喷雾装置为两个腔体相互独立的双腔喷雾装置,溶液a和溶液b分别装在两个所述腔体中。
55.对比例1
56.一种载药多功能纳米凝胶喷雾的制备方法,包括如下步骤:
57.(1)悬浮液的配制:将20mg的mpeg(2000)-tk-plga(2000)溶于20ml去离子水中,得悬浮液a;将4mg阿托伐醌和1mg卡博替尼加入2ml二氯甲烷中,得悬浮液b;
58.(2)ato/cabo@peg-tk-plga nps的制备:将悬浮液a加入到悬浮液b中,随后进行超声处理60min至二氯甲烷挥发完全;接着,加入10ml去离子水,多次离心分离,即得ato/cabo@peg-tk-plga nps;
59.(3)将步骤(2)中所得ato/cabo@peg-tk-plga nps加入到10ml的10mg/ml纤维蛋白原中,混合均匀,得溶液a;将10ug的凝血酶加入10ml到水中,搅拌均匀,得溶液b;
60.(4)将步骤(3)所得溶液a和溶液b分别装入喷雾装置中,制得载药多功能纳米凝胶喷雾,所述喷雾装置为两个腔体相互独立的双腔喷雾装置,溶液a和溶液b分别装在两个所述腔体中。
61.本对比例与实施例1的区别是:没有添加冰片。
62.对比例2
63.一种载药多功能纳米喷雾的制备方法,包括如下步骤:
64.(1)悬浮液的配制:将20mg的mpeg(2000)-tk-plga(2000)溶于20ml去离子水中,得
悬浮液a;将4mg阿托伐醌和1mg卡博替尼加入2ml二氯甲烷中,得悬浮液b;
65.(2)ato/cabo@peg-tk-plga nps的制备:将悬浮液a加入到悬浮液b中,随后进行超声处理60min至二氯甲烷挥发完全;接着,加入10ml去离子水,多次离心分离,即得ato/cabo@peg-tk-plga nps;
66.(3)将步骤(2)中所得ato/cabo@peg-tk-plga nps、质量分数为5%的冰片加入到10ml的10mg/ml纤维蛋白原中,混合均匀,得溶液a;溶液b为10ml去离子水;
67.(4)将步骤(3)所得溶液a和溶液b分别装入喷雾装置中,制得载药多功能纳米喷雾,所述喷雾装置为两个腔体相互独立的双腔喷雾装置,溶液a和溶液b分别装在两个所述腔体中。
68.本对比例与实施例1的区别是:没有添加凝血酶,a液与b液接触后,不会形成凝胶。
69.对比例3
70.一种载药多功能纳米喷雾的制备方法,包括如下步骤:
71.(1)悬浮液的配制:将20mg的mpeg(2000)-tk-plga(2000)溶于20ml去离子水中,得悬浮液a;将4mg阿托伐醌和1mg卡博替尼加入2ml二氯甲烷中,得悬浮液b;
72.(2)ato/cabo@peg-tk-plga nps的制备:将悬浮液a加入到悬浮液b中,随后进行超声处理60min至二氯甲烷挥发完全;接着,加入10ml去离子水,多次离心分离,即得ato/cabo@peg-tk-plga nps;
73.(3)将步骤(2)中所得ato/cabo@peg-tk-plga nps加入到10ml的10mg/ml纤维蛋白原中,混合均匀,得溶液a;溶液b为10ml去离子水;
74.(4)将步骤(3)所得溶液a和溶液b分别装入喷雾装置中,制得载药多功能纳米喷雾,所述喷雾装置为两个腔体相互独立的双腔喷雾装置,溶液a和溶液b分别装在两个所述腔体中。
75.本对比例与实施例1的区别是:既没有添加冰片,也没有添加凝血酶,a液与b液接触后,不会形成凝胶。
76.试验例
77.对本技术实施例1~3和对比例1~3制备得到的产品进行性能测试,具体如下:
78.(1)纳米凝胶喷雾的透皮能力测试
79.为了检测纳米凝胶喷雾的透皮能力,本发明对实施例1和对比例1、对比例2、对比例3进行了测试:
80.测试方法:本发明采用franz立式扩散池法评价纳米凝胶喷雾中纳米粒子的透皮能力(如图2)。选用6周龄雌性balb/c小鼠给予5%水合氯醛脱毛,保证其皮肤完好无损。次日取鼠背部皮肤,在供给池和接收池之间固定。用fitc分别标记实施例1、对比例1、对比例2、对比例3,分别记为样品1、样品2、样品3、样品4,将1.0ml的预先准备的样品加入供给池,在接受池中加入ph为7.4的pbs缓冲液,透皮扩散池水温调节至37℃,搅拌速度调节至250rpm。分别于0.5h、1h、2h、4h、6h、10h、16h、24h、30h从接收池收集100μl样品,以激发波长490nm、发射波长520nm测定溶液中样品的荧光强度。透皮实验结束后,取皮肤,用pbs缓冲液清洗后,固定于载玻片后激光共聚焦显微镜下z轴扫描,观察每组样品在皮肤中分布。
81.结果分析:如图3所示,样品1和样品3中加入了冰片,可见显著绿色荧光,样品2中没有加入冰片,荧光非常微弱甚至不可见,说明冰片可有效帮助纳米粒子透皮。其中相同处
理时间下,都加入了冰片的样品1优于样品3,说明凝胶状态可延长纳米粒子与皮肤的有效接触时间。此外,收集接收池溶液进行荧光强度测定,趋势与激光共聚焦实验结果一致,截止30h,样品1透皮能力分别达到样品3溶液、样品2、样品4的1.2倍、3.0倍、4.1倍。
82.综上所述,纳米凝胶喷雾不仅可以帮助载药纳米粒子快速渗透至皮下组织,而且还能延长药物作用时间,发挥后续治疗作用。
83.(2)纳米凝胶喷雾对肿瘤细胞ocr影响的测试
84.如图5所示,阿托伐醌组呈现剂量依赖性ocr下降趋势,当阿托伐醌浓度1mm时,ocr降低超80%,说明阿托伐醌对细胞呼吸存在显著抑制作用,ato@peg-tk-plganps、ato/cabo@peg-tk-plga nps组未显示ocr下降;当体系中引入0.2mm h2o2后,ato@peg-tk-plga nps、ato/cabo@peg-tk-plga nps两组响应性释放阿托伐醌,对ocr呈现剂量依赖性抑制作用,说明细胞呼吸被干扰,且纳米粒子中的卡博替尼并不影响阿托伐醌的释放及活性。因此,ato/cabo@peg-tk-plga nps在模拟肿瘤ros环境下可释放阿托伐醌并抑制细胞氧气消耗。
85.(3)纳米凝胶喷雾对外周血及脾中髓系衍生性抑制细胞水平影响的测试
86.测试方法:以gr1和cd11b作为髓系衍生性抑制细胞的标记物,检测纳米凝胶喷雾对小鼠外周血及脾中髓系衍生性抑制细胞水平的影响。
87.结果分析:如图6所示,ato/cabo@peg-tk-plga冰片凝胶组处理组小鼠外周血和脾中髓系衍生性抑制细胞水平均见显著降低,抑制率分别为70.47%,42.04%。与对照组相比,冰片凝胶组(不含ato/cabo@peg-tk-plga nps)和ato/cabo@peg-tk-plga nps组(不含冰片凝胶)髓系衍生性抑制细胞未见显著降低,表明纳米粒子透皮给药策略的成功对髓系衍生性抑制细胞抑制具有重要意义。
88.(4)纳米凝胶喷雾对光动力治疗疗效的影响研究
89.测试方法:选用荷b16f10肿瘤的balb/c小鼠作为模型,模型的造模日记为day0,在day13时将小鼠随机分为:荷b16f10肿瘤balb/c小鼠模型造模日记为day0,day13随机分为:对照组(仅生理盐水处理)、透皮组(仅ato/cabo@peg-tk-plga nps透皮凝胶处理)、静脉注射组(仅静注光敏剂icg)、联合治疗组(静注icg ato/cabo@peg-tk-plga nps透皮凝胶),并分别以不同给药方案处理后,尾静脉注射光敏剂icg予以pdt治疗,每隔2天联合治疗一次,记录肿瘤生长情况。共治疗6次,第29天处死并收集组织。
90.其抗肿瘤效果如图7所示:实验终点与初次治疗时肿瘤体积相比,对照组可达18.64倍,而透皮组和静脉注射组都减缓了肿瘤生长(分别为14.39倍和7.74倍)。值得注意的是,联合治疗组显示出显著治疗效果,终点时肿瘤体积仅为初次治疗时的3.37倍。
91.(5)纳米凝胶喷雾对光动力治疗抑制肿瘤细胞扩散的影响研究
92.设计如下实验:第13天初次治疗前,尾静脉注射b16f10细胞,其他治疗方案与(4)相同,第29天处死小鼠,剥离肺组织,观察肿瘤转移情况。
93.结果分析:如图8所示,纳米凝胶喷雾在减少肿瘤肺转移结节方面效果显著,几乎完全阻断了黑色素瘤肺转移,表明透皮凝胶喷雾可中和免疫抑制,调动全身免疫系统,预防和治疗肿瘤肺转移,规避潜在的肿瘤转移风险,使光动力治疗达到最佳治疗效果。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。