1.本发明涉及医用材料技术领域,具体而言,涉及一种伤口敷料的制备方法、伤口敷料及应用。
背景技术:
2.组织创伤是临床最常见的疾病之一,在过去十年中,促进伤口护理和愈合的费用持续增加,据统计全球每年约有580万人死于严重创伤。伤口愈合的第一步是止血,严重创伤后导致的过度失血容易引起伤者低血压和多器官衰竭,甚至死亡。因此,迅速控制出血意义重大。此外,暴露的伤口很容易被细菌感染,造成难愈性伤口,严重影响人类健康,甚至造成死亡。
3.目前,组织粘接剂、密封剂、止血剂等已广泛应用于伤口闭合、止血、愈合等领域,用于治疗严重创伤、切口、感染及相关并发症。例如,纤维蛋白胶、白蛋白-戊二醛生物胶、氰基丙烯酸酯等,已广泛应用于临床。
4.但是,现在的几种材料在用于伤口治疗时均存在一定的问题。纤维蛋白胶粘接强度不足,且来源有限,成本高,易引起潜在的感染和免疫原性。而白蛋白-戊二醛生物胶和氰基丙烯酸酯粘接剂等虽然具备较强的组织粘接强度,然而其潜在的毒性限制了其应用,且对于湿润组织的粘接作用有限。
5.此外,这些组织粘接剂或止血剂难以防止后续潜在的伤口感染。为防止伤口感染,现阶段往往运用负载抗菌剂的伤口敷料促进伤口愈合,如抗生素、金属离子和季铵盐等。但传统的抗菌剂通常具有细胞毒性且能诱导耐药细菌的产生。
6.因此,开发具备良好组织粘接性能、抗菌、抗氧化应激、抗感染的止血粘接剂和伤口敷料具备重要的临床意义。
7.鉴于此,特提出本发明。
技术实现要素:
8.本发明的目的在于提供一种伤口敷料及其制备方法,旨在制备具有伤口表面快速止血效果,同时能够保护创面发挥抗炎、抗菌效果的伤口敷料。
9.本发明的另一目的在于提供上述伤口敷料在制备组织创伤修复材料中的应用。
10.本发明是这样实现的:
11.第一方面,本发明提供一种伤口敷料的制备方法,包括:利用聚乙烯醇与3,4-二羟基苯丙氨酸反应得到pdp聚合物,将pdp聚合物与铜离子络合形成水凝胶。
12.在可选的实施方式中,包括:
13.将聚乙烯醇溶解之后,在催化剂存在的条件下与3,4-二羟基苯丙氨酸反应,在反应完成之后通过后处理得到凝胶状态的pdp聚合物;
14.将pdp聚合物复溶之后与铜盐混合反应,以使pdp聚合物与铜离子络合。
15.在可选的实施方式中,聚乙烯醇与3,4-二羟基苯丙氨酸的摩尔比为2.5-4.5:1;优
选为3-4:1;
16.优选地,所述聚乙烯醇的分子量为85-124kda。
17.在可选的实施方式中,催化剂为nahso4·
h2o;
18.优选地,将聚乙烯醇在90-110℃的条件下溶解于有机溶剂中,有机溶剂为二甲基亚砜。
19.在可选的实施方式中,聚乙烯醇和3,4-二羟基苯丙氨酸的反应时间为20-24h,反应温度为75-80℃;
20.优选地,反应过程在保护气存在的条件下进行。
21.在可选的实施方式中,后处理的过程包括:将反应后的溶液进行透析、旋蒸和干燥;
22.优选地,透析时间为2-4h;
23.优选地,干燥采用冻干的方式,冻干时间为1-2天。
24.在可选的实施方式中,将pdp聚合物在加热的条件下与水混合溶解得到pdp溶液,在pdp溶液中滴加铜盐溶液,反应30-60min;
25.优选地,控制pdp溶液中pdp聚合物浓度为80-120mg/ml。
26.在可选的实施方式中,铜盐选自氯化铜、硫酸铜和硝酸铜中的至少一种;优选地,铜盐为cucl2·
2h2o,且pdp聚合物与铜盐的质量比为100:1-2。
27.第二方面,本发明提供一种伤口敷料,通过前述实施方式中任一项的制备方法制备而得。
28.第三方面,本发明提供前述实施方式的伤口敷料在制备组织创伤修复材料中的应用。
29.本发明具有以下有益效果:通过利用聚乙烯醇与3,4-二羟基苯丙氨酸进行脱水缩合反应得到pdp聚合物,将pdp聚合物与铜离子络合形成水凝胶。制备得到的伤口敷料具有丰富的多孔结构,可通过快速吸收血液对伤口进行止血,是一种集组织粘附性、快速止血特性、ros清除活性、近红外光热响应性、抗菌性等多功能于一体的材料,能够牢固粘附于伤口表面快速止血、保护创面并发挥抗炎效应,发挥高效的抗菌效果,快速促进创面伤口的愈合,具备广泛的临床应用前景。
附图说明
30.为了更清楚地说明本发明实施例的技术方案,下面将对实施例中所需要使用的附图作简单地介绍,应当理解,以下附图仅示出了本发明的某些实施例,因此不应被看作是对范围的限定,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据这些附图获得其他相关的附图。
31.图1为本发明实施例提供的伤口敷料的制备流程和效果示意图;
32.图2为pdp和pdpc水凝胶的sem形貌图和mapping图;
33.图3为pva及pdp的紫外光谱图;
34.图4为pdpc水凝胶的xps图像;
35.图5为pdpc水凝胶在0-1000应变范围内pdpc的储能模量(g
′
)和损耗模量(g
″
)的变化图;
36.图6为pdpc的黏度随剪切速率的变化曲线;
37.图7为pdpc水凝胶粘接小鼠脏器实例图;
38.图8为pdp和pdpc水凝胶对猪皮的粘接强度;
39.图9为利用dpph检测不同水凝胶清除氧自由基的示意图(见图中a)、颜色变化图(见图中b)和定量结果;
40.图10为利用nbt检测不同水凝胶清除超氧阴离子(o2·-)的示意图(见图中a)、颜色变化图(见图中b)和定量结果;
41.图11为利用tmb检测不同水凝胶清除羟基自由基(oh
·
)的示意图(见图中a)、颜色变化图(见图中b)和定量结果;
42.图12为利用活性氧探诊dcfh-da检测不同水凝胶对l929细胞的氧化应激改善能力检测和定量分析;
43.图13为利用氧探针ru(dpp)3cl2检测不同水凝胶促使l929细胞的氧气生成能力检测和定量分析;
44.图14为不同浓度的不同水凝胶与l929细胞共培养1天(见图中a)、3天(见图中b)和7天(见图中c)后的细胞活性结果;
45.图15为利用近红外光热仪照射不同水凝胶6min内的热图(见图中a)和温度定量结果(见图中b);
46.图16为利用近红外光热仪照射不同水凝胶4个光热循环的温度变化情况;
47.图17为不同水凝胶分别与大肠杆菌(e.c)和金黄色葡萄球菌(s.a)共培养24h后的菌落图;
48.图18为不同水凝胶分别与大肠杆菌(e.c)和金黄色葡萄球菌(s.a)共培养24h后的细菌活死染色图及其定量结果;
49.图19为不同水凝胶分别与大肠杆菌(e.c)和金黄色葡萄球菌(s.a)细菌生物膜共培养24h后的结晶紫染色及定量结果图;
50.图20为不同水凝胶分别与大肠杆菌(e.c)和金黄色葡萄球菌(s.a)细菌生物膜共培养48h后的荧光染色图;
51.图21为不同水凝胶分别与大肠杆菌(e.c)和金黄色葡萄球菌(s.a)共培养24h后用近红外光照射5min后的菌落图;
52.图22为不同水凝胶分别与大肠杆菌(e.c)和金黄色葡萄球菌(s.a)共培养24h后用近红外光照射5min后的细菌活死染色图及其定量结果;
53.图23为不同水凝胶分别与大肠杆菌(e.c)和金黄色葡萄球菌(s.a)细菌生物膜共培养24h后用近红外光照射5min后的结晶紫染色及定量结果图;
54.图24为不同水凝胶分别与大肠杆菌(e.c)和金黄色葡萄球菌(s.a)细菌生物膜共培养48h后用近红外光照射5min后的荧光染色图;
55.图25为pdpc水凝胶对sd大鼠肝脏止血图(见图中a)及出血量定量图(见图中b);
56.图26为pdpc水凝胶对sd大鼠心脏止血过程图;
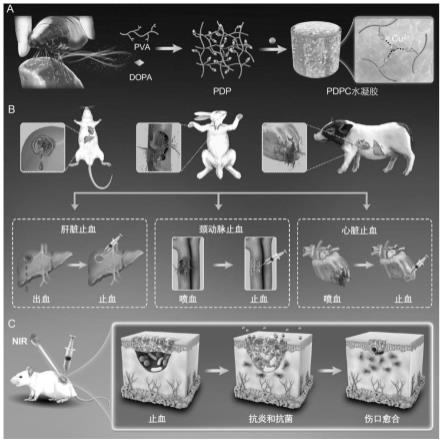
57.图27为pdpc水凝胶对新西兰大白兔颈动脉止血过程图;
58.图28为pdpc水凝胶对巴马小型猪的肝脏线性出血伤口的止血过程图;
59.图29为pdpc水凝胶对巴马小型猪的肝脏圆形出血伤口的止血过程图;
60.图30为pdpc水凝胶对巴马小型猪心脏止血过程图;
61.图31为pdpc水凝胶对巴马小型猪颈动脉止血过程图;
62.图32为pdpc水凝胶对balbc小鼠背部皮肤伤口愈合过程图;
63.图33为不同组别水凝胶处理balbc小鼠背部皮肤伤口后提取细菌的菌落图;
64.图34为pdpc水凝胶治疗balbc小鼠背部皮肤伤口10天后的血常规和血生化分析结果;
65.图35为不同pdpc水凝胶的溶血实验结果图;
66.图36为pdp溶液分别与cucl2·
2h2o和cuso4混合后的图片。
具体实施方式
67.为使本发明实施例的目的、技术方案和优点更加清楚,下面将对本发明实施例中的技术方案进行清楚、完整地描述。实施例中未注明具体条件者,按照常规条件或制造商建议的条件进行。所用试剂或仪器未注明生产厂商者,均为可以通过市售购买获得的常规产品。
68.图1中(a)表示贻贝在樵石上的黏附作用,贻贝依靠其足丝处分泌的黏性液体牢牢地粘附在礁石或渔船表面,在波浪冲刷下仍旧保持良好的粘接强度,它强大而独特的湿粘接性能受到愈加广泛的关注。
69.贻贝之所以具备如此优异的湿粘接性能,主要原因是贻贝足丝黏液中含有一种多巴的物质,多巴所含有的儿茶酚基团(catechol)能与多种功能性基团产生相互作用力,是产生粘附作用的关键所在。此外,儿茶酚基团具有良好的生物相容性和ros清除能力,与金属离子络合后表现出良好的组织粘附性、自愈合性以及近红外光热效应。本发明实施例正是利用这一特性,制备水凝胶形态的伤口敷料。
70.请参照图1中(a),本发明实施例提供一种伤口敷料的制备方法,其利用聚乙烯醇与3,4-二羟基苯丙氨酸反应得到pdp聚合物,将pdp聚合物与铜离子络合形成水凝胶。参照图1中(b)和(c),制备得到的水凝胶集组织粘附性、快速止血特性、ros清除活性、近红外光热响应性、抗菌性等多功能于一体,实现了伤口表面快速止血和抗炎抗菌的多重效果。
71.本发明实施例所提供的伤口敷料具体制备方法如下:
72.s1、pdp聚合物的合成
73.将聚乙烯醇溶解之后,在催化剂存在的条件下与3,4-二羟基苯丙氨酸进行脱水缩合反应,在反应完成之后通过后处理得到凝胶状态的pdp聚合物。具体地,利用聚乙烯醇上的羟基和3,4-二羟基苯丙氨酸上的羧基进行脱水缩合,使3,4-二羟基苯丙氨酸接枝在聚乙烯醇的长链上。
74.在一些实施例中,聚乙烯醇与3,4-二羟基苯丙氨酸的摩尔比为2.5-4.5:1;优选为3-4:1,聚乙烯醇的分子量为85-124kda。通过控制聚乙烯醇分子量以及两种原料的用量比,以提升产品的组织粘附性能以及止血效果。
75.具体地,聚乙烯醇与3,4-二羟基苯丙氨酸的摩尔比可以为2.5:1、3.0:1、3.5:1、4.0:1、4.5:1等,也可以为以上相邻摩尔比值之间的任意值。
76.在一些实施例中,催化剂为nahso4·
h2o。以上几种原料均适合于作为反应催化剂,促进3,4-二羟基苯丙氨酸的快速接枝,催化剂可以为一种,也可以为几种。
77.在一些实施例中,将聚乙烯醇在90-110℃的条件下溶解于有机溶剂中,有机溶剂为二甲基亚砜。有机溶剂的用量不做限定,保证聚乙烯醇能够充分溶解便于进行反应即可。
78.在一些实施例中,聚乙烯醇和3,4-二羟基苯丙氨酸的反应时间为20-24h,反应温度为75-80℃,通过进一步控制反应时间和反应温度以提升3,4-二羟基苯丙氨酸的接枝率。具体地,反应时间可以为20h、21h、22h、23h、24h等,也可以为以上相邻时间值之间的任意值;反应温度可以为75℃、76℃、77℃、78℃、79℃、80℃等,也可以为以上相邻温度值之间的任意值。
79.在一些实施例中,反应过程在保护气存在的条件下进行,以防止氧化。具体地,保护气的种类不限,可以为氮气或其他惰性气体。
80.在一些实施例中,后处理的过程包括:将反应后的溶液进行透析、旋蒸和干燥;透析时间为2-4h;干燥采用冻干的方式,冻干时间为1-2天。具体地,透析是将反应后的溶液装入透析袋中进行处理,以达到使pdp聚合物得到纯化的目的,经过旋蒸去除多余水分和溶剂之后经过冻干得到凝胶状态的中间产物。
81.s2、pdpc水凝胶的合成
82.将凝胶状态的pdp聚合物复溶之后与铜盐混合反应,利用氢键和铜离子金属配位的作用,以使pdp聚合物与铜离子络合形成水凝胶,该水凝胶具有较好的柔韧性和可注射性。
83.需要说明的是,cu
和cu
2
之间的可逆的电子转移赋予其强大的抗氧化活性,而且cu离子还具备优异的近红外光热响应性能和抗菌效应。此外,cu还具有价格便宜,合成简易、生物相容性良好的优点。
84.在实际操作过程中,将pdp聚合物在加热的条件下与水混合溶解得到pdp溶液,在pdp溶液中滴加铜盐溶液,反应30-60min。将冻干的pdp聚合物在60℃水浴加热的条件下溶解于水中,再滴加铜盐溶液进行络合形成水凝胶。
85.在一些实施例中,控制pdp溶液中pdp聚合物浓度为80-120mg/ml,在此浓度条件下便于和铜离子络合形成水凝胶状态。具体地,pdp聚合物浓度为80mg/ml、85mg/ml、90mg/ml、95mg/ml、100mg/ml、105mg/ml、110mg/ml、115mg/ml、120mg/ml等,也可以为以上相邻浓度值之间的任意值。
86.在一些实施例中,铜盐选自氯化铜、硫酸铜和硝酸铜中的至少一种;优选地,铜盐为cucl2·
2h2o,且pdp聚合物与铜盐的质量比为100:1-2(如100:1、100:2等)。铜盐溶液的浓度较大,可以控制为100-200mg/ml,以使络合之后能够形成水凝胶状态。
87.本发明实施例还提供一种伤口敷料,通过上述制备方法制备而得。
88.需要说明的是,图1中(a)为pdpc水凝胶的合成策略示意图;(b)为pdpc水凝胶用于不同动物(大鼠、兔、猪)的颈动脉、心脏和肝脏止血示意图;(c)为pdpc水凝胶促进伤口愈合示意图。
89.本发明实施例所提供的伤口敷料不仅能够在创伤早期快速促进伤口区域止血,且能够有效抗菌和抗感染,显著促进急性(外伤和手术)和慢性感染伤口(如糖尿病患者伤口),可望有效促多种创伤的伤口愈合。
90.本发明实施例还提供了上述伤口敷料在制备组织创伤修复材料中的应用,可以以本发明实施例所提供的伤口敷料为基础,结合其他原料再制备形成用于组织创伤修复的材
料。
91.以下结合实施例对本发明的特征和性能作进一步的详细描述。
92.实施例1
93.本实施例提供一种伤口敷料的制备方法,包括如下步骤:
94.(1)pdp聚合物的合成:将75mmol、分子量为85-124kda的聚乙烯醇(pva)在100℃的条件下溶于180ml的dmso中,溶解后加入11g nahso4·
h2o催化,待温度降至78℃时,加入20mmol 3,4-二羟基苯丙氨酸(dopa)。在n2保护下反应22h,反应结束后待温度降至室温时将所得溶液在透析袋内透析3天,悬蒸仪去除多余水分,然后用冻干机冻干2天,得到干燥的pdp聚合物。
95.(2)pdpc水凝胶的合成:将冻干的pdp聚合物称重,在60℃水浴加热的条件下,按照100mg/ml的浓度溶解于去离子水中,再滴入氯化铜水溶液(采用cucl2·
2h2o溶于水制备而得),氯化铜水溶液中铜离子浓度为100mg/ml,控制pdp聚合物和cucl2·
2h2o的质量比为100:1。充分搅拌反应30-60min,制备成pdpc水凝胶,用pdpc1表示。
96.实施例2
97.与实施例1的区别仅在于:控制pdp聚合物和cucl2·
2h2o的质量比为100:2,用pdpc2表示。
98.实施例3
99.本实施例提供一种伤口敷料的制备方法,包括如下步骤:
100.(1)pdp聚合物的合成:将70mmol、分子量为89-98kda的聚乙烯醇(pva)在90℃的条件下溶于150ml的dmso中,溶解后加入10g nahso4·
h2o催化,待温度降至75℃时,加入18mmol 3,4-二羟基苯丙氨酸(dopa)。在n2保护下反应20h,反应结束后待温度降至室温时将所得溶液在透析袋内透析2天,悬蒸仪去除多余水分,然后用冻干机冻干1天,得到干燥的pdp聚合物。
101.(2)pdpc水凝胶的合成:将冻干的pdp聚合物称重,在60℃水浴加热的条件下,按照80mg/ml的浓度溶解于去离子水中,再滴入氯化铜水溶液(采用cucl2·
2h2o溶于水制备而得),氯化铜水溶液中铜离子浓度为200mg/ml,控制pdp聚合物和cucl2·
2h2o的质量比为100:2。充分搅拌反应30min,制备成pdpc水凝胶。
102.实施例4
103.本实施例提供一种伤口敷料的制备方法,包括如下步骤:
104.(1)pdp聚合物的合成:将80mmol、分子量为13-23kda的聚乙烯醇(pva)在110℃的条件下溶于200ml的dmso中,溶解后加入12g nahso4·
h2o催化,待温度降至80℃时,加入24mmol 3,4-二羟基苯丙氨酸(dopa)。在n2保护下反应24h,反应结束后待温度降至室温时将所得溶液在透析袋内透析4天,悬蒸仪去除多余水分,然后用冻干机冻干2天,得到干燥的pdp聚合物。
105.(2)pdpc水凝胶的合成:将冻干的pdp聚合物称重,在60℃水浴加热的条件下,按照120mg/ml的浓度溶解于去离子水中,再滴入氯化铜水溶液(采用cucl2·
2h2o溶于水制备而得),氯化铜水溶液中铜离子浓度为150mg/ml,控制pdp聚合物和cucl2·
2h2o的质量比为100:2。充分搅拌反应60min,制备成pdpc水凝胶。
106.对比例1
107.与实施例1的区别仅在于:控制pdp聚合物和cucl2·
2h2o的质量比为100:3,用pdpc3表示。
108.对比例2
109.将常见市售的明胶海绵与本发明中pdpc水凝胶伤口敷料进行对比,比较二者对伤口止血的效果。
110.对比例3
111.与实施例1的区别仅在于:将cucl2·
2h2o替换为等质量的cuso4。
112.试验例1
113.对实施例中制备得到的pdpc水凝胶进行材料表征。
114.(1)测试实施例1中得到的pdp聚合物,以及实施例1-2中制备得到的pdpc1和pdpc2水凝胶的sem照片和mapping图,结果如图2所示。图2中a表示pdp聚合物的sem照片,b表示pdpc1的sem照片和mapping图,c表示pdpc2的sem照片和mapping图。
115.从图2可以看出,pdp聚合物以及pdpc1和pdpc2水凝胶呈现出均匀的多孔结构,且pdpc1和pdpc2水凝胶中cu离子均匀分布。
116.(2)测试实施例1中得到pdp聚合物和pva的紫外光谱,结果如图3所示。
117.从图3可以看出相比pva而言,pdp聚合物在280nm左右处具有明显的特征峰,该特征峰为邻苯二酚结构的特征峰,证明dopa成功接枝到pva聚合物链上,从而证明pdp聚合物的成功合成。
118.(3)测试实施例1中得到pdpc1水凝胶的xps图像,结果如图4所示。
119.从图4可以看出,xps不仅证明了pdpc水凝胶中含有铜离子,即证明pdpc水凝胶铜离子的成功引入。此外,从xps结果还可以看出,pdpc1水凝胶内含有两种价态的铜离子(cu
和cu
2
),且定量分析两种铜离子的比例为cu
:cu
2
=61.7:38.3,证明cu
和cu
2
之间的可逆的电子转移赋予其良好的抗氧化活性。
120.(4)利用应变振幅扫描测试实施例1中得到pdpc1水凝胶的弹性响应,测试了在0-1000%应变范围内pdpc1水凝胶的储能模量(g
′
)和损耗模量(g
″
)的改变,结果如图5所示。
121.从图5可以看出,在低应变条件下,g'和g”几乎保持不变,直到达到约100%,表明pdpc水凝胶可以维持较大的弹性变形。当应变进一步增加时,g'和g”急剧下降,在约400%时二者趋于相等,表明水凝胶网络结构破裂转变为溶胶状态。
122.(5)测试实施例1中得到pdpc水凝胶黏度与剪切速率的关系以及可注射性,结果如图6所示。
123.从图6可以看出,在0-100剪切速率范围内,pdpc的黏度随着剪切速率增加而减小,证明pdpc水凝胶具有剪切稀化性能,有明显的可注射性,且如图中大体图所示,水凝胶可以随注射器注射出来,也证明其具备良好的可注射性。
124.试验例2
125.测试实施例中制备得到pdpc水凝胶的体外粘接性能。
126.(1)测试实施例1中制备得到的pdpc水凝胶的组织粘接性能,结果如图7所示。
127.图7中分别表示pdpc水凝胶对于小鼠肾脏、肺和肝脏的粘接实例。从图7可以看出,pdpc水凝胶对小鼠各个部位均表现出较好的粘接性能。
128.(2)测试实施例1中制备得到的pdp和pdpc水凝胶对猪皮的粘接强度,结果如图8所
示。从图中可以看出,pdpc水凝胶对猪皮肤的粘接性能明显优于pdp水凝胶,证明pdpc水凝胶具备良好的粘接性能。
129.试验例3
130.测试实施例中制备得到pdpc水凝胶的体外抗氧化性能。
131.(1)测试实施例1和实施例2制备得到的pdp、pdpc1和pdpc2水凝胶清除氧自由基的能力,结果如图9所示。图9中a表示清除氧自由基的原理图;b表示不同水凝胶与dpph作用30min后的颜色变化图,c表示不同水凝胶与dpph反应30min后清除氧自由基的定量结果。
132.利用dpph的颜色变化进行分析,将dpph与水凝胶反应半小时记录颜色变化情况,并用酶标仪进行定量分析,如图9所示,pdpc水凝胶具备良好的清除氧自由基的能力,且pdpc2优于pdpc1水凝胶。
133.(2)测试实施例1和实施例2制备得到的pdp、pdpc1和pdpc2水凝胶清除超氧阴离子(o2·-)的能力,结果如图10所示。图10中a表示清除超氧阴离子(o2·-)的原理图;b表示不同水凝胶与nbt作用30min后的颜色变化图,c表示不同水凝胶与dpph反应30min后清除o2·-的定量结果。
134.图10可以看出,pdpc水凝胶具备良好的清除清除超氧阴离子的能力,且pdpc2优于pdpc1水凝胶。
135.(3)测试实施例1和实施例2制备得到的pdp、pdpc1和pdpc2水凝胶清除羟基自由基(oh
·
)的能力,结果如图11所示。图11中a表示清除羟基自由基(oh
·
)的原理图;b表示不同水凝胶与tmb作用30min后的颜色变化图,c表示不同水凝胶与dpph反应30min后清除oh
·
的定量结果。
136.图11可以看出,pdpc水凝胶具备良好的清除羟基自由基的能力,且pdpc2优于pdpc1水凝胶。
137.(4)测试实施例1和实施例2制备得到的pdp、pdpc1和pdpc2水凝胶对l929细胞的氧化应激改善能力,结果如图12所示。图12中a表示利用dcfh-da探针检测不同水凝胶清除氧化应激状态l929细胞中ros的荧光染色图;b表示对应的荧光强度。
138.图12可以看出,pdpc水凝胶具备更好的抵抗氧化应激的能力,且pdpc2优于pdpc1水凝胶。
139.(5)测试实施例1和实施例2制备得到的pdp、pdpc1和pdpc2水凝胶促使l929细胞的氧气生成能力,结果如图13所示。图13中a表示利用ru(dpp)3cl2探针检测不同水凝胶与氧化应激状态l929细胞共培养后o2生成情况的荧光染色图;b表示对应的荧光强度。
140.图13可以看出,可以看到相比于pdp而言,pdpc拥有更好的抗氧化性能,且与铜离子的含量成正比,即pdpc2优于pdpc1水凝胶。
141.试验例4
142.测试实施例中制备得到pdpc水凝胶的体外生物相容性。
143.测试实施例1和实施例2制备得到的pdp、pdpc1和pdpc2水凝胶对l929细胞的毒性,结果如图14所示。图14中a表示不同浓度的不同水凝胶与l929细胞共培养1天后的细胞活性;b表示不同浓度的不同水凝胶与l929细胞共培养3天后的细胞活性;c表示不同浓度的不同水凝胶与l929细胞共培养7天后的细胞活性。
144.图14可以看出,不同浓度的不同水凝胶与l929细胞共培养1天、3天和7天后的细胞
活性较空白对照组而言均无明显差异,证明不同水凝胶均具备良好的生物相容性。
145.试验例5
146.测试实施例中制备得到pdpc水凝胶的光热性能。
147.(1)测试实施例1和实施例2制备得到的pdp、pdpc1和pdpc2水凝胶光热性能,结果如图15所示。图15中a表示不同水凝胶在近红外光照射6min内的温度热图;b表示不同水凝胶在近红外光照射6min内的温度变化定量结果。
148.图15可以看出,不同pdpc水凝胶均拥有优异的光热性能,pdpc2水凝胶的温度从最开始的22℃升至51℃,且快速趋于稳定到达平台期。
149.(2)测试实施例1和实施例2制备得到的pdp、pdpc1和pdpc2水凝胶光热稳定性,结果如图16所示。
150.图16表示pdpc水凝胶在相同条件进行4个循环激光照射周期的升温测试,在4个不同周期内pdpc水凝胶均呈现良好的光热性能,证实了pdpc水凝胶具备优异的光稳定性。
151.试验例6
152.测试实施例1和实施例2制备得到的pdp、pdpc1和pdpc2水凝胶抗菌性能,结果如图17-图20所示。
153.(1)图17为不同水凝胶分别与大肠杆菌(e.c)(a)和金黄色葡萄球菌(s.a)(b)共培养24h后的菌落图,证明pdpc水凝胶可以抑制两种菌的菌落形成;
154.(2)图18为不同水凝胶分别与e.c(a)和s.a(b)共培养24h后的细菌活死染色图及其定量结果,证明pdpc水凝胶可以有效杀死两种细菌;
155.(3)图19为不同水凝胶分别与e.c(a)和s.a(b)共培养24h后的结晶紫染色及定量结果图,证明pdpc水凝胶可以有效杀灭细菌生物膜;
156.(4)图20为不同水凝胶分别与e.c(a)和s.a(b)细菌生物膜共培养48h后的荧光染色图,也证明pdpc水凝胶可以有效杀灭细菌生物膜。
157.从以上结果均可以看出,pdpc水凝胶均具备更加优异的抗菌效果,且pdpc2水凝胶优于pdpc1水凝胶。
158.试验例7
159.测试实施例1和实施例2制备得到的pdp、pdpc1和pdpc2水凝胶的光热抗菌性能,结果如图21-图24所示。
160.(1)图21为不同水凝胶分别与大肠杆菌(e.c)(a)和金黄色葡萄球菌(s.a)(b)共培养24h并用808nm近红外光照射5min后的菌落图,证明pdpc水凝胶光照后可进一步抑制两种菌的菌落形成。
161.(2)图22为不同水凝胶分别与e.c(a)和s.a(b)共培养24h并用808nm近红外光照射5min后的细菌活死染色图及其定量结果,证明pdpc水凝胶光照后可更加有效杀死两种细菌。
162.(3)图23为不同水凝胶分别与e.c(a)和s.a(b)共培养24h并用808nm近红外光照射5min后的结晶紫染色及定量结果图,证明pdpc水凝胶光照后可以有效杀灭细菌生物膜;
163.(4)图24为不同水凝胶分别与e.c(a)和s.a(b)细菌生物膜共培养48h并用808nm近红外光照射5min后的荧光染色图,也证明pdpc水凝胶光照后可以有效杀灭细菌生物膜。
164.从以上结果均可以看出,pdpc水凝胶均具备更加优异的光热抗菌效果,且pdpc2水
凝胶优于pdpc1水凝胶。
165.试验例8
166.测试实施例2制备得到的pdpc2水凝胶的止血性能,结果如图25-图31所示。
167.(1)图25为pdpc2水凝胶对sd大鼠肝脏止血定量结果,图25中a表示60s内肝脏的出血情况图,b表示60s内肝脏的失血量定量结果。如图所示,pdpc水凝胶具备更优异的止血性能,可使大鼠肝脏快速止血,且相较于空白组的失血量明显减少;
168.(2)图26为pdpc水凝胶对sd大鼠心脏止血过程图,从图中可以看出,使用pdpc2水凝胶对大鼠心脏创口进行涂抹后pdpc水凝胶可快速有效封闭心脏创口,使心脏停止出血,证明其优异的止血性能;
169.(3)图27为pdpc水凝胶对新西兰大白兔颈动脉止血过程图,如图所示,将颈动脉截流并制造创口,然后用pdpc2水凝胶涂抹创口,松开动脉夹后pdpc2水凝胶可成功封闭猪颈动脉的创口出血,且在原创口的远心端再建立一个创口后,颈动脉可恢复血供,表明材料应用后未影响兔子的正常血供。
170.(4)图28为pdpc水凝胶对巴马小型猪的肝脏线性出血伤口的止血过程图;图29为pdpc水凝胶对巴马小型猪的肝脏圆形出血伤口的止血过程图。图28和图29均可以看出,使用pdpc2水凝胶覆盖猪肝脏线性和圆形出血创口均可快速成功封闭创口,并达到止血的目的。证明pdpc水凝胶可封闭猪等大型动物的出血,具备优异的止血性能。
171.(5)图30为pdpc水凝胶对巴马小型猪心脏止血过程图;图31为pdpc水凝胶对巴马小型猪颈动脉止血过程图。同上,pdpc水凝胶不仅可以快速封闭大鼠、兔子等中小型动物心脏和颈动脉的出血,还可以封闭猪等大型动物心脏和颈动脉的出血,即使在心脏和颈动脉较大的血液压力冲击下仍旧能够牢固黏附于创口组织表面,达到快速的止血效果。
172.试验例9
173.测试实施例2制备得到的pdpc2水凝胶对大鼠皮肤伤口的愈合效果,结果如图32和图33所示。
174.图32为pdpc水凝胶对balbc小鼠背部皮肤伤口愈合过程图,如图所示,pdpc水凝胶较其他组别的小鼠伤口愈合更快,证明pdpc水凝胶可有效促进皮肤伤口愈合。图33为不同组别水凝胶处理小鼠背部皮肤伤口后在伤口处提取菌液的菌落图,如图所示,pdpc水凝胶处理小鼠皮肤伤口后可明显减少伤口处的细菌数量,证明pdpc水凝胶具备良好的抗菌性能,从而促进皮肤伤口愈合。
175.试验例10
176.测试实施例1和实施例2制备得到的pdp和pdpc2水凝胶的体内生物相容性,结果如图34所示。图34分别表示不同组别水凝胶处理后的白细胞(wbc)(a)、红细胞(rbc)(b)、血小板(plt)(c)、血清肌酸激酶(ck)(d)、乳酸脱氢酶(ldh)(e)、谷丙转氨酶(alt)(f)、谷草转氨酶(ast)(g)、尿素氮(bun)(h)和肌酐(crea)(i)。
177.如图34中a-c所示,不同组别水凝胶处理伤口10天后的wbc、rbc和plt与空白对照组均无明显差异,证明pdpc水凝胶无明显的血液毒性;如图34中d-i所示,不同组别水凝胶处理伤口10天后的ck、ldh、alt、ast、bun和crea与空白对照组均无明显差异,证明pdpc水凝胶对心脏、肝脏、肾脏均无明显毒性。证明pdpc水凝胶具备优异的体内生物相容性。
178.试验例11
179.测试实施例1和实施例2制备得到的pdpc1和pdpc2水凝胶和对比例1制备得到的pdpc3水凝胶的溶血性,结果如图35所示。
180.从图35可以看出,pdp、pdpc1和pdpc2水凝胶组颜色与阴性对照组(pbs)相似,表明其均未发生明显溶血,而pdpc3水凝胶组与阳性对照组(triton x-100)相似,呈现亮红色,表明其发生严重溶血,以上结果证明pdp、pdpc1和pdpc2水凝胶均具备良好的生物相容性,而pdpc3水凝胶生物相容性较差,无法进一步应用于生物医学领域。
181.试验例12
182.测试实施例2制备得到pdpc2水凝胶与对比例2中常见市售的明胶海绵对伤口止血的效果,结果如图25所示。
183.从图25可以看出,pdpc2水凝胶的止血效果明显优于明胶海绵的止血效果,其出血量明显少于明胶海绵,且差异具备统计学意义,证明pdpc水凝胶比市售明胶海绵可以达到更好的止血效果,减少病人出血量,加速病人伤口愈合。
184.试验例13
185.测试实施例1中使用cucl2·
2h2o与对比例3中cuso4制备pdpc水凝胶的效果,结果如图36所示。
186.从图36中可以看出,将pdp溶液与cucl2·
2h2o溶液混合后的pdpc为均匀分布的溶液状态,而将pdp溶液与cuso4溶液混合后的pdpc出现明显的沉淀,即cuso4溶液无法与pdp溶液充分反应形成均匀的pdpc溶液,也无法形成所需的pdpc水凝胶,因此本发明选取cucl2·
2h2o制备pdpc水凝胶。
187.综上所述,本发明提供一种伤口敷料的制备方法、伤口敷料及应用,以聚乙烯醇(pva)为载体,整合多巴(dopa)优良的湿粘接性能和金属离子cu的优良特性,实现儿茶酚基的动态交联,制备了一种仿生的贻贝多功能水凝胶(pdpc水凝胶)。该水凝胶具备以下优良特性:
188.(1)超强的粘接性能,在血液的冲洗及病人运动情况下能够长期稳固粘附于创伤组织;
189.(2)超强、快速的止血性能,即使在心脏、颈动脉等血管压力下仍旧能够快速有效止血,降低死亡率;
190.(3)良好的可注射性和塑形能力,操作便捷,适用于不同形状缺损;
191.(4)高效、广谱的抗氧化活性;
192.(5)优异的近红外光热响应性和抗菌效果;
193.(6)良好的生物安全性能和血液相容性;
194.(7)有效促进伤口愈合。
195.以上仅为本发明的优选实施例而已,并不用于限制本发明,对于本领域的技术人员来说,本发明可以有各种更改和变化。凡在本发明的精神和原则之内,所作的任何修改、等同替换、改进等,均应包含在本发明的保护范围之内。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。