用于电场分布的快速近似的方法、系统和装置
1.相关专利申请的交叉引用本技术要求2019年12月31日提交的美国临时申请第62/955,678号的优先权,所述美国申请通过引用被整体地并入本文中。
背景技术:
2.肿瘤治疗场或ttfields是中频范围(100-300 khz)内的低强度(例如1-3 v/cm)交变电场。ttfields疗法是美国食品和药品管理局(fda)批准的针对多形性胶质母细胞瘤(gbm)和恶性胸膜间皮瘤(mpm)的治疗。这种非侵入性治疗以实体瘤为目标,并且在美国专利第7,565,205号中描述,该美国专利通过引用被整体地并入本文中。临床试验已经表明,将ttfields添加到护理的标准中显著地延长胶质母细胞瘤患者的总生存期。在mpm患者中已经观察到类似的改善。使用放置在肿瘤附近皮肤上的成对换能器阵列非侵入性地传递ttfields。该阵列被连接到场发生器,该场发生器在被激活时产生在100-300 khz的范围内的交变电场,该交变电场传播到癌组织中。ttfields通过在有丝分裂期间与关键分子的物理相互作用来扰乱细胞分裂。ttfields疗法是一种被批准用于复发性胶质母细胞瘤的单一治疗,并且是被批准用于新诊断患者的化疗联合疗法。这些电场由直接放置在患者的头皮上的换能器阵列(即电极的阵列)非侵入性地感应。ttfields似乎也有利于治疗身体的其他部分中的肿瘤。由换能器阵列产生的电场的分布使ttfields疗法的益处最大化,但是换能器阵列的最佳定位不容易确定。用于估计ttfields强度分布的当前方法依赖于有限元方法,该方法耗时并且可能需要数小时来计算由单对换能器阵列产生的场。例如,电场分布的估计涉及复杂和耗时的计算,这在专用高性能计算机上至少需要3-4小时。因此,在用于ttfields治疗规划的任何实际优化方案中,只能评估有限数量的换能器阵列位置,并且优化结果可能是次优的。
技术实现要素:
3.描述了方法,所述方法包括:确定与多个患者相关联的多个图像数据集,其中每个患者与从对患者的一部分进行成像来导出的图像数据集相关联,其中每个图像数据集包括多个体素,其中多个体素中的每个体素用组织类型来标记,并且其中多个体素中的每个体素用电场强度分布值(v cm-1)来标记,所述电场强度分布值是从一对换能器阵列向患者的部分模拟施加交变电场而导出的;基于多个图像数据集的第一部分来确定预测模型的多个特征;基于多个特征和多个图像数据集的第一部分来训练所述预测模型,其中所述预测模型被配置成估计电场强度分布值;基于多个图像数据集的第二部分来测试预测模型;以及基于测试来输出预测模型。
4.还描述了方法,所述方法包括:针对患者确定图像数据集,其中该图像数据集包括多个体素;向预测模型呈现图像数据集,其中所述预测模型被配置成基于来自多个位置处的一对换能器阵列的一个或多个模拟交变电场来估计电场强度分布值;通过所述预测模型,针对多个体素中的每个体素估计在多个位置中的每个位置处的该对换能器阵列的一个
或多个电场分布强度值;以及基于在多个位置中的每个位置处的该对换能器阵列的估计的一个或多个电场分布强度值、感兴趣的区域以及与患者相关联的解剖限制来确定包括多个位置中的一个或多个位置的换能器阵列图。
5.附加的优点将部分地在跟随的描述中阐述或者可以通过实践来了解。所述优点将通过所附权利要求中特别指出的要素和组合来实现和获得。要理解,前述一般描述和下面的详细描述两者都只是示例性和解释性的,而不是限制性的。
附图说明
6.为了易于标识任何特定元素或动作的讨论,参考数字中的一个或多个最高有效数字是指其中该元素第一次被引入的图号。
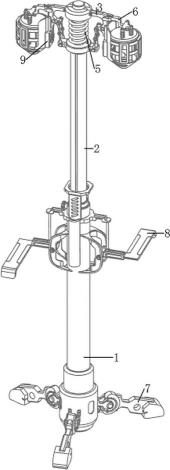
7.图1示出了用于电疗治疗的示例装置。
8.图2示出了示例换能器阵列。
9.图3a和图3b示出了用于电疗治疗的装置的示例应用。
10.图4a示出了放置在患者的头部上的换能器阵列。
11.图4b示出了放置在患者的腹部上的换能器阵列。
12.图5a是放置在患者的躯干上的换能器阵列。
13.图5b示出了放置在患者的骨盆上的换能器阵列。
14.图6是描述电场发生器和患者支持系统的框图。
15.图7a示出了来自有限元方法模拟模型的冠状视图中所示的电场幅度和分布(以v/cm为单位)。
16.图7b-c示出了示例模拟结果。
17.图8a示出了三维阵列布局图800。
18.图8b示出了换能器阵列在患者的头皮上的放置。
19.图9a示出了包含最顶端图像的轴向t1序列切片,包括用于测量头部大小的轨道(orbits)。
20.图9b示出了用于测量头部大小的耳道的水平处的冠状t1序列切片选择图像。
21.图9c示出了增强后t1轴向图像,其示出了用于测量肿瘤位置的最大增强肿瘤直径。
22.图9d示出了增强后t1冠状图像,其示出了用于测量肿瘤位置的最大增强肿瘤直径。
23.图10是使用不同方法的近似电场分布的绝对值;图11示出了示例机器学习系统;图12示出了示例机器学习方法;图13示出了示例决策树。
24.图14a-c示出了示例ttfields估计。
25.图15a-b示出了示例ttfields估计。
26.图16a示出了基于患者的头部中的肿瘤的中心点的示例横向平面图(plan)。
27.图16b示出了基于患者的胸部中的肿瘤的中心点的示例横向平面图。
28.图17是描绘示例操作环境的框图。
29.图18示出了示例方法。
30.图19示出了示例方法。
具体实施方式
31.在公开和描述本方法和系统之前,要理解该方法和系统不限于特定方法、特定组件或特定实现。还要理解,本文中使用的术语仅用于描述特定实施例的目的,并不旨在进行限制。
32.如说明书和所附权利要求书中所使用的,单数形式“一”、“一个”和“该”包括复数个指示物,除非上下文另外明确规定。范围在本文中可以被表示为从“约”一个特定值,和/或到“约”另一个特定值。当表示这样的范围时,另一个实施例包括从一个特定值和/或到另一个特定值。类似地,当通过使用先行词“约”将值表示为近似值时,将理解该特定值形成另一个实施例。将进一步理解,范围中的每个的端点与另一个端点有关和独立于另一个端点两者都是重要的。
[0033]“可选”或“可选地”意指随后描述的事件或情况可能发生或可能不发生,并且该描述包括其中所述事件或情况发生的情况和其中所述事件或情况不发生的情况。
[0034]
贯穿本说明书的描述和权利要求,词语“包括”及词语的变体,诸如“包括了”和“包含”,表示“包括但不限于”,并不旨在排除例如其他组件、整数或步骤。“示例性”意指
“……
的示例”,并不旨在传达优选或理想实施例的指示。“诸如”不是在限制性的意义上使用,而是用于解释的目的。
[0035]
公开了可以用于执行公开的方法和系统的组件。本文中公开了这些和其他组件,并且要理解,当这些组件的组合、子集、相互作用、组等被公开时,虽然可能没有明确公开这些组件的每个不同的单独和集体的组合和排列的具体参考,但是对于所有的方法和系统,每个都在本文中被具体考虑和描述。这适用于本技术的所有方面,包括但不限于所公开方法中的步骤。因此,如果有多种可以执行的附加步骤,要理解,这些附加步骤中的每个都可以用所公开方法的任何特定实施例或实施例的组合来执行。
[0036]
通过参考以下对优选实施例的详细描述及其中包括的示例,以及附图及其先前和之后的描述,可以更容易理解本方法和系统。
[0037]
如本领域技术人员将理解的,方法和系统可以采取完全硬件实施例、完全软件实施例或结合软件和硬件方面的实施例的形式。此外,该方法和系统可以采取计算机可读存储介质上的计算机程序产品的形式,该计算机可读存储介质具有在存储介质中实现的计算机可读程序指令(例如,计算机软件)。更特别地,本方法和系统可以采取web实现的计算机软件的形式。可以利用任何合适的计算机可读存储介质,包括硬盘、cd-rom、光存储设备或磁存储设备。
[0038]
下面参考方法、系统、装置和计算机程序产品的框图和流程图图示来描述方法和系统的实施例。将理解,框图和流程图图示中的每个框,以及框图和流程图图示中的框的组合分别可以通过计算机程序指令来实现。这些计算机程序指令可以被加载到通用计算机、专用计算机或其他可编程数据处理装置上以产生机器,使得在计算机或其他可编程数据处理装置上执行的指令创建用于实现一个或多个流程图框中指定的功能。
[0039]
这些计算机程序指令也可以被存储在计算机可读存储器中,其可以引导计算机或
其他可编程数据处理装置以特定方式运转,使得存储在计算机可读存储器中的指令产生包括用于实现一个或多个流程图框中指定的功能的计算机可读指令的制品(article of manufacture)。计算机程序指令也可以被加载到计算机或其他可编程数据处理装置上,以使一系列操作步骤在计算机或其他可编程装置上执行,以产生计算机实现的过程,使得在计算机或其他可编程装置上执行的指令提供用于实现一个或多个流程图框中指定的功能的步骤。
[0040]
因此,框图和流程图图示的框支持用于执行指定功能的装置的组合、用于执行指定功能的步骤的组合以及用于执行指定功能的程序指令装置。还将理解,框图和流程图图示中的每个框以及框图和流程图图示中的框的组合可以由执行指定功能或步骤的基于专用硬件的计算机系统或者专用硬件和计算机指令的组合来实现。
[0041]
在本文中也称为交变电场的ttfields被确立为抗有丝分裂癌症治疗模式,因为它们在中期期间干扰适当的微管组装,并最终在末期和胞质分裂期间破坏细胞。功效随着场强的增加而增加,并且最佳频率依赖于癌细胞系,其中200 khz是针对其由ttfields引起的对神经胶质瘤细胞生长的抑制是最高的频率。对于癌症治疗,开发了具有电容耦合换能器的非侵入性设备,其直接被放置在靠近肿瘤的皮肤区域处,例如,用于患有多形性胶质母细胞瘤(gbm)的患者,这是人类最常见的原发性恶性脑肿瘤。
[0042]
临床试验已经表明,将ttfields添加到护理的标准显著地延长胶质母细胞瘤患者的总生存期。在恶性胸膜间皮瘤(mpm)患者中观察到类似的改善。临床数据的事后分析表明,向肿瘤传递更高场强与延长的患者生存期相关联。因此,放置换能器阵列使得在癌组织中ttfields强度最大化,具有进一步延长患者的寿命的潜力。
[0043]
因为ttfields的作用是定向的,其中平行于场分裂的细胞比沿其他方向分裂的细胞受影响更大,并且因为细胞沿所有方向分裂,所以ttfields通常通过两对换能器阵列传递,所述换能器阵列在治疗的肿瘤内产生垂直场。更具体地,一对换能器阵列可以位于肿瘤的左侧和右侧(lr),而另一对换能器阵列可以位于肿瘤的前方和后方(ap)。在这两个方向(即,lr和ap)之间循环场确保了以最大范围的细胞取向为目标。除了垂直场之外,还考虑了换能器阵列的其他位置。在实施例中,考虑三个换能器阵列的不对称定位,其中三个换能器阵列中的一对可以传递交变电场,并且然后三个换能器阵列中的另一对可以传递交变电场,并且三个换能器阵列中的剩余一对可以传递交变电场。
[0044]
体内和体外研究表明,ttfields疗法的功效随着电场的强度增加而增加。因此,优化患者的头皮上的阵列放置以增加脑部的患病区域中的强度是optune系统的标准实践。可以通过“经验法则”(例如,将阵列放置在尽可能靠近肿瘤的头皮上)、描述患者的头部的几何形状、肿瘤尺寸和/或肿瘤位置的测量值来执行阵列放置优化。用作输入的测量值可以从成像数据中导出。成像数据旨在包括任何类型的视觉数据,例如单光子发射计算断层摄影(spect)图像数据、x射线计算断层摄影(x射线ct)数据、磁共振成像(mri)数据、正电子发射断层摄影(pet)数据、可以由光学仪器(例如,摄影相机、电荷耦合器件(ccd)相机、红外相机等)捕获的数据、以及诸如此类。在某些实现中,图像数据可以包括从3d扫描仪获得或由3d扫描仪生成的3d数据(例如,点云数据)。优化可以依赖于对电场如何作为阵列的位置的函数在头部内分布的理解,并且在一些方面中,考虑不同患者的头部内电性质分布中的变化。本文中描述了一种结合随机森林回归(和/或其他机器学习)来快速估计ttfields的新颖方
法。如本文中所述,可以标识影响ttfields强度的关键参数,并且描述用于提取这些参数的方法。已经对gbm患者(至少10个患者)验证了使用随机森林回归来快速估计ttfields。
[0045]
图1示出了用于电疗治疗的示例装置100。通常,装置100可以是便携式的、电池或电源操作的设备,其通过非侵入性表面换能器阵列在体内产生交变电场。装置100可以包括电场发生器102和一个或多个换能器阵列104。装置100可以被配置成经由电场发生器102产生肿瘤治疗场(ttfields)(例如,以150 khz),并通过一个或多个换能器阵列104将ttfields传递到身体的区域。电场发生器102可以是电池和/或电源操作的设备。在实施例中,一个或多个换能器阵列104是均匀成形的。在实施例中,一个或多个换能器阵列104不是均匀成形的。
[0046]
电场发生器102可以包括与信号发生器108通信的处理器106。电场发生器102可以包括被配置用于控制处理器106和信号发生器108的性能的控制软件110。
[0047]
信号发生器108可以生成以波形或脉冲序列的形式的一个或多个电信号。信号发生器108可以被配置成生成在从约50 khz到约500 khz(优选地从约100 khz到约300 khz)的范围内的频率下的交流电压波形(例如,ttfields)。电压使得待治疗组织中的电场强度在约0.1 v/cm至约10 v/cm的范围内。
[0048]
电场发生器102的一个或多个输出114可以被耦合到一个或多个导电引线112,导电引线112在其一端处被附接到信号发生器108。导电引线112的相对端被连接到由电信号(例如,波形)激活的一个或多个换能器阵列104。导电引线112可以包括具有柔性金属屏蔽的标准隔离导体,并且可以接地以防止由导电引线112产生的电场的扩散。一个或多个输出114可以顺序地操作。信号发生器108的输出参数可以包括例如场的强度、波的频率(例如,治疗频率)以及一个或多个换能器阵列104的最大可允许温度。输出参数可以由控制软件110结合处理器106来设置和/或确定。在确定期望的(例如,最佳的)治疗频率之后,控制软件110可以使处理器106向信号发生器108发送控制信号,该控制信号使信号发生器108向一个或多个换能器阵列104输出期望的治疗频率。
[0049]
一个或多个换能器阵列104可以以多种形状和位置来配置,以在目标体积处产生期望的配置、方向和强度的电场,以进行聚焦治疗。一个或多个换能器阵列104可以被配置成通过感兴趣的体积传递两个垂直的场方向。
[0050]
一个或多个换能器阵列104阵列可以包括一个或多个电极116。一个或多个电极116可以由具有高介电常数的任何材料制成。一个或多个电极116可以包括例如一个或多个绝缘陶瓷盘。电极116可以是生物相容的,并且耦合到柔性电路板118。电极116可以被配置成不与皮肤直接接触,因为电极116通过一层导电水凝胶(未示出)与皮肤分离(类似于心电图垫上发现的)。
[0051]
电极116、水凝胶和柔性电路板118可以被附着到低过敏性医用粘性绷带120,以在身体上将一个或多个换能器阵列104保持就位,并与皮肤持续直接接触。每个换能器阵列104可以包括一个或多个热敏电阻器(未示出),例如8个热敏电阻器(准确度
±
1℃),以测量换能器阵列104下方的皮肤温度。热敏电阻器可以被配置成周期性地(例如每秒钟一次)测量皮肤温度。热敏电阻器可以在ttfields未必传递时由控制软件110读取,以避免对温度测量的任何干扰。
[0052]
如果在两次后续测量之间,测量的温度低于预设最高温度(tmax),例如38.5-40.0
℃
±
0.3℃,则控制软件110可以增加电流,直到电流达到最大治疗电流(例如,4安培峰峰值)。如果温度达到tmax 0.3℃并继续上升,则控制软件110可以降低电流。如果温度上升到41℃,则控制软件110可以关闭ttfields治疗,并且可以触发过热警报。
[0053]
一个或多个换能器阵列104可以基于患者身体大小和/或不同的疗法治疗,在大小方面进行改变,并可以包括不同数量的电极116。例如,在患者的胸部的情况下,每个小换能器阵列可以包括13个电极,而每个大换能器阵列可以包括20个电极,其中每个阵列中的电极串联互连。例如,如图2这所示,在患者的头部的情况下,每个换能器阵列可以各自包括9个电极,其中每个阵列中的电极串联互连。
[0054]
考虑并且也可以使用针对一个或多个换能器阵列104的替代结构,包括例如使用非盘形的陶瓷元件的换能器阵列,以及使用位于多个扁平导体上的非陶瓷介电材料的换能器阵列。后者的示例包括布置在印刷电路板上的焊盘上或扁平的金属片上的聚合物膜。也可以使用用非电容耦合的电极元件的换能器阵列。在这种情况下,换能器阵列的每个元件将使用导电材料的区域来实现,该导电材料的区域被配置成靠着受试者/患者的身体放置,其中在导电元件和身体之间没有布置绝缘介电层。也可以使用用于实现换能器阵列的其他替代结构。任何换能器阵列(或类似的设备/部件)配置、布置、类型和/或诸如此类都可以用于本文中所述的方法和系统,只要换能器阵列(或类似的设备/部件)配置、布置、类型和/或诸如此类(a)能够将ttfields传递到受试者/患者的身体,以及(b)并且可以如本文中所述定位布置和/或放置在患者/受试者的身体的一部分上。
[0055]
装置100的状态和监视参数可以被存储在存储器(未示出)中/由存储器存储,并可以通过有线或无线连接被传递至计算设备。装置100可以包括显示器(未示出),用于显示视觉指示器,诸如通电、治疗开启、警报和低电量。
[0056]
图3a和图3b图示了装置100的示例应用。示出了换能器阵列104a和换能器阵列104b,每个换能器阵列分别结合到低过敏性医用粘性绷带120a和120b中。将低过敏性医用粘性绷带120a和120b施加到皮肤表面302。肿瘤304位于皮肤表面302和骨组织306下方,并且位于脑组织308内。电场发生器102使换能器阵列104a和换能器阵列104b在脑组织308内产生交变电场310,该交变电场310扰乱由肿瘤304的癌细胞表现出的快速细胞分裂。交变电场310已经在非临床实验中显示出阻止(arrest)肿瘤细胞的增殖和/或破坏它们。交变电场310的使用利用了癌细胞的特殊特性、几何形状和分裂速率,这使得它们易受交变电场310的影响。交变电场310在中频(大约100-300 khz)处变更它们的极性。用于特定治疗的频率可以特定于被治疗的细胞类型(例如,对于mpm为150 khz)。交变电场310已经显示了扰乱有丝分裂纺锤体微管组装,并导致胞质分裂期间细胞内大分子和细胞器的介电泳错位。这些过程导致细胞膜的物理扰乱和程序性细胞死亡(凋亡)。
[0057]
因为交变电场310的作用是定向的,其中平行于电场分裂的细胞比沿其他方向分裂的细胞受影响更大,并且因为细胞沿所有方向分裂,所以交变电场310可以通过两对换能器阵列104传递,所述换能器阵列104在治疗的肿瘤内产生垂直场。更具体地,一对换能器阵列104可以位于肿瘤的左侧和右侧(lr),而另一对换能器阵列104可以位于肿瘤的前方和后方(ap)。在这两个方向(例如,lr和ap)之间循环交变电场310确保了靶向最大范围的细胞取向。在实施例中,交变电场310可以根据换能器阵列104的对称设置(例如,总共四个换能器阵列104,两个匹配对)来传递。在另一个实施例中,交变电场310可以根据换能器阵列104的
不对称设置(例如,总共三个换能器阵列104)来传递。换能器阵列104的不对称设置可以接合(engage)三个换能器阵列104中的两个来传递交变电场310,并且然后切换到三个换能器阵列104中的另外两个来传递交变电场310,以及诸如此类。
[0058]
体内和体外研究表明,ttfields疗法的功效随着电场的强度增加而增加。所描述的方法、系统和装置被配置用于优化患者的头皮上的阵列放置,以增加脑部的患病区域中的强度。
[0059]
如图4a中所示,换能器阵列104可以被放置在患者的头部上。如图4b中所示,换能器阵列104可以被放置在患者的腹部上。如图5a中所示,换能器阵列104可以被放置在患者的躯干上。如图5b中所示,换能器阵列104可以被放置在患者的骨盆上。特别考虑将换能器阵列104放置在患者的身体的其他部分(例如,手臂、腿等)上。
[0060]
图6是描绘包括患者支持系统602的系统600的非限制性示例的框图。患者支持系统602可以包括一个或多个计算机,其被配置为操作和/或存储电场发生器(efg)配置应用606、患者建模应用608和/或成像数据610。患者支持系统602可以包括例如计算设备。患者支持系统602可以包括例如膝上型计算机、台式计算机、移动电话(例如,智能电话)、平板计算机以及诸如此类。
[0061]
患者建模应用608可以被配置成根据成像数据610生成患者的身体的一部分的三维模型(例如,患者模型)。成像数据610可以包括任何类型的视觉数据,例如,单光子发射计算断层摄影(spect)图像数据、x射线计算断层摄影(x射线ct)数据、磁共振成像(mri)数据、正电子发射断层摄影(pet)数据、可以由光学仪器(例如,摄影相机、电荷耦合器件(ccd)相机、红外相机等)捕获的数据、以及诸如此类。在某些实现中,图像数据可以包括从3d扫描仪获得或由3d扫描仪生成的3d数据(例如,点云数据)。患者建模应用608还可以被配置成基于患者模型和一个或多个电场模拟来生成三维阵列布局图。
[0062]
为了适当地优化患者的身体的一部分上的阵列放置,可以通过患者建模应用608分析成像数据610,诸如mri成像数据,以标识包括肿瘤的感兴趣的区域。在患者的头部的情况下,为了表征电场在人头部内如何表现和分布,可以使用基于使用有限元方法(fem)模拟的解剖头部模型的建模框架。这些模拟产生基于磁共振成像(mri)测量的真实头部模型,并划分头部内的组织类型,诸如头骨、白质、灰质和脑脊液(csf)。可以为每种组织类型分配相对电导率和介电常数的介电性质,并且可以运行模拟,由此将不同的换能器阵列配置施加到模型的表面,以理解预设频率的外部施加的电场将如何贯穿患者的身体的任何部分(例如脑部)分布。采用成对阵列配置、恒定电流和200 khz的预设频率的这些模拟的结果已经证明,电场分布贯穿脑部是相对不均匀的,并且在除csf之外的大多数组织隔室中产生超过1 v/cm的电场强度。这些结果是假设在换能器阵列-头皮界面处具有1800毫安(ma)的峰峰值的总电流而获得的。电场强度的该阈值足以阻止胶质母细胞瘤细胞系中的细胞增殖。
[0063]
此外,通过操纵成对换能器阵列的配置,实现使脑部的特定区域的电场强度增至几乎三倍,这是可能的,如图7a中所示。图7a图示了来自有限元方法模拟模型的冠状视图中示出的电场幅度和分布(以v/cm为单位)。该模拟采用左右成对的换能器阵列配置。
[0064]
基于欧姆定律、物质中的麦克斯韦方程和库仑定律,对于ttfields,电场分别与电导率(σ)、介电常数(ε)和与电源的距离(de)成反比。如图7b-d中所示,对模拟结果的仔细检查表明,当组织在脑脊液(csf)附近时,ttfields更大。
[0065]
图7b示出了接受ttfield治疗的gbm患者的示例头部mri t1与钆。图7c示出了将患者的mri分割成具有不同电性质的组织的示例。图7d示出了用有限元方法计算的ttfields空间分布,如本文中所述。注意,在脑脊液(箭头)附近,ttfields增加。此外,在更靠近ta对的中心之间的虚线的组织中,ttfields更大。
[0066]
对该观察结果的可能解释是,由于csf的高电导率,电子在csf的边界上累积,因此增加了这些区域中的电势。体素与csf的体素的最短距离被表示为dc。另一个观察结果是,在更靠近ta对的中心之间的假想线的组织中,ttfields更大(图7b)。这个观察结果与库仑定律推广到均匀物质中的有限平行板是一致的。体素和沿着ta中心的线之间的距离被表示为dl。电导率和介电常数预期与电场具有线性关系,并且距离是电场的多项式。
[0067]
给定患者的头部mri,提取上述关键参数如下。首先,我们已经将头部分割成八个组织(图7c):1)皮肤和肌肉(作为一个组织);2)头骨;3)csf;4)白质;5)灰质;6)肿瘤-增强;7)肿瘤-坏死,以及;8)肿瘤切除空腔。使用区域生长和活动轮廓方法半自动地执行肿瘤的分割。头部组织(1-5)的分割是用基于定制图谱的方法自动执行的。确定不同组织的电导率和介电常数。有效地计算每个体素与电源、csf和沿ta中心的线的距离。
[0068]
在一个方面中,患者建模应用608可以被配置成基于肿瘤的位置和范围确定患者的期望(例如,最佳)换能器阵列布局。例如,可以使用轴向和冠状视图,从脑部mri的t1序列中确定初始形态测定头部大小测量值。可以选择增强后的轴向和冠状mri切片来显示增强病变的最大直径。采用头部大小和从预定基准标记到肿瘤边缘的距离的测量,可以评估成对阵列布局的变化排列和组合,以产生向肿瘤部位传递最大电场强度的配置。如图8a中所示,输出可以是三维阵列布局图800。如图8b中所示,在ttfields疗法的正常过程期间,可以由患者和/或护理人员在头皮上布置阵列时使用三维阵列布局图800。
[0069]
在一个方面中,患者建模应用608可以被配置成确定患者的三维阵列布局图。可以确定要接收换能器阵列的患者的部分的mri测量值。举例来说,mri测量值可以经由标准的医学数字成像和通信(dicom)查看器接收。mri测量确定可以自动执行(例如通过人工智能技术),或者可以手动执行(例如通过医生)。
[0070]
手动mri测量确定可以包括经由dicom查看器接收和/或提供mri数据。mri数据可以包括对包含肿瘤的患者的部分的扫描。举例来说,在患者的头部的情况下,mri数据可以包括头部的扫描,其包括右额颞部肿瘤、右顶颞部肿瘤、左额颞部肿瘤、左顶枕部肿瘤和/或多病灶中线肿瘤中的一个或多个。图9a、图9b、图9c和图9d示出了显示患者的头部的扫描的示例mri数据。图9a示出了包含最顶端图像的轴向t1序列切片,包括用于测量头部大小的轨道。图9b示出了用于测量头部大小的耳道的水平处的冠状t1序列切片选择图像。图9c示出了增强后t1轴向图像,其示出了用于测量肿瘤位置的最大增强肿瘤直径。图9d示出了增强后t1冠状图像,其示出了用于测量肿瘤位置的最大增强肿瘤直径。mri测量可以从头皮的外缘处的基准标记开始,并从右、前、上原点切向延伸。可以从选择仍包括轨道的最顶端图像(或轨道的上缘正上方的图像)的轴向t1 mri序列估计形态测量头部大小。
[0071]
在一个方面中,mri测量可以包括例如一个或多个头部大小测量和/或肿瘤测量。在一个方面中,一个或多个mri测量值可以被舍入到最接近的毫米,并且可以被提供给换能器阵列放置模块(例如,软件)用于分析。然后,mri测量可以用于生成三维阵列布局图(例如,三维阵列布局图800)。
[0072]
mri测量可以包括一个或多个头部大小测量,诸如:从头皮的外缘开始测量的最大前后(a-p)头部大小;垂直于a-p测量的头部的最大宽度:右到左的横向距离;和/或从头皮的最右侧边缘到解剖中线的距离。
[0073]
mri测量可以包括一个或多个头部大小测量,诸如冠状视图头部大小测量。冠状视图头部大小测量可以在选择耳道的水平处的图像(图9b)的t1 mri序列上获得。冠状视图头部大小测量可以包括以下各项中的一项或多项:从头皮的顶点到描绘颞叶的下缘的正交线的垂直测量;最大的右到左的横向头部宽度;和/或从头皮的最右侧边缘到解剖中线的距离。
[0074]
mri测量可以包括一种或多种肿瘤测量,诸如肿瘤位置测量。可以使用t1增强后mri序列进行肿瘤位置测量,首先在展示最大增强肿瘤直径的轴向图像上进行(图9c)。肿瘤位置测量可以包括以下各项中的一个或多个:最大a-p头部大小,不包括鼻子;垂直于a-p距离测量的最大右到左横向直径;从头皮的右边缘到解剖中线的距离;平行于右-左横向距离和垂直于a-p测量值测量的从头皮的右边缘到最近肿瘤边缘的距离;平行于右-左横向距离、垂直于a-p测量值测量的从头皮的右边缘到最远肿瘤边缘的距离;平行于a-p测量值测量的从头部的前方到最近肿瘤边缘的距离;和/或平行于a-p测量值测量的从头部的前方到最远肿瘤边缘的距离。
[0075]
一个或多个肿瘤测量可以包括冠状视图肿瘤测量。冠状视图肿瘤测量可以包括标识以肿瘤增强的最大直径为特征的增强后t1 mri切片(图9d)。冠状视图肿瘤测量可以包括以下各项中的一个或多个:从头皮的顶点到大脑的下缘的最大距离。在前部切片中,这将通过在额叶或颞叶的下缘处绘制的水平线来划界(demarcate),并且在后面,它将延伸到可见天幕的最低水平;最大右到左横向头部宽度;从头皮的右边缘到解剖中线的距离;平行于右-左横向距离测量的从头皮的右边缘到最近肿瘤边缘的距离;平行于右-左横向距离测量的从头皮的右边缘到最远肿瘤边缘的距离;平行于上顶点到下大脑线测量的从头部的顶部到最近的肿瘤边缘的距离;和/或平行于上顶点到下大脑线测量的从头部的顶部到最远肿瘤边缘的距离。
[0076]
可以使用其他mri测量,特别是当肿瘤存在于患者的身体的另一部分中时。
[0077]
可以由患者建模应用608使用mri测量值来生成患者模型。患者模型然后可以用于确定三维阵列布局图(例如,三维阵列布局图800)。继续患者的头部内的肿瘤的示例,可以生成健康的头部模型,该头部模型用作可变形模板,从该模板可以创建患者模型。当创建患者模型时,可以从患者的mri数据(例如,一个或多个mri测量)中分割肿瘤。分割mri数据标识每个体素中的组织类型,并且可以基于经验数据将电性质分配给每个组织类型。表1示出了可以用于模拟中的组织的标准电性质。可以掩蔽患者mri数据中的肿瘤的区域,并且可以使用非刚性配准算法将患者头部的剩余区域配准到表示健康头部模型的可变形模板的3d离散图像上。该过程产生将患者的头部的健康部分映射到模板空间中的非刚性变换,以及将模板映射到患者空间中的逆变换。将逆变换应用于3d可变形模板,以在没有肿瘤的情况下产生患者头部的近似。最后,将肿瘤(称为感兴趣的区域(roi))植入回到变形模板中,以产生完整的患者模型。患者模型可以是患者的身体的部分(包括内部结构,诸如组织、器官、肿瘤等)的三维空间中的数字表示。
[0078]
。
[0079]
在一些情况下,患者建模应用608可以使用人工智能和/或机器学习来确定患者的三维换能器阵列布局图。例如,可以从患者mri中提取与电场分布相关的特征。通过提供从mri特征到电场值的预计算映射,可以将提取的特征结合到紧凑模型中,以快速估计、预测和/或确定换能器阵列的电场和/或电场分布。建模可以基于线性方程,或者可以涉及复杂的机器学习模型。例如,可以基于从患者确定的数据集来测试模型,所述患者接受了用于管理多形性胶质母细胞瘤(gbm)的ttfields疗法。数据集可以基于来自患者的头部(或患者的身体的任何其他区域)的三维(3d)mri图像的数据,其中体素被标记以指示肿瘤和不同组织类型的分割,诸如:组合的皮肤和肌肉组织、头骨/骨、脑脊液、灰质和白质。3d图像的未标记体素可以被认为是空气。鉴于电场强度与电导率、介电常数、与电源的距离以及与导电材料的距离成反比,可以使用下面的建模方程:方程1:,其中c表示电导率,p表示介电常数,d
ta
表示到最近的换能器阵列的距离,并且d
conductor
表示到最近的导体的距离。系数ai表示模型并且计算一次。方程1表示可以例如使用微分方程求解器、使用线性近似和/或诸如此类快速求解的简单模型。微分方程求解器可
以用于求解方程1。例如,使用微分方程求解器,计算的近似时间是三(3)小时。可以对由微分方程求解器确定的所得电场应用阈值,以创建表示换能器阵列的位置的二进制图像。应当注意,在一些情况下,用于模型的数据集可以包括来自每个换能器阵列的数据。为了使用方程1来近似电场,3d mri图像中的每个体素可以根据与该体素相关联的组织类型与电导率和介电常数值相关联。可以在每个体素处计算最近的换能器和最近的脑脊液之间的距离。可以计算方程1的系数ai以最小化最小平方误差。方程1的计算可以应用于3d mri图像的每个体素,以创建近似电场的体积。图10图示了计算的电场绝对值。1010图示了用微分方程求解器计算的电场绝对值,其中计算的近似时间为三(3)小时。1020图示了使用快速线性近似计算的电场绝对值,其中计算的近似时间为四(4)分钟。将使用建模快速近似的电场的结果与完全计算的电场进行比较,揭示了估计的和完全计算的电场之间的平均差为0.56 v/cm2 (sd = 2.01 v/cm2),其中估计和完全计算之间的pearson相关系数为0.74(p 《 0.05),这表明可以用快速计算来近似该电场。机器学习可以用于确定更复杂的模型,其用更少的时间产生改进的估计。
[0080]
可以根据从来自各种各样的患者的3d mri图像中提取的特征创建的多个数据集(或大型数据集)来训练机器学习模型,所述患者诸如接受了用于管理多形性胶质母细胞瘤(gbm)的ttfields疗法的患者。从每个图像中提取的特征可以包括患者的头部,其中体素被标记以指示肿瘤和不同组织类型的分割,诸如:组合的皮肤和肌肉组织、头骨/骨、脑脊液、灰质和白质。3d图像的未标记体素可以被认为是空气。应当注意,数据集(或大数据集)可以被改变、修改和/或诸如此类,以包括与计算换能器阵列布局的电场相关的任何数据。
[0081]
如图11中所示,系统1100可以使用机器学习技术,以基于训练模块1120对一个或多个训练数据集1110a-110n的分析,训练至少一个基于机器学习的分类器1130,所述分类器1130被配置以对从包括多个体素的3d mri图像提取的特征进行分类。基于机器学习的分类器1130可以对从3d mri图像中提取的特征进行分类,以使能实现基于预测模型的电场分布的快速近似。
[0082]
一个或多个训练数据集1110a-1110n可以包括来自大量患者3d mri图像的标记的基线组织类型、电场分布、感应治疗性肿瘤治疗场的换能器阵列位置和/或诸如此类。标记的基线数据可以与针对胶质母细胞瘤(gbm)或任何其他癌症进行治疗的患者相关联。在一些情况下,标记的数据集可以包括从患者的解剖结构的其他部分的3d mri图像、从不同的肿瘤组织、从配置有各种材料的换能器阵列和/或诸如此类提取的特征。在一些情况下,标记的基线数据可以包括在施用ttfields治疗之前、期间和之后来自患者的标记的基线数据。标记的基线数据可以包括任何数量的特征集(标识提取特征的标记数据)。特征集可以基于肿瘤的分割、不同的组织类型(例如,组合的皮肤和肌肉组织、头骨/骨、脑脊液、灰质和白质等),或者与(例如,可能影响等)换能器阵列的电场和/或电场分布相关的任何其他特征。例如,3d mri图像的每个体素可以用组织类型来标记,并且用电场强度分布值(v cm-1)来标记,该电场强度分布值是从一对换能器阵列向患者的一部分模拟施加交变电场而导出的。
[0083]
标记的基线数据可以存储在一个或多个数据库中。可以将每个患者的数据随机分配给训练数据集或测试数据集。在一些实现中,将数据分配给训练数据集或测试数据集可能不是完全随机的。在这种情况下,在分配期间可以使用一个或多个标准,诸如确保具有不
同程度的癌症(例如,良性、恶性等)的相似数量的患者,不同的换能器阵列布局、不同的换能器配置材料和/或诸如此类可以用于训练和测试数据集中的每个。通常,可以使用任何合适的方法将数据分配给训练或测试数据集。
[0084]
训练模块1120可以通过根据一种或多种特征选择技术从标记的基线数据中提取特征集来训练基于机器学习的分类器1130。在一些情况下,训练模块1120可以进一步通过将一种或多种特征选择技术应用于一个或多个训练数据集1110a-1110n中的标记的基线数据来定义从标记的基线数据获得的特征集。训练模块1120可以以多种方式从训练数据集1110a-1110n中提取特征集。训练模块1120可以多次执行特征提取,每次使用不同的特征提取技术。在一些情况下,使用不同技术生成的特征集可以各自用于生成不同的基于机器学习的分类模型1140。在实施例中,可以选择具有最高质量度量的特征集以在训练时使用。训练模块1120可以使用(一个或多个)特征集来构建一个或多个基于机器学习的分类模型1140a-1140n,其被配置用于电场分布的快速近似。
[0085]
在一些情况下,可以对训练数据集110a-110n和/或标记的基线数据进行分析,以确定训练数据集1110a-1110n和/或标记的基线数据中换能器阵列位置、组织类型和电场分布之间的任何依赖性、关联性和/或相关性。如本文中使用的术语“特征”可以指数据项的任何特性,其可以用于确定数据项是否落入一个或多个特定类别中。举例来说,本文中描述的特征可以包括换能器阵列特性(例如,材料特性、定位规则和特性、组织类型以及相关的电/介电特性(例如,电导率、介电常数等)、电场分布和/或诸如此类。
[0086]
在一些情况下,特征选择技术可以包括一个或多个特征选择规则。一个或多个特征选择规则可以包括电场分布规则。电场分布规则可以包括确定标记的基线数据中的哪些特征在标记的基线数据中出现超过阈值次数,并且将满足阈值的那些特征标识为候选特征。例如,在标记的基线数据中出现大于或等于2次的任何特征可以被认为是候选特征。出现少于2次的任何特征可以从考虑作为特征中排除。在一些情况下,可以应用单个特征选择规则来选择特征,或者可以应用多个特征选择规则来选择特征。在一些情况下,特征选择规则可以以级联方式应用,其中特征选择规则以特定顺序应用并应用于前一规则的结果。例如,电场分布规则可以应用于标记的基线数据,以基于换能器阵列位置生成电场分布。候选基因的最终列表可以根据附加特征来分析。
[0087]
在一些情况下,电场分布的快速近似可以基于包装器(wrapper)方法。包装器方法可以被配置成使用特征的子集,并使用该特征的子集来训练机器学习模型。基于从先前模型得出的推论,可以从子集添加和/或删除特征。包装器方法包括例如前向特征选择、后向特征消除、递归特征消除、其组合以及诸如此类。在一些情况下,前向特征选择可以用于标识一个或多个候选电场分布。前向特征选择是迭代方法,其从机器学习模型中没有特征开始。在每次迭代中,添加最能改进模型的特征,直到新变量的添加不能改进机器学习模型的性能。在实施例中,反向消除可以用于标识一个或多个候选电场分布。反向消除是迭代方法,其从机器学习模型中的所有特征开始。在每次迭代中,移除最不重要的特征,直到在特征的移除上没有观察到改进。在实施例中,递归特征消除可以用于标识一个或多个候选电场分布。递归特征消除是贪婪优化算法,其旨在找到表现最佳的特征子集。递归特征消除重复地创建模型,并在每次迭代时保留表现最好或最差的特征。递归特征消除用剩余的特征构造下一个模型,直到所有特征都用尽。然后,递归特征消除基于特征消除的顺序对特征进
行排序。
[0088]
在一些情况下,可以根据嵌入式方法选择一个或多个候选电场分布(近似值)。嵌入式方法结合了过滤器和包装器方法的优点。嵌入式方法包括例如最小绝对收缩和选择算子(lasso)和岭回归(ridge regression),其实现惩罚函数以减少过度拟合。例如,lasso回归执行l1正则化,它增加了相当于系数的大小的绝对值的惩罚,而岭回归执行l2正则化,它增加了相当于系数的大小的平方的惩罚。
[0089]
在训练模块1120已经生成(一个或多个)特征集后,该训练模块1120可以基于(一个或多个)特征集生成基于机器学习的预测模型1140。基于机器学习的预测模型可以指使用机器学习技术生成的用于数据分类的复杂数学模型。在一个示例中,该基于机器学习的分类器可以包括表示边界特征的支持向量图。举例来说,边界特征可以选自和/或表示特征集中排序最高的特征。
[0090]
在实施例中,训练模块1120可以使用从训练数据集1110a-1110n和/或标记的基线数据中提取的特征集,以构建基于机器学习的分类模型1140a-1140n,以近似多种换能器阵列布局的电场分布。在一些示例中,基于机器学习的分类模型1140a-1140n可以被组合成单个基于机器学习的分类模型1140。类似地,基于机器学习的分类器1130可以表示包含单个或多个基于机器学习的分类模型1140的单个分类器和/或包含单个或多个基于机器学习的分类模型1140的多个分类器。此外,在一些实施例中,基于机器学习的分类器130可以包括训练数据集1110a-1110n中的每个和/或从训练数据集1110a-810n提取的和/或从标记的基线数据提取的每个特征集。
[0091]
可以在使用机器学习方法训练的分类模型中组合来自3d mri图像的提取的特征,所述机器学习方法诸如判别分析;决策树;最近邻(nn)算法(例如,k-nn模型、复制器nn模型等);统计算法(例如,贝叶斯网络等);聚类算法(例如,k均值、均值漂移等);神经网络(例如,储层网络(reservoir networks)、人工神经网络等);支持向量机(svm);逻辑回归算法;线性回归算法;马尔可夫模型或链;主成分分析(pca)(例如,用于线性模型);多层感知器(mlp)ann(例如,用于非线性模型);复制储层网络(例如,用于非线性模型,通常用于时间系列);随机森林分类;其组合和/或诸如此类。所得的基于机器学习的分类器1130可以包括使用候选电场分布的换能器阵列布局的决策规则或映射。
[0092]
换能器阵列布局和基于机器学习的分类器1130可以用于近似测试数据集中的测试样本的相关电场分布。在一个示例中,每个测试样本的结果包括置信水平,该置信水平对应于相应测试样本属于近似电场分布的可能性或概率。置信水平可以是零和一之间的值,其表示近似电场与计算值一致的可能性。可以为每个测试样本和每个候选(近似)电场分布提供多个置信水平。通过将针对每个测试样本获得的结果与针对每个测试样本的计算的电场分布进行比较,可以确定表现最好的候选电场分布。通常,表现最好的候选电场分布将具有与计算的电场分布最紧密匹配的结果。表现最好的候选电场分布可以用于电场分布的快速近似。
[0093]
图12是图示用于使用训练模块1120快速近似电场分布的示例训练方法1200的流程图。训练模块1120可以实现监督、无监督和/或半监督的(例如,基于强化的)基于机器学习的分类模型1140。图12中所图示的方法1200是监督学习方法的示例;下面讨论训练方法的该示例的变体,然而,可以类似地实现其他训练方法来训练无监督和/或半监督机器学习
(预测)模型。
[0094]
在1210处,训练方法1200可以确定(例如,访问、接收、检索等)一个或多个患者的群体的3d mri数据。电场分布数据可以包含一个或多个数据集,每个数据集与肿瘤的分割、不同的组织类型(例如,组合的皮肤和肌肉组织、头骨/骨、脑脊液、灰质和白质等)或者与(例如,其可能影响等)换能器阵列的电场和/或电场分布相关的任何其他特征相关联。每个数据集可以包括标记的基线数据。每个数据集可以进一步包括标记的肿瘤、组织类型(例如,组合的皮肤和肌肉组织、头骨/骨、脑脊液、灰质和白质等)或者与(例如,其可能影响等)换能器阵列的电场和/或电场分布相关的任何其他数据。
[0095]
在920处,训练方法1200可以产生训练数据集和测试数据集。训练数据集和测试数据集可以通过核算和/或计算在患者的不同区域上的不同位置处的换能器阵列的电场分布来生成。在一些情况下,可以通过将电场分布数据随机分配给训练数据集或测试数据集来生成训练数据集和测试数据集。在一些情况下,电场分布数据作为训练或测试样本的分配可能不是完全随机的。在一些情况下,只有从3d mri提取的特定特征的标记的基线数据可以用于生成训练数据集和测试数据集。在一些情况下,从3d mri提取的大多数标记的基线数据可以用于生成训练数据集。例如,从3d mri提取的标记的基线数据的75%可以用于生成训练数据集,而25%可以用于生成测试数据集。可以使用任何方法或技术来创建训练和测试数据集。
[0096]
在1230处,训练方法1200可以确定(例如,提取、选择等)一个或多个特征,所述特征可以被例如从多种3d mri图像中提取的分类器标记特征使用。一个或多个特征可以包括肿瘤标识符/数据(例如,细胞类型、细胞取向等)、组织类型(例如,组合的皮肤和肌肉组织、头骨/骨、脑脊液、灰质和白质等)或者与(例如,其可能影响等)换能器阵列的电场和/或电场分布相关的任何其他数据。在一些情况下,训练方法1200可以从训练数据集确定一组训练基线特征。在一些情况下,训练方法1200可以从训练数据集确定一组训练治疗中换能器阵列布局和相关联的的电场分布。3d mri图像的特征可以通过任何方法来确定。
[0097]
在1240处,训练方法1200可以使用一个或多个特征训练一个或多个机器学习模型。在一些情况下,可以使用监督学习来训练机器学习模型。在另一个实施例中,可以采用其他机器学习技术,包括无监督学习和半监督学习。在1240处训练的机器学习模型可以基于不同的标准(例如,换能器阵列材料、施加的信号强度和频率等)和/或训练数据集中可用的数据来选择。例如,机器学习分类器可能遭受不同程度的偏差。因此,可以在1240处训练多于一个机器学习模型,在1250处对其进行优化、改进和交叉验证。
[0098]
在1260处,训练方法1200可以选择一个或多个机器学习模型来构建预测模型(例如,机器学习分类器、预测模型等)。可以使用测试数据集来评估预测引擎。在1270处,预测引擎可以分析测试数据集并生成分类值和/或预测值。可以在1280处评估分类和/或预测值,以确定这样的值是否已经达到期望的准确度水平。可以基于由预测引擎指示的多个数据点的多个真阳性、假阳性、真阴性和/或假阴性分类,以多种方式评估预测引擎的性能。例如,预测引擎的假阳性可以指预测引擎错误地近似电场分布的次数。相反,预测引擎的假阴性可以指机器学习模型错误地近似特定换能器阵列布局的电场分布的次数,而事实上,近似的电场分布与计算的电场分布相匹配。真阴性和真阳性可以指预测引擎正确地近似电场分布的次数。与这些测量相关的是召回率和精度的概念。通常,召回指真阳性与真阳性和假
阴性之和的比率,其量化了预测引擎的灵敏度。类似地,精度指真阳性与真阳性和假阳性之和的比率。
[0099]
当达到这样的期望的准确度水平时,训练阶段结束,并且可以在1290处输出预测引擎;然而,当没有达到期望的准确度水平时,则可以在1210处开始执行训练方法1200的后续迭代,其具有变化,诸如例如考虑从大量的3d mri图像确定的与电场分布数据相关的更大的收集换能器阵列布局。
[0100]
训练的预测模型(例如,系统1100等)可以使用随机森林回归来估计ttfields。ttfields的估计可以用于确定换能器阵列的最佳位置。随机森林是决策树预测器的集合,使得每棵树都受到随机向量的限制,该向量控制树对输入特征的敏感度。已经证明回归树有助于机械力场的基于fem的非线性映射的有效建模。此外,它们表明,由于随机森林将数据集划分为具有相似特征的组,并有助于局部组拟合,因此当数据是异构的、不规则的且具有有限大小时,也可以生成良好的模型。
[0101]
本文中描述的用于电场分布的快速近似的方法、系统和装置可以使用随机森林回归器。例如,30棵树的设置、分割测量的均方误差质量、使用自举(bootstrap)和袋外样本可用于估计关于未知样本的回归质量。可以通过试错过程(trial-and-error process)来选择树的数量,以平衡准确度和预测时间的权衡。回归树的每个体素的输入可以如下。1)电导率(σ);2)介电常数(ε);3)与最近电源的距离(de);4)与最近csf的距离(dc),以及;5)与ta中线的距离(dl)。
[0102]
测试示出了特征(例如,电导率(σ)、介电常数(ε)、与最近电源的距离(de)、与最近csf的距离(dc)、与ta中线的距离(dl)等)的相关性可以用于在实验设置(如之后在本文中所述)中使用杂质平均减少法进行预测,该方法导致特征的重要性分数在0到1的范围内。最近的电源的距离是最重要的特征(0.65)。与换能器阵列(ta)中线和csf的距离是次要的(分别为0.15和0.1)。电导率和介电常数重要性分数两者均为0.05。图13示出了随机森林中的决策树的示例。注意,对于较远离ta的位置,均方误差(mse)减小。本示例中的特定树以与ta 16.6mm的距离分割数据。事实上,对于在这个范围内的15%的数据,观察到较大的误差。
[0103]
此外,测试用于将随机森林与多线性回归进行比较。具体地,结合线性公式(方程2)来估计ttfields。
[0104]
方程2:计算系数ai以使有限元方法输出与线性回归模型最佳拟合。
[0105]
实验设置使用接受ttfields疗法的10个患者的数据集,使用测试来验证本文中所述的方法。首先,对患者的mri进行分割,并使用移动立方体算法(marching cubes algorithm)提取头部的外表面。然后,两个换能器阵列(ta)对被虚拟地放置在头部的表面上。第一对被放置成使得一个ta在前额上,并且另一个ta在后脑勺上。在这种情况下,ttfield方向大致平行于前后(ap)轴。第二对被放置成使得ta位于头部的相对侧边上。在这种情况下,ttfield方向大致平行于头部的左右(lr)轴。对于20对中的每一对,用有限元方法确定绝对电场强度空间分布。图14示出了示例结果。如图14a-c中所示,确定了患者的mri中每个体素的电场的关联性。该数据集被标记为金标准,因为它在模型中得到验证,并与患者的存活率相关联。图14a示出了通过金标准有限元方法计算的ttfields估计的结果。图14b示出了通过随
机森林回归计算的ttfields估计的结果。图14c示出了通过线性回归计算的ttfields估计的结果。
[0106]
使用留一法(leave-one-out approach)进行训练。一次排除一个测试患者,而其余九个患者的18个数据集被合并以训练随机森林和多线性回归模型(方程2)。
[0107]
使用随机森林和多线性回归模型对测试患者数据预测ttfields。图像的大部分与不导电的空气相关联。因此,它可能使模型的结果产生偏差。为了处理这种情况,通过确保训练中具有空气的体素的数量与其他分割组织中的数量相似,只考虑了训练中带有空气的一小部分体素。训练和预测是独立于其邻居的每个体素执行的。
[0108]
例如,该方法可以借助使用scipy、numpy、scikit-learn和simpleitk包的python 3.6来实现。例如,使用3d切片器对结果进行目视检查。金标准模拟可以使用sim4life(zurich med tech,瑞士苏黎世)在专用模拟计算机(例如,intel i7 cpu、nvidia 1080 ti gpu、128 gb ram等)上计算。患者的mri用钆进行t1加权,其中体素间距为1x1x1 mm3,并且包含整个头部。
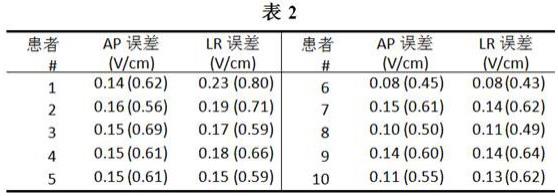
[0109]
结果随机森林预测和金标准之间的平均绝对差异为0.14 v/cm(患者的sd=0.035,范围0.08-0.23 v/cm,n = 20)。表2示出了我们的结果的每个患者总结。
[0110]
。
[0111]
如表2中所示,与多线性回归相比,随机森林回归产生了更好的准确度。比较上述随机森林平均绝对差值和0.29 v/cm的线性回归结果(患者的sd=0.04,范围0.23
–
0.37 v/cm,n = 20)。随机森林平均预测时间为15秒(sd = 1.5秒)。注意,该测量不包括提取距离测量值所需的预处理,通常对于如下各项中的每个需要30秒:ta、csf和中线。
[0112]
图14a-c示出了通过金标准、随机森林和多线性回归计算的典型电场空间分布。图15a-b示出了金标准和随机森林预测之间的典型绝对差异。图15a-b示出了在换能器阵列附近(图15a)和沿着主换能器阵列轴的脑室(ventricles)附近(图15b)观察到的较大误差。
[0113]
在大多数位置中,所述值非常相似(《 0.4 v/cm)。然而,在ta附近(图4a)和沿ta主轴线的脑室之外(图15b)观察到较大的误差(》 2 v/cm)。
[0114]
如所示和所述,本文中所述的方法、系统和装置可以用于快速估计ttfields空间分布。结果表明,在短时间内可以达到0.14 v/cm的平均准确度。将使用建议的随机森林方法的~1.5分钟计算时间与使用金标准方法的3-4小时计算时间进行比较。注意,通过数据准备的并行化,计算时间可以进一步减少三分之一。
[0115]
最佳ta位置的选择涉及肿瘤区域上平均ttfields的计算。平均可以进一步提高准确度。随机森林方法也可以用于ttfields估计,以优化ta放置。
[0116]
本文中所述的方法可以结合相邻体素,并考虑卷积和递归神经网络。基于ta位置的交替的一次性距离图计算和这些图的快速操纵可以用于将总计算时间减少到几秒钟。本文中描述的方法可以用于接受ttfields治疗的患者的身体的任何部分。
[0117]
在一些情况下,电场分布的快速近似(例如,在1290处的预测引擎的输出等)可以用于为放置在患者的解剖结构的区域(例如,头部、躯干等)上的(一个或多个)换能器阵列提供一个或多个候选位置。例如,电场分布的快速近似可以用于确定在患者的解剖结构上的多个位置中的每个位置处的一对换能器阵列的一个或多个电场分布强度值。换能器阵列放置的一个或多个候选位置可以用于确定换能器阵列的最佳位置。
[0118]
可以基于患者模型、在多个位置中的每个位置处的一对换能器阵列的分布电场强度值的快速近似值、感兴趣的区域(roi)(例如,肿瘤位置等)以及与患者的解剖结构相关联的解剖限制来确定换能器阵列的最佳位置。解剖限制可以指示在确定电场分布图时应当排除使用的roi的横向平面的一个或多个位置。可以基于roi的中心来确定横穿患者的身体的一部分的平面。
[0119]
图16a示出了患者的头部中的横向平面1602的定义,并且图16b示出了如患者的胸部中定义的横向平面1602。横向平面1602可以在患者的身体的任何部分中定义。横向平面1602最初可以由感兴趣的区域1604的中心和倾斜角来定义。倾斜角可以由本领域技术人员定义。举例来说,头部的倾斜角可以偏离轴向平面(例如,水平)150-20度。横向平面1602可以包括由解剖模型(例如,头部、胸部、躯干、腹部、腿部、手臂以及诸如此类)的边界(例如,外形)创建的轮廓。例如,轮廓可以类似于椭圆形、圆形、不规则形状以及诸如此类。确定横向平面1602可以包括确定沿着横向平面1602的轮廓的多个位置1606。多个位置1606可以表示从根据横向平面1602放置的潜在换能器阵列的电场分布的快速近似(例如,1290处的预测引擎的输出等)确定的一个或多个位置。可以使用快速近似来确定由换能器阵列在多个位置1606中的每个位置处产生的电场可能将穿过roi 1604。可以基于电场分布的快速近似(例如,1290处的预测引擎的输出等)来确定多个位置1606。考虑任何数量的位置1606。在一些情况下,位置1606可以分成对,使得由一对换能器阵列(每个换能器阵列位于该对位置中的一个位置处)产生的交变电场将穿过roi 1604。位置1606可以间隔开例如15度,对应于大约2 cm的平移,从而在180度的范围内给出总共十二个不同的位置。考虑其他间距。
[0120]
横向平面可以包括该对换能器阵列沿平面的轮廓的多对位置。可以基于解剖限制来调整多对位置中的一个或多个位置,以生成修改的平面。对于两对换能器阵列的多个组合中的每个组合,基于电场分布图,可以确定roi中的多个剂量度量。多个剂量度量可以基于针对两对换能器阵列的多个组合中的每个组合产生的模拟电场。
[0121]
在一些情况下,基于角度限制参数和roi中的多个剂量度量,可以确定一个或多个候选换能器阵列布局图。在一些情况下,角度限制参数可以指示多对换能器阵列之间的正交角度。在一些情况下,角度限制参数指示多对换能器阵列之间的角度的范围。为了优化,候选换能器阵列布局图可以与在多个位置中的每个位置处的该对换能器阵列的估计的一个或多个电场分布强度值进行比较、与之相关联和/或与之匹配。
[0122]
对于一个或多个候选换能器阵列布局图中的每个,其与在多个位置中的每个位置处的该对换能器阵列的估计的一个或多个电场分布强度值进行密切比较、与之相关联和/或与之匹配,可以通过调整该对换能器阵列中的一个或多个换能器阵列的位置或取向来确
定一个或多个调整的候选换能器阵列布局图。对于每个调整的候选换能器阵列布局图,roi中的调整的剂量度量。基于roi中的调整的剂量度量,可以从调整的候选换能器阵列布局图中确定最终的换能器阵列布局图。在一些情况下,如果最终换能器阵列布局图与在多个位置中的每个位置处的该对换能器阵列的一个或多个电场分布强度值的至少一部分不相关,则可以通过进一步训练来重新调整(例如,优化等)预测模型的准确度。
[0123]
一旦已经针对患者确定了三维阵列布局图(例如,最终换能器阵列布局图等),则可以由患者建模应用608使用患者模型来模拟ttfields的传递。模拟电场分布、剂量测定和基于模拟的分析在美国专利公开号20190117956 a1和ballo等人(2019)的出版物“correlation of tumor treating fields dosimetry to survival outcomes in newly diagnosed glioblastoma: a large-scale numerical simulation-based analysis of data from the phase 3 ef-14 randomized trial”中描述,其通过引用被整体地并入本文中。
[0124]
为了确保换能器阵列相对于肿瘤位置的系统定位,可以定义参考坐标系。例如,横向平面最初可以由换能器阵列的常规lr和ap定位来定义。左-右方向可以被定义为x轴,ap方向可以被定义为y轴,并且垂直于xy平面的头尾方向可以被定义为z轴。
[0125]
在定义坐标系后,可以将换能器阵列虚拟地放置在患者模型上,其中它们的中心和纵轴在xy平面内。一对换能器阵列可以围绕头部模型的z轴系统地旋转,即,在xy平面中,从0度到180度,从而覆盖头部的整个圆周(通过对称)。旋转间隔可以是例如15度,对应于大约2 cm平移,从而在180度的范围内给出总共十二个不同的位置。考虑其他旋转间隔。可以针对相对于肿瘤坐标的每个换能器阵列位置执行电场分布计算。
[0126]
患者模型中的电场分布可以由患者建模应用608使用电势的有限元(fe)近似值来确定。通常,定义时变电磁场的量由复杂的麦克斯韦方程给出。然而,在生物组织中,并且在ttfields的低到中频(f = 200khz)下,电磁波长远大于头部的大小,并且与实值电导率σ相比,介电常数ε是可忽略不计的,即,其中ω = 2πf是角频率。这意味着组织中的电磁传播效应和电容效应是可忽略不计的,因此标量电势可以由静态拉普拉斯方程
∇∙
(σ
∇
φ)= 0很好地近似,其在电极和皮肤处具有适当的边界条件。因此,复阻抗被视为电阻性的(即,电抗是可忽略不计的),并且因此,在体积导体内流动的电流主要是自由(欧姆)电流。使用simnibs软件(simnibs.org)来计算拉普拉斯方程的fe近似。计算基于galerkin方法,并且共轭梯度求解器的残差要求《1e-9。使用狄利克雷边界条件,其中在每组电极阵列处电势被设置为(任意选择的)固定值。电(向量)场被计算为电势的数值梯度,并且电流密度(向量场)使用欧姆定律从电场计算。对电场值和电流密度的电势差进行线性重新标度(rescale),以确保每个阵列对的总峰峰幅度为1.8a,其计算为有源电极盘上所有三角形表面元件上正常电流密度分量的(数值)表面积分。这对应于optune
®
设备用于临床ttfields治疗的当前水平。ttfields的“剂量”被计算为场向量的强度(l2范数)。假设建模电流由两个分离且顺序活动的源提供,每个源连接到一对3
×
3换能器阵列。左边和后部阵列可以被定义为模拟中的源,而右边和前部阵列分别是相应的汇(sink)。然而,由于ttfields采用交变场,因此这种选择是任意的,并且不影响结果。
[0127]
可以由患者建模应用608针对一种或多种组织类型确定由放置在患者上多个位置处的换能器阵列产生的平均电场强度。在一个方面中,对应于(一种或多种)肿瘤组织类型
中最高平均电场强度的换能器阵列位置可以被选择作为患者的期望(例如,最佳)换能器阵列位置。在另一方面中,作为患者的身体状况的结果,可以排除(一个或多个)换能器阵列的一个或多个候选位置。例如,可以基于皮肤刺激、疤痕、手术部位、不适等的区域排除一个或多个候选位置。因此,在排除一个或多个候选位置之后,对应于(一种或多种)肿瘤组织类型中最高平均电场强度的换能器阵列位置可以被选择为患者的期望(例如,最佳)换能器阵列位置。因此,可以选择导致小于最大可能平均电场强度的换能器阵列位置。
[0128]
可以修改患者模型,以包括期望的换能器阵列位置的指示。包括(一个或多个)期望的换能器阵列位置的指示的所得到的患者模型可以被称为三维阵列布局图(例如,三维阵列布局图600)。因此,三维阵列布局图可以包括患者的身体的部分在三维空间中的数字表示、肿瘤位置的指示、用于放置一个或多个换能器阵列的位置的指示、其组合以及诸如此类。
[0129]
三维阵列布局图可以以数字形式和/或物理形式提供给患者。患者和/或患者护理人员可以使用三维阵列布局图来将一个或多个换能器阵列固定到患者的身体的相关联的部分(例如,头部)。
[0130]
图17是描绘包括患者支持系统1702的非限制性示例的环境1700的框图。在一个方面中,任何描述的方法的一些或所有步骤可以在如本文中所述的计算设备上执行。患者支持系统1702可以包括一个或多个计算机,其被配置成存储efg配置应用606、患者建模应用608、成像数据610以及诸如此类中的一个或多个。
[0131]
患者支持系统1702可以是数字计算机,就硬件架构而言,其通常包括处理器1709、存储器系统1720、输入/输出(i/o)接口1712和网络接口1714。这些组件(606、608、610、1718和1722)经由本地接口1716通信地耦合。本地接口1716可以是例如但不限于一个或多个总线或其他有线或无线连接,如本领域中已知的。本地接口1716可以具有附加元件,诸如控制器、缓冲器(高速缓存)、驱动器、中继器和接收器,以使能实现通信,为了简单起见省略了所述附加元件。此外,本地接口可以包括地址、控制和/或数据连接,以使能实现上述组件之间的适当通信。
[0132]
处理器1709可以是用于执行软件(特别是存储在存储器系统1720中的软件)的硬件设备。处理器1709可以是任何定制制作的或商业上可获得的处理器、中央处理单元(cpu)、与患者支持系统1702相关联的几个处理器中的辅助处理器、基于半导体的微处理器(以微芯片或芯片组的形式)、或通常用于执行软件指令的任何设备。当患者支持系统1702在操作中时,处理器1709可以被配置成执行存储在存储器系统1720中的软件,向存储器系统1720传送数据和从存储器系统1720传送数据,以及根据软件总体控制患者支持系统1712的操作。
[0133]
i/o接口1712可以用于从一个或多个设备或组件接收用户输入和/或用于向一个或多个设备或组件提供系统输出。用户输入可以经由例如键盘和/或鼠标来提供。可以经由显示设备和打印机(未示出)提供系统输出。i/o接口1712可以包括例如串行端口、并行端口、小型计算机系统接口(scsi)、ir接口、rf接口和/或通用串行总线(usb)接口。
[0134]
网络接口1714可以用于从患者支持系统1702传输和接收。网络接口1714可以包括例如10baset以太网适配器、100baset以太网适配器、lan phy以太网适配器、令牌环适配器、无线网络适配器(例如wifi)或任何其他合适的网络接口设备。网络接口1714可以包括
地址、控制和/或数据连接,以使能实现适当的通信。
[0135]
存储器系统1720可以包括易失性存储器元件(例如,随机存取存储器(ram,诸如dram、sram、sdram等))和非易失性存储器元件(例如,rom、硬盘驱动器、磁带、cdrom、dvdrom等)中的任何一种或其组合。此外,存储器系统1720可以包含电子、磁性、光学和/或其他类型的存储介质。注意,存储器系统1720可以具有分布式架构,其中各种组件彼此远离定位,但是可以被处理器1709访问。
[0136]
存储器系统1720中的软件可以包括一个或多个软件程序,其中的每个软件程序包括用于实现逻辑功能的可执行指令的有序列表。在图17的示例中,患者支持系统1702的存储器系统1720中的软件可以包括efg配置应用606、患者建模应用608、成像数据610和合适的操作系统(o/s)1718。操作系统1718基本上控制其他计算机程序的执行,并提供调度、输入输出控制、文件和数据管理、存储器管理、和通信控制以及相关服务。
[0137]
为了说明的目的,应用程序和其他可执行程序组件(诸如操作系统1718)在本文中被图示为离散的框,但是要认识到,这样的程序和组件可以在不同时间驻留在患者支持系统1702的不同存储组件中。efg配置应用1706、患者建模应用608、成像数据610和/或控制软件1720的实现可以被存储在某种形式的计算机可读介质上或跨某种形式的计算机可读介质传输。公开的方法中的任何方法都可以由在计算机可读介质上实现的计算机可读指令来执行。计算机可读介质可以是可以由计算机访问的任何可用介质。作为示例而不旨在限制,计算机可读介质可以包括“计算机存储介质”和“通信介质”。“计算机存储介质”可以包括以用于存储诸如计算机可读指令、数据结构、程序模块或其他数据的信息的任何方法或技术实现的易失性和非易失性、可移动和不可移动介质。示例性计算机存储介质可以包括ram、rom、eeprom、闪存或其他存储技术、cd-rom、数字多功能盘(dvd)或其他光存储装置、盒式磁带、磁带、磁盘存储装置或其他磁存储设备,或者可以用于存储期望信息并且可以由计算机访问的任何其他介质。
[0138]
在图18中所图示的实施例中,装置100、患者支持系统602、患者建模应用608、患者支持系统1702和/本文中所述的任何其他装置/部件中的一个或多个可以被配置成执行方法1800,该方法包括,在1810处,确定与多个患者相关联的多个图像数据集,其中每个患者与从对患者的一部分进行成像来导出的图像数据集相关联,其中每个图像数据集包括多个体素,其中多个体素中的每个体素用组织类型来标记,并且其中多个体素中的每个体素用电场强度分布值(v cm-1)来标记,该电场强度分布值是从一对换能器阵列向患者的该部分模拟施加交变电场而导出的。例如,确定多个图像数据集可以包括:确定针对每个患者的原始图像数据,其中原始图像数据包括多个体素;将组织类型分配给多个体素中的每个体素;基于每个体素的组织类型,模拟在原始图像数据内的多个位置处施加来自一对换能器阵列的交变电场;用组织类型、模拟电场和与模拟电场相关联的位置来标记原始图像数据的多个体素中的每个体素;以及基于标记的原始数据,生成多个图像数据集。
[0139]
在1820处,基于多个图像数据集的第一部分来确定预测模型的多个特征。例如,基于多个图像数据集的第一部分确定预测模型的多个特征可以包括特征选择技术,该技术包括过滤方法、包装器方法或嵌入方法中的一种或多种。多个特征可以包括电导率值、介电常数值、到最近的换能器阵列的距离、到最近的导电材料的距离和/或诸如此类中的两个或更多个。
[0140]
在1830处,基于多个特征和多个图像数据集的第一部分来训练预测模型,其中所述预测模型被配置成估计电场强度分布值。例如,基于多个特征和多个图像数据集的第一部分训练预测模型可以包括机器学习技术,该技术包括判别分析、决策树、最近邻(nn)算法(例如,k-nn模型、复制器nn模型等)、统计算法(例如,贝叶斯网络等)、聚类算法(例如,k均值、均值漂移等)、神经网络(例如,储层网络、人工神经网络等)、支持向量机(svm)、逻辑回归算法、线性回归算法、马尔可夫模型或链、主成分分析(pca)(例如,用于线性模型)、多层感知器(mlp)ann(例如,用于非线性模型)、复制储层网络(例如,用于非线性模型,通常用于时间系列)、随机森林分类、其组合和/或诸如此类中的一个或多个。
[0141]
在1840处,基于多个图像数据集的第二部分来测试预测模型。
[0142]
在1850处,基于测试来输出预测模型。例如,预测模型可以用于电场分布的快速近似。
[0143]
在一些情况下,方法1800还可以包括:针对新患者确定新的图像数据集,其中新的图像数据集包括多个体素;向预测模型呈现新的图像数据集;以及由预测模型针对多个体素中的每个体素估计在多个位置中的每个位置处的该对换能器阵列的一个或多个电场分布强度值。在一些情况下,方法1800还可以包括基于估计的一个或多个电场分布强度值来选择多个位置中的位置。在一些情况下,方法1800还可以包括:针对新的图像数据集的多个体素中的每个体素确定组织类型;以及针对新的图像数据集的多个体素中的每个体素确定电导率值、介电常数值、到最近的换能器阵列的距离以及到最近的导电材料的距离。
[0144]
在图19中所图示的实施例中,装置100、患者支持系统602、患者建模应用608、患者支持系统1702和/本文中所述的任何其他设备/部件中的一个或多个可以被配置成执行方法1900,该方法包括在1910处针对患者确定图像数据集,其中该图像数据集包括多个体素。
[0145]
在1920处,向预测模型呈现图像数据集,其中所述预测模型被配置成基于来自多个位置处的一对换能器阵列的一个或多个模拟交变电场来估计电场强度分布值。
[0146]
在1930处,通过所述预测模型,针对多个体素中的每个体素估计在多个位置中的每个位置处的该对换能器阵列的一个或多个电场分布强度值。
[0147]
在一些情况下,方法1900还可以包括基于估计的一个或多个电场分布强度值,选择多个位置中的位置。在一些情况下,方法1900还可以包括:针对图像数据集的多个体素中的每个体素确定组织类型;以及针对图像数据集的多个体素中的每个体素确定电导率值、介电常数值、到最近的换能器阵列的距离以及到最近的导电材料的距离。
[0148]
在1940处,可以确定换能器阵列图。例如,可以基于该图像数据集、在多个位置中的每个位置处的该对换能器阵列的估计的一个或多个电场分布强度值、感兴趣的区域(roi)(例如,肿瘤位置等)以及患者的解剖参数来确定换能器阵列的最佳位置。图像数据集可以用于确定患者的身体的一部分的三维(3d)模型。对于一对换能器阵列的多个位置中的每个位置,基于3d模型、roi和与患者相关联的解剖限制,可以基于在多个位置中的每个位置处的该对换能器阵列的估计的一个或多个电场分布强度值来确定电场分布图。
[0149]
解剖限制可以指示在确定电场分布图时应当排除使用的roi的横向平面的一个或多个位置。在一些情况下,该方法可以包括基于roi的中心来确定横穿患者的身体的部分的平面,其中该平面包括换能器阵列对沿着平面的轮廓的多对位置,以及基于解剖限制参数来调整多对位置中的一个或多个位置以生成修改的平面。对于两对换能器阵列的多个组合
中的每个组合,基于电场分布图,可以确定roi中的多个剂量度量。多个剂量度量可以基于针对两对换能器阵列的多个组合中的每个组合产生的模拟电场。
[0150]
在一些情况下,该方法可以包括基于角度限制参数和roi中的多个剂量度量,确定一个或多个候选换能器阵列布局图。在一些情况下,角度限制参数可以指示多对换能器阵列之间的正交角度。在一些情况下,角度限制参数指示多对换能器阵列之间的角度的范围。为了优化,候选换能器阵列布局图可以与在多个位置中的每个位置处的该对换能器阵列的估计的一个或多个电场分布强度值进行比较、与之相关联和/或与之匹配。
[0151]
对于一个或多个候选换能器阵列布局图中的每个,其与在多个位置中的每个位置处的该对换能器阵列的估计的一个或多个电场分布强度值进行密切比较、与之相关联和/或与之匹配,可以通过调整该对换能器阵列中的一个或多个换能器阵列的位置或取向来确定一个或多个调整的候选换能器阵列布局图。对于每个调整的候选换能器阵列布局图,roi中的调整的剂量度量。基于roi中的调整的剂量度量,可以从调整的候选换能器阵列布局图中确定最终的换能器阵列布局图。在一些情况下,如果最终换能器阵列布局图与在多个位置中的每个位置处的该对换能器阵列的一个或多个电场分布强度值的至少一部分不相关,则可以通过进一步训练来重新调整(例如,优化等)预测模型的准确度。
[0152]
鉴于所描述的装置、系统和方法及其变型,下文中描述了本发明的某些更特别描述的实施例。然而,这些特别列举的实施例不应该被解释为对包含本文中描述的不同或更一般的教导的任何不同权利要求有任何限制作用,或者“特定”实施例在某种程度上受限于除了其中字面使用的语言的固有含义之外的一些方式。
[0153]
实施例1:一种方法,包括:确定与多个患者相关联的多个图像数据集,其中每个患者与从对患者的一部分进行成像来导出的图像数据集相关联,其中每个图像数据集包括多个体素,其中多个体素中的每个体素用组织类型来标记,并且其中多个体素中的每个体素用电场强度分布值(v cm-1)来标记,所述电场强度分布值是从一对换能器阵列向患者的部分模拟施加交变电场而导出的;基于多个图像数据集的第一部分来确定预测模型的多个特征;基于多个特征和多个图像数据集的第一部分来训练所述预测模型,其中所述预测模型被配置成估计电场强度分布值;基于多个图像数据集的第二部分来测试预测模型;以及基于测试来输出预测模型。
[0154]
实施例2:如前述实施例中的任一实施例中所述的实施例,其中确定多个图像数据集包括:确定针对每个患者的原始图像数据,其中原始图像数据包括多个体素;将组织类型分配给多个体素中的每个体素;基于每个体素的组织类型,模拟在原始图像数据内的多个位置处施加来自一对换能器阵列的交变电场;用组织类型、模拟电场和与模拟电场相关联的位置来标记原始图像数据的多个体素中的每个体素;以及基于标记的原始数据,生成多个图像数据集。
[0155]
实施例3:如前述实施例中的任一实施例中所述的实施例,其中基于多个图像数据集的第一部分来确定预测模型的多个特征包括特征选择技术,所述特征选择技术包括过滤方法、包装器方法或嵌入方法中的一种或多种。
[0156]
实施例4:如前述实施例中的任一实施例中所述的实施例,其中所述多个特征包括电导率值、介电常数值、到最近的换能器阵列的距离或到最近的导电材料的距离中的两个或更多个。
[0157]
实施例5:如前述实施例中的任一实施例中所述的实施例,其中基于多个特征和多个图像数据集的第一部分来训练预测模型包括机器学习技术,该技术包括判别分析、决策树、最近邻(nn)算法(例如,k-nn模型、复制器nn模型等)、统计算法(例如,贝叶斯网络等)、聚类算法(例如,k均值、均值漂移等)、神经网络(例如,储层网络、人工神经网络等)、支持向量机(svm)、逻辑回归算法、线性回归算法、马尔可夫模型或链、主成分分析(pca)(例如,用于线性模型)、多层感知器(mlp)ann(例如,用于非线性模型)、复制储层网络(例如,用于非线性模型,通常用于时间系列)或随机森林分类中的一个或多个。
[0158]
实施例6:如前述实施例中的任一实施例中所述的实施例,进一步包括:针对新患者确定新的图像数据集,其中新的图像数据集包括多个体素;向预测模型呈现新的图像数据集;以及由预测模型针对多个体素中的每个体素来估计在多个位置中的每个位置处的该对换能器阵列的一个或多个电场分布强度值。
[0159]
实施例7:如前述实施例中的任一实施例中所述的实施例,进一步包括基于估计的一个或多个电场分布强度值,选择多个位置中的位置。
[0160]
实施例8:如前述实施例中的任一实施例中所述的实施例,进一步包括:针对新的图像数据集的多个体素中的每个体素确定组织类型;以及针对新的图像数据集的多个体素中的每个体素来确定电导率值、介电常数值、到最近的换能器阵列的距离以及到最近的导电材料的距离。
[0161]
实施例9:如前述实施例中的任一实施例中所述的实施例,进一步包括使用预测模型。
[0162]
实施例10:一种方法,包括:针对患者确定图像数据集,其中该图像数据集包括多个体素;向预测模型呈现图像数据集,其中所述预测模型被配置成基于来自多个位置处的一对换能器阵列的一个或多个模拟交变电场来估计电场强度分布值;通过所述预测模型,针对多个体素中的每个体素估计在多个位置中的每个位置处的该对换能器阵列的一个或多个电场分布强度值;以及基于在多个位置中的每个位置处的该对换能器阵列的估计的一个或多个电场分布强度值、感兴趣的区域以及与患者相关联的解剖限制来确定包括多个位置中的一个或多个位置的换能器阵列图。
[0163]
实施例11:如实施例10中所述的实施例,进一步包括基于估计的一个或多个电场分布强度值,选择多个位置中的位置。
[0164]
实施例12:如实施例10-11中所述的实施例,进一步包括:针对图像数据集的多个体素中的每个体素确定组织类型;以及针对图像数据集的多个体素中的每个体素,确定电导率值、介电常数值、到最近的换能器阵列的距离以及到最近的导电材料的距离。
[0165]
除非另有明确说明,否则绝不旨在将本文中阐述的任何方法解释为要求其步骤以特定顺序执行。因此,在方法权利要求实际上没有叙述其步骤所遵循的顺序,或者在权利要求或描述中没有另外具体说明所述步骤将被限制为特定顺序,则绝不旨在在任何方面中都推断出顺序。这适用于任何可能的非明确解释基础,包括:关于步骤或操作流程的布置的逻辑问题;源自语法组织或标点符号的简单含义;说明书中描述的实施例的数量或类型。
[0166]
虽然已经结合优选实施例和具体示例描述了方法和系统,但是不旨在将范围限于所阐述的特定实施例,因为本文中的实施例在所有方面中都旨在是说明性而非限制性的。
[0167]
对本领域技术人员而言,在不脱离范围或精神的情况下,可以进行各种修改和变
化。通过考虑本文中公开的说明书和实践,其他实施例对于本领域技术人员将是显而易见的。旨在将说明书和示例仅视为示例性的,其中真实范围和精神由所附权利要求来指示。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。