治疗儿童个体的cln2病的方法
1.相关申请的交叉参考
2.本技术案要求保护2019年8月29日申请的美国临时专利申请案第62/893,535号的优先权,所述申请案以引用的方式并入本文中。
3.以引用的方式并入以电子方式提交的材料
4.与本技术案同时提交且如下标识的计算机可读核苷酸/氨基酸序列列表以全文引用的方式并入本文中:一个8,177位组ascii(文本)文件,其命名为“54735_seqlisting.txt”;创建于2020年8月27日。
技术领域
5.本公开案是关于治疗小于3岁的个体的神经性类蜡脂褐质病(cln2)的方法和延缓cln2或其相关生理症状发作的方法。
背景技术:
6.神经性类蜡脂褐质病(cln2)为罕见的基因疾病,其特征为由tpp1基因突变引起的溶酶体酶三肽基肽酶-1(tpp1)的缺乏。cln2病作为常染色体隐性遗传病遗传,估计发病率为每100,000个存活新生儿中有0.5个发病。在tpp1不存在的情况下,通常由酶代谢的溶酶体贮积物质在许多器官中累积,且中枢神经系统中的累积会导致cln2病典型的神经退化性症状。如由来自北美洲和欧洲中的独立患者群体的天然病史数据所表明,cln2病的未治疗的疾病进展已得到充分表征,且疾病的天然病史明显一致且可预测。
7.cln2病具有主要为
‘
经典的’晚期婴儿表达型。患有cln2病的儿童通常发育至约3岁,直至出现首发症状。最常见的,cln2患者会首先出现无端癫痫发作,且开始在获得正常的语言里程碑方面滞后。到3岁时,所有患者均呈现出一或多种疾病病征,包含例如癫痫发作、痴呆、运动丧失、运动障碍、失明、笨拙、共济失调和认知衰退。自临床症状发作开始,所述病的病程快速且具有侵略性,通常导致在2至4年内完全丧失语言、认知、步态、精细运动、延髓功能和视力,使患者无法移动、失声且失明。患者维持植物人状态直至死亡,此通常发生在6岁与12岁之间。
8.在评估cln2病的严重程度方面,专家临床医师已研发出两个定量评定量表,且其用于天然病史研究:(1)汉堡量表(hamburg scale)(steinfeld等人,《美国医学遗传学杂志(am j med genet.)》2002;112(4):347-54);和(2)威尔康奈尔医疗学会(weill cornell medical college;wcmc)量表(worgall等人,《神经学(neurology.)》2007;69(6):521-35)。两个量表的结构和评定方法类似。两个量表均测量cln2患者先前已达到的重要神经里程碑的丧失,其中疾病评定量表中的各单位丧失代表进行性衰退的基本里程碑。
9.未治疗的cln2影响的儿童的疾病病程的分析展示,在疾病发作之后,其可以预见地在3年内丧失所有语言和步态,每年平均损失2.1个里程碑事件(即在疾病评定量表中损失2.1分)。语言衰退通常先于步态,以使得第一年的特征在于丧失清晰的话语,且进展为步态共济失调,第二年的特征在于丧失行走能力和清晰的语言,且第三年的特征在于丧失任
何移动或交流能力。
10.重组人类三肽基肽酶-1(rhtpp1)正在研发作为cln2病的可能的治疗。rhtpp1蛋白作为酶原(前酶)在细胞培养物中产生,其不具有酶促活性。在吸收至溶酶体时,前酶在酸性ph下(且利用溶酶体蛋白酶)自体活化。成熟的天然tpp1蛋白为溶酶体丝氨酸蛋白酶,且为丝氨酸-羧基肽酶(serine-carboxyl peptidase;sedolisin)家族中唯一已知的哺乳动物成员,其特征为高度保守的ser-glu-asp(sed)催化三联体。rhtpp1上的催化三联体由s456、e253和d341形成。所述酶的主要活性为具有广泛的受质特异性的三肽基外肽酶。酶在其受质上的活性导致三肽自蛋白质受质的n端依序释放(oyama等人,《生物化学杂志(j biochem.)》2005;138(2):127-34)。还已经报道具有最适ph为3的,次要的,明显较弱的内蛋白分解活性(lin等人,《生物化学杂志》2001;276(3):2249-55)。
11.对cln2唯一可商购的治疗方法是对症治疗和支持治疗;目前尚无批准的治疗选择来减缓或中断cln2的不可阻挡的进展,更不用说逆转所述疾病的有害影响(mole,s.e.,和williams,r.e.,2010,《基因综述(genereviews)》;chang等人,在《神经元类蜡脂褐质病(巴氏病)(the neuronal ceroid lipofuscinoses(batten disease))》中;2011,oxford univ press)。为这些孩子保留运动、语言和/或视力的能力,对患者和父母/看护者都具有临床上有意义的益处。因此,需要cln2的新疗法,其减少或预防与疾病相关的生理功能的恶化。
技术实现要素:
12.本公开案是关于在个体中治疗cln2病或与cln2病相关的一或多种症状的方法。在示范性实施例中,个体小于3岁。在示范性实施例中,所述方法包括以可有效治疗个体中的cln2病的量向个体施用包括重组人类三肽基肽酶-1(rhtpp1)的调配物。本公开案还是关于延缓个体中cln2病或其症状发作的方法。在示范性实施例中,个体小于3岁。在示范性实施例中,所述方法包括以可有效延缓个体中的cln2病或其症状发作的量向个体施用包括rhtpp1的调配物。在示范性方面中,经由脑室内、鞘内或眼内施用将调配物施用至个体。在示范性情况下,所述调配物每2周施用一次。在各个方面中,利用输注以约2.5毫升/小时的速率施用调配物。在当前公开的方法的各种情况下,向个体施用约300mg或更少的剂量。在示范性方面中,个体大于或为约2岁,且任选地,向个体施用约300mg rhtpp1的剂量。在各个方面中,个体大于或为约1岁且小于2岁,且任选地,向个体施用约200mg rhtpp1的剂量。在示范性方面中,向个体(例如大于或为约1岁且小于2岁的个体)施用的第1、第2、第3和第4剂量中的每一者为约200mg rhtpp1,且向个体施用的第5和后续剂量中的每一者大于约200mg rhtpp1。在示范性情况下,向个体施用的第5和后续剂量中的每一者为约300mg rhtpp1。在各个方面中,个体大于或为约6月龄,且小于1岁,且任选地,向个体施用约150mg rhtpp1的剂量。在各个方面中,个体小于6月龄,且任选地,向个体施用约100mg rhtpp1的剂量。在示范性方面中,基于血液测试,个体呈现出tpp1酶活性降低。在示范性实例中,个体为诊断患有cln2的个体的兄弟姐妹。在示范性方面中,个体在运动和语言分量表上的总评分为约3至约6分。在示范性方面中,个体先前未用干细胞疗法、基因疗法或酶补充疗法治疗。在示范性情况下,所述方法包括在施用rhtpp1之前,任选地在施用rhtpp1之前约30至约60分钟,与退热剂一起或不与退热剂一起向个体施用抗组织胺剂。在各个方面中,调配物包括rhtpp1和至少一种药学上可接受的载剂、稀释剂或赋形剂。在各种情况下,所述调配物包括五水合磷
酸氢二钠、单水合磷酸一钠、氯化钠、氯化钾、氯化镁、水合氯化钙、注射用水或其组合。在各种情况下,所述方法包括在施用调配物之后向个体施用冲洗溶液。在各个方面中,冲洗溶液包括五水合磷酸氢二钠、单水合磷酸一钠、氯化钠、氯化钾、氯化镁、水合氯化钙、注射用水或其组合。在各个方面中,治疗期为至少10周、至少20周、至少40周、至少80周或至少96周。
13.前述概述并非旨在限定本发明的每个方面中,且根据包含附图的以下详细描述,本公开案的其它特点和优点将变得显而易见。本公开案旨在作为统一文件相关,且应当理解,即使在本公开案的同一句子、段落或章节中未找到特点的组合,还可以涵盖本文所述的特点的所有组合。另外,作为额外方面,本公开案包含本发明的所有实施例,其范围以任何方式与由上文具体提及的变化形式相比较窄。关于用“一个”或“一种”描述或所要求保护的本公开案的各方面中,应当理解,除非上下文明确要求更严格的含义,否则这些术语表示“一或多个”。关于描述为一组内的一或多个的要素,应当理解,可以涵盖所述组内的所有组合。如果将本公开案的方面中描述为“包括”特征,那么还可以涵盖“由特点组成”或“基本上由特点组成”的实施例。自本技术案的整体,本公开案的额外特点和变型对于本领域技术人员而言将为显而易见的,且所有所述特点旨在作为本公开案的方面。
附图说明
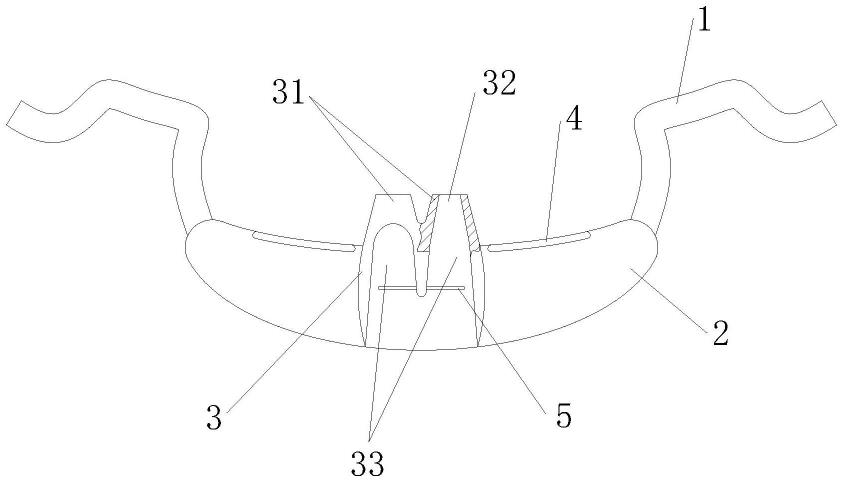
14.图1描绘了缺乏相关信号肽的rhtpp1酶原的氨基酸序列。所述酶之前段为前176个氨基酸残基,且成熟酶自177位开始的长度为368个氨基酸。
15.图2描绘了自然病史研究中未治疗的患有cln2病的个体的临床进展,且显示了0至6的汉堡运动和语言综合评分与患者年龄的关系。还显示中值、四分位数和10%/90%分布;以及平均值和95%的置信区间。
16.图3a至3f描绘了在治疗期间累积的24名患者的临床评估,且显示了0至6个汉堡运动和语言综合评分。空心圆圈代表在第一次输注300mg rhtpp1后或之前获得的cln2评分,而空心圆圈代表在第一次输注300mg rhtpp1后获得的cln2评分。同时显示了总分(圆圈)以及运动/步态(正方形)和语言(三角形)对总分的贡献。分析第1天为第一次输注的日期。
17.图4a至4i比较了0至6个汉堡运动和语言综合量表的疾病评分(用前缀“ham”表示),将9名接受rhtpp1治疗的患者和与接受治疗的个体相匹配的未接受治疗的自然病史患者的cln2评分变化。与实线匹配的未治疗的自然病史患者的结果相比,每组中的实线显示了治疗患者的结果,而未治疗的自然病史患者的结果显示为虚线。
18.图5描绘了与研究个体(正方形)相比较的患者匹配治疗期间,匹配的未经治疗的自然病史患者(圆圈)自基线开始的临床变化分布。
19.图6a至6i描绘了自0至9个汉堡运动/语言/视觉总体量表上的疾病评分与匹配的9名用rhtpp1治疗的患者至未治疗的自然病史患者的cln2评分的变化。与实线匹配的未治疗的自然病史患者的结果相比,每组中的实线显示了治疗患者的结果,而未治疗的自然病史患者的结果显示为虚线。
20.图7描绘了在治疗期间内测量的所有24名患者的脑脊髓液的体积(上图)和比例(下图)。每条线代表一名患者。
21.图8a至8l描绘了24名治疗的患者的脑容量。白质的体积(上图)和比例(下图)显示为全脑容量(点划线)与csf和灰质(虚线)之间的差异,而灰质显示为csf和灰色质(虚线)与
csf(实线)之间的差异。
22.图9a和9b描绘了用rhtpp1治疗的患者和未治疗的自然病史患者的cln2评分的平均变化。图9a描绘用300mg rhtpp1治疗48周的23名患者(虚线)和41个个体的未经治疗自然病史群组(实线)的cln2评分。图9b描绘了用300mg rhtpp1治疗48周的23名患者的cln2评分自基线的变化。
23.图10a至10l描述了在治疗期间累积的24名患者的临床评估,且显示了0至12个组合汉堡(左图)运动(正方形)、语言(三角形)、癫痫发作(十字)和视觉综合评分(钻石型)0至12的wcmc(右图)步态(正方形)、语言(三角形)、肌阵挛(十字形)和进食(钻石)综合评分。空心圆圈代表在第一次rhtpp1 300mg输注后或之前获得的总cln2评分,而空心圆圈代表在第一次rhtpp1 300mg输注后获得的总cln2评分。
24.图11显示了在实例4-10中描述的研究中测试的临床实验室评估和事件的表。
25.图12显示了列出汉堡lincl量表的表格。
26.图13显示了利用icv输注30、100和300mg单次剂量后细胞利波纳酶α(cerliponase alfa)的中值(范围)pk参数。
27.图14显示了icv输注300mg qow后细胞利波纳酶α的中值(范围)pk参数。
28.图15显示了通过icv输注300mg qow后csf和血浆中细胞利波纳酶α的平均浓度-时间曲线。时间0代表开始输注。sd=稳定剂量阶段。
29.图16显示了在300mg icv qow下,患者和访问匹配的csf与细胞利波纳酶α的血浆暴露。
30.图17a-17d显示了csf和血浆中的患者特征和细胞利波纳酶αpk。各个患者数据显示为圆圈。图17a,性别;图17b,基线年龄;图17c,基线体重;图17d,基线cln2评分。方框代表第一(q1)和第三(q3)四分位数之间的四分位数间距(iqr),方框内的条形代表中值,晶须表示不包含异常值的最小值和最大值(即,超出标准数据范围的值定义为范围自q1-1.5*iqr至q3 1.5*iqr;空心圆)。
31.图18a-18b显示了细胞利波纳酶α的单独访问匹配的pk和ada状态。图18a,csf;图18b,血浆/血清。在研究访问时显示为ada阴性的患者的空心圆圈,在研究访问时显示为ada阳性的患者的空心圆圈。
32.图19显示了csf中cln2临床评估量表和细胞利波纳酶αpk的运动语言功能综合评分自基线的变化。各个患者数据显示为圆圈。方框代表第一(q1)和第三(q3)四分位数之间的四分位数间距(iqr),方框内的条形代表中值,晶须表示不包含异常值的最小值和最大值(即,超出标准数据范围的值定义为范围自q1-1.5*iqr至q3 1.5*iqr;空心圆)。
具体实施方式
33.以下定义可适用于帮助熟习所属领域者理解本公开案。除非本文另外定义,否则结合本公开案中所用的科学和技术术语具有本领域普通技术人员通常所了解的含义。在提供值范围时,应理解本发明涵盖彼范围的上限与下限之间的各中间值(除非上下文另外明确指示,否则至下限单位的十分之一)和彼所陈述范围内的任何其它所陈述或中间值。这些较小范围的上限和下限可独立地包含于较小范围内,在所陈述范围内受到任何特定排他性限制。
34.术语“家族病史”是指是经诊断患有cln2病的血亲,例如兄弟姐妹、父母、祖父母、曾祖父母等的个体。
35.在一个方面中,术语“片段”是指包括seq id no:1和图1中所阐述的rhtpp1前酶氨基酸序列的一部分的重组蛋白。举例来说,片段可含有至少约60%、至少约70%、至少约80%、至少约90%或至少约95%的seq id no:1中所阐述的氨基酸序列。在另一方面中,片段可包括seq id no:2中所阐述的全长(368个氨基酸长;seq id no:1的氨基酸177-544)成熟tpp1酶氨基酸序列、其一部分和/或至少包括由氨基酸残基s456、e253和d341形成的催化三联体。片段保留催化活性。举例来说,片段呈现三肽基外肽酶活性和/或呈现催化活性,其使得三肽自蛋白质受质的n端依序释放。在某些方面中,rhtpp1前酶的“片段”包括至少500个seq id no:1的连续氨基酸、至少450个seq id no:1的连续氨基酸、至少400个seq id no:1的连续氨基酸、至少368个seq id no:1的氨基酸、至少350个seq id no:1的氨基酸或至少300个seq id no:1的连续氨基酸。在其它方面中,rhtpp1前酶的“片段”包括至少350个seq id no:2的连续氨基酸、至少325个seq id no:2的连续氨基酸、至少300个seq id no:2的连续氨基酸、至少275个seq id no:2的连续氨基酸、至少250个seq id no:2的连续氨基酸或至少200个seq id no:2的连续氨基酸。
36.术语“脑室内”是指例如经由注射、输注或植入(例如至脑室中)将组合物施用至脑室系统中。
37.术语“眼内”是指例如经由注射、输注或植入(例如至眼球中)或局部/经眼施用(例如使用乳膏、软膏、凝胶或液滴)将组合物施用至眼睛区域中。
38.术语“鞘内”是指例如经由注射、输注或植入(例如至脊髓的蛛膜下空间中)将组合物施用至腰部区域中。
39.术语“治疗有效”是指由于本发明的治疗方法而产生的任何治疗效益。举例来说,此类效应可为在适当的目标组织或器官中表达的有益效应,在所述组织或器官中在酶替代疗法不存在的情况下将所述有益的生理效应与所测量的生理参数进行比较。此类治疗效应可为cln2病的一或多种临床或亚临床表达的任何减少或消除。举例来说,治疗有效的治疗改善、逆转、延缓、预防或减轻如本文所述的cln2的一或多种生理功能和/或神经症状的恶化。
40.术语“稳定”或“稳定化”是指含有蛋白质的调配物,其中其蛋白质组分在随时间贮积时基本上保留其物理、功能性和/或化学稳定性。可在选定温度下在选定时间段内测量稳定性。优选地,调配物在室温(约30℃)下或在约40℃下稳定至少1个月和/或在约2℃至约8℃下稳定至少1年,且优选至少2年。举例来说,贮积期间蛋白质降解或聚集程度可用作蛋白质稳定性的指标。因此,“稳定”调配物可为其中在贮积之后小于约20%、更优选小于约10%、且最优选小于约5%的蛋白质组分以降解或聚集形式存在于调配物中的调配物。“稳定”调配物基本上保留新制备的调配物的相同的功能性或治疗性特征。用于测量蛋白质稳定性的各种分析技术可在所属领域中获得且综述于例如《肽和蛋白质药物递送(peptide and protein drug delivery)》,247-301,vincent lee编,marcel dekker公司,new york,n.y.,pubs.(1991)和jones,a.《先进药物递送综述(adv.drug delivery rev.)》10:29-90(1993)中。
41.术语“预防”或“减少”或其语法等效物在提及预防或减少个体的cln2病的一或多
种症状或生理后果使用时意谓经治疗cln2个体的彼/那些症状的衰退速率比未经治疗cln2个体中观测到的衰退速率慢。就此而言,未经治疗cln2可为随后用本发明组合物治疗的相同个体,或可为如本文所公开的自然病史研究结果观测到的所关注症状的衰退的平均速率。
42.在禁止对人体实践的方法授予专利权的权限中,向人类个体“施用”rhtpp1或其调配物的含义是指rhtpp1或其调配物,例如用于治疗如本文所述的cln2病的rhtpp1或其调配物的医疗用途,或用于制造用以治疗如本文所述的cln2病的药剂的rhtpp1的用途。符合界定可获专利的主题的法律或法规的最广泛合理解释为吾人所需。在不禁止对人体实践的方法授予专利权的权限中,“施用”rhtpp1或其调配物包含对人体实践的方法以及前述活动。
43.本公开案提供包括rhtpp1的调配物和试剂盒以及使用其治疗cln2病的方法。施用rhtpp1允许利用阳离子非依赖型甘露糖6磷酸受体(ci-mpr)的细胞吸收蛋白质,和在整个中枢神经系统中在细胞中定位至溶酶体。酶吸收至溶酶体中和后续活化促进受影响组织中的贮积物质的分解代解增加,减少溶酶体贮积物质的进行性累积,且遏制疾病衰退。本公开案的调配物和方法提供超过当前批准的治疗的治疗效益。
44.调配物
45.关于本公开案,调配物包括一定量的rhtpp1,且在示范性方面中,调配物适用于脑室内、鞘内和/或眼内施用。在一个方面中,rhtpp1包括seq id no:1或其片段。适用于本文所述的调配物和方法的rhtpp1蛋白和获得rhtpp1蛋白的方法描述于美国专利第6,302,685号和第8,277,800号中,其以全文引用的方式并入本文中。
46.在一个方面中,rhtpp1包括seq id no:1的氨基酸序列(图1中所示的氨基酸序列的氨基酸1-544)或具有催化活性的其片段。在另一方面中,rhtpp1包括seq id no:2的氨基酸序列(图1中所示的氨基酸序列的氨基酸177-544)或具有催化活性的其片段。在再一方面中,rhtpp1具有可检测酶活性,或经活体内处理成具有可检测酶活性(即“功能性”)的酶的形式,且与seq id no:1或seq id no:2具有至少约70%的序列一致性。举例来说,功能性rhtpp1与seq id no:1或seq id no:2至少约70%一致、至少约75%一致、至少约80%一致、至少约85%一致、至少约90%一致、至少约95%一致或至少约97%一致。在一个方面中,调配物为液体调配物,其包括约1mg/ml至约100mg/ml,例如约10mg/ml至约50mg/ml、约25mg/ml至约40mg/ml或约30mg/ml至约60mg/ml的浓度的rhtpp1。在各个方面中,调配物包括约1mg/ml至约100mg/ml、约5mg/ml至约80mg/ml、约10mg/ml至约50mg/ml、约20mg/ml至约40mg/ml、约25mg/ml至约35mg/ml、更具体地约1mg/ml、约10mg/ml、约20mg/ml、约30mg/ml、约40mg/ml、约50mg/ml、约60mg/ml、约70mg/ml、约80mg/ml、约90mg/ml或约100mg/ml的浓度的rhtpp1。在一个方面中,调配物的ph为约5.5至约7.5、或约6.0至约7.0,例如约5.5、约6.0、约6.5、约7.0或约7.5。
47.在一个方面中,包括本公开案的rhtpp1的调配物进一步包括一或多种赋形剂,其在脑脊髓液(csf)或眼液中维持关键电解质含量。举例来说,在一个方面中,除rhtpp1或其片段的外,调配物进一步包括约0.01mg/ml至约1mg/ml,例如约0.1mg/ml至约0.5mg/ml、约0.2mg/ml至约0.8mg/ml、约0.2mg/ml至约0.4mg/ml、约0.15mg/ml至约0.25mg/ml或约0.05mg/ml至约0.3mg/ml的浓度的氯化钾。在另一方面中,调配物进一步包括约0.01mg/ml至约1mg/ml,例如约0.1mg/ml至约0.5mg/ml、约0.1mg/ml至约0.8mg/ml、约0.1mg/ml至约
0.3mg/ml、约0.15mg/ml至约0.25mg/ml或约0.05mg/ml至约0.3mg/ml的浓度的六水合氯化镁。在另一方面中,调配物进一步包括约0.01mg/ml至约1mg/ml,例如约0.1mg/ml至约0.5mg/ml、约0.2mg/ml至约0.8mg/ml、约0.15mg/ml至约0.25mg/ml、约0.1mg/ml至约0.3mg/ml或约0.05mg/ml至约0.3mg/ml的浓度的二水合氯化钙。在再一方面中,调配物包括前述内容中的所有或任一种的组合。
48.在另一方面中,包括rhtpp1的调配物进一步包括一或多种缓冲剂。举例来说,在各个方面中,调配物进一步包括约0.01mg/ml至约1mg/ml,例如约0.1mg/ml至约0.5mg/ml、约0.05mg/ml至约0.4mg/ml或约0.1mg/ml至约0.3mg/ml的浓度的七水合磷酸氢二钠;和/或约0.01mg/ml至约1mg/ml,例如约0.01mg/ml至约0.2mg/ml、约0.05mg/ml至约0.3mg/ml或约0.08mg/ml至约0.4mg/ml的浓度的单水合磷酸二氢钠。
49.在另一方面中,调配物进一步包括约1mg/ml至约20mg/ml,例如约1mg/ml至约10mg/ml、约5mg/ml至约15mg/ml或约8mg/ml至约20mg/ml的浓度的等张剂,例如氯化钠。本领域中已知的其它缓冲剂和等张剂为适合的,且可常规地适用于本公开案的调配物中。
50.在一个方面中,包括约30mg/ml的rhtpp1的调配物进一步包括约0.11mg/ml的浓度的七水合磷酸氢二钠、约0.08mg/ml的浓度的单水合磷酸二氢钠、约8.77mg/ml的浓度的氯化钠、约0.22mg/ml的浓度的氯化钾、约0.16mg/ml的浓度的六水合氯化镁、约0.21mg/ml的浓度的二水合氯化钙和稀释剂,例如注射用水。
51.本公开案的rhtpp1调配物稳定,且可存储一段延长的时间而无质量、性能或纯度的不可接受的变化。在一个方面中,调配物在约5℃(例如2℃至8℃)的温度下稳定至少1个月,例如至少1个月、至少3个月、至少6个月、至少12个月、至少18个月、至少24个月或更久。在另一方面中,调配物在低于或等于约-20℃的温度下稳定至少6个月,例如至少6个月、至少12个月、至少18个月、至少24个月、至少36个月或更久。在另一方面中,调配物在低于或等于约-40℃的温度下稳定至少6个月,例如至少6个月、至少12个月、至少18个月、至少24个月、至少36个月或更久。在另一方面中,调配物在低于或等于约-60℃的温度下稳定至少6个月,例如至少6个月、至少12个月、至少18个月、至少24个月、至少36个月或更久。
52.在一个方面中,本公开案的调配物无防腐剂和/或无稳定剂,且因此不含有硫柳汞、苯基汞盐、氯己定、酚、苯甲酸、山梨酸、对羟基苯甲酸酯、醇或常见于非经肠或经眼调配物中的其它防腐剂中的任一种。
53.在另一方面中,本发明的调配物可包括一或多种防腐剂、稳定剂或赋形剂。就此而言,适用于鞘内或icv递送的含有蛋白质的调配物的多种熟知和常规采用的防腐剂、稳定剂和赋形剂为本领域中已知的。更具体地,适用于鞘内或icv递送的进入含有酶的调配物的所述添加剂的实例描述于wo2013/096899中,所述文献以引用的方式并入本文中。
54.方法
55.本公开案提供治疗cln2病的方法,其包括向有需要的个体施用治疗有效量的包括本文所述的rhtpp1的调配物。本公开案还提供用于治疗本文所述的cln2病的包括rhtpp1的组合物和rhtpp1在制造用以治疗本文所述的cln2病的药剂中的用途。在一个方面中,cln2病的严重程度和进展和在患者中施用rhtpp1的治疗效益可使用汉堡或wcmc临床疾病评定量表来测量。汉堡和wcmc量表两者由四个疾病相关域组成,其根据分量表评定评分为0至3分,因此3分为正常,2分为异常但具有功能性,1分为异常且明显功能异常,且0分为无残留
功能。四个域中的两个,步态/运动和语言在两个量表之间共享,且具有高的内部内容有效性。各量表皆检索随疾病进展和疾病管理两者变化而发生的变化。步态、语言和视力量表检索疾病进展。癫痫发作频率、运动障碍和进食视护理决定,具体地抗痉挛药物和饲管管理而定。通常使用聚集语言和步态分量表评估临床进展,因此评定为6分表示基于年龄是正常的,且0分为完全丧失功能。表1描绘wcmc和汉堡cln2病量表。
56.表1
[0057][0058]
在各个方面中,本公开案提供治疗cln2病或cln2病的一或多种临床症状的方法、rhtpp1在制造用以治疗个体的cln2病的药剂或rhtpp1用于治疗个体的cln2病中的用途,所述方法包括向有需要的个体施用包括治疗有效量的rhtpp1的组合物。
[0059]
本公开案还提供预防cln2病的一或多种临床症状的方法,其包括向有需要的个体施用包括本文所述的rhtpp1的调配物,任选地其中所述个体具有cln2病的家族病史。在各个方面中,本公开案提供预防cln2病的一或多种临床症状的方法、rhtpp1在制造用以预防个体的cln2病的一或多种临床症状的药剂或rhtpp1用于预防个体的cln2病的一或多种临床症状中的用途,所述方法包括向有需要的个体施用包括治疗有效量的rhtpp1的组合物,任选地其中所述个体具有cln2病的家族病史。
[0060]
本公开案进一步提供治疗cln2病的方法,其包括以可有效维持有需要的个体的生理功能或减慢或减轻生理功能的恶化的剂量向个体施用rhtpp1,其中生理功能为语言功能、运动功能、视力或进食功能。本公开案还提供rhtpp1在制造用以维持患有cln2的个体的生理功能或减慢或减轻生理功能的恶化的药剂和rhtpp1用于维持患有cln2病的个体的生理功能或减慢或减轻生理功能的恶化中的用途;其中生理功能为语言功能、运动功能、视力或进食功能。
[0061]
在一个方面中,治疗患有cln2病或cln2病的家族病史的个体的方法包括向个体施用可有效维持语言功能或减慢或减轻语言功能的恶化的剂量的rhtpp1。在一个方面中,如使用wcmc或汉堡疾病评定量表所测量,与治疗之前或期间测定的先前评定相比,语言功能恶化降低至少一分。在wcmc和汉堡量表两者中,评定为3分指示语言正常;2分(可辨识地)指示语言异常;1分指示语言很少/几乎不可理解;且0分指示语言听不懂或无法说话。在一个方面中,rhtpp1的剂量有效地将个体的语言评定维持在与治疗之前或期间测定的先前评定相同的水准,例如3分、2分或1分。在另一方面中,rhtpp1的剂量可有效减慢或减轻个体的与cln2相关的语言功能恶化,与考虑到疾病的自然进展所预期相比,此可由将语言评定维持在相同水准一段较长的时间或语言功能评定降低较少来证实。
[0062]
在另一方面中,治疗患有cln2或cln2的家族病史的个体的方法包括向个体施用可有效维持运动功能或减慢或减轻运动功能的恶化的剂量的rhtpp1。在一个方面中,如使用wcmc或汉堡疾病评定量表所测量,与治疗之前或期间测定的先前评定相比,运动功能恶化降低至少一分。wcmc量表中的步态或汉堡量表中的运动的临床评定量表可用于评估运动功能。在wcmc和汉堡量表两者中,评定为3分指示步行正常;2分指示步行异常但不具有依赖性,例如频繁摔倒或明显笨拙;1分指示步行异常,需要辅助,例如无辅助无法步行或只能爬行;且0分指示不可走动/无法移动,例如大多卧床不起的个体。在一个方面中,rhtpp1的剂量有效地将个体的运动功能评定维持在与治疗之前或期间测定的先前评定相同的水准,例如3分、2分或1分。在另一方面中,rhtpp1的剂量可有效减慢或减轻个体的与cln2相关的运动功能恶化,与考虑到疾病的自然进展所预期相比,此可由将运动评定维持在相同水准一段较长的时间或运动功能评定降低较少来证实。
[0063]
在再一方面中,治疗患有cln2或cln2的家族病史的个体的方法包括向个体施用可有效维持视力或减慢或减轻视力的恶化的剂量的rhtpp1。在一个方面中,如使用汉堡疾病评定量表所测量,与治疗之前或期间测定的先前评定相比,视力恶化降低至少一分。根据汉堡量表,评定为3分指示个体认出所期望的物体,且抓住所述物体;2分指示不能协调地抓住物体;1分指示个体对光有反应,且0分指示个体对视觉刺激无反应。在一个方面中,rhtpp1的剂量可有效地将个体的视力评定维持在与治疗之前或期间测定的先前评定相同的水准,例如3分、2分或1分。在另一方面中,rhtpp1的剂量可有效减慢或减轻个体的与cln2相关的视力恶化,与考虑到疾病的自然进展所预期相比,此可由将视力评定维持在相同水准一段较长的时间或视力评定降低较少来证实。
[0064]
在另一方面中,治疗患有cln2或cln2的家族病史的个体的方法包括向个体施用可有效维持进食功能或减慢或减轻进食功能的恶化的剂量的rhtpp1。在一个方面中,如使用wcmc评定量表所测量,与治疗之前或期间测定的先前评定相比,进食功能降低至少一分。根据wcmc量表,评定为3分指示无吞咽功能障碍;2分指示轻度吞咽功能障碍;1分指示中度吞咽功能障碍,且0分指示个体对胃管具有依赖性。在一个方面中,rhtpp1的剂量可有效地将个体的进食功能维持在与治疗之前或期间测定的先前评定相同的水准,例如3分、2分或1分。在另一方面中,rhtpp1的剂量可有效减慢或减轻个体的与cln2相关的进食功能恶化,与考虑到疾病的自然进展所预期相比,此可由将进食功能维持在相同水准一段较长的时间或进食评定降低较少来证实。
[0065]
本公开案进一步提供治疗cln2病的方法,其包括以可有效改善生理功能的剂量向
有需要的个体施用rhtpp1,其中生理功能为语言功能、运动功能、视力或进食功能。本公开案还提供rhtpp1在制造用以改善患有cln2的个体的生理功能的药剂或rhtpp1用于改善患有cln2的个体的生理功能中的用途;其中生理功能为语言功能、运动功能、视力或进食功能。考虑到疾病的逐渐退化性质,尤其期望语言功能、运动功能、视力和/或进食功能有所改善,指示个体已恢复丧失的功能,但用当前的治疗选择难以实现。
[0066]
在一个方面中,治疗患有cln2病的个体的方法包括向个体施用可有效改善语言功能的剂量的rhtpp1。在一个方面中,如使用wcmc或汉堡疾病评定量表所测量,与治疗之前或期间测定的先前评定相比,语言功能改善增加至少一分。举例来说,个体可自评定为1分或2分提高至评定为3分,指示恢复至正常语言,或自评定为1分提高至评定为2分。
[0067]
在另一方面中,治疗患有cln2病的个体的方法包括向个体施用可有效改善运动功能的剂量的rhtpp1。在一个方面中,如使用wcmc或汉堡疾病评定量表所测量,与治疗之前或期间测定的先前评定相比,运动功能改善增加至少一分。举例来说,个体可自评定为1分或2分提高至评定为3分,指示恢复至正常步行,或自评定为1分提高至评定为2分。
[0068]
在一个方面中,治疗患有cln2病的个体的方法包括向个体施用可有效改善视力的剂量的rhtpp1。在一个方面中,如使用汉堡疾病评定量表所测量,与治疗之前或期间测定的先前评定相比,视力改善增加至少一分。举例来说,个体可自评定为1分或2分提高至评定为3分,或自评定为1分提高至评定为2分。
[0069]
在另一方面中,治疗患有cln2病的个体的方法包括向个体施用可有效改善进食功能的剂量的rhtpp1。在一个方面中,如使用wcmc疾病评定量表所测量,与治疗之前或期间测定的先前评定相比,进食功能改善增加至少一分。举例来说,个体可自评定为1分或2分提高至评定为3分,指示恢复至正常吞咽,或自评定为1分提高至评定为2分或3分。
[0070]
本公开案进一步提供治疗cln2病的方法,其包括向有需要的个体以可有效预防或治疗疾病的神经症状的剂量施用rhtpp1,其中神经症状为癫痫发作、脑容量减小、脑灰质减少或颅脑脊髓液(csf)增加。本公开案还提供rhtpp1在制造用以预防或治疗患有cln2或cln2的家族病史的个体的神经症状的药剂和rhtpp1用于预防或治疗患有cln2或cln2的家族病史的个体的神经症状中的用途;其中神经症状为癫痫发作、脑容量减小、脑灰质减少或颅csf增加。
[0071]
在一个方面中,治疗患有cln2或cln2的家族病史的个体的方法包括向个体施用可有效维持或减少癫痫发作次数的剂量的rhtpp1。在一个方面中,所述剂量可有效减少个体经历的每月癫痫发作次数。在另一方面中,如使用汉堡疾病评定量表所测量,与治疗之前或期间测定的先前评定相比,所述剂量可有效地将癫痫发作评定增加至少一分。根据汉堡量表,评定为3分指示3个月内无癫痫发作;2分指示3个月内1至2次癫痫发作;1分指示每月1次癫痫发作;且0分指示每月超过1次癫痫发作。在一个方面中,rhtpp1的剂量可有效地将个体的癫痫发作评定维持在与治疗之前或期间测定的先前评定相同的水准,例如3分、2分或1分。在另一方面中,rhtpp1的剂量可有效维持或减少个体的癫痫发作此时,与考虑到疾病的自然进展所预期相比,此可由将每月癫痫发作次数维持一段较长的时间或癫痫发作评定降低较少来证实。
[0072]
在另一方面中,治疗患有cln2或cln2的家族病史的个体的方法包括向个体施用可有效维持脑容量或减慢或减少脑容量减小的剂量的rhtpp1。脑萎缩随着疾病进展而增加,
使得脑容量损失和颅内csf的体积和相对比例相关联地增加。脑容量可使用本领域中已知的方法测量,所述方法包含成像技术,例如磁共振成像(mri)、计算机断层摄影术(ct/cat)、正电子发射断层摄影术(pet)、单光子发射计算机断层摄影术(spect)、脑电波法(eeg)、脑磁描记法(meg)和近红外线光谱(nirs)。在一个方面中,rhtpp1的剂量可有效地减慢或减少个体的与cln2相关的脑容量减小,与考虑到疾病的自然进展所预期相比,此可由将脑容量维持一段较长的时间或脑容量减小较少来证实。
[0073]
在另一方面中,治疗患有cln2或cln2的家族病史的个体的方法包括向个体施用可有效维持脑灰质或减慢或减少脑灰质减少的剂量的rhtpp1。由于脑萎缩引起的灰质损失随着疾病进展而发生,使得灰质占脑容量的百分比降低。脑中的灰质的量可使用本领域中已知的方法评估,所述方法例如成像技术,例如mri、ct/cat、pet、spect、eeg、meg和nirs。在一个方面中,rhtpp1的剂量可有效减慢或减少个体的灰质减少,与考虑到疾病的自然进展所预期相比,此可由将灰质粒积维持一段较长的时间或灰质减少较少来证实。
[0074]
在另一方面中,治疗患有cln2或cln2的家族病史的个体的方法包括向个体施用可有效维持颅csf的体积或减慢颅csf的体积增加的剂量的rhtpp1。由于大脑萎缩,颅csf的总csf的体积和比例增加。颅csf的量和比例可使用本领域中已知的方法评估,所述方法例如成像技术,例如mri和ct/cat。在一个方面中,rhtpp1的剂量可有效减慢或减少个体的颅csf增加,与考虑到疾病的自然进展所预期相比,此可由颅csf的体积维持一段较长的时间或颅csf占总csf的百分比的较少增加来证实。
[0075]
前述方法、所用组合物和用途可单独和组合地进一步包括以下特点中的任一种。
[0076]
在一个方面中,本公开案的方法、所用组合物或用途包括经至少约1小时,例如至少约1小时、至少约2小时、至少约3小时、至少约4小时、至少约5小时、至少约6小时或更久的时段连续地或不断地向个体施用包括rhtpp1的调配物、组合物或剂量。在另一方面中,本公开案的方法或用途包括向有需要的个体施用包括约20mg至约500mg、约30mg至约500mg、约50mg至约500mg、约100mg至约500mg、约200mg至约400mg、约250mg至约350mg或约275mg至约325mg的rhtpp1,例如约20mg、约30mg、约50mg、约100mg、约200mg、约300mg、约400mg或约500mg的rhtpp1的调配物、组合物或剂量。在一个方面中,本公开案的方法或用途包括施用每剂量或施用事件的体积为约20ml或更少、约15ml或更少、约10ml或更少、约7.5ml或更少或约5ml或更少,例如约20ml、约15ml、约10ml、约9ml、约8ml、约7ml、约6ml、约5ml、约4ml、约3ml、约2ml、约1ml或约0.5ml的调配物、组合物或剂量。
[0077]
在各个方面中,本公开案的方法、所用组合物或用途包括以每小时少于或等于约2.5ml调配物、组合物或剂量、每小时少于或等于约75mg rhtpp1、或每小时每2.5ml调配物或组合物少于或等于约75mg rhtpp1的速率向个体施用包括rhtpp1的调配物、组合物或剂量。任选地经至少约4小时的时段连续地或不断地施用调配物、组合物或剂量。
[0078]
在一个方面中,本公开案的方法、所用组合物或用途包括每周或以更低频率,例如每周、每隔一周或每月施用包括rhtpp1的调配物、组合物或剂量。更具体地,本公开案的方法、所用组合物或用途包括每7天、8天、9天、10天、11天、12天、13天、14天、15天、16天、17天、18天、19天、20天、21天、22天、23天、24天、25天、26天、27天、28天、29天、30天或31天一次施用包括rhtpp1的调配物、组合物或剂量。在一个方面中,脑室内施用调配物、组合物或剂量。在另一方面中,鞘内施用调配物、组合物或剂量。在再一方面中,眼内施用调配物、组合物或
剂量。在一个方面中,脑室内或鞘内以及眼内施用调配物、组合物或剂量。脑室内递送允许渗透至脑深部灰质结构,例如丘脑、纹状体和中脑,此是由于csf流的生理机能,在csf流中脑室递送允许流入第三和第四脑室中,且还经由大脑半球的神经纤维网沿微小压力梯度自脑室渗入蛛膜下空间。鞘内和脑室内施用重组酶以治疗溶酶体贮积病描述于美国专利第7,442,372号中,所述专利以全文引用的方式并入本文中。
[0079]
本公开案的rhtpp1的调配物、组合物或剂量可以单次快速注射或一系列注射(例如至脑、腰部区域或眼睛中)形式、或以连续或持续不断的输注形式,例如使用输注泵或其它植入装置施用。在一个方面中,使用包括管道、管线内过滤器(例如约0.2μm)、储液槽(例如鞘内或脑室内)和导管的输注系统施用rhtpp1的调配物、组合物或剂量。通常,当鞘内或脑室内施用组合物时,为了预防由人为增加的脑内或鞘内压力引起的不利副作用,在施用组合物之前首先自个体去除与待施用的组合物的体积相当的csf的体积。然而,如实例3中所述,本文证实,可在不自个体去除任何体积的csf的情况下在恰好施用rhtpp1的调配物、组合物或剂量之前施用本公开案的rhtpp1的调配物、组合物或剂量。
[0080]
在一个方面中,本公开案的方法或用途包括每隔一周经约4小时的时段向患有cln2的个体脑室内施用约10ml的包括约300mg rhtpp1的调配物、组合物或剂量。
[0081]
本发明的调配物和组合物可向有需要的个体直接施用(即非等容的),或可在自先前的个体去除限定体积的csf之后施用,其中限定体积大致与随后施用的组合物的体积相同(即等容的)。
[0082]
在一个方面中,本公开案的方法、所用组合物或用途进一步包括在施用rhtpp1之后向个体施用冲洗溶液。经由与rhtpp1相同的途径且使用相同递送系统(例如输注系统)施用冲洗溶液以去除递送系统中残留的任何rhtpp1,且确保个体接受完整预期剂量的rhtpp1。在一个方面中,以介于约0.5ml与约5ml之间,例如约0.5ml、约1ml、约2ml、约3ml或约5ml的量向个体施用(例如使用先前用于施用包括rhtpp1的组合物的相同导管)冲洗溶液。在一个方面中,冲洗溶液包括与包括rhtpp1的调配物或组合物相同的组分,但无rhtpp1。在一个方面中,冲洗溶液包括约0.11mg/ml的浓度的七水合磷酸氢二钠、约0.08mg/ml的浓度的单水合磷酸二氢钠、约8.77mg/ml的浓度的氯化钠、约0.22mg/ml的浓度的氯化钾、约0.16mg/ml的浓度的六水合氯化镁、约0.21mg/ml的浓度的二水合氯化钙和稀释剂,例如注射用水。
[0083]
在各种实施例中,输注结束之后,rhtpp1在脑脊髓液中的最大浓度(t
max
)的时间介于4小时与10小时之间。在各种实施例中,rhtpp1在脑脊髓液中的消除半衰期(t
1/2
)介于5小时与20小时之间。
[0084]
儿童个体
[0085]
本公开案还关于治疗个体的cln2病或与cln2病相关的一或多种症状的方法和延缓个体的cln2病或其症状发作的方法,其中示范性个体为儿童个体,例如小于约18岁。在各个方面中,个体小于3岁。在各个方面中,个体小于2岁。在各个方面中,个体小于1岁。在各个方面中,个体大于或为约1月龄至约3月龄、或大于或为约1月龄至约6月龄、或大于或为约1月龄至约9月龄、或大于或为约1月龄至约12月龄。在各个方面中,个体小于或为约12月龄,但为至少或约2周龄、4周龄、6周龄、12周龄或16周龄。在各种情况下,个体小于12月龄,但为至少或约5月龄、6月龄、7月龄、8月龄、9月龄、10月龄或11月龄。在各种情况下,个体为至少
12月龄,但小于或为约24月龄、或小于或为约23月龄、或小于或为约22月龄、或小于或为约21月龄、或小于或为约20月龄、或小于或为约19月龄、或小于或为约18月龄、或小于或为约17月龄、或小于或为约16月龄、或小于或为约15月龄、或小于或为约14月龄、或小于或为约13月龄。在各种情况下,个体小于24月龄,且为至少或约13月龄、或至少或约14月龄、或至少或约15月龄、或至少或约16月龄、或至少或约17月龄、或至少或约18月龄、或至少或约19月龄、或至少或约20月龄、或至少或约21月龄、或至少或约22月龄、或至少或约23月龄。在各种情况下,个体大于或为约24月龄,且小于或为约36月龄、或小于或为约35月龄、或小于或为约34月龄、或小于或为约33月龄、或小于或为约32月龄、或小于或为约31月龄、或小于或为约30月龄、或小于或为约29月龄、或小于或为约28月龄、或小于或为约27月龄、或小于或为约26月龄、或小于或为约25月龄。
[0086]
在示范性实施例中,所述方法包括以有效量向个体施用包括重组人类三肽基肽酶-1(rhtpp1)的调配物,以得到所期望结果,例如治疗cln2病或其症状或延缓cln2病或其症状发作。在本发明所公开的方法的各种情况下,向个体施用约300mg或更少rhtpp1的剂量。在示范性方面中,个体大于或为约2岁,且任选地,向个体施用约300mg rhtpp1的剂量。在各个方面中,个体大于或为约1岁且小于2岁,且任选地,向个体施用约200mg rhtpp1的剂量。在示范性方面中,向个体施用rhtpp1的多种剂量。在示范性方面中,所述方法包括施用初始剂量,随后施用后续剂量。在各个方面中,初始剂量低于后续剂量。在各个方面中,初始剂量高于后续剂量。在各个方面中,初始剂量为约200mg rhtpp1,且后续剂量更高。在示范性方面中,初始剂量为约200mg rhtpp1,且后续剂量高至少50%,例如为至少或约300mg rhtpp1。在示范性方面中,向个体(例如大于或为约1岁且小于2岁的个体)施用的第1、第2、第3和第4剂量中的每一者为约200mg rhtpp1,且向个体施用的第5和后续剂量中的每一者大于约200mg rhtpp1。在示范性情况下,向个体施用的第5和后续剂量中的每一者为约300mg rhtpp1。在各个方面中,个体大于或为约6月龄,且小于1岁,且任选地,向个体施用约150mg rhtpp1的剂量。在各个方面中,个体小于6月龄,且任选地,向个体施用约100mg rhtpp1的剂量。在各个方面中,每2周一次、每两周、每隔一周或约每14天(
±
3天)一次施用调配物。在各个方面中,利用输注以每小时约2.5ml的速率或以更低速率施用调配物。
[0087]
在示范性方面中,基于血液测试,个体,例如儿童个体呈现tpp1酶活性的降低。在示范性情况下,个体,例如儿童个体为诊断患有cln2的个人的兄弟姐妹。在示范性情况下,个体,例如儿童个体不为诊断患有cln2的个人的兄弟姐妹。在示范性方面中,个体,例如儿童个体根据运动和语言分量表的总评分为约3至约6分(例如约3分、约4分、约5分、约6分)。在示范性方面中,根据表1中所叙述的评分,已施用rhtpp1之后的个体的评分更接近与“健康”或“正常”相关的评分。
[0088]
在示范性方面中,个体,例如儿童个体先前未用干细胞疗法、基因疗法或酶补充疗法治疗。在示范性情况下,所述方法包括在施用rhtpp1之前,任选地在施用rhtpp1之前约30至约60分钟,与退热剂一起或不与退热剂一起向个体施用抗组织胺剂。在各个方面中,调配物包括rhtpp1和至少一种药学上可接受的载剂、稀释剂或赋形剂。在各种情况下,调配物为前述调配物中的任一种,包含但不限于包括五水合磷酸氢二钠、单水合磷酸一钠、氯化钠、氯化钾、氯化镁、水合氯化钙、注射用水或其组合的调配物。在各种情况下,所述方法包括在施用调配物之后向个体施用冲洗溶液。在各个方面中,冲洗溶液为本文所述的中的任一种。
在各个方面中,冲洗溶液包括五水合磷酸氢二钠、单水合磷酸一钠、氯化钠、氯化钾、氯化镁、水合氯化钙、注射用水或其组合。在各个方面中,治疗期为至少10周、至少20周、至少40周、至少80周或至少96周。在各个方面中,治疗期长于96周。在各个方面中,所述方法治疗cln2病或延缓cln2病或其症状发作而不引起严重不良事件(sae)。在各个方面中,个体具有icv装置。在各个方面中,所述方法包括将icv装置植入个体体内。
[0089]
试剂盒
[0090]
本公开案进一步提供呈适用于向患者施用的剂量和形式的包括本文所述的rhtpp1的调配物的试剂盒。在一个方面中,试剂盒包括一种调配物,所述调配物包括约30mg/ml的rhtpp1、约0.11mg/ml的浓度的七水合磷酸氢二钠、约0.08mg/ml的浓度的单水合磷酸二氢钠、约8.77mg/ml的浓度的氯化钠、约0.22mg/ml的浓度的氯化钾、约0.16mg/ml的浓度的六水合氯化镁、约0.21mg/ml的浓度的二水合氯化钙和稀释剂,例如注射用水。在一个方面中,试剂盒进一步包括除治疗性调配物的外脑室内、鞘内和/或眼内施用本发明的治疗性组合物的说明书。在另一方面中,试剂盒进一步包括如本文所述的冲洗溶液。在再一方面中,试剂盒进一步包括用于施用调配物的系统,其包括以下组件中的任一者或所有:管道、管线内过滤器、用于植入的储液槽和导管。在一个方面中,试剂盒可包括预负载有本公开案的治疗性调配物的导管、储液槽或其它装置。举例来说,尤其涵盖在药学上可接受的调配物中预负载有约100mg rhtpp1、约200mg rhtpp1、约300mg rhtpp1、约400mg rhtpp1或约500mg rhtpp1的导管。可替代地,试剂盒可包括可再填充的导管、储液槽或其它装置和适当量的用于再填充所述装置的酶。
[0091]
在某些实施例中,本发明的试剂盒可包括以下组件中的一或多种:延伸管线(例如产品编号536040,smiths medical,dublin oh)、管线内过滤器(例如产品编号fs116,smiths medical)、端口针(例如产品编号21-2737-24,smiths medical)、一个注射器或两个或更多个注射器(例如产品编号309604,becton dickinson,franklin lakes,nj)或一个注射器针或两个或更多个注射器针(例如产品编号305196,becton dickinson)。
[0092]
参考以下实例将更容易地理解本公开案,所述实例借助于说明的方式提供且并不打算为限制性的。
[0093]
实例
[0094]
以下实例描述包括用于脑室内(icv)施用的rhtpp1的调配物和与匹配的未经治疗的自然病史患者相比,向人类患者施用调配物的结果。
[0095]
实例1
[0096]
用于脑室内施用的rhtpp1的调配物
[0097]
rhtpp1在基因工程改造的cho宿主细胞系中产生,且利用标准色谱法纯化,如美国专利第6,302,685号和sleat等人.1997,《科学(science)》277:1802-1805中所述,所述文献以全文引用的方式并入本文中。rhtpp1以在吸收至溶酶体中时在酸性ph下发生自体活化的非活性前酶形式产生。rhtpp1之前酶形式的经计算同位素平均分子量为大约59kda。成熟酶的表观分子量为大约46kda。rhtpp1前酶的氨基酸序列阐述于seq id no:1中且示于图1中。酶之前段为前176个氨基酸残基,且成熟酶为长度起始于位置177处的368个氨基酸,且阐述于seq id no:2中。
[0098]
实例中所用的rhtpp1调配物为用于icv输注的无菌溶液。其为透明和无色至淡黄
色的液体,含有以30mg/ml的浓度调配的rhtpp1蛋白。将调配物封装在容器封闭系统中,所述容器封闭系统由用氟聚合物涂布的丁基橡胶塞封闭且用铝密封件封端的1型透明硼硅酸盐玻璃小瓶组成。调配物在-40℃
±
10℃的温度下存储且冷冻供应。调配物的目标ph值为ph6.5。
[0099]
将实例中所用的rhtpp1调配物的组成提供于表2中。
[0100]
表2
[0101][0102]
rhtpp1调配物谨慎地经设计以模拟人类csf的特征,例如关键电解质的浓度与人类csf中活体内发现的浓度类似,且调配物不含任何常规防腐剂或稳定剂作为赋形剂。在施用rhtpp1调配物之后未报道或观测到安全性问题,即严重不良反应,其可能为以前无法预测的。
[0103]
根据ich指南和按照方案,在长期(≤-60℃)和加速条件(5
±
3℃)下进行稳定性研究以监测时间-温度稳定性。稳定性样品存储于由与全尺寸封装相同的材料构成的小尺寸瓶中。在支持性和临床批次上收集的稳定性数据证实,rhtpp1调配物在≤-60℃下稳定至少36个月,且在5
±
3℃下稳定至少6个月,考虑到调配物缺乏常见于医药产品中的防腐剂和稳定剂,此是出人意料的。表3展示稳定性测试的结果。
[0104]
表3
[0105][0106]
实例2
[0107]
自然病史研究
[0108]
在41名未经治疗的cln2患者群组中分析了cln2自然病史疾病进展的定量评估。汉堡临床量表用于评估受疾病影响的年龄适当的神经和功能域。
[0109]
未经治疗自然病史cln2个体中的临床衰退的定量描述展示于图2中。自然病史分析证实年龄与疾病严重程度的清楚的和可预测的关系。运动和语言症状发作之后,基本上呈快速线性衰退趋势,其中儿童平均每年损失约2个里程碑事件(线性速率为每年衰退2.1分)。存在很大程度上可预测病程,但仍有一些
‘
晚发型’病例,其占群组中的群体的少于20%。这些患者往往具有较晚发作的症状和较长时间段的轻度疾病,但随后死于快速和主
动衰退,通常比典型形式晚2至3年。
[0110]
通过叠加来自wcmc的非依赖型(患者和评分员)群组(n=49)的临床等级评估证实来自汉堡群组的定量临床进展。尽管非依赖型cln2群组的临床描述类似,但此为不同患者组中的疾病进展中的强力定量关系的首次确认。两个群组的cln2患者均具有绝大部分的典型晚期婴儿发作和进展,和较小比例的具有
‘
晚发型’表达型的儿童,通常在5岁而非3岁具有早期疾病表达。使用运动(步态)和语言功能的量表可再现地检索cln2患者的神经衰退。基于前述分析,确定自然研究个体的群组为适当的非治疗对照群体,此未经治疗的自然病史群体中的cln2病的症状衰退的平均速率可用作用于由施用本发明组合物引起的罹患cln2病的个体的症状的衰退速率的任何预防或降低的有效和提供信息的比较例。
[0111]
实例3
[0112]
cln2患者的第1阶段/第2阶段开放标记剂量递增研究
[0113]
研究为用以评估每隔一周以300mg(10ml总体积)的剂量经由icv导管递送至患有cln2病的儿童的本公开案的rhtpp1调配物的安全性、耐受性和功效的开放标记治疗临床试验。研究经设计以评估以低剂量(30mg和100mg)起始的安全性和耐受性,但当非依赖型数据监测委员会指出较低剂量是安全的时,所有患者递增至高的预期治疗剂量(300mg)。所有登记的患者的研究持续时间在每隔一周300mg icv的稳定预期治疗剂量下治疗48周。主要研究目标为评估利用植入的icv储液槽和导管向患有cln2病的个体施用的本公开案的rhtpp1调配物的安全性和耐受性,且治疗12个月之后与自然病史数据进行比较,使用cln2病特异性评定量表评分评估有效性。次要研究目标为治疗12个月之后与cln2病自然病史数据进行比较,评估治疗对脑萎缩的测量的影响。
[0114]
主要纳入标准为cln2诊断和登记年龄为至少3岁。在筛选时基线疾病评定评分小于3(使用汉堡0至6聚集运动/语言量表)的患者排除在研究的外。如由进展曲线上水平线描绘,小于3岁的患者有可能由于年龄而非治疗而无进程。在筛选时评分为2或更低的患者还较不线性、更可变,且由于疾病阶段而可能被视为更难以治疗。因此,仅由年龄和评分界定治疗组以包含早期和高度可预测衰退。
[0115]
登记的平均年龄4.0岁,女孩比男孩略多,主要为白种人。筛选时和基线的临床cln2评分展示于下表4中,其展示各研究群组的汉堡运动/语言评分和筛选和基线的总分。
[0116]
表4
[0117][0118]
总体而言,治疗前cln2评分偏向于更晚期的疾病。考虑到所述疾病的快速发展和确认困难,预期评分会偏低。此外,筛查时以及基线评估(恰好在放置icv储液槽之前)期间(最多两周)的评分有所下降。筛选组中有4名评分为3的患者在基线降低了一分,且筛选组中有两名评分为4的患者在基线损失至3分。以6岁(即大体正常)进入的两名患者为受影响儿童的兄弟姐妹。下表5中概述了个体群体的部署、人口统计数据和特征。
[0119]
表5
[0120][0121]a登记的患者1287-1007由于不能遵守研究程序而接受单次剂量且撤回了同意书。
[0122]b与自然病史群体的分布类似
[0123]
*
一般基因型:c.622c》t和c.509-1g》c
[0124]
所有登记的患者每隔一周接受300mg icv的稳定给药。群组1每隔一周在30mg icv下暴露≥1个月,随后上升至每隔一周100mg icv达≥4周,而群组2开始接受每隔一周100mg icv达≥4周。群组1和群组2两者上升至每隔一周300mg icv,且包含群组3的所有后续患者均开始每隔一周以300mg icv的稳定剂量方案给药,且持续≥48周。300mg剂量经由icv导管经约4小时的时段以10ml输注的形式施用。恰好在开始输注之前不去除一定体积的csf,例如等于待施用的rhtpp1调配物的量,此为非典型的,但意外地并未引起任何不良效应。在施用300mg剂量之后立即经由同一icv导管向个体施用约2ml的量的冲洗溶液。冲洗溶液与表2中的调配物一致,但不含rhtpp1。每次施用事件的酶的300mg的单次剂量明显高于先前鞘内或icv施用的酶置换疗法,且因此以前可能无法预测施用如此高的剂量的药物之后观测到的安全性和功效概况。更具体地,以前可能无法预测到施用300mg单次剂量的rhtpp1而无相关的严重、不可管理的不良事件。
[0125]
结果
[0126]
治疗对步态和语言的临床评估的效应:定量评估临床严重程度的主要评估工具为两种汉堡和wcmc疾病评定量表所共享的步态和语言分量表的0至6分聚集。此量表在匹配的未经治疗的自然病史患者中检索可预测、快速和进行性临床衰退,其用作主要功效分析的比较例。
[0127]
治疗持续时间超过42周的23名患者的步态/语言疾病评定评分展示于图3a至3f中。在此23名患者中,3名患者(1244-1001、1244-1002和1244-1003)来自群组1(c1),3名患者(1244-1004、1244-1006和1287-1005)来自群组2(c2),3名患者(1244-1008、1244-1009、1244-1010)来自群组3(c3),且14名患者(0119-1020、0146-1021、0146-1022、0146-1023、1244-1011、1244-1012、1244-1017、1244-1024、1323-1013、1323-1014、1323-1015、1323-1016、1323-1018和1323-1019)来自300mg仅稳定给药(sbo)组。正如预期的,语言缺陷通常比步态缺陷更提前。进入评分不为随机分布的;12名患者的疾病进展显著,组合进入评分为3分,且2名患者的组合进入评分为6分。考虑到快速进展和疾病确认,儿童经常表达出明显的衰退或表达为明显衰退的那些的兄弟姐妹。
[0128]
在用本公开案的rhtpp1调配物(示于上表2中)治疗后,如图3a至3f中所示,cln2步态/语言疾病评定评分稳定。23名患者中有十一名在治疗期内未出现不可逆转的衰退。四名患者在治疗早期出现单一单位衰退,但此后没有不可逆转的衰退。两名患者(1244-1008和1323-1013)在筛选与基线之间自3分至2分,降低了一个单位,但在治疗期间在评定中未经历任何额外损失。基于结果,与群组(起始剂量)或进入评分无关,所有患者中出现显著治疗效益。在许多患者中,评定下降有逆转。举例来说,患者1287-1005(图3b)的评定在治疗的第一个月内下降了2个单位,此表示步态和语言两者的功能丧失。然而,此患者在第60个治疗日恢复一个单位,且之后无净变化直至第440个分析日。恢复的评分为语言的获得,强调了单个单位变化的临床重要性。
[0129]
进入时评分为6的2名患者均不损失一个评定单位。进入评分为3的12名患者中有7名未出现不可逆转的衰退,且初始单一单位衰退之后有2名稳定。因此,治疗效益在具有显著缺陷和疾病进展的患者中很明显。
[0130]
如cln2自然病史研究所证实,未经治疗的自然病史群体中的衰退中值速率据估计
为每年2.1个单位。因此,治疗组中的所有患者与未经治疗的自然病史群体的预期结果相比评定得到改善。
[0131]
为了在经治疗患者与匹配的未经治疗的自然病史患者之间建立更清晰的疾病病程关系,利用基线cln2评分、年龄和基因型的参数使各研究患者与未经治疗的自然病史患者匹配。尽管预测cln2病的进展无清楚的子组或因素,但这些参数最常用于界定疾病严重程度。个别经治疗患者与在基线具有类似步态/语言评定评分的自然病史群组的各成员进行比较,如图4a至4i中所示。研究中的患者利用基线cln2评分进行匹配,如下:对于具有给定基线评分的给定研究患者,鉴别报道一或多个具有相同cln2评分的cln2评估的所有自然病史患者。如果研究患者的基线cln2评分为2、3、4或5,那么各自然病史患者的cln2对比时间概况随左时移或右时移,以使得其与研究患者的基线评分重叠。如果自然病史患者具有等于研究患者的基线cln2评分的多个评估,那么多个评估的中间时间点用于时移。如果研究患者的基线cln2评分为6分,那么6分的自然病史患者的最后评分用于时移。敏感性分析使用其它匹配的标准进行,且来自这些分析的结果与评分匹配的分析一致。
[0132]
图4a至4i显示来自用本公开案的rhtpp1调配物治疗的个体的结果,其针对匹配的未经治疗的自然病史患者进行绘制。经治疗个体和未经治疗的自然病史患者利用疾病评定评分,使用0至6个单位步态和语言分量表作为聚集进行匹配。在一年的治疗期内比较各评定。与匹配的未经治疗的自然病史患者组的所有成员相比,接受rhtpp1的个体有治疗效益。治疗120天之后个体1244-1001(图4a)的评定自3个单位降低至2个单位,但恢复了一个单位,且之后无净变化。个体1244-1002(图4b)的评定自3个单位增加至4个单位,自4个单位降低至2个单位,且自2个单位增加至3个单位,使得在研究结束时与第1天相比疾病评定总体维持不变。个体1244-1003(图4c)和1244-1010(图4i)在整个研究中维持6个单位的评定,即正常运动和语言功能。个体1244-1004(图4d)和1244-1009(图4h)在整个研究中维持3个单位的评定。个体1244-1006(图4e)的评定首先自3个单位降低至2个单位,但在再一次自3个单位降低至2个单位之前恢复一个单位,之后无净变化。个体1244-1008(图4g)的评定首先自3个单位降低至2个单位,之后无净变化。
[0133]
与所有经治疗个体相反,在比较期结束之前,其匹配的未经治疗的自然病史患者中的大部分的不可逆转的评定自3个单位降低至0个单位,指示完全丧失经组合的步态和语言功能。匹配的分析证实,维持其疾病评定评分且还具有初始评定下降,但随后稳定的那些患者的治疗效益。
[0134]
最复杂的反应(个体1287-1005)展示于图4f中。尽管此患者在研究的第一个月内快速下降2个单位,自3分的基线评分至1分的研究评分,但患者能够恢复一个单位且稳定在2分。通过比较评分匹配的未经治疗的自然病史患者阐明此病程的解释。临床进程在18名评分匹配的未经治疗的自然病史患者的15名中更糟,且仅在2名评分匹配的未经治疗的自然病史患者中相同(单次未经治疗的自然病史匹配不可评估)。未经治疗的患者中的临床病程始终在恶化,通常在损失的里程碑之间几乎没有时间。损失的功能和后续稳定性从未重新建立。因此,与最复杂的经治疗概况匹配还指示明显的治疗效益。
[0135]
图5显示与研究个体相比,对于患者匹配的治疗持续时间在匹配的未经治疗的自然病史患者中的自基线的临床变化的分布。如前所述,9名患者中有7名(》75%)的基线疾病评定量表没有变化。对于治疗期间的此7名患者,所有匹配的未经治疗的自然病史患者下降
至少一个单位,但更常见的为多个单位下降或2个单位至4个单位下降。作为一实例,患者1244-1001具有损失单分的1个匹配、损失2分的3个匹配和损失可获得的语言/步态疾病评定的所有3分的14个匹配。因此,在相同时间段内,经治疗的患者没有变化,但18名匹配的未经治疗的自然病史患者中有14名(》75%)损失所有步态和语言功能。存在基线进入评分为3分的下限效应,其中许多匹配的未经治疗的自然病史患者损失所有可获得的评定单位,但2名进入评分为6分的患者(患者1244-1003和1244-1010)重要地显示,这些匹配也在主动地降低,其中一些在治疗期降低4分和5分。这一观察明确地临床证实了实质性治疗效果;大多数经治疗儿童在未经治疗的自然病史匹配的情况下保留进入临床评定,其在相同时间段内主动地损失语言和非依赖性步态,许多人完全丧失功能。其余2名损失单分的经治疗的患者(个体1287-1005和1287-1006)在治疗期比起绝大部分匹配仍具有优选临床评定。总体而言,在评分匹配的未经治疗的自然病史患者中,97%的评分比经治疗个体更糟。
[0136]
使用多个匹配标准(例如,基线、年龄和基因型),与匹配的未经治疗的自然病史患者相比,近100%的比较显示出有利的治疗效应。与自然病史患者相比,所有经治疗的患者中匹配标准的平均治疗差异视所用匹配标准而定介于1.9至2.1分之间。
[0137]
图9a显示经治疗≥48周的患者(n=21;虚线)和自然病史群组(n=41;实线)的运动-语言评定的平均变化。经治疗患者的疾病评定的平均下降为0.43(标准差0.839),在48周内中值下降为0.00个单位。相比的下,自然病史群组的疾病评定中的平均下降为2.09(标准差0.966),在48周内中值下降为1.87个单位。总体而言,经治疗患者的预期临床衰退显著减少(p《0.0001)79%。图9b展示在≥48周时,第一次300mg剂量(基线)至最后一次300mg剂量之前最后一次测量的患者(n=23)的运动-语言评分的变化。总体而言,65%(23名中有15名)的患者在治疗期间好转或无临床疾病进展,且87%(23名中有20名)的患者与来自自然病史研究的未经治疗的个体相比在治疗期间表达更优选(即评分改变-1或更多)。这些分析一致地支持以下结论:与快速和可以预见地衰退的未经治疗的自然病史组的匹配成员相比,经治疗的患者中有cln2评分的显著和临床上有意义的稳定性。
[0138]
治疗对视力临床评估的影响:在未经治疗的cln2患者中,视力丧失发生的时间要晚于语言和步态的衰退,但一旦出现症状,病程可以预见地快速且发展为失明。因此,保留视力为重要治疗结果。视力丧失可以在0至3分的分量表上以与其它分量表类似的方式检索,其中3为正常,且0为功能性失明。在治疗期间,大多数经治疗的患者在视力分量表域内均未发生不可逆转的丧失。当使用步态、语言和视力分量表(0至9个单位)的量表组合按评分、年龄和基因型将经治疗的患者与未经治疗的自然病史个体匹配时,很明显,与治疗组的相比,未经治疗的匹配的自然病史患者会损失额外分。
[0139]
图6a至6i显示来自用本公开案的rhtpp1调配物治疗的九个个体的结果,其使用0至9个单位步态、语言和视力分量表作为聚集按疾病评定评分针对匹配的未经治疗的自然病史患者进行绘制。个体1244-1001(图6a)的评定自6分至5分降低一个单位,但随后立刻恢复一分成评分为6,之后无净变化。个体1244-1002(图6b)的评定自5分增加至6分,随后自6分降低至4分,随后自4分增加至5分,使得与第1天相比在研究结束时疾病评定总体维持不变。个体1244-1003(图6c)和1244-1010(图6i)在整个研究中维持9分的评定,指示步态;语言功能和视力正常;个体1244-1004(图6d)和1244-1009(图6h)在整个研究中维持6分的评定,且个体1244-1008(图6g)在整个研究中维持5分的评定。个体1244-1006(图6e)的初始评
定自6分至5分降低一个单位,随后再次降低至4分,但恢复一个单位至评定为5分,此后无净变化。个体1287-1005(图6f)的评定自6分降低至4分,随后自4分增加至5分,且降低至4分,但再次恢复一个单位,至最终评定为5分。
[0140]
在治疗期间,增加视力分量表不会使得九名经治疗的患者发生变化。然而,评分匹配的未经治疗的自然病史患者的视力丧失对聚集评分的贡献很大。与经治疗患者相比,有多个未经治疗的自然病史匹配,差异大于3分,表明在研究期间视力衰退对聚集评分的贡献。因此,添加视力分量表会增大经治疗患者与匹配的未治疗的自然病史患者之间的差异。由于在匹配的未经治疗的自然病史患者中无疾病评定单位的不可逆转的损失,因此与阻止疾病进展和稳定功能有关的rhtpp1的治疗效果的观察可以自运动/步态和语言延伸至包含视力的临床域。
[0141]
治疗对总疾病评估的影响:在研究过程中,还使用含有完整汉堡或wcmc评分的组合的12分量表对患者进行评估。12分量表的评分为(1)运动/步态、(2)语言、(3)癫痫发作/肌阵挛和(4)视觉/进食的患者个人评分的总和。图10a至10l显示使用0至12个单位的组合汉堡(左图)和wcmc量表(右图)用本公开案的rhtpp1调配物治疗的个体的结果。23名患者中有十六名根据至少一个量表无不可逆转的衰退,且8名与基线相比在治疗期结束时根据至少一个量表评分增加,证实了接受rhtpp1的患者的总体治疗效益。
[0142]
治疗对脑容量的影响:mri用于评估经治疗患者的次要终点。疾病过程的特征在于萎缩、细胞损失和信号异常。这些参数单独地或作为综合评分与患者年龄和疾病评定评分相关。因此,普遍认为疾病进展与萎缩的mri指数相关,且已显示多种mri参数与cln2病的年龄和疾病严重程度相关(dyke等人,《美国神经放射学杂志(ajnr am j neuroradiol.)》2013;34(4):884-9);(paniagua等人,《临床神经放射学(clin neuroradiol.)》2013;23(3):189-96)。支持这些结论的成像数据库是基于大量患者的横截面相关性,然而,患者内无mri图像的纵向采集。因此,不能同样匹配纵向研究衍生的mri分析与类似衍生的自然病史数据库。
[0143]
为了分析经治疗的患者,在研究点的整个硬件平台上对mri采集参数进行标准化。数据为在本地获取的经过编辑的识别信息,且已传递到中央成像核心实验室。将图像随机化,以使独立放射科医生不了解患者或与基线的时间关系。脑容量的变化自随机独立的中央读数重构。分析数据以将研究与经治疗群体的基线进行纵向比较。图7显示经治疗患者的mri测量的脑容量的概述。脑萎缩导致颅内csf体积和比例更大。这些萎缩测量的增加与cln2患者的年龄和严重程度相关。经治疗患者的csf体积和比例的纵向图指示,csf参数的测量还似乎几乎无变化(如果存在)。所有患者的mri容测量定法均呈现恒定且与评定评估的稳定性一致。
[0144]
图8a至8l示出在经治疗患者中脑容量的纵向mri评估。cln2患者的活动性神经退化的特征在于灰质大量损失和csf补偿性增加。然而,在评估期间,经治疗患者的脑容量非常稳定,且无证据表明存在神经退化过程。在图8a至图8l中以上图和下图中的各者中的csf和灰质曲线(虚线)与csf曲线(实线)之间的差异展示,经治疗患者中的各者的灰质粒积在整个研究中均保持稳定。与在≥48周的治疗后的最后一次观察相比,第一次300mg输注(基线)之前的最后一次测量得出的皮质灰质粒积占总脑容量的百分比的变化示于下表6中。
[0145]
表6
[0146][0147]
在4-12岁的正常儿童中,皮质粒积的纵向变化为每年-1%,但对于未经治疗的cln2患者为每年-12.5%。在用rhtpp1治疗期间,csf、灰质和白质的体积保持相对恒定,从而减少89%的与疾病相关的皮质粒积损失。
[0148]
不良事件:一名患者由于无法遵守方案而退出研究。其余23名患者留在研究中,且经由icv途径耐受用rhtpp1药品进行的治疗。没有因安全性相关的原因导致死亡、治疗相关的退出或研究中断。与装置植入的最小影响一致,所有患者均在手术一周内给药。在总共325次输注中,仅有5次(1.5%)由于任何原因中断,其中仅有2次(0.6%)由于与不良事件相关的原因而中断。在研究中观察到的最常见的非cln2病相关不良事件为发热、过敏和上呼吸道感染(各自占个体总体的25%)。通常,这些事件是轻度的、自身限制的且在医学上得到管控。研究者定义的过敏事件与极少周围表达相关,且利用退热剂、抗组织胺和/或类固醇的组合进行医学管控。实验室数据证实,周围实验室中缺乏临床相关变化。在脑脊髓液中,一些患者出现轻度、短暂的脑脊髓液细胞增多,而csf葡萄糖或蛋白质中无变化。总的,对安全性参数的评估证实,在所有患者中均可以耐受经由icv输注用本公开案的rhtpp1调配物进行的治疗。
[0149]
结论
[0150]
临床研究证实,每位治疗暴露超过36周的患者均具有显著的临床效益,其特征为完全遏制cln2病的进展,此构成了最大的治疗效益,因为在时间范围内对于具有中度进展和活动退化的患者不预期功能获得。
[0151]
当基于多个参数(包含基线疾病评定、年龄和基因型)将患者与自然病史数据库的成员进行匹配时,此发现甚至更加令人信服。此匹配公开,在用rhtpp1药品治疗时,所治疗个体经历了停止的疾病进展的同一时间段,匹配的未经治疗的自然病史患者经历了显著的功能丧失。因此,与匹配的未经治疗的自然病史患者中的活动性疾病进展相比,所有经治疗患者均显示出疾病进展的遏制。根据可获得的自然病史数据,未经治疗的自然病史群体的中值衰退速率据估计为每年2.1分,每个衰退单位代表生理功能的显著里程碑损失。对于大多数进入研究的患者,保留2个单位意味着继续独立行走且具有有意义的交流。
[0152]
总体而言,结果证实,本公开案的rhtpp1调配物和治疗方法具有可接受的安全性/耐受性概况。无个体由于不良事件而中断研究或治疗。一名个体由于无法遵守方案,在一次治疗剂量后退出研究。pk和免疫原性的分析公开高cns传递,且在csf中无抗体形成。
[0153]
前述实例证实,本文所述的包括rhtpp1的调配物和方法可有效预防或治疗cln2病和/或cln2的一或多种临床症状。在临床病程的特征在于快速、无法改变和不可逆的神经退化性疾病进展的疾病中,尤其在每一经治疗的患者中,疾病进展停止为显著且出人意料的临床效益。
[0154]
实例4
[0155]
此实例描述第2阶段开放标记研究,以评估包括rhtpp1的调配物用于患有cln2病的小于18岁的儿童患者的脑室内施用的安全性、耐受性和功效。
[0156]
研究目标
[0157]
此研究的主要目标包含以下:(1)评估经由脑室内(icv)装置施用的tpp1的安全性和耐受性,以及(2)评估作为cln2运动-语言临床量表的进展延缓的治疗效力。
[0158]
此研究的次要目标包含以下:(1)评估csf和血清中的免疫原性,(2)评估疾病进展的mri参数,和(3)评估治疗对总汉堡临床评定量表的影响。
[0159]
此研究的探索性目标包含以下:(1)评估发育成就,(2)评估异常非自主运动,(3)使用光学相干断层扫描技术(oct)评估视网膜解剖结构,(4)确定癫痫发作、类型和频率,(5)评估生活质量度量,和(6)分析来自csf和血浆的假定分子生物标记。
[0160]
研究计划:总体研究设计和规划
[0161]
此将为对cln2病患者的第2阶段开放标记研究,所述患者已证实cln2基因突变和tpp1活性受损。包括rhtpp1(在本文中称为“tpp1”)的调配物将利用icv输注每两周施用。由于实际和道德问题排除了同时或未经治疗的对照个体,因此可以将发现与现有cln2病注册的病史数据和/或来自兄弟姐妹的数据(视需要)进行比较。由图11中的访问提供事件的概述。
[0162]
研究适用性将在个体入院进行手术植入icv进入装置之前(≤21天)确定。收集临床评分和临床实验室参数的基线访问将在第一次输注之前不超过两天完成。
[0163]
此研究的计划登记至多为5个个体。有资格登记入此研究中的患者必须具有cln2诊断确诊的兄弟姐妹,所述兄弟姐妹登记入实例3中所述的先前研究。自第一次输注的日( 3天)起,每14天向所有个体施用一定剂量的tpp1(300mg)达至少96周。在试验过程期间,可以通过降低至150mg和/或通过降低输注速度来使给药适用于研究者对不良事件的判断。
[0164]
将需要此研究中的患者以手术方式植入icv储液槽以用于施用tpp1。在所述程序之前将进行mri,以确保正确规划和放置icv进入装置。术后48小时将在护理密集型环境中严密监测患者。在放置icv进入装置后,将向个体和其护理人员提供书面说明书,其提供有关装置并发症的病征和症状的详细信息,以及有关何时返回研究点以进行装置评估的指示。住院患者出院48小时内将再进行一次随访电话呼叫。
[0165]
第一次输注将在自植入icv储液槽的手术起至少14天,且在手术后不超过28天进行。此后,自第一次输注的日( 3天)起,每两周
±
3天进行研究访问。一般来说,功能和qol评估应在mri和采样之前,而mri和采样应在输注之前;给个体服镇静剂以进行mri时,可进行样品收集。如果个体过早中断研究,那么应在3天内安排提前终止访问。
[0166]
对于所有输注,自开始输注起至少要在24小时内将在住院患者环境中监测个体。仅对于第一次输注,个体还将在输注开始后72小时返回诊所进行随访访问。在所有访问之后,将在48小时内致电父母或法定监护人以确定健康状况。
[0167]
将在每次输注前30(
±
5)分钟内、每次输注期间每60(
±
5)分钟以及每次输注后1和4小时(
±
5分钟)测量生命体征。对于第一剂量,将在输注开始(或重新开始)之前30(
±
5)分钟内、输注期间每30(
±
5)分钟、输注结束后0.5和1小时(
±
5分钟)以及直至出院每4小时(
±
15分钟)测量生命体征。
[0168]
将使用cln2运动-语言临床评定量表来测量功效。将收集汉堡0至12分cln2总量
表。其它次要功效测量将包含发育状况、癫痫发作频率、非自主运动以及视网膜解剖结构和生活质量度量。治疗的安全性和耐受性将通过收集不良事件(ae)、身体发现、生命体征、ecg、eeg和临床实验室测试来评估。研究人员将评估ae的严重程度、严重性以及与研究药物和/或icv进入装置的关系。
[0169]
由于过敏反应可能与ert施用有关,因此应在输注前约30分钟用年龄适合的剂量的抗组织胺(以及如果适宜退热剂)对个体进行预治疗。根据机构的标准操作,在tpp1输注之前约30分钟,研究者可以酌情使用年龄适合的镇静药物对个体进行预治疗。
[0170]
研究药物输注的时间关系将用于界定tre。此应与输注反应的临床评估相区别。因此,将在tpp1输注开始或重新开始的24小时内发生的不良事件定义为tre。
[0171]
输注后24小时时段内发生的某些事件可为过敏介导的。过敏反应的特征为暴露于过敏原后产生不利的局部或全身反应。过敏反应的症状可包含发烧、发冷/寒战、皮肤症状(荨麻疹、血管性水肿、皮疹)、呼吸系统症状(呼吸困难、喘息、喘鸣)、胃肠道症状(恶心、呕吐、腹痛)和/或心血管变化(低血压/高血压)。
[0172]
在严重的情况下,还可能发生重度过敏(全身性过敏反应)。重度过敏为最严重的过敏反应形式,其中在输注期间或数小时内可能出现症状;如果重度过敏未经治疗,那么可能会导致死亡。
[0173]
重度过敏的症状可能包含皮肤和/或黏膜组织受累(例如,全身性荨麻疹、瘙痒或面红、嘴唇-舌-腭舌肿胀)、呼吸困难(例如,呼吸困难、喘息-支气管痉挛、喘鸣、呼气峰流量减少、低氧血症)以及血压降低或末梢器官功能障碍(例如,低张症、晕厥、失禁)。
[0174]
迄今为止,tpp1研究尚未出现重度过敏或类重度过敏反应。然而,如果怀疑有重度过敏反应,严重的过敏事件或严重的过敏(定义为3级或更高的过敏事件),那么将在事件1小时内收集血液样品以评估c4、血清类胰蛋白酶和总ige;为了评估药物特异性ige,将在事件发生后不超过8小时(或下次输注之前)收集血液样品。
[0175]
另一可能的ae为自留置icv导管的感染。如果怀疑感染,那么将抽取血液和csf样品进行评估。后续治疗过程可包含抗生素疗法和导管重置或撤回。如果暂停tpp1治疗,那么在最后一次给定剂量后连续错过的剂量不超过4次的情况下,tpp1可能恢复。
[0176]
研究规划的评估安排将提供于图11中。
[0177]
筛选
[0178]
在进行任何与研究相关的程序之前,父母或法定监护人将为符合研究条件的患者提供知情同意书。将评估患者以确定其是否满足研究进入标准(实例5),且为适合植入icv进入装置的候选者。通过tpp1酶活性(干血斑)确定的cln2病的诊断应在筛选时可用。无论此基因型信息是否可用,在筛选访问时均将收集血液以用于cln2基因分析。另外,在筛选访问时将收集用于tpp1酶活性的血液(干血斑)且进行集中分析。筛选程序应在icv储液槽植入手术之前≤21天完成。
[0179]
如适于个体,cln2评定量表将全面进行。评定评估指南提供关于评定量表评估的详细指示,且imaging charter(参见丹佛发育量表ii(denver development scale ii))提供关于利用集中式设施进行的mri评估的指示。另外,将进行完整身体检查。
[0180]
手术和第一剂量
[0181]
研究个体将被送往医院,以便在右半球的侧脑室中手术植入mri相容性icv进入装
置;手术和麻醉将在神经外科医生的指导下进行(有关相容性icv储液槽和导管,请参考《研究药剂手册(study pharmacy manual)》)。手术前将进行mri,以确保正确规划和放置icv进入装置。一般来说,手术和术后护理将由研究中心的护理标准和个体的特定临床需要决定。将在护理密集型环境中对个体进行至少48小时的术后监测。在放置icv进入装置后,将向个体和其护理人员提供书面说明书,其提供有关装置并发症的病征和症状的详细信息,以及有关何时返回研究点以进行装置评估的指示。住院患者出院之后48小时内将再次进行随访电话呼叫。
[0182]
第一次输注将在自植入icv储液槽的手术起至少14天,且在手术后不超过28天进行。在第一次(和后续的每次)研究药物施用下,研究者将评估储液槽的通畅性、位置和皮肤完整性。使用严格的无菌技术进行装置接入。检查覆盖储液槽的皮肤的适当针头插入部位。针头插入部位必须为完整的,无破裂、伤口、感染或皮疹的迹象。所用针头为小规格的未开孔尖端。一旦接入储液槽,那么将针头固定,以确保移动或去除风险最小。《研究药剂手册》中提供了用于评估储液槽装置关于渗漏和置换的指南。根据研究者和/或神经外科医生的判断,可以在临床研究期间置换储液槽。
[0183]
讨论研究设计,包含对照组的选择
[0184]
此研究必须在患有cln2病的患者中进行,因为icv进入装置植入或tpp1自身免疫性的潜在发展以及其未知的长期健康后果对于健康志愿者而言是可接受的风险。然而,在几年内几乎肯定有严重的残疾和死亡可以平衡患者群体中的这些风险。
[0185]
cln2病的诊断通常基于酶活性的分析,其将为参与此研究所需的。通过tpp1酶活性(干血斑)确定的cln2病的诊断应在筛选时可用。无论基因型信息是否可用,在筛选访问时均将收集血液以用于cln2基因分析。
[0186]
由于cln2病在儿童时期为致命的,因此研究群体必须为儿童。由于在晚期cln2病中不太可能获得治疗效益,考虑到皮层神经元的大量消耗,参与研究需要缺乏大量的cln2病进展,导致研究群体与tpp1基因疗法研究的研究人群相当(worgall,2008,《人类基因疗法(hum.gene ther.))。安全性评估在基本上处于营养状态的晚期患者中还将受到限制。所述研究限于1岁或更大的受影响儿童。
[0187]
研发出临床评定量表:汉堡量表以记录cln2病的自然病史(steinfeld,2002,《美国医学遗传学杂志》)。
[0188]
尽管汉堡评定量表的所有四个域均将完成(图12),但运动和语言域对此研究最为有用。语言和运动是最早丧失功能的域,因此,聚集cln2运动-语言量表是用于功效的适当度量。效力终点将比较经治疗研究个体与未经治疗的患者的运动和语言分量表评分,所述评分自cln2病注册的自然病史数据和/或视需要来自兄弟姐妹的数据中获取。
[0189]
评定量表中的其余两个域(图12)不太可能为此研究提供信息。为了更详细地检索cln2病的癫痫发作和运动障碍表达,将来自统一巴氏病(batten disease)评定量表(ubdrs)的适应域并入方案中。ubdrs域根据类型、频率和严重程度记录非自主运动和癫痫发作(kwon,2011,《神经病学(neurology)》)。
[0190]
由于实际(可用患者数量有限)和道德(患有致命神经疾病的儿童进行神经外科手术)方面的关注,此研究设计不能涉及同时、匹配、随机化、盲或未经治疗的对照个体(arkin,2005,《人类基因疗法》);(crystal,2004,《人类基因疗法》)。汉堡cln2病量表的运
动和语言分量表以及总评分将与德国汉堡大学医疗中心的注册表中的自然病史数据和/或来自兄弟姐妹的数据(视需要)进行比较。
[0191]
实例5
[0192]
此实例描述了实例4中所述的第2阶段开放标记研究的研究群体的选择。
[0193]
研究计划:研究群体的选择
[0194]
确认cln2病进展的患者可能有资格参加此研究。参与此研究的额外标准详述如下。个体必须满足以下标准才能参与研究(表7):
[0195]
表7
[0196][0197]
实例6
[0198]
此实例描述了个体参与实例4和5中所述的研究的持续时间。
[0199]
个体参与将涉及手术植入icv进入装置,然后在术后14至28天恢复,且将对所有个体持续至少96周的治疗。治疗将继续进行,直至完成所有程序,个体撤回同意书且中断研究,研究者中断研究或终止研究。最终tpp1输注后6个月将进行安全性随访访问,但如果个
体参与延伸研究、注册或以其它方式在最后一次输注后6个月内仍可继续接入tpp1,那么不需要进行安全性随访访问(有关ae/sae报告指示,请参考章节10.2.1)。
[0200]
实例7
[0201]
此实例描述了实例4至6中所述的研究中所施用的治疗。
[0202]
每两周,优选在至少2小时禁食后的上午利用icv输注向所有研究个体施用tpp1。使用饲管时,应在输注前2小时关闭管。所有个体均将经施用300mg的tpp1输注,但出于安全性原因,可视需要使剂量降低至150mg。
[0203]
施用指导
[0204]
icv储液槽的手术植入将在研究药物施用之前进行。研究者将在每次研究药物施用时评估储液槽的通畅性、位置和皮肤完整性(请参考《研究药剂手册》)。每次施用时,研究者将在施用研究药物之前将1-2ml的csf吸入装置套管中,以检查通畅性。使用严格的无菌技术进行装置接入。检查覆盖储液槽的皮肤的适当针头插入部位。针头插入部位必须为完整的,无破裂、伤口、感染或皮疹的迹象。所用针头为小规格的未开孔尖端。一旦接入储液槽,那么将针头固定,以确保移动或去除风险最小。根据研究者和/或神经外科医生的判断,可以在临床研究期间置换储液槽。
[0205]
每两周,优选在至少2小时禁食后的上午利用icv输注向所有研究个体施用tpp1。在使用饲管时,应在输注前2小时关闭管,除非另外指定,否则每次研究访问的研究程序应在研究药物输注之前。向各个体施用的研究药物的各剂量的日期、时间、体积和浓度将记录在为研究提供的配药日志中以及适当的crf上。《研究药剂手册》提供了有关研究药物的制备和施用的进一步指示。
[0206]
个体将入院以进行每次tpp1输注。对于所有输注,自开始输注起至少要在24小时内将在住院患者环境中监测个体。仅对于第一次输注,个体还将在输注开始后72小时返回诊所进行随访访问。在所有访问之后,将在48小时内致电父母或法定监护人以确定健康状况。
[0207]
由于过敏反应可能与ert施用有关,因此应在tpp1输注之前约30分钟用年龄适当的抗组织胺(和退热剂(如果适宜))对个体进行预治疗。根据机构的标准操作,在tpp1输注之前约30分钟,研究者可以酌情使用年龄适合的镇静药物对个体进行预治疗。在输注的术前用药之前,应进行临床、发育和qol评估。
[0208]
对于300mg的施用,tpp1将以2.5毫升/小时icv输注,以在大约4(
±
1)小时内递送全部体积。应使用注射泵,以确保均匀的输注速度,所述注射泵应具有适当的递送范围、递送速度准确度以及不正确递送或阻塞的警报。如果出于安全性或其它原因需要终止剂量,那么所述剂量可以相同速率重新开始且完成,只要在准备剂量注射器10小时内施用总剂量即可。
[0209]
正常输注将为300mg,经4(
±
1)小时施用。如果个体经历ae,那么研究者可在与医学监护者协商后降低剂量或输注速率以用于将来的输注。输注的变化应按以下顺序进行:
[0210]
(i)降低输注速度且经总共6小时施用药物
[0211]
(ii)将经4(
±
1)小时的标准时间施用的剂量降低至150mg
[0212]
(iii)降低输注速率且经总共6小时施用150mg
[0213]
安全性监测
[0214]
在放置icv进入装置后,将向个体和其护理人员提供书面说明书,其提供有关装置并发症的病征和症状的详细信息,以及有关何时返回研究点以进行装置评估的指示。个体将入院以进行每次tpp1输注。对于所有输注,自开始输注起至少要在24小时内将在住院患者环境中监测个体。仅对于第一次输注,个体还将在输注开始后72小时返回诊所进行随访访问。在所有访问之后,将在48小时内致电父母或法定监护人以确定健康状况。
[0215]
对于第一次输注,将在输注开始或重新开始前30(
±
5)分钟内、输注期间每30(
±
5)分钟、输注结束后0.5和1小时(
±
5分钟)以及直至出院每4小时(
±
15分钟)测量生命体征(参见《生命体征(vital signs)》)。
[0216]
对于后续各输注,将在输注开始前30(
±
5)分钟内、输注期间每60(
±
5)分钟以及输注结束后1和4小时(
±
5分钟)测量生命体征。
[0217]
个体需要在整个输注的持续时间中由适当培训的人员定期监测不良事件和癫痫性癫痫发作。如果出现癫痫性癫痫发作,那么可由研究者酌情中断输注。由于可能会发生过敏反应(重度过敏或一般过敏),因此在研究药物输注期间,床附近需要经过适当培训的人员和设备进行可用紧急复苏(包含肾上腺素)。如果需要紧急治疗,在输注期间所有个体应有静脉内线。
[0218]
过敏反应的症状可包含发烧、发冷/寒战、皮肤症状(荨麻疹、血管性水肿、皮疹)、呼吸系统症状(呼吸困难、喘息、喘鸣)、胃肠道症状(恶心、呕吐、腹痛)和/或心血管变化(低血压/高血压)。如果出现更严重的症状,例如血管性水肿(舌或咽喉肿胀)或喘鸣,那么应终止输注。
[0219]
迄今为止,tpp1研究尚未出现重度过敏或类重度过敏反应。然而,如果怀疑有重度过敏,那么应遵循局部指南。如果怀疑有重度过敏反应、严重tre或重度tre(定义为3级或更高的tre),那么将在事件发生1小时内收集血液样品,以评估c4、血清类胰蛋白酶和总ige;为了评估药物特异性ige,应在事件发生后不超过8小时(或下次输注之前)收集血液样品。
[0220]
各输注期间和之后均进行安全性评估。根据研究者的判断,个体可能需要保持更长的观察期。如果观察到与tre一致的ae(章节7.4.1),那么适当的干预措施可包含输注中断、输注速率降低或施用抗组织胺、氧气、液体或类固醇。如果中断后重新开始输注,那么初始速率应为反应发生速率的大约一半。《研究药剂手册》中提供了输注改进的更多细节。
[0221]
指示父母或法定监护人在出院后联系研究者讨论任何ae。
[0222]
使用icv进入装置会导致感染,长期使用储液槽导致脑出血,储液槽渗漏和癫痫发作(karavelis,1996,《神经外科手术(neurosurgery)》)(kronenberg,1998,《疼痛(pain)》)。可能需要进行额外手术才能固定或置换装置。在整个研究中,将监测患者的潜在感染(体温高、咳嗽、皮疹、头痛、切口区域肿胀或引流)以及icv储液槽渗漏或故障的迹象(参考《研究药剂手册》)。
[0223]
出于植入装置周围固有的安全性考虑,
[0224]
在完成研究访问或提前终止访问后不超过4周,应安排个体将icv进入装置去除。如果个体打算在参与此研究后继续接受tpp1(例如,经由市售产品,注册使用或其它tpp1研究),那么无需去除装置。在去除装置之后,个体应在4周(
±
3天)后返回研究点进行安全性随访访问。
[0225]
将个体分配至治疗组的方法
[0226]
个体将在有空的情况下参与,而无需关注任何进入标准或其它患者特征。
[0227]
剂量选择
[0228]
计划的剂量为300mg。
[0229]
建议剂量水平衍生自tpp1空腊肠犬研究中所用的剂量含量(vuillemenot,2011,《分子遗传学代谢(mol.genet.metab)》)。在4mg和16mg剂量含量的tpp1空腊肠犬中已充分证实了药理效应,包含功能改善和寿命延长。由于脑组织中的tpp1活性与cns溶酶体贮积物质在近端有关,因此判断按脑质量进行的按比例调整可预测人类治疗剂量。利用脑质量按比例调整计算人类等效剂量。人脑到2岁时平均达到成人体重的约75%,到5岁时达到100%(giedd,1996,《脑皮质(cereb.cortex)》)。如果成人脑质量为1400g,那么2至7岁健康儿童的范围为1050至1400g。考虑到cln2病患者中的进行性脑萎缩,假定平均质量为1000g,基于50g的腊肠犬平均脑质量,产生的比例因子按比例调整因数为20倍。
[0230]
还得到受益于腊肠犬的非临床研究地临床疾病的未观测到的不良效应含量(noael)为48mg,此将对应于人类的960mg。
[0231]
对实例3中的研究进行的初步分析证实,经由脑室内(icv)装置每2周给药300mg的所有参与研究的儿童均具有阳性效益风险概况。此外,与匹配地病史未经治疗的对照组(其中在大多数匹配中,其下降迅速而深刻)相反,在接受tpp1给药超过36周的那些儿童中,临床评分稳定。
[0232]
各个体的剂量的时序选择
[0233]
平均cns半衰期为约2周,此表明每两周给药可以维持cns中治疗性tpp1含量。csf中的tpp1浓度在csf动力学与人类的动力学类似的物种中单一icv或it-l输注之后将保持高于溶酶体kuptake维持大约48小时(vuillemenot,2014,《毒理学应用药理学(toxicol.appl.pharmacol.)》)、(vuillemenot,2011,《分子遗传学代谢》);0190-09-071)。在这些相同的物种(狗和猴子)中,tpp1的cns分布在许多脑区域中广泛存在。
[0234]
输注体积和速率的选择
[0235]
腊肠犬和食蟹猴中的非临床研究使用的输注速度为每小时总csf体积的约5%。预期此代表了一种安全的输注速率,其可将总csf体积和颅内压的变化降至最低。腊肠犬以0.6毫升/小时的速率接受icv输注,持续2-4小时,而猴子接受0.88毫升/小时,持续3.6小时。在这些研究中未观测到任何效应,指示由于输注速率而引起的安全问题。在cln2患者群体中,估计的csf体积为约100ml。对于建议临床试验,在4小时时间段内输注10ml的体积表示每小时总csf体积的2.5%的输注速率,其为在非临床研究中无安全性效应的速率的大约一半。因此,吾等期望在4小时内输注10ml在cln2患者中为安全的。
[0236]
不知情
[0237]
此为单臂、开放标记研究。将进行安全性和临床严重程度的研究点评估,对将在符合条件后参与的治疗和个体不知情。
[0238]
根据imaging charter中所定义,mri评估的监督将由中央成像设施由独立放射科医生进行。解译放射科医生和软件分析将对研究的个体和时间不知情。在评估端点之前,将重新编辑所有个体识别信息。
[0239]
先前和伴随药物
[0240]
在知情同意之前的30天期间服用的药物(处方药、非处方药和草药)和营养补品将
记录在筛选时的crf中。在后续每次访问中(或提前终止访问的一周内),由于先前访问的任何药物(剂量、频率、新药或停止)的变化均将记录在crf中。
[0241]
在研究期间添加或中断的任何伴随药物应记录在crf中(或在提前终止访问的一周内)。
[0242]
个体可能正在服用抗惊厥剂和药物以用于肌阵挛、震颤、躁动和疼痛。研究者将被要求在整个研究中保持这些方案不变,除非由于缺乏功效或毒性而需要进行改变。
[0243]
治疗依从性
[0244]
研究药物将由合格的专业人员在研究点向个体施用。每个剂量的日期、时间、体积和浓度均必须记录在分配日志中以及适当的crf上。在研究治疗的剂量错过或不完全的情况下,研究者应视需要记录crf上的原因和任何其它相关信息。
[0245]
饮食或其它方案限制
[0246]
对于此研究不存在饮食或其它方案限制。将使在研究过程期间需要peg(经皮内窥镜胃造口术)管作为护理标准的个体继续进行研究。使用饲管时,应在输注前2小时关闭管。
[0247]
实例8
[0248]
此实例描述实例4-7的研究的功效和安全性变量。
[0249]
功效变量
[0250]
尽管此研究经设计以主要评估安全性和耐受性,但将使用cln2运动-语言临床评定量表来测量功效。将收集总汉堡0至12分的cln2量表和疾病进展的mri测量作为次要终点。其它探索性功效测量将包含发育状况、癫痫发作频率、非自主运动、视网膜解剖结构和生活质量度量。
[0251]
cln2临床评定量表
[0252]
疾病严重程度将利用cln2临床评定量表(steinfeld,2002,《美国医学遗传学杂志》);(worgall,2008,《人类基因疗法》)评估。此量表由四个具有固有内容有效性的域组成。在各域中,分配0至3的评分,且通过将四个域评分相加得出最终评定为0(严重受损)至12(正常)来计算总评分。
[0253]
由于运动和语言域与cln2病进展最相关(章节9.2),因此将使用其来评估功效(附录1)。
[0254]
评分员将被鉴定为合格的从业者,其已经接受过cln2病评估量表的定义和实施例的培训。在进行研究评定之前,将需要所有研究点处的所有评分员来通过经设计以标准化整个研究中的定义和量表锚定点的培训课程。只要有可能,就应由一位评分员评估每个参与患者的治疗持续时间。此外,应在研究访视的同时进行患者评分,优选在进行程序和/或输注之前的上午进行。在对tpp1输注进行预处理之前,应进行cln2量表评估。
[0255]
丹佛发育量表ii
[0256]
丹佛ii为丹佛发育筛选测试的修订和更新。
[0257]
两项测试均经设计以监测婴儿和学龄前儿童的发育。测试涵盖四个基本功能:个人社交(例如微笑)、适应性良好的运动(例如抓握和绘画)、语言(例如组合单词)和大运动(例如行走)。测试涵盖的年龄自出生至6岁不等。
[0258]
修改后的统一巴氏病评定量表非自主运动量表
[0259]
修改后的统一巴氏病评定量表(mubdrs)非自主运动量表为一种评定量表,其测量
与cln2病(例如肌阵挛和肌张力障碍)相关的常见非自主运动的类型、频率和严重程度。
[0260]
磁共振成像
[0261]
所有图像数据将在1.5tesla mri平台上采集。研究mri将包含imaging charter中指定的定位器、3d t1加权矢状、t2加权梯度回波、扩散加权轴向和flair轴向采集。扫描仪的总时间少于60分钟,且有望在大多数有镇静作用的个体中完成。
[0262]
图像的体积分析将通过估计总皮质灰质的体积和颅csf的比例来完成。
[0263]
在植入icv进入装置之前,所有患者均将接受mri,无任何造影剂,以确保适当计划和放置。在进行此mri时,不会进行与mri相关的研究评估,且在mri期间获得的任何读数均不包含在研究数据的分析中。
[0264]
当研究人员怀疑感染或分流功能障碍时,还应进行mri扫描。在此情况下,根据imaging charter,至少应具有t1加权的轴向和矢状方面,应存在或不存在静脉内造影的情况下进行mri。对于疑似脑膜炎,根据成像手册,应在有或没有造影剂的情况下对大脑进行mri。
[0265]
光学相干断层扫描技术
[0266]
光学相干断层扫描技术(oct)为非侵入性成像测试,其使用光波拍摄视网膜各层的横截面图片,以测量其厚度。这些测量可以有助于视网膜疾病的早期检测和治疗。oct将局部进行,且应在输注之前进行。
[0267]
修改后的统一巴氏病评定量表癫痫发作量表
[0268]
mubdrs癫痫发作量表测量前3个月间隔内cln2患者的癫痫发作类型和频率。在研究访问之间的时间段内,借助于照护者/家庭成员的回顾来完成量表。
[0269]
pedsql
[0270]
pedsqltm通用核心量表经设计以测量儿童和青少年的生活质量。评估是简单、实用和适合发展的。仪器对随着时间推移的临床变化有反应(msall,2005,《智力低下与发育障碍研究综述(ment.retard.dev disabil.res rev)》)。四份父母报告涵盖1-12个月、13-24个月、2-4岁和5-7岁的年龄,且包含有关身体、情感和社交功能的问题,以及在适用情况下的学校功能。在研究期间年龄大于7岁的患者将不再使用此工具进行评估。
[0271]
eq-5d-5l
[0272]
eq-5d-5l仪器为自身报告的问卷,经设计以测量一般健康状态(euroqol group,1990,《健康政策(health policy)》)、(brooks,1996,《健康政策》)。eq-5d-5l由2个部分构成:描述系统,其自5个维度和eq视觉模拟量表(eq vas)中评估5个程度的感知问题(运动、自我护理、日常活动、疼痛/不适和焦虑/抑郁)评估总体健康状况。
[0273]
cln2特异性qol问卷
[0274]
cln2特异性qol问卷为使用相同格式和定量对pedsql的疾病特异性补充。所述问卷为一种新仪器,其与患者家庭和倡导团体合作设计以检索晚期婴儿cln2病的基本护理和生活质量问题。
[0275]
婴幼儿生活质量问卷
[0276]
婴幼儿生活质量问卷(itqol)用于评估2个月至5岁之间年龄的儿童的健康程度。此工具要求学龄前儿童的父母反思身体和社会心理域,例如发育、疼痛、情绪以及儿童健康对父母的影响。
[0277]
免疫原性
[0278]
免疫原性测试将在中央实验室使用经过验证的对血清和csf样品的免疫原性分析进行。将收集血液样品(血清)用于tab测试,且将在第一次输注之前(基线或在输注之前的第1周)、之后每12周和在安全性随访(或在提前终止访问的一周内)收集csf样品用于tab和nab测试。收集必须在输注之前。nab将在基线时在csf中进行测试,且在后续时间点,仅在tab在csf中为阳性时才进行测试。
[0279]
如果以后发生过敏反应需要额外的实验室工作,那么将使用基线样品获得基线总ige和药物特异性ige含量。
[0280]
迄今为止,tpp1研究尚未出现重度过敏或类重度过敏反应。然而,如果怀疑有重度过敏反应,严重的过敏事件或严重的过敏(定义为3级或更高的过敏事件),那么将在事件1小时内收集血液样品以评估c4、血清类胰蛋白酶和总ige;为了评估药物特异性ige,将在事件发生后不超过8小时(或下次输注之前)收集血液样品。
[0281]
临床实验室评估
[0282]
将收集血液和尿液样品用于常规临床实验室评估(血液化学、血液学、尿分析)且进行集中分析。收集应在输注之前。
[0283]
由研究者确定为具有临床显著性的任何异常测试结果应重复进行,直至确定其原因,所述值返回至基线或在正常限制内,或研究者确定异常值不再具有临床显著性为止。
[0284]
所有异常的临床实验室页面均应由研究者进行初始化和注明日期,且附上有关临床意义的评论。每个临床上显著的实验室结果均将在筛选时记录为病史,且随后记录为ae。
[0285]
如果已知,那么应将与研究者认为具有临床显著性的临床实验室结果异常相关的诊断记录在ae crf上。
[0286]
如下文所述进行的临床实验室测试的表(表8):
[0287]
表8
[0288]
血液化学血液学尿分析白蛋白血红素外观碱性磷酸酶血容比颜色alt(sgpt)wbc计数phast(sgot)rbc计数比重直接胆红素血小板计数酮类总胆红素差异细胞计数蛋白质血尿素氮 葡萄糖钙 胆红素二氧化碳 亚硝酸盐氯化物 尿胆素原总胆固醇 血红素c反应蛋白
ꢀꢀ
肌酐
ꢀꢀ
肌酸激酶
ꢀꢀ
葡萄糖
ꢀꢀ
ggt
ꢀꢀ
ldh
ꢀꢀ
磷
ꢀꢀ
钾
ꢀꢀ
总蛋白质
ꢀꢀ
钠
ꢀꢀ
尿酸
ꢀꢀ
[0289]
脑脊髓液监测
[0290]
每次输注前30(
±
5)分钟内,将收集用于常规监测的标准临床实验室csf样品(差异细胞计数、蛋白质和葡萄糖)。将自icv储液槽中收集少体积的csf,且进行局部分析。收集应在研究药物输注之前。
[0291]
生物标记
[0292]
将收集血浆和csf的样品以分析假定的分子/生物化学生物标记。收集应在研究药物输注之前。将集中测试样品。
[0293]
其它实验室评估
[0294]
经历可能与tpp1或其它相关ae有关的sae的个体可能需要抽取额外血液样品来评估免疫原性或安全性参数。
[0295]
生命体征、身体检查和其它观测
[0296]
生命体征
[0297]
对于第一次输注,将在输注开始或重新开始前30(
±
5)分钟内、输注期间每30(
±
5)分钟、输注结束之后0.5和1小时(
±
5分钟)以及直至出院每4小时(
±
15分钟)测量生命体征(sbp、dbp、心跳速率、呼吸速率和体温)。
[0298]
对于后续各输注,将在输注开始前30(
±
5)分钟内、输注期间每60(
±
5)分钟以及输注结束后1和4小时(
±
5分钟)测量生命体征。
[0299]
身体检查
[0300]
完整身体检查将包含总体外观(头部、眼睛、耳朵、鼻子和咽喉)、心血管、皮肤病学、淋巴、呼吸、胃肠道、泌尿生殖、肌肉骨胳以及体重和身高。
[0301]
简单身体检查将包含总体外观、心血管、呼吸、神经和胃肠道评估。
[0302]
使用icv储液槽装置进行脑室内药物施用需要在整个研究中监测患者的潜在感染(体温高、咳嗽、皮疹、头痛、精神状态变化、切口区域肿胀或引流)以及icv储液槽渗漏或故障的迹象(储液槽部位周围的皮肤肿胀、csf提取困难、头皮红斑、储液槽装置膨胀或输注时渗出液体)。
[0303]
研究者将在每次研究药物施用时评估储液槽的通畅性、位置和皮肤完整性。在输注之前,研究者将检查储液槽部位的头皮水肿、红斑或皮肤破裂。在输注前采样期间以及输注时再次评估通畅性。难以获得输注前样品所需的所需csf体积或icv储液槽渗漏的迹象(储液槽部位周围的皮肤肿胀、头皮红斑、储液槽装置膨胀或渗出液体),将促使在继续输注之前对储液槽的故障进行进一步评估。可能需要进行其它手术咨询,包含外科手术,以固定或置换装置。
[0304]
临床上显著的异常将在筛选时记录在“病史”下或之后记录为ae。
[0305]
神经检查
[0306]
完整神经检查将包含意识水平、话语、语言、颅神经、运动强度、运动张力、异常运动、反射、上肢感觉、下肢感觉、步态、隆伯格(romberg)、眼球震颤和协调能力。
[0307]
心电图
[0308]
标准的12导联心电图包含心跳速率、心律、时间间隔、轴、传导缺陷和解剖异常。将在输注结束后15(
±
5)分钟内进行ecg。
[0309]
如果发现临床上显著的异常,那么研究者或指定人员将评估是否适合进行研究参与或继续;临床上显著的异常将在筛选期间记录在病史中,且之后记录为ae。
[0310]
脑电图
[0311]
将记录标准唤醒eeg。如果发现临床上显著的异常,那么研究者或指定人员将评估是否适合进行研究参与或继续研究;在筛选期间,将在“病史”下记录临床上显著的异常。
[0312]
妊娠测试
[0313]
在筛选和研究期间的任何时间,将由研究者判断有生育能力的女性个体(根据月经来潮定义)将利用尿液妊娠测试进行妊娠测试;不论何时妊娠如有问题,将进行额外尿液测试。如果尿液测试结果呈阳性或模棱两可,那么将进行血清妊娠测试。
[0314]
实例9
[0315]
此实例描述实例4-8的研究的研究程序。
[0316]
在解释了研究的性质之后,必须在任何与研究相关的程序之前获得父母或法定法定监护人的书面知情同意。在住院植入icv进入装置的21天的内,将进行以下程序:
[0317]
·
知情同意书
[0318]
·
确认由tpp1酶活性(干血斑)确定的cln2病的诊断
[0319]
·
用于cln2基因分析的血液
[0320]
·
带录像的汉堡cln2病评定量表(图12)
[0321]
·
用于研究入口的验证标准
[0322]
·
颅mri
[0323]
·
完整身体检查,包含病史
[0324]
·
cln2特异性qol问卷
[0325]
·
怀孕测试(有生育能力的女性)
[0326]
·
知情同意后,评估与方案强加干预措施和癫痫发作病史有关的sae
[0327]
·
伴随药物
[0328]
手术访问
[0329]
符合条件的研究候选者将入院,以将icv进入装置手术植入右侧脑室中。手术前将进行mri,以确保适当计划和放置icv进入装置。至少应在术后48小时内在护理密集型环境中对个体进行观测。还将进行以下程序:
[0330]
·
ae评估,包含持续的癫痫发作病史
[0331]
·
伴随药物
[0332]
在放置icv进入装置后,将向个体和其护理人员提供书面说明书,其提供有关装置并发症的病征和症状的详细信息,以及有关何时返回研究点以进行装置评估的指示。住院患者出院48小时内将再进行一次随访电话呼叫。
[0333]
基线访问和第一次输注
[0334]
基线访问
[0335]
以下基线值将在第一次输注(其将发生于手术后至少14天和手术后不超过28天)前2天内记录:
[0336]
·
带录像的汉堡cln2病评定量表(附录1)
[0337]
·
ecg(12导联)(心跳速率、心律、时间间隔、轴、传导缺陷和解剖异常)
[0338]
·
eeg(标准唤醒)
[0339]
·
颅mri
[0340]
·
用于免疫原性的csf(所有个体中的tab和nab)和血清(所有个体中的tab和药物特异性ige)
[0341]
·
完整身体检查
[0342]
·
神经检查
[0343]
·
临床实验室测试(血液学、血液化学和尿分析)
[0344]
·
修改后的统一巴氏病评定量表非自主运动量表(mubdrs-运动)
[0345]
·
修改后的统一巴氏病评估量表癫痫发作量表(mubdrs-癫痫发作)
[0346]
·
光学相干断层扫描技术
[0347]
·
婴幼儿qol问卷
[0348]
·
pedsql
[0349]
·
eq-5d-5l
[0350]
·
丹佛ii发育量表
[0351]
·
cln2特异性qol问卷
[0352]
·
眼科评估
[0353]
·
ae评估,包含持续的癫痫发作病史
[0354]
·
伴随药物
[0355]
第一次输注
[0356]
通常,对于所有输注,应在mri和采血之前完成功能和qol的评估;对个体进行镇静以进行mri检查时,可能会收集血液样本。
[0357]
第一次输注-第1天
[0358]
第一次输注的第1天将执行以下过程:
[0359]
·
csf监测(细胞计数、蛋白质、葡萄糖)
[0360]
·
设备通畅/感染
[0361]
·
研究药物输注
[0362]
·
脑脊髓液和血浆用于生物标志物
[0363]
·
开始输注前30(
±
5)分钟内、输注期间每30(
±
5)分钟、输注结束后0.5和1小时(
±
5)以及直至出院每4小时(
±
15分钟)的生命体征生命体征
[0364]
·
简单身体检查
[0365]
·
ae评估(研究者可收集额外血液样品用于任何所关注ae的安全性或免疫原性测试)和持续的癫痫发作病史
[0366]
·
伴随药物评估
[0367]
·
在住院患者环境中进行输注后监测至少24小时
[0368]
第一次输注-第2-6天
[0369]
第一次输注后第2-6天将执行以下过程:
[0370]
·
生命体征(第2天)(输注结束后每4小时至20小时)
[0371]
·
临床实验室测试(血液学、血液化学和尿分析)(第2天)
[0372]
·
csf监测(细胞计数、蛋白质、葡萄糖)(第6天)
[0373]
·
简单身体检查(第6天)
[0374]
·
设备通畅/感染(第6天)
[0375]
·
ae评估(研究者可收集额外血液样品用于任何所关注ae的安全性或免疫原性测试)(每日)和持续的癫痫发作病史
[0376]
·
伴随药物评估(每天)
[0377]
第一次输注以来住院患者出院后,将在48小时内与父母/监护人进行随访电话呼叫。
[0378]
每2周
[0379]
在研究过程中,应每2周执行以下评估和程序。自第一次输注的日(
±
3天)起,每2周应进行所有研究访问。除非另外规定,否则在进行研究药物输注之前,应完成所有评估和程序。一般来说,在进行mri和血液采样之前应完成功能和qol的评估;给个体服镇静剂以进行mri时,可收集血液样品。
[0380]
对于所有访问,如果未观测到安全性问题,那么在医学上稳定的情况下,个体可在24小时后出院。出院后约48小时将随访电话呼叫父母或法定监护人,以确定健康状况。
[0381]
·
简单身体检查
[0382]
·
csf监测(差异细胞计数、蛋白质、葡萄糖)
[0383]
·
装置通畅性/感染评估
[0384]
·
研究药物施用
[0385]
·
输注开始前30(
±
5)分钟内、输注期间每60(
±
5)分钟、输注结束后1和4小时(
±
5分钟)的生命体征
[0386]
·
ae评估(研究者可收集额外血液样品用于任何所关注ae的安全性或免疫原性测试)和持续的癫痫发作病史
[0387]
·
伴随药物评估
[0388]
·
访问之后48小时内电话呼叫父母/监护人
[0389]
每4周
[0390]
在研究期间,应每4周执行以下评估和程序。在适用情况下,在进行mri镇静时可能会进行血液采样。
[0391]
常规临床实验室测试(血液学、血液化学和尿分析)
[0392]
每12周
[0393]
在研究期间,应每12周执行以下评估和程序。除非另外规定,否则在进行研究药物输注之前,应完成所有评估和程序。一般来说,在进行mri和血液采样之前应完成功能和qol的评估;给个体服镇静剂以进行mri时,可收集血液样品。
[0394]
·
录制汉堡cln2病评定量表(图12)
[0395]
·
神经检查
[0396]
·
用于免疫原性的csf和血清采样
[0397]
·
mubdrs-运动
[0398]
·
mubdrs-癫痫发作
[0399]
·
光学相干断层扫描技术
[0400]
·
婴幼儿生活质量问卷
[0401]
·
pedsql
[0402]
·
丹佛ii发育量表
[0403]
·
cln2特异性qol问卷
[0404]
·
eq-5d-5l
[0405]
每24周
[0406]
在研究过程中,应每24周执行以下评估和程序:
[0407]
·
输注结束后15(
±
5)分钟内的ecg(12导联)(心跳速率、心律、时间间隔、轴、传导缺陷和解剖异常)
[0408]
·
eeg(标准唤醒)
[0409]
·
颅mri
[0410]
·
用于生物标志分析的csf和血浆
[0411]
·
完整身体检查
[0412]
每48周
[0413]
在研究期间,应每48周执行以下评估和程序:
[0414]
·
眼科评估
[0415]
研究完成或提早终止访问
[0416]
在研究完成或提前终止时,个体将在3天内返回研究点。将完成以下过程:
[0417]
·
录制了汉堡cln2病评定量表(附录1)
[0418]
·
ecg(12导联)心跳速率、心律、时间间隔、轴、传导缺陷和解剖异常)[如果输注,那么在输注结束后15(
±
5)分钟]
[0419]
·
颅mri
[0420]
·
csf监测(细胞计数、蛋白质、葡萄糖)
[0421]
·
用于生物标志分析的csf和血浆
[0422]
·
用于免疫原性的csf和血清采样
[0423]
·
生命体征(sbp、dbp、心跳速率、口腔体温和呼吸速率)
[0424]
·
完整身体检查
[0425]
·
神经检查
[0426]
·
常规临床实验室测试(血液学、血液化学和尿分析)
[0427]
·
丹佛ii发育量表
[0428]
·
cln2特异性qol问卷
[0429]
·
眼科评估
[0430]
·
ae评估(研究者可收集额外血液样品用于任何所关注ae的安全性或免疫原性测试)和持续的癫痫发作病史
[0431]
·
伴随药物评估
[0432]
在研究完成完成或早期终止访问之后,将不会继续在其它情况(例如,商业用途、
参与注册、参与另一tpp1临床研究等)下接受tpp1的个体的icv进入装置应去除。应在研究完成访问或etv后不超过4周进行设备去除。
[0433]
装置和安全性随访
[0434]
在完成以下步骤后,个体将在去除icv进入装置后4周(
±
3天)返回研究点:
[0435]
·
生命体征(sbp、dbp、心跳速率、口腔体温和呼吸速率)
[0436]
·
简单身体检查(包含仔细检查之前一装置部位以检查感染迹象等)
[0437]
·
用于免疫原性的血清采样
[0438]
·
神经检查
[0439]
·
常规临床实验室测试(血液学、血液化学和尿分析)
[0440]
·
ae评估(研究者可能会收集额外血液样品以用于安全性或免疫原性测试,以用于任何所关注ae)
[0441]
·
伴随药物评估
[0442]
对于未进行装置去除的个体,将免除其为期4周的装置安全性随访访问,因为其将继续在其它环境下接受tpp1(例如,商业用途、注册参与、参与另一项tpp1临床研究等)。
[0443]
安全性随访
[0444]
如果个体参与延伸研究或注册表,或在最终输液后的6个月内仍可继续使用tpp1,那么不需要进行安全性随访访问。必要时,在完成以下程序后,个体将在最后一次研究治疗后6个月返回研究点:
[0445]
·
ecg(12导联)(心跳速率、心律、时间间隔、轴、传导缺陷和解剖异常)[如果输注,那么在输注结束后15(
±
5)分钟内]
[0446]
·
用于免疫原性的血清采样
[0447]
·
生命体征(sbp、dbp、心跳速率、口腔体温和呼吸速率)
[0448]
·
完整身体检查
[0449]
·
常规临床实验室测试(血液学、血液化学和尿分析)
[0450]
·
ae评估(研究者可收集额外血液样品用于任何所关注ae的安全性或免疫原性测试)和持续的癫痫发作病史
[0451]
·
伴随药物评估
[0452]
研究终止
[0453]
研究将在最后一个个体完成最后一次安全性随访访问之后结束。biomarin保留因临床或行政原因随时中断研究的权利,以及出于临床或行政原因中止单独的研究者或研究点的权利,所述临床或行政原因包含但不限于参与不良或不遵守方案或gcp的程序。另外,如果biomarin认为可能损害研究个体的安全性,那么可以终止研究。
[0454]
实例10
[0455]
此实例描述实例4-9中所述的研究的结果、修改和论述。
[0456]
药品和冲洗溶液、组分和调配物研发
[0457]
实例4-9中所述的研究的药品是在单个10ml玻璃瓶中含有每5ml溶液150mg细胞利波纳酶α的冻干可注射调配物。药品含有以下赋形剂:五水合磷酸氢二钠、单水合磷酸一钠、氯化钠、氯化钾、氯化镁、水合氯化钙和注射用水。出于完全施用残留在施用管线中的药品的目的而供应冲洗溶液,以在脑室内施用药品之后维持管线的通畅。冲洗溶液的组成与药品
相同,不同的处在于冲洗溶液不含活性物质,且以5ml溶液的形式供应于单个10ml玻璃小瓶中。
[0458]
细胞利波纳酶α的作用机制
[0459]
细胞利波纳酶α为由544个氨基酸组成的重组htpp1前体。氨基酸序列与活体内htpp1前体的氨基酸序列一致。n-连接的寡醣(例如双磷酸化的高甘露糖链)与五个n-连接的寡醣谱中的天冬氨酸残基(asn191、asn203、asn267、asn294和asn424)结合,且利用ci-m6pr经由此寡醣吸收至目标细胞或溶酶体中(《生物化学杂志(j biol chem)》2001;276:2249-55)。此后,前肽片段在酸性环境中由活体内蛋白酶裂解,产生活性酶(例如,《生物化学杂志》2004;279,31058-67;《生物化学杂志》2009;284:3985-97),和其来自溶酶体中累积的多肽上裂解出三肽,预防贮积物质增加,且因此预防cln2病进展。
[0460]
药代动力学
[0461]
在此研究中,brineura适用于非日本cln2患者(目标样品大小:5),向患者施用brineura。下表(表9)展示接受200或300mg脑室内剂量的个别患者的csf和血浆药代动力学参数。
[0462]
表9
[0463]
接受200或300mg脑室内剂量的个别患者的csf和血浆的药代动力学参数
a)
[0464][0465]cmax
:csf或血浆中的最大浓度
[0466]
auc
0-t
:csf或血浆浓度下的面积-自施用至最后一个定量时间点t的时间曲线
[0467]
a)在此研究中,在数据截止日期之后进行药代动力学评定;所展示的细胞利波纳酶α药代动力学参数数据为接受brineura介于2天之间的5名患者的药代动力学参数数据。
[0468]
b)第49剂量;c)第13剂量
[0469]
此研究的讨论
[0470]
此研究中的关键纳入标准为基于血液测试的tpp1酶活性降低,年龄为1岁或更大,有参与实例3的研究的兄弟姐妹,运动和语言分量表的总评分为3至6分,
19
且先前未用干细胞疗法、基因疗法或酶补充疗法进行治疗。
[0471]
此研究由以下组成:在植入用于脑室内施用的装置的程序之后14至28天的术后恢复期和96周的研究药物治疗期。
[0472]
剂量和施用为在约4小时内,每2周一次(输注速率:2.5ml/h),tpp1(brineura)300mg
的脑室内剂量。治疗期为96周。
20
[0473]
此外,在数据截止后稍晚对研究方案进行了修订,以使研究的参与不再仅限于参与实例3的研究的cln2患者的兄弟姐妹。参加研究的合格年龄改为出生至《18岁,且小于2岁的患者的剂量和施用改为以下:出生至《0.5岁的患者为100mg;≥0.5岁且《1岁的患者为150mg;且≥1岁且《2岁的患者,前4个剂量为200mg,且随后这之后每2周一次300mg。所有剂量均以2.5ml/h的输注速率进行脑室内施用。
[0474]
安全性分析组和功效分析组均包含四名经治疗患者(基线年龄:2至5岁)。对于功效,表10显示来自cln2临床评分量表
21
的基线运动和语言分量表评分和其总和(ml评分)以及自基线至最后一次评估时间点的变化。在任何临床评定量表中均未发现基线下降;所有皆不变。
[0475]
表10
[0476]
各临床评定量表的基线评分和自基线至最后一次评估时间点的其中的变化(研究109-203)
[0477][0478]
患者数(%)
[0479]
a)在截至数据截止日期参与的4名患者中,1名基线ml分量表评分为1,且因为此患者同时患有自闭症,因此将此患者排除在语言和ml分量表评估的外。
[0480]
就安全性而言,所有4名患者中报道了ae 22(上呼吸道感染、上呼吸道感染、不适、癫痫发作、癫痫发作、部分性癫痫发作、部分性癫痫发作、便秘和腹痛;发热、睡眠障碍和发热;流行性感冒、发热和胃肠炎;和呕吐、过敏、跌落发作、支气管炎、全身性强直性痉挛性癫痫发作、上呼吸道感染、上呼吸道感染、全身性强直性痉挛性癫痫发作、全身性强直性痉挛性癫痫发作和胃肠炎)。在这些事件中,3名(2名患者发热和1名患者过敏)被视为adr。
[0481]
未报道死亡。据报道,3名患者有严重ae(2名患者发热和1名患者过敏),且所有这些事件被视为adr。未报道导致治疗中断的ae。
[0482]
直至开始治疗后13周,所有4名患者血清中的抗细胞利波纳酶α抗体均为阳性。直至治疗起始后37周,未检测到在任何患者中的csf中有抗细胞利波纳酶α抗体。
[0483]
未报道生命体征或12导联ecg发现有临床上显著的变化。
[0484]
功效
[0485]
就涉及brineura在小于3岁的cln2患者中的疗效而言,在此研究中,在数据截止后,研究方案进行了修订,以使符合条件的研究群体患者的年龄为出生至《18岁。根据所得最新数据,
27
已向11名患者施用brineura,其中5名小于3岁(3名为2岁,且2名为1岁)。表11展示基线年龄的ml评分。自基线至持续一次评估时间点,ml评分在8名患者中无变化(4名患者维持评分为6分,3名患者维持评分为4分,且1名患者维持评分为2分),2名患者的评分有所改善(1名患者的评分自5分提高至6分,且1名患者的评分自1分提高至2分),且1名患者的评分下将1分(所述患者的评分自4分下将至3分)。在3名2岁患者中,2名患者维持ml评分为6分,且其它患者的评分提高1分(自5分至6分)。两名小于2岁的患者维持ml评分为6分。
[0486]
表11
[0487]
基线和最终评估时间点的ml评分的分布
[0488][0489]
患者数(%)
[0490]
a)两名小于2岁的患者的基线年龄均为1岁。
[0491]
b)此数据包含表29,a)中所述的自闭症患者的ms评分。
[0492]
就涉及小于3岁的患者中的功效而言,结果证实在brineura疗法期间不存在症状恶化。
[0493]
鉴于以上,认为可预期使用brineura可有效预防较年轻患者中的cln2的疾病进展。
[0494]
安全性和严重不良事件
[0495]
关于《3岁的cln2患者的安全性:在此研究中,基于最新数据,在11名患者(6名患者≥3岁,3名患者2岁,且2名患者1岁)中施用brineura,且所有11名患者报道有ae。在其的中,
3名≥3岁的患者(每个患者出现1至3次发热发作)和3名《3岁的患者件(2名2岁的患者发热和过敏;1名1岁的患者药物过敏和药物过敏)中的事经评估为adr,且所有这些事件的结果“恢复”。在6名≥3岁的患者(埃希氏菌泌尿道感染(escherichia urinary tract infection)、胃肠道瘘和肺炎;丙酸杆菌(propionibacterium)测试阳性;发热、腺样体肥大和鼻炎;装置插入并发症;眼眶周围血肿;和发热、龋齿和发热)和3名《3岁的患者(在2岁患者中持续性癫痫和感染;发热、流行性感冒和流行性感冒;和过敏和医疗装置部位血肿)中报道sae。在其的中,2名≥3岁的患者中的事件(发热和发热;和发热)和2名《3岁的患者中的事件(在2岁患者中发热和过敏)经评估为adr,且所有这些事件的结果“恢复”。基于以上,在此研究中在《3岁的患者中未观测到新的临床上显著的ae。
[0496]
基于临床研究和海外港口营销经历中的ae的发生率,brineura输注的安全性被视为可接受的。
[0497]
总的,可预期brineura的某一含量的功效,且当基于≥3岁的cln2患者中的先前研究和包含《3岁的cln2患者中的此研究进行脑室内施用时,brineura的安全性似乎可接受。
[0498]
剂量和施用
[0499]
通过使用手术放置可植入脑室内装置决定施用brineura的脑室内途径以绕过血-脑屏障,直接且充分将酶递送至中枢神经系统,从而达成针对神经症状的功效。
[0500]
在主要药效动力学研究中,在tpp1缺乏的狗(腊肠犬)中,每2周脑室内施用16mg细胞利波纳酶α,
3)
延长神经症状发作的时间,且伴随有长期存活的趋势。基于脑组织中tpp1活性与中枢神经系统中积聚的溶酶体物质更密切相关的事实,基于人类剂量根据脑重量按比例调整因数研究临床剂量。考虑到人脑在2岁之前达至成人脑重量的75%,且在5岁之前达至几乎100%(cereb cortex 1996;6:551-60),按1400g的平均成人脑重量计,2至7岁的脑重量可以在1050至1400g的范围内。考虑到cln2患者中进行性脑萎缩的可能性,本技术人假定此年龄组中的cln2患者的脑重量可能为大约1000g。因为腊肠犬的平均脑重量经估计为50g(《肽药物递送至脑(peptide drug delivery to the brain)》,raven press,1991:112),所以决定人类剂量的按比例调整因数为20倍,且基于各物种之间的脑重量比,向≥2岁的tpp1缺乏的狗(腊肠犬)施用的16mg细胞利波纳酶α的剂量被视为320mg。随后,开始≥3岁的cln2患者中的实例3中所述的研究,其中例如以30mg起始的群组,且考虑到安全性滴定至300mg。确认耐受性之后,评估300mg的功效和安全性,包含固定剂量的时间段。对于此研究,对方案进行修订(数据截止之后)。基于《2岁的患者的脑重量选择剂量
39
以用于研究brineura的功效和安全性:出生至0.5岁的患者为《100mg,0.5至《1岁的患者为150mg,1岁至《2岁的患者前四次剂量为200mg,后续剂量为300mg。在1岁至《2岁的患者中,基于其脑重量,剂量经估计为300mg。然而,初始剂量设定为200mg作为开始用brineura治疗的0.5至《1岁的患者的中间剂量,且基于安全性考虑根据其年龄将剂量自150mg增加至300mg。对于给药间隔,在临床研究中以每两周一次的剂量间隔施用brineura,因为非临床药代动力学研究等中的组织分布的结果表明,预期在cns中暴露于药物活性物质维持每两周一次的剂量间隔。
[0501]
[0502]
对于小于2岁的儿童,降低剂量参考下表(表12)。
[0503]
表12
[0504][0505]
通常,通过使用输注泵以2.5毫升/小时的速率输注此药物,但视患者情况而降低输注速率。
[0506]
包含重度过敏的过敏可在施用此药物时发生。为了缓解症状,考虑在输注开始之前与退热剂一起或不与退热剂一起用抗组织胺预治疗患者30至60分钟。
[0507]
对于临床研究中的输注速率,在所有年龄以2.5毫升/小时的输注速率脑室内施用brineura。如果输注速率经估计在2至7岁患者中为大约100ml csf且在《1岁的患者中为大约50ml csf(《肽药物递送至脑》,raven press 1991:112),那么brineura的输注体积经估计为小于csf的大约10%。人体内csf产生速率通常为约20毫升/小时(《美国生理学杂志(am j physiol)》1962;203:763-74),其为brineura输注速率(2.5毫升/小时)的大约12%,且0.5岁时csf产生速率(经估计为大约2.5-4.7毫升/小时)
40
还假定比brineura输注速率(2.5毫升/小时)大。基于这些数据,brineura的脑室内输注速率似乎对人类csf或csf产生速率无显著影响。
[0508]
考虑到以上,证实基于每2周一次向≥3岁的cln2患者脑室内施用300mg的先前研究和向《3岁的cln2患者每2周一次脑室内施用300mg或更少的此研究的结果,brineura可有效抑制疾病进展,且不造成任何重大安全性问题。
[0509]
实例4-9中所引用的参考文献
[0510]
以下参考文献根据以下编号在本文中引用,和/或以引用的方式并入本文中。
[0511]
arkin,lm,sondhi,d,worgall,s,suh,lh等人《面对基于用于致命病症的基因药品的临床研究中治疗性治疗误解、参与决定和个人动机的问题(confronting the issues of therapeutic misconception,enrollment decisions,and personal motives in genetic medicine-based clinical research studies for fatal disorders.)》《人类基因治疗(hum gene ther)》16[9],1028-1036.2005。
[0512][0513]
awano,t,katz,ml,o'brien,dp,sohar,i等人.《患有神经性类蜡脂褐质病的幼年腊肠犬中的犬tpp1(人类cln2的直系同源物)的框移突变(a frame shift mutation in canine tpp1(the ortholog of human cln2)in a juvenile dachshund with neuronal ceroid lipofuscinosis.)》《分子基因代谢(mol genet metab)》89[3],254-260.2006。
[0514]
brooks r.《euroqol:当前参与状态(euroqol:the current state of play.)》《健康政策》37[1],53-72.1996。
474.2008。
[0535]
xu,s,wang,l,el-banna,m,sohar,i等人.《大体积鞘内酶递送提高晚期婴儿神经性类蜡脂褐质病的小鼠模型的存活率(large-volume intrathecal enzyme delivery increases survival of a mouse model of late infantile neuronal ceroid lipofuscinosis.)》《分子治疗(mol ther)》19[10],2011。
[0536]
实例11
[0537]
此实例描述对来自实例3的第1阶段/第2阶段研究的患者样品进行的额外药代动力学和药效动力学分析。
[0538]
药代动力学分析:在初始剂量、剂量递增阶段期间各新的剂量含量下的第一剂量之后以及稳定剂量阶段的第5周和第13周收集用于药代动力学分析的csf和血液(血浆)样品。给药前(在输注开始之前0.25小时内)和输注结束之后0.25、4、8、20、72和120小时收集样品。开始时给药前以及稳定剂量阶段的每4周收集额外csf和血液(血浆)样品,不论何时不收集连续样品。csf样品是使用icv端口获自侧脑室。
[0539]
利用经验证的电化学发光免疫分析(ecla)法(biomarin pharmaceutical公司,novato,ca,us)分析csf和血浆样品的细胞利波纳酶α浓度。csf中的定量下限(lloq)为20ng/ml,且血浆中的定量下限为16ng/ml。在整个样品测试操作中,质量对照组的分析间准确度(相对误差绝对制%)和精确度(变异是数%)在csf中为≤13.2%,且在血浆中为≤17.2%。
[0540]
利用非分室分析(nca),使用phoenix winnonlin 6.4(pharsight公司,cary,nc,usa),基于csf和血浆中的浓度-时间数据估计pk参数。直接自观测到的数据记录最大浓度(c
max
)和最大浓度时间(t
max
)。所估计的其它pk参数为消除半衰期(t
1/2
);时间0至最后一次可测量浓度的时间的浓度-时间曲线下的面积(auc
0-t
),其利用线性梯形法则估计;外推无穷大的浓度-时间曲线下的面积(auc
0-∞
);吸收洗脱份的清除率(cl);基于末期的分布体积(vz);和稳态分布体积(v
ss
)。
[0541]
免疫原性分析:在基线、剂量递增阶段期间每4周且在开始时和稳定剂量阶段之后每4周收集用于免疫原性的csf和血液(血清)样品。利用经验证的桥接电化学发光分析(biomarin pharmaceutical公司,novato,ca,us)针对对细胞利波纳酶α具有特异性的总抗药物抗体(tab)测试csf和血清样品。使用经验证的基于细胞的流式细胞术分析(biomarin pharmaceutical公司,novato,ca,us)针对阻止细胞利波纳酶α吸收至溶酶体中的中和抗体(nab)进一步表征csf中的tab阳性样品。仅在csf样品中进行nab测试,因为目标作用部位为cns,且针对nab反应测试tab阳性样品。先前已报道完整免疫原性方法和此研究的结果[cherukuri-2018]。
[0542]
统计分析:针对pk群体概述人口统计特征。利用生物基质、剂量组和研究访问以描述方式概述pk参数。以图形方式评估pk参数与人口统计特征、免疫原性、安全性和功效参数的关系,因为pk群体的分析无法评估统计显著性。对于无时间作为共变量的分析,用300mg qow治疗的期间各患者的平均pk参数用作个别患者的暴露的代表性度量。通过在研究访问期间利用300mg qow给药和密集型pk采样(即第一剂量为300mg,和稳定剂量阶段的第5周和第13周)计算c
max
和auc
0-t
值的平均值来推导平均pk参数。
[0543]
结果
[0544]
在各种剂量含量和研究访问内在所有患者中估计pk参数。在300mg qow下,在csf中有24名患者具有可评估pk数据,对比在血浆中有15名患者具有可评估pk数据。
[0545]
单次剂量pk数据可获自接受30(n=3)、100(n=3)或300mg(n=17)(4/4来自剂量,且13/14直接参与稳定剂量阶段)的初始剂量的细胞利波纳酶α的患者(图13)。
[0546]
在csf中,在4小时的输注结束之后在第一采样时间点观测到峰值浓度,且其似乎呈双相衰退。相比于剂量自30至300mg增大10倍,csf暴露增大较小剂量比例,中值c
max
和auc增大大约5至7倍。100mg组中有一名患者在其初始剂量之后高度暴露,且因此,100mg剂量含量的暴露参数由于样品尺寸小而高度可变。此患者的c
max
和auc(由针对100mg组所报道的最大值所示)高于300mg组的中值。尽管无结论性发现公开考虑此离群值暴露,但后续输注300mg之后此患者的csf暴露低于初始100mg剂量之后的其暴露。
[0547]
在研究进行的初始阶段期间,血浆pk样品存储在稳定性范围的外,且因此无数据可用于30mg组,且在100mg组中仅可用于一名患者中。主要基于300mg剂量含量,血浆中的浓度在4小时的icv输注结束之后8至20小时之间达至峰值,且似乎呈两相衰退,经过72小时保持高于上述定量下限(lloq)。
[0548]
自直接参与稳定剂量阶段的患者(n=14)评估多剂量pk数据,所述患者在整个研究中接受300mg的细胞利波纳酶αqow(图14-15)。
[0549]
在第1天、第5周和第13周访问之间csf中的pk参数类似。虽然可变,但在访问中血浆t
max
、c
max
和auc
0-t
与无可辨别趋势相当。在icv施用300mg qow的情况下,血浆中的中值c
max
比csf中低大约1000倍,且血浆中的中值auc
0-t
比csf中低大约300至1000倍。基于患者匹配和访问匹配的pk,csf中对比血浆中c
max
或auc
0-t
的量值之间无明显相关性(图16)。在访问中,c
max
和auc
0-t
的个人间变化分别为在csf中26%-73%和31%-49%对比在血浆中54%-89%和59%-103%。在访问中,c
max
和auc
0-t
的个人内变化分别为在csf中33%和24%对比在血浆中69%和80%。
[0550]
药代动力学和患者特征:针对300mg qow方案评估基线患者特征对细胞利波纳酶αpk的潜在影响。c
max
和auc
0-t
的平均估计值用于代表在疗法疗程内个别患者的暴露,且由于缺乏药物累积或与300mg qow的时间依赖型pk被视为适当的。基线性别、年龄、体重或cln2评分对细胞利波纳酶α在csf或血浆中的暴露无明显效应(图17a-17d)。随着年龄减小,血浆c
max
存在略微增加的趋势,但未展现血浆auc
0-t
。
[0551]
药代动力学和免疫原性:在研究持续时间内,在5/24(21%)患者的csf中且在19/24(79%)患者的血清中检测到抗细胞利波纳酶α的总抗体(tab)。csf tab反应首先在稳定剂量阶段的第13周检测到,而血清tab反应在最早采样时间点(剂量递增阶段的第5周)检测到。在具有csf tab阳性的5名患者中的任一者的csf中未检测到中和抗体(nab),且因此不可用于进一步分析。
[0552]
为了确定细胞利波纳酶αpk是否受抗药物抗体(ada)的发展影响,将具有阳性tab反应的访问的c
max
和auc
0-t
与具有阴性tab反应的访问进行比较。自以300mg开始治疗且具有可评估pk和ada数据的所有患者评估访问匹配的暴露参数和ada状态(即在第1天、第5周稳定剂量和第13周稳定剂量)。纳入具有csf数据的十八名患者(4/4来自剂量递增阶段,且14/14直接参与稳定剂量阶段)和具有血浆/血清数据的14名患者(1/4来自剂量递增阶段,且13/14来自稳定剂量阶段)以进行分析。
[0553]
如图18a中显示,在患者中利用csf ada状态无csf c
max
和auc
0-t
的可辨别的趋势。具有阳性ada反应的访问的csf c
max
和auc
0-t
值恰好在具有阴性ada反应的暴露值的分布内。对于具有访问匹配的pk和csf ada阳性的两名患者,ada阳性访问的csf auc
0-t
与ada阴性访问相比降低了17-27%。在患者中和患者内,在具有血清ada状态的血浆c
max
与auc
0-t
之间观测到无关联(图18b)。血清ada的访问阳性的血浆暴露横跨个别患者内的ada阴性访问的暴露范围。
[0554]
自开始时300mg qow至研究结束,使用运动-语言评分的变化评估细胞利波纳酶αpk与功效结果之间的关系。在此分析中的23名患者中,在治疗48周之后,2名增加一分,13名无变化,5名损失一分,且3名损失两分,总反应率为87%(20/23)。在第48周患者运动-语言评分的变化与csf中个别平均c
max
和auc
0-t
不相关(图19)。评分下降的患者在评分无变化或增加的患者的分布内具有csf暴露参数。类似地,在48周的治疗期间利用患者评分降低最大值评估时展示无相关性。
[0555]
还分析pk与不良事件之间的关系。如上文所指出,包含在至少10%的研究群体中出现的研究药物相关事件以用于分析:发热46%(11/24)、过敏33%(8/24)、癫痫发作33%(8/24)、癫痫症17%(4/24)、头痛13%(3/24)和呕吐13%(3/24)。在发热、过敏、癫痫发作或癫痫症发生或不发生的患者之间,csf或血浆中cmax和auc0-t的无显著不同。相比于无事件的患者,头痛患者具有略微更高的csf暴露趋势,且呕吐患者更容易暴露于csf和血浆两者中。头痛或呕吐患者的暴露通常未超过无事件中的任一者的患者中观测到的最高暴露。
[0556]
上述结果表明,初始icv输注30、100和300mg之后,细胞利波纳酶α证实在csf暴露中低于剂量比例增加。单次剂量范围(分别为2.08
×
105、6.65
×
105和1.42
×
106ng/ml)内的csf c
max
通常与向人脑内的约100ml csf施用的icv剂量的量(分别为3.00
×
105、1.00
×
106和3.00
×
106ng/ml)的预期值一致(pardridge等人,《脑血流与代谢杂志(j.cereb.blood flow metab.)》17,713-731,1997)。在300mg qow下,在研究访问中基于相当的c
max
、auc、cl和v
ss
,无显而易见累积或csf或血浆pk无时间依赖性。考虑到每两周给药频率,此在患者中符合6.2-7.7小时的csf半衰期以及一名患者中11.8小时的可计算血浆半衰期。应强调,csf半衰期不直接反映目标部位,因为数天至数周的cns组织半衰期(来自猴中的评估)和溶酶体半衰期(来自离体人类成纤维细胞)与每两周给药的治疗剂的基本原理最相关。在患者中,csf浓度大于溶酶体k
吸收
达约4天,此是基于动物数据,表面酶至cns组织的普遍分布。此由csf分布体积的估计值支持,所述估计值超过约100ml的典型csf体积。将细胞利波纳酶α直接施用至脑的内部csf空间比起外周产生大约高三个数量级的暴露,其中csf与血浆之间的c
max
或auc的量值无相关性;指示血浆pk不为csf pk的良好替代物。与紧接在输注结束之后出现的csf t
max
相比,血浆t
max
在完成4小时的icv输注之后8小时。与bbb相比血液-csf势垒漏泄,且因此icv施用的药物经由csf流动轨道转运出大脑,且在蜘蛛膜绒毛中吸收至周围血流中(pardridge等人,《液体势垒中枢神经系统(fluids barriers cns.)8:7,2011)。
[0557]
患者之间的csf和血浆pk变化无法由患者人口统计数据解释,因为固有因素似乎与细胞利波纳酶α暴露不相关。根据脑质量设计细胞利波纳酶α的icv剂量,且因此将预期csf暴露在此研究中对于年龄(3-8岁)和体重(14.5-26.0kg)的范围无显著变化。人脑在2岁前平均达到成人质量的约75%,且在5岁前达到100%,其中发育期间脑与体重的比进行性地减小(giedd等人,《脑皮质(cereb.cortex.)》6:551-560,1996)。3岁至8-9岁之间,与
14.1-26.0kg和15.6-27.5kg的体重相比,未患病人类的脑重量分别为男性平均1.09-1.18kg,女性平均1.27-1.37kg(dekaban等人,《神经学年报》4,345-356,1978)。因此,相比于体重变化80%,在此研究中在年龄范围内脑重量变化仅为8%。值得注意的,随着年龄减小,血浆c
max
略微增加的趋势有可能归因于早期童年期间体重对比脑重量的不相称变化。尽管年龄与脑重量匹配,但icv剂量的量吸收至明显较小体重和相应较小的血容量中,从而导致全身暴露更集中。
[0558]
csf暴露中的患者之间的变化可能归因于疾病严重程度的差异而非icv施用的酶固有的变化,因为患者内的变化比患者之间的变化小得多(csf c
max
为33%,且csf auc
0-t
为24%)。尽管未展示csf暴露与基线cln2评分之间的关联,但对cns可存在病理学效果,其在csf pk中翻译,但不经翻译为临床评定评分变化。由于此后发生全身性吸收,因此血浆pk的患者间和患者内变化均显著高于csf中的变化,部分是因为由具有可定量浓度的血浆样品的数目不足。
[0559]
基于300mg qow的患者匹配和访问匹配的分析,ada在csf和血清中的存在似乎分别对csf和血浆中的pk无影响。大部分经治疗患者在血清中发现ada,表明细胞利波纳酶α的血浆暴露将有可能引起血清中的ada阳性,此与其它ert一致,因为患者缺乏内源蛋白(long等人,《临床疗法(clin.ther.)》39:118-129,2017)。在此研究中出现ada反应先前经证实不预测不利的安全概况或不良的治疗结果(cherukuri等人,《临床免疫学(clin.immunol.)》197:68-76,2018)。对于与细胞利波纳酶α相关的最常见不良事件,csf与血浆暴露和发热、过敏、癫痫发作或癫痫症的发生之间无明显相关性。考虑到两个事件的样品尺寸较小(3/24患者),频率较低,因此对头痛和呕吐发生伴随的暴露增加的微小趋势的解释受到限制。
[0560]
如通过在300mg qow的48周之后的cln2评分变化所测量,对治疗的反应似乎与csf暴露的量值不相关,指示在300mg qow的暴露范围内获得最大效益。值得注意的,cln2患者中的csf暴露超过与tpp1空狗中的有效16mg剂量相关的暴露,表明这些暴露在暴露-反应关系的平稳阶段内(katz等人,《神经科学研究杂志》92,1591-1598,2014;vuillemenot等人,《分子基因代谢(mol.genet.metab.)》114,281-293,2015)。不管患者间和患者内pk变化,在临床300mg剂量下具有可报道csf auc
0-t
的访问的91%(62/68)的值高于tpp1空的经治疗狗中的平均值csf auc
0-t
(6.45
×
106ng-小时/ml)(vuillemenot 2015,见上文)。在cln2突变小鼠研究中已展示tpp1的低表达量显著缓解疾病,其中脑中仅6%的正常tpp1活性将寿命增加至几乎与野生型小鼠一样(sleat 2008,见上文)。综合而言,这些非临床和临床数据指示300mg qow下的细胞利波纳酶岬菟椭甀icv提供足够的tpp1暴露于cns以获得有意义的治疗效益。此为icv施用的蛋白质的临床csf和血浆药代动力学的第一特征。
[0561]
本说明书中所引用的所有公开案、专利和专利申请案均以引用的方式并入本文中,就如同各个别公开案或专利申请案特定地且个别地指示以引用的方式并入一般。尽管已出于清楚理解的目的借助于说明和实例相当详细地描述前述发明,但根据本公开案的教示,本领域普通技术人员将显而易知,可在不背离所附权利要求书的精神或范围的情况下对其进行某些变化和修改。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。