1.本发明属于观赏植物组织培养技术领域,尤其涉及一种美人蕉属植物种子离体萌发及高效快繁的方法。
背景技术:
2.目前,美人蕉(canna spp.)是美人蕉科美人蕉属多年生球根花卉,原产美洲,可应用于园林绿化、污染水体净化、食用及治疗疾病,是一种观赏、生态及药食两用的园林花卉。美人蕉的传统繁殖方式多采用分株繁殖,繁殖系数极低,且长期的无性繁殖易造成新生植株体内病毒积累,导致品种退化,新品种选育速度极慢,极大限制了美人蕉的进一步应用;可结实美人蕉可通过播种繁殖,如大花美人蕉、芭蕉芋、水生美人蕉等种群,是现代美人蕉属植物品种改良的重要亲本,但美人蕉属植物的种子种皮致密坚硬,常规播种出苗率不足2%。
3.现有的美人蕉离体繁殖技术存在的问题及缺陷为:现有的美人蕉属植物繁殖方法繁殖系数极低,易造成新生植株体内病毒积累、品种退化,种子种皮致密坚硬自然萌发率较低,限制了美人蕉杂交新品种推广应用。
技术实现要素:
4.针对现有技术存在的问题,本发明提供了一种美人蕉属植物种子离体萌发及高效快繁的方法。
5.本发明是这样实现的:一种美人蕉属植物种子离体萌发及高效快繁的方法,所述美人蕉属植物种子离体萌发及高效快繁的方法包括:
6.通过对美人蕉的自然结实种子的采集和消毒后,接种于离体萌发培养基中诱导种子萌发,再以无菌苗为外植体,进行无菌苗的切取,接种在不同基础培养基中进行不定芽增殖培养、试管苗的生根培养、试管苗的驯化移栽。
7.进一步,所述美人蕉属植物种子离体萌发及高效快繁的方法包括以下步骤:
8.步骤一,于美人蕉属植物种子成熟、种皮坚硬且呈黑褐色时,进行美人蕉属植物种子的采收,将采收的种子放置于阴凉处自然风干,并从中选择自然结实的种子;
9.步骤二,将选择的种子进行预处理,并将预处理后的种子接种于种子离体萌发培养基中进行培养,得到无菌苗;
10.步骤三,将得到的无菌苗切除种子部分,取健壮苗转接于不定芽增殖培养基中进行培养,得到不定芽;
11.步骤四,将得到的不定芽转分成单株接种于生根培养基进行培养,得到生根苗;将得到的生根苗驯化后移栽温室即可。
12.进一步,所述将选择的种子进行预处理包括:
13.首先,将选择的种子利用浓硫酸浸泡120min后再利用清水冲洗至中性;
14.其次,在超净工作台上,利用75%乙醇对清洗后的种子浸泡30s,再利用无菌水冲
洗所述种子4~5次;
15.最后,利用hgcl2浸泡所述种子15min,再利用无菌水冲洗所述种子4~5次,并利用无菌滤纸上吸干水分,得到预处理后的种子。
16.进一步,所述浓硫酸浓度为98%;所述hgcl2的浓度为0.1%。
17.进一步,所述将预处理后的种子接种于种子离体萌发培养基中进行培养包括:
18.将预处理后的种子接种于种子离体萌发培养基中于25
±
2℃、光强2000lx~3000lx、光照周期16h/d下进行培养;
19.所述种子离体萌发培养基由ms、1mg/l的6-ba、0.5mg/l的naa、1~3mm的2kg/l的玻璃珠以及30g/l蔗糖组成;所述种子离体萌发培养基ph为5.8~6.0。
20.进一步,所述取健壮苗转接于不定芽增殖培养基中进行培养包括:
21.取株高2~3cm的健壮苗转接于不定芽增殖培养基中于25
±
2℃、光强2000lx~3000lx、光照周期16h/d下培养25~30d。
22.进一步,所述不定芽增殖培养基可为ms、3mg/l的6-ba、1.5mg/l的naa、2kg/l的1~3mm的玻璃珠以及30g/l蔗糖组成的培养基;
23.所述不定芽增殖培养基可为b5、3mg/l的6-ba、1.5mg/l的naa、2kg/l的1~3mm的玻璃珠以及30g/l蔗糖组成的培养基;
24.所述不定芽增殖培养基可为n6、3mg/l的6-ba、1.5mg/l的naa、2kg/l的1~3mm的玻璃珠以及30g/l蔗糖组成的培养基;
25.所述不定芽增殖培养基的ph为5.8~6.0。
26.进一步,所述将得到的不定芽转分成单株接种于生根培养基进行培养包括:
27.将得到的不定芽转分成单株接种于生根培养基中于25
±
2℃、光强2000lx~3000lx、光照周期16h/d下培养25~30d;
28.所述生根诱导培养基由1/2ms、2kg/l的1~3mm玻璃珠以及15g/l的蔗糖组成;所述生根诱导培养基的ph为5.8~6.0。
29.进一步,所述驯化包括:于驯化移栽基质中驯化7d。
30.进一步,所述驯化移栽基质由泥炭土、珍珠岩、原土按6:3:1的比例混合而成。
31.结合上述的技术方案和解决的技术问题,请从以下几方面分析本发明所要保护的技术方案所具备的优点及积极效果为:
32.第一、针对上述现有技术存在的技术问题以及解决该问题的难度,紧密结合本发明的所要保护的技术方案以及研发过程中结果和数据等,详细、深刻地分析本发明技术方案如何解决的技术问题,解决问题之后带来的一些具备创造性的技术效果。具体描述如下:
33.本发明建立了美人蕉属植物种子无菌高效萌发体系及离体快繁体系,应用于大花美人蕉
‘
墨红’、大花美人蕉
‘
grand due’、水生美人蕉和芭蕉芋的栽培上,本发明中所选择品种大花美人蕉
‘
墨红’、大花美人蕉
‘
grand due’、水生美人蕉的种子均可通过江苏长景种业有限公司采购;芭蕉芋种子可通过贵州省亚热带作物研究所采购。大花美人蕉
‘
墨红’、大花美人蕉
‘
grand due’、水生美人蕉和芭蕉芋种子的无菌萌发率最高分别为94.19%、75.56%、76.67%和83.33%以上,大花美人蕉
‘
墨红’的不定芽增殖培养基增殖系数达4.98倍,不定芽增殖率为95%,生根率达100%,驯化成活率达100%。
34.本发明对美人蕉属植物的自然结实种子进行离体萌发及离体快繁技术研究,利用
组织培养技术繁殖美人蕉属植物无菌苗,并对培养基状态进行优化改进,实验过程中培养基介质使用简单易操作,并且可循环使用。
35.本发明提供的美人蕉属植物组培再生方法,解决了利用新品种选育过程中种子萌发率低和优良品种繁殖系数小等问题;采用玻璃珠 液体培养基作为培养基质,大大降低了琼脂和激素的使用,节约了培养成本;同时本发明大大缩短了美人蕉属植物种子萌发时间,缩短了育种进程,提高了不定芽增殖系数,为种苗繁育和商品化应用提供技术支撑。
36.本发明于美人蕉属植物种子成熟、种皮坚硬且呈黑褐色时,进行美人蕉属植物种子的采收,将采收的种子放置于阴凉处自然风干,并从中选择自然结实的种子,能够提高种子萌发率。
37.本发明将选择的种子进行预处理,并将预处理后的种子接种于种子离体萌发培养基中进行培养,得到无菌苗,能够为不定芽增殖培养时提供大量的外植体。
38.本发明将得到的无菌苗切除种子部分能够避免不定芽增殖时受种子内其他成分影响增殖效果。
39.本发明将得到的不定芽转分成单株接种于生根培养基进行培养,得到生根苗;将得到的生根苗驯化后移栽温室,能够提高再生单株成活率。
40.本发明利用98%浓硫酸对种子处理120min能够破坏种子的坚硬种皮,有利于无菌培养时快速吸水萌发;利用75%乙醇、无菌水、0.1%hgcl2处理种子的目的是为离体萌发时提供无菌材料。
41.本发明种子离体萌发培养基中,设置25
±
2℃、光强2000lx~3000lx和光照周期16h/d能够确保种子在适宜温度、光照条件下顺利萌发;种子离体萌发培养基中,ms和30g/l蔗糖能够为种子萌发过程中提供培养基所需营养元素,1mg/l的6-ba、0.5mg/l的naa能够促进种子萌发苗快速生长,1~3mm的2kg/l的玻璃珠能够为种子萌发过程中提供适宜培养基状态。
42.本发明不定芽增殖培养基中,取株高2~3cm的健壮苗、设置25
±
2℃、光强2000lx~3000lx和光照周期16h/d能够确保无菌苗在适宜温度、光照条件下顺利增殖;不定芽增殖培养基中,ms、b5、n6和30g/l蔗糖能够为不定芽增殖过程中提供培养基所需营养元素,3mg/l的6-ba、1.5mg/l的naa能够为不定芽增殖速率加快,1~3mm的2kg/l的玻璃珠能够为不定芽增殖过程中提供适宜培养基状态。
43.本发明不定芽生根培养基中,设置25
±
2℃、光强2000lx~3000lx和光照周期16h/d能够确保不定芽在适宜温度、光照条件下顺利生根;不定芽生根培养基中,1/2ms和15g/l蔗糖能够为不定芽生根过程中提供培养基所需营养元素,1~3mm的2kg/l的玻璃珠能够为不定芽生根过程中提供适宜培养基状态。
44.本发明驯化7d能够减轻移栽过程中对根系的伤害以及提高生根苗对生长环境变化适应能力。驯化移栽基质由泥炭土、珍珠岩、原土按6:3:1的比例混合能够为生根苗提供适宜的生长基质,提高移栽成活率。
45.第二,把技术方案看做一个整体或者从产品的角度,本发明所要保护的技术方案具备的技术效果和优点,具体描述如下:
46.本发明建立美人蕉种子组培快繁体系,可以加速美人蕉育种进程,加快获得优良杂种无性系,推进新品种的快速应用;同时可为优良杂交种质的离体保存提供优良材料和
技术体系,对美人蕉的种苗繁育和生产栽培具有重要意义。
47.第三,作为本发明的权利要求的创造性辅助证据,还体现在以下几个重要方面:
48.本发明的技术方案解决了人们一直渴望解决、但始终未能获得成功的技术难题:
49.传统的美人蕉属植物繁殖方法的繁殖系数极低,且易品种退化,种子种皮致密坚硬自然萌发率较低,限制了美人蕉杂交新品种推广应用。因此,本发明建立美人蕉种子组培快繁体系,提高了不定芽增殖系数,加速了美人蕉新品种育种进程,加快获得优良杂种无性系,推进新品种的快速应用;同时为优良杂交种质的离体保存提供优良材料和技术体系。
附图说明
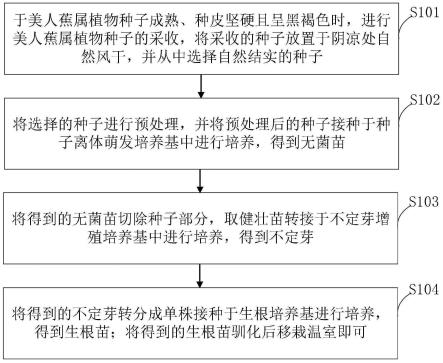
50.图1是本发明实施例提供的美人蕉属植物种子离体萌发及高效快繁的方法流程图。
51.图2是本发明实施例提供的将选择的种子进行预处理的方法流程图。
具体实施方式
52.为了使本发明的目的、技术方案及优点更加清楚明白,以下结合实施例,对本发明进行进一步详细说明。应当理解,此处所描述的具体实施例仅仅用以解释本发明,并不用于限定本发明。
53.一、解释说明实施例。为了使本领域技术人员充分了解本发明如何具体实现,该部分是对权利要求技术方案进行展开说明的解释说明实施例。
54.本发明实施例提供的美人蕉属植物种子离体萌发及高效快繁的方法包括:
55.进行种子的采集、种子的消毒、接种、离体萌发、无菌苗的切取和不定芽增殖培养、试管苗的生根培养、试管苗的移栽驯化。
56.如图1所示,本发明实施例提供的美人蕉属植物种子离体萌发及高效快繁的方法包括以下步骤:
57.s101,于美人蕉属植物种子成熟、种皮坚硬且呈黑褐色时,进行美人蕉属植物种子的采收,将采收的种子放置于阴凉处自然风干,并从中选择自然结实的种子;
58.s102,将选择的种子进行预处理,并将预处理后的种子接种于种子离体萌发培养基中进行培养,得到无菌苗;
59.s103,将得到的无菌苗切除种子部分,取健壮苗转接于不定芽增殖培养基中进行培养,得到不定芽;
60.s104,将得到的不定芽转分成单株接种于生根培养基进行培养,得到生根苗;将得到的生根苗驯化后移栽温室即可。
61.如图2所示,本发明实施例提供的将选择的种子进行预处理包括:
62.s201,将选择的种子利用98%的浓硫酸浸泡120min后再利用清水冲洗至中性;
63.s202,在超净工作台上,利用75%乙醇对清洗后的种子浸泡30s,再利用无菌水冲洗所述种子4~5次;
64.s203,利用0.1%的hgcl2浸泡所述种子15min,再利用无菌水冲洗所述种子4~5次,并利用无菌滤纸上吸干水分,得到预处理后的种子。
65.本发明实施例提供的将预处理后的种子接种于种子离体萌发培养基中进行培养
包括:
66.将预处理后的种子接种于ph为5.8~6.0的由ms、1mg/l的6-ba、0.5mg/l的naa、1~3mm的2kg/l的玻璃珠以及30g/l蔗糖组成的种子离体萌发培养基中于25
±
2℃、光强2000lx~3000lx、光照周期16h/d下进行培养。
67.本发明实施例提供的取健壮苗转接于不定芽增殖培养基中进行培养包括:
68.取株高2~3cm的健壮苗转接于ph为5.8~6.0的不定芽增殖培养基中于25
±
2℃、光强2000lx~3000lx、光照周期16h/d下培养25~30d。
69.本发明实施例提供的不定芽增殖培养基可为ms、3mg/l的6-ba、1.5mg/l的naa、2kg/l的1~3mm的玻璃珠以及30g/l蔗糖组成的培养基。
70.本发明实施例提供的不定芽增殖培养基可为b5、3mg/l的6-ba、1.5mg/l的naa、2kg/l的1~3mm的玻璃珠以及30g/l蔗糖组成的培养基。
71.本发明实施例提供的不定芽增殖培养基可为n6、3mg/l的6-ba、1.5mg/l的naa、2kg/l的1~3mm的玻璃珠以及30g/l蔗糖组成的培养基。
72.本发明实施例提供的将得到的不定芽转分成单株接种于生根培养基进行培养包括:
73.将得到的不定芽转分成单株接种于由1/2ms、2kg/l的1~3mm玻璃珠以及15g/l的蔗糖组成的ph为5.8~6.0的生根培养基中于25
±
2℃、光强2000lx~3000lx、光照周期16h/d下培养25~30d。
74.本发明实施例提供的驯化包括:于驯化移栽基质中驯化7d。
75.本发明实施例提供的驯化移栽基质由泥炭土、珍珠岩、原土按6:3:1的比例混合而成。
76.下面结合具体实施例对本发明的技术方案做进一步说明。
77.实施例1:
78.本发明提供的美人蕉属植物种子离体萌发及高效快繁的方法,其步骤包含:
79.1)、种子的采集
80.选择美人蕉属植物的自然结实种子,待种子成熟,种皮坚硬且变为黑褐色时,人工采收,阴凉处自然风干。
81.2)、消毒与接种
82.将1)的种子用98%浓硫酸浸泡120min。清水冲洗至中性后,在超净工作台上,用75%乙醇浸泡30s,无菌水冲洗4~5次,0.1%hgcl2浸泡15min,无菌水冲洗4~5次,无菌滤纸上吸干水分,接种于种子离体萌发培养基。
83.3)、种子的离体萌发
84.将2)完成接种的种子离体萌发培养基进行培养,25
±
2℃,光强2000lx~3000lx,光照周期16h/d。
85.4)、无菌苗的切取和不定芽增殖培养
86.将3)萌发得到的无菌苗切掉种子部分,取株高2~3cm的健壮苗,转接于不定芽增殖培养基,25
±
2℃,光强2000lx~3000lx,光照周期16h/d,培养25~30d;
87.5)试管苗的生根培养
88.将4)得到的不定芽转分成单株接于生根培养基,25
±
2℃,光强2000lx~3000lx,
光照周期16h/d,培养25~30d;
89.6)、试管苗的移栽驯化
90.将5)得到的生根苗驯化7d后移栽温室。
91.所述种子无菌萌发培养基为:ms 6-ba 1mg/l naa 0.5mg/l 1~3mm玻璃珠2kg/l 蔗糖30g/l,ph5.8~6.0。
92.所述不定芽增殖培养基为:ms 6-ba 3mg/l naa 1.5mg/l 1~3mm玻璃珠2kg/l 蔗糖30g/l,ph5.8~6.0。
93.所述不定芽增殖培养基为:b5 6-ba 3mg/l naa 1.5mg/l 1~3mm玻璃珠2kg/l 蔗糖30g/l,ph5.8~6.0。
94.所述不定芽增殖培养基为:n6 6-ba 3mg/l naa 1.5mg/l 1~3mm玻璃珠2kg/l 蔗糖30g/l,ph5.8~6.0。
95.所述生根培养基为:1/2ms 1~3mm玻璃珠2kg/l 蔗糖15g/l,ph5.8~6.0。
96.所述驯化移栽基质为:泥炭土:珍珠岩:原土=6:3:1。
97.二、应用实施例。为了证明本发明的技术方案的创造性和技术价值,该部分是对权利要求技术方案进行具体产品上或相关技术上的应用实施例。
98.本发明将美人蕉属植物种子离体萌发及高效快繁方法应用在大花美人蕉
‘
墨红’、大花美人蕉
‘
grand due’、水生美人蕉、芭蕉芋或其他美人蕉属植物种子的离体萌发及高效快繁中。
99.三、实施例相关效果的证据。本发明实施例在研发或者使用过程中取得了一些积极效果,和现有技术相比的确具备很大的优势,下面内容结合试验过程的数据、图表等进行描述。
100.本发明美人蕉属植物种子离体萌发及高效快繁的方法,其步骤包含:
101.1)种子的采集
102.选择美人蕉属植物的自然结实种子,待种子成熟,种皮坚硬且变为黑褐色时,人工采收:大花美人蕉
‘
墨红’、大花美人蕉
‘
grand due’、水生美人蕉和芭蕉芋的自然结实种子,阴凉处自然风干。
103.2)消毒与接种
104.将步骤1)的种子用98%浓硫酸浸泡120min。清水冲洗至中性后,在超净工作台上,用75%乙醇浸泡30s,无菌水冲洗4~5次,0.1%hgcl2浸泡15min,无菌水冲洗4~5次,无菌滤纸上吸干水分,接种于种子离体萌发培养基。
105.3)种子的离体萌发
106.将步骤2)完成接种的种子离体萌发培养基进行培养,25
±
2℃,光强2000lx~3000lx,光照周期16h/d。种子萌发率的实验如下表:
107.种子123a92.33%90.47%94.19%b75.56%73.33%70.00%c66.67%76.67%70.00%d76.67%83.33%73.33%
108.其中,a为大花美人蕉
‘
墨红’,b为大花美人蕉
‘
grand due’,c为水生美人蕉,d为芭
蕉芋。培养基成分为ms 6-ba 1mg/l naa 0.5mg/l 1~3mm玻璃珠2kg/l 蔗糖30g/l。ph均为5.8~6.0,其余参数一致。进行3次对比试验,统计后发明优选的种子无菌萌发培养基大花美人蕉
‘
墨红’、大花美人蕉
‘
grand due’、水生美人蕉和芭蕉芋种子萌发率最高分别为94.19%、75.56%、76.67%和83.33%以上,效果最好。
109.4)无菌苗的切取和不定芽增殖培养ⅰ110.将步骤3)萌发得到的大花美人蕉
‘
墨红’无菌苗切掉种子部分,取株高2-3cm的健壮苗,转接于不定芽增殖培养基e,25
±
2℃,光强2000lx~3000lx,光照周期16h/d,培养25~30d;
[0111][0112][0113]
e为ms 6-ba 3mg/l naa 1.5mg/l 1~3mm玻璃珠2kg/l 蔗糖30g/l。ph均为5.8~6.0,其余参数一致。进行3次对比试验,统计后发明优选的不定芽增殖培养基增殖系数达4.98倍,不定芽增殖率为95.00%,整体增殖效果最好。
[0114]
5)无菌苗的切取和不定芽增殖培养ⅱ[0115]
将步骤3)萌发得到的大花美人蕉
‘
墨红’无菌苗切掉种子部分,取株高2-3cm的健壮苗,转接于不定芽增殖培养基f、g、h,25
±
2℃,光强2000lx~3000lx,光照周期16h/d,培养25~30d;
[0116][0117]
f为ms 6-ba 3mg/l naa 1.5mg/l 1~3mm玻璃珠2kg/l 蔗糖30g/l,g为b5 6-ba 3mg/l naa 1.5mg/l 1~3mm玻璃珠2kg/l 蔗糖30g/l,h为n6 6-ba 3mg/l naa 1.5mg/l 1~3mm玻璃珠2kg/l 蔗糖30g/l。ph均为5.8~6.0,其余参数一致。进行3次对比试验,统计后发明优选的不定芽增殖培养基增殖系数f达4.71倍、g达3.44倍和h达3.08倍,不定芽增殖率分别达86.33%、97.11%、62.01%,不定芽增殖培养基f的整体效果最好。
[0118]
6)试管苗的生根培养
[0119]
将步骤4)、步骤5)得到的不定芽转分成单株接于生根培养基,25
±
2℃,光强2000lx~3000lx,光照周期16h/d,培养25~30d;
[0120][0121]
其中,i为1/2ms 1~3mm玻璃珠2kg/l 蔗糖15g/l。ph均为5.8~6.0,其余参数一致。进行3次对比试验,统计后发明优选的生根培养基生根率达100%,效果最好。
[0122]
7)试管苗的移栽驯化
[0123]
将步骤6)得到的生根苗驯化7d,移栽温室,移栽成活率为100%,生长状况良好。其中,驯化移栽基质为:泥炭土:珍珠岩:原土=6:3:1。
[0124]
以上所述,仅为本发明的具体实施方式,但本发明的保护范围并不局限于此,任何熟悉本技术领域的技术人员在本发明揭露的技术范围内,凡在本发明的精神和原则之内所作的任何修改、等同替换和改进等,都应涵盖在本发明的保护范围之内。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。