1.本发明涉及生物材料技术领域,具体涉及一种硒鎓盐抗菌聚酯及其制备方法与应用。
背景技术:
2.塑料时代的来临,给人们带来极大便利的同时,不可降解塑料所造成的环境问题也不容忽视。脂肪族聚酯是目前应用最广泛的生物可降解材料,具有良好生物相容性,其相关制品已经商品化。
3.在众多的聚酯材料中,聚(ε-己内酯)(pcl)是研究最广泛的可生物降解聚合物之一,已被批准用于生物医学和制药领域。在大多数情况下,pcl是通过开环聚合合成的,这是因为开环聚合便于实现活性聚合的过程,可以合成有特定分子结构的聚合物。pcl虽然已经被证明是组织工程领域所使用的最佳聚合物之一,但是,由于其聚合物链中缺乏抗菌部分,所以容易被细菌感染,这也造成了其应用的局限性。目前,pcl与银纳米粒子、氧化锌纳米粒子、纳米铜等纳米工程材料以及一些小分子抗菌剂物理共混是获得抗菌聚酯的最简单方法。然而这种直接共混的方法具有不可控的释放方式,材料与抗菌剂的相容性也是一个巨大的挑战。另外,抗菌剂的浸出,会造成环境的污染,以及材料抗菌活性的下降。
4.通过化学键将杀菌剂固定在聚合物链上可以赋予材料永久的抗菌性。taejun eom等人首次合成了硒鎓离子聚合物(eom,t.;khan,a.polyselenonium salts:synthesis through sequential selenium-epoxy
‘
click’chemistry and se-alkylation.chemical communications 2020,56,14271-14274),并探索了其抗菌性能,其中结构最优的聚合物对大肠杆菌和金黄色葡萄球菌的最小抑菌浓度高达500μg/ml。抗菌物质在杀菌的同时存在环境积累等问题,长期存在于环境中可以诱导产生耐药菌,而酯键作为可降解基团,引入聚合物链中,不仅避免了毒性在环境中的积累,符合抗菌剂未来的发展方向,也实现了对抗菌材料寿命的调节。基于此,本课题组在2021年合成一种硒鎓盐聚酯(li,y.;xing,d.;zhu j.synthesis and antibacterial activity of selenium-functionalized poly(ε-caprolactone).chin j polym sci 2022,40,67-74.),其最小的抑菌浓度降至62.5μg/ml,远优于taejun eom等人合成的聚合物的抗菌效果。本发明在此基础上,通过对聚合物结构的进一步探索和优化,获得一类具有极高抗菌活性的新型硒鎓盐聚酯。
技术实现要素:
5.本发明要解决的技术问题是提供一种硒鎓盐抗菌聚酯及其制备方法与应用,本发明设计合成了一系列不同硒醚功能化的己内酯单体,并在催化剂的作用下,通过开环聚合制备得到含硒聚酯,进一步通过烷基化反应,得到了硒鎓盐聚酯;该类硒鎓盐聚酯对大肠杆菌和金黄色葡萄球菌具有良好的抑制效果,最小的抑菌浓度仅为1μg/ml。
6.为解决上述技术问题,本发明提供以下技术方案:
7.本发明第一方面提供了一种硒鎓盐抗菌聚酯,所述硒鎓盐抗菌聚酯的结构式如下
烯)、tu(硫脲)、tu1中的一种或几种;其中mtbd、tbd、dbu为有机碱。
23.进一步地,步骤(1)中,所述单体、引发剂、催化剂的摩尔比为50~200:1:3~15;当所述催化剂包含硫脲和碱时,所述硫脲和碱的摩尔比为2:1。
24.进一步地,步骤(1)中,所述开环聚合反应的温度为20~35℃。
25.进一步地,步骤(2)中,所述甲基化试剂为碘甲烷,所述硼氟酸盐为agbf4。
26.进一步地,所述方法还包括将产物含硒聚酯、硒鎓盐抗菌聚酯在乙醚中沉降提纯的过程。
27.本发明第三方面提供了一种第一方面所述的硒鎓盐抗菌聚酯作为抗菌敷料的应用。
28.本发明第四方面提供了一种第一方面所述的硒鎓盐抗菌聚酯作为组织工程材料的应用。
29.本发明第五方面提供了一种第一方面所述的硒鎓盐抗菌聚酯作为药物控释载体的应用。
30.本发明的有益效果在于:
31.1.本发明通过在聚酯材料中引入硒鎓离子的结构,制备得到一种兼具抗菌性与可降解性的抗菌聚酯,对革兰氏阳性菌和革兰氏阴性菌均具有良好的抑制作用,最小的抑菌浓度仅为1μg/ml,远低于现有技术中硒鎓离子聚合物的抑菌浓度。
32.2.本发明合成一类硒醚功能化的己内酯单体,再通过开环聚合、甲基化反应制备得到分子量可控且分布窄的硒鎓盐抗菌聚酯;制备方法简单且过程易控,可操作性强,制备得到的硒鎓盐聚酯表现出优异的抑菌效果,同时具有良好的生物相容性,在抗菌敷料、组织工程材料以及药物控释载体等生物医药领域具有良好的应用前景。
附图说明
33.图1为催化剂tu1的核磁共振氢谱;
34.图2(a)为实施例2制备的c3secl的核磁共振氢谱;
35.图2(b)为实施例2制备的c5secl的核磁共振氢谱;
36.图2(c)为实施例2制备的clseph的核磁共振氢谱;
37.图2(d)为实施例2制备的c
10
secl的核磁共振氢谱;
38.图3(a)为实施例3制备的pc3secl的核磁共振氢谱;
39.图3(b)为实施例3制备的pc5secl的核磁共振氢谱;
40.图3(c)为实施例3制备的pclseph的核磁共振氢谱;
41.图3(d)为实施例3制备的pc
10
secl的核磁共振氢谱;
42.图4为实施例3制备的不同侧链的含硒聚酯的凝胶色谱图;
43.图5(a)为实施例3制备的不同侧链的含硒聚酯的热重图;
44.图5(b)为实施例3制备的不同侧链的含硒聚酯的差式扫描量热分析图;
45.图6为实施例4制备的不同侧链的硒鎓盐聚酯的核磁共振氢谱;
46.图7为抑菌效果随不同侧链的硒鎓盐聚酯的浓度的变化;
47.图8为不同侧链的硒鎓盐聚酯对小鼠成纤维细胞的细胞活性的影响;
48.图9为pclse
ph(dp=13)与金黄色葡萄球菌、大肠细菌作用前后的电位变化;
49.图10为pclse
ph(dp=13)与金黄色葡萄球菌、大肠细菌作用前后的扫描电镜图;
50.图11为共混膜的制备示意图及其抗菌活性测试对比图。
具体实施方式
51.下面结合附图和具体实施例对本发明作进一步说明,以使本领域的技术人员可以更好地理解本发明并能予以实施,但所举实施例不作为对本发明的限定。
52.除非另有定义,本文所使用的所有的技术和科学术语与属于本发明的技术领域的技术人员通常理解的含义相同。本文中在本发明的说明书中所使用的术语只是为了描述具体的实施例的目的,不是旨在于限制本发明。本文所使用的术语“及/或”包括一个或多个相关的所列项目的任意的和所有的组合。
53.实施例1催化剂tu1的合成
54.本实施例涉及催化剂tu1的合成,具体如下:
55.向环己胺(10mmol)和thf(30ml)的溶液中加入4-三氟甲基异氰酸酯(10mmol),在室温下搅拌2h。旋转蒸发除去溶剂之后,在ch2cl2中重结晶,得白色固体即为产物tu1;对产物进行1h nmr表征,表征结果如图1所示。
56.实施例2不同侧链的硒醚功能化己内酯单体的制备
57.本实施例涉及不同侧链的硒醚功能化己内酯单体的制备,具体如下:
58.正丙基硒醚己内酯(c3secl)合成:在100ml的schlenk瓶中,加入ε-己内酯(4.56g,40mmol)的thf(20ml)溶液中,在通氮气的条件下,冷却至-78℃。用注射器将二异丙基氨基锂(lda)溶液(2m的thf/正庚烷/乙苯溶液,20.5ml,41mmol)滴加至schlenk烧瓶中,滴加结束后,反应1h。然后将正丙基溴化硒(9.7g,48mmol)溶解在20ml干燥的thf中,通过注射器逐滴加入,滴加结束后,tlc点板跟踪反应。反应结束后,逐渐升至室温,加入去离子水稀释,并用ch2cl2萃取三次,合并有机层,用饱和氯化钠洗涤后,加入无水硫酸钠干燥。旋转蒸发除去溶剂之后,用石油醚/乙酸乙酯(体积比为10:1)柱层析分离,得淡黄色液体即为产物。对产物进行1h nmr表征,表征结果如图2(a)所示。
59.正戊基硒醚己内酯(c5secl)的合成:与上述c3secl合成步骤基本一致,不同的是将正丙基溴化硒替换为正戊基溴化硒,对制备的产物进行1h nmr表征,表征结果如图2(b)所示。
60.苯基硒醚己内酯(clseph)的合成:与上述c3secl合成步骤基本一致,不同的是将正丙基溴化硒替换为苯基溴化硒,对制备的产物进行1h nmr表征,表征结果如图2(c)所示。
61.正癸基硒醚己内酯(c
10
secl)的合成:与上述c3secl合成步骤基本一致,不同的是将正丙基溴化硒替换为正癸基溴化硒,对制备的产物进行1h nmr表征,表征结果如图2(d)所示。
62.实施例3不同侧链的含硒聚酯的制备
63.本实施例涉及不同侧链的含硒聚酯的制备,具体如下:
64.pc3secl的制备:在充满氮气的手套箱中,先将实施例1制备的tu1(74mg,0.2mmol)
和dbu(15.2mg,0.1mmol)以及2ml的thf加入5ml安瓿瓶中,在室温下搅拌10分钟。然后,加入bnoh(10.8mg,0.1mmol)并在室温下搅拌10分钟。最后,将实施例2制备的额c3secl(1.18g,5mmol)加入安瓿瓶中,封管。将安瓿瓶置于室温下搅拌至设定时间,聚合完成后,加入苯甲酸的thf溶液淬灭反应,并在无水乙醚中沉降,通过离心收集产物,并在40℃下真空干燥至恒重。对产物进行1h nmr表征,表征结果如图3(a)所示;利用凝胶渗透色谱测定聚合物的分子量和分子量分布,计算聚合度n为12。
65.pc5secl的制备:与上述pc3secl的制备步骤基本一致,不同的是将c3secl替换为实施例2制备的c5secl。对产物进行1h nmr表征,表征结果如图3(b)所示;利用凝胶渗透色谱测定聚合物的分子量和分子量分布,计算聚合度n为13。
66.pclseph的制备:与上述pc3secl的制备步骤基本一致,不同的是将c3secl替换为实施例2制备的clseph。对产物进行1h nmr表征,表征结果如图3(c)所示;利用凝胶渗透色谱测定聚合物的分子量和分子量分布,计算聚合度n为13。
67.pc
10
secl的制备:与上述pc3secl的制备步骤基本一致,不同的是将c3secl替换为实施例2制备的c
10
secl。对产物进行1h nmr表征,表征结果如图3(d)所示;利用凝胶渗透色谱测定聚合物的分子量和分子量分布,计算聚合度n为12。
68.对上述制备的不同侧链的含硒聚酯pc3secl,dp(聚合度)=12、pc5secl,dp=13、pclseph,dp=13及pc
10
secl,dp=12进行凝胶色谱测试,测试结果如图4所示,其中分子较小的pc3secl在色谱柱中保留的时间最长,而分子较大的pc
10
secl最先被淋洗出,其它两种聚合物分子大小相似,在色谱柱中保留的时间相近。
69.对上述制备的五种含硒聚酯进行热性能表征,图5(a)为不同聚酯样品的热重图,加热至200℃时,样品pc5secl,dp=13及pc
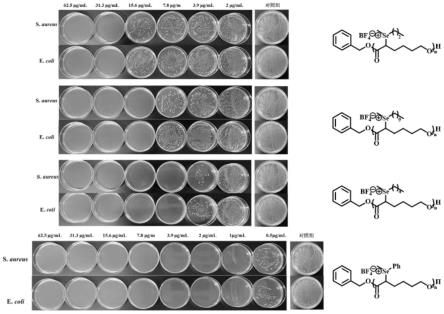
10
secl,dp=12的失重量近似,且均小于另外两个样品的失重量;图5(b)为不同聚酯样品的差式扫描量热分析结果,上述样品的玻璃转化温度点由低至高依次为(pc
10
secl,dp=12)《(pc5secl,dp=13)《(pc3secl,dp=12)《(pclseph,dp=13)。
70.实施例4不同侧链的硒鎓盐聚酯的制备
71.本实施例涉及不同侧链的硒鎓盐聚酯的制备,具体如下:
72.pc3se
cl的制备:在25ml schlenk烧瓶中,将碘甲烷(4eq硒醚单元)添加到含1g的实施例3制备的pc3secl(dp=12)的1,2-二氯乙烷溶液中,混合物在n2气下,50℃黑暗环境中搅拌12h。然后,将agbf4(4eq硒醚单元)加入混合物中,搅拌12h。反应结束之后,粗产物过滤头并沉降在乙醚中,离心得产物,在40℃下真空干燥至恒重,获得pc3se
cl。对产物进行1h nmr表征,表征结果如图6所示。
73.pc5se
cl的制备:与上述pc3se
cl的制备步骤基本一致,不同的是将pc3secl(dp=12)替换为实施例3制备的pc5secl(dp=13)。对产物进行1h nmr表征,表征结果如图6所示。
74.pclse
ph的制备:与上述pc3se
cl的制备步骤基本一致,不同的是将pc3secl(dp=12)替换为实施例3制备的pclseph(dp=13)。对产物进行1h nmr表征,表征结果如图6所示。
75.pc
10
se
cl的制备:与上述pc3se
cl的制备步骤基本一致,不同的是将pc3secl(dp=12)替换为实施例3制备的pc
10
secl(dp=12)。对产物进行1h nmr表征,表征结果如图6所示。
76.性能表征
77.1.不同硒鎓盐聚酯的最小抑菌浓度测试
78.在lb琼脂板上分别挑取金黄色葡萄球菌(s.aureus)和大肠细菌(e.coli)的单克隆菌落,将其接种到1ml的lb培养基中,并在37℃下振荡培养。采用二倍稀释法,分别将实施例4中的硒鎓盐聚酯配制成不同浓度的pbs溶液(62.5μg/ml、31.3μg/ml、15.6μg/ml、7.8μg/ml、3.9μg/ml、2μg/ml、1μg/ml)。分别取不同浓度下的溶液100μl加入无菌的96孔板中,再加入100μl稀释好的菌液,然后将混合溶液在96孔培养板上于37℃下共同孵育3h。然后吸取稀释后的混合液10μl分别滴加到预先制备好的固体培养基上,并用涂布器涂布均匀,将涂有细菌悬液的固体培养基放置在37℃恒温培养箱中倒置培养24h。培养结束后对每个固体培养基进行拍照。
79.结果如图7所示,几种硒鎓盐聚酯均对上述两种菌表现出良好的抑制效果,其中pc
10
se
cl(dp=12)相对抑制效果较差,对两种菌的最小抑制浓度为31.3μg/ml,其次为pc3se
cl(dp=12),最小抑制浓度为15.6μg/ml,pc5se
cl(dp=13)的最小抑菌浓度为7.8μg/ml,而pclse
ph(dp=13)表现出极其优异的抑菌效果,在最低浓度2μg/ml时,两种细菌均未在培养基中观察到;进而降低pclse
ph(dp=13)的浓度,增加浓度为1μg/ml和0.5μg/ml的试样,抑制效果如图所示,当pclse
ph(dp=13)浓度降至0.5μg/ml时,在培养基中可观察到两种菌落聚集情况,而在浓度为1μg/ml时,培养基仅有极少量的菌落可被观察到,因此pclse
ph(dp=13)最小抑制浓度仅为1μg/ml。
80.2.细胞毒性测试
81.由上述测试可知,本发明制备的几种硒鎓盐聚酯的最小抑制浓度均小于62.5μg/ml,测定该浓度范围内的硒鎓盐聚酯对鼠成纤维细胞(l929)的毒性。具体试验设置如下:
82.在96孔板中每孔接种1
×
104个l929细胞,放于培养箱中培养12h后使细胞贴壁。然后吸出废液,向孔板中加入包含不同浓度硒鎓盐聚酯(4μg/ml、7.9μg/ml、15.7μg/ml、31.3μg/ml、62.5μg/ml)的样品溶液(样品溶液是聚合物按比例与1640培养基混合得到),每孔200μl,37℃下培养48h。之后吸出孔板中溶液,加入200μl新的培养基,再加入20μl cck-8,1.5h后用酶标仪测定450nm的吸收值。所有实验一式三份进行。对照组是无样品溶液,培养基 细胞 cck-8;空白组是无细胞,只有培养基和cck-8,用来扣除背景。
83.细胞毒性测试结果如图8所示,在测试浓度范围内,pclse
ph(dp=13)、pc3se
cl(dp=12)有利于提升细胞活性,且浓度的提升并未降低细胞的活性;低浓度(4~7.9μg/ml)的pc
10
se
cl(dp=12)对细胞活性有良好的促进作用,但随着浓度的增加,逐渐对细胞活性产生抑制效果;在pc5se
cl(dp=13)相对其它几种硒鎓盐聚酯,在低浓度时对细胞活性的促进作用不明显,且随着浓度的增加,细胞活性大幅度降低。
84.结合不同硒鎓盐聚酯的最小抑菌浓度,相应浓度的硒鎓盐聚酯对细胞活性基本呈现促进作用,仅pc
10
se
cl(dp=13)由于对金黄色葡萄球菌和大肠细菌两种菌落的最小抑制浓度相对较高为31.3μg/ml,相应浓度作用下的细胞活性有所降低(》80%)。
85.3.pclse
ph(dp=13)对金黄色葡萄球菌、大肠细菌的zeta电位的影响
86.将金黄色葡萄球菌和大肠细菌两种细菌分别接种并在lb培养基中于37℃培养过夜,然后将细菌在lb培养基中稀释得到工作悬浮液。将1mg/ml的硒鎓盐溶液与稀释后的细菌悬浮液加入到24孔板中,培养2h,以未经任何处理的大肠杆菌和金黄色葡萄球菌,以及未加细菌的硒鎓盐溶液作为对照。取出混合液离心,倒掉上清液之后,用去离子水清洗三次,最后,将菌液分散至去离子水中,测试zeta电位。
87.测试结果如图9所示,pclse
ph(dp=13)的zeta电位值为 44.23mv,未经处理的金黄色葡萄球菌、大肠细菌的zeta电位值分别为-34.3mv、-43.6mv,由pclse
ph(dp=13)处理后的金黄色葡萄球菌、大肠细菌的zeta电位值分别降至-3.79mv、-7.4mv。
88.4.pclse
ph(dp=13)对金黄色葡萄球菌、大肠细菌形貌的影响
89.将金黄色葡萄球菌和大肠细菌两种细菌分别接种并在lb培养基中于37℃培养过夜,然后将细菌在lb培养基中稀释得到工作悬浮液。1mg/ml的硒鎓盐溶液与稀释后的细菌悬浮液加入到装有0.5*0.5cm2硅片的24孔板中,培养2h,以未经任何处理的细菌作为对照。然后在4℃下使用5%戊二醛在磷酸盐缓冲液中固定细菌过夜。用pbs洗涤一次后,使用一系列乙醇(30%、50%、70%、80%、90%和100%)对细菌进行脱水。然后将样品干燥用于扫描电镜测试,测试结果如图10所示,经pclse
ph(dp=13)处理后,两种细菌的细胞壁均被破坏。
90.5.pclse
ph(dp=13)与pcl共混膜的制备及其抗菌性能测试
91.首先通过静电纺丝的方法制备pclse
ph(dp=13)和pcl的共混膜,其中pclse
ph(dp=13)的含量为10%,以单一pcl膜作为对照样品。将膜裁剪为1
×
1cm2的正方形,取15μl细菌浓度为5
×
105cfu/ml的菌液,滴在所制备的膜上;然后在37℃下孵育4h,用超声波将细菌震荡到1.5ml pbs溶液中,再将其涂布到固体琼脂培养基上,在37℃下培养24h,培养结束后对每个固体培养基进行拍照,结果如图11所示,在对照组的培养基中均可观察到大量中菌落,而先由共混膜孵育后再进行培养的培养基中未观察到细菌;由此可知,共混膜中的pclse
ph(dp=13)对细菌表现出优异的抑制效果。
92.以上所述实施例仅是为充分说明本发明而所举的较佳的实施例,本发明的保护范围不限于此。本技术领域的技术人员在本发明基础上所作的等同替代或变换,均在本发明的保护范围之内。本发明的保护范围以权利要求书为准。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。
