1.本发明属于生物医药技术领域,具体涉及铜丝藤根在制备骨性关节炎治疗药物中的作用。
背景技术:
2.骨关节炎的主要表现为身体或骨关节的炎症反应,目前对关节炎尚无根治性药物,大多采用非甾体抗炎药或糖皮质激素以减轻症,对该类疾病的治疗药物有待深入开发。
3.铜丝藤根,是畲族习用药材,系为海金沙科植物海金沙(lygodium japonicum(thunb.)sw.)的干燥根及根茎,现收载于2015年版《浙江省中药炮制规范》,别名铁蜈蚣、铁丝草、铁脚蜈蚣根、海金沙根。其性甘、淡、寒,无毒,具有清热解毒、利湿消肿之功效,临床主治肺炎、乙型脑炎、急性肠胃炎、黄疸型肝炎、湿热肿满、淋病,附方可治疗肺炎、乙型脑炎、急性肠胃炎、传染性肝炎、乳痈、小儿脱肛和腮腺炎等。
4.目前对铜丝藤根的化学成分、药理作用方面的研究均较少,因此尚未有将铜丝藤根用于治疗骨性关节炎的报道。
技术实现要素:
5.本发明的发明目的是提供铜丝藤根在制备骨性关节炎治疗药物中的作用,既丰富了铜丝藤根的用途,也为骨性关节炎的治疗提供了新思路。
6.为实现上述发明目的,本发明的技术方案为:
7.铜丝藤根在制备骨性关节炎治疗药物中的作用。
8.本发明对铜丝藤根所含化学成分进行分离和表征,首次发现铜丝藤根中含有多种抗骨性关节炎的活性成分,包括6-羟基-2-异丙基-7-甲基-1.4-萘醌、原儿茶醛、(e)-3,4-二羟基苯亚甲基丙酮、3-氯-4-羟基-苯甲酸、山奈酚-3-o-芸香糖苷、对羟亚甲基苄基丙酮等等,表明铜丝藤根能够用于治疗骨性关节炎。
9.在本发明从铜丝藤根中分离到的抗骨性关节炎活性成分中,(e)-3,4-二羟基苯亚甲基丙酮、3-氯-4-羟基-苯甲酸和对羟亚甲基苄基丙酮是本发明首次发现具有抗炎活性,能够显著降低软骨细胞培养上清液中mmp-13的含量的;不仅如此,本发明还首次发现(e)-3,4-二羟基苯亚甲基丙酮、3-氯-4-羟基-苯甲酸和对羟亚甲基苄基丙酮能够显著提高il-1β干预后软骨细胞存活率,尤其是3-氯-4-羟基-苯甲酸对软骨细胞增殖活性优于阳性药物多西环素。
10.因此,本发明还提供了具有如式(ⅰ)所示化学结构的化合物在制备骨性关节炎治疗药物中的作用;
[0011][0012]
式中,r1为h、oh或卤素,r2、r4和r5为h,r3为羧基或
[0013]
作为优选,所述的化合物的结构式如式(ⅱ)、式(ⅲ)和式(iv)所示:
[0014][0015]
其中,x为卤素,优选为氯;
[0016][0017]
因此本发明还提供了化合物在制备促软骨组织生长药物中的应用,所述的化合物为结构式如(ⅱ)、(ⅲ)和(iv)所示化合物中的至少一种;
[0018]
[0019]
其中,x为卤素;
[0020][0021]
进一步地,本发明还提供了一种骨性关节炎治疗药物和促软骨组织生长药物,该骨性关节炎治疗药物和促软骨组织生长药物的有效成分为结构式如(ⅱ)、(ⅲ)和(iv)所示化合物中的至少一种;
[0022][0023]
其中,x为卤素,优选为氯;
[0024][0025]
与现有技术相比,本发明的有益效果体现在:
[0026]
(1)本发明对铜丝藤根所含化学成分进行分离和表征,首次发现铜丝藤根中含有多种抗骨性关节炎的活性成分,包括6-羟基-2-异丙基-7-甲基-1.4-萘醌、原儿茶醛、(e)-3,4-二羟基苯亚甲基丙酮、3-氯-4-羟基-苯甲酸、山奈酚-3-o-芸香糖苷、对羟亚甲基苄基
丙酮等等,表明铜丝藤根能够用于治疗骨性关节炎。
[0027]
(2)在本发明从铜丝藤根中分离到的抗骨性关节炎活性成分中,(e)-3,4-二羟基苯亚甲基丙酮、3-氯-4-羟基-苯甲酸和对羟亚甲基苄基丙酮是本发明首次发现具有抗炎活性,能够显著降低软骨细胞培养上清液中mmp-13的含量的;不仅如此,本发明还首次发现(e)-3,4-二羟基苯亚甲基丙酮、3-氯-4-羟基-苯甲酸和对羟亚甲基苄基丙酮能够显著提高il-1β干预后软骨细胞存活率,尤其是3-氯-4-羟基-苯甲酸对软骨细胞增殖活性优于阳性药物多西环素;表明(e)-3,4-二羟基苯亚甲基丙酮、3-氯-4-羟基-苯甲酸和对羟亚甲基苄基丙酮不仅能够用于制备骨性关节炎治疗药物,还能用于制备促软骨组织生长药物。
附图说明
[0028]
图1为本发明从铜丝藤根中提取和分离化合物的流程图;
[0029]
图2为本发明从铜丝藤根中提取到的化合物13的hmbc关联图;
[0030]
图3为本发明从铜丝藤根中提取和分离到的各化合物对软骨细胞培养上清液中mmp-13的含量水平的影响。
具体实施方式
[0031]
下面结合附图和具体实施方式对本发明的技术方案作进一步详细说明。
[0032]
本发明实施例中所使用到的仪器和材料如下:
[0033]
试验仪器包括:实验型多功能提取浓缩罐(型号:yc-100,上海雅程仪器设备有限公司),安捷伦1100分析液相色谱仪(美国安捷伦科技有限公司);制备液相色谱仪(江苏智润科技有限公司);制备柱(规格:50
×
250mm;填料:大曹c18,10μm;江苏永健医药科技有限公司);bruker avance-iii 400mhz核磁共振波谱仪(德国bruker公司);ftir-650红外光谱仪(天津港东科技);细胞培养箱(型号:bb150,美国thermo公司);光学显微镜(型号:ae2000,麦克奥迪实业集团有限公司);低温高速离心机(型号:micro17r,美国thermo公司);酶标仪(型号:cmaxplus,美国md公司)
[0034]
试验材料包括:薄层层析硅胶板(规格:25
×
75mm,青岛硕远硅胶科技有限公司);柱层析硅胶(规格:100-200目,青岛硕远硅胶科技有限公司);甲醇、乙腈(色谱级,上海星可高纯试剂有限公司);甲醇、乙腈(制备级,上海星可高纯试剂有限公司);其它试剂为化学纯,购自国药集团化学试剂有限公司;sw1353软骨细胞购自赛百慷(上海)生物技术股份有限公司;盐酸多西环素(批号:10592-13-9,上海源叶生物科技有限公司);dmem/high glucose(批号:fi101-01,transgen biotech);transserum fq fetal bovine serum(批号:fs301-02,transgen biotech);trypsin 0.25%(1
×
)solution(批号:sh30042.0,hyclone);penicillin-streptomycin solμtion(批号:sv30010,hyclone);phosphate buffered saline(1x)(批号:fg701-01,transgen biotech);cck8试剂盒(批号:c0039,上海碧云天生物技术有限公司);96孔板(货号:167008,thermo);human mmp13 elisa kit(货号:ek0468,boster)。
[0035]
铜丝藤根样品采自浙江省丽水市,由丽水市中医院林娜副主任中药师鉴定为海金沙科植物海金沙lygodium japonicum(thunb.)sw.的地下根及根茎,凭证样品存于丽水市中医院中药库。
[0036]
实施例1
[0037]
1、提取分离
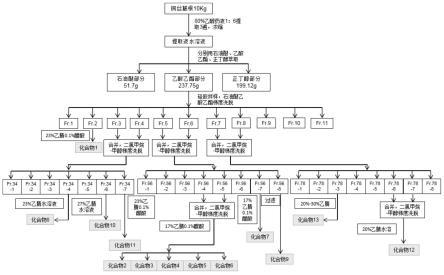
[0038]
取10kg铜丝藤根药材,粉碎后,用6倍量80%乙醇回流提取三遍,每次时长2h,提取液减压浓缩,得到的浸膏依次用石油醚、乙酸乙酯、正丁醇以体积比1:1依次萃取,萃取液分别浓缩,得到石油醚萃取部分(51.17g)、乙酸乙酯萃取部分(237.75g)、正丁醇萃取部分(199.12g)。
[0039]
乙酸乙酯萃取部分经硅胶柱色谱sephadex lh-20柱色谱层析,以石油醚-乙酸乙酯梯度洗脱,薄层检测,合并浓缩后得到fr.1~11共11个馏分。
[0040]
其中,馏分fr.2经液相制备(23%乙腈、0.1%醋酸)得到化合物1(21.5mg)。
[0041]
馏分fr.3与4合并,再经硅胶柱层析,以二氯甲烷-甲醇梯度洗脱,薄层检测,合并浓缩后得到馏分fr.34-1~34-7,其中馏分fr.34-4经液相制备(23%乙腈)得化合物8(52mg),馏分fr.34-6经液相制备(27%乙腈)得化合物10(84.9mg),馏分fr.34-7经液相制备(23%乙腈、0.1%醋酸)得化合物11(10mg)。
[0042]
馏分fr.5与6合并,再经硅胶柱层析,以二氯甲烷-甲醇梯度洗脱,薄层检测,合并浓缩后得到馏分fr.56-1~56-8,其中馏分fr.56-4与馏分fr.56-5合并后,经液相制备(17%乙腈、0.1%醋酸)得化合物2(186.3mg),化合物3(10mg),化合物4(20mg),化合物5(53.3mg),化合物6(154.1mg);馏分fr.56-7经液相制备(17%乙腈、0.1%醋酸)得化合物7(75.3mg),馏分fr.56-8过滤得化合物9(145mg)。
[0043]
馏分fr.7与8合并,再经硅胶柱层析,以二氯甲烷-甲醇梯度洗脱,薄层检测,合并浓缩后得到馏分fr.78-1~78-7,其中馏分fr.78-3经液相制备(20%-30%乙腈)得化合物13(44mg);馏分fr.78-6与馏分fr.78-7合并后,经液相制备(20%乙腈)得化合物12(335mg)。
[0044]
提取流程图见图1。
[0045]
2、结构鉴定
[0046]
(1)化合物1
[0047]
外观:黄色粉末。
[0048]
ir(kbr,cm-1
):3369,2964,1660,1649,1577,1336,1266,1034,885,727。
[0049]
uv谱显示:204.2nm,266.7nm,346.6nm。1h-nmr(400mhz。
[0050]
dmso-d6)显示:在低场区有3个芳氢质子信号:7.77(1h,s),7.30(1h,s),6.68(1h,s);高场区有一组异丙基质子信号:1.12(6h,d,j=6.8hz),3.10(1h,m),还有一个甲基信号2.24(3h,s),根据化学位移及裂分信号,推测甲基应连于苯环上。
[0051]
13
c-nmr(100mhz,dmso-d6)显示:低场区(185.1~110.2ppm)共有10个c信号,含2个羰基信号185.1和183.4,为萘醌类化合物的特征信号;在高场区有3个c信号,结合氢谱,确定为1个甲基、1个异丙基信号。
[0052]
esi-ms:m/z 228.9[m-h]-,提示该化合物分子量为230。
[0053]
综上分析,确定该化合物为具有1个异丙基、1个甲基、1个羟基取代的萘醌;与文献(lijuan chen,guogang zhang,jie he,et al.new naphthoquinone from the root of lygodium japonicum(thunb.)sw.j nat med.2010,64(1):114
–
116.)比较,确定其结构为6-羟基-2-异丙基-7-甲基-1,4-萘醌。
[0054]
表1化合物1的1h-and 13
c-nmr数据比对表
[0055][0056]
(2)化合物2
[0057]
外观:白色粉末。
[0058]
ir(kbr,cm-1
):3329,3228,1645,1597,1533,1441,1296,1164,876,812,754,631。
[0059]
uv谱显示:205.3nm(max),230.1,278.6,311.9nm。
[0060]1h-nmr(400mhz,cd3od)显示:一组邻间位三取代的苯环质子信号7.33(1h,dd,j=7.6,2.0hz),7.32(1h,s),6.92(1h,d,j=7.6hz),另有一个质子信号9.71(1h,s)推测为醛基质子。
13
c-nmr(100mhz,cd3od)显示共有7个c信号,其中193.1ppm为醛基c,另外6个c信号为苯环信号,其中153.7,147.2为苯环上2个连羟基的c信号。
[0061]
esi-ms:m/z 136.9[m-h]-,274.8[2m-h]-,提示该化合物精确分子量为138。
[0062]
与文献(陆冰云,巫兴东,贾毓宁,等.蜜炙枇杷叶中1个新酚苷类化合物[j].中国中药杂志,2019,44(13):2806-2812.)比较,确定该化合物2为原儿茶醛。
[0063]
(3)化合物3
[0064]
外观:无色油状物。
[0065]1h-nmr(400mhz,cd3od)显示:δ:1.03(3h,s,h-12),1.06(3h,s,h-11),1.26(3h,d,j=6.4hz,h-10),1.93(3h,s,h-13),2.17(1h,d,j=16.8hz,h-2b),2.49(1h,d,j=16.8hz,h-2a),4.33(1h,m,h-9)。
[0066]
13
c-nmr(100mhz,cd3od)显示:δ:42.4(s,c-1),50.7(t,c-2),201.2(s,c-3),127.1(d,c-4),136.9(d,c-7),130.0(d,c-8),68.6(d,c-9),23.5(q,c-10),23.8(q,c-11),24.5(q,c-12),19.6(q,c-13)。
[0067]
其他波谱数据与文献(abidah parveen,ying huang,omer fantoukh,et al.rearranged clerodane diterpenoid from tinospora crispa.nat prod res,2021,35(3):369-376.)报道一致,化合物3鉴定为吐叶醇。
[0068]
(4)化合物4
[0069]
外观:黄色粉末。
[0070]
ir(kbr,cm-1
):3464,1619,1601,1445,1281,1189,1155,1111,1012,966,804,565。
[0071]
uv谱显示:221.8nm,249.0nm,338.2nm(max)。
[0072]1h-nmr(400mhz,cd3od)显示:δ:2.36(3h,s,4-h),6.57(1h,d,j=16.0hz,1-h),7.54(1h,d,j=16.0hz,2-h),7.10(1h,d,j=2.0hz,2'-h),6.81(1h,d,j=8.4,2.1hz,5'-h),7.01(1h,dd,j=j=8.4,2.1hz,6'-h)。
[0073]
13
c-nmr(100mhz,cd3od)显示:δ:27.0(c-4),115.3(c-2'),116.6(c-5'),123.5(c-2),124.7(c-6'),127.8(c-1'),6.8(c-1),146.9(c-3'),150.0(c-4'),201.5(c-3)。
[0074]
esi-ms:m/z 176.8[m-h]-,354.9[2m-h]-提示该化合物精确分子量为178。
[0075]
经与文献(triveni pativada,myung hwan kim,jung-hun lee,et al.benzylideneacetone derivatives inhibit osteoclastogenesis and activate osteoblastogenesis independently based on specific structure-activity relationship.j.med.chem,2019,62(13):6063-6082.)对照,确认化合物4为3',4'-二羟基苄叉丙酮(3',4'-dihydroxybenzylideneacetone)。
[0076]
(5)化合物5
[0077]
外观:白色粉末。
[0078]
ir(kbr,cm-1
):3386,1672,1602,1450,1312,1245,1215,1173,1012,978,831,557,515。
[0079]
uv谱显示:204.2nm,266.7nm。1h-nmr(400mhz,cd3od)显示有一组对取代苯环质子信号7.46(2h,d,j=8.6hz),6.82(2h,d,j=8.6hz);一组反式双键质子信号7.61(1h,d,j=16.0hz),6.30(2h,d,j=16.0hz),为对羟基肉桂酰的特征质子信号。
[0080]
13
c-nmr(100mhz,cd3od)显示:δ146.6(c-1),115.7(c-2),171.0(c-3),127.3(c-1’),116.8(c-2’,6'),131.1(c-3',5’),161.2(c-4’),171.0位羧基信号。
[0081]
esi-ms:m/z 162.8[m-h]-,326.5[2m-h]-,提示该化合物精确分子量为164。
[0082]
与文献(qiang tong,qinghu wang,bilegetu pa,et al.two new compounds from artemisia ordosica krasch.nat prod res,2020,34(21):3061-3065.)对照,确认化合物5为对羟基肉桂酸。
[0083]
(6)化合物6
[0084]
外观:白色粉末。
[0085]
ir(kbr,cm-1
):3367,1684,1589,1381,1302,1248,1207,769,694。
[0086]
uv谱显示:212.4nm,252.5nm。1h-nmr(400mhz,cd3od)显示有一组邻间对三取代苯环质子信号7.96(1h,d,j=2.0hz),7.81(1h,dd,j=8.4,1.6hz),6.96(1h,d,j=8.4hz),未见其它质子信号。推测该化合物为邻间对为三取代苯甲酸。
[0087]
13
c-nmr(100mhz,cd3od)显示δ:1个羧基c信号168.8;1个苯环连氧(羟基)的c信号158.8;3个ch,分别为132.9,131.0和117.1;另有2个季碳信号为124.0和121.7,根据化学位移,其中一个为连羧基的季碳,另1个季碳可能连有卤素原子。
[0088]
esi-ms:m/z 170.8[m-h]-,342.6[2m-h]-,提示该化合物精确分子量为172。
[0089]
与文献(jingya ruan,zheng li,ying zhang,et al.bioactive constituents from the roots of eurycoma longifolia.molecules,2019,24(17):315-3173.)比较,确定该化合物6为3-氯-4-羟基-苯甲酸。
[0090]
(7)化合物7
[0091]
外观:黄色粉末。
[0092]
ir(kbr,cm-1
):3421,1658,1604,1508,1450,1362,1207,1061,1012,970,833。
[0093]
uv谱显示:212.4nm,252.5nm。1h-nmr(400mhz,cd3od)显示:低场区有一组对取代苯环质子信号8.09(2h,d,j=8.8hz),6.91(2h,dd,j=8.8hz);一组间位耦合的质子信号6.43(1h,d,j=2.0hz),6.23(1h,d,j=2.0hz),推测该化合物母核为山奈酚。高场区显示有2个糖的端基质子信号5.15(1h,d,j=7.2hz),4.59(1h,brs);一个甲基信号1.14(3h,d,j=6.0hz),为鼠李糖6-h;在3.2~4.0ppm为糖上质子信号,根据积分应为2个糖。
[0094]
13
c-nmr(100mhz,cd3od)显示δ:179.4(c-4),166.1(c-7),163.0(c-5),161.5(c-4’),159.4(c-2),158.6(c-9),135.5(c-3),132.4(c-2’,6’),122.8(c-1’),116.2(c-3’,5’),105.7(c-10),100.0(c-6),94.9(c-8),glc(c-1~c-6):104.6,75.8,78.2,72.3,77.2,68.6.rha(c-1~c-6):102.4,71.5,72.1,73.9,69.7,17.9。
[0095]
esi-ms:m/z 593.0[m-h]-,提示该化合物精确分子量为594。
[0096]
[10]以上数据与文献(qian wei,rong zhang,qin wang,et al.iridoid,phenylethanoid and flavonoid glycosides from forsythia suspensa.nat prod res,2020,34(9):1320-1325.)报道一致,故确定该化合物7为山奈酚-3-o-芸香糖苷。
[0097]
表2化合物7的1h-and 13
c-nmr数据比对
[0098][0099]
(8)化合物8
[0100]
外观:白色粉末。
[0101]
ir(kbr,cm-1
):3211,1660,1591,1452,1284,1219,1163,839,820,696,602,505。
[0102]
uv谱显示:220.6nm,262.0nm。1h-nmr(400mhz,cd3od)显示:一组对取代的苯环质子信号7.79(2h,d,j=8.6hz),6.93(2h,d,j=8.6hz),以及1个醛基质子信号9.78(1h,s),推测该化合物为对羟基苯甲醛。
[0103]
13
c-nmr(100mhz,cd3od)显示:共有5个c信号,其中192.8ppm为醛基c信号,另外4个c信号为苯环信号,其中133.4与116.9为对取代苯环质子信号,165.3为苯环连羟基的季碳信号,130.3为苯环连醛基的季碳信号。
[0104]
esi-ms:m/z 120.9[m-h]-,242.8[2m-h]-,提示该化合物精确分子量为122。
[0105]
与文献(hong-yu bi,chun-liang xu,hui-zheng fu,et al.two new norneolignans from callicarpa kwangtungensis.nat prod res,2020,34(2):197-203.)对照,确定该化合物8为对羟基苯甲醛。
[0106]
(9)化合物9
[0107]
外观:白色粉末。
[0108]1h-nmr(400mhz,pyr-d5)显示:三萜皂苷的特征信号,含有1个糖基。
[0109]
13
c-nmr(100mhz,pyr-d5)显示:共有1组双键c信号140.7ppm和121.7ppm;1个糖上端基c信号102.4ppm,与78.4,78.3,77.9,75.1,62.4,共同构成葡萄糖的骨架c信号。
[0110]
与文献(王山立,周浪,朱安祥,等.高粱根中1个新大环酚苷[j].中国中药杂志,2020,45(15):3689-3693.)对照,确定该化合物9为胡萝卜苷。
[0111]
(10)化合物10
[0112]
外观:黄色粉末。
[0113]
uv谱显示:232.4nm,207.2nm。
[0114]1h-nmr(400mhz,cd3od)显示:一组对取代苯环质子信号:7.51(2h,d,j=7.2hz),6.83(2h,d,j=7.2hz);一组反式双键质子信号:7.60(1h,d,j=16.0hz),6.63(1h,d,j=16.0hz);高场区还有一个甲基质子信号:2.36(3h,s),推测其与羰基相连。
[0115]
13
c-nmr(100mhz,cd3od)显示:有1个羰基信号201.5ppm,1个甲基信号27.1ppm,161.6ppm为连羟基的苯环季碳信号,一组对取代苯环的ch质子信号为131.6ppm和116.9ppm。
[0116]
esi-ms:m/z 160.8[m-h]-,提示该化合物精确分子量为162。
[0117]
综合以上分析,并与化合物(e)-3,4-二羟基苯叉丙酮(化合物4)的核磁图谱比较,确定该化合物10为对羟亚甲基苄基丙酮。
[0118]
(11)化合物11
[0119]
外观:白色粉末。
[0120]1h-nmr(400mhz,cd3od)显示:一组邻间位三取代苯环质子信号6.81(1h,d,j=7.4hz),7.44(1h,s),7.43(1h,d,j=7.4hz),以及1个甲氧基质子信号3.84(3h,s),推测该化合物为3,4-二羟基苯甲酸甲酯。
[0121]3c-nmr(100mhz,cd3od)低场区显示共有7个c信号,其中168.8ppm为酯羰基c信号,另外6个c信号为苯环信号,其中151.7与146.2为苯环连羟基的季碳信号。
[0122]
esi-ms:m/z 182.8[m-h]-,366.7[2m-h]-,提示该化合物精确分子量为184。
[0123]
与文献(phi-hung nguyen,bing tian zhao,jeong hyung lee,et al.isolation of benzoic and cinnamic acid derivatives from the grains of sorghum bicolor and their inhibition of lipopolysaccharide-induced nitric oxide production in raw 264.7cells.food chem.2015,168(1):512-519.)对照,确定该化合物11为3,4-二羟基苯甲酸甲酯。
[0124]
(12)化合物12
[0125]
外观:白色粉末。
[0126]
ir(kbr,cm-1
):3462,3343,1696,1619,1535,1437,1372,1260,1198,1051,1001,
768。
[0127]
uv谱显示:214.7nm,272.7nm。1h-nmr(400mhz,cd3od)显示1个芳氢质子7.06(2h,s),推测为苯环上对称的2个质子;1个甲氧基质子信号3.83(3h,s)。
13
c-nmr(100mhz,cd3od)低场区显示共有5个c信号,其中169.0ppm为酯羰基c信号,另外4个c信号为苯环信号,146.5为2个连羟基的季碳信号,139.8位1个连羟基的季碳信号;110.1为苯环上2个ch的c信号;在高场区还有1个甲氧基c信号52.3ppm。
[0128]
综上分析,确定该化合物12为没食子酸甲酯。
[0129]
(13)化合物13
[0130]
外观:黄色粉末。
[0131]
ir(kbr,cm-1
):3284,1667,1608,1550,1454,1412,1350,1251,1147,962,812。
[0132]
uv谱显示:219.5nm,249.0nm,369.1nm。
[0133]1h-nmr(400mhz,cd3od)显示:有一组反式双键的质子信号7.29(1h,d,j=16.0hz)和6.58(1h,d,j=16.0hz);一组邻间位三取代苯环的3个质子信号6.77(1h,d,j=8.0hz),6.94(1h,dd,j=8.0,1.6hz)和7.02(1h,d,j=1.6hz);一组间位耦合的芳香质子信号5.56(1h,d,j=1.6hz)和6.14(1h,d,j=1.6hz);低场区还有1个甲氧基质子信号3.87(3h,s)。
[0134]
13
c-nmr(100mhz,cd3od)结合dept显示:该化合物含有14个c信号,其中7个ch(137.0,121.7,116.4,116.3,114.6,101.1,88.3),1个-och3(56.6)。hsqc谱归属了与c信号直接相关的质子信号。
[0135]
hmbc谱显示:c-2’、c-6’与双键质子8-h有相关,确定苯环的1’位与反式双键的8位相连;吡喃环的c-5、c-6与双键质子7-h有相关,确定吡喃环的6位与反式双键的7位相连;c-4与甲氧基质子(9-h)有相关,证实甲氧基连于吡喃环的4位。
[0136]
esi-ms:m/z 258.8[m-h]-,提示该化合物精确分子量为260。
[0137]
综合以上分析,并进一步与文献(ji hye kim,hyun jung kim,ik-soo lee.microbial metabolism of yangonin,a styryl lactone from piper methysticum(kava).natural product sciences.2010;16(3):148-152.)对比,确定化合物13的化学结构为4-甲氧基-6-(3’,4
’‑
二羟基苯乙烯基)-2-吡喃。
[0138]
化合物13的hmbc关联图如图2所示。
[0139]
表3化合物13的1h-and 13
c-nmr数据(400and 100mhz,in cd3od)
[0140]
no.
13
c1hno.
13
c1h2167.0
‑‑
956.93.87(3h,s)388.65.56(1h,d,j=1.6hz)1’122.0
‑‑
4174.0 2’114.87.02(1h,d,j=1.6hz)5101.46.14(1h,d,j=1.6hz)3’146.8 6161.1
‑‑4’
148.7 7116.76.58(1h,d,j=16.0hz)5’116.66.77(1h,d,j=8.0hz)8137.37.29(1h,d,j=16.0hz)6’122.06.94(1h,dd,j=8.0,1.6hz)
[0141]
综上,本实施例以铜丝藤藤根为原材料,从其80%乙醇提取物中分离得到13个化合物(化学式见表4),其中酚类9种,醌类2种,黄酮类1种,甾醇类1种。分别为:6-羟基-2-异丙基-7-甲基-1,4-萘醌(1)、原儿茶醛(2)、吐叶醇(3)、(e)-3,4-二羟基苯亚甲基丙酮(4)、
对羟基肉桂酸(5)、3-氯-4-羟基-苯甲酸(6)、山奈酚-3-o-芸香糖苷(7)、对羟基苯甲醛(8)、胡萝卜苷(9)、对羟亚基苄基丙酮(10)、3,4-二羟基苯甲酸甲酯(11)、没食子酸甲酯(12)、4-甲氧基-6-(3’,4
’‑
二羟基苯乙烯基)-2-吡喃(13)。其中,化合物2~8、10~13为首次从该植物中分离得到,也是首次从海金沙属中分离得到。
[0142]
表4各化合物的化学结构式
[0143]
[0144][0145]
3、抗骨关节炎活性的测定
[0146]
(1)cck8实验
[0147]
取对数生长期的sw1353细胞,消化计数后,用培养基(将dmem/high glucose按比例配制成含10%fbs、1%p/s的完全培养基)制成3
×
104/ml的细胞悬液,96孔板中每孔加入100μl细胞悬液,将孔板置于4℃,5%co2培养箱中培养;培养箱培养24h后,将各孔分为空白
组、模型组和14个给药组,而后进行造模处理:除空白组(nc)外,每孔加入10ng/ml的il-1β试剂干预细胞24h;24h后吸去孔板内的培养基,在14个给药组的孔内分别加入化合物1-13和阳性对照(多西环素),进行药物干预,给药处理24h后,向每孔加入100μl cck-8溶液,在培养箱内孵30min。用酶标仪测定在450nm处的吸光度,计算细胞存活率,每组细胞平行测定6个复孔。
[0148]
计算结果见表5。
[0149]
表5各化合物对软骨细胞sw1353细胞活性的影响(n=6)
[0150][0151][0152]
注:a)13种化合物的给药浓度为0.1μm(低剂量)、1μm(中剂量)、10μm(高剂量),多西环素的给药浓度为0.1mm(低剂量)、1mm(中剂量)、10mm(高剂量);
[0153]
b)与nc组比较,##p《0.01;与模型组比较,*p《0.05,**p《0.01。
[0154]
由表5可见,与nc组比较,模型组软骨细胞sw1353的细胞活性显著降低(p《0.05或p《0.01),说明造模有效;与模型组比较,化合物1~8低剂量干预组软骨细胞sw1353的细胞增殖活性显著升高(p《0.05或p《0.01),化合物10高剂量组干预后细胞增殖活性显著升高(p《0.01);说明以上9种化合物对于炎症损伤下的软骨细胞sw1353具有显著的保护作用,可以达到一定的抗炎效果。
[0155]
由表5可以看出,化合物1~8在低浓度时的抗炎活性优于阳性药多西环素。
[0156]
其中,6-羟基-2-异丙基-7-甲基-1.4-萘醌(化合物1)的抗炎活性较佳,其对炎症细胞的保护作用呈现剂量依赖性,在浓度为10μm时细胞存活率可达(85.22
±
4.62)%。
[0157]
而原儿茶醛(化合物2),在其浓度为1μm时细胞存活率最高可达(77.15
±
3.96)%。
[0158]
(e)-3,4-二羟基苯亚甲基丙酮(化合物4)的抗炎活性优于阳性对照,且与模型组比较差异有统计学意义。前期研究表明,具有苯亚甲基丙酮的一类化合物(如化合物4与10)可抑制破骨细胞产生、促进成骨细胞生成,是一类潜在的治疗骨质疏松类药物,本发明首次发现这类化合物具有抗炎活性。
[0159]
3-氯-4-羟基-苯甲酸(化合物6)是一个较为少见的卤素取代的化合物,其生理活性在本发明前尚未见报道。本发明首次发现化合物6能够显著提高il-1β干预后软骨细胞存活率,且对sw1353的细胞增殖活性优于阳性药物多西环素。
[0160]
山奈酚-3-o-芸香糖苷(化合物7)具有较好的抗炎活性,在浓度为0.1μm时细胞存活率最高(77.93
±
2.99)%。
[0161]
(2)mmp-13含量测定
[0162]
骨关节炎的微环境以mmp-13过表达为标志,以mmp-13为评价指标可以有效评估单体化合物对骨关节炎的抗炎活性。因此,按与“(1)cck8实验”相同的方法,对软骨细胞sw1353进行药物干预,但测试药物为化合物1~8和10,其中化合物1~8的给药浓度为0.1μm,化合物10的给药浓度为10μm;给药处理24h后,按照human mmp13 elisa kit(货号:ek0468,boster)说明书对软骨细胞培养上清液中mmp-13的含量进行测试。
[0163]
测试数据用spss 16.0统计软件进行数据分析,所有数据以均值
±
标准差表示,计量资料多组间用one-way-anoay单因素方差分析,组间比较采用snk分析,方差不齐者采用kruskal-wallis h检验。p《0.05为差异有统计学意义;测试结果见图3。
[0164]
由图3可见,与模型组比较,化合物2、4、6、10给药组的mmp-13的含量显著降低,说明该4种化合物是潜在的抗骨关节炎的活性成分。而与模型组比较,化合物1、3、5、7、8给药组的mmp-13的含量虽有所下降,但无显著性差异。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。